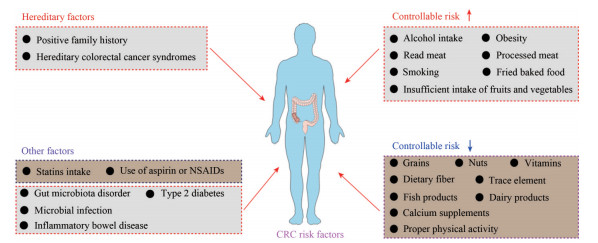
结直肠癌(colorectal cancer, CRC) 是全球最常见的恶性肿瘤之一。最新数据显示, 其发病率仅次于肺癌[1, 2]。据统计, 结直肠癌的发病数约占所有年度诊断恶性肿瘤的10%, 在2018和2020年分别造成88.1万和94万人死亡[3, 4]。此外, 男性结直肠癌的发病率和死亡率均比女性高约25%左右, 在不同地区这个比例存在一定差异, 在发达国家其发病率最高[5]。据估计, 到2030年, 结直肠癌在全世界范围内将造成约110万人死亡[6]。导致结直肠癌发病率升高的因素(图 1) 除了人口的老龄化和高收入国家饮食结构的改变, 还包括肥胖、缺乏锻炼、吸烟、遗传因素及长期控制不佳的慢性炎症等[7-9]。由于早期症状并不十分明显, 大多数患者在确诊后已处于晚期。这种恶性肿瘤不仅对人体消化系统造成损害, 而且如果伴随肿瘤的转移, 还会损害淋巴、肝、肺和骨等部位。因此, 寻找有效的治疗方案已成为国内外学者研究的热点。
|
Figure 1 The risk factors of colorectal cancer (CRC). NSAIDs: Non-steroidal anti-inflammatory drugs |
目前, 在临床实践中, 针对非转移性结直肠癌的治疗多采用手术治疗, 多数患者会倾向于切除部分直肠或结肠, 而晚期复发性或转移性结直肠癌常采用再手术、化疗、放疗、靶向治疗或其他综合治疗手段进行干预。当前, 尽管结直肠癌的诊断和治疗已经取得了长足进展, 但患者的预后仍令人堪忧[10]。在药物治疗方面, 5-氟尿嘧啶(5-fluorouracil, 5-FU) 是目前结直肠癌姑息性和辅助性全身化疗的经典药物。在过去的几十年中, 各种各样的调控策略如5-FU的联合实施方案和前体药物的开发和测试, 在临床上被广泛用来提高抗癌活性和减少耐药性的发生。然而, 患者对这些治疗的反应仍不容乐观, 并且基于5-FU治疗的疗效经常受到化疗耐药性发展的影响[11, 12]。此外, 盐酸伊立替康是一种广泛应用于晚期结直肠癌患者的广谱细胞毒性药物。不幸的是, 在近年的临床实践中, 其也因存在致命的腹泻脱水、胃肠道损伤、腹部痉挛性疼痛和发热等不良反应而广受诟病[13-15]。因此, 探寻更为有效的治疗策略和医疗干预方法, 尤其是开发疗效好、不良反应小的药物, 是临床亟待解决的问题。中药是天然药物的宝库, 同时也是开发抗结直肠癌药物的重要来源[16]。最近的研究发现, 中医药可以作为降低结直肠癌发病率的有效辅助手段[17, 18]。具体来说, 中药中的有效成分能够通过破坏癌细胞的生存环境, 促进细胞凋亡, 增强机体的免疫力, 通过自身强大的免疫系统清除病原体, 从而达到抗癌的效果。此外, 中药还可与其他化疗药物联合应用, 以减少化疗过程引起的不良反应, 显著改善患者生活质量[19, 20]。近年来, 随着国家对中医药扶持政策的向好趋势, 多个传统中药成分因其卓越的抗结直肠癌作用脱颖而出, 而来源于我国传统植物黄连中的主要有效成分黄连素就是其中的代表之一[21, 22]。
黄连素, 又名小檗碱, 为来源于我国传统毛茛科植物黄连Coptis chinensis Franch.中的一种异喹啉类生物碱[23], 在临床上长期作为非处方药物用于治疗肠道细菌性感染和腹泻[24]。得益于现代药理学手段的发展和多学科信息交叉的融合, 黄连素在心血管疾病、代谢性疾病及肿瘤治疗方面的优势也逐渐得到认可, 尤其是作为临床肿瘤治疗的辅助药物[25-27]。当前, 多个关于黄连素抗癌作用的临床研究正有序进行(表 1), 这一现象在很大程度上表明, 黄连素抗肿瘤作用的重现性和转化潜力已经引起人们的广泛关注。鉴于结直肠癌的发病率和死亡率逐年攀升, 近年来, 黄连素抗结直肠癌的研究也逐渐受到科研工作者的广泛关注。房静远团队[28]在组织的一项针对891例近期诊断为腺瘤并进行腺瘤全切除手术患者进行的多中心随机双盲对照研究中发现, 黄连素能够有效预防结直肠癌的癌前病变直肠腺瘤的复发, 这一研究无疑增强了黄连素抗结直肠癌的信服力。然而, 目前鲜有关于其抗结直肠癌机制的系统介绍和临床试验结果的报告[29, 30]。基于此, 本文主要从抑制癌细胞增殖及迁移、诱导癌细胞凋亡、阻滞细胞周期、介导炎症反应、逆转耐药性及调节肠道菌群等方面总结黄连素抗结直肠癌的作用及相关机制, 以期为该天然活性成分在结直肠癌治疗的临床研究中提供参考。
| Table 1 Clinical trials of berberine in treating cancer registered at ClinicalTrials.gov. EGFR: Epidermal growth factor receptor; PCOS: Polycystic ovary syndrome |
据报道, 黄连素可通过作用于多条细胞信号转导途径, 抑制结直肠癌细胞的异常增殖和迁移。一项基于黄连素对ApcMin/+小鼠结直肠癌化学预防作用的研究显示, 其能通过下调Wnt/β-catenin、表皮生长因子受体(epidermal growth factor receptor, EGFR) 信号通路参与对结直肠癌细胞的增殖抑制作用[31]。黄连素还能通过磷酸腺苷活化蛋白激酶(adenosine phosphate-activated protein kinase, AMPK) 依赖性抑制哺乳动物雷帕霉素靶体蛋白(mammalian target protein of rapamycin, mTOR) 活性和AMPK非依赖性途径抑制核转录因子(nuclear transcription factor-kappa B, NF-κB) 信号通路, 进而抑制结直肠癌细胞的增殖[32]。基于二甲基肼(dimethylhydrazine, DMH) 和葡聚糖硫酸钠(dextran sulfate sodium, DSS) 诱发的大鼠结直肠癌模型, 黄连素能够靶向Wnt/β-catenin信号通路, 降低细胞核和细胞质中β-catenin的蛋白水平, 从而抑制结直肠癌细胞的增殖[33]。此外, 黄连素还能通过直接与核受体维甲酸X受体α (retinoic acid X receptor α, RXRα) 中含有的残基Gln275、Arg316和Arg371的独特区域结合, 进而导致c-Casitas B谱系淋巴瘤(c-Casitas B-lineage lymphoma, c-Cbl) 基因介导的β连环蛋白降解, 从而抑制结直肠癌细胞KM12C的增殖。在体内, 这种直接的结合作用也于结直肠癌细胞异种移植瘤模型中得到了证实[34]。一项关于黄连素对结肠癌细胞HT29增殖及裸鼠体内EGFR活性调节作用及机制研究表明, 黄连素能增强Cbl基因的活性, 导致EGFR表达的下调, 产生对癌细胞增殖的抑制效应[35]。此外, 黄连素在与其他活性成分协同抑制结直肠癌细胞增殖方面的研究也有报道, 当其与山茱萸提取物联合应用时, 能够引起参与细胞增殖和上皮间充质转化的33个基因呈时间和剂量依赖性下调[36]。
在临床上, 多数结直肠癌患者因癌细胞从单一病灶向其他远端组织的侵袭和转移而加重病情。研究发现, 黄连素能够通过降低环氧化酶-2/前列腺素E2 (cyclooxygenase-2/prostaglandin E2, COX-2/PGE2) 的表达水平, 进而降低酪氨酸激酶2 (Janus kinase, JAK2) 和信号传导与转录活化因子3 (signal transduction and activator of transcription 3, STAT3) 的磷酸化, 以及基质金属蛋白酶-2/-9 (matrix metalloproteinase-2/-9, MMP-2/-9) 的表达水平, 抑制结直肠癌细胞的体内外迁移和侵袭[37]。基于结直肠癌SW480和HT29细胞模型, 研究者证实黄连素能够剂量依赖性地抑制上述两种细胞的迁移, 其机制可能涉及下调葡萄糖调节蛋白78 (glucose regulated protein 78, GRP78) 的表达。因此, 靶向GRP78可能是开发有效抗结直肠癌药物的一个潜在途径[38]。
2 诱导结直肠癌细胞凋亡据报道, 黄连素主要通过调节转化生长因子-β (transforming growth factor-β, TGF-β) 信号通路、活性氧(reactive oxygen, ROS) 相关信号通路JNK/p38、丝裂原活化蛋白激酶(mitogen-activatedprotein kinase, MAPK) 及激活凋亡诱导因子(apoptosis-inducing factor, AIF) 等来介导线粒体相关途径诱导结直肠癌细胞的凋亡[39]。研究发现, 黄连素能通过介导Smad依赖和Smad非依赖的TGF-β信号通路抑制肿瘤相关成纤维细胞诱导的结肠上皮细胞上皮间质转化并促进凋亡的发生, 具体表现为浓度依赖性地下调E盒锌指结合蛋白1 (zinc finger E-box binding protein 1, ZEB1)、Snail及B淋巴细胞瘤-2基因(B-cell lymphoma-2, Bcl-2) 的表达水平, 上调促凋亡因子BCL2-相关X蛋白(Bcl2-associated X, Bax) 的表达[40]。在SW620细胞模型中, 黄连素(50 µmol·L-1) 能够激活半胱天冬氨酸蛋白酶3 (cysteinyl aspartate specific proteinase 3, caspase 3) 和caspase 8, 引起多聚ADP核糖聚合酶(poly ADP ribose polymerase, PARP) 的断裂, 并释放细胞色素C, 同时使凋亡抑制蛋白1 (inhibitor of apoptosis protein 1, c-IAP1)、Bcl-2和B淋巴细胞瘤-XL基因(B-cell lymphoma-XL, Bcl-XL) 的表达明显降低, 而这种凋亡诱导效应伴随着JNK和p38 MAPK的持续磷酸化, 以及ROS的产生[41]。此外, 黄连素以ROS产生依赖性的方式刺激caspase独立细胞死亡介导物、线粒体AIF的释放, 进而引起细胞凋亡。值得注意的是, 这种凋亡现象是通过组织蛋白酶B的释放和PARP活化依赖性AIF的激活来共同实现的[42]。长链非编码RNA (long non-coding RNA, lncRNA) 癌症易感性候选物2 (cancer susceptibility candidate 2, CASC2) 在结直肠癌的进展中扮演着重要的角色, 其能以EZH2依赖的方式结合到Bcl-2的启动子区域来沉默抗凋亡基因Bcl-2的表达。研究显示, 黄连素能通过靶向lncRNA CASC2在抑制细胞活力的同时激活细胞凋亡[43, 44]。
3 阻滞结直肠癌细胞周期细胞周期的精确调控在机体组织的正常发育和稳态中发挥着非常重要的作用, 然而其异常改变则能不同程度地促进恶性肿瘤的发生和发展[45-47]。研究发现, 黄连素能够通过调节多个靶点引起细胞周期阻滞, 进而产生抗结直肠癌效应。一方面, 其能通过下调人端粒酶逆转录酶(telomerase reverse transcriptase, TERT) mRNA和人端粒酶RNA组分的水平, 同时降低端粒酶活性进而时间依赖性地引起人结直肠癌HCT116细胞G0/G1周期阻滞[48]; 另一方面, 黄连素能通过下调胰岛素生长因子2结合蛋白3 (insulin growth factor 2 binding protein 3, IGF2BP3) 的mRNA水平诱导结直肠癌HCT116和SW480细胞G0/G1周期阻滞, 其机制可能涉及对于磷酸肌醇3-激酶/蛋白激酶B (phosphatidylinostide 3-kinase/protein kinase B, PI3K/Akt) 信号通路的负性调控[49]。一项基于黄连素对人结直肠癌LoVo、SW480及HT29细胞生长影响的研究显示, 其还能通过调节细胞周期关键蛋白cyclin B1、Cdc2和Cdc25C的表达水平, 引起细胞阻滞于G2/M期。随后, 作者基于人结直肠癌裸鼠异种移植瘤模型对黄连素的这种周期阻滞效应在体内进行了评价, 体内实验结果同样支持了黄连素作为结直肠癌替代疗法的可能性[50]。此外, 黄连素还能通过提高p21的表达水平, 实现对人结直肠癌细胞G2/M周期阻滞[51]。
4 调节炎症反应炎症反应与恶性肿瘤的发生和发展密切相关。当机体遭遇内源/外源性的伤害或感染时, 免疫系统的炎性细胞被激活, 继而分泌大量细胞因子与细胞外基质组成一个庞大的炎性网络调控环境。为了修复组织损伤和对抗感染, 持续长时间的慢性炎性环境会生成大量对细胞正常内环境产生干扰效应的活性氧簇、细胞因子、趋化因子和生长因子等, 继而诱导炎性细胞的聚集, 导致DNA损伤, 最终引起炎性部位的癌变[52-54]。目前, 虽然仅有5%的结直肠肿瘤被报道是在明显的慢性炎症环境下发生的, 但炎症相关肿瘤发生的小鼠模型, 特别是AOM-DSS模型, 对肿瘤发生的各种机制的鉴定提供了非常丰富的信息, 其中许多机制也被证明与散发性肿瘤发生有关。因此, 有效控制肠道炎症反应是预防结直肠癌发生的重要手段。据文献[55]报道, 黄连素能够通过调节炎症和氧化应激反应, 降低促炎细胞因子的水平, 同时提高抗炎细胞因子的浓度, 显著改善结直肠炎性环境的浸润。在DSS诱导的溃疡性结肠炎大鼠模型中, 黄连素能显著抑制白细胞介素-1/1β/6/12 (interleukin, IL-1/1β/6/12)、肿瘤坏死因子-α (tumor necrosis factor-α, TNF-α)、TGF-β和干扰素-γ (interferon-γ, IFN-γ) 的表达水平, 同时增加微环境中的白细胞介素-4 (interleukin 4, IL-4) 和白细胞介素-10 (interleukin 10, IL-10) 含量。生化分析结果表明, 黄连素处理组的p-信号传导及转录激活因子3 (p-signal transducers and activators of transcription 3, p-STAT3) 表达明显增加, 而与模型组相比, p65水平则显著降低。总体来讲, 这种抗炎效应的机制可能与IL-6/STAT3/NF-κB信号通路的阻断有关[56]。巨噬细胞和肠上皮细胞是参与结直肠癌发生发展的重要炎症反应细胞。研究发现, 黄连素可显著降低结肠内诸如TNF、IFN-γ、趋化因子和白细胞介素-17 (interleukin 17, IL-17) 在内的促炎性细胞因子水平, 同时, 其还能抑制C57BL/6小鼠结肠巨噬细胞和上皮细胞中促炎性细胞因子的产生以及参与刺激炎症前细胞因子信号通路(包括MAPK和NF-κB) 的激活, 进而促进结肠巨噬细胞的凋亡[57]。此外, 黄连素还被发现能够通过抑制炎症反应和与肿瘤细胞生长相关的EGFR信号通路减少结肠炎相关的肿瘤发生[58]。在一项关于黄连素治疗溃疡性结肠炎的双盲I期临床试验中, 黄连素(900 mg·kg-1) 能显著降低患者结肠组织的Geboes分级, 同时, 其与美沙拉秦合用时对溃疡性结肠炎患者耐受性良好, 这一结果表明黄连素可以增强美沙拉秦在结肠组织中的抗炎作用[59]。除此之外, 黄连素还可以通过抑制巨噬细胞对结肠的浸润, 改善肠道屏障功能和促进抗炎反应来减轻结肠炎症[60]。富含黄连素的葛根芩连汤是一种常用的中草药复方, 在临床上已被广泛用作治疗急性结肠炎, 其机制可能涉及诱导诸如TNF-α、IL-6、IL-1β和IL-4在内的多种炎性细胞因子的下调, 同时降低髓过氧化物酶(myeloperoxidase, MPO) 活性和丙二醛(malondialdehyde, MDA) 的水平, 升高谷胱甘肽(glutathione, GSH) 含量[61]。
5 逆转化疗药物耐药性在临床上, 癌细胞常常对化疗药物产生耐药性, 并最终导致化疗的失败。近年来, 黄连素用于逆转恶性肿瘤化疗药物耐药性的研究日趋增多[62-64]。据文献[65]报道, 在黄连素与第二代热休克蛋白90 (heat shock protein, Hsp90) 抑制剂NVP-AUY922联合用于对抗结直肠癌的过程中, 其能通过抑制survivin的表达逆转耐药性, 进而对NVP-AUY922不敏感的结直肠癌HCT-15和HT-29细胞产生协同抗增殖作用。伊立替康是临床上常用的一种治疗结直肠癌的化疗药物, 但在临床长期使用过程中发现, 患者对伊立替康容易产生获得性耐药现象[66]。然而, 黄连素能以剂量依赖性的方式抑制盐酸伊立替康诱导的NF-κB通路激活, 并通过下调与NF-κB激活相关的抗凋亡基因c-IAP1、c-IAP2、survivin和Bcl-XL的表达, 增强人结直肠癌细胞HCT116对伊立替康的化疗敏感性, 进而提高临床抗肿瘤疗效[67]。
6 调节肠道菌群肠道菌群是以共生方式居住于人体胃肠道内较为复杂和庞大的体系。据最新报道, 肠道微生物菌群与多种疾病的发生密切相关, 如帕金森病、慢性肾病和非酒精性脂肪性肝病等[68-70]。近年来, 随着现代高通量基因测序、新型代谢组学等检测技术的快速发展, 肠道菌群在结直肠癌方面的研究也成为了生命科学领域一个重要的研究热点[71]。众所周知, 黄连素在水中的溶解性能较差, 口服后难以被肠道吸收进入血液, 生物利用度较低。然而, 这种不容乐观的药代动力学特性很难解释其在体内的显著疗效。因此, 有研究者推测, 经口服的黄连素在进入胃肠道之后难以避免地与数量庞大的肠道微生物产生直接或间接作用, 进而发挥抗肿瘤效应[72, 73]。Wang等[74]借助16S RNA测序技术, 研究了黄连素对高脂饮食(high fat diet, HFD) Apcmin/+小鼠结直肠癌发生的影响。结果显示, 其能显著减少小鼠肠道肿瘤的发生, 改变肠道菌群结构。在门水平上显著抑制疣状芽胞菌的丰度, 而在属水平上, 黄连素减少阿克曼菌的数量, 并提高一些短链脂肪酸(short-chain fatty acid, SCFA) 产生菌的丰度。此外, 黄连素还被报道能逆转核梭杆菌介导的机会致病菌增多, 同时降低IL-21/22/31、CD40L的分泌, 以及p-STAT3、p-STAT5和磷酸化细胞外调节激酶1/2 (phosphorylated extracellular regulatory kinase 1/2, p-ERK1/2) 的表达水平, 进而有效调节肿瘤微环境, 阻断结直肠癌发生相关通路的激活[75]。除此之外, 黄连素还可以减少2, 4, 6-三硝基苯磺酸(2, 4, 6-trinitrobenzene sulfonic acid, 2, 4, 6-TNBS) 诱导的肠杆菌数量, 恢复在这种化学物质刺激下降低的双歧杆菌丰度, 进而阻止结肠炎向结肠癌的转变[76]。Chen等[77]以AOM-DSS诱导小鼠结直肠癌动物模型, 结合16S RNA技术及核磁共振波谱研究了黄连素对结直肠癌的干预作用。结果表明, 黄连素明显改变了小鼠肠道菌群的组成, 具体表现为在门水平上显著降低了嗜酸杆菌和疣状杆菌的丰度。此外, 黄连素还被证明能够提高其他SCFA产生菌的丰度, 例如普雷沃菌属、黄酮莱克托菌和口腔杆菌。代谢数据进一步显示, 黄连素诱导的粪便代谢变化主要集中在糖代谢、SCFA代谢和氨基酸代谢, 这也为微生物群的改变提供了证据, 因为这些粪便代谢产物是宿主与微生物群落相互作用的产物。
7 其他机制较高的肠黏膜通透性伴肿瘤负荷增加是影响结直肠癌预后的重要因素。研究发现, 黄连素能通过增加结直肠黏膜组织中多胺的含量, 抑制鸟氨酸脱羧酶(ornithine decarboxylase, ODC)、细胞性骨髓细胞瘤病毒癌基因(cellular-myelocytomatosis viral oncogene, C-Myc) 及缺氧诱导因子1-α (hypoxia-inducible factor 1-alpha, HIF-1α) 的表达, 同时上调鸟氨酸脱羧酶抗酶1 (ornithine decarboxylase antienzyme 1, OAZ1) 和亚精胺/精胺N1-乙酰转移酶(spermidine/spermine N1-acetyltransferase, SSAT) 的水平, 提高肠黏膜通透性进而发挥抗结直肠癌作用[78]。此外, 黄连素还被报道通过调节Apcmin/+小鼠模型巨噬细胞极化, 进而抑制家族性腺瘤性息肉病肿瘤的发生[79], 而这种效应可能与抑制Wnt/β-catenin信号通路的传导有关[80]。吴茱萸碱是来源于传统中药吴茱萸中的一种天然喹唑啉类生物碱。然而, 近年来有文献报道, 吴茱萸碱在临床使用过程中存在较为严重的心脏毒性[81], 而当黄连素与其配伍使用时, 吴茱萸碱诱导的心脏毒性能被黄连素介导的核相关因子2 (nuclear related factor 2, Nrf2) 依赖性和活性氧非依赖性途径大幅减弱, 同时产生协同抗结直肠癌活性[82]。黄连素的抗结直肠癌作用机制见图 2[83]。

|
Figure 2 Mechanism of berberine in treating colorectal cancer. (Adapted from Ref. 83 with kind permission. Copyright Chinese Traditional and Herbal Drugs ® 2021 Chinese Pharmaceutical Association). Berberine has an extensive range of pharmacological mechanisms including inhibiting cancer cell proliferation and migration, inducing cell apoptosis, blocking cell cycle, mediating inflammatory response, et al. It has remarkable therapeutic potential on colorectal cancer. eEF2: Eukaryotic elongation factor 2; PCNA: Proliferating cell nuclear antigen; CDK1: Cycle dependent kinase 1; CDK2: Cycle dependent kinase 2; CDK4: Cycle dependent kinase 4; SOD: Superoxide dismutase; MPO: Myeloperoxidase; RB: Retinoblastoma protein; miR-429: Micro ribonucleic acid-429; miR-106b/25: Micro ribonucleic acid-106b/25 |
传统中医药作为补充医学和替代医学的重要组成部分, 在多种疾病的治疗方面已有数千年的历史。随着人类结直肠癌发病率和死亡率的不断攀升以及中医药优势的日益凸显, 传统中药在治疗结直肠癌方面的价值也与日俱增。我国古代医籍《外科正宗》云: “又有生平情性暴急, 纵食膏梁或兼补术, 蕴毒结于脏腑, 炎热流注肛门, 结而为肿。”由此可见, 热毒内藏为结直肠癌发病的典型病机之一。因此, 在治法上, 清热解毒法是临床治疗结直肠癌的重要治则。黄连首载于《神农本草经》, 同时也是我国著名的川产道地药材, 具有清热燥湿、泻火解毒等功效, 在临床上被广泛用于治疗泻痢、呕吐和湿热痞满等疾病。现代药理学研究表明, 黄连具有抗菌、抗病毒、抗肿瘤、降血压以及调节血糖和血脂等多种药理作用。近年来的研究发现, 黄连中富含的异喹啉类生物碱黄连素为其介导抗结直肠癌效应的主要物质基础, 然而具体机制尚不明确。因此, 本文对黄连素抗结直肠癌的作用及潜在机制进行系统性总结, 旨在为中药有效成分抗结直肠癌提供新的研究策略和视野。
未病先防, 结直肠癌的发生由多种风险因素共同介导。因此, 针对其发病机制来制定科学合理的预防方案以降低癌症发生风险具有重大的现实意义和科学意义。例如, 健康的饮食和适当的膳食补充剂可能通过对肠道微生物和菌群的组成和功能起着重要的调控效应, 这也是一种比治疗结直肠肿瘤的更好、更经济的抗癌方法。众所周知, 中药凭借多靶点及多途径的优势, 以及较小的不良反应在相关疾病的预防和治疗方面受到广泛青睐。黄连素作为一种植物源活性单体成分, 能够通过靶向肿瘤发生和发展的多个环节发挥抗结直肠癌效应。同时, 鉴于其来源广泛, 在结直肠癌的防治方面显示出巨大的潜力。然而, 黄连素作用靶点广泛, 通路众多, 导致临床研究结果的重复性和重现性较差, 因此在机制研究上较难明确相对突出的作用靶点和路径。制定有关研究的一致性模型和评价标准, 以及构建高质量、大样本的临床数据网络对于黄连素在复杂细胞信号通路的潜在机制研究方面尤为重要。此外, 基于传统中医药理论, 单一有效成分黄连素是否能代替整个黄连中起效的药效物质基础, 也值得深入思考。
众所周知, 药物的临床应用是研究的终极目标。当前, 黄连素抗结直肠癌的研究多停滞于基础阶段, 而临床成功的转化可能受制于给药方式的差异、药物剂量变异、动物模型与患者差异以及临床试验条件的复杂性等诸多因素, 而这也无疑赋予了临床试验设计极大的挑战性。因此, 开展大规模多中心随机对照试验对黄连素抗结直肠癌的确切疗效进行相关验证是非常必要的。此外, 黄连素令人困惑的药代动力学参数(溶解度、生物利用度、部位特异性等) 和成药性也成为了该成分临床产品转化路上的拦路虎。近年来, 脂质体、纳米粒及介孔硅等纳米载药平台为改善黄连素的上述缺陷提供了极富内涵的策略。然而, 这些递送系统在动物模型方面的表现往往不能确切地反映人体的病理生理过程, 而这也加剧了人们对纳米药物体内有效性的质疑。因此, 黄连素纳米制剂从动物模拟向人体临床应用的转化和推广仍然有较长的路要走。需要进一步探索与人体生理环境更相似的模型, 同时加强载黄连素纳米药物临床前研究与进入人体后体内命运的相关性研究。
近年来, 临床常用于治疗结直肠恶性肿瘤的一线用药5-FU及伊立替康等由于较为严重的毒副作用引起了医药学界的广泛担忧。此外, 在强调中医药在治疗结直肠肿瘤方面优势的同时, 也不得不正视中药成分疗效不明显的弊端。因此, 一味强调单方面的优势与劣势, 在临床实践中有失偏颇, 利弊难以定论。总体来看, 中医药和化疗药物在治疗结直肠癌方面各有优势, 不可一言以蔽之。中医药在临床中更多的是作为辅助疗法或替代性药物的身份, 在减少化疗药物毒副作用, 改善患者生存质量和生存时间等方面大有裨益, 但起效较为缓慢, 作用稍逊。而化学治疗药物则能快速杀死恶性肿瘤细胞, 但毒副作用较大。在传统中医药理论中, 配伍用药是临床遣药组方的精髓, 而在西医理论中, 药物联用是化疗药物临床抗结直肠癌的常用方式, 二者具有异曲同工之妙。因此, 根据中药成分与化学治疗药物的特殊属性, 将二者进行科学合理地有机结合, 优势互补, 在减少毒副作用的同时增强临床疗效, 有利于保障临床用药的安全性和有效性。但是, 基于目前的现状来看, 联合用药药效的定量评判以及协同作用的衡量标准是当前较为薄弱的环节。此外, 联合用药的基本原则、用药剂量等也亟待通过更加规范、更大样本量的临床试验进行验证。更深入的研究以及中西医理论的有机结合将为中西联合用药研究提供新的契机和支撑, 以实现药物的精准施用。
作者贡献: 孙强和刘茂伦负责文献检索和文章撰写; 杨寒、任珊和陈莉负责绘制插图; 曾沙、赵晖和明天琪负责绘制表格; 徐海波进行文章的构思、布局和文章修改。
利益冲突: 所有作者声明本文不存在任何利益冲突。
| [1] |
Chen L, He M, Zhang M, et al. The role of non-coding RNAs in colorectal cancer, with a focus on its autophagy[J]. Pharmacol Ther, 2021, 226: 107868. DOI:10.1016/j.pharmthera.2021.107868 |
| [2] |
Vecchia SL, Sebastián C. Metabolic pathways regulating colo-rectal cancer initiation and progression[J]. Semin Cell Dev Biol, 2020, 98: 63-70. DOI:10.1016/j.semcdb.2019.05.018 |
| [3] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68: 394-424. DOI:10.3322/caac.21492 |
| [4] |
Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71: 209-249. DOI:10.3322/caac.21660 |
| [5] |
Siegel RL, Miller KD, Fuchs HE, et al. Cancer statistics, 2021[J]. CA Cancer J Clin, 2021, 71: 7-33. DOI:10.3322/caac.21654 |
| [6] |
Arnold M, Sierra MS, Laversanne M, et al. Global patterns and trends in colorectal cancer incidence and mortality[J]. Gut, 2017, 66: 683-691. DOI:10.1136/gutjnl-2015-310912 |
| [7] |
Siegel RL, Fedewa SA, Anderson WF, et al. Colorectal cancer incidence patterns in the United States, 1974-2013[J]. J Natl Cancer Inst, 2017, 109: djw322. |
| [8] |
Kasi PM, Shahjehan F, Cochuyt J, et al. Rising proportion of young individuals with rectal and colon cancer[J]. Clin Colorectal Cancer, 2018, 18: E87-E95. |
| [9] |
Wolf AMD, Fontham ETH, Church TR, et al. Colorectal cancer screening for average-risk adults: 2018 guideline update from the American Cancer Society[J]. CA Cancer J Clin, 2018, 68: 250-281. DOI:10.3322/caac.21457 |
| [10] |
Wang YF, Zhang HJ, Wu LQ. Advances in drug research targeting the Wnt signaling pathway in colorectal cancer[J]. Acta Pharm Sin (药学学报), 2021, 56: 689-695. |
| [11] |
Vodenkova S, Buchler T, Cervena K, et al. 5-Fluorouracil and other fluoropyrimidines in colorectal cancer: past, present and future[J]. Pharmacol Ther, 2020, 206: e107447. DOI:10.1016/j.pharmthera.2019.107447 |
| [12] |
Marjaneh RM, Khazaei M, Ferns GA, et al. The role of microRNAs in 5-FU resistance of colorectal cancer: possible mechanisms[J]. J Cell Physiol, 2018, 234: 2306-2316. |
| [13] |
Hattori T, Imaoka A, Akiyoshi T, et al. Irinotecan-induced gastrointestinal damage impairs the absorption of dabigatran etexilate[J]. Biopharm Drug Dispos, 2019, 40: 315-324. DOI:10.1002/bdd.2205 |
| [14] |
Chamseddine AN, Ducreux M, Armand JP, et al. Intestinal bacterial β-glucuronidase as a possible predictive biomarker of irinotecan-induced diarrhea severity[J]. Pharmacol Ther, 2019, 199: 1-15. DOI:10.1016/j.pharmthera.2019.03.002 |
| [15] |
Cheng KW, Tseng CH, Tzeng CC, et al. Pharmacological inhibition of bacterial beta-glucuronidase prevents irinotecan-induced diarrhea without impairing its antitumor efficacy in vivo[J]. Pharmacol Res, 2019, 139: 41-49. DOI:10.1016/j.phrs.2018.10.029 |
| [16] |
Kong MY, Li LY, Lou YM, et al. Chinese herbal medicines for prevention and treatment of colorectal cancer: from molecular mechanisms to potential clinical applications[J]. J Integr Med, 2020, 18: 369-384. DOI:10.1016/j.joim.2020.07.005 |
| [17] |
Ye L, Jia YN, Ji KE, et al. Traditional Chinese medicine in the prevention and treatment of cancer and cancer metastasis[J]. Oncol Lett, 2015, 10: 1240-1250. DOI:10.3892/ol.2015.3459 |
| [18] |
Wang YL, Liu P, Fang Y, et al. The effect of long-term traditional Chinese medicine treatment on survival time of colorectal cancer based on propensity score matching: a retrospective cohort study[J]. Evid Based Complement Alternat Med, 2020, 2020: e7023420. |
| [19] |
Yan Z, Lai Z, Lin J. Anticancer properties of traditional Chinese medicine[J]. Comb Chem High Throughput Screen, 2017, 20: 423-429. |
| [20] |
Qiao L, Han MS, Gao SJ, et al. Research progress on nanotechnology for delivery of active ingredients from traditional Chinese medicines[J]. J Mater Chem B, 2020, 8: 6333-6351. DOI:10.1039/D0TB01260B |
| [21] |
Ayati SH, Fazeli B, Momtazi-Borojeni AA, et al. Regulatory effects of berberine on microRNome in cancer and other conditions[J]. Crit Rev Oncol Hematol, 2017, 116: 147-158. DOI:10.1016/j.critrevonc.2017.05.008 |
| [22] |
Kwon S, Chan AT. Extracting the benefits of berberine for colorectal cancer[J]. Lancet Gastroenterol Hepatol, 2020, 5: 231-233. DOI:10.1016/S2468-1253(19)30430-3 |
| [23] |
Ma XL, Jiang W, Fan WM, et al. Berberine ameliorates dexamethasone-induced metabolic disorder in C57 mice[J]. Acta Pharm Sin (药学学报), 2020, 55: 2636-2641. |
| [24] |
Yu M, Jin X, Liang C, et al. Berberine for diarrhea in children and adults: a systematic review and meta-analysis[J]. Therap Adv Gastroenter, 2020, 13: 1756284820961299. |
| [25] |
Wang J, Wang L, Lou GH, et al. Coptidis Rhizoma: a comprehensive review of its traditional uses, botany, phytochemistry, pharmacology and toxicology[J]. Pharm Biol, 2019, 57: 193-225. DOI:10.1080/13880209.2019.1577466 |
| [26] |
Cai Y, Xin Q, Lu J, et al. A new therapeutic candidate for cardiovascular diseases: berberine[J]. Front Pharmacol, 2021, 12: e631100. DOI:10.3389/fphar.2021.631100 |
| [27] |
Zhang C, Sheng J, Li G, et al. Effects of berberine and its derivatives on cancer: a systems pharmacology review[J]. Front Pharmacol, 2020, 10: e1461. DOI:10.3389/fphar.2019.01461 |
| [28] |
Chen YX, Gao QY, Zou TH, et al. Berberine versus placebo for the prevention of recurrence of colorectal adenoma: a multi-centre, double-blinded, randomised controlled study[J]. Lancet Gastroenterol, 2020, 5: 267-275. |
| [29] |
Song D, Hao J, Fan D. Biological properties and clinical applications of berberine[J]. Front Med, 2020, 14: 564-582. DOI:10.1007/s11684-019-0724-6 |
| [30] |
Wang N, Tan HY, Li L, et al. Berberine and Coptidis Rhizoma as potential anticancer agents: recent updates and future perspectives[J]. J Ethnopharmacol, 2015, 176: 35-48. DOI:10.1016/j.jep.2015.10.028 |
| [31] |
Cao HL, Song SL, Zhang H, et al. Chemopreventive effects of berberine on intestinal tumor development in Apcmin/+ mice[J]. BMC Gastroenterol, 2013, 13: e163. DOI:10.1186/1471-230X-13-163 |
| [32] |
Li WD, Hua BJ, Saud SM, et al. Berberine regulates AMP-activated protein kinase signaling pathways and inhibits colon tumorigenesis in mice[J]. Mol Carcinogen, 2015, 54: 1096-1109. DOI:10.1002/mc.22179 |
| [33] |
Wu K, Yang QJ, Mu YQ, et al. Berberine inhibits the proliferation of colon cancer cells by inactivating Wnt/β-catenin signaling[J]. Int J Oncol, 2012, 41: 292-298. |
| [34] |
Ruan H, Zhan YY, Hou J, et al. Berberine binds RXRα to suppress β--catenin signaling in colon cancer cells[J]. Oncogene, 2017, 36: 6906-6918. DOI:10.1038/onc.2017.296 |
| [35] |
Wang L, Cao H, Lu N, et al. Berberine inhibits proliferation and down-regulates epidermal growth factor receptor through activation of Cbl in colon tumor cells[J]. PLoS One, 2013, 8: e56666. DOI:10.1371/journal.pone.0056666 |
| [36] |
Palmieri A, Scapoli L, Iapichino A, et al. Berberine and Tinospora cordifolia exert a potential anticancer effect on colon cancer cells by acting on specific pathways[J]. Int J Immunopathol Pharmcol, 2019, 33: 2058738419855567. |
| [37] |
Liu X, Ji Q, Ye N, et al. Berberine inhibits invasion and meta-stasis of colorectal cancer cells via COX-2/PGE2 mediated JAK2/STAT3 signaling pathway[J]. PLoS One, 2015, 10: e0123478. DOI:10.1371/journal.pone.0123478 |
| [38] |
Gong C, Hu X, Xu Y, et al. Berberine inhibits proliferation and migration of colorectal cancer cells by downregulation of GRP78[J]. Anti Cancer Drug, 2020, 31: 141-149. DOI:10.1097/CAD.0000000000000835 |
| [39] |
Tong MF, Liu HM, Hao JY, et al. Comparative pharmacoproteomics reveals potential targets for berberine, a promising therapy for colorectal cancer[J]. Biochem Biophys Res Commun, 2020, 525: 244-250. DOI:10.1016/j.bbrc.2020.02.052 |
| [40] |
Huang C, Wang XL, Qi FF, et al. Berberine inhibits epithelial-mesenchymal transition and promotes apoptosis of tumour-associated fibroblast-induced colonic epithelial cells through regulation of TGF-β signaling[J]. J Cell Commun Signal, 2020, 14: 53-66. DOI:10.1007/s12079-019-00525-7 |
| [41] |
Hsu WH, Hsieh YS, Kuo HC, et al. Berberine induces apoptosis in SW620 human colonic carcinoma cells through generation of reactive oxygen species and activation of JNK/p38 MAPK and Fas L[J]. Arch Toxicol, 2007, 81: 719-728. DOI:10.1007/s00204-006-0169-y |
| [42] |
Wang L, Liu L, Shi Y, et al. Berberine induces caspase-independent cell death in colon tumor cells through activation of apoptosis-inducing factor[J]. PLoS One, 2012, 7: e36418. DOI:10.1371/journal.pone.0036418 |
| [43] |
Dai W, Mu L, Cui Y, et al. Long non-coding RNA CASC2 enhances berberine-induced cytotoxicity in colorectal cancer cells by silencing BCL2[J]. Mol Med Rep, 2019, 20: 995-1006. |
| [44] |
Dai W, Mu LY, Cui YL, et al. Berberine promotes apoptosis of colorectal cancer via regulation of the long non-coding RNA (lncRNA) cancer susceptibility candidate 2(CASC2)/AU-binding factor 1(AUF1)/B-cell CLL/lymphoma 2(Bcl-2) axis[J]. Med Sci Monit, 2019, 25: 730-738. DOI:10.12659/MSM.912082 |
| [45] |
Guo K, Zhao C, Lang B, et al. Regulator of chromosome condensation 2 modulates cell cycle progression, tumorigenesis, and therapeutic resistance[J]. Front Mol Biosci, 2021, 7: e620973. DOI:10.3389/fmolb.2020.620973 |
| [46] |
Matera R, Saif MW. New therapeutic directions for advanced pancreatic cancer: cell cycle inhibitors, stromal modifiers and conjugated therapies[J]. Expert Opin Emerg Drugs, 2017, 22: 223-233. DOI:10.1080/14728214.2017.1362388 |
| [47] |
Jahagirdar D, Gore CR, Patel H, et al. Induction of apoptotic death and cell cycle arrest in HeLa cells by extracellular factors of breast cancer cells[J]. Asian Pac J Cancer Prev, 2018, 19: 3307-3316. DOI:10.31557/APJCP.2018.19.12.3307 |
| [48] |
Samad MA, Saiman MZ, Majid NA, et al. Berberine inhibits telomerase activity and induces cell cycle arrest and telomere erosion in colorectal cancer cell line, HCT 116[J]. Molecules, 2021, 26: e376. DOI:10.3390/molecules26020376 |
| [49] |
Zhang Y, Liu X, Yu M, et al. Berberine inhibits proliferation and induces G0/G1 phase arrest in colorectal cancer cells by down-regulating IGF2BP3[J]. Life Sci, 2020, 260: e118413. DOI:10.1016/j.lfs.2020.118413 |
| [50] |
Cai YC, Xia Q, Luo RZ, et al. Berberine inhibits the growth of human colorectal adenocarcinoma in vitro and in vivo[J]. J Nat Med, 2014, 68: 53-62. DOI:10.1007/s11418-013-0766-z |
| [51] |
Murthy K, Jayaprakasha GK, Patil BS. The natural alkaloid berberine targets multiple pathways to induce cell death in cultured human colon cancer cells[J]. Eur J pharmacol, 2012, 688: 14-21. DOI:10.1016/j.ejphar.2012.05.004 |
| [52] |
Litta F, Scaldaferri F, Parello A, et al. Anorectal function and quality of life in IBD patients with a perianal complaint[J]. J Invest Surg, 2019, 34: 547-553. |
| [53] |
Todoric J, Antonucci L, Karin M. Targeting inflammation in cancer prevention and therapy[J]. Cancer Prev Res, 2016, 9: 895-905. DOI:10.1158/1940-6207.CAPR-16-0209 |
| [54] |
Vagia E, Cristofanilli M. New treatment strategies for the inflammatory breast cancer[J]. Curr Treat Options Oncol, 2021, 22: e50. DOI:10.1007/s11864-021-00843-2 |
| [55] |
Ashrafizadeh M, Najafi M, Mohammadinejad R, et al. Berberine administration in treatment of colitis: a review[J]. Curr Drug Targets, 2020, 21: 1385-1393. DOI:10.2174/1389450121666200621193758 |
| [56] |
Zhu L, Gu PQ, Shen H. Protective effects of berberine hydrochloride on DSS-induced ulcerative colitis in rats[J]. Int Immuno-pharmacol, 2019, 68: 242-251. DOI:10.1016/j.intimp.2018.12.036 |
| [57] |
Fang Y, Wang L, Shi Y, et al. Berberine promotes recovery of colitis and inhibits inflammatory responses in colonic macrophages and epithelial cells in DSS-treated mice[J]. Am J Physiol Gastrointest Liver Physiol, 2012, 302: G504-G514. DOI:10.1152/ajpgi.00312.2011 |
| [58] |
Li DD, Zhang YY, Liu K, et al. Berberine inhibits colitis-associated tumorigenesis via suppressing inflammatory responses and the consequent EGFR signaling-involved tumor cell growth[J]. Lab Invest, 2017, 97: 1343-1353. DOI:10.1038/labinvest.2017.71 |
| [59] |
Bergan R, Xu L, Zhang Y, et al. A phase Ⅰ trial of berberine in Chinese with ulcerative colitis[J]. Cancer Prev Res, 2019, 13: 117-126. |
| [60] |
Zhang L, Wang Y, Tong L, et al. Berberine alleviates dextran sodium sulfate-induced colitis by improving intestinal barrier function and reducing inflammation and oxidative stress[J]. Exp Ther Med, 2017, 13: 3374-3382. DOI:10.3892/etm.2017.4402 |
| [61] |
Li RY, Chen YY, Shi MJ, et al. Gegen Qinlian decoction alleviates experimental colitis via suppressing TLR4/NF-kappa B signaling and enhancing antioxidant effect[J]. Phytomedicine, 2016, 23: 1012-1020. DOI:10.1016/j.phymed.2016.06.010 |
| [62] |
Wang X, Gong Q, Song C, et al. Berberine-photodynamic therapy sensitizes melanoma cells to cisplatin-induced apoptosis through ROS-mediated P38 MAPK pathways[J]. Toxicol Appl Pharm, 2021, 418: 115484. DOI:10.1016/j.taap.2021.115484 |
| [63] |
Kou Y, Tong B, Wu W, et al. Berberine improves chemo-sensitivity to cisplatin by enhancing cell apoptosis and repressing PI3K/AKT/mTOR signaling pathway in gastric cancer[J]. Front Pharmacol, 2020, 11: 616251. DOI:10.3389/fphar.2020.616251 |
| [64] |
Yin Z, Huang G, Gu C, et al. Discovery of berberine that targetedly induce autophagic degradation of both BCR-ABL and BCR-ABL T315I through recruiting LRSAM1 for overcoming imatinib-resistance[J]. Clin Cancer Res, 2020, 26: 4040-4053. DOI:10.1158/1078-0432.CCR-19-2460 |
| [65] |
Su YH, Tang WC, Cheng YW, et al. Targeting of multiple oncogenic signaling pathways by Hsp90 inhibitor alone or in combination with berberine for treatment of colorectal cancer[J]. Biochim Biophys Acta, 2015, 1853: 2261-2272. DOI:10.1016/j.bbamcr.2015.05.012 |
| [66] |
Wu ZX, Yang Y, Zeng L, et al. Establishment and characterization of an irinotecan-resistant human colon cancer cell line[J]. Front Oncol, 2021, 10: e624954. DOI:10.3389/fonc.2020.624954 |
| [67] |
Yu ML, Tong XH, Qi BQ, et al. Berberine enhances chemosensitivity to irinotecan in colon cancer via inhibition of NF-κB[J]. Mol Med Rep, 2014, 9: 249-254. DOI:10.3892/mmr.2013.1762 |
| [68] |
Aho VT, Houser MC, Pereira PA, et al. Relationships of gut microbiota, short-chain fatty acids, inflammation, and the gut barrier in Parkinson's disease[J]. Mol Neurodegener, 2021, 16: e6. DOI:10.1186/s13024-021-00427-6 |
| [69] |
Peng Y, Xu XJ, Li JP, et al. Strategy to delay the progression of chronic kidney disease by targeting gut microbiota and uremic toxins metabolism pathway[J]. Acta Pharm Sin (药学学报), 2021, 56: 37-49. |
| [70] |
Li XL, Jiang W, Fan WM, et al. Role of gut microbiota in the treatment of nonalcoholic fatty liver disease with traditional Chinese medicine[J]. Acta Pharm Sin (药学学报), 2020, 55: 15-24. |
| [71] |
Hs A, Qy B, Hong HA, et al. Colorectal cancer occurrence and treatment based on changes in intestinal flora[J]. Semin Cancer Biol, 2021, 70: 3-10. DOI:10.1016/j.semcancer.2020.05.004 |
| [72] |
Habtemariam S. Berberine pharmacology and the gut microbiota: a hidden therapeutic link[J]. Pharmacol Res, 2020, 155: e104722. DOI:10.1016/j.phrs.2020.104722 |
| [73] |
Wang Y, Jiang JD. A new research mode of drug PK-PD mediated by the gut microbiota: insights into the pharmacokinetics of berberine[J]. Acta Pharm Sin (药学学报), 2018, 53: 659-666. |
| [74] |
Wang H, Guan L, Jing L, et al. The effects of berberine on the gut microbiota in Apcmin/+ mice fed with a high fat diet[J]. Molecules, 2018, 23: e2298. DOI:10.3390/molecules23092298 |
| [75] |
Yu YN, Yu TC, Zhao HJ, et al. Berberine may rescue Fusobacterium nucleatum-induced colorectal tumorigenesis by modulating the tumor microenvironment[J]. Oncotarget, 2015, 6: 32013-32026. DOI:10.18632/oncotarget.5166 |
| [76] |
Lee IA, Hyun YJ, Kim DH. Berberine ameliorates TNBS-induced colitis by inhibiting lipid peroxidation, enterobacterial growth and NF-κB activation[J]. Eur J Pharmacol, 2010, 648: 162-170. DOI:10.1016/j.ejphar.2010.08.046 |
| [77] |
Chen H, Zhang F, Zhang J, et al. A holistic view of berberine inhibiting intestinal carcinogenesis in conventional mice based on microbiome-metabolomics analysis[J]. Front Immunol, 2020, 11: e588079. DOI:10.3389/fimmu.2020.588079 |
| [78] |
Wu YY, Li TM, Zang LQ, et al. Effects of berberine on tumor growth and intestinal permeability in HCT116 tumor-bearing mice using polyamines as targets[J]. Biomed Pharmacother, 2018, 107: 1447-1453. DOI:10.1016/j.biopha.2018.08.130 |
| [79] |
Piao MY, Cao HL, He NN, et al. Berberine inhibits intestinal polyps growth in Apcmin/+ mice via regulation of macrophage polarization[J]. Evid Based Complement Alternat Med, 2016, 2016: e5137505. |
| [80] |
Zhang JF, Cao HL, Zhang B, et al. Berberine potently attenuates intestinal polyps growth in ApcMin mice and familial adenomatous polyposis patients through inhibition of Wnt signaling[J]. J Cell Mol Med, 2013, 17: 1484-1493. DOI:10.1111/jcmm.12119 |
| [81] |
Sun Q, Xie L, Song JW, et al. Evodiamine: a review of its pharmacology, toxicity, pharmacokinetics and preparation researches[J]. J Ethnopharmacol, 2020, 262: e113164. DOI:10.1016/j.jep.2020.113164 |
| [82] |
Guan X, Zheng X, Chi TV, et al. Combined effects of berberine and evodiamine on colorectal cancer cells and cardiomyocytes in vitro[J]. Eur J Pharmacol, 2020, 875: e173031. DOI:10.1016/j.ejphar.2020.173031 |
| [83] |
Sun Q, He M, Zhang M, et al. Research progress on anti-tumor effect of berberine[J]. Chin Tradit Herbal Drugs (中草药), 2021, 52: 603-612. |
 2022, Vol. 57
2022, Vol. 57


