2. 江西中医药大学现代中药制剂教育部重点实验室, 江西 南昌 330004
2. Key Laboratory of Modern Chinese Medicine Preparations of Ministry of Education, Jiangxi University of Traditional Chinese Medicine, Nanchang 330004, China
据统计, 经过化学组合和高通量筛选后的药物约40%都属于难溶性药物[1]。较差的水溶性使这些候选药物在临床研究时治疗效果不理想。在开发难溶性药物时, 通常采用晶型优化、包合技术、微粉化技术和固体分散体等方法增加药物的溶解度[2], 从而改善药物在体内的溶出度和生物利用度。生物大分子药物具有靶点选择性好、疗效确切和不良反应小等优点, 但同样也存在体内生物利用度低的问题[3, 4]。脂质体[5]、聚合物胶束[6]和磁性纳米粒[7]等纳米技术被广泛应用于递送生物大分子药物, 一定程度上提高了生物大分子药物在体内的稳定性和克服生理屏障的能力。目前, 无论是针对难溶性药物还是生物大分子药物提出的递送方法, 相对来说技术要求高, 所用到的辅料成分复杂, 研究者们正探索是否有一种更加简单有效的技术能达到理想的递送效果。
离子液体(ionic liquids, ILs) 是由有机阳离子与无机或有机阴离子在一定条件下形成的液态混合物, 熔点通常低于100 ℃[8]。ILs的制备工艺简单[9-11], 具有挥发性低、稳定性高、电导率高和不易燃等特点[12]。这些特点高度符合“绿色化学”的制药理念。作为一种“绿色”溶剂, ILs已在合成催化[13]、生物质转换[14]、电化学[15]和液晶开发[16]等领域得到广泛应用。同时, ILs还具有“可调节性”, 即可以通过选择不同的阴、阳离子或者不同比例的阴、阳离子来改变ILs的物理、化学性质与生物活性。这两大特性也使ILs在医药领域的应用存在天然优势。在药物合成中, ILs可以替代挥发性有机溶剂, 从天然产物中提取药物活性成分(active pharmaceutical ingredients, APIs)。在药物分析中, ILs可在不同色谱系统中充当流动相, 通过调节组成离子的极性形成极性梯度。目前, 具有ILs的双相溶剂系统已经成功应用于分离天然产物混合物[17]。在药物递送中, ILs具有增加药物溶解度、提高药物稳定性和促进药物渗透性等作用, 除此之外, ILs还可以作为药物活性成分, 构成API-ILs新型给药体系[18, 19], 应用于解决传统药物低溶解度、低生物利用度和多晶型的问题。本文主要介绍ILs的形成原理、分类、理化性质以及在药物递送中的应用, 为难溶性药物和生物大分子药物的剂型设计提供新的思路。
1 离子液体概述 1.1 形成原理ILs通常由不对称的阳离子和弱配位的阴离子组成[20]。目前大多数观点认为, 形成ILs的作用力包括了阴、阳离子间形成的氢键和范德华力, 其中氢键占主导作用。氢键的形成引起组成分子晶格离域化, 降低了晶格能, 导致混合物的熔点显著低于各组分的熔点[19]。此外, 阴、阳离子间的高度不对称性也会导致晶格处于不稳定状态, 进一步降低晶格能, 使混合物呈现出液态[21]。Lu等[22]采用密度泛函理论(density functional theory, DFT) 模拟了以左旋肉碱为阳离子的ILs的结构与静电势能。分子表面的静电势能图表明, 在ILs的形成过程中, 左旋肉碱的正电荷区域与阴离子的负电荷区域互相吸引, 产生强烈的氢键作用, 这种强烈的吸引力也使形成的ILs具有良好的稳定性。同时, 电子密度梯度降低分析的结果表明, 阴、阳离子间的过渡区域存在范德华力, 这一现象证明了范德华力也参与了ILs的形成。除DFT外, 分子动力学模型和导体屏蔽模型等分子模拟技术也已被应用于观察ILs的结构、研究其分子间作用力和推测其物理化学性质等方面[19]。
1.2 分类根据ILs的发展历史, 可以将现有的ILs划分为三代: 第一代ILs由于具有独特的物理性质, 如低黏度、高热稳定性和可忽略的蒸气压等[20], 常被用作“绿色”溶剂。但是, 第一代ILs也存在对氧敏感、吸湿性强等缺点, 需要在惰性气体的环境中合成与应用[20]; 第二代ILs克服了第一代ILs的缺点, 具有高化学稳定性, 常用作高能材料、润滑剂和金属离子络合剂等[23]。但较大的毒性和较高的纯化成本限制了此类ILs的应用; 第三代ILs选用天然产物, 如胆碱、氨基酸、糖和烷基硫酸盐等[9, 24, 25], 形成了生物降解性高、毒性低且无需纯化的ILs。其中, 具有不同生物活性的ILs可以作为药物活性成分, 构成API-ILs新型离子液体[12], 进一步扩大了ILs的应用领域。除了发展历史, 还可以根据组分中阴、阳离子的性质对ILs进行分类。以阳离子来说, ILs可以分为以下4类: N, N取代的咪唑类、N取代的吡啶类、季铵盐类和季磷盐类[25]。其中, 关于咪唑类的研究最多。图 1列出了一些常见的阳离子和阴离子。
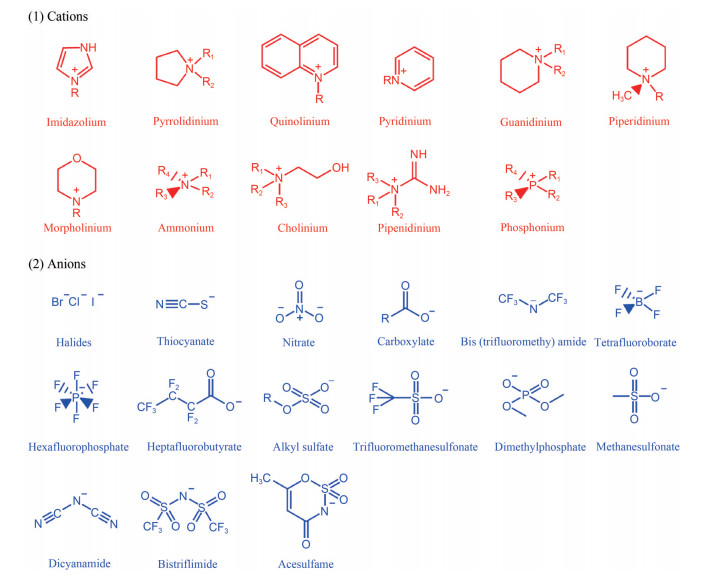
|
Figure 1 Common (1) cations and (2) anions composing ionic liquids (ILs) |
ILs的密度一般处于1.05~1.36 g·cm-3之间, 略大于水, 且受组成成分体积大小的影响。当阳离子烷基链中的碳原子数增加时, 密度也随之增加[24]。
1.3.2 黏度大多数研究使用旋转式毛细管黏度计和滚球式毛细管黏度计测定ILs的黏度[26]。与有机溶剂相比, ILs的黏度较大, 一般在10~762 cP之间[27]。ILs的黏度受内、外因素共同调节: 内部因素主要包括阴、阳离子的结构及其相互作用, 如范德华力和氢键等作用力[28]。有研究发现, 阳离子烷基链中的支链越多, 组成的ILs的黏度就越大[29]; 外部因素主要包括温度和含水量。有研究表明, 在39.85 ℃以下, 随着温度的升高, ILs的黏度显著下降, 在高于此温度后, 温度变化带来的影响不大[30]。此外, 随着水含量的增加, ILs的黏度显著降低[31]。
1.3.3 电导率一般情况下, ILs的电导率与黏度成反比, 主要受温度与水含量等因素的影响。温度升高, 引起分子动能增加、分子间碰撞的频率增加, 导致分子间作用力减弱、电导率增加[19]。与呈水性的电解溶液相比, ILs的电导率较低[20]。这可能是由于纯ILs内部阴、阳离子高度聚集, 自由离子的迁移率降低, 最终导致电导率下降[32], 当水含量升高时, 电导率也显著增加[31]。
1.3.4 折射率折射率是指光在真空中的传播速度与在某种介质中的传播速度之比, 一般用于表示材料的光学特性。ILs的折射率较高, 且受到组成成分和温度影响。阳离子中烷基链的长度增加、支链增加, 折射率也随之增加; 相反, 温度上升会导致折光率的降低[33]。目前, 折射率在1.68~2.33内的ILs可作为浸润液用于筛选矿物和宝石[20]。
1.3.5 表面张力与水合无机熔融盐相比, ILs的表面张力稍小, 主要与阴、阳离子的性质及温度等因素有关。阴离子的体积越大, 阳离子中的烷基链越短, 温度越低时, ILs的表面张力就越大[20, 34]。有研究表明, 表面张力还与分子间作用力相关。携带羟基的阳离子形成氢键的能力更强, 导致ILs可能具有较高的表面张力[19]。
1.3.6 溶解性与混溶性ILs的水溶解性主要取决于组成成分的性质和温度[20]。由六氟磷酸根(hexaflfluorophosphate, PF
热重分析法被广泛应用于研究ILs的热稳定性。研究表明, ILs具有高度稳定性, 在-96~200 ℃内都保持液态[36]。与阳离子相比, 阴离子热稳定性更高, 但随着阴离子亲水性的增加, 热稳定性逐渐降低[37]。分解温度取决于化合物的结构和分子大小。分子量越低, 化合物稳定性越高[38]。有研究[39]显示, ILs的热稳定性可能被高估了, 咪唑基ILs的反向气相色谱显示其在200 ℃以下就会发生降解。
1.3.8 相变温度ILs的相变温度主要包括两个方面: 玻璃化转变温度和熔点, 差示扫描量热法是研究其相变温度的主要手段。相关研究表明, ILs的玻璃化转变温度主要取决于阳离子的结构, 对于具有对称四丁基铵阳离子的ILs则具有较高的玻璃化转变温度[38]。ILs的熔点与组分间形成的氢键大小有关, 氢键越强, 熔点越低[40]。氢键的大小主要取决于组成成分的性质与比例[19], 组分的性质限定了熔点的变化范围, 而组分的比例决定产物最终的熔点[41]。
2 离子液体在药物制剂中的作用 2.1 增加药物溶解度ILs可以增加难溶性小分子药物和生物大分子药物的溶解度, 增溶效果受外界因素和自身因素共同影响。温度是主要的外界影响因素。Abbasi等[42]发现山梨醇在ILs中的溶解度很高, 且温度越高, 黏度越低、溶解度越高。山梨醇的溶解过程为非自发的吸热过程, 溶解后的分子比溶解前具有更多的不规则性, 无定形状态使溶解加快、溶解度增大。Smith等[43]在不同温度下, 测定了扑热息痛和布洛芬在两种不同离子液体中的溶解度, 发现两者溶解度均随温度的升高而增加, 推测温度升高使ILs有更多的空腔以溶解更多的药物, 对药物加工处理过程有指导意义。
忽略外界因素, ILs自身浓度与类型对药物溶解度的影响也不容小觑。不同阴、阳离子组成的ILs对药物的增溶效果不同, 尺寸小、碱性强的阴离子可提高生物聚合物的溶解性, 阳离子的协同作用对增溶具有贡献。Huang等[44]使用了含有不同阴离子的咪唑类ILs处理大豆分离蛋白(soy protein isolate, SPI), 发现SPI在其中溶解度各不相同。Hu等[45]研究了不同温度下阿拉伯木聚糖的溶解度, 通过使用同种阴离子(acetate, Ac—) 不同阳离子的咪唑类ILs溶解药物, 发现阳离子和Ac—对阿拉伯木聚糖的增溶具有协同作用, 但Ac—起主要作用。Wu等[46]首先研究了疏水性药物酮康唑(ketoconazole, KCZ) 在不同羧酸阴离子的ILs中的溶解度, 发现烷基链的长度和分支的差异以及羟基和羧基数目的不同是导致KCZ在其中溶解度不同的主要原因。烷基链和羟基限制了KCZ的溶解, 而羧基和双键有助于KCZ的溶解。随后, 研究者使用含有不同氨基酸阴离子的ILs进一步验证了这一假设, 发现部分实验结果与之前相反, 即羟基增加了酮康唑溶解度。相同基团在不同体系中所起的作用不同, 说明除了ILs的组成外, 分子间相互作用也可能导致溶解度的提高, 如ILs和KCZ阴离子之间的氢键等。虽然目前普遍的观点认为ILs的增溶原理与氢键或π-π键有关, 但目前对ILs增溶的机制尚未有明确的说法。表 1[43, 44, 46-51]直观地列出了ILs对药物溶解度的影响, 关于此内容更详细的介绍可见文献[25]。
| Table 1 Changes of solubility of some drugs in ILs. [BDmim]: 1-Butyl-2, 3-dimethyl imidazolium; [Cl]: Chloride; [Hmim]: 1-Hexyl-3-methylimidazolium; [PF6]: Hexafluorophosphate; [Ch]: Choline; [Ger]: Geranic acid; [Br]: Bromid; [C2mim]: 1-Ethyl-3-methylimidazolium; [OAc]: Acetate; [BF4]: Tetrafluoroborate; O: Oil; [hhcpy]: 1-Hexyl-3-hexyloxy-carbonylpyridinium; [N(CN)2]: Dicyanamide. a If not specified, solubility change is the multiple of dissolution of ILs with respect to water at 25 ℃ |
ILs能够提高药物的稳定性。对于蛋白质类药物, ILs主要是通过维持其三级结构、减少其变性反应来提高稳定性; 而核酸类药物的稳定性受ILs的浓度和阳离子性质影响。Sindhu等[52]制备了4种ILs混合物, 通过光谱和粒度分析技术, 观察到混合物可以减轻碘化胆碱对β-乳球蛋白的损害。ILs混合物不仅维持了该蛋白质的三级结构, 抑制其聚集, 还能在高温下保护该蛋白的天然结构, 改善其复性, 提高了其稳定性, 这一发现为开发生态友好的蛋白保护添加剂开辟了新的方向。Zou等[53]合成的乙烯基ILs-念珠菌脂肪酶纳米凝胶, 能够改善该酶的活性和稳定性, 有望成为一种优良的生物催化剂。Dinis等[54]对几种ILs进行了筛选, 通过实验检验其对溶液中DNA的影响, 发现较高的ILs浓度和相应阳离子的疏水性导致DNA结构构象的扰动, 阴离子作用不显著, 其中, [N111(2OH)]Br对DNA稳定性的保护作用最好。
对于多肽类药物, ILs经常通过形成结合物来提高稳定性。抗菌肽是一类具有抗菌活性的碱性多肽物质, 相对分子质量在2 000~7 000。ILs和抗菌肽之间能够形成共价结合物, 提高抗菌肽的稳定性。Gomes等[55]将甲基咪唑类ILs通过共轭偶联到胶原生成诱导肽的N末端, 发现形成的结合物能够保持强大的抗菌和抗生物膜作用, 还能显著提高对与皮肤伤口环境相关酶的稳定性。Saraswat等[56]制备的吡咯烷基ILs和蜂毒肽的非共价偶联物, 不仅能够显著提高大肠杆菌和金葡菌的最低抑菌浓度, 而且能够抑制蜂毒肽的过量摄入, 降低细菌的耐药性风险, 表现出明显的稳定性和生物相容性。
2.3 促进药物渗透性除了增加药物溶解度和提高药物的稳定性外, ILs还具有促进药物渗透性的作用。ILs促进药物渗透进入皮肤的原理与其有亲水和亲脂基团有关(图 2)。亲水基团可以打开紧密的角质层从而促进药物的细胞旁转运[57], 亲脂基团能够改善上皮细胞的通透性从而促进药物的跨细胞转运[57, 58], 长链的烷烃也能够起到表面活性剂作用扰乱细胞膜[59]。Lim等[60]利用分子动力学模型, 研究了两亲性ILs中1-辛基-3-甲基咪唑阳离子(1-octyl-3-methylimidazolium cation, OMIM+) 与模型细胞膜的相互作用及对细胞膜功能的影响。实验结果表明, OMIM+的头部插入细胞膜后, 能够与带负电荷的磷脂基团配位形成OMIM+-phosphate-OMIM+的结构, 导致细胞膜结构紊乱。细胞膜厚度减小0.6 nm, 有利于氨等小分子物质的通过[60]。Kundu等[61]考察了亲水性ILs对囊泡的影响, 发现亲水性ILs能够插入囊泡膜中, 增大囊泡体积, 并提高囊泡膜的流动性, 为分子扩散创造途径。Cao等[62]以一种胞内酶的含量为指标, 证明了亲脂性ILs能够增加大肠杆菌的细胞膜的通透性。实验结果表明, 这种促渗效果主要依赖于ILs中的氢键供体(一般为阴离子) 与磷脂双分子层相互作用。氢键供体的疏水部分能够溶解磷脂, 从而扰乱细胞膜的结构, 氢键供体的疏水性越强, 扰乱磷脂双分子层的程度也就越大[63]。且与传统的超声破碎法相比, ILs对细胞膜结构的干扰程度小, 不会使整个细胞破碎[62]。
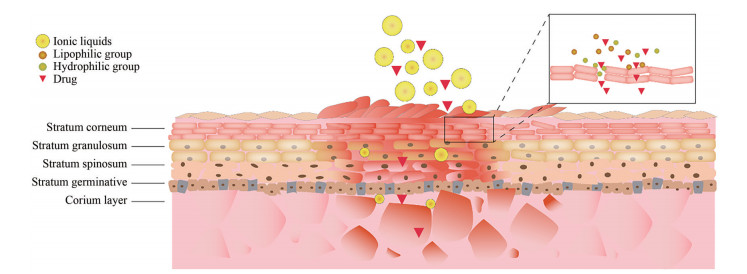
|
Figure 2 Permeation promotion mechanisms of ILs |
ILs除了物理化学性质外, 其生物活性也愈发引起人们的关注。某些ILs本身具有抗菌和抗癌作用, 组成不同的ILs发挥的药理活性作用也不尽相同[12]。除此之外, ILs也能够与传统药物构成API-ILs新型给药系统, 解决其在溶解度、稳定性、生物利用度和多晶型等方面的问题。
2.4.1 抗菌活性随着抗生素的广泛应用, 如何解决抗生素的滥用造成的耐药性成为人类亟需解决的难题。据统计, 2019年全世界约70万人死于抗药性感染, 到2050年预计将达到1 000万[64]。大量研究表明, 咪唑类、吡啶类和铵类等ILs对不同种类的细菌或真菌均有一定程度的抑制作用[65-69], 尤其是以四氮酸铵为阳离子的ILs具有广谱抗细菌和抗真菌的作用[68]。目前, 关于ILs的抗菌机制没有统一的说法, 通常认为ILs是通过阳离子的烷基链扰乱细胞膜的方式发挥抗菌作用, 也有少部分研究认为ILs是通过抑制胞外乙酰胆碱酯酶的活性从而影响细胞活性[70]。ILs的抗菌作用主要取决于阳离子烷基链的长度与结构, 受阴离子的影响较小, 当阳离子的烷基侧链含有12~18个碳原子时, ILs的抗菌作用最强[71, 72]。Forero等[72]设计合成了4种具有不同烷基链大小的N-肉桂基咪唑ILs, 并测定其对于引起软组织感染的细菌的抗菌活性。结果表明, 随着碳原子数的增加, 最小抑菌浓度逐渐降低。此外, ILs对耐药性高的细菌也能产生很强的抑制作用[73, 74], 为未来解决抗生素的滥用造成的耐药性提供了新的可能。
目前, 具有抗菌活性的ILs已被应用于开发消毒剂、防腐剂和生物杀菌剂等日常清洁用品[75]。金属离子作为常见的抗菌剂对各类广谱细菌的抑制率较高, 且抗菌持久性好。Xu等[76]将锌离子(Zn2+) 加入咪唑类ILs中形成聚合状离子液体(poly ionic liquid, PIL), 用作抗菌伤口敷料。研究表明, 与原PIL相比, 含有Zn2+的PIL抑制大肠杆菌、金葡菌和白色念珠菌的活性更强, 这可能是由于ILs中的阳离子与Zn2+产生了协同作用。其他研究也证明了ILs能够与银离子(Ag+) 和铜离子(Cu2+) 发生类似的协同作用[77], 提高制剂的抗菌能力, 为新型抗菌用品的发展提供了新的思路。
2.4.2 抗癌活性现有报道的疾病中, 癌症的致死率位居全球第二, 是威胁人类健康的重要因素[78, 79]。目前, 治疗癌症的常规方法有手术切除、放射疗法和化学疗法, 但手术治疗造成的创伤大, 放疗和普通化疗伴随着严重的不良反应, 临床上急需一种疗效好且不良反应小的治疗方案来提高患者治疗的顺应性。近年来的研究发现, 第二代ILs中的咪唑类ILs对60多种人源癌细胞具有较强的细胞毒性, 且对正常细胞的毒性较小[80, 81], 被视为潜在的抗癌药物。
研究表明, ILs的细胞毒性机制可能包括细胞内活性氧介导的氧化应激、线粒体功能障碍和DNA损伤等[82]。ILs的抗癌作用主要受其组成成分影响, 由不同阴、阳离子组成的ILs对癌细胞和正常细胞的毒性有很大差别[20]。Kumar等[83]测定了由不同阴、阳离子组成的ILs对人乳腺癌细胞(human breast cancer cell, MCF7) 的体外细胞毒性。结果表明, 不同组成的ILs对MCF7生长的半数抑制浓度从8到40 mmol·L-1不等, 且当阳离子烷基侧链越长时, 细胞毒性越大。Frade等[84]的研究也证明了ILs对人结直肠癌细胞(human colon cancerous cell, Caco-2) 的毒性作用随阳离子的改变发生显著变化。这一点也是ILs作为抗癌药物活性成分使用时需要考虑的重点, 研究者能够通过选取合适的组成成分, 调整ILs的细胞毒性潜力, 以达到理想的治疗效果。
2.4.3 构成API-ILs新型给药系统除了由普通阴、阳离子组合形成的ILs外, 大量研究表明, 若形成包含API的ILs, 即由API与其对应的反离子或由两种不同的API形成的API-ILs新型给药系统, 能够有效提升药物在溶解度、稳定性和渗透性等方面的能力, 更好地发挥药物的治疗作用。目前, API-ILs主要有3种组成方式[20, 25]: ①对于具有离子形式的API来说, 可以通过离子间的相互作用与带有相反电荷的离子结合; ②对于中性API来说, 可与离子化合物进行共价结合; ③当组分为两种不同的API时, 可以结合前两种方式生成具有双功能的API-ILs系统。
API-ILs的第一大优势是能够增加药物的溶解性, 提高药物的生物利用度。例如, 布洛芬是用于镇痛和治疗关节炎的基本药物之一, 但布洛芬在胃液中溶解度差, 导致临床生物利用度低。Santos等[85]使用中性布洛芬和阳离子氢氧化物合成了API-ILs新型给药系统, 通过增加布洛芬的溶解度来提高其生物利用度, 整个体系也表现出良好的镇痛作用。此外, 胆碱与水杨酸[86]和阿昔洛韦[87]等药物、天然化合物薄荷醇与布洛芬[88]和阿司匹林[89]等药物结合形成API-ILs后, 均能通过增加原料药的溶解度来提高其生物利用度。
API-ILs的第二大优势是能够促进原料药的渗透性, 增强药物的治疗作用。疟疾是一种由疟原虫引起的传染性疾病, 一直威胁着全球热带和亚热带地区人们的健康安全。最新的数据表明, 非洲地区是全球疟疾病情最严重的区域, 每年大概有43万人死于该疾病[90]。Ferraz等[91]设计将活性药物伯喹与肉桂酸结合形成API-ILs, 通过差示扫描量热法证实了该体系能够增强伯喹本身对感染疟疾的红细胞的渗透性, 对于寄生在肝脏和血液红细胞中的疟原虫有显著的抑制作用。Moshikur等[92]合成了由水杨酸和氨基酸酯组成的API-ILs, 并评价了其对水杨酸的经皮递送效果。与游离的水杨酸相比, 该系统显著提高了水杨酸的皮肤渗透性, 且能够与水任意比例混合。目前, 由小分子非甾体抗炎药依托度酸和止痛药利多卡因组成的ILs透皮贴剂已进入临床试验, 但最新的报告指出, 其Ⅰ期与Ⅱ期临床试验并未体现出理想的治疗效果[93]。
API在传统药物制剂中多以固体结晶的形态存在, 以保持药物的纯度、溶解性和稳定性等理化性质, 但某些固体药物(如雷尼替丁和利多卡因等) 存在多种晶型, 限制了其生物利用度[19]。而API-ILs系统的第三大优势就是能够将固体药物液体化, 有效减少固体药物的结晶形态, 从而提高药物的生物利用度。Hough等[94]将雷尼替丁与一种阴离子表面活性剂结合形成API-ILs, 有效解决了其多晶型导致的溶解度低和稳定性差等问题。此外, 与游离的盐酸利多卡因相比, 基于利多卡因合成的API-ILs也表现出更高的溶解度、更好的热稳定性和更强的局部镇痛作用[94]。
3 离子液体在不同给药途径中的应用 3.1 口服给药对于绝大多数患者来说, 口服无疑是最方便的服药方式。相比于注射给药, 口服给药具有无创、无疼痛、无需医护人员辅助和低成本等优点[95]。目前, 大约有40%候选药物和70%上市药物存在因水溶性差导致口服生物利用度低的问题[1]。ILs的组分具有独特的物理化学性质, 能够通过增加难溶性药物的溶解度、促进药物的肠道渗透性等方式改善药物的口服吸收, 从而提高药物的口服生物利用度。Shi等[48]尝试采用由胆碱和香叶酸合成的ILs口服递送小分子难溶性药物索拉菲尼(sorafenib, SRF)。与纯水相比, SRF在ILs中的溶解度提高了1亿多倍。基于ILs能在水溶液中自发形成胶束的实验现象, 研究者推测当SRF-ILs进入胃肠道后, SRF-ILs会被胃肠液稀释, 以纳米胶束的形式增加SRF的口服吸收[96]。细胞毒性实验表明, 当ILs的质量浓度为0.5 mg·mL-1时, SRF的抗癌效果提高了5倍[97]。此外, 药物体内分布实验结果表明, ILs能够调节SRF在肺部特异性积累[48], 为器官靶向治疗提供了可能性。Banerjee等[98]以胆碱和香叶酸为原料, 制成摩尔比为1∶2的ILs, 用于大分子药物胰岛素的口服递送。研究表明, ILs中的阴离子能够与黏液层相互作用导致黏液层变薄, 降低胰岛素被肠道消化酶降解的可能性, 而阳离子作用于肠上皮细胞, 促进胰岛素的细胞旁转运。药动学和药效学实验证明了ILs能够显著提高胰岛素的口服生物利用度, 有效降低大鼠的血糖水平。目前, 单克隆抗体被广泛应用治疗癌症、银屑病和关节炎等疾病, 但给药方式均为静脉注射。Angsantikul等[99]设计用胆碱和乙醇酸制成ILs用于肿瘤坏死因子α (tumor necrosis factor alpha, TNFα) 单克隆抗体的口服递送。研究表明, ILs不仅能够维持TNFα抗体的结构稳定性, 还能破坏肠上皮细胞间的紧密连接, 促进TNFα抗体的细胞旁转运, 为单克隆抗体口服制剂的研究提供了新思路。
3.2 经皮给药皮肤是人体最大的器官。经皮给药对于治疗皮肤疾病和递送口服吸收效果差的药物有重要意义[100]。皮肤表面的角质层是难溶性药物实现透皮吸收需要克服的第一道屏障[101]。目前, 超声[102]和微针[103]等物理手段和促渗透剂[104]等化学手段已被用于提高药物的皮肤渗透性。最近的研究表明, ILs能够有效改善难溶性药物和生物大分子药物的透皮吸收。
阿昔洛韦是一种人工合成小分子药物, 临床上常用于治疗由单纯疱疹病毒引起的感染。但阿昔洛韦的口服吸收差, 在体内中性pH的环境下极易成盐, 临床多采用经皮或注射的给药方式[105]。Moniruzzaman等[106]设计将ILs与表面活性剂混合, 制备了IL-in-Oil (IL/O) 微乳经皮递药体系。该体系不仅增加了阿昔洛韦的溶解度, 且与传统制剂相比, 阿昔洛韦的经皮传递量提高了6倍。此外, Wang等[107]基于咪唑类ILs成功制备出了一种新型微乳用于递送天然小分子化合物三七素。研究结果表明, 该微乳体系能够显著提高三七素的皮肤渗透性, 能够发挥良好的止血作用, 且对皮肤的刺激性小。ILs的经皮递送效果主要受组成成分的影响, 尤其是阴、阳离子间的相互作用[82]。Tanner等[108]研究了不同摩尔比组成的ILs对亲水性药物阿卡波糖和亲脂性药物鲁索利替尼经皮递送效率的影响。结果表明, 当阳离子与阴离子的摩尔比为1∶2时, 两种小分子药物在ILs中的溶解度良好, 且两者在真皮层的含量都达到最高值。此外, 通过二维核磁共振光谱法发现ILs的透皮促渗效果与组分间的作用力成反比, 即组分间相互作用越少, 促渗效果越好。除了小分子药物, ILs也能够促进如蛋白质和核酸等生物大分子的透皮吸收。Banerjee等[109]使用由胆碱和香叶酸合成的ILs递送牛血清白蛋白、卵清蛋白和胰岛素3种蛋白质。体外皮肤渗透性实验结果表明, ILs显著提高了3种蛋白质在表皮层和真皮层的含量, 且其促渗效果呈时间依赖性。通过圆二色谱法, 证明了ILs并不会破坏胰岛素的空间结构, 从存放17 h后的制剂中分离出的胰岛素仍具有较高的降血糖活性。通过皮下注射小干扰RNA (small interfering RNA, siRNA) 能够治疗牛皮癣、红斑狼疮等自身免疫性皮肤病, 但注射面积小限制了治疗效果, 注射给药也造成了患者顺应性差等问题。Zakrewsky等[110]研究发现经ILs修饰后的苄基二甲辛铵-siRNA能够提高成人表皮细胞中siRNA的转染效率。基于这一现象, Dharamdasani等[111]设计使用由胆碱和香叶酸合成的ILs局部递送siRNA。与先前的实验结果相似, ILs能够显著提高siRNA在表皮层和真皮层的含量, 且无明显临床毒性。Tanner等[112]的研究也证明了由辛烯酸和胆碱合成的ILs能够促进3D骨架核酸完整地达到真皮层, 显著增加3D骨架核酸进入体循环的含量。以上研究都为生物大分子药物的非侵入型给药剂型提供了新的设计思路与可能。
3.3 黏膜给药黏膜给药是指药物通过人体黏膜(包括口腔黏膜、鼻黏膜、眼黏膜、肺部黏膜、子宫黏膜等) 处的上皮细胞运输到全身或直接与病变黏膜发生作用的给药途径[113]。黏膜给药能够有效减少药物在胃肠道的降解、避免首过效应, 从而提高药物的吸收和生物利用度[114]。目前, ILs的黏膜给药主要是通过口腔黏膜和鼻腔黏膜进行。Vaidya等[115]将ILs作为渗透促进剂, 与胰岛素混合成黏弹性较好的凝胶, 夹在可生物降解聚乙烯醇(polyvinyl alcohol, PVA) 两层之间, 通过壳聚糖固定后, 制成了口服给药的高分子贴片, 在颊黏膜处发挥作用, 发现其可以有效克服口腔黏膜障碍, 使胰岛素在猪口腔组织中的转运增加了7倍。唾液内容物进入该贴片会稀释凝胶, 并允许胰岛素持续释放, 以避免明显的低血糖, 实现了良好的血糖水平控制。Li等[18]用氯化胆碱和苹果酸合成的ILs用于改善胰岛素的鼻腔给药。一方面, 增加了胰岛素的溶解度; 另一方面, 通过促进鼻黏膜上皮细胞的渗透性, 而增强了胰岛素的鼻腔给药降血糖作用, 且刺激性小, 无明显毒性, 证明了其作为胰岛素鼻腔传递载体的有效性和生物相容性。
3.4 其他给药方式ILs除了参与上述的给药途径外还可以用于注射给药, 其组成成分必须经过安全性考察。Chowdhury等[116]使用胆碱和氨基酸组成的ILs与乙醇、Tween 80和水组成紫杉醇注射剂。研究表明, 与普通紫杉醇制剂相比, 基于ILs的紫杉醇注射剂具有相似的抗肿瘤活性, 且生物相容性和稳定性更好, 毒性和致敏性更低, 证明了ILs作为注射剂载体的可能性。
目前, 按照阳离子类型来说, 应用于药物递送的ILs主要分为咪唑类和胆碱类。由于具有较强细胞毒性, 咪唑类ILs在药物递送中的应用受限; 而胆碱类ILs具有原料天然、毒性低和生物降解性好等优点, 其递送的药物种类和给药途径更为多样化。表 2更直观地列出了不同ILs在不同给药途径中的应用。
| Table 2 Combinations of ionic liquids in different administration routes. API: Active pharmaceutical ingredient; [C1mim]: 1, 3-Dimethylimidazolium; [(MeO)2PO2]: Dimethyl phosphate; [HOEIM]: 1-Hydroxyethyl-3-methylimidazolium |
与现有药物递送手段相比, ILs具有工艺简单、制备成本低和绿色环保等优点。ILs既可以应用于解决传统药物低溶解度、低生物利用度和多晶型的问题, 也可以作为药物活性成分, 构成API-ILs新型给药系统。组分的可调节性也提供了制备具有特定功能的ILs的可能性, 使得ILs在医药领域有巨大的发展潜力。
目前, ILs在药物递送领域的应用还处于萌芽阶段。高黏性和生物毒性是限制ILs发展的主要因素。ILs在室温下呈高黏性, 在溶解药物时需要借助一定的机械外力。高黏性也限制了纯ILs的流动性, 若想制备成透皮制剂, 可能需要加入其他辅料调节其延展性。一方面, ILs的生物毒性可能与ILs的促渗机制有关。Hayyan等[117]使用真实溶剂似导体屏蔽模型(conductor-like screening model for real solvents, COSMO-RS) 分析了ILs的细胞毒性机制。模拟实验表明, ILs能够与细胞膜的磷脂层发生很强的相互作用, 其积累和聚集可能导致细胞破裂, 从而引发细胞死亡; 另一方面, 虽然ILs具有低挥发性, 但很容易进入水、陆生态系统, 从而对生物及其所处的环境造成威胁[118]。因此, 选择合适的组分, 并在制备时做好废液的处理工作, 能够有效降低ILs对生物和环境的危害性。
虽然近5年来有关ILs的研究大量增加, 但在药物与ILs的相互作用、ILs与体内屏障的作用机制及ILs的生物相容性等方面仍未形成系统性的认识, 亟待更深入的研究。目前对ILs的研究主要集中在咪唑类离子液体上, 后续需要增加对其他组合ILs的研究, 探索ILs潜在的生物活性和递送方式。对于API-ILs是否会诱导耐药性或者降低治疗效果这一问题, 也亟需系统完整的研究。未来研究人员可以利用ILs作为载体的优势, 根据不同的疾病选择合适的给药方式, 设计出更加简单、安全和有效的递药系统。
作者贡献: 姜毓鑫和姜琦负责资料调研和写作; 王迪和张婉婷参与资料调研和绘图; 何伟和杨明提出想法、指导并修改论文。
利益冲突: 本文作者声明无利益冲突。
| [1] |
Shekhawat PB, Pokharkar VB. Understanding peroral absorption: regulatory aspects and contemporary approaches to tackling solubility and permeability hurdles[J]. Acta Pharm Sin B, 2017, 7: 260-280. DOI:10.1016/j.apsb.2016.09.005 |
| [2] |
Williams HD, Trevaskis NL, Charman SA, et al. Strategies to address low drug solubility in discovery and development[J]. Pharmacol Rev, 2013, 65: 315-499. |
| [3] |
Moroz E, Matoori S, Leroux JC. Oral delivery of macromolecular drugs: where we are after almost 100 years of attempts[J]. Adv Drug Deliv Rev, 2016, 101: 108-121. DOI:10.1016/j.addr.2016.01.010 |
| [4] |
Anselmo AC, Gokarn Y, Mitragotri S. Non-invasive delivery strategies for biologics[J]. Nat Rev Drug Discov, 2019, 18: 19-40. DOI:10.1038/nrd.2018.183 |
| [5] |
Bozzuto G, Molinari A. Liposomes as nanomedical devices[J]. Int J Nanomedicine, 2015, 10: 975-999. |
| [6] |
Wang Z, Li X, Wang D, et al. Concurrently suppressing multidrug resistance and metastasis of breast cancer by co-delivery of paclitaxel and honokiol with pH-sensitive polymeric micelles[J]. Acta Biomater, 2017, 62: 144-156. DOI:10.1016/j.actbio.2017.08.027 |
| [7] |
Li C, Zhang M, Liu X, et al. Immobilization of heparin-mimetic biomacromolecules on Fe3O4 nanoparticles as magnetic anticoagulant via mussel-inspired coating[J]. Mater Sci Eng C Mater Biol Appl, 2020, 109: 110516. DOI:10.1016/j.msec.2019.110516 |
| [8] |
Kubota K, Shibata A, Yamaguchi T. The molecular assembly of the ionic liquid/aliphatic carboxylic acid/aliphatic amine as effective and safety transdermal permeation enhancers[J]. Eur J Pharm Sci, 2016, 86: 75-83. DOI:10.1016/j.ejps.2016.03.002 |
| [9] |
Dai Y, Van SJ, Witkamp GJ, et al. Natural deep eutectic solvents as new potential media for green technology[J]. Anal Chim Acta, 2013, 766: 61-68. DOI:10.1016/j.aca.2012.12.019 |
| [10] |
Wikene KO, Rukke HV, Bruzell E, et al. Physicochemical characterisation and antimicrobial phototoxicity of an anionic porphyrin in natural deep eutectic solvents[J]. Eur J Pharm Biopharm, 2016, 105: 75-84. DOI:10.1016/j.ejpb.2016.06.001 |
| [11] |
Gutiérrez MC, Ferrer ML, Yuste L, et al. Bacteria incorporation in deep-eutectic solvents through freeze-drying[J]. Angew Chem Int Ed Engl, 2010, 49: 2158-2162. DOI:10.1002/anie.200905212 |
| [12] |
Egorova KS, Gordeev EG, Ananikov VP. Biological activity of ionic liquids and their application in pharmaceutics and medicine[J]. Chem Rev, 2017, 117: 7132-7189. DOI:10.1021/acs.chemrev.6b00562 |
| [13] |
Potdar MK, Kelso GF, Schwarz L, et al. Recent developments in chemical synthesis with biocatalysts in ionic liquids[J]. Molecules, 2015, 20: 16788-16816. DOI:10.3390/molecules200916788 |
| [14] |
Kuchenbuch A, Giernoth R. Ionic liquids beyond simple solvents: glimpses at the state of the art in organic chemistry[J]. ChemistryOpen, 2015, 4: 677-681. DOI:10.1002/open.201500113 |
| [15] |
Fedorov MV, Kornyshev AA. Ionic liquids at electrified interfaces[J]. Chem Rev, 2014, 114: 2978-3036. DOI:10.1021/cr400374x |
| [16] |
Goossens K, Lava K, Bielawski CW, et al. Ionic liquid crystals: versatile materials[J]. Chem Rev, 2016, 116: 4643-4807. DOI:10.1021/cr400334b |
| [17] |
Roehrer S, Bezold F, García EM, et al. Deep eutectic solvents in countercurrent and centrifugal partition chromatography[J]. J Chromatogr A, 2016, 1434: 102-110. DOI:10.1016/j.chroma.2016.01.024 |
| [18] |
Li Y, Wu X, Zhu Q, et al. Improving the hypoglycemic effect of insulin via the nasal administration of deep eutectic solvents[J]. Int J Pharm, 2019, 569: 118584. DOI:10.1016/j.ijpharm.2019.118584 |
| [19] |
Xuan J, Wu X, Qi J, et al. Application of natural deep eutectic solvents in pharmaceutics[J]. Acta Pharm Sin (药学学报), 2020, 56: 146-157. |
| [20] |
Zandu SK, Chopra H, Singh I. Ionic liquids for therapeutic and drug delivery applications[J]. Curr Drug Res Rev, 2020, 12: 26-41. DOI:10.2174/2589977511666191125103338 |
| [21] |
Hayes R, Warr GG, Atkin R. Structure and nanostructure in ionic liquids[J]. Chem Rev, 2015, 115: 6357-6426. DOI:10.1021/cr500411q |
| [22] |
Lu B, Bo Y, Yi M, et al. Enhancing the solubility and transdermal delivery of drugs using ionic liquid-in-oil microemulsions[J]. Adv Funct Mater, 2021, 31: 2102794. DOI:10.1002/adfm.202102794 |
| [23] |
Plechkova NV, Seddon KR. Applications of ionic liquids in the chemical industry[J]. Chem Soc Rev, 2008, 37: 123-150. DOI:10.1039/B006677J |
| [24] |
Singh G, Kumar A. Ionic liquids: physico-chemical, solvent properties and their applications in chemical processes[J]. Indian J Chem A, 2008, 47: 495-503. |
| [25] |
Huang W, Wu X, Qi J, et al. Ionic liquids: green and tailor-made solvents in drug delivery[J]. Drug Discov Today, 2020, 25: 901-908. DOI:10.1016/j.drudis.2019.09.018 |
| [26] |
Belay K, Abisa Z. Properties, applications and synthesis of ionic liquids in chemistry: a review[J]. World J Pharm Med Res, 2015, 1: 32-39. |
| [27] |
Rooney D, Jacquemin J, Gardas R. Thermophysical properties of ionic liquids[J]. Top Curr Chem, 2010, 290: 185-212. |
| [28] |
Barthen P, Frank W, Ignatiev N. Development of low viscous ionic liquids: the dependence of the viscosity on the mass of the ions[J]. Ionics, 2015, 21: 149-159. DOI:10.1007/s11581-014-1153-9 |
| [29] |
Zhang S, Sun N, He X, et al. Physical properties of ionic liquids: database and evaluation[J]. J Phys Chem B, 2006, 35: 1475-1517. |
| [30] |
Gajardo-Parra NF, Lubben MJ, Winnert JM, et al. Physicochemical properties of choline chloride-based deep eutectic solvents and excess properties of their pseudo-binary mixtures with 1-butanol[J]. J Chem Thermodyn, 2019, 133: 272-284. DOI:10.1016/j.jct.2019.02.010 |
| [31] |
Tanner EEL, Piston KM, Ma H, et al. The influence of water on choline-based ionic liquids[J]. ACS Biomater Sci Eng, 2019, 5: 3645-3653. DOI:10.1021/acsbiomaterials.9b00243 |
| [32] |
Papancea A, Patachia S, Porzsolt A. Conductivity studies of imidazolium-based ionic liquids in aqueous solution[J]. Bull Transilv Univ Braşov, 2015, 8: 67-72. |
| [33] |
Zandu SK, Chopra H, Singh I. Ionic liquids for therapeutic and drug delivery applications[J]. Curr Drug Res Rev, 2020, 12: 26-41. DOI:10.2174/2589977511666191125103338 |
| [34] |
Bhattacharjee A, Luís A, Lopes-Da-Silva JA, et al. Thermophysical properties of sulfonium- and ammonium-based ionic liquids[J]. Fluid Phase Equilib, 2014, 381: 36-45. DOI:10.1016/j.fluid.2014.08.005 |
| [35] |
Mcdaniel JG, Verma A. On the miscibility and immiscibility of ionic liquids and water[J]. J Phys Chem B, 2019, 123: 5343-5356. DOI:10.1021/acs.jpcb.9b02187 |
| [36] |
Das RN, Roy K. Advances in QSPR/QSTR models of ionic liquids for the design of greener solvents of the future[J]. Mol Divers, 2013, 17: 115-196. |
| [37] |
Dejene DI. Ionic liquids: a review on greener chemistry applications, quality ionic liquid synthesis and economical viability in a chemical processes[J]. Am J Phys Chem, 2016, 5: 74-79. DOI:10.11648/j.ajpc.20160503.14 |
| [38] |
Ossowicz P, Klebeko J, Roman B, et al. The relationship between the structure and properties of amino acid ionic liquids[J]. Molecules, 2019, 24: 3252. DOI:10.3390/molecules24183252 |
| [39] |
Han X, Armstrong DW. Using geminal dicationic ionic liquids as solvents for high-temperature organic reactions[J]. Org Lett, 2005, 7: 4205-4208. DOI:10.1021/ol051637w |
| [40] |
Abbott AP, Capper G, Davies DL, et al. Novel solvent properties of choline chloride/urea mixtures[J]. Chem Commun, 2003(1): 70-71. DOI:10.1039/b210714g |
| [41] |
Qin H, Hu XT, Wang JW, et al. Overview of acidic deep eutectic solvents on synthesis, properties and applications[J]. Green Energy Environ, 2020, 5: 8-21. DOI:10.1016/j.gee.2019.03.002 |
| [42] |
Abbasi M, Pazuki G, Raisi A, et al. Thermophysical and rheological properties of sorbitol +([mmim](MeO)2PO2) ionic liquid solutions: solubility, density and viscosity[J]. Food Chem, 2020, 320: 126566. DOI:10.1016/j.foodchem.2020.126566 |
| [43] |
Smith KB, Bridson RH, Leeke GA. Solubilities of pharmaceutical compounds in ionic liquids[J]. J Chem Eng Data, 2011, 56: 2039-2043. DOI:10.1021/je101040p |
| [44] |
Huang L, Zhang W, Yan D, et al. Solubility and aggregation of soy protein isolate induced by different ionic liquids with the assistance of ultrasound[J]. Int J Biol Macromol, 2020, 164: 2277-2283. DOI:10.1016/j.ijbiomac.2020.08.031 |
| [45] |
Hu L, Peng H, Zhang Y, et al. Insight into the interaction between arabinoxylan and imidazolium acetate-based ionic liquids[J]. Carbohydr Polym, 2020, 231: 115699. DOI:10.1016/j.carbpol.2019.115699 |
| [46] |
Wu X, Yu Q, Wu J, et al. Ionic liquids containing ketoconazole improving topical treatment of T. Interdigitale infection by synergistic action[J]. Int J Pharm, 2020, 589: 119842. DOI:10.1016/j.ijpharm.2020.119842 |
| [47] |
Yang Q, Zu C, Li W, et al. Enhanced water solubility and oral bioavailability of paclitaxel crystal powders through an innovative antisolvent precipitation process: antisolvent crystallization using ionic liquids as solvent[J]. Pharmaceutics, 2020, 12: 1008. DOI:10.3390/pharmaceutics12111008 |
| [48] |
Shi Y, Zhao Z, Gao Y, et al. Oral delivery of sorafenib through spontaneous formation of ionic liquid nanocomplexes[J]. J Control Release, 2020, 322: 602-609. DOI:10.1016/j.jconrel.2020.03.018 |
| [49] |
Mccrary P, Beasley P, Gurau G, et al. Drug specific, tuning of an ionic liquid's hydrophilic-lipophilic balance to improve water solubility of poorly soluble active pharmaceutical ingredients[J]. New J Chem, 2013, 37: 2196-2202. DOI:10.1039/c3nj00454f |
| [50] |
Moniruzzaman M, Kamiya N, Goto M. Ionic liquid based microemulsion with pharmaceutically accepted components: formulation and potential applications[J]. J Colloid Interface Sci, 2010, 352: 136-142. DOI:10.1016/j.jcis.2010.08.035 |
| [51] |
Williams HD, Sahbaz Y, Ford L, et al. Ionic liquids provide unique opportunities for oral drug delivery: structure optimization and in vivo evidence of utility[J]. Chem Commun, 2014, 50: 1688-1690. DOI:10.1039/C3CC48650H |
| [52] |
Sindhu A, Kumar S, Mondal D, et al. Protein packaging in ionic liquid mixtures: an ecofriendly approach towards the improved stability of β-lactoglobulin in cholinium-based mixed ionic liquids[J]. Phys Chem Chem Phys, 2020, 22: 14811-14821. DOI:10.1039/D0CP02151B |
| [53] |
Zou B, Yan Y, Xia J, et al. Enhancing bio-catalytic activity and stability of lipase nanogel by functional ionic liquids modification[J]. Colloids Surf B Biointerfaces, 2020, 195: 111275. DOI:10.1016/j.colsurfb.2020.111275 |
| [54] |
Dinis TBV, Sousa F, Freire MG. Insights on the DNA stability in aqueous solutions of ionic liquids[J]. Front Bioeng Biotechnol, 2020, 8: 547857. DOI:10.3389/fbioe.2020.547857 |
| [55] |
Gomes A, Bessa LJ, Correia P, et al. "Clicking" an ionic liquid to a potent antimicrobial peptide: on the route towards improved stability[J]. Int J Mol Sci, 2020, 21: 6174. DOI:10.3390/ijms21176174 |
| [56] |
Saraswat J, Wani FA, Dar KI, et al. Noncovalent conjugates of ionic liquid with antibacterial peptide melittin: an efficient combination against bacterial cells[J]. ACS Omega, 2020, 5: 6376-6388. DOI:10.1021/acsomega.9b03777 |
| [57] |
Agatemor C, Ibsen KN, Tanner EEL, et al. Ionic liquids for addressing unmet needs in healthcare[J]. Bioeng Transl Med, 2018, 3: 7-25. DOI:10.1002/btm2.10083 |
| [58] |
Sidat Z, Marimuthu T, Kumar P, et al. Ionic liquids as potential and synergistic permeation enhancers for transdermal drug delivery[J]. Pharmaceutics, 2019, 11: 96. DOI:10.3390/pharmaceutics11020096 |
| [59] |
Almeida TS, Júlio A, Saraiva N, et al. Choline- versus imidazole-based ionic liquids as functional ingredients in topical delivery systems: cytotoxicity, solubility, and skin permeation studies[J]. Drug Dev Ind Pharm, 2017, 43: 1858-1865. DOI:10.1080/03639045.2017.1349788 |
| [60] |
Lim GS, Jaenicke S, Klähn M. How the spontaneous insertion of amphiphilic imidazolium-based cations changes biological membranes: a molecular simulation study[J]. Phys Chem Chem Phys, 2015, 17: 29171-29183. DOI:10.1039/C5CP04806K |
| [61] |
Kundu N, Roy S, Mukherjee D, et al. Unveiling the interaction between fatty-acid-modified membrane and hydrophilic imidazolium-based ionic liquid: understanding the mechanism of ionic liquid cytotoxicity[J]. J Phys Chem B, 2017, 121: 8162-8170. DOI:10.1021/acs.jpcb.7b06231 |
| [62] |
Cao J, Wu R, Dong Q, et al. Effective release of intracellular enzymes by permeating the cell membrane with hydrophobic deep eutectic solvents[J]. Chembiochem, 2020, 21: 672-680. DOI:10.1002/cbic.201900502 |
| [63] |
Hayyan M, Looi CY, Hayyan A, et al. In vitro and in vivo toxicity profiling of ammonium-based deep eutectic solvents[J]. PLoS One, 2015, 10: e0117934. DOI:10.1371/journal.pone.0117934 |
| [64] |
Trifan A, Luca SV, Greige-Gerges H, et al. Recent advances in tackling microbial multidrug resistance with essential oils: combinatorial and nano-based strategies[J]. Crit Rev Microbiol, 2020, 46: 338-357. DOI:10.1080/1040841X.2020.1782339 |
| [65] |
Hajfarajollah H, Mokhtarani B, Sharifi A, et al. Toxicity of various kinds of ionic liquids towards the cell growth and end product formation of the probiotic strain, Propionibacterium freudenreichii[J]. RSC Adv, 2014, 4: 13153-13160. DOI:10.1039/C4RA00925H |
| [66] |
Zhang C, Malhotra SV, Francis AJ. Toxicity of ionic liquids to Clostridium sp. and effects on uranium biosorption[J]. J Hazard Mater, 2014, 264: 246-253. DOI:10.1016/j.jhazmat.2013.11.003 |
| [67] |
O'toole GA, Wathier M, Zegans ME, et al. Diphosphonium ionic liquids as broad-spectrum antimicrobial agents[J]. Cornea, 2012, 31: 810-816. DOI:10.1097/ICO.0b013e31823f0a86 |
| [68] |
Walkiewicz F, Materna K, Kropacz A, et al. Multifunctional long-alkyl-chain quaternary ammonium azolate based ionic liquids[J]. New J Chem, 2010, 34: 2281-2289. DOI:10.1039/c0nj00228c |
| [69] |
Hossain MI, El-Harbawi M, Noaman YA, et al. Synthesis and anti-microbial activity of hydroxylammonium ionic liquids[J]. Chemosphere, 2011, 84: 101-104. DOI:10.1016/j.chemosphere.2011.02.048 |
| [70] |
Docherty KM, Kulpa CF. Toxicity and antimicrobial activity of imidazolium and pyridinium ionic liquids[J]. Green Chem, 2005, 7: 185-189. DOI:10.1039/b419172b |
| [71] |
Miskiewicz A, Ceranowicz P, Szymczak M, et al. The use of liquids ionic fluids as pharmaceutically active substances helpful in combating nosocomial infections induced by Klebsiella Pneumoniae New Delhi strain, Acinetobacter Baumannii and Enterococcus species[J]. Int J Mol Sci, 2018, 19: 2779. DOI:10.3390/ijms19092779 |
| [72] |
Forero DO, Castro R, Gutierrez M, et al. Novel alkylimidazolium ionic liquids as an antibacterial alternative to pathogens of the skin and soft tissue infections[J]. Molecules, 2018, 23: 2354. DOI:10.3390/molecules23092354 |
| [73] |
Carson L, Chau PW, Earle M, et al. Antibiofilm activities of 1-alkyl-3-methylimidazolium chloride ionic liquids[J]. Green Chem, 2009, 11: 492-497. DOI:10.1039/b821842k |
| [74] |
Busetti A, Crawford DE, Earle MJ, et al. Antimicrobial and antibiofilm activities of 1-alkylquinolinium bromide ionic liquids[J]. Green Chem, 2010, 12: 420-425. DOI:10.1039/b919872e |
| [75] |
Venkata NY, Reddy GK, Lalithamanasa P, et al. The ionic liquid 1-alkyl-3-methylimidazolium demonstrates comparable antimicrobial and antibiofilm behavior to a cationic surfactant[J]. Biofouling, 2012, 28: 1141-1149. DOI:10.1080/08927014.2012.736966 |
| [76] |
Xu Q, Zheng Z, Wang B, et al. Zinc ion coordinated poly(ionic liquid) antimicrobial membranes for wound healing[J]. ACS Appl Mater Interfaces, 2017, 9: 14656-14664. DOI:10.1021/acsami.7b01677 |
| [77] |
Zheng Z, Guo J, Mao H, et al. Metal-containing poly (ionic liquid) membranes for antibacterial applications[J]. ACS Biomater Sci Eng, 2017, 3: 922-928. DOI:10.1021/acsbiomaterials.7b00165 |
| [78] |
Henley SJ, Ward EM, Scott S, et al. Annual report to the nation on the status of cancer, part Ⅰ: national cancer statistics[J]. Cancer, 2020, 126: 2225-2249. DOI:10.1002/cncr.32802 |
| [79] |
Erratum: Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2020, 70: 313.
|
| [80] |
Dias AR, Costa-Rodrigues J, Fernandes MH, et al. The anticancer potential of ionic liquids[J]. ChemMedChem, 2017, 12: 11-18. DOI:10.1002/cmdc.201600480 |
| [81] |
Malhotra SV, Kumar V. A profile of the in vitro anti-tumor activity of imidazolium-based ionic liquids[J]. Bioorg Med Chem Lett, 2010, 20: 581-585. DOI:10.1016/j.bmcl.2009.11.085 |
| [82] |
Egorova KS, Ananikov VP. Toxicity of ionic liquids: eco(cyto)activity as complicated, but unavoidable parameter for task-specific optimization[J]. ChemSusChem, 2014, 7: 336-360. DOI:10.1002/cssc.201300459 |
| [83] |
Kumar RA, Papaïconomou N, Lee JM, et al. In vitro cytotoxicities of ionic liquids: effect of cation rings, functional groups, and anions[J]. Environ Toxicol, 2009, 24: 388-395. DOI:10.1002/tox.20443 |
| [84] |
Frade R, Rosatella AA, Marques CS, et al. Toxicological evaluation on human colon carcinoma cell line (CaCo-2) of ionic liquids based on imidazolium, guanidinium, ammonium, phosphonium, pyridinium and pyrrolidinium cations[J]. Green Chem, 2009, 11: 1660. DOI:10.1039/b914284n |
| [85] |
Santos MM, Raposo LR, Carrera G, et al. Ionic liquids and salts from ibuprofen as promising innovative formulations of an old drug[J]. ChemMedChem, 2019, 14: 907-911. DOI:10.1002/cmdc.201900040 |
| [86] |
Araújo JM, Florindo C, Pereiro AB, et al. Cholinium-based ionic liquids with pharmaceutically active anions[J]. RSC Adv, 2014, 4: 28126-28132. DOI:10.1039/C3RA47615D |
| [87] |
Shamshina JL, Cojocaru OA, Kelley SP, et al. Acyclovir as an ionic liquid cation or anion can improve aqueous solubility[J]. ACS Omega, 2017, 2: 3483-3493. DOI:10.1021/acsomega.7b00554 |
| [88] |
Duarte AR, Ferreira AS, Barreiros S, et al. A comparison between pure active pharmaceutical ingredients and therapeutic deep eutectic solvents: solubility and permeability studies[J]. Eur J Pharm Biopharm, 2017, 114: 296-304. DOI:10.1016/j.ejpb.2017.02.003 |
| [89] |
Aroso IM, Silva JC, Mano F, et al. Dissolution enhancement of active pharmaceutical ingredients by therapeutic deep eutectic systems[J]. Eur J Pharm Biopharm, 2016, 98: 57-66. DOI:10.1016/j.ejpb.2015.11.002 |
| [90] |
Moxon CA, Gibbins MP, Mcguinness D, et al. New insights into malaria pathogenesis[J]. Annu Rev Pathol, 2020, 15: 315-343. DOI:10.1146/annurev-pathmechdis-012419-032640 |
| [91] |
Ferraz R, Pinheiro M, Gomes A, et al. Effects of novel triple-stage antimalarial ionic liquids on lipid membrane models[J]. Bioorg Med Chem Lett, 2017, 27: 4190-4193. DOI:10.1016/j.bmcl.2017.07.006 |
| [92] |
Moshikur RM, Chowdhury MR, Wakabayashi R, et al. Characteri zation and cytotoxicity evaluation of biocompatible amino acid esters used to convert salicylic acid into ionic liquids[J]. Int J Pharm, 2018, 546: 31-38. DOI:10.1016/j.ijpharm.2018.05.021 |
| [93] |
Shamshina JL, Kelley SP, Gurau G, et al. Chemistry: develop ionic liquid drugs[J]. Nature, 2015, 528: 188-189. DOI:10.1038/528188a |
| [94] |
Hough WL, Smiglak M, Rodríguez H, et al. The third evolution of ionic liquids: active pharmaceutical ingredients[J]. New J Chem, 2007, 31: 1429-1436. DOI:10.1039/b706677p |
| [95] |
Reinholz J, Landfester K, Mailänder V. The challenges of oral drug delivery via nanocarriers[J]. Drug Deliv, 2018, 25: 1694-1705. DOI:10.1080/10717544.2018.1501119 |
| [96] |
Xia F, Fan W, Jiang S, et al. Size-dependent translocation of nanoemulsions via oral delivery[J]. ACS Appl Mater Interfaces, 2017, 9: 21660-21672. DOI:10.1021/acsami.7b04916 |
| [97] |
Shi Y, Zhao Z, Peng K, et al. Enhancement of anticancer efficacy and tumor penetration of sorafenib by ionic liquids[J]. Adv Healthc Mater, 2021, 10: 2001455. DOI:10.1002/adhm.202001455 |
| [98] |
Banerjee A, Ibsen K, Brown T, et al. Ionic liquids for oral insulin delivery[J]. Proc Natl Acad Sci U S A, 2018, 115: 7296-7301. DOI:10.1073/pnas.1722338115 |
| [99] |
Angsantikul P, Peng K, Curreri AM, et al. Ionic liquids and deep eutectic solvents for enhanced delivery of antibodies in the gastrointestinal tract[J]. Adv Funct Mater, 2020. DOI:10.1002/adfm.202002912 |
| [100] |
Münch S, Wohlrab J, Neubert RHH. Dermal and transdermal delivery of pharmaceutically relevant macromolecules[J]. Eur J Pharm Biopharm, 2017, 119: 235-242. DOI:10.1016/j.ejpb.2017.06.019 |
| [101] |
Mueller J, Oliveira JSL, Barker R, et al. The effect of urea and taurine as hydrophilic penetration enhancers on stratum corneum lipid models[J]. Biochim Biophys Acta, 2016, 1858: 2006-2018. DOI:10.1016/j.bbamem.2016.05.010 |
| [102] |
Azagury A, Khoury L, Enden G, et al. Ultrasound mediated transdermal drug delivery[J]. Adv Drug Deliv Rev, 2014, 72: 127-143. DOI:10.1016/j.addr.2014.01.007 |
| [103] |
Prausnitz MR. Microneedles for transdermal drug delivery[J]. Adv Drug Deliv Rev, 2004, 56: 581-587. DOI:10.1016/j.addr.2003.10.023 |
| [104] |
Lane ME. Skin penetration enhancers[J]. Int J Pharm, 2013, 447: 12-21. DOI:10.1016/j.ijpharm.2013.02.040 |
| [105] |
Kłysik K, Pietraszek A, Karewicz A, et al. Acyclovir in the treatment of herpes viruses-a review[J]. Curr Med Chem, 2020, 27: 4118-4137. DOI:10.2174/0929867325666180309105519 |
| [106] |
Moniruzzaman M, Tahara Y, Tamura M, et al. Ionic liquid-assisted transdermal delivery of sparingly soluble drugs[J]. Chem Commun, 2010, 46: 1452-1454. DOI:10.1039/b907462g |
| [107] |
Wang C, Zhu J, Zhang D, et al. Ionic liquid-microemulsions assisting in the transdermal delivery of dencichine: preparation, in-vitro and in-vivo evaluations, and investigation of the permeation mechanism[J]. Int J Pharm, 2018, 535: 120-131. DOI:10.1016/j.ijpharm.2017.10.024 |
| [108] |
Tanner EEL, Curreri AM, Balkaran J, et al. Design principles of ionic liquids for transdermal drug delivery[J]. Adv Mater, 2019, 31: 1901103. DOI:10.1002/adma.201901103 |
| [109] |
Banerjee A, Ibsen K, Iwao Y, et al. Transdermal protein delivery using choline and geranate (CAGE) deep eutectic solvent[J]. Adv Healthc Mater, 2017, 6: 1601411. DOI:10.1002/adhm.201601411 |
| [110] |
Zakrewsky M, Mitragotri S. Therapeutic RNAi robed with ionic liquid moieties as a simple, scalable prodrug platform for treating skin disease[J]. J Control Release, 2016, 242: 80-88. DOI:10.1016/j.jconrel.2016.09.003 |
| [111] |
Dharamdasani V, Mandal A, Qi QM, et al. Topical delivery of siRNA into skin using ionic liquids[J]. J Control Release, 2020, 323: 475-482. DOI:10.1016/j.jconrel.2020.04.038 |
| [112] |
Tanner EEL, Wiraja C, Curreri CA, et al. Stabilization and topical skin delivery of framework nucleic acids using ionic liquids[J]. Adv Ther, 2020. DOI:10.1002/adtp.202000041 |
| [113] |
Morales JO, Fathe KR, Brunaugh A, et al. Challenges and future prospects for the delivery of biologics: oral mucosal, pulmonary, and transdermal routes[J]. AAPS J, 2017, 19: 652-668. |
| [114] |
Montenegro NM, Morales JO. Overview and future potential of buccal mucoadhesive films as drug delivery systems for biologics[J]. AAPS PharmSciTech, 2017, 18: 1-12. DOI:10.1208/s12249-016-0685-x |
| [115] |
Vaidya A, Mitragotri S. Ionic liquid-mediated delivery of insulin to buccal mucosa[J]. J Control Release, 2020, 327: 26-34. |
| [116] |
Chowdhury MR, Moshikur RM, Wakabayashi R, et al. Ionic-liquid-based paclitaxel preparation: a new potential formulation for cancer treatment[J]. Mol Pharm, 2018, 15: 2484-2488. |
| [117] |
Hayyan M, Mbous YP, Looi CY, et al. Natural deep eutectic solvents: cytotoxic profile[J]. Springerplus, 2016, 5: 913. |
| [118] |
Pham T, Cho CW, Yun YS. Environmental fate and toxicity of ionic liquids: a review[J]. Water Res, 2010, 44: 352-372. |
 2022, Vol. 57
2022, Vol. 57


