多数疾病的产生和发展皆与蛋白的异常表达或聚集有关。针对该类病理机制, 传统的药物研发思路是开发各类小分子或蛋白类的抑制剂, 通过占据和阻断靶标蛋白的活性作用位点, 抑制蛋白的功能活性[1]。此类研发策略需要靶标蛋白具有明确的“可成药性”的活性口袋或结合位点, 这使得诸多不具有活性结合区域的蛋白质(如非酶类蛋白) 成为“不可成药”的靶点。小分子抑制剂以“占用驱动” (occupancy-driven) 的模式与靶蛋白(protein of interest, POI) 的活性位点特异性结合[2]。该模式需要在一定时间内保持较高的药物浓度, 以保证药物与靶点的有效结合, 因此易引起药物的脱靶效应与不良反应[3, 4]。此外, 小分子抑制剂可能使蛋白代偿性增加或发生基因突变, 导致抑制剂产生耐药性[5, 6]。近几十年来发展起来的基因干扰技术, 例如RNAi技术和CRISPR技术, 从基因水平对蛋白质表达进行调控, 进而影响蛋白质的总体表达水平。尽管基因干扰技术突破了蛋白质结构层面对药物设计的限制, 但该类技术存在“脱靶”风险高、发挥效应时间长导致细胞启动补偿机制等问题和挑战, 严重制约其发展[7, 8]。
近十年发展起来的靶向蛋白质降解技术(targeted protein degradation technology) 是通过利用真核细胞中固有的调控蛋白质稳态的蛋白质降解机制, 干扰蛋白质功能的新技术。该技术的兴起一定程度上解决了小分子抑制剂和基因干扰技术所面临的困境。目前该领域发展最为成熟的是基于泛素化-蛋白酶体系统降解途径的蛋白水解靶向嵌合体(proteolysis-targeting chimera, PROTAC) 技术。随着降解机制和降解对象的拓展, 近几年相继涌现出各类新型靶向蛋白质降解技术, 包括溶酶体靶向嵌合体(lysosome-targeting chimera, LYTAC) 技术、自噬靶向嵌合体(autophagy-targeting chimera, AUTAC) 技术、自噬小体绑定化合物(autophagosome-tethering compound, ATTEC) 技术以及分子伴侣介导的自噬(chaperone-mediated autophagy, CMA) 嵌合体技术。靶向蛋白质降解技术在多种疾病领域如恶性肿瘤、神经退行性疾病、代谢性疾病等具有广阔的应用前景和发展空间。本文将简述各类蛋白质降解技术的作用机制和特点, 重点介绍几类新兴技术的研究现状、优势和存在的问题。
1 细胞内蛋白质降解的两种途径蛋白质降解是调控细胞内固有的维持蛋白质稳态的重要机制, 其中泛素-蛋白酶体系统和溶酶体途径是细胞内蛋白质降解的两个主要途径。
1.1 泛素-蛋白酶体系统泛素-蛋白酶体系统(ubiquitin-proteasome system, UPS) 负责细胞内80%以上内源性蛋白的降解, 在调节细胞的生命活动中起着重要的作用, 如细胞周期调控、信号转导、核酸密码翻译等[9]。蛋白质的泛素化修饰通常需要3种关键的酶共同作用, 包括泛素活化酶E1 (E1活化酶)、泛素结合酶E2 (E2结合酶) 和泛素连接酶E3 (E3连接酶)。在泛素(ubiquitin, Ub) 修饰过程中, 首先E1活化酶通过消耗ATP激活游离泛素, 然后将活化的泛素呈递给E2结合酶, 随后E3连接酶招募E2结合酶和靶蛋白, 从而将E2结合酶上的泛素转移到靶蛋白[7, 9]。当第一个泛素分子转移到靶蛋白上后, 泛素分子相继连接到靶蛋白上, 形成多聚泛素链。被多泛素化修饰的靶蛋白随即被蛋白酶体识别并降解[7]。利用UPS的降解机制, 近十年来开发的PROTAC技术为不可成药靶标提供了全新的调控策略和研究工具。
1.2 溶酶体途径: 内吞-溶酶体途径和自噬-溶酶体途径溶酶体途径主要包括内吞-溶酶体途径(endocytosis-lysosome pathway) 和自噬-溶酶体途径(autophagy-lysosome pathway)。
1.2.1 内吞-溶酶体途径内吞-溶酶体途径主要负责胞外蛋白与跨膜蛋白的降解, 在细胞的营养摄取、信号传递、抗原呈递和储存等过程中发挥着重要作用[10]。内吞-溶酶体途径主要经由网格蛋白介导的内吞(clathrin-mediated endocytosis, CME) 方式来实现蛋白质在溶酶体的降解[11]。该途径首先通过受体介导, 招募衔接蛋白和网格蛋白形成包被小凹, 继而在细胞膜表面凹陷; 在含有GTP酶的动力蛋白作用下, 网格蛋白包被的囊泡最终脱离细胞膜, 并与早期内体融合[1, 12]。进入内体后的蛋白与受体复合物有两种主要的去向: ①蛋白与受体的复合物在酸性环境下发生解离, 游离的受体随后被循环回到细胞膜表面; ②蛋白与受体的复合物不发生解离, 而被继续运送至晚期内体, 并最终与溶酶体融合[10, 13]。最新发展的LYTAC技术利用内吞-溶酶体途径, 有效地实现胞外蛋白和膜蛋白的降解[1], 克服了PROTAC技术仅靶向胞内蛋白的局限性。
1.2.2 自噬-溶酶体途径自噬是细胞清除自身受损或无用蛋白质或细胞器, 维持细胞的稳态和正常生命活动的重要过程。根据物质运输到溶酶体的途径不同, 自噬主要分为以下3种[14, 15]: ①大自噬: 内质网膜将目标蛋白包裹形成自噬小体, 随后自噬小体与溶酶体融合而实现降解; ②微自噬: 溶酶体膜将目标蛋白直接包裹入溶酶体, 进而将其降解; ③分子伴侣介导的自噬(CMA): 目标蛋白首先与分子伴侣结合, 继而被转运至溶酶体进行降解。近年来发展的基于自噬-溶酶体途径的蛋白质降解技术主要有AUTEC、ATTEC及基于CMA的嵌合体。
2 基于泛素-蛋白酶体系统的蛋白质降解: PROTACPROTAC是一种杂合双功能的小分子或多肽化合物, 通过连接子(linker) 将靶蛋白结合配体(protein binding domain, PBD) 与E3连接酶配体连接而成[16]。PROTAC技术的原理是通过拉近靶蛋白和泛素连接酶E3的距离, 形成“靶蛋白-PROTAC-E3连接酶”三元复合物, 继而给靶蛋白加上泛素化标签, 最终利用泛素-蛋白酶体系统降解靶蛋白(图 1)[7]。在完成对靶蛋白的泛素化标记后, PROTAC可脱离靶蛋白和E3连接酶, 在细胞内循环利用[17]。总结来说, PROTAC技术具有以下两个主要优势: ① PROTAC只需具备与靶蛋白结合活性, 不需要直接抑制靶蛋白的功能活性, 因此可靶向传统“不可成药”的靶点[7]; ② PROTAC通过“事件驱动” (event-driven) 模式降解靶蛋白, 只需亚化学剂量的PROTAC分子与靶蛋白以非共价作用力瞬态结合即可实现靶蛋白的降解, 因此具有效率高、毒副作用弱、耐受性强的特点[5, 7]。
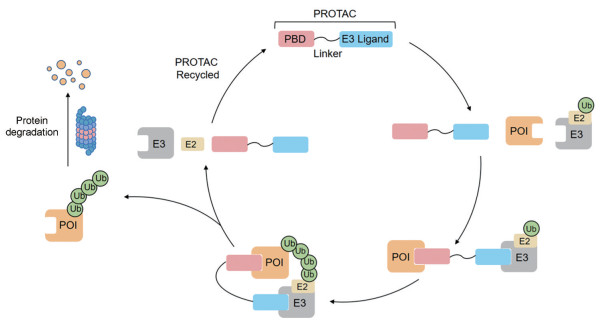
|
Figure 1 Mechanism of action of protein proteolysis-targeting chimeras (PROTAC). PBD: Protein binding domain; POI: Protein of interest; Ub: Ubiquitin |
第一代多肽类PROTACs采用β-TrCP和VHL作为E3连接酶, 但多肽分子的细胞通透性和稳定性问题限制了其临床应用。第二代小分子PROTACs采用MDM2、IAPs、CRBN和VHL作为E3连接酶, 使得PROTAC技术在靶向蛋白质降解技术领域获得迅速发展[18, 19]。针对PROTAC技术存在的问题和缺点, 研究者开发各种新型PROTACs, 不断提高该技术的应用价值。以下列举一些新兴的PROTAC技术: ①光控PROTAC: Trauner课题组[20]开发一种光控的蛋白质降解技术(PHOTAC), 通过将偶氮苯结构作为光开关, 引入到PROTAC分子结构中, 从而实现光诱导的靶蛋白降解。②抗体-PROTAC偶联物: Tate课题组[21]将PROTAC概念应用到抗体偶联药物的设计中, 通过将曲妥珠单抗与PROTAC进行偶联, 选择性降解HER2阳性细胞的溴结构域蛋白4 (BRD4), 从而实现PROTAC技术的细胞特异性。③抗体类PROTAC: Wells课题组[22]首次报道抗体类的PROTAC (antibody-based PROTAC, AbTACs), 其核心是一种双特异性抗体, 通过同时靶向位于细胞膜上的E3连接酶(RNF43) 和程序性死亡配体1 (PD-L1), 从而实现PD-L1的降解。
PROTACs发展迅速, 越来越多的疾病相关的蛋白通过该技术被成功降解, 但是PROTAC技术也面临着诸多潜在的问题和挑战。首先, 大多数PROTAC分子量大, 溶解性不高, 细胞渗透性不佳, 因此存在口服吸收差、生物利用度低等缺点, 是开发该类药物过程中亟待解决的难题[23]。第二, PROTAC活性的发挥依赖于某种特定的E3连接酶和蛋白酶体, 因此受限于对应E3连接酶和蛋白酶体在特定细胞的表达量, 同时也可能引起E3连接酶的耐受性[7, 18]。最后, 目前PROTAC技术主要利用的是细胞内的泛素-蛋白酶体系统, 该途径作用的是胞内蛋白, 因此无法降解不具有胞内结合域的膜蛋白或胞外蛋白[24]。
3 基于内吞-溶酶体途径的蛋白质降解: LYTAC2020年7月Bertozzi课题组[1]首次提出溶酶体靶向嵌合体(lysosome-targeting chimeras, LYTACs) 的概念, 首次利用了内吞-溶酶体途径, 通过靶向蛋白的胞外结构域, 实现胞外蛋白和膜蛋白的靶向降解。LYTAC主要由两个结合域组成, 其中一个是靶向细胞表面的溶酶体靶向受体(lysosome-targeting receptor, LTR) 的寡聚糖结构, 另外一个是靶向靶蛋白的抗体、多肽或小分子, 两者通过一个化学链连接在一起。LYTAC的作用机制如图 2A所示: 首先, LYTAC分子的靶蛋白配体部分与靶蛋白的胞外结构域结合, 同时寡糖结构与细胞表面的LTR结合, 三者形成LTR-LYTAC-靶蛋白三元复合物; 而后, 复合物经网格蛋白介导内吞进入细胞内, 并经囊泡运送到早期内体中; 随着内体酸化, 三元复合物中的LTR解离并回到细胞膜或高尔基体, LYTAC与靶蛋白的复合物被继续转运至溶酶体中降解, 其中LYTAC分子与蛋白解离后是否可以再次循环降解蛋白有待进一步研究[1, 25]。
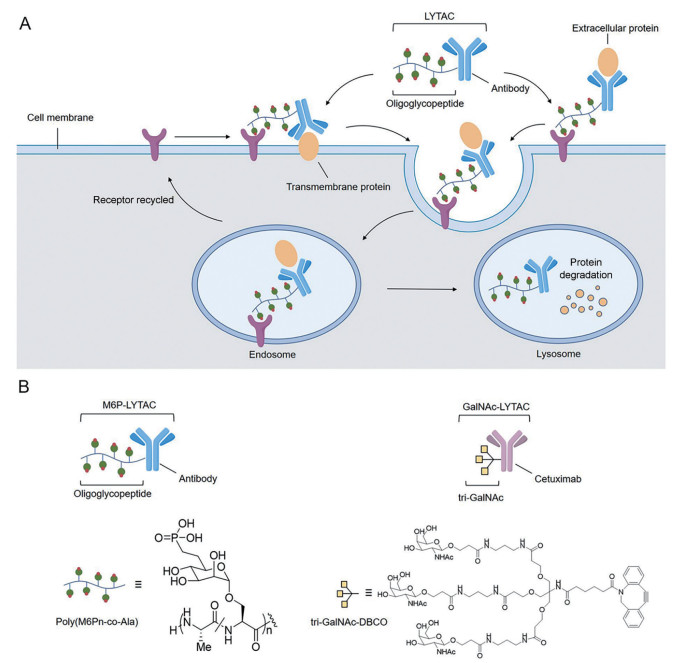
|
Figure 2 LYTACs for targeted degradation of POI. A: Mechanisms of action of LYTAC; B: LYTACs developed to degrade various target[1, 25] |
目前已报道的LTR只有两种, 分别是非阳离子依赖型甘露糖-6-磷酸受体(cation-independent mannose-6-phosphate receptor, CI-M6PR) 和去唾液酸糖蛋白受体(asialoglycoprotein receptor, ASGPR); 其对应的配体分别是多聚甘露糖-6-磷酸(mannose-6-phosphonate, M6P) 和N-乙酰半乳糖胺(N-acetylgalactosamine, GalNAc)。Bertozzi课题组所开发的抗体偶联物M6P-LYTAC通过与CI-M6PR发生特异性结合而诱导靶蛋白的内化, 进而转运到溶酶体发生降解。如图 2B所示, M6P-LYTAC包括两个结构元素: ①能与靶蛋白发生特异性识别并结合的抗体; ②能与LTR结合的含M6P支链的聚糖肽(聚合度约20~90)。该课题组利用M6P-LYTAC成功降解了胞外蛋白(载脂蛋白E4) 和多种膜蛋白, 包括表皮生长因子受体(EGFR) 和转铁蛋白受体1 (CD71)、程序死亡蛋白配体1 (PD-L1)[1]。但是, 由于CI-M6PR在多种细胞表面均有表达, M6P-LYTACs不具有细胞特异性。针对该问题, 2021年3月Bertozzi课题组设计出一种三联GalNAc分子(tri-GalNAc), 通过“点击”化学偶联到能特异性识别靶蛋白的抗体结构上, 得到具有肝细胞特异性的GalNAc-LYTAC (图 2B)。通过GalNac靶向肝脏特异性溶酶体靶向受体ASGPR, 该LYTAC技术成功实现了选择性降解肝癌细胞上的表皮生长因子受体(EGFR) 和人表皮生长因子受体2 (HER2)。此外, 该课题组将LYTAC的靶蛋白配体进行简化, 将tri-GalAc与靶向细胞整合素的多肽分子进行偶联, 设计出的多肽类的LYTAC分子, 可选择性地降解肝癌细胞表面的整合素, 进而抑制肝癌细胞增殖[25]。同期, Tang课题组也报道了相关GalNAc-LYTAC的研究, 该课题组通过将tri-GalNAc与生物素、抗体或抗体片段偶联合成LYTAC分子, 并成功利用其降解了肝脏细胞的胞外蛋白鼠抗兔IgG-647、鼠抗生物素IgG-647与膜蛋白EGFR[26]。
LYTAC技术弥补了之前PROTAC等蛋白质降解技术仅可降解胞内蛋白结构域的局限性, 实现了胞外蛋白与膜蛋白的降解[1], 极大地拓宽了靶向蛋白质降解技术的应用空间, 但是目前LYTAC技术也存在一些问题和挑战: ①目前报道的两种LYTAC结构中糖结构与抗体的偶联方式均为非特异性, 糖结构与靶蛋白配体的最优化学计量比和两者的最佳连接位点仍无法确定, 是影响该技术应用的障碍之一[1, 25]。②目前研究表明, 非特异性糖基修饰的抗体在小鼠体内会被很快清除, 因此如何调节LYTAC的药代动力学特性以控制LYTAC的脱靶清除率, 是该技术面临的另一难点[1]。③ LYTACs分子的LTR配体是化学合成的非天然糖结构, 因此在人体内可能产生较强免疫原性。④ LTR在大多数细胞表面广泛表达, 因此如何避免LYTAC分子靶向只表达LTR但不表达靶蛋白的细胞, 如何提高LYTACs的选择性与安全性, 也是亟待解决的问题。⑤目前已被报道的LYTAC主要是抗体类大分子, 小分子类LYTAC仍有待开发。
4 基于自噬-溶酶体途径的蛋白质降解 4.1 AUTAC自噬靶向嵌合体是基于机体清除A群链霉菌(Group A Streptococcus, GAS) 的自噬机制设计的。该自噬机制如下: 机体通过内源性8-硝基-cGMP (S-鸟苷酸) 与链霉菌细胞表面相关蛋白发生S-鸟苷化反应, 进而介导链霉菌的K63多聚泛素化, 随后链霉菌被自噬小体包裹, 进入溶酶体而实现降解[27-29]。也就是说, S-鸟苷酸化修饰是招募自噬体的一种重要信号。基于此, 2019年Arimoto课题组首次提出AUTAC的概念[30]。AUTAC主要由3部分组成, 分别是靶蛋白的靶向配体、连接子和降解标签鸟嘌呤衍生物(guanine derivative, GD)。AUTAC的作用原理是, 通过降解标签模拟S-鸟苷酸化修饰, 诱导靶蛋白的多聚泛素化, 进而招募自噬体实现溶酶体途径降解(图 3A)。该课题组设计一系列AUTAC分子(图 3B), 通过将鸟苷酸衍生物(FBnG) 与靶蛋白结合部分连接, 有效实现多种疾病相关的靶蛋白的降解, 包括甲硫氨酸氨基肽酶2 (MetAP2)、FK506结合蛋白(FKBP12)、BET家族蛋白, 并开展相关实验证明AUTAC分子是通过自噬-溶酶体途径实现蛋白质的降解。此外, 他们还将AUTAC技术应用于碎片化线粒体的降解, 通过设计靶向线粒体转运蛋白配体TSPO的AUTAC分子, 成功实现碎片线粒体的降解, 并证实其降解是通过自噬-溶酶体途径完成。
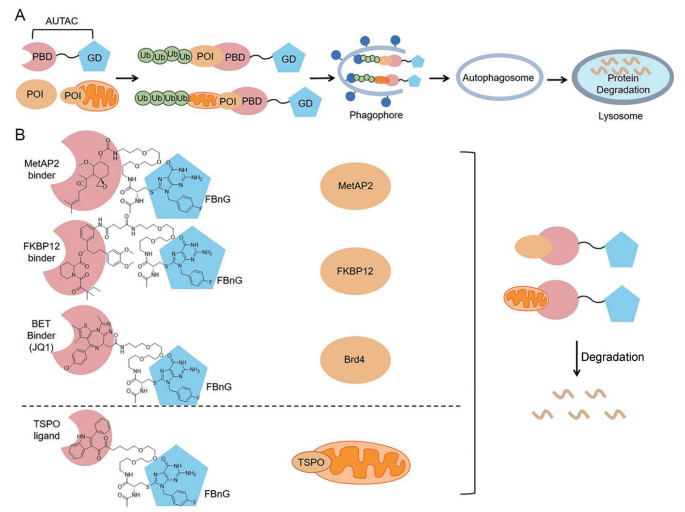
|
Figure 3 AUTACs for targeted degradation of POI. A: Mechanisms of action of AUTAC; B: AUTACs developed to degrade MetAP2, FKBP12, Brd4 and mitochondria[30]. GD: Guanine derivative; FBnG: p-Flurobenzylguanine; TSPO: Mitochondria translocator protein |
AUTAC与PROTAC相似, 也是通过诱导靶蛋白的多聚泛素化实现蛋白质降解; 但是与PROTAC不同, AUTAC是通过自噬-溶酶体途径实现降解, 因此具有更加广泛的降解范围, 不仅可以降解细胞质蛋白, 还可以实现碎片化的细胞器降解。但是, AUTAC技术还存在以下需要解决的问题: ① AUTAC的潜能还需要进一步开发, 比如探究AUTAC是否可以降解蛋白聚集体[27]; ② AUTAC的具体降解机制仍尚未清楚, 对AUTAC的多聚泛素化降解标签如何发挥作用仍需进一步研究[27]; ③在降解速率方面, AUTAC速度比PROTACs慢, 一般PROTAC降解过程只需要约1 h, 而AUTAC降解需要几个小时[30]。
4.2 ATTECATTEC (autophagosome-tethering compound) 即自噬小体绑定化合物, 该化合物可同时作用于靶蛋白和自噬小体蛋白LC3, 从而拉近靶蛋白与LC3之间距离, 实现两者的捆绑。LC3可进一步诱导自噬泡包裹靶蛋白, 形成自噬小体, 随后将自噬小体运输到溶酶体, 从而实现靶蛋白的降解(图 4A)。2019年复旦大学的Ding等[31]首次报道利用ATTEC启动自噬途径, 降解细胞内聚集的HTT突变蛋白。该课题组通过高通量筛选, 从一个由3 375个小分子组成的化合物库中筛选出候选ATTEC小分子, 并对其进行结构优化, 使其能特异性地结合LC3或HTT突变蛋白, 但不能与野生型HTT蛋白结合(图 4B)。研究者在细胞水平上证明优化后的ATTEC分子通过直接与HTT突变蛋白和LC3结合, 促进HTT突变蛋白被自噬体吞噬, 并在动物模型上对ATTEC的疗效进行验证。

|
Figure 4 ATTECs for targeted degradation of POI. A: Mechanisms of action of ATTEC; B: ATTECs developed to degrade mutant huntingtin protein (mHTT)[31] |
总结来说, ATTEC技术具有以下几点优势: ①相比于PROTAC技术, ATTEC不需要泛素化途径介导降解, 因此不存在蛋白酶体不充足、靶向E3连接酶导致耐药性等难题[31, 32]; ② ATTEC分子不需要连接子的介入, 分子量较低, 穿膜活性好, 能够更好地满足药代动力学等要求, 因此可能具有更好的药物特性。但是, ATTEC的研究还有以下需解决的问题: ①分子设计成本比较高, 如何高效地设计出能够靶向LC3等自噬相关蛋白的化合物, 是亟待解决的一个问题; ② ATTEC分子的作用是否会影响整体自噬活性, 如何避免自噬相关蛋白和细胞器的非特异性降解, 仍有待进一步探究。
4.3 靶向CMA的嵌合体靶向分子伴侣介导的自噬(chaperone-mediated autophagy, CMA) 的嵌合体是利用CMA机制设计的一类双功能分子, 主要是嵌合多肽。CMA的作用机制如下: 首先, 分子伴侣热休克蛋白HSP70的复合物识别靶蛋白的KFERQ基序, 与靶蛋白形成大复合物; 随后, 该大复合物与溶酶体相关膜蛋白2A (LAMP2A) 相互作用[14, 33], 导致LAMP2A低聚化, 进而介导靶蛋白与Hsc70复合物进入溶酶体, 从而实现降解。目前的研究主要是利用CMA途径设计出多肽嵌合体, 一方面可以靶向目标降解蛋白, 另一方面通过CMA途径介导蛋白的降解(图 5A)。

|
Figure 5 CMA chimeras for targeted degradation of POI. A: Mechanisms of action of CMA chimeras; B: CMA chimeras developed to degrade DAPK1, α-synuclein and PSD-95[34]. CTM: CMA-targeting motif |
2014年Wang课题组[34]利用CMA途径设计出一种嵌合多肽, 用于诱导分子伴侣介导的自噬。如图 5B所示, 该多肽由以下3个部分组成: CMA靶向基序(CMA-targeting motif, CTM)、细胞穿膜肽段(TAT47-57) 以及靶蛋白结合区域(PBD)。该课题组设计了由死亡相关蛋白激酶1 (DAPK1) 结合区域、CTM和穿膜肽TAT47-57组成的多肽, 证明其能够通过溶酶体靶向降解cDAPK1。此外, 该设计除了实现cDAPK1的降解外, 还成功应用到α-突触核蛋白(α-synuclein) 和后突触密度蛋白95 (PSD-95) 的靶向降解。Xu课题组[35]在研究亨廷顿互作蛋白1相关蛋白(HIP1R) 诱导PD-L1降解机制的研究中, 发现HIP1R上的多肽基序(MDFSGLSLIKLKKQ) 具有与KFERQ基序类似的溶酶体靶向活性, 可应用于溶酶体靶向的蛋白质降解。利用HIP1R的结构功能特征, 该课题组设计了PD-LYSO多肽, 该多肽含有PD-L1结合的多肽基序以及溶酶体靶向的多肽基序, 可实现PD-L1在溶酶体的降解。Zhou等[36]设计了由细胞周期蛋白依赖性激酶5 (CDK5) 的配体、穿膜肽Tat和CMA靶向基序CTM组成的Tat-CDK5配体-CTM嵌合多肽, 该多肽能够阻断CDK5与受体的结合, 最终介导CDK5的溶酶体降解。
靶向CMA的嵌合体技术相比于RNA干扰降解蛋白等技术, 具有更快的降解速度、更优的可逆性和剂量依赖性、更强的专一性等优点[34]。另外, 相比于靶向降解蛋白的小分子化合物, 肽段可能更容易设计, 合理利用噬菌体筛选、肽阵列、计算机随机模拟设计等来筛选目标蛋白结合区域, 可更高效地获得高选择性和高亲和力的肽段[34, 37]。但是, 这项技术也具有一定的局限性和挑战: ①通过靶向CMA来实现自噬体途径的降解需要所设计的嵌合多肽与靶蛋白具有较高的亲和性; ②嵌合多肽存在的跨膜能力差和稳定性低等问题是影响其最终成药的主要障碍。
5 总结与展望靶向蛋白质降解技术通过改变蛋白质稳态来干预和调控疾病的过程, 是近年来迅速发展起来的一个重要研究领域。目前应用最广泛的靶向降解技术主要是利用泛素化-蛋白酶体系统, 通过多肽和小分子类PROTAC来实现胞内蛋白的降解。最近发展起来的大分子生物类LYTAC技术通过靶向内吞-溶酶体途径, 降解胞外蛋白和膜蛋白。此外, 新兴发展起来的CMA嵌合体、AUTAC和ATTEC等靶向自噬途径的蛋白质降解技术能够降解错误折叠蛋白、蛋白多聚体或受损细胞器, 未来有希望在神经退行性疾病和代谢性疾病的治疗上得以应用。尽管每种技术都有其优点和缺点, 新兴的降解技术还处于初级发展阶段, 仍存在诸多问题, 但随着研究的不断深入, 它们将极大地拓展降解技术的潜在应用领域, 为生物医学研究和药物研发提供强有力的工具。
作者贡献: 陈怡敏、刘京虹负责文章撰写和绘制插图; 蔡晓青负责文献检索、文章修改、审查与指导。
利益冲突: 本文不存在利益冲突。
| [1] |
Banik SM, Pedram K, Wisnovsky S, et al. Lysosome-targeting chimaeras for degradation of extracellular proteins[J]. Nature, 2020, 584: 291-297. DOI:10.1038/s41586-020-2545-9 |
| [2] |
Ahn G, Banik SM, Bertozzi CR. Degradation from the outside in: targeting extracellular and membrane proteins for degradation through the endolysosomal pathway[J]. Cell Chem Biol, 2021, 28: 1072-1080. DOI:10.1016/j.chembiol.2021.02.024 |
| [3] |
Adjei AA. What is the right dose? The elusive optimal biologic dose in phase I clinical trials[J]. J Clin Oncol, 2006, 24: 4054-4055. DOI:10.1200/JCO.2006.07.4658 |
| [4] |
Xie QH, Hu ZY, Ning WT, et al. The research progress of PROTACs for breast cancer treatment[J]. Acta Pharm Sin (药学学报), 2020, 55: 2053-2061. |
| [5] |
Gopal P, Dick T. Targeted protein degradation in antibacterial drug discovery?[J]. Prog Biophys Mol Biol, 2020, 152: 10-14. DOI:10.1016/j.pbiomolbio.2019.11.005 |
| [6] |
Salami J, Crews CM. Waste disposal-an attractive strategy for cancer therapy[J]. Science, 2017, 355: 1163-1167. DOI:10.1126/science.aam7340 |
| [7] |
Burslem GM, Crews CM. Proteolysis-targeting chimeras as therapeutics and tools for biological discovery[J]. Cell, 2020, 181: 102-114. DOI:10.1016/j.cell.2019.11.031 |
| [8] |
Duan YC, Zhai XY, Qin WP, et al. Advances in the treatment of cancer by PROTACs[J]. Acta Pharm Sin (药学学报), 2017, 52: 1801-1810. |
| [9] |
Pickart CM. Back to the future with ubiquitin[J]. Cell, 2004, 116: 181-190. DOI:10.1016/S0092-8674(03)01074-2 |
| [10] |
Pillay CS, Elliott E, Dennison C. Endolysosomal proteolysis and its regulation[J]. Biochem J, 2002, 363: 417-429. DOI:10.1042/bj3630417 |
| [11] |
Han Y, Da Y, Yu M, et al. Protein labeling approach to improve lysosomal targeting and efficacy of antibody-drug conjugates[J]. Org Biomol Chem, 2020, 18: 3229-3233. DOI:10.1039/D0OB00265H |
| [12] |
Le Roy C, Wrana JL. Clathrin-and non-clathrin-mediated endocytic regulation of cell signalling[J]. Nat Rev Mol Cell Biol, 2005, 6: 112-126. DOI:10.1038/nrm1571 |
| [13] |
Kandimalla V, Neeta N, Karanth N, et al. Regeneration of ethyl parathion antibodies for repeated use in immunosensor: a study on dissociation of antigens from antibodies[J]. Biosens Bioelectron, 2004, 20: 903-906. DOI:10.1016/j.bios.2004.03.027 |
| [14] |
Li W, Nie T, Xu H, et al. Chaperone-mediated autophagy: advances from bench to bedside[J]. Neurobiol Dis, 2019, 122: 41-48. DOI:10.1016/j.nbd.2018.05.010 |
| [15] |
Zhu Q, Lin F. Molecular makers of autophagy[J]. Acta Pharm Sin (药学学报), 2016, 51: 33-38. |
| [16] |
Maniaci C, Ciulli A. Bifunctional chemical probes inducing protein-protein interactions[J]. Curr Opin Chem Biol, 2019, 52: 145-156. DOI:10.1016/j.cbpa.2019.07.003 |
| [17] |
Flanagan JJ, Neklesa TK. Targeting nuclear receptors with PROTAC degraders[J]. Mol Cell Endocrinol, 2019, 493: 110452. DOI:10.1016/j.mce.2019.110452 |
| [18] |
Liu J, Ma J, Liu Y, et al. PROTACs: a novel strategy for cancer therapy[J]. Semin Cancer Biol, 2020, 67: 171-179. DOI:10.1016/j.semcancer.2020.02.006 |
| [19] |
Wang Y, Long J, Chang Q, et al. The application of small molecule PROTAC in researches of different targets[J]. Acta Pharm Sin (药学学报), 2020, 55: 446-452. |
| [20] |
Reynders M, Matsuura BS, Bérouti M, et al. PROTACs enable optical control of protein degradation[J]. Sci Adv, 2020, 6: eaay5064. DOI:10.1126/sciadv.aay5064 |
| [21] |
Maneiro M, Forte N, Shchepinova MM, et al. Antibody-PROTAC conjugates enable HER2-dependent targeted protein degradation of BRD4[J]. ACS Chem Biol, 2020, 15: 1306-1312. DOI:10.1021/acschembio.0c00285 |
| [22] |
Cotton AD, Nguyen DP, Gramespacher JA, et al. Development of antibody-based PROTACs for the degradation of the cell-surface immune checkpoint protein PD-L1[J]. J Am Chem Soc, 2021, 143: 593-598. DOI:10.1021/jacs.0c10008 |
| [23] |
Klein VG, Townsend CE, Testa A, et al. Understanding and improving the membrane permeability of VH032-based PROTACs[J]. ACS Med Chem Lett, 2020, 11: 1732-1738. DOI:10.1021/acsmedchemlett.0c00265 |
| [24] |
Ding Y, Fei Y, Lu B. Emerging new concepts of degrader technologies[J]. Trends Pharmacol Sci, 2020, 41: 464-474. DOI:10.1016/j.tips.2020.04.005 |
| [25] |
Ahn G, Banik SM, Miller CL, et al. LYTACs that engage the asialoglycoprotein receptor for targeted protein degradation[J]. Nat Chem Biol, 2021, 17: 937-946. DOI:10.1038/s41589-021-00770-1 |
| [26] |
Zhou Y, Teng P, Montgomery NT, et al. Development of triantennary N-acetylgalactosamine conjugates as degraders for extracellular proteins[J]. ACS Cent Sci, 2021, 7: 499-506. DOI:10.1021/acscentsci.1c00146 |
| [27] |
Takahashi D, Arimoto H. Targeting selective autophagy by AUTAC degraders[J]. Autophagy, 2020, 16: 765-766. DOI:10.1080/15548627.2020.1718362 |
| [28] |
Nakagawa I, Amano A, Mizushima N, et al. Autophagy defends cells against invading group A Streptococcus[J]. Science, 2004, 306: 1037-1040. DOI:10.1126/science.1103966 |
| [29] |
Lu SL, Kawabata T, Cheng YL, et al. Endothelial cells are intrinsically defective in xenophagy of Streptococcus pyogenes[J]. PLoS Pathog, 2017, 13: e1006444. DOI:10.1371/journal.ppat.1006444 |
| [30] |
Takahashi D, Moriyama J, Nakamura T, et al. AUTACs: cargo-specific degraders using selective autophagy[J]. Mol Cell, 2019, 76: 797-810. DOI:10.1016/j.molcel.2019.09.009 |
| [31] |
Li Z, Wang C, Wang Z, et al. Allele-selective lowering of mutant HTT protein by HTT-LC3 linker compounds[J]. Nature, 2019, 575: 203-209. DOI:10.1038/s41586-019-1722-1 |
| [32] |
Li Z, Zhu C, Ding Y, et al. ATTEC: a potential new approach to target proteinopathies[J]. Autophagy, 2020, 16: 185-187. DOI:10.1080/15548627.2019.1688556 |
| [33] |
Kaushik S, Cuervo AM. Chaperone-mediated autophagy: a unique way to enter the lysosome world[J]. Trends Cell Biol, 2012, 22: 407-417. DOI:10.1016/j.tcb.2012.05.006 |
| [34] |
Fan X, Jin WY, Lu J, et al. Rapid and reversible knockdown of endogenous proteins by peptide-directed lysosomal degradation[J]. Nat Neurosci, 2014, 17: 471-480. DOI:10.1038/nn.3637 |
| [35] |
Wang H, Yao H, Li C, et al. HIP1R targets PD-L1 to lysosomal degradation to alter T cell-mediated cytotoxicity[J]. Nat Chem Biol, 2019, 15: 42-50. DOI:10.1038/s41589-018-0161-x |
| [36] |
Zhou YF, Wang J, Deng MF, et al. The peptide-directed lysosomal degradation of CDK5 exerts therapeutic effects against stroke[J]. Aging Dis, 2019, 10: 1140-1145. DOI:10.14336/AD.2018.1225 |
| [37] |
Mason JM. Design and development of peptides and peptide mimetics as antagonists for therapeutic intervention[J]. Future Med Chem, 2010, 2: 1813-1822. DOI:10.4155/fmc.10.259 |
 2022, Vol. 57
2022, Vol. 57


