目前存在多种免疫治疗方法, 如免疫检查点抑制剂、过继性免疫治疗等, 以激活机体适应性和先天免疫系统, 作为经典抗肿瘤治疗的替代方法或联合其进行协同治疗[1, 2]。由于肿瘤细胞的生长代谢异常, 其通常形成独特的微环境特征如缺氧、低pH和氧化应激等[3], 这为肿瘤形成免疫抑制微环境、免疫逃逸提供了基础, 也为研究者利用该特征进行特异性调控提供了思路。其中, 活性氧(reactive oxygen species, ROS) 是介导氧化应激的重要介质, 也是介导先天性免疫反应的重要分子。具体而言, ROS可以作为直接的化学引诱剂, 调节免疫细胞的招募[4]; 免疫细胞可通过识别病原相关分子模式和损伤相关分子模式(damage-associated molecular patterns, DAMPs) 触发细胞内信号事件, 导致ROS生成增加, 从而分泌促炎细胞因子; 吞噬细胞可通过产生ROS杀死病原微生物[4]。近年来, 越来越多的研究发现, ROS水平与肿瘤免疫应答具有相关性, 其在肿瘤抗原的产生、T细胞等淋巴细胞的增殖和功能中发挥重要作用, 通过诱导或清除ROS可调节免疫微环境, 增强抗肿瘤免疫应答。
1 ROS概述ROS是一组具有化学反应性的自由基、含氧分子或离子, 主要包括氧的一电子还原产物超氧阴离子(superoxide anion free radicals, O2•-)、二电子还原产物过氧化氢(hydrogen peroxide, H2O2)、三电子还原产物羟基自由基(hydroxyl radicals, OH•) 等。ROS内源性的产生途径主要包括有氧呼吸电子传递链中线粒体氧化过程的副产物, 或通过还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶(reduced nicotinamide adenine dinucleotide phosphate oxidase, NOX) 经电子转移产生[5]; 除此之外, 光动力疗法(photodynamic therapy, PDT)、放射疗法、基于芬顿反应的治疗策略等[6]可介导产生外源性ROS, 但不同方法所产生的ROS类型有所不同, 例如PDT中单线态氧被认为是发挥作用的主要类型, 而芬顿反应主要通过芬顿离子催化H2O2产生高毒性的OH•发挥杀伤作用。ROS具有高反应性, 其理化性质与生物活性因其种类不同而具有差异性, 如OH•具有极短的半衰期(~10-9 s), 通常仅与邻近的生物分子反应, 但其反应活性极强, 可氧化大多数的生物分子[7]; 而相比于其他的ROS, H2O2半衰期相对较长, 可通过水通道蛋白扩散和穿过生物膜, 因此可作为细胞内信号转导和细胞间交流的信号分子[8]。ROS发挥作用主要依赖于其对各种靶分子的氧化作用, ROS可氧化靶蛋白分子中的半胱氨酸残基, 例如蛋白酪氨酸激酶可通过调控蛋白的磷酸化和去磷酸化、激活相关转录因子, 参与多种信号级联转导途径; ROS可通过氧化DNA中特定位置的碱基促进转录或引起DNA的断裂; 除此之外, OH•等自由基可攻击磷脂中的不饱和脂肪酸, 引发脂质过氧化链式反应[9]。
ROS参与氧化应激和细胞信号转导等, 其浓度对于细胞的功能和稳态具有重要的调节作用: 当外来生物和细菌入侵时, ROS反应性升高发挥杀伤作用以清除微生物[6]; 但ROS浓度持续升高或持续时间过长也会引起蛋白质、核酸损伤和脂质过氧化等, 产生细胞毒性, 而正常细胞中存在抗氧化机制, 可利用超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT) 和谷胱甘肽过氧化物酶(glutathion peroxidase, GPX) 等维持细胞氧化还原稳态[4] (图 1)。
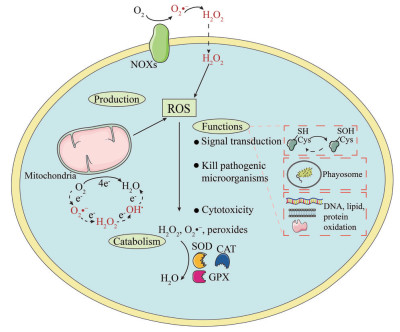
|
Figure 1 Reactive oxygen species (ROS)-related cellular redox homeostasis. O2•-: Superoxide anion free radicals; H2O2: Hydrogen peroxide; OH•: Hydroxyl radicals; NOX: Reduced nicotinamide adenine dinucleotide phosphate oxidase; SOD: Superoxide dismutase; CAT: Catalase; GPX: Glutathion peroxidase; Cys: Cysteine |
抗肿瘤免疫应答的主要过程为: 肿瘤抗原的释放、抗原提呈细胞(antigen presenting cell, APC) 摄取抗原及APC的激活和成熟、APC将抗原提呈给T细胞、T细胞的活化及其介导的免疫应答。ROS可参与免疫应答的各个阶段, 并对不同的免疫细胞产生复杂的调控作用(图 2)。

|
Figure 2 Main mechanism of ROS participating in tumor immune response. ICD: Immunogenic cell death |
ROS与肿瘤细胞的相互作用涉及肿瘤发生发展的多个过程。ROS的积累可导致DNA的突变和损伤, 通过影响甲基化的修饰引起表观遗传的不稳定性, 从而导致细胞癌变, 这也是肿瘤新抗原产生的基础; 癌细胞中ROS水平的升高有助于致瘤信号的维持, ROS的过度增加导致胞内氧化还原态失衡, 激活p53引起细胞周期阻滞和细胞凋亡[10], 以及通过脂质过氧化诱导铁死亡。
肿瘤抗原的产生是引起肿瘤免疫应答的起始步骤, 但肿瘤抗原的低表达和突变、表观遗传变化导致的低免疫原性是限制肿瘤免疫治疗的关键因素之一[11]。肿瘤细胞的免疫原性细胞死亡(immunogenic cell death, ICD) 可释放DAMPs和肿瘤相关抗原, 增强肿瘤的免疫原性[12]。ICD诱导剂通常分为Ⅰ期和Ⅱ期。多柔比星(doxorubicin, DOX)、米托蒽醌等Ⅰ期诱导剂的效应位点主要分布于细胞核或质膜, 可通过继发或间接作用引起内质网应激, 从而诱导DAMPs释放[13]; 而Ⅱ期诱导剂主要基于ROS或靶向内质网等直接作用诱导内质网应激, 其免疫原性诱导能力通常更强[14]。肿瘤细胞由于线粒体基因突变、代谢和过氧化物酶的活性改变, 其基础ROS水平升高, 因此相比于正常细胞更易受氧化应激的影响从而达到致命的ROS水平。高浓度的ROS及内质网氧化应激使肿瘤细胞释放三磷酸腺苷(adenosine triphosphate, ATP)、高迁移率族蛋白B1 (high mobility group box 1, HMGB1) 等募集APC, 并引起钙网蛋白(calreticulin, CRT) 移位至质膜, 作为“eat me”的信号促进APC的成熟和抗原提呈。
2.2 ROS与抗原提呈细胞树突状细胞(dendritic cell, DC) 是最主要的抗原提呈细胞, 在摄取肿瘤抗原后迁移至淋巴结将抗原提呈给T细胞启动免疫应答。抗原的加工途径主要依赖于抗原肽与主要组织相容性复合体I (major histocompatibility complex I, MHC I) 或MHC Ⅱ类分子结合。MHC Ⅰ类分子主要在胞质中结合内源性抗原肽, 并激活CD8+ T细胞介导的免疫应答; MHC Ⅱ类分子则在溶酶体中结合外源性抗原, 激活CD4+ T细胞介导的免疫应答[15]。由于激活肿瘤抗原特异性的细胞毒性T细胞是肿瘤免疫应答的关键, 因此增强肿瘤抗原经MHC Ⅰ类分子的交叉呈递是提高肿瘤免疫应答的重要手段。ROS可增强细胞内蛋白酶体的活性, 其通过诱导溶酶体破裂促进抗原在胞质中释放, 从而促进抗原肽与MHC Ⅰ类分子的结合[16-18]。ROS对于抗原提呈的调控还与细胞的状态、基础ROS水平密切相关。研究表明[19], 老年鼠的树突状细胞中ROS水平上调, 应用ROS清除剂可显著改善衰老DC的抗原交叉提呈能力, 研究者推测, 过量的ROS可能破坏参与交叉提呈途径的相关分子, 从而降低DC交叉提呈的能力。
2.3 ROS与T细胞T细胞受体(T cell receptor, TCR) 识别APC表面的抗原肽-MHC分子复合物, 并在共刺激分子的作用下活化为效应T细胞, T细胞尤其是CD8+ T细胞是介导抗肿瘤免疫的主要效应细胞。与其他细胞类似, 低水平的ROS对于T细胞的正常激活、增殖和分化是必要的; 而高水平的ROS被认为是抑制T细胞激活和增殖的主要因素之一。ROS可激活哺乳动物雷帕霉素靶蛋白和腺苷酸激活蛋白激酶, 引起下游的过氧化物酶体增殖物激活受体-γ辅助活化因子1α及其辅助因子的级联激活, 最终引起相关转录因子激活、脂肪酸氧化、氧化磷酸化以及线粒体扩张, 促进CD8+ T细胞的激活和分化[20]。ROS可改变激酶的氧化还原状态, 激活活化T细胞核因子、诱导白细胞介素-2 (interleukin-2, IL-2) 的产生, 从而支持T细胞增殖[21]。T细胞的活性与其表面巯基数量具有相关性, 活化T细胞相对于未活化型, 其表面游离硫醇水平、还原电位升高[22], 因此胞外的ROS可能通过改变T细胞表面还原电位影响其活性。文献研究表明CD8+ T细胞在体外经H2O2处理后, 其增殖可被明显抑制且抑制程度呈H2O2浓度依赖性; 在ROS清除后细胞的增殖水平恢复且γ-干扰素的分泌显著增加[23]。在肿瘤微环境中, 肿瘤细胞、肿瘤相关巨噬细胞(tumor associated macrophages, TAMs)、髓源性抑制细胞(myeloid-derived suppressor cells, MDSCs)、调节性T细胞(regulatory T cells, Tregs) 等可产生过量的ROS, 引起T细胞的功能衰竭, 并通过凋亡相关因子配体途径增加T细胞的凋亡, 从而导致肿瘤免疫治疗的抵抗。
2.4 ROS与免疫抑制微环境 2.4.1 ROS与肿瘤相关巨噬细胞免疫抑制微环境是导致肿瘤免疫治疗效果不佳的另一重要因素。TAMs是微环境中含量较高的免疫抑制性细胞, 主要分为具有抗肿瘤作用的M1型和促肿瘤作用的M2型。在缺氧酸性的条件下以及多种细胞因子、细胞外基质成分的影响下, TAMs主要为M2亚型。将M2型TAM复极化为M1巨噬细胞可发挥其潜在的免疫激活作用, 重塑免疫微环境[24-29]。ROS可氧化蛋白质半胱氨酸残基促进丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK) 和核因子κB (nuclear factor kappa-B, NF-κB) 下游通路, 促进巨噬细胞促炎基因的表达[30]; ROS也可降低信号传导及转录激活蛋白3 (signal transduction and activator of transcription 3, STAT3) 的表达, 介导TAMs复极化[31]。在更深入的研究中, Yang等[32]通过合成不同ROS产生机制的光敏剂, 探讨ROS种类对巨噬细胞复极化的影响。结果表明, Ⅰ期机制产生自由基的光敏剂tTDCR NPs可通过激活NF-κB信号通路, 将M0和M2巨噬细胞重编程为M1表型, 而Ⅱ型机制产生单线态氧的光敏剂玫瑰红对巨噬细胞的表型无明显影响。此外, 胞外ROS对细胞的复极化作用较胞内ROS更强。但在ROS调节巨噬细胞表型的相关研究中, 也有结果表明ROS可以促进IL-4诱导的M2巨噬细胞极化。Roux等[33]用谷胱甘肽合成抑制剂、丁硫氨酸亚砜、紫杉醇诱导ROS, 丁硫氨酸亚砜刺激可促进巨噬细胞分泌IL-10、IL-17、IL-4, 并表达低水平的IL-12等, 表明巨噬细胞的抗原呈递功能和共刺激能力减弱, 该研究还表明ROS可通过激活NF-κB途径增加骨髓来源的巨噬细胞(bone marrow derived macrophages, BMDMs) 的程序性死亡配体1 (programmed death-ligand 1, PD-L1) 的表达。
ROS的靶蛋白众多, 其调控作用可能涉及多种信号通路, 而且ROS的胞内外定位、亚细胞定位, ROS的种类, 诱导ROS的方法等因素对于TAM的表型功能的调节有不同的倾向性。巨噬细胞的表型受干扰素调节因子5、STAT1、NF-κB等多种信号途径的调控[34, 35]; 且在肿瘤微环境中影响TAM表型的因素众多[36], TAM本身的ROS水平、氧化还原状态都可能使其表型的变化远比简单的M1与M2分类要复杂。因此, ROS对于TAM的调控机制以及在基于TAM的肿瘤免疫调节中的应用还需更加系统深入的研究。
2.4.2 ROS与其他免疫细胞除TAM外, 肿瘤微环境中的免疫抑制细胞还包括MDSCs、Tregs等。MDSCs是巨噬细胞、DC和粒细胞的前体细胞, 正常生理条件下能分化为相应的成熟细胞在体内发挥正常免疫功能, 而肿瘤微环境细胞因子可使其分化受阻从而停留在成熟前的各个阶段, 并通过产生ROS、分泌抑制性的细胞因子等发挥免疫抑制作用。有研究结果表明MDSCs内源性H2O2水平的增加可能是阻止其向抗原提呈细胞的分化的原因, 以过氧化氢酶清除H2O2后, 粒细胞-巨噬细胞集落刺激因子诱导的未成熟骨髓细胞向巨噬细胞分化的比例显著提高[37]。另外, Tregs具有较高的线粒体活性和ROS水平, 且其核因子E2相关性因子2相关的抗氧化系统较弱, 所以易受肿瘤微环境中氧化应激的影响而引发细胞凋亡, 凋亡的Tregs可释放大量的ATP, 并在局部环境中通过核酸酶CD39和CD73转化为腺苷, 从而发挥免疫抑制作用, 介导肿瘤免疫逃逸[38]。
3 基于ROS的肿瘤免疫调控 3.1 ROS诱导ICD线粒体是细胞内源性产生ROS的重要场所, 因此通过直接靶向或间接作用诱导线粒体功能障碍可达到增加ROS的目的。如Jeong等[39]将全氟烷基链引入螺旋多肽的侧链, 开发得到了一种氟化的线粒体破坏螺旋多肽, CT26细胞内吞后引起线粒体膜电位损失。线粒体外膜失稳导致的功能障碍使胞内的ROS水平显著增加、谷胱甘肽(glutathione, GSH) 水平降低, 由此引发内质网应激相关标记葡萄糖调节蛋白78和CCAAT/增强子结合蛋白同源蛋白的表达增加, 最终导致ATP、HMGB1的释放以及CRT的暴露, 诱导癌细胞的免疫原性死亡。Wang等[40]合成了可选择性定位在内质网中的铱复合物, 其引起的内质网应激促进Ca2+的释放, 进一步引起线粒体功能障碍, 产生过量ROS并引起细胞凋亡, 释放DAMP最终激活细胞毒性T淋巴细胞和下调Tregs。
由于CRT存在于内质网中, 很多研究者通过内质网靶向肽[41]、内质网靶向光敏剂[42]等增强光动力诱导的ICD效应, 可解决因ROS半衰期短、细胞内扩散深度有限而引起的内质网氧化应激受限的问题。除此之外, 通过声动力疗法、芬顿反应和铁死亡等[43, 44]途径也可引起基于ROS的ICD。Yang等[45]通过三价铁和二硫代二乙酸配位作用合成金属有机框架, 共载葡萄糖氧化酶(glucose oxidase, GOD) 和DOX, 并包裹一层肿瘤细胞膜实现肿瘤同源靶向, 该制剂中的二硫键可消耗GSH, GOD催化葡萄糖释放H2O2以增强芬顿反应, 共同引起ROS水平增加, 并且与DOX联合诱导ICD激活抗肿瘤免疫应答。
同时, ROS对于ICD的影响也是多方面的, 肿瘤微环境中高水平的ROS也可能是削弱免疫应答、介导肿瘤免疫逃逸的一种途径。Deng等[23]的一项研究指出, 欧夹竹桃甙(oleandrin, OLE) 可以诱导肿瘤细胞释放HMGB1、CRT等诱导DC的成熟, 而肿瘤微环境中的ROS可氧化HMGB1, 削弱其ICD的诱导作用。该研究通过聚醚酰亚胺-聚硫化丙烯自组装包载药物, 修饰胶原靶向肽将制剂靶向至肿瘤微环境中, 其硫醚结构消耗ROS的同时向亚砜转变, 亲水性增强, 纳米粒解体释放药物。游离的OLE组在过氧化氢预处理后, 其诱导DC细胞成熟的能力被削弱, 而目标制剂组的ROS清除作用可恢复OLE诱导的ICD。
3.2 ROS增强抗原提呈Wang等[46]利用卵清蛋白抗原(ovalbumin antigen, OVA) 分子间形成二硫键进行自组装作为光敏剂二氢卟吩(chlorin e6, Ce6) 的载体, 并通过包覆肿瘤细胞膜实现同源靶向。体外实验利用抗原肽SIINFEKL的抗体结合髓源性树突状细胞表面抗原肽-MHC分子复合物定量检测细胞的抗原提呈能力。Ce6和OVA的分子混合物仅具有1.19%的抗原提呈效率, 而制剂组经照射后提高为7.2%; 体内药效实验表明在激光照射下该制剂可完全消除肿瘤, 并激发长期的抗肿瘤免疫记忆效应。Zhou等[47]制备了分别负载2, 2ʹ-偶氮-双(3-乙基苯并噻唑啉-6-磺酸) 和辣根过氧化物酶(ABTS & HRP) 体系以及马来酰亚胺的两种脂质体。马来酰亚胺消耗肿瘤细胞内的GSH, 促进H2O2生成, 在HRP催化下激活ABTS, 用于光声成像、光热治疗并激活ICD诱导的免疫应答; 此外, 制剂组通过增加DC细胞内的ROS水平, 促进MHC Ⅰ类分子及CD80/86的表达, 促进DC的成熟和抗原提呈能力, 从而增加CD8+ T细胞的浸润, 有效抑制远端肿瘤和转移。
3.3 ROS调控免疫抑制微环境针对TAM的免疫微环境调控策略主要包括耗竭TAM、抑制募集和TAM的复极化。TAM的复极化策略因其可利用巨噬细胞潜在的抗原提呈和免疫激活作用而受到越来越多的关注, 而ROS可作为第二信使激活巨噬细胞表型相关的信号通路。Shi等[30]制备了两种负载光敏剂的聚乳酸-羟基乙酸共聚物纳米粒, 通过甘露糖修饰靶向M2巨噬细胞, 并分别定位于溶酶体和胞质, 激光照射下产生的单线态氧在溶酶体中可抑制半胱氨酸蛋白酶和质子泵的活性, 避免抗原肽被过度水解成非常短的肽或氨基酸, 促进抗原肽与MHC Ⅱ类分子的结合; 而胞质活性氧可以增强蛋白酶体的活性, 刺激自噬, 从而促进可溶性抗原的交叉呈递。在M2型的RAW264.7巨噬细胞及BMDMs模型中, 激光照射后产生的ROS可直接激活MAPK和NF-κB相关信号通路, 介导巨噬细胞表型向M1型转化, 制剂组诱导型一氧化氮合成酶水平升高, CD206表达水平降低。另外, 该研究还发现, 定位于溶酶体的ROS生成剂激活的CD4+ T细胞的比例高于定位在胞质的制剂组, 而后者的CD8+ T细胞的比例相对更高, 这也提示诱导ROS的不同亚细胞定位可能影响免疫应答的效果。Shao等[48]利用介孔氧化铁纳米粒IONP作为载体, 共载青蒿素和GOD, GOD催化葡萄糖氧化生成过氧化氢并用于铁催化的芬顿反应, 亚铁离子还原青蒿素中的过氧桥, 进一步促进ROS的产生, ROS在诱导肿瘤细胞免疫原性死亡的同时, 可介导TAM由M2型向M1型的转换, 重塑免疫抑制微环境并抑制肿瘤的进展和转移。
3.4 ROS增强过继免疫疗法高水平的ROS可降低T细胞中TCR/CD3ζ的表达, 从而抑制TCR介导的效应功能, 这也是导致嵌合抗原受体T细胞(chimeric antigen receptor T cell, CAR-T) 免疫疗法治疗效果不佳的原因之一。Ligtenberg等[49]通过将过氧化氢酶与肿瘤特异性嵌合抗原受体共同转染于T细胞中实现共表达, 得到可以抵御ROS的CAR-CAT, 与不表达过氧化氢酶的CAR-T相比, 其在H2O2条件下仍可以保持较强的靶细胞清除作用。
3.5 ROS激活固有免疫通路环鸟苷酸腺苷酸合成酶/干扰素基因刺激因子(cyclic GMP-AMP synthase/stimulator of interferon gene, cGAS/STING) 信号通路是固有免疫的重要组成部分, 该信号途径的激活作为增强肿瘤免疫的策略被广泛研究和应用。cGAS识别细胞质内的外源性或内源性受损的线粒体DNA等, 催化产生第二信使环鸟苷酸-腺苷酸, 结合和激活STING蛋白, 招募丝氨酸苏氨酸蛋白激酶, 激活干扰素调节因子3, 最终导致Ⅰ期干扰素和免疫因子的产生。Cen等[50]通过自组装合成了ZnS@BSA纳米粒, 在酸性肿瘤微环境中, 释放的硫离子与胞内质子结合形成硫化氢, 特异性抑制肝癌细胞过氧化氢酶的活性, 使肿瘤细胞中ROS的水平增加, ROS的积累可导致线粒体损伤和线粒体DNA的释放, 从而激活cGAS/STING信号通路, 释放的锌离子可进一步促进ROS的产生以及cGAS的催化活性。该实验结果表明, ZnS@BSA纳米粒可激活荷瘤小鼠体内的cGAS/STING通路, 促进肿瘤部位CD8+ T细胞的浸润, 显著抑制肿瘤的生长。
4 总结与展望在肿瘤免疫治疗中, ROS与先天性和适应性免疫应答密切联系, 其可诱导肿瘤细胞的免疫原性死亡, 调节DC的抗原提呈能力, 影响T细胞的增殖分化和免疫应答能力, 以及调控其他免疫细胞如TAMs的表型和功能。综合近期研究, ROS在肿瘤免疫中的研究和应用还需要考虑以下几方面: ① ROS的胞内胞外定位及亚细胞定位对于免疫细胞功能和免疫应答影响的差异性; ② ROS的种类对于肿瘤细胞免疫原性死亡诱导的差异性; ③如何平衡ROS促生成和ROS清除对免疫应答的正向调控作用, 以及如何调控ROS的水平以达到最大化的肿瘤免疫促进作用; ④通过靶向策略针对微环境或某种细胞或细胞器提高基于ROS的调控作用; ⑤对于处于不同免疫状态(冷肿瘤/热肿瘤) 的肿瘤类型或肿瘤发展的不同阶段, ROS对肿瘤免疫治疗调节的有效性和差异性。这些问题可能决定着研究者制剂的设计、评价方法的建立以及影响最终的治疗结果。
作者贡献: 卜凡雪负责文献、资料的收集整理及全文的撰写工作; 郑宇钊参与文章的撰写及修改; 周建平和殷婷婕为通讯作者, 负责综述内容把关和稿件修改等工作。
利益冲突: 所有作者均声明无任何利益冲突。
| [1] |
Galon J, Bruni D. Tumor immunology and tumor evolution: intertwined histories[J]. Immunity, 2020, 52: 55-81. DOI:10.1016/j.immuni.2019.12.018 |
| [2] |
Robert C. A decade of immune-checkpoint inhibitors in cancer therapy[J]. Nat Commun, 2020, 11: 3801. DOI:10.1038/s41467-020-17670-y |
| [3] |
Augustin RC, Delgoffe GM, Najjar YG. Characteristics of the tumor microenvironment that influence immune cell functions: hypoxia, oxidative stress, metabolic alterations[J]. Cancers (Basel), 2020, 12: 3802. DOI:10.3390/cancers12123802 |
| [4] |
Kotsafti A, Scarpa M, Castagliuolo I, et al. Reactive oxygen species and antitumor immunity-from surveillance to evasion[J]. Cancers (Basel), 2020, 12: 1748. DOI:10.3390/cancers12071748 |
| [5] |
Mou Y, Wen S, Gao XX, et al. Advances in anti-tumor drug research based on reactive oxygen regulation[J]. Acta Pharm Sin (药学学报), 2020, 55: 1453-1465. |
| [6] |
Zhou Z, Ni K, Deng H, et al. Dancing with reactive oxygen species generation and elimination in nanotheranostics for disease treatment[J]. Adv Drug Delivery Rev, 2020, 158: 73-90. DOI:10.1016/j.addr.2020.06.006 |
| [7] |
Huang MZ, Li JY. Physiological regulation of reactive oxygen species in organisms based on their physicochemical properties[J]. Acta Physiol, 2020, 228: e13351. |
| [8] |
Yang B, Chen Y, Shi J. Reactive oxygen species (ROS)-based nanomedicine[J]. Chem Rev, 2019, 119: 4881-4985. DOI:10.1021/acs.chemrev.8b00626 |
| [9] |
Su LJ, Zhang JH, Gomez H, et al. Reactive oxygen species-induced lipid peroxidation in apoptosis, autophagy, and ferroptosis[J]. Oxid Med Cell Longev, 2019, 2019: 5080843. |
| [10] |
Sarmiento-Salinas FL, Perez-Gonzalez A, Acosta-Casique A, et al. Reactive oxygen species: role in carcinogenesis, cancer cell signaling and tumor progression[J]. Life Sci, 2021, 284: 119942. DOI:10.1016/j.lfs.2021.119942 |
| [11] |
Phuengkham H, Ren L, Shin IW, et al. Nanoengineered immune niches for reprogramming the immunosuppressive tumor microenvironment and enhancing cancer immunotherapy[J]. Adv Mater, 2019, 31: e1803322. DOI:10.1002/adma.201803322 |
| [12] |
Vandenabeele P, Vandecasteele K, Bachert C, et al. Immunogenic apoptotic cell death and anticancer immunity[J]. Adv Exp Med Biol, 2016, 930: 133-149. |
| [13] |
Guo J, Yu Z, Sun D, et al. Two nanoformulations induce reactive oxygen species and immunogenetic cell death for synergistic chemo-immunotherapy eradicating colorectal cancer and hepatocellular carcinoma[J]. Mol Cancer, 2021, 20: 10. DOI:10.1186/s12943-020-01297-0 |
| [14] |
Krysko DV, Garg AD, Kaczmarek A, et al. Immunogenic cell death and DAMPs in cancer therapy[J]. Nat Rev Cancer, 2012, 12: 860-875. DOI:10.1038/nrc3380 |
| [15] |
Ho NI, Camps MG, Garcia-Vallejo JJ, et al. Distinct antigen uptake receptors route to the same storage compartments for cross-presentation in dendritic cells[J]. Immunology, 2021, 164: 494-506. DOI:10.1111/imm.13382 |
| [16] |
Wang C, Li P, Liu L, et al. Self-adjuvanted nanovaccine for cancer immunotherapy: role of lysosomal rupture-induced ROS in MHC class I antigen presentation[J]. Biomaterials, 2016, 79: 88-100. DOI:10.1016/j.biomaterials.2015.11.040 |
| [17] |
Battisti F, Napoletano C, Rahimi Koshkaki H, et al. Tumor-derived microvesicles modulate antigen cross-processing via reactive oxygen species-mediated alkalinization of phagosomal compartment in dendritic cells[J]. Front Immunol, 2017, 8: 1179. DOI:10.3389/fimmu.2017.01179 |
| [18] |
Mao D, Hu F, Yi Z, et al. AIEgen-coupled upconversion nanoparticles eradicate solid tumors through dual-mode ROS activation[J]. Sci Adv, 2020, 6: eabb2712. DOI:10.1126/sciadv.abb2712 |
| [19] |
Chougnet CA, Thacker RI, Shehata HM, et al. Loss of phagocytic and antigen cross-presenting capacity in aging dendritic cells is associated with mitochondrial dysfunction[J]. J Immunol, 2015, 195: 2624-2632. DOI:10.4049/jimmunol.1501006 |
| [20] |
Chamoto K, Chowdhury PS, Kumar A, et al. Mitochondrial activation chemicals synergize with surface receptor PD-1 blockade for T cell-dependent antitumor activity[J]. Proc Natl Acad Sci U S A, 2017, 114: E761-E770. |
| [21] |
Sena LA, Li S, Jairaman A, et al. Mitochondria are required for antigen-specific T cell activation through reactive oxygen species signaling[J]. Immunity, 2013, 38: 225-236. DOI:10.1016/j.immuni.2012.10.020 |
| [22] |
Tang L, Zheng Y, Melo MB, et al. Enhancing T cell therapy through TCR-signaling-responsive nanoparticle drug delivery[J]. Nat Biotechnol, 2018, 36: 707-716. DOI:10.1038/nbt.4181 |
| [23] |
Deng H, Yang W, Zhou Z, et al. Targeted scavenging of extracellular ROS relieves suppressive immunogenic cell death[J]. Nat Commun, 2020, 11: 4951. DOI:10.1038/s41467-020-18745-6 |
| [24] |
Feng YX, Mu RY, Wang ZZ, et al. A toll-like receptor agonist mimicking microbial signal to generate tumor-suppressive macrophages[J]. Nat Commun, 2019, 10: 2272. DOI:10.1038/s41467-019-10354-2 |
| [25] |
Rong L, Zhang Y, Li WS, et al. Iron chelated melanin-like nanoparticles for tumor-associated macrophage repolarization and cancer therapy[J]. Biomaterials, 2019, 225: 119515. DOI:10.1016/j.biomaterials.2019.119515 |
| [26] |
Chen Q, Wang C, Zhang X, et al. In situ sprayed bioresponsive immunotherapeutic gel for post-surgical cancer treatment[J]. Nat Nanotechnol, 2019, 14: 89-97. DOI:10.1038/s41565-018-0319-4 |
| [27] |
Xie R, Ruan S, Liu J, et al. Furin-instructed aggregated gold nanoparticles for re-educating tumor associated macrophages and overcoming breast cancer chemoresistance[J]. Biomaterials, 2021, 275: 120891. DOI:10.1016/j.biomaterials.2021.120891 |
| [28] |
Rodell CB, Arlauckas SP, Cuccarese MF, et al. TLR7/8-agonist-loaded nanoparticles promote the polarization of tumour-associated macrophages to enhance cancer immunotherapy[J]. Nat Biomed Eng, 2018, 2: 578-588. DOI:10.1038/s41551-018-0236-8 |
| [29] |
Wei Z, Zhang X, Yong T, et al. Boosting anti-PD-1 therapy with metformin-loaded macrophage-derived microparticles[J]. Nat Commun, 2021, 12: 440. DOI:10.1038/s41467-020-20723-x |
| [30] |
Shi C, Liu T, Guo Z, et al. Reprogramming tumor-associated macrophages by nanoparticle-based reactive oxygen species photogeneration[J]. Nano Lett, 2018, 18: 7330-7342. DOI:10.1021/acs.nanolett.8b03568 |
| [31] |
Liu L, He H, Liang R, et al. ROS-inducing micelles sensitize tumor-associated macrophages to TLR3 stimulation for potent immunotherapy[J]. Biomacromolecules, 2018, 19: 2146-2155. DOI:10.1021/acs.biomac.8b00239 |
| [32] |
Yang G, Ni JS, Li Y, et al. Acceptor engineering for optimized ROS generation facilitates reprogramming macrophages to M1 phenotype in photodynamic immunotherapy[J]. Angew Chem Int Ed Engl, 2021, 60: 5386-5393. DOI:10.1002/anie.202013228 |
| [33] |
Roux C, Jafari SM, Shinde R, et al. Reactive oxygen species modulate macrophage immunosuppressive phenotype through the up-regulation of PD-L1[J]. Proc Natl Acad Sci U S A, 2019, 116: 4326-4335. DOI:10.1073/pnas.1819473116 |
| [34] |
Murray PJ. Macrophage polarization[J]. Annu Rev Physiol, 2017, 79: 541-566. DOI:10.1146/annurev-physiol-022516-034339 |
| [35] |
Yunna C, Mengru H, Lei W, et al. Macrophage M1/M2 polarization[J]. Eur J Pharmacol, 2020, 877: 173090. DOI:10.1016/j.ejphar.2020.173090 |
| [36] |
DeNardo DG, Ruffell B. Macrophages as regulators of tumour immunity and immunotherapy[J]. Nat Rev Immunol, 2019, 19: 369-382. DOI:10.1038/s41577-019-0127-6 |
| [37] |
Liang W, He X, Bi J, et al. Role of reactive oxygen species in tumors based on the 'seed and soil' theory: a complex interaction[J]. Oncol Rep, 2021, 46: 208. DOI:10.3892/or.2021.8159 |
| [38] |
Maj T, Wang W, Crespo J, et al. Oxidative stress controls regula-tory T cell apoptosis and suppressor activity and PD-L1-blockade resistance in tumor[J]. Nat Immunol, 2017, 18: 1332-1341. DOI:10.1038/ni.3868 |
| [39] |
Jeong SD, Jung BK, Ahn HM, et al. Immunogenic cell death inducing fluorinated mitochondria-disrupting helical polypeptide synergizes with PD-L1 immune checkpoint blockade[J]. Adv Sci, 2021, 8: 2001308. DOI:10.1002/advs.202001308 |
| [40] |
Wang L, Guan R, Xie L, et al. An ER-targeting iridium (Ⅲ) complex that induces immunogenic cell death in non-small-cell lung cancer[J]. Angew Chem Int Ed Engl, 2021, 60: 4657-4665. DOI:10.1002/anie.202013987 |
| [41] |
Li W, Yang J, Luo L, et al. Targeting photodynamic and photothermal therapy to the endoplasmic reticulum enhances immunogenic cancer cell death[J]. Nat Commun, 2019, 10: 3349. DOI:10.1038/s41467-019-11269-8 |
| [42] |
Deng H, Zhou Z, Yang W, et al. Endoplasmic reticulum targeting to amplify immunogenic cell death for cancer immunotherapy[J]. Nano Lett, 2020, 20: 1928-1933. DOI:10.1021/acs.nanolett.9b05210 |
| [43] |
Ji C, Si J, Xu Y, et al. Mitochondria-targeted and ultrasound-responsive nanoparticles for oxygen and nitric oxide codelivery to reverse immunosuppression and enhance sonodynamic therapy for immune activation[J]. Theranostics, 2021, 1: 8587-8604. |
| [44] |
Tan X, Huang J, Wang Y, et al. Transformable nanosensitizer with tumor microenvironment-activated sonodynamic process and calcium release for enhanced cancer immunotherapy[J]. Angew Chem Int Ed Engl, 2021, 60: 14051-14059. DOI:10.1002/anie.202102703 |
| [45] |
Yang J, Ma S, Xu R, et al. Smart biomimetic metal organic frameworks based on ROS-ferroptosis-glycolysis regulation for enhanced tumor chemo-immunotherapy[J]. J Control Release, 2021, 334: 21-33. DOI:10.1016/j.jconrel.2021.04.013 |
| [46] |
Wang H, Wang K, He L, et al. Engineering antigen as photo-sensitiser nanocarrier to facilitate ROS triggered immune cascade for photodynamic immunotherapy[J]. Biomaterials, 2020, 244: 119964. DOI:10.1016/j.biomaterials.2020.119964 |
| [47] |
Zhou Z, Wu H, Yang R, et al. GSH depletion liposome adjuvant for augmenting the photothermal immunotherapy of breast cancer[J]. Sci Adv, 2020, 6: eabc4373. DOI:10.1126/sciadv.abc4373 |
| [48] |
Shao Y, Wang Z, Hao Y, et al. Cascade catalytic nanoplatform based on "butterfly effect" for enhanced immunotherapy[J]. Adv Healthc Mater, 2021, 10: e2002171. DOI:10.1002/adhm.202002171 |
| [49] |
Ligtenberg MA, Mougiakakos D, Mukhopadhyay M, et al. Coexpressed catalase protects chimeric antigen receptor-redirected T cells as well as bystander cells from oxidative stress-induced loss of antitumor activity[J]. J Immunol, 2016, 196: 759-766. DOI:10.4049/jimmunol.1401710 |
| [50] |
Cen D, Ge Q, Xie C, et al. ZnS@BSA nanoclusters potentiate efficacy of cancer immunotherapy[J]. Adv Mater, 2021. DOI:10.1002/adma.202104037 |
 2022, Vol. 57
2022, Vol. 57


