2. 高原医学教育部重点实验室、青海省高原医学应用基础重点实验室 (青海-犹他高原医学联合重点实验室), 青海 西宁 810001;
3. 青海省人民医院, 青海 西宁 810007
2. Key Laboratory of High Altitude Medicine(Ministry of Education), Key Laboratory of Application and Foundation for High Altitude Medicine Research in Qinghai Province(Qinghai-Utah Joint Research Key Lab for High Altitude Medicine), Xining 810001, China;
3. Qinghai Provincial People's Hospital, Xining 810007, China
肺动脉高压(pulmonary hypertension, PH) 是一种威胁生命的疾病, 其特征是进行性肺血管阻力增加和闭塞性血管重构, 从而导致右心肥大、衰竭和过早死亡[1]。组织病理学特征包括内膜和中膜增厚、远端肺动脉肌化、血管闭塞和复杂的丛状病变[2]。其诊断标准为: 海平面、静息状态下、经右心导管测定的肺动脉平均压(mean pulmonary artery pressure, mPAP) ≥ 25 mmHg[3]。根据WHO标准, 肺动脉高压分为5类: 动脉性PH、左心疾病导致的PH、肺病和/或低氧导致的PH、慢性血栓栓塞性PH和其他肺动脉阻塞病变所致的PH、未明和(或) 多因素所致的PH[4]。尽管不同类PH的病因不同, 但都表现出相似的病理变化。目前认为, 肺动脉高压发生机制是遗传基因突变(骨形成蛋白Ⅱ型受体、活化素受体样激酶1、内皮糖蛋白、SMAD蛋白9、SMAD蛋白1、细胞质膜微囊蛋白-1、钾离子通道3、T-box gene 4、真核翻译起始因子2α激酶3、生长分化因子2、ATP酶13A3、水通道蛋白1、Y染色体性别决定区相关高迁移率17群)、表观遗传因素(DNA甲基化、组蛋白乙酰化、微小RNA等) 以及环境因素(低氧、机械剪切力、炎症、药物或毒物等) 共同作用的结果[5-8]。此外, 血管活性分子(内皮素、一氧化氮、血管紧张素Ⅱ、前列环素、雌激素等)、钾钙离子通道、Ras同源基因/Rho相关螺旋卷曲蛋白激酶、磷脂酰肌醇3激酶/蛋白激酶B、核因子-κB、骨形成蛋白/转化生长因子-β1、蛋白激酶C/丝裂原活化蛋白激酶、肾素血管紧张素醛固酮系统、血小板衍生生长因子、过氧化物酶体增殖物激活受体、Janus激酶/信号转导子和转录激活子、哺乳动物雷帕霉素靶蛋白和Notch等信号通路以及精氨酸酶(arginase, Arg)、一氧化氮合酶(nitric oxide synthase, NOS)、细胞周期蛋白(cyclin)、周期蛋白依赖性激酶(cyclin-dependent kinases, CDK)、叉头框转录因子M1 (forkhead box M1, FoxM1)、肿瘤坏死因子-α (tumor necrosis factor-α, TNF-α)、白介素(interleukin, IL)-6、血管内皮生长因子(vascular endothelial growth factor, VEGF)、骨形成蛋白Ⅱ型受体(bone morphogenetic protein type Ⅱ receptor, BMPR2) 等靶蛋白在PH形成过程中也发挥着重要作用[9-21]。
目前, 临床上治疗PH的药物主要包括前列环素类似物和前列环素受体激动剂、内皮素受体拮抗剂、磷酸二酯酶-5抑制剂和可溶性鸟苷酸环化酶抑制剂, 这些药物只能够抑制血管收缩或促进血管扩张, 对血管进行调控, 无法根治PH[22]。虽然干细胞治疗能够修复或替换受损肺血管结构, 改善心肺功能, 但目前还停留在动物实验研究阶段, 仍有很多问题需要解决[23]。加之PH发病机制复杂、病程隐匿等多种原因, 常在就诊时, 患者对药物已不再敏感, 各主要脏器结构也已发生不可逆的改变, 故PH的死亡率仍居高不下。现有研究表明, 低氧诱导因子(hypoxia inducible factor, HIF)-2α在PH的发生发展中起重要作用, 现做一综述, 以更好了解PH的发病机制, 寻找有价值的药物靶点和有效治疗方法。
1 HIF-2α的结构和功能HIF-2α于1997年被发现和克隆[24], 由α和β亚基组成。HIF-1β又称芳香烃受体核转运蛋白(aryl hydrocarbon receptor nuclear translocator, ARNT), 为结构性表达蛋白, HIF-2α为氧调节性蛋白, 由870个氨基酸组成, 分子量为118 kD, N-端包含螺旋-环-螺旋结构域(basic-helix-loop-helix domain, bHLH) 和PAS (Per-ARNT-Sim) 结构域, 后者又含有PAS-A和PAS-B两个亚结构域, 这有助于α和β异质二聚体的稳定性。HIF-2α的活性在翻译后受氧、脯氨酸羟化酶(prolyl hydroxylase, PHD) 和泛素蛋白酶体的协同调节。常氧时, HIF-2α的氧依赖性降解结构域(oxygen-dependent degradation domain, ODDD) 中的特定位点Pro405和Pro531可与PHD结合而发生羟基化, 羟基化的ODDD与肿瘤抑制蛋白(von Hippel-Lindau, pVHL) 亲和力增加, 使HIF-2α泛素化并通过泛素蛋白酶体途径降解[25, 26]。除PHD外, 天冬酰羟化酶又称为HIF-1α抑制因子(factor-inhibiting HIF-1α, FIH-1), 也可调节HIF-2α, 可使HIF-2α的天冬酰胺残基羟化后被降解[27]。在低氧条件下, PHD和FIH失去活性, 阻断pVHL与ODDD的结合, 从而阻断泛素-蛋白溶解酶体通路, 使HIF-2α转位至核内, 与HIF-1β形成异源二聚体, 结合于目的基因的低氧反应元件(hypoxic reaction element, HRE) 区域, 促进目的基因转录[28]。此外, 磷酸化、去乙酰化等修饰也对HIF-2α的转录功能具有调控作用。
相比HIF-1α几乎在不同动物的所有细胞均有表达[29], HIF-2α的表达则具有组织特异性, 为内皮偏向性[30]。早期研究认为, 其mRNA几乎只在内皮细胞中表达, 因此又称为“内皮PAS蛋白-1 (endothelial PAS domain protein-1, EPAS-1)”。但Wiesener等[31]通过RNA酶保护法在RNA水平和蛋白质水平检测了一系列细胞类型的表达, 发现11种人体细胞系均能表达HIF-2α mRNA, 其中10种为非内皮细胞。HIF-2α mRNA的丰度在不同细胞系之间差异很大, 可相差近百倍。在常氧和低氧条件(1% O2, 4 h) 下培养后, 发现低氧对这些细胞中HIF-2α mRNA水平无明显影响, 但能显著诱导HIF-2α蛋白的表达, 提示低氧并不影响其转录过程, 但能影响其翻译过程。此外, HIF-2α还可影响HIF-1α的表达, 通过在细胞内瞬时转染显性突变体, 发现HIF-2α可阻止慢性低氧下HIF-1α mRNA和蛋白的表达, 提示在慢性低氧时HIF-2α可能参与了抑制HIF-1α表达的作用[32]。
作为同源异构体的HIF-1α和HIF-2α, 在结构和生化特性上有许多相似性, 两者的氨基酸有48%的一致性, 均在低氧下稳定, 并可通过激活HRE依赖的基因表达[33], 但这两个亚单位在N-末端激活结构域(N-terminal activation domains, NAD) 上存在差异[34], 这意味着它们可能有独特的靶基因。低氧条件下, HIF-1α和HIF-2α可以调节VEGF、内皮素-1 (endothelin-1, ET-1)、促红细胞生成素、NOS等基因的表达[35]。HIF-2α的1个等位基因缺失可导致相关基因显著下调, 包括纤溶酶原激活物抑制剂1 (plasminogen activator inhibitor-1, PAI-1)、ET-1、血小板衍生生长因子B链、CXC趋化因子配体12 (C-X-C motif chemokine ligand 12, CXCL12) 和抵抗素样α[36], 提示以上基因可能为HIF-2α的下游靶基因。此外, HIF-2α的靶基因还涉及炎症、铁代谢、糖代谢、胎肺成熟、精氨酸酶活性等多方面, 这些均与低氧性PH、肿瘤、慢性阻塞性肺疾病等有关[37]。
2 HIF-2α对PH细胞水平的影响PH是一种破坏性疾病, 其特征是由平滑肌细胞过度增殖、内皮细胞抗凋亡、成纤维细胞增殖迁移、巨噬细胞聚集、细胞外基质沉积和慢性炎症引起的肺血管重构[38-40], 故主要介绍HIF-2α对上述细胞的影响。
2.1 HIF-2α对肺动脉平滑肌细胞(pulmonary arterial smooth muscle cells, PASMCs) 的影响目前, 对于PH细胞水平的研究大多侧重于PASMCs, 其作为疾病发病机制中的主要细胞类型, 它的增殖导致肺血管重构, 进而发生PH。Ahmad等[41]用腺病毒转染PASMCs发现HIF-1α可以促进细胞增殖, 而HIF-2α没有这种作用。从特发性肺动脉高压(idiopathic pulmonary hypertension, IPAH) 患者和正常对照人群肺中分离出的PASMCs中HIF-2α蛋白表达也没有显著差异[42]。虽然HIF-2α对PASMCs没有直接促增殖作用, 但HIF-2α可以通过影响下游信号分子或内皮细胞旁分泌来影响PASMCs的增殖。研究发现, HIF-2α在低氧下可通过诱导下游信号分子FoxM1的表达促进人PASMCs的增殖[43], 还可以激活Oct-4基因的转录而导致PASMCs的过度增殖[44]。此外, 敲除PHD2基因可导致HIF-2α降解减少, HIF-2α的积聚可激活内皮细胞中CXCL12引起PASMCs增殖[45]。
2.2 HIF-2α对肺动脉内皮细胞(pulmonary artery endothelial cell, PAEC) 的影响虽然PASMCs在PH中具有重要地位, 但随着对PH病理机制研究的深入, 越来越多的实验数据表明, PAEC和PASMCs间的相互作用更有助于PH的发生发展。与健康供体相比, IPAH患者肺中HIF-2α mRNA和蛋白的表达显著增加, 免疫荧光染色提示HIF-2α主要分布在内皮细胞(endothelial cells, ECs) 中[42]。在常氧条件下, 由腺病毒介导的HIF-2α过度表达可明显促进人PAEC的增殖[41], 这可能与HIF-2α通过破坏线粒体和代谢稳态而诱导的内皮细胞炎症、增殖和抵抗凋亡有关[46]。此外, 血管内皮细胞中HIF-2α可通过调节结缔组织生长因子(connective tissue growth factor, CTGF) 的表达, 促进内皮细胞黏附和增殖, 并促进转化生长因子-β (transforming growth factor-β, TGF-β) 增加胶原蛋白表达从而加速肺纤维化相关PH的发展[47, 48]。
在体内, ECs会根据局部条件的变化表现出不同表型。在发生重构的肺血管腔内, 包含有间充质细胞和平滑肌细胞(smooth muscle cell, SMC), 而ECs的细胞标志物并不突出。这种现象称之为内皮向间充质转变(endothelial-to-mesenchymal transition, EndMT), 通过EndMT使得ECs获得间充质细胞和平滑肌细胞表型, 而失去ECs表型。同时, EndMT能够增强肺血管内皮细胞(lung vascular endothelial cells, LVEC) 的迁移能力, 并且可将缓慢增殖的LVEC转化为高度增殖的细胞类型, 从而导致闭塞性内膜病变的形成和发展。上述过程与LVEC中PHD2下调导致HIF-2α激活, 进而上调SNAI锌指转录因子家族成员Snai1/Snai2的表达有关(SNAI为EndMT的已知诱导剂)[49]。作为HIF-2α的重要调节因子, PHD2在LVEC中高表达, 而在全身血管ECs中低表达, PHD2缺乏可引起严重的PH, 但对体循环压力没有影响[45]。
外周血来源的过度生长内皮细胞(blood outgrowth endothelial cells, BOECs) 富含血管新生和细胞黏附所需的蛋白, 与内皮干细胞相比, 生物学特性更像内皮细胞, 同时它克服了成熟人脐血内皮细胞体外培养扩增量少、表型易改变的缺点, 已被广泛作为血管疾病体外内皮功能研究的模型[50]。当健康志愿者和PH患者暴露于低氧环境下, 均能够促进BOEC中HIF-2α靶基因(葡萄糖转运蛋白1、PAI-1、VEGF和精氨酸酶2) 的表达, 导致BOEC过度增殖以及分化、侵袭、迁移能力增强[51]。可见, HIF-2α对ECs的影响不仅体现在细胞表型上, 对基因水平也具有调节作用。
2.3 HIF-2α对肺动脉成纤维细胞的影响肺小动脉外膜成纤维细胞的增殖已被证实为低氧性PH和肺心病发展的早期表现。采用RNA干扰技术特异性抑制HIF-1α和HIF-2α, 发现外膜成纤维细胞的增殖反应仅依赖于HIF-2α, 而其迁移反应与HIF-1α和HIF-2α均有关[52]。此外, 肿瘤抑制蛋白VHL密码子200 (R200W) 突变可导致HIF-2α的积聚, 后者进一步促进细胞外基质沉积和肺成纤维细胞或肌成纤维细胞增殖, 最终发生肺纤维化。这种突变纯合子VHLR/R模型小鼠与野生型相比, 7~8月龄肺组织中纤维连接蛋白沉积增强且分布杂乱, 而野生型小鼠纤维连接蛋白主要局限于肺血管周围[36]。
2.4 HIF-2α对巨噬细胞的影响炎症在PH的发生发展中起着关键作用, 大多数免疫细胞, 如T细胞、树突状细胞、自然杀伤细胞、巨噬细胞、B细胞、肥大细胞和嗜酸性粒细胞都参与了PH的进展[53, 54]。其中, 单核细胞和巨噬细胞在血管周围募集是PH的一个显著特征, 可加剧炎症并促进与肺动脉平滑肌细胞和肺动脉内皮细胞的相互作用, 导致肺血管重塑[55, 56]。特别是, CD68+巨噬细胞与PH的进展密切相关[56]。HIF-2α的激活可导致急性低氧暴露SD大鼠肺组织中CD68+单核细胞聚集, 经HIF-2α抑制剂PT2567干预后可抑制聚集现象, 提示抑制HIF-2α活性对低氧性PH极早期启动具有遏制作用[57]。集落刺激因子-1 (colony stimulating factor-1, CSF-1) 和IL-6可以通过激活HIF-2α的转录, 诱导巨噬细胞选择性激活[58]。此外, 细胞因子如IL-6、IL-8、IL-10、IL-13、IL-18、IL-1β和TNF-α也参与了PH的发生发展, 其血浆的高水平表达提示PH患者预后不良[59]。在PH动物模型中, 敲除肺内皮细胞HIF-2α可降低血浆中IL-6、IL-8、IL-1β、TNF-α、CXCL12的水平[60]。PT2567干预也可降低血浆TNF-α浓度, 增加抗炎因子IL-10的水平[51]。髓系HIF-2α敲除的小鼠可使血浆IL-10增加或恢复至正常水平[61]。因巨噬细胞主要位于血管周围腔隙, 单纯靶向巨噬细胞治疗PH可行性差[62], 基于细胞因子和趋化因子的疫苗治疗可能是治疗PH的潜在靶点[53]。
3 HIF-2α对PH整体水平的影响 3.1 HIF-2α激活突变可诱导PH研究表明, HIF-1α+/-和HIF-2α+/-小鼠对慢性低氧均表现出右心室收缩压(right ventricular systolic pressure, RVSP) 和右心室肥厚的钝性反应, HIF-1α+/-小鼠肺动脉压降低, 而HIF-2α+/-小鼠由于没有响应慢性低氧而未发展为PH[63]。小鼠平滑肌细胞中HIF-1α基因缺失可减轻RVSP和肺动脉壁厚度, 但对右室重构没有影响[64], 而HIF-2α选择性抑制剂C76可逆转由Sugen5416/低氧和/或野百合碱(monocrotaline, MCT) 诱导的PH大鼠病理特征, 能够抑制血管重塑、心肌纤维化和右心衰竭(right heart failure, RHF), 提高PH大鼠的存活率[42]。此外, HIF-2α获得性功能突变与患者严重PH相关, HIF-2α激活突变(G536W) 基因敲入小鼠会发生严重的PH[65]。应用反义寡核苷酸(antisense oligonucleotides, ASOs) 敲低HIF-2α可减轻低氧诱导的小鼠血管肌化作用, 降低肺动脉压和右心室肥厚。在慢性低氧条件下, 肺内皮细胞HIF-2α缺失的小鼠中RVSP并不升高, 且与常氧野生型小鼠无显著差异, 显著低于低氧下野生型和肺内皮细胞缺失HIF-1α小鼠的RVSP值, 同时, 肺内皮细胞HIF-2α的缺失可显著抑制低氧所致的小鼠肺血管重塑[57]。但Skuli等[66]引入一种内皮细胞HIF-2α缺陷的小鼠模型, 发现尽管发育正常, 但这些小鼠内皮细胞超微结构异常, 可诱发PH, 这可能是因为缺失HIF-2α的ECs降低了细胞外基质蛋白、纤维连接蛋白、整合素、内皮素B受体(endothelin B receptor, ET-B) 的表达水平, 影响了内皮完整性, 导致血管通透性增加, 液体渗漏, 从而促进水肿、炎症和出血, 进而驱动肺动脉压力的升高。
HIF-2α还可通过影响下游靶基因导致PH。Cowburn等[60]发现, 从基因敲除HIF-2α小鼠分离的肺内皮细胞和整个肺组织中精氨酸酶-1 (arginase-1, Arg-1) 的表达均下调, 肺血管内皮细胞Arg-1的缺失同样减轻了许多与低氧性PH相关的病理生理症状, 表明HIF-2α可通过Arg-1依赖的机制影响肺血管阻力和PH的发展。HIF-2α还可上调SNAI锌指转录因子家族成员导致PH。IPAH患者和PH动物模型均表现出高水平的EndMT和HIF-2α蛋白表达, HIF-2α通过介导Snai1/Snai2上调, 导致肺血管壁增厚和血管闭塞[49]。
离体动物肺灌注/通气实验提示, 将肺血管内皮细胞中HIF-1α或HIF-2α敲低后对急性低氧诱导的肺血管收缩没有影响[49]。利用全身体积描记法测定响应低氧的每分通气量、潮气量、流量和肺活量, 在基因敲除HIF-1α和HIF-2α以及野生型三组中没有差异[60], 说明HIF-2α对急性低氧诱导的肺血管收缩无明显贡献。
3.2 HIF-2α对颈动脉体的影响颈动脉体(carotid body, CB) 在调节低氧心肺反应中具有重要作用。研究表明, HIF-2α对颈动脉体在慢性低氧反应中的发育和生长至关重要[67]。但通过对颈动脉分叉处细胞酪氨酸羟化酶(tyrosine hydroxylase, TH) 免疫染色发现, 野生型和基因敲除HIF-2α的动物中颈动脉体组织学结构均正常[60], 与常氧对照大鼠相比, Sugen/低氧3周大鼠颈动脉分支CB体积显著增加, 给予HIF-2α抑制剂PT2567干预后体积明显减小, 但与溶剂对照组和西地那非组并无明显差异, 说明HIF-2α对颈动脉体的影响并不起主要作用[51]。
3.3 继发性HIF-2α增多导致PH作为HIF-2α的重要调节因子PHD和pVHL的异常均可导致HIF-2α表达的改变。由于ECs和骨髓造血细胞(hematopoietic cells, HCs) PHD2基因缺失, 导致HIF-2α被继发激活, 小鼠出现严重的血管重塑包括血管阻塞和复杂丛状样病变、严重PH和RHF, 从而出现死亡, 同临床PH的病理学表现相类似。在此过程中, ECs中PHD2的缺失起着重要作用, 而骨髓造血细胞PHD2的缺失并不是PH发展的必要条件, 但可加剧病理表现和PH的严重性, 两者具有协同作用。在IPAH患者闭塞性肺血管内皮细胞中也证实了PHD2的表达明显减少[45]。VHL功能获得突变的人和小鼠均发生PH, R200W VHL突变纯合子VHLR/R小鼠的肺出现肺血管重构、出血、水肿和巨噬细胞浸润现象, 老龄小鼠的肺表现出纤维化。HIF-2α活性在VHLR/R小鼠肺中上调, HIF-2α敲低后可以逆转VHLR/R小鼠的红细胞增多、肺动脉高压和右心室肥大, 并可以降低ET-1的表达, 使非肌化血管数量增加到接近正常野生型水平, 逆转血管的重构, 减缓出血和水肿表型[36]。
3.4 HIF-2α对种群水平的影响在种群水平, 居住在海拔4 700米的藏族人中HIF-2α-rs6756667-A或rs1868092-A占70%以上, 且随着海拔增高, AA携带者增多[68]。应用高通量全基因组芯片技术从世居海拔4 350米地区藏族人群中筛选出10个特有正选基因, 进一步对全基因组外显子进行测序发现, HIF-2α基因在高原低氧环境下进化速率最快, 与世居人群低血红蛋白相关[69], 并通过下游靶基因调节能量和铁代谢[70], 降低了慢性高原病的发病可能, 提示该人群对高原低氧环境的适应与HIF-2α基因位点选择有关[71]。HIF-2α基因位点选择不仅与慢性高原病的发生有关, 它和急性高原病(acute mountain sickness, AMS) 的发生也有关。黄岚课题组[72, 73]通过对18~45岁汉族男性由平原急进高原后18~24 h进行单核苷酸多态性检测发现HIF-2α-rs4953354和rs6756667与头痛明显相关, HIF-2α-rs675667位点与AMS发病相关, HIF-2α-rs675667-G等位基因较HIF-2α-rs675667-A等位基因更易发生AMS, AG+AA携带者较GG携带者AMS发病风险明显减少45%。临床上, Chuvash真性红细胞增多症(一种由VHL基因纯合性点突变引起的常染色体隐性遗传病) 的患者HIF-2α水平升高, 增加了发生PH的易感性[36]。总之, 目前研究结果一致显示, 世居藏族人HIF-2α基因具有积极的正向选择性, 从而能发生有利突变以增强机体对高原环境的适应性, 降低PH的发病风险[74]。
4 针对HIF-2α PH的候选治疗方案目前针对HIF-2α在肺动脉高压中的主要作用机制, 涉及下述7个相关治疗方案(图 1)。
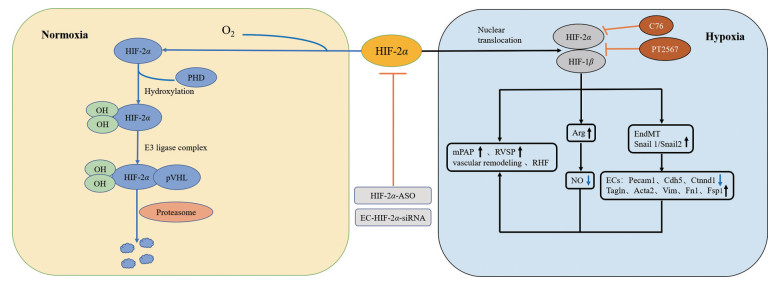
|
Figure 1 The main mechanism and related therapeutic targets of HIF-2α in pulmonary hypertension. pVHL: von Hippel-Lindau; HIF-2α: Hypoxia inducible factor-2 alpha; OH: Hydroxyl; PHD: Prolyl hydroxylase; O2: Oxygen; HIF-1β: Hypoxia inducible factor-1 beta; mPAP: Mean pulmonary arterial pressure; RVSP: Right ventricular systolic pressure; RHF: Right heart failure; Arg: Arginase; NO: Nitric oxide; EndMT: Endothelial-to-mesenchymal transition; ECs: Endothelial cells; Pecam 1: Platelet/endothelial cell adhesion molecule 1; Cdh5: Cadherin 5; Ctnnd1: Catenin delta 1; Tagln: Transgelin; Acta2: Actin alpha 2; Vim: Vimentin; Fn1: Fibronectin 1; Fsp1: Fibroblast specific protein S100A4 |
Arg可以与内皮型一氧化氮合酶(endothelial nitric oxide synthase, eNOS) 竞争二者共同底物L-精氨酸, 当Arg过度表达, 打破二者的平衡状态, 使一氧化氮(nitric oxide, NO) 合成减少, 从而损害内皮功能, 造成血管内皮功能紊乱。HIF-2α可以通过增加Arg-1的表达减少肺中NO的合成[60], NO作为血管活性剂, 其生成减少会促进PH的初期发展和血管重塑。在临床中也发现PH患者肺内硝酸盐、支气管肺泡液中NO的生化反应产物以及呼出的NO均减少[75]。从PH患者分离的肺内皮细胞的Arg-2表达大幅增加(人肺动脉内皮细胞不表达Arg-1)[76], 这会减少可利用的L-精氨酸并减少NOS衍生NO的形成。PH患者来源的BOEC中Arg-2酶活性升高, BOECs成管脆弱, 连接短, 回路小, 抑制HIF-2α后可恢复至正常水平[51]。因此, 可探索通过HIF-2α途径操纵NO稳态控制PH的疗法。
4.2 PHD2/HIF-2α信号作为HIF-2α的重要调节因子, PHD2对PH的形成至关重要。通过条件敲除大鼠内皮细胞和骨髓造血细胞中PHD2基因后, 大鼠可表现出类似临床IPAH患者的病理表现, 而敲除PHD2的大鼠未出现PH症状, 其原因可能是PHD2缺失导致HIF-2α降解减少, HIF-2α积聚诱导CXCL12促进SMC增殖[45]。因此, 靶向PHD2/HIF-2α信号传导失调, 可能是一种新颖的有效治疗策略。
4.3 抑制EndMT进程通过EndMT过程, 可以使缓慢生长的完全分化的LVEC转化为高度增殖的间充质细胞, 特征是细胞之间失去黏附, 细胞形态转化为纺锤形, 表现为SMC特异性基因[转胶蛋白(transgelin, Tagln) 和肌动蛋白α2 (actin alpha 2, Acta2)] 和/或成纤维细胞特异性基因[波形蛋白(vimentin, Vim)、纤维连接蛋白1 (fibronectin 1, Fn1) 和成纤维细胞特异蛋白S100A4 (fibroblast specific protein S100A4, Fsp1)] 的上调以及EC特异性基因[血小板内皮细胞黏附分子1 (platelet/endothelial cell adhesion molecule 1, Pecam1)、钙黏蛋白5 (cadherin 5, Cdh5) 和连环蛋白δ1 (catenin delta 1, Ctnnd1)] 的下调, 最终导致闭塞性内膜病变。低氧条件下, HIF-2α可上调SNAI锌指转录因子家族成员Snai1/Snai2的表达, 诱导内皮细胞向间充质细胞转变, 导致肺血管重构, 发生肺动脉高压[49]。HIF-2α和EndMT的联合抑制可能会为治疗肺动脉高压提供独特的治疗方法。
4.4 ASOsASOs是人工合成的一类通过碱基互补原则特异性地与靶DNA或mRNA结合而抑制该基因表达的核酸片段。利用HIF-2α-ASO敲低HIF-2α基因的效率为72%。在低氧条件下, 与对照低氧小鼠相比, HIF-2α-ASO干预的小鼠RVSP、右心室肥厚指数和右心室/体重比值均降低, 肺内完全肌化血管明显减少。注射HIF-2α-ASO后虽然没有出现像整体基因敲除小鼠在低氧下的致死现象, 但在该模型中, 成年小鼠体重降低, 循环血液中儿茶酚胺包括肾上腺素和去甲肾上腺素减少, 心率、心输出量以及左室收缩功能指标dp/dtmax均降低。除了观察到的心脏功能变化外, HIF-2α-ASO干预动物的红细胞比容也降低, 导致氧输送效率下降, 上述变化使得这些小鼠更加脆弱, 从而导致死亡风险增加[57]。总之, 如果未来临床应用HIF-2α-ASO治疗PH需谨慎。
4.5 细胞类型特异性敲除因为整体敲除HIF-2α对模型动物具有胚胎致死性, 所以条件敲除特定细胞HIF-2α成为可选的替代方法。在肺血管细胞中, HIF-2α在ECs中高表达, 所以一般选择肺血管内皮细胞为基因敲除的靶细胞。其原理为利用Cre/LoxP或Flipe/Frt原理, 将待敲除的一段目标DNA序列的两端各敲入一个loxP序列, 得到flox小鼠, 将flox小鼠与带有细胞特异性表达Cre酶的小鼠交配繁殖, 以获得在特定细胞中敲除目标基因的小鼠。ECs特异性HIF-2α敲除可防止小鼠在低氧条件下发展为肺动脉高压。有研究提示, ECs中HIF-2α基因缺失在预防低氧性PH发展方面似乎比整体HIF-2α敲低更有效[57]。除ECs外, Eul等[52]利用RNA干扰技术敲低肺内小动脉外膜成纤维细胞中HIF-2α的表达, 对低氧诱导的肺内小动脉成纤维细增殖有显著抑制作用, 而HIF-1α-siRNA对其增殖无影响。HIF-1α-siRNA和HIF-2α-siRNA联合使用抑制成纤维细胞增殖的效果并没有超过单独使用HIF-2α-siRNA的效果。在研究细胞迁移时, 发现HIF-1α-siRNA和HIF-2α-siRNA均有明显抑制作用, 且两者联用效果更好。
4.6 化合物76 (compound 76, C76)Zimmer等[77]通过在细胞上筛选HIF-2α抑制剂, 发现了C76, 其可以通过结合铁调节蛋白抑制HIF-2α的翻译。在PHD2基因敲除小鼠中, 经C76治疗逆转了闭塞性肺血管重构, 包括新生内膜形成和闭塞性血管病变, 改善了右心室肥大和心肌纤维化, 减少了RHF的发生, 提高了生存率。C76没有影响从IPAH患者中分离出的PASMC的增殖和凋亡, 但可通过影响ECs旁分泌抑制PASMC增殖。在Sugen5416/低氧大鼠中, C76可逆转肺血管重塑, 抑制右室肥大和心肌纤维化, 并保护其心脏功能。在MCT大鼠中, C76可降低RVSP、改善肺血管重塑和右心室肥大, 并能够降低死亡率[42]。
4.7 PT2567PT2567是Peloton Therapeutics公司研发的一种有效的、选择性的口服HIF-2α抑制剂, 用于非肿瘤适应症, 最开始针对PH, 目前仍在探索其在炎症性肠病中的开发潜力, 处于临床前研究阶段。Hu等[57]利用PT2567抑制HIF-2α, 观察正常成年啮齿动物暴露于短期(4天) 或慢性(4~5周) 低氧中的血液动力学及心肺病理变化, 发现PT2567显著抑制了短期低氧暴露大鼠肺血管周围单核细胞募集, 以及慢性低氧暴露大鼠肺血管细胞增殖、血管肌化、细胞黏合素C (tenascin C, Tnc) 沉积, 降低了平均肺动脉压。机制可能为: HIF-2α作为一个转录因子, 其是通过蛋白质与蛋白质的相互作用而发挥转录功能的, 既往认为HIF-2α和HIF-1β的结合很难被小分子破坏, 但Scheuermann和他的同事[78]发现HIF-2α的PAS-B结构域的内核具有疏水腔, 可以结合小分子, 通过变构破坏同HIF-1β的二聚化, 从而阻断转录活性。HIF-2α抑制剂PT2567即可作为这样的小分子直接与HIF-2α的PAS-B结构域结合, 并破坏HIF-2α/HIF-1β二聚体的形成, 从而终止其转录功能, 逆转肺血管重构、减少循环促炎因子和恢复血浆亚硝酸盐水平, 降低与严重PH发展相关的血流动力学参数。PT2567不仅减轻了PH的病理表现, 还可在分子水平使异常基因表达正常化。经PT2567干预后, ECs中异常的经典HIF下游靶基因葡萄糖转运蛋白1、N-myc下游调节基因1、VEGF、碳酸酐酶9趋于正常, 与炎症相关基因CXC趋化因子受体4、CXCL12、基质细胞衍生因子-1、细胞间黏附分子1、E-选择素以及与细胞增殖相关因子分化抑制因子1、分化抑制因子3、转化生长因子α基本恢复正常, 与PH相关的信号靶标, 包括爱帕琳肽、Arg-2、细胞周期蛋白D1、PAI-1、ET-1均降低[51, 57]。此外, 还可纠正心脏相关基因的异常表达, 如降低心肌结构靶标β-肌球蛋白重链、骨骼肌肌动蛋白α1、心脏负荷靶标心房钠尿肽前体A、膜联蛋白A5和心肌纤维化靶标I型胶原蛋白α1、Ⅲ型胶原蛋白α1和金属蛋白酶2的表达。而作为目前临床治疗PH常用药物西地那非只降低了Ⅲ型胶原蛋白α1和金属蛋白酶2的表达。PT2567干预使血浆心肌应激标志物肌钙蛋白I和脂肪酸结合蛋白3、血浆亚硝酸盐浓度正常化, 降低PH患者和健康志愿者来源BOEC增殖, 但不影响细胞凋亡[51]。这表明HIF-2α小分子抑制剂PT2567可能成为治疗PH的一种潜力药物。
5 结语与展望大多数已发表的关于HIF-2α在PH发生中的作用, 采用的模型为胚胎期HIF-2α敲除或激活, 先天存在肺或血管缺陷的动物, 但现实中观察到PH的人和动物的肺循环对慢性低氧应激反应是正常的。所以采用上述动物模型作为研究对象可能导致研究不客观。原因如下: ①这些模型在胚胎中存在血管缺陷, 可能在成年后继续表现出血管缺陷[79]; ②当基因缺失在胚胎中开始与在成年小鼠中开始时其表型存在差异。如在成年动物中抑制单核细胞趋化蛋白1 (monocyte chemotactic protein 1, MCP1) 可降低低氧或MCT诱导的PH, 而MCP1或MCP1受体敲除小鼠(始于胚胎) 表现出自发的PH[80, 81]。细胞类型特异性敲除是了解特定细胞类型中靶基因对疾病贡献的有力方法。然而, 仅从细胞类型特异性敲除实验中得出的结论在确定疾病中基因功能方面可能存在缺陷。在疾病发生发展过程中并非单一细胞发挥作用, 而是存在不同细胞间的相互作用, 并且特定基因在不同疾病相关细胞类型中可能具有不同或相反的功能。如微囊蛋白在PH患者ECs中降低, 促进PH的发展, 但微囊蛋白在原发性肝癌中过度表达也促进原发性肝癌的发展[82], 故需要寻求更符合临床PH的动物模型及研究手段。
目前, 对于PH的研究主要集中在对血管舒缩功能进行调控, 然而PH导致患者死亡的原因往往是因为脏器重构导致的右心衰竭, 故研发可以逆转肺血管和右心重构的药物十分必要。HIF-2α作为PH的关键调节因子, 参与了肺血管重构的过程, HIF-2α抑制剂已经在PH患者肺组织显示出抑制重构的优势, 且在不同动物模型中不仅具有降低PH的作用, 还具有抑制肺血管和右心室重构的效果, 尤其在抑制右心重构方面优于西地那非。HIF-2α抑制剂的研发将对临床PH死亡率居高不下的现状带来希望。PT2567目前处于临床前期研究阶段, 根据临床试验效果, 如患者生活质量、生存时间、药物不良反应以及耐药性等问题, 未来可以尝试研发针对PAS-A结构域的HIF-2α的抑制剂以及除针对HIF-2α的直接变构调控外其他间接调控的小分子。此外, 目前研发的双环类HIF-2α抑制剂PT2399、PT2385、PT2977已经处于临床I/II期阶段, 显示出良好的治疗肾透明细胞癌的效果, 且其作用机制与PT2567类似, 即诱导HIF-2α-PAS-B结构域结合面上残基位置发生变化, 削弱两个PAS-B结构域之间的结合能力, 导致HIF-2α与HIF-1β无法形成二聚体[83]。是否可以将双环类HIF-2α抑制剂应用于PH的治疗还需实验验证, 以给临床治疗提供更多可能。
作者贡献: 冀磊负责查阅文献、撰写文章; 李占强负责文章选题、指导撰写思路; 芦殿香负责指导撰写思路、文章修改。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
McLaughlin VV, Shah SJ, Souza R, et al. Management of pulmonary arterial hypertension[J]. J Am Coll Cardiol, 2015, 65: 1976-1997. DOI:10.1016/j.jacc.2015.03.540 |
| [2] |
Tuder RM, Stacher E, Robinson J, et al. Pathology of pulmonary hypertension[J]. Clin Chest Med, 2013, 34: 639-650. DOI:10.1016/j.ccm.2013.08.009 |
| [3] |
Pulmonary Embolism and Pulmonary Vascular Disease Group, Respiratory Society, Chinese Medical Association. Chinese guidelines for the diagnosis and treatment of pulmonary hypertension (the 2021 version)[J]. Natl Med J China (中华医学杂志), 2021, 101: 11-51. |
| [4] |
Hoeper MM, Humbert M, Souza R, et al. A global view of pulmonary hypertension[J]. Lancet Resp Med, 2016, 4: 306-322. DOI:10.1016/S2213-2600(15)00543-3 |
| [5] |
Morrell NW, Aldred MA, Chung WK, et al. Genetics and genomics of pulmonary arterial hypertension[J]. Eur Respir J, 2019, 53: 1801899. DOI:10.1183/13993003.01899-2018 |
| [6] |
Thomas CA, Anderson RJ, Condon DF, et al. Diagnosis and management of pulmonary hypertension in the modern era: insights from the 6th World Symposium[J]. Pulm Ther, 2020, 6: 9-22. DOI:10.1007/s41030-019-00105-5 |
| [7] |
Wu WH, Yuan P, Zhang SJ, et al. Impact of pituitary-gonadal axis hormones on pulmonary arterial hypertension in men[J]. Hypertension, 2018, 72: 151-158. DOI:10.1161/HYPERTENSIONAHA.118.10963 |
| [8] |
Thompson AAR, Lawrie A. Targeting vascular remodeling to treat pulmonary arterial hypertension[J]. Trends Mol Med, 2017, 23: 31-45. DOI:10.1016/j.molmed.2016.11.005 |
| [9] |
Luo L, Liu D, Tang C, et al. Sulfur dioxide upregulates the inhibited endogenous hydrogen sulfide pathway in rats with pulmonary hypertension induced by high pulmonary blood flow[J]. Biochem Biophys Res Commun, 2013, 433: 519-525. DOI:10.1016/j.bbrc.2013.03.014 |
| [10] |
Yerabolu D, Weiss A, Kojonazarov B, et al. Targeting Jak-Stat signaling in experimental pulmonary hypertension[J]. Am J Respir Cell Mol Biol, 2021, 64: 100-114. DOI:10.1165/rcmb.2019-0431OC |
| [11] |
Anwar MA, Samaha AA, Ballan S, et al. Salvia fruticosa induces vasorelaxation in rat isolated thoracic aorta: role of the PI3K/Akt/eNOS/NO/cGMP signaling pathway[J]. Sci Rep, 2017, 7: 686. DOI:10.1038/s41598-017-00790-9 |
| [12] |
Dang ZC, Su SS, Jin GE, et al. Tsantan Sumtang attenuated chronic hypoxia-induced right ventricular structure remodeling and fibrosis by equilibrating local ACE-AngII-AT1R/ACE2-Ang1-7-Mas axis in rat[J]. J Ethnopharmacol, 2020, 250: 112470. DOI:10.1016/j.jep.2019.112470 |
| [13] |
Cai Z, Li J, Zhuang Q, et al. miR-125a-5p ameliorates monocrotaline-induced pulmonary arterial hypertension by targeting the TGF-β1 and IL-6/STAT3 signaling pathways[J]. Exp Mol Med, 2018, 50: 45. |
| [14] |
Sun LY, Cai ZY, Pu J, et al. 5-Aminosalicylic acid attenuates monocrotaline-induced pulmonary arterial hypertension in rats by increasing the expression of Nur77[J]. Inflammation, 2017, 40: 806-817. DOI:10.1007/s10753-017-0525-5 |
| [15] |
Legchenko E, Chouvarine P, Borchert P, et al. PPARγ agonist pioglitazone reverses pulmonary hypertension and prevents right heart failure via fatty acid oxidation[J]. Sci Transl Med, 2018, 10: eaao0303. DOI:10.1126/scitranslmed.aao0303 |
| [16] |
Dai ZY, Zhu MM, Peng Y, et al. Endothelial and smooth muscle cell interaction via FoxM1 signaling mediates vascular remodeling and pulmonary hypertension[J]. Am J Respir Crit Care Med, 2018, 198: 788-802. DOI:10.1164/rccm.201709-1835OC |
| [17] |
Deng LY, Chen JD, Wang T, et al. PDGF/MEK/ERK axis represses Ca2+ clearance via decreasing the abundance of plasma membrane Ca2+ pump PMCA4 in pulmonary arterial smooth muscle cells[J]. Am J Physiol Cell Physiol, 2021, 320: C66-C79. DOI:10.1152/ajpcell.00290.2020 |
| [18] |
He YH, Zuo CJ, Jia DL, et al. Loss of DP1 aggravates vascular remodeling in pulmonary arterial hypertension via mTORC1 signaling[J]. Am J Respir Crit Care Med, 2020, 201: 1263-1276. DOI:10.1164/rccm.201911-2137OC |
| [19] |
Wang LL, Wang Y, Lei Z. Chrysin ameliorates ANTU-induced pulmonary edema and pulmonary arterial hypertension via modulation of VEGF and eNOs[J]. J Biochem Mol Toxicol, 2019, 33: e22332. |
| [20] |
López V, Moraga FA, Llanos AJ, et al. Plasmatic concentrations of ADMA and homocystein in Llama (Lama glama) and regulation of arginase type Ⅱ: an animal resistent to the development of pulmonary hypertension induced by hypoxia[J]. Front Physiol, 2018, 9: 606. DOI:10.3389/fphys.2018.00606 |
| [21] |
Tian HS, Lei L, Wu Y, et al. Resistin-like molecule β acts as a mitogenic factor in hypoxic pulmonary hypertension via the Ca2+-dependent PI3K/Akt/mTOR and PKC/MAPK signaling pathways[J]. Respir Res, 2021, 22: 8. DOI:10.1186/s12931-020-01598-4 |
| [22] |
Jiang XH, Xing XY, Wang XC, et al. Drugs and drug delivery strategies for treatment of pulmonary arterial hypertension[J]. Acta Pharm Sin (药学学报), 2021, 56: 1332-1342. |
| [23] |
Zhang D, Yang J. The current application of stem cell based therapy in pulmonary hypertension[J]. Acta Pharm Sin (药学学报), 2018, 53: 1778-1783. |
| [24] |
Tian H, Mcknight SL, Russell DW. Endothelial PAS domain protein 1(EPAS1), a transcription factor selectively expressed in endothelial cells[J]. Genes Dev, 1997, 11: 72-82. DOI:10.1101/gad.11.1.72 |
| [25] |
Patel SA, Simon MC. Biology of hypoxia-inducible factor-2α in development and disease[J]. Cell Death Differ, 2008, 15: 628-634. DOI:10.1038/cdd.2008.17 |
| [26] |
Maxwell PH, Wiesener MS, Chang GW, et al. The tumour suppressor protein VHL targets hypoxia-inducible factors for oxygen-dependent proteolysis[J]. Nature, 1999, 399: 271-275. DOI:10.1038/20459 |
| [27] |
Dyson HJ, Wright PE. Role of intrinsic protein disorder in the function and interactions of the transcriptional coactivators CREB-binding protein (CBP) and p300[J]. J Biol Chem, 2016, 291: 6714-6722. DOI:10.1074/jbc.R115.692020 |
| [28] |
Kim SY, Yang EG. Recent advances in developing inhibitors for hypoxia-inducible factor prolyl hydroxylases and their therapeutic implications[J]. Molecules, 2015, 20: 20551-20568. DOI:10.3390/molecules201119717 |
| [29] |
Semenza GL. Hypoxia-inducible factor 1:master regulator of O2 homeostasis[J]. Curr Opin Genet Dev, 1998, 8: 588-594. DOI:10.1016/S0959-437X(98)80016-6 |
| [30] |
Young JM, Williams DR, Thompson AAR. Thin air, thick vessels: historical and current perspectives on hypoxic pulmonary hypertension[J]. Front Med, 2019, 6: 93. DOI:10.3389/fmed.2019.00093 |
| [31] |
Wiesener MS, Turley H, Allen WE, et al. Induction of endothelial PAS domain protein-1 by hypoxia: characterization and comparison with hypoxia-inducible factor-1[J]. Blood, 1998, 92: 2260-2268. DOI:10.1182/blood.V92.7.2260 |
| [32] |
Uchida T, Rossignol F, Matthay MA, et al. Prolonged hypoxia differentially regulates hypoxia-inducible factor (HIF)-1alpha and HIF-2alpha expression in lung epithelial cells: implication of natural antisense HIF-1alpha[J]. J Biol Chem, 2004, 279: 14871-14878. DOI:10.1074/jbc.M400461200 |
| [33] |
Shimoda LA, Semenza GL. Role of hypoxia-inducible factors in pulmonary development and disease[J]. Am J Respir Crit Care Med, 2011, 183: 152-156. DOI:10.1164/rccm.201009-1393PP |
| [34] |
Hu CJ, Sataur A, Wang L, et al. The N-terminal transactivation domain confers target gene specificity of hypoxia-inducible factors HIF-1alpha and HIF-2alpha[J]. Mol Biol Cell, 2007, 18: 4528-4542. DOI:10.1091/mbc.e06-05-0419 |
| [35] |
Kumar H, Choi DK. Hypoxia inducible factor pathway and physiological adaptation: a cell survival pathway?[J]. Med Inflamm, 2015, 2015: 584758. |
| [36] |
Hickey MM, Richardson T, Wang T, et al. The von Hippel-Lindau Chuvash mutation promotes pulmonary hypertension and fibrosis in mice[J]. J Clin Invest, 2010, 120: 827-839. DOI:10.1172/JCI36362 |
| [37] |
Yoo S, Takikawa S, Geraghty P, et al. Integrative analysis of DNA methylation and gene expression data identifies EPAS1 as a key regulator of COPD[J]. PLoS Genet, 2015, 11. |
| [38] |
Rabinovitch M. Molecular pathogenesis of pulmonary arterial hypertension[J]. J Clin Invest, 2012, 122: 4306-4313. DOI:10.1172/JCI60658 |
| [39] |
Rabinovitch M, Guignabert C, Humbert M, et al. Inflammation and immunity in the pathogenesis of pulmonary arterial hypertension[J]. Circ Res, 2014, 115: 165-175. DOI:10.1161/CIRCRESAHA.113.301141 |
| [40] |
Lai YC, Potoka KC, Champion HC, et al. Pulmonary arterial hypertension: the clinical syndrome[J]. Circ Res, 2014, 15: 115-130. |
| [41] |
Ahmad A, Ahmad S, Malcolm KC, et al. Differential regulation of pulmonary vascular cell growth by hypoxia-inducible transcription factor-1α and hypoxia-inducible transcription factor-2α[J]. Am J Respir Cell Mol Biol, 2013, 49: 78-85. DOI:10.1165/rcmb.2012-0107OC |
| [42] |
Dai ZY, Zhu MM, Peng Y, et al. Therapeutic targeting of vascular remodeling and right heart failure in pulmonary arterial hypertension with a HIF-2α inhibitor[J]. Am J Respir Crit Care Med, 2018, 198: 1423-1434. DOI:10.1164/rccm.201710-2079OC |
| [43] |
Raghavan A, Zhou G, Zhou Q, et al. Hypoxia-induced pulmonary arterial smooth muscle cell proliferation is controlled by forkheadbox M1[J]. Am J Respir Cell Mol Biol, 2012, 46: 431-436. DOI:10.1165/rcmb.2011-0128OC |
| [44] |
Firth AL, Yao WC, Ogawa A, et al. Upregulation of Oct-4 isoforms in pulmonary artery smooth muscle cells from patients with pulmonary arterial hypertension[J]. Am J Physiol Lung Cell Mol Physiol, 2010, 298: L548-L557. DOI:10.1152/ajplung.00314.2009 |
| [45] |
Dai ZY, Li M, Wharton J, et al. PHD2 deficiency in endothelial cells and hematopoietic cells induces obliterative vascular remodeling and severe pulmonary arterial hypertension in mice and humans through HIF-2α[J]. Circulation, 2016, 133: 2447-2458. DOI:10.1161/CIRCULATIONAHA.116.021494 |
| [46] |
Fijalkowska I, Xu W, Comhair SA, et al. Hypoxia inducible-factor 1alpha regulates the metabolic shift of pulmonary hypertensive endothelial cells[J]. Am J Pathol, 2010, 176: 1130-1138. DOI:10.2353/ajpath.2010.090832 |
| [47] |
Bryant AJ, Carrick RP, McConaha ME, et al. Endothelial HIF signaling regulates pulmonary fibrosis-associated pulmonary hypertension[J]. Am J Physiol Lung Cell Mol Physiol, 2016, 310: L249-L262. DOI:10.1152/ajplung.00258.2015 |
| [48] |
Rimon E, Chen B, Shanks AL, et al. Hypoxia in human trophoblasts stimulates the expression and secretion of connective tissue growth factor[J]. Endocrinology, 2008, 149: 2952-2958. DOI:10.1210/en.2007-1099 |
| [49] |
Tang HY, Babicheva A, McDermott KM, et al. Endothelial HIF-2α contributes to severe pulmonary hypertension due to endothelial-to-mesenchymal transition[J]. Am J Physiol Lung Cell Mol Physiol, 2018, 314: L256-L275. |
| [50] |
Yin J, Ma ZN, Zhao XJ, et al. Isolation, culture and characterization of outgrowth endothelial cells from the human peripheral blood[J]. J Exp Hematol (中国实验血液学杂志), 2014, 22: 1711-1715. |
| [51] |
Macias D, Moore S, Crosby A, et al. Targeting HIF2α-ARNT hetero-dimerisation as a novel therapeutic strategy for pulmonary arterial hypertension[J]. Eur Respir J, 2021, 57: 1902061. DOI:10.1183/13993003.02061-2019 |
| [52] |
Eul B, Rose F, Krick S, et al. Impact of HIF-1α and HIF-2α on proliferation and migration of human pulmonary artery fibroblasts in hypoxia[J]. FASEB J, 2006, 20: 163-165. DOI:10.1096/fj.05-4104fje |
| [53] |
He W, Kapate N, Shields CW 4th, et al. Drug delivery to macrophages: a review of targeting drugs and drug carriers to macrophages for inflammatory diseases[J]. Adv Drug Deliv Rev, 2020, 165-166: 15-40. DOI:10.1016/j.addr.2019.12.001 |
| [54] |
Li C, Liu PP, Song R, et al. Immune cells and autoantibodies in pulmonary arterial hypertension[J]. Acta Biochim Biophys Sin, 2017, 49: 1047-1057. DOI:10.1093/abbs/gmx095 |
| [55] |
Tian W, Jiang XG, Tamosiuniene R, et al. Blocking macrophage leukotriene b4 prevents endothelial injury and reverses pulmonary hypertension[J]. Sci Transl Med, 2013, 5: 200ra117. |
| [56] |
Thenappan T, Goel A, Marsboom G, et al. A central role for CD68+ macrophages in hepatopulmonary syndrome: reversal by macrophage depletion[J]. Am Respir Crit Care Med, 2011, 183: 1080-1091. DOI:10.1164/rccm.201008-1303OC |
| [57] |
Hu CJ, Poth JM, Zhang H, et al. Suppression of HIF2 signalling attenuates the initiation of hypoxia-induced pulmonary hypertension[J]. Eur Respir J, 2019, 54: 1900378. |
| [58] |
Wang QR, He ZQ, Huang MG, et al. Vascular niche IL-6 induces alternative macrophage activation in glioblastoma through HIF-2α[J]. Nat Commun, 2018, 9: 559. DOI:10.1038/s41467-018-03050-0 |
| [59] |
Groth A, Vrugt B, Brock M, et al. Inflammatory cytokines in pulmonary hypertension[J]. Respir Res, 2014, 15: 47. DOI:10.1186/1465-9921-15-47 |
| [60] |
Cowburn AS, Crosby A, Macias D, et al. HIF2α-arginase axis is essential for the development of pulmonary hypertension[J]. Proc Natl Acad Sci U S A, 2016, 113: 8801-8806. DOI:10.1073/pnas.1602978113 |
| [61] |
Imtiyaz HZ, Williams EP, Hickey MM, et al. Hypoxia-inducible factor 2alpha regulates macrophage function in mouse models of acute and tumor inflammation[J]. J Clin Invest, 2010, 120: 2699-2714. DOI:10.1172/JCI39506 |
| [62] |
Xiao QQ, Li XT, Li Y, et al. Biological drug and drug delivery-mediated immunotherapy[J]. Acta Pharm Sin B, 2021, 11: 941-960. DOI:10.1016/j.apsb.2020.12.018 |
| [63] |
Brusselmans K, Compernolle V, Tjwa M, et al. Heterozygous deficiency of hypoxia-inducible factor-2α protects mice against pulmonary hypertension and right ventricular dysfunction during prolonged hypoxia[J]. J Clin Invest, 2003, 111: 1519-1527. DOI:10.1172/JCI15496 |
| [64] |
Ball MK, Waypa GB, Mungai PT, et al. Regulation of hypoxia-induced pulmonary hypertension by vascular smooth muscle hypoxia-inducible factor-1α[J]. Am J Respir Crit Care Med, 2014, 189: 314-324. DOI:10.1164/rccm.201302-0302OC |
| [65] |
Tan Q, Kerestes H, Percy MJ, et al. Erythrocytosis and pulmonary hypertension in a mouse model of human HIF2A gain of function mutation[J]. J Biol Chem, 2013, 288: 17134-17144. DOI:10.1074/jbc.M112.444059 |
| [66] |
Skuli N, Liu LP, Runge A, et al. Endothelial deletion of hypoxia-inducible factor-2alpha (HIF-2alpha) alters vascular function and tumor angiogenesis[J]. Blood, 2009, 114: 469-477. |
| [67] |
Macias D, Cowburn AS, Torres-Torrelo H, et al. HIF-2alpha is essential for carotid body development and function[J]. Elife, 2018, 7: e34681. DOI:10.7554/eLife.34681 |
| [68] |
Basang Z, Wang BY, Li L, et al. HIF2A variants were associated with different levels of high-altitude hypoxia among native Tibetans[J]. PLoS One, 2015, 10: e0137956. DOI:10.1371/journal.pone.0137956 |
| [69] |
Simonson TS, Yang YZ, Huff CD, et al. Genetic evidence for high-altitude adaptation in Tibet[J]. Science, 2010, 329: 72-75. DOI:10.1126/science.1189406 |
| [70] |
Beall CM, Cavalleri GL, Deng L, et al. Natural selection on EPAS1(HIF2alpha) associated with low hemoglobin concentration in Tibetan high landers[J]. Proc Natl Acad Sci U S A, 2010, 107: 11459-11464. DOI:10.1073/pnas.1002443107 |
| [71] |
Lorenzo FR, Huff C, Myllymki M, et al. A genetic mechanism for Tibetan high-altitude adaptation[J]. Nat Genet, 2014, 46: 951-956. DOI:10.1038/ng.3067 |
| [72] |
Yang S, Zhang JH, Yang J, et al. Association of EPAS1 and PPARA gene polymorphisms with high-altitude headache in Chinese Han population[J]. Biomed Res Int, 2020, 2020: 1593068. |
| [73] |
Guo L, Zhang JH, Jin J, et al. Genetic variants of endothelial PAS domain protein 1 are associated with susceptibility to acute mountain sickness in individuals unaccustomed to high altitude: a nested casecontrol study[J]. Exp Ther Med, 2015, 10: 907-914. DOI:10.3892/etm.2015.2611 |
| [74] |
He QL, Ge RL, Li ZQ, et al. Hypoxia inducing factor related genetic adaptation in high-altitude and pharmacological modulation[J]. Acta Pharm Sin (药学学报), 2019, 54: 611-619. |
| [75] |
Girgis RE, Champion HC, Diette GB, et al. Decreased exhaled nitric oxide in pulmonary arterial hypertension: response to bosentan therapy[J]. Am J Respir Crit Care Med, 2005, 172: 352-357. DOI:10.1164/rccm.200412-1684OC |
| [76] |
Xu WL, Kaneko FT, Zheng S, et al. Increased arginase II and decreased NO synthesis in endothelial cells of patients with pulmonary arterial hypertension[J]. FASEB J, 2004, 18: 1746-1748. DOI:10.1096/fj.04-2317fje |
| [77] |
Zimmer M, Ebert BL, Neil C, et al. Small-molecule inhibitors of HIF-2α translation link its 5'UTR iron-responsive element to oxygen sensing[J]. Mol Cell, 2008, 32: 838-848. DOI:10.1016/j.molcel.2008.12.004 |
| [78] |
Scheuermann TH, Tomchick DR, Machius M, et al. Artificial ligand binding within the HIF2alpha PAS-B domain of the HIF2 transcription factor[J]. Proc Natl Acad Sci U S A, 2009, 106: 450-455. DOI:10.1073/pnas.0808092106 |
| [79] |
Takeda K, Ho VC, Takeda H, et al. Placental but not heart defects are associated with elevated hypoxia-inducible factor alpha levels in mice lacking prolyl hydroxylase domain protein 2[J]. Mol Cell Biol, 2006, 26: 8336-8346. DOI:10.1128/MCB.00425-06 |
| [80] |
Kosanovic D, Dahal BK, Vroom C, et al. Selective inhibition of chemokine CCL2/MCP-1 reduces experimental pulmonary hypertension[J]. Pneumologie, 2013, 67: 10. |
| [81] |
Yu YR, Mao L, Piantadosi CA, et al. CCR2 deficiency, dysregulation of Notch signaling, and spontaneous pulmonary arterial hypertension[J]. Am J Respir Cell Mol Biol, 2013, 48: 647-654. DOI:10.1165/rcmb.2012-0182OC |
| [82] |
Mathew R. Cell-specific dual role of caveolin-1 in pulmonary hypertension[J]. Pulm Med, 2011, 2011: 573432. |
| [83] |
Yu YC, Yu QW, Zhang XJ. Allosteric inhibition of HIF-2α as a novel therapy for clear cell renal cell carcinoma[J]. Drug Discov Today, 2019, 24: 2332-2340. DOI:10.1016/j.drudis.2019.09.008 |
 2022, Vol. 57
2022, Vol. 57


