目前, 肿瘤免疫治疗是一种强有力的肿瘤治疗策略[1], 肿瘤免疫原性死亡(immunogenic cell death, ICD) 是一种通过激活免疫作用杀伤肿瘤细胞的有效手段[2]。肿瘤细胞受到刺激后会产生损伤相关分子信号(damage-associated molecular patterns, DAMPs), 包括钙网蛋白(calreticulin, CRT)、高迁移率蛋白1 (high-mobility group box 1, HMGB1) 和三磷酸腺苷(adenosine triphosphate, ATP), 激活免疫应答并活化肿瘤免疫反应[3]。但是, ICD诱导作用后产生的细胞毒性T淋巴细胞(cytotoxic T lymphocyte, CTL) 分泌的干扰素-γ (interferon-γ, IFN-γ) 会增加内源性吲哚胺2, 3-双加氧酶1 (indoleamine 2, 3-dioxygenase 1, IDO1) 的表达, 从而增强了免疫抑制肿瘤微环境(immunosuppressive tumor microenvironment, ITM), 阻止肿瘤的免疫应答[4, 5]。IDO1蛋白在大多数肿瘤细胞中高表达, 其催化色氨酸(tryptophan, Trp) 的耗竭, 导致犬尿氨酸(kynurenine, Kyn) 增多。Trp的耗竭和Kyn等代谢物的产生导致肿瘤微环境产生免疫抑制作用, 促进癌细胞的免疫逃逸[5-8], 故降低IDO1蛋白的表达不但可以显著地增强肿瘤的免疫应答, 更能提高多柔比星(doxorubicin, DOX) 的ICD作用。
RNA干扰(RNA interference, RNAi) 是指由与特定基因序列同源的双链RNA (double-stranded RNA, dsRNA) 诱发的特定基因沉默[9-11]。小干扰RNA (small interfering RNA, siRNA) 作为潜在的癌症治疗策略具有高度安全性、高效性以及特异性等优势, 利用siRNA能够引起同源基因mRNA降解并沉默其蛋白表达。因此, 本文引入IDO1 siRNA, 其与DOX的协同作用会显著降低IDO1蛋白的表达, 增强DOX的ICD作用, 显著增强肿瘤的免疫应答[12-14]。然而, siRNA在生理环境下极不稳定, 易被血清中的核糖核酸酶(ribonuclease, RNase) 迅速降解[15, 16]。因此, 研究开发具有多功能递药系统并实现有效递送siRNA的临床意义重大。另外, 异质结构和独特的肿瘤微环境阻止载药系统深入肿瘤组织, 从而减低药物的治疗效果, 设计构建一种既能包载siRNA又能深层递送的载药系统势在必行。
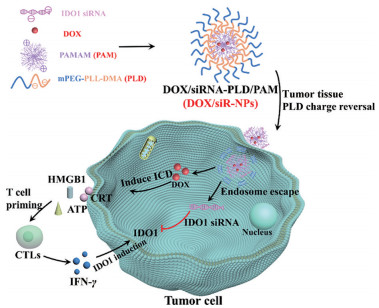
综上所述, 本课题组构建了一种基于pH敏感共聚物聚乙二醇-聚赖氨酸-2, 3-二甲基马来酸酐[poly(ethylene glycol)-poly-L-lysine-2, 3-dimethylmaleic anhydride, mPEG-PLL-DMA, 简称PLD][17]和聚酰胺-胺树状大分子(polyamidoamine, PAMAM) 的新型电荷转换和高渗透纳米粒, 包载疏水性药物DOX和负电荷的IDO1 siRNA作为多功能纳米平台(示意图 1)。利用DOX的ICD作用将癌细胞变成“肿瘤疫苗”, 刺激释放抗肿瘤免疫相关分子信号, 提升肿瘤免疫原性。另外, IDO1 siRNA调节肿瘤的免疫抑制微环境。通过两种药物的联合应用, 可获得安全、低毒的肿瘤免疫治疗能力。pH敏感共聚物PLD在中性环境中呈现为负电荷, 当在pH 6.5左右的肿瘤微酸性环境中, 由于mPEG-PLL和DMA之间的可切割酰胺键, PLD共聚物从负电荷转变为正电荷, 从纳米粒上脱离, 暴露出带有正电荷的PAMAM纳米粒, 其电荷的反转和粒径的降低会显著提高纳米粒对肿瘤组织的渗透能力。
|
Scheme 1 DOX/siRNA-PLD/PAM was prepared with IDO1 siRNA, DOX and PAMAM dendrimers and then capped with a pH-sensitive copolymer PLD. DOX/siRNA-NPs boasted enhance tumor penetration in the effective treatment of 4T1 cells in tumor bearing mice. DOX and IDO1 siRNA were encapsulated to achieve efficient tumor immunotherapy. DOX: Doxorubicin; PLD: Poly(ethylene glycol)-poly-L-lysine-2, 3-dimethylmaleic anhydride (mPEG-PLL-DMA); IDO1: Indoleamine 2, 3-dioxygenase 1; PAMAM: Polyamidoamine; HMGB1: High-mobility group box 1; ICD: Immunogenic cell death; ATP: Adenosine triphosphate; CRT: Calreticulin; CTLs: Cytotoxic T lymphocytes; IFN-γ: Interferon-γ |
试剂和仪器 mPEG-PLL-DMA [本实验室自制, mPEG (聚乙二醇) 分子质量为2 000 Da, PLL (聚赖氨酸)为1 500 Da)][17]; PAMAM树状大分子(G4.0, 含NH2端基, 乙二胺核); DOX (北京华奉联博科技有限公司); IDO1 siRNA (上海吉玛制药有限公司) 正义链: 5′-GGGCUUCUUCCUCGUCUCUTT-3′; 反义链: 5′-AGA GACGAGGAAGAAGCCCTT-3′ [12]; 胰酶、胎牛血清、DMEM (Dulbecco's modified Eagle's medium) 培养基(Gibco公司); 甲基噻唑蓝(methyl thiazolyl tetrazolium, MTT)、4', 6-二氨基-2-苯基吲哚(4', 6-diamino-2-phenyl indole, DAPI) (碧云天生物技术研究所); 抗IDO1-异硫氰酸荧光素(fluorescein isothiocyanate, FITC) 抗体、抗CD8-FITC抗体和抗CD4-PE (phycoerythrin) 抗体(Proteintech公司); ATP试剂盒、Ki67试剂盒、苏木素-伊红(hematoxylin-eosin staining, H&E) 试剂盒(联科生物有限公司); 其他试剂均为分析纯。
Tanon 2500R全自动数码凝胶图像分析系统(上海天能科技有限公司); Varioskan Flash多功能酶标仪(美国Thermo Scientific公司); JEM-1200EX透射电子显微镜(日本Electron株式会社); FV1000-IX81激光共聚焦显微镜(日本Olympus公司)。
细胞培养 小鼠乳腺癌细胞4T1细胞于含10% FBS的DMEM培养液中, 置于5% CO2、37 ℃培养箱中培养。
DOX/siR-PLD/PAM纳米粒的制备 将DOX和PAMAM树状大分子以10∶1的质量比溶解在30 mL甲醇中。室温搅拌24 h, 旋转蒸发完全去除甲醇后, 加入磷酸盐缓冲液(phosphate buffer, PBS, pH 7.4) 10 mL, 搅拌以溶解PAMAM树状大分子, 0.22 μm滤膜过滤后, 利用超速离心法对制剂的包封率进行测定。将溶液置于离心管中并离心(12 000 r·min-1, 10 min), 吸取上清液计算包载的DOX含量。另外, 精密吸取溶液, 加入甲醇进行破乳, 得到总的DOX含量, 从而计算DOX的包封率。随后, 按照氮磷比(N/P, PAMAM的氨基与siRNA的磷酸基团的摩尔比) 为4加入IDO1 siRNA, 负电荷的IDO1 siRNA与正电荷的PAMAM树状大分子正负电荷吸附, 包载IDO1 siRNA, 制备成DOX/siR-PAM纳米制剂。在pH 7.4时, 按照不同的PLD/PAM质量比加入PLD共聚物, 制备成DOX/siR-PLD/PAM纳米制剂(DOX/siR-NPs)。
利用琼脂糖凝胶阻滞实验来考察siRNA的包封率。首先, 称取1.0 g琼脂糖于锥形瓶中, 加入0.5×Tris-硼酸(TBE) 50 mL后, 微波炉中火加热2 min至全部溶解。待凝胶略微冷却后精密吸取溴化乙锭(ethidium bromide, EB) 溶液2.5 μL加入其中, 轻轻摇晃混匀, 趁热倒入模具中并插入梳齿, 室温冷却后将梳齿取出, 即得凝胶备用。随后, 取上述制备的一系列N/P比的siR-PAM纳米粒加入至琼脂糖凝胶各泳道中, 等量游离siRNA作为阴性对照组, 100 V恒定电压电泳30 min后将凝胶放入凝胶成像系统中, 采用透射光观察成像并拍照。
另外, 采用超滤管分离-荧光分光光度法测定纳米粒中的siRNA的包封率(用带有荧光的FAM siRNA替换siRNA)。将纳米制剂置于Amicon Ultra-4超滤管(截留分子质量为50 kDa), 5 000 r·min-1离心10 min后, 所得滤液即为未包封FAM siRNA, 测得其荧光强度(F1; EX: 480 nm, Em: 520 nm)。取与制剂等量的FAM siRNA测定其荧光强度(F2)。最后用公式(1) 计算FAM siRNA的包封率(encapsulation efficiency, EE):
| $ {\rm{EE}} (\%) = (1 - F_{1} / F_{2}) × 100 $ | (1) |
采用马尔文激光粒度仪测定不同PLD/PAM质量比的DOX/siR-PLD/PAM纳米粒(DOX/siR-NPs) 的粒径和zeta电位的变化。利用透射电子显微镜(transmission electron microscope, TEM) 进行制剂的形态学的考察。
pH敏感性的考察 采用动态光衍射法(DLS) 测定纳米粒在pH 6.5和7.4的PBS中的zeta电位和粒径。
体外细胞毒性考察
利用MTT方法考察空白载体(PLD/PAM纳米粒) 的细胞毒性 将4T1细胞以每孔1×104个接种于96孔板中, 置于5% CO2、37 ℃细胞培养箱中培养24 h。采用PBS清洗后向每孔加入含10、40、80、100和200 μg·mL-1的PLD/PAM纳米粒DMEM培养液200 μL, 分别培养24和48 h后每孔加入MTT溶液20 μL, 继续培养4 h, 弃去培养液每孔加入二甲基亚砜150 μL, 避光震荡10 min, 采用酶标仪于490 nm处测定吸光度(A) 值。
利用MTT方法考察载药制剂的体外细胞毒性 将4T1细胞以每孔1×104个接种于96孔板中, 置于5% CO2、37 ℃细胞培养箱中培养24 h。弃去培养液, 用PBS清洗细胞3次, 向每孔加入一定量的DOX和DOX/NPs的DMEM培养液200 μL, 使其终浓度(以DOX计) 分别为2、4、6、8和10 μmol·L-1, 并且在不同pH条件下培养(7.4或6.5)。后续实验方法同上。
体外摄取实验 为考察pH敏感材料对细胞摄取的影响, 本研究使用共聚焦激光显微镜(confocal laser scanning microscope, CLSM) 观察4T1细胞对不同制剂的摄取情况。将4T1细胞以每孔1×106个接种于铺有盖玻片的6孔板中, 置于5% CO2、37 ℃细胞培养箱中培养12 h, 加入一定量的free FAM siRNA和FAM siR-NPs (FAM siRNA: 100 nmol L-1) 在pH 7.4或6.5条件下孵育4 h后, 用4%多聚甲醛固定细胞30 min, DAPI染细胞核后, 采用CLSM观察细胞摄取情况并拍照。
体外3D肿瘤细胞的深层递送考察 为了充分证明pH敏感材料对肿瘤深层递送的影响, 建立了4T1细胞的3D肿瘤模型[18-20]。用100 μL无菌琼脂糖溶液(2%, w/v) 覆盖96孔板中, 以每孔2×103个细胞数接种4T1细胞, 置于5% CO2、37 ℃细胞培养箱中培养。待4T1细胞的3D肿瘤球的直径长至300 μm时, 加入FAM siR-NPs (FAM siRNA: 100 nmol L-1) 分别在pH 7.4和6.5条件下共孵育4 h后, 采用CLSM观察并拍照。
体外诱导ICD作用 将4T1细胞在12孔板(2×105个/孔) 中培养过夜, 然后用PBS、DOX、DOX-NPs pH 7.4和DOX-NPs pH 6.5 (2 μmol·L-1 DOX) 处理24 h。收集条件培养基, 通过ELISA试剂盒检测ATP的水平。为了评估CRT暴露, 培养4T1细胞并用PBS、DOX和DOX-NPs制剂分别在pH 7.4和6.5条件下孵育24 h。然后用兔CRT一抗(0.1 μg·mL-1) 处理30 min, PBS冲洗后用FITC标记的抗兔IgG二抗(1 μg·mL-1) 处理20 min, 采用流式细胞仪定量检测CRT的表达。采用CLSM定性观察, 4%多聚甲醛固定细胞, DAPI染细胞核后, 采用CLSM观察CRT暴露情况并拍照。
体内药效学实验 将4T1细胞按照细胞条件培养, 待细胞处于对数生长期时, 将细胞消化制备成每毫升5×107个的细胞悬液, 每只BALB/c雌性小鼠[18~22 g; 质量合格证号: 211002300064979; 许可证号: SCXK (辽) 2020-0001] 右腋皮下接种0.2 mL细胞悬液, 约7天后选取同一批次肿瘤体积约为100 mm3的成瘤小鼠进行实验。动物实验操作过程依照沈阳药科大学动物实验伦理委员会的要求执行。
将荷瘤小鼠随机分成6组, 分别为生理盐水组、free siRNA组、DOX组、siR-NPs组、DOX-NPs组和DOX/siR-NPs组。每组按照5 mg·kg-1 DOX、1 mg·kg-1 siRNA的剂量尾静脉注射给药, 每2天1次, 共给药4次。治疗期间, 每4天对小鼠进行体重称量。
在实验结束后, 处死BALB/c小鼠并剥离肿瘤, 称取瘤重并拍照。另外, 在停止给药后, 每天检测小鼠的生存数量从而观察小鼠的生存状态, 绘制生存曲线并应用GraphPad Prism软件分析中位生存期。
组织学实验 将肿瘤剥离后立即用福尔马林固定过夜, 经石蜡包埋, 制成石蜡切块, 切至5 μm厚的石蜡切片, 二甲苯脱蜡, 分别经无水乙醇、95%、75%、50%、30%乙醇至水洗涤, 用H&E染色后再用梯度乙醇脱水, 二甲苯透明, 封片液封片, 置于倒置荧光显微镜下观察。
Ki67是一种增殖细胞相关的核抗原, 其功能与有丝分裂密切相关, 在细胞增殖中至关重要。Ki67常作为标记细胞增殖状态的抗原, 阳性说明癌细胞增殖活跃。依照Ki67试剂盒进行实验并拍照。
为了验证DOX的ICD作用, 以及与IDO1 siRNA的协同作用, 肿瘤组织进行一系列的组织学染色。肿瘤组织切片分别用抗IDO1-FITC抗体(IDO1蛋白), 抗CD8-FITC抗体(CD8+ T细胞) 和抗CD4-PE抗体(CD4+ T细胞) 染色。CRT蛋白的染色过程依照“体外诱导ICD作用”项中的实验流程操作。最后, 切片经DAPI染色后用CLSM拍照。
统计学方法 数据以平均值±标准差表示。统计显著性通过单因素方差分析(ANOVA) 确定, P < 0.05代表组间具有显著性差异。所有实验需要重复进行3次。
结果与讨论 1 制剂的处方优化和特征PAMAM树状大分子空腔内部具有较强的疏水性, 可包裹疏水性药物DOX, 形成DOX-PAM纳米粒。而PAMAM表面带有正电荷, 可通过静电相互作用吸附带有负电荷的IDO1 siRNA, 形成DOX/siR-PAM纳米粒, 之后与在pH 7.4条件下带有负电荷的pH敏感聚合物PLD正负电荷吸引, 制成DOX/siR-PLD/PAM (DOX/siR-NPs)。
采用琼脂糖凝胶实验考察N/P比对siRNA包封率的影响。如图 1A所示, 当N/P比为4时, siR-PAM组观察不到siRNA条带, 故确定优化处方siR-PAM组的N/P比为4。当在不同质量比条件下, DOX的包封率随DOX与PAMAM的质量比的增加而增加(图 1B), 当质量比为10时, 其包封率达到80%, 故确定优化处方的DOX与PAMAM的质量比为10。

|
Figure 1 A: Agarose gel electrophoresis analysis of different formulations with different N/P ratios. B: DOX entrapment efficiency (EE, %) verification with an increase of the weight ratio (DOX/PAM) of DOX-PAM group. C: DOX and siRNA EE% verification with an increase of the weight ratio (PLD/PAM) of DOX/siR-PLD/PAM group. D: Particle size and zeta potential verification with an increase of the weight ratio (PLD/PAM) of DOX/siR-PLD/PAM group. E: Transmission electron microscope (TEM) image and dynamic light scattering (DLS) result of DOX/siR-PLD/PAM group. Scale bar: 200 nm. F: Size distribution and zeta potential of DOX/siR-PLD/PAM group under diverse conditions. n = 3, |
制备DOX/siR-PAM纳米粒后, 在中性环境下与负电荷的PLD共聚物包裹, 形成DOX/siR-PLD/PAM纳米粒(DOX/siR-NPs)。如图 1C、D所示, 随PLD/PAM质量比增加, DOX和siRNA的包封率逐渐增加, 粒径也逐渐增加, 但是电位逐渐降低。当PLD/PAM质量比为5时, 其粒径为140.73 ± 1.65 nm, zeta电位为-7.73 ± 1.44 mV, 为负电荷, 可以显著提高其在血液中滞留的时间, 故确定PLD/PAM质量比为5。
TEM为观察纳米粒形态大小的一种重要手段。如图 1E所示, DOX/siR-NPs呈球形和类球形, 分布比较均一。其大小与DLS测定的结果较为相近。总之, 此纳米制剂的包封率较高; 粒径小于200 nm, 有利于增强渗透和保留(enhanced permeation and retention, EPR) 效应; zeta电位为负电荷, 延长制剂的血液循环时间; 外观圆整分布均匀。
2 pH敏感性测定为考察DOX/siR-NPs的pH敏感性, 将DOX/siR-NPs置于pH 6.5 PBS中, 4 h后测定zeta电位和粒径。结果如图 1F所示, 当pH从7.4变为6.5时, DOX/siR-NPs的粒径变小且zeta电位从负电荷转变为正电荷, 原因为修饰的PLD共聚物可以迅速从DOX/siR-NPs上面解离, 使zeta电位增加和粒径变小。
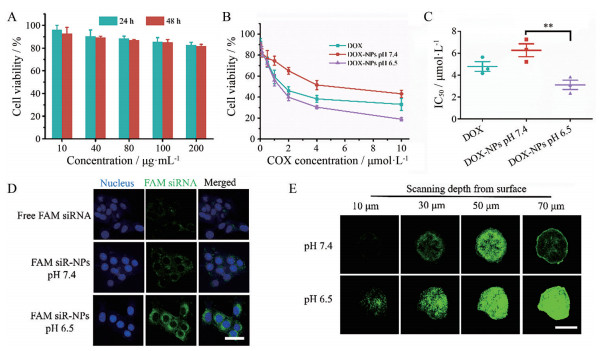
3 体外细胞毒性考察利用MTT实验考察空白载体对4T1细胞的毒性。结果如图 2A所示, 空白载体在孵育24和48 h后, 其均没有明显细胞毒性, 细胞存活率均在80%以上, 说明空白载体的细胞毒性很低, 生物相容性良好, 是安全无毒的纳米载体材料。
|
Figure 2 In vitro cell cytotoxicity of blank formulations (A) and different DOX-loaded for-mulations (B) against the 4T1 cell line under different conditions. C: 50% inhibiting concentration (IC50) value of DOX-NPs under different conditions. n = 3, |
不同制剂组对4T1细胞的细胞毒性和IC50值如图 2B、C所示。相比pH 7.4条件下的DOX-NPs溶液组, pH 6.5条件下的DOX-NPs组的细胞毒性显著提高。以上结果间接说明, PLD具有良好的pH敏感性, 在pH 6.5时, pH敏感的共聚物PLD从负电荷转变为正电荷, 可以与细胞表面微弱的负电荷相互结合, 更好地发挥作用。
4 细胞摄取实验为考察不同条件下的FAM siR-NPs对细胞的摄取情况, 采用CLSM进行定性观察。结果如图 2D所示, 在4 h时, free FAM siRNA组的荧光较弱, 说明细胞对游离的siRNA的摄取有限。对于siR-NPs组, 在pH 6.5条件下的摄取明显高于pH 7.4的摄取, 其原因可能为pH 6.5条件下PLD电荷反转, 迅速从纳米粒上面解离, 暴露出带有正电荷的siR-PAM NPs, 从而具有更强的细胞摄取量, 此结果验证了上述MTT实验的结果。以上结果表明, 在pH 6.5条件下, DOX-NPs的细胞毒性明显高于pH 7.4条件下的细胞毒性, 并且pH 6.5的siR-NPs的细胞摄取明显多于pH 7.4条件下的细胞摄取, 验证了制剂的pH敏感性。
5 体外肿瘤组织的渗透考察此纳米制剂的设计关键是通过可变大小和电荷反转材料实现肿瘤组织的高肿瘤渗透性, 因此, 研究了不同条件下的体外肿瘤穿透能力。如图 2E所示, 在pH 7.4下经过siR-NPs组(此处均用FAM siRNA) 处理4 h后, 在z轴距离为70 μm处可以观察到微弱的绿色荧光信号。相比之下, pH 6.5下的siR-NPs组显示了较强的绿色荧光, 结果表明, siR-NPs在微酸性环境下具有较高的肿瘤穿透性, 并且进一步验证了纳米粒pH敏感性的必要性。
6 体外诱导ICDDOX诱导ICD的能力通过检测CRT表达和ATP的细胞外释放来表征(图 3)。CRT是一种促凋亡蛋白, 在ICD期间充当APC的“吃我”信号。为了考察pH的变化对ICD的作用是否有影响, 空白对照组在不同pH条件下的CRT的阳性率及ATP的分泌量无差别, 结果说明pH不影响细胞的ICD作用。将4T1细胞与DOX-NPs孵育4 h后, CLSM实验结果表明4T1细胞的CRT阳性百分比的不同变化, 图 3A显示DOX-NPs在pH 6.5条件下具有较强的绿色荧光, 其表达较多的CRT蛋白。流式实验结果如图 3B所示, 当pH从7.4转变为6.5时, DOX-NPs组的CRT阳性的百分比从12%增至28%, 显示最强的CRT的表达。

|
Figure 3 A: CLSM examination of different DOX-loaded formulations CRT expression on the cell surface of 4T1 cells in vitro. Scale bar: 50 μm. B: Flow cytometric examination of CRT exposure on the surface of 4T1 cells. C: Quantitative determination of ATP secretion of 4T1 cells after treatment with different DOX-loaded formulations. n = 3, |
此外, 不同环境下的ATP分泌量也有所不同。当pH从7.4转变为6.5时, 4T1细胞的ATP的分泌量明显增多。总之, 这些结果验证了DOX可有效地诱导ICD, 并且进一步验证了纳米粒pH敏感性的必要性。
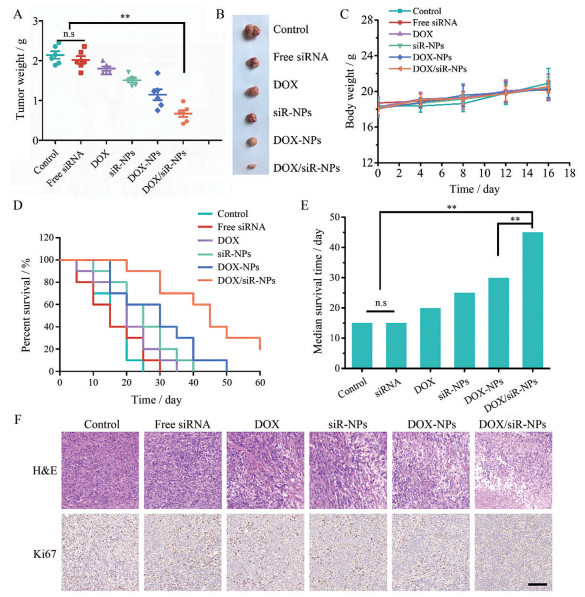
7 体内药效学实验肿瘤瘤重及图片如图 4A、B所示, 空白对照组及free siRNA溶液组几乎无差别, 其瘤重均高于2 g, 说明free siRNA可能会快速降解, 从而几乎没有抑瘤作用。相对于DOX-NPs组, DOX/siR-NPs组具有明显的抗肿瘤活性, 结果说明IDO1 siRNA的加入能协同DOX的ICD作用, 共同抑制肿瘤的生长。
|
Figure 4 Tumor weight (A), the image of tumors (B) and body weight (C) in 4T1 cell-bearing BALB/c mice. Survival curves (D) and median survival time (E) of 4T1 tumor-bearing mice after the treatment. n = 6, |
肿瘤治疗期间, 对体重进行监测。图 4C表明各个制剂组的小鼠体重均无明显变化并呈现微弱的上升趋势, 说明制剂对正常组织均没有明显的体内毒性, 载体制剂的安全性能良好。
在停止给药后, 每天检测小鼠的生存数量从而观察小鼠的生存状态及中位生存期。由图 4D、E可见, DOX/siR-NPs表现出更长的生存时间且中位生存期较长, 从而表明DOX和IDO1 siRNA的协同治疗作用。
H&E染色显示蓝紫色为细胞核, 粉红色为细胞质。对照组肿瘤细胞的细胞核较大, 并且细胞排列极不规律, 密集成群。在不同制剂组中, 细胞数目均存在不同程度减少, 坏死部分也存在不同程度增多, 其中DOX/siR-NPs组制剂的抑瘤效果最为明显(图 4F), 此结果与药效学实验结果一致。
Ki67是一种增殖细胞相关的核抗原, 阳性说明癌细胞增殖活跃。不同制剂对于肿瘤组织的增生情况的影响如图 4F所示。对照组Ki67呈现高表达(棕色斑点)。而不同的给药组均呈现了不同程度的肿瘤增生抑制, 其中DOX/siR-NPs组呈现出最为明显的抗增生活性。各实验组抗增生活性趋势与H&E染色相同。
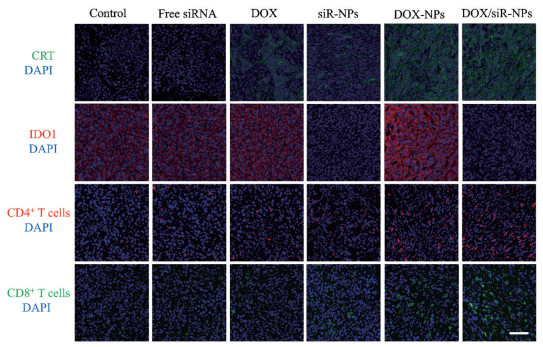
8 组织学研究本研究利用免疫荧光染色进一步研究了DOX的CRT暴露情况及IDO1 siRNA的IDO1抑制结果。除此之外, CLSM实验结果显示CD4+ T细胞和CD8+ T细胞在肿瘤中的数量。相较于对照组, DOX组的CRT有微弱的绿色荧光, 而siRNA包载的制剂组几乎没有荧光, 说明DOX的ICD作用。DOX/siR-NPs表现出更强的绿色荧光, 说明载体可以增强DOX的作用。为了观察IDO1 siRNA的作用效果, 利用免疫荧光染色考察IDO1蛋白的表达。结果如图 5所示, 对照组和free siRNA组无明显不同。然而, DOX组及DOX-NPs组的IDO1表达略有增加, 主要原因是ICD作用后CTL分泌的IFN-γ会增加IDO1的表达, 而IDO1 siRNA的协同作用会降低IDO1蛋白的表达, 调节肿瘤免疫抑制微环境, 增强DOX的ICD作用, 因此DOX/siR-NPs制剂的治疗效果最好。
|
Figure 5 Immunofluorescence examination of CRT exposure, IDO1 expression on the surface of 4T1 tumor, CD4+ T cells (red: CD4) and CD8+ T cells (green: CD8) in tumor sections after different treatments. Scale bar: 100 μm. PE: Phycoerythrin; FITC: Fluorescein isothiocyanate; DAPI: 4', 6-Diamino-2-phenyl indole |
为了更直观地观察免疫治疗, 利用CLSM考察CD8+ T细胞和CD4+ T细胞的数量变化。结果表明, 相对于对照组, DOX/siR-NPs组的CD8+ T细胞和CD4+ T细胞的数量均明显增多。结果显示, DOX/siR-NPs的化疗-免疫联合应用可以通过提高肿瘤细胞凋亡效率、提高纳米粒的肿瘤组织的高渗透率、提高CD8+ T细胞及CD4+ T细胞等多种手段, 从而实现最优的免疫治疗。
总之, DOX作用后会增加IDO1的表达, 而IDO1 siRNA的引入显著降低IDO1蛋白, 增强DOX的ICD作用。DOX/siR-NPs组的CD8+ T细胞和CD4+ T细胞明显多于DOX-NPs组, 进一步验证了IDO1 siRNA的协同作用增强了DOX的作用效果。
结论本文成功构建了一种多功能纳米平台, 该平台具有电荷转换和高渗透性的纳米载体, 包载DOX和IDO1 siRNA, 提高肿瘤的免疫治疗。该纳米载体主要是由PAMAM树状大分子内部疏水空腔包载DOX, IDO1 siRNA与PAMAM表面的正电荷正负电荷吸附。在pH 7.4时, 负电荷的pH敏感聚合物PLD包载在纳米载体的表面, 得到DOX/siR-NPs制剂。
当静脉注射给药时, DOX/siR-NPs由于PEG的空间位阻作用通过EPR效应积聚在弱酸性肿瘤组织中。肿瘤组织的弱酸性微环境刺激PLD共聚物发生电荷反转, 从而暴露出正电荷的DOX/siR-PAM纳米粒, 粒径减小, 能够深层地递送到肿瘤组织的深部, 增强肿瘤细胞的摄取, 释放DOX和IDO1 siRNA药物。DOX和IDO1 siRNA的联合作用会改善肿瘤免疫治疗, 从而显著抑制肿瘤生长。
作者贡献: 陈大为和史梦浩提供了研究思路, 所有作者参与了本项研究的设计, 史梦浩收集和分析数据并撰写了论文, 王瑜、韩妍妍、张九龙和吴诗洋负责修改文章, 陈大为负责文章选题和指导写作。
利益冲突: 所有作者声明本文无任何利益冲突。
| [1] |
Adams JL, Smothers J, Srinivasan R, et al. Big opportunities for small molecules in immuno-oncology[J]. Nat Rev Drug Discov, 2015, 14: 603-622. |
| [2] |
Li J, Wang H, Wang Y, et al. Tumor-activated size-enlargeable bioinspired lipoproteins access cancer cells in tumor to elicit anti-tumor immune responses[J]. Adv Mater, 2020, 32: 2002380. DOI:10.1002/adma.202002380 |
| [3] |
Huang ZY, Chen YY, Zhang JL, et al. Laser/GSH-activatable oxaliplatin/phthalocyanine-based coordination polymer nanoparticles combining chemophotodynamic therapy to improve cancer immunotherapy[J]. ACS Appl Mater Interfaces, 2021, 13: 39934-39948. DOI:10.1021/acsami.1c11327 |
| [4] |
Sun JJ, Wan ZY, Xu JN, et al. Tumor size-dependent abscopal effect of polydopamine-coated all-in-one nanoparticles for immunochemo-photothermal therapy of early- and late-stage metastatic cancer[J]. Biomaterials, 2021, 269: 120629. DOI:10.1016/j.biomaterials.2020.120629 |
| [5] |
Huang H, Jiang CT, Shen S, et al. Nanoenabled reversal of IDO1-mediated immunosuppression synergizes with immunogenic chemotherapy for improved cancer therapy[J]. Nano Lett, 2019, 19: 5356-5365. DOI:10.1021/acs.nanolett.9b01807 |
| [6] |
Röhrig UF, Reynaud A, Majjigapu SR, et al. Inhibition mechanisms of indoleamine 2, 3-dioxygenase 1 (IDO1)[J]. J Med Chem, 2019, 62: 8784-8795. DOI:10.1021/acs.jmedchem.9b00942 |
| [7] |
Dong MJ, Liu ZZ. Advances in research on inhibitors based on targets: IDO1 and TDO[J]. Acta Pharm Sin (药学学报), 2021, 56: 1265-1278. |
| [8] |
Wang T, Wen H, Cui HQ, et al. Research progress on indoleamine 2, 3-dioxygenase 1 (IDO1) inhibitors[J]. Acta Pharm Sin (药学学报), 2021, 56: 723-733. |
| [9] |
Chavez-Pena C, Kamen AA. RNA interference technology to improve the baculovirus-insect cell expression system[J]. Biotechnol Adv, 2018, 36: 443-451. DOI:10.1016/j.biotechadv.2018.01.008 |
| [10] |
Ratnayake G, Bain AL, Fletcher N, et al. RNA interference to enhance radiation therapy: targeting the DNA damage response[J]. Cancer Lett, 2018, 439: 14-23. DOI:10.1016/j.canlet.2018.09.011 |
| [11] |
Mali SB. RNA interference in oral cancer[J]. Oral Oncol, 2015, 51: e2-e3. DOI:10.1016/j.oraloncology.2014.09.018 |
| [12] |
Li J, Zhao M, Xu YH, et al. Hybrid micelles codelivering shikonin and IDO-1 siRNA enhance immunotherapy by remodeling immunosuppressive tumor microenvironment[J]. Int J Pharm, 2021, 597: 120310. DOI:10.1016/j.ijpharm.2021.120310 |
| [13] |
Zhang YJ, Fu JM, Shi YM, et al. A new cancer immunotherapy via simultaneous DC-mobilization and DC-targeted IDO gene silencing using an immune-stimulatory nanosystem[J]. Int J Cancer, 2018, 143: 2039-2052. DOI:10.1002/ijc.31588 |
| [14] |
Chen D, Koropatnick J, Jiang N, et al. Targeted siRNA silencing of indoleamine 2, 3-dioxygenase in antigen-presenting cells using mannose-conjugated liposomes: a novel strategy for treatment of melanoma[J]. J Immunother, 2014, 37: 123-134. DOI:10.1097/CJI.0000000000000022 |
| [15] |
Zhu J, Qiao MX, Wang Q, et al. Dual-responsive polyplexes with enhanced disassembly and endosomal escape for efficient delivery of siRNA[J]. Biomaterials, 2018, 162: 47-59. |
| [16] |
Wang HX, Yang XZ, Sun CY, et al. Matrix metalloproteinase 2-responsive micelle for siRNA delivery[J]. Biomaterials, 2014, 35: 7622-7634. |
| [17] |
Shi MH, Wang Y, Zhao XF, et al. Stimuli-responsive and highly penetrable nanoparticles as a multifunctional nanoplatform for boosting nonsmall cell lung cancer siRNA therapy[J]. ACS Biomater Sci Eng, 2021, 7: 3141-3155. DOI:10.1021/acsbiomaterials.1c00582 |
| [18] |
Yue EW, Sparks R, Polam P, et al. INCB24360 (epacadostat), a highly potent and selective indoleamine-2, 3-dioxygenase 1 (IDO1) inhibitor for immuno-oncology[J]. ACS Med Chem Lett, 2017, 8: 486-491. |
| [19] |
Wu HY, Yu MR, Miao YQ, et al. Cholesterol-tuned liposomal membrane rigidity directs tumor penetration and anti-tumor effect[J]. Acta Pharm Sin B, 2019, 9: 858-870. |
| [20] |
Shu M, Tang JJ, Chen LL, et al. Tumor microenvironment triple-responsive nanoparticles enable enhanced tumor penetration and synergetic chemo-photodynamic therapy[J]. Biomaterials, 2021, 268: 120574. |
 2022, Vol. 57
2022, Vol. 57


