原发性肝细胞癌(hepatocellular carcinoma, HCC) 是最常见的肝脏恶性肿瘤, 每年造成约70万人死亡。临床治疗方法主要包括手术切除、化学治疗、介入治疗和免疫治疗等, 然而临床肝癌的5年生存率仍不足15%, 探寻新的有效的药物联用方案是临床的迫切需求[1, 2]。近年来, 化学免疫联合治疗被高度重视, 并日益成为一种新兴的临床联合治疗方式。例如, 帕博利珠单抗、卡铂和培美曲塞联合治疗已经成为FDA批准的非小细胞肺癌一线治疗方案。在化学免疫联合治疗中, 化疗对肿瘤细胞具有快速、直接的杀伤作用; 免疫治疗则通过激活免疫系统发挥长期特异性的杀伤作用, 两者机制协同互补[3, 4]。基于此, 寻找有效的化疗免疫治疗方案提高肝癌的治疗效果是临床治疗的迫切需求[5, 6]。
在HCC的化学治疗中, 索拉非尼(sorafenib, SF) 是FDA首个批准用于临床的一线抗肝癌化疗药物[7, 8], 其可显著延长患者的中位生存期, 但有限(3~5个月)[9-11]。研究表明, SF对肿瘤血管的抑制作用能诱导肿瘤区域缺氧加重, 诱导免疫抑制使免疫治疗的效应T细胞失活, 从而导致SF抗肿瘤效果难以满足预期[12-14]。目前程序性死亡配体-1 (programmed cell death 1 ligand 1, PD-L1) 阻断疗法已经用于肝癌的免疫治疗中, 并展现了良好的效果, 但其响应率仍较低。T细胞免疫球蛋白和黏蛋白结构域3 (T-cell immunoglobulin and mucin domain 3, Tim-3) 是PD-L1、细胞毒性T细胞相关蛋白-4 (cytotoxic T lymphocyte associate protein-4, CTLA-4) 之外最有前景的免疫检查点之一, 并于2020年获批在中国进行临床试验[15]。研究表明, Tim-3在HCC组织中的异常表达与肿瘤的侵袭、转移密切有关。当T细胞表面表达的Tim-3与肝癌细胞膜上高表达的半乳糖凝集素-9 (galectin-9) 结合后, 可诱导T细胞耗竭抑制抗肿瘤免疫, 是造成肝癌治疗的不良预后的重要因素[16]。利用Tim-3单抗阻断Tim-3通路, 可增强T细胞免疫, 并促进T细胞产生干扰素-γ (interferon-γ, IFN-γ), 调节HCC免疫抑制微环境。因此, 为实现更好的协同抗肝癌效果, SF与Tim-3单抗的联合有望逆转SF对T细胞的抑制作用, 具有良好的联合应用前景。目前, Tim-3单抗在肝癌化学免疫联合治疗的研究尚处于早期, 其研究有助于寻找新型化学免疫治疗联用药物组合。
为提高SF与Tim-3单抗的协同作用, 使用纳米药物递送载体共递送SF和Tim-3单抗有利于达到最佳的联合治疗效果。目前, 多种纳米载体[17, 18], 如无机纳米载体[19]、脂质体[20]和聚合物胶束[21]等被广泛应用于药物的共递送, 并展现出良好的联合治疗效果。在本研究中, SF需要被递送至肿瘤细胞, 而Tim-3单抗需要被递送至T细胞, 因此, 制备能够将共载药物递送到对应作用细胞的纳米载体具有重要的研究价值。基于此, 本课题设计具有金属基质蛋白酶2 (matrix metallopeptidase 2, MMP2) 响应性介孔二氧化硅纳米粒(mesoporous silica nanoparticles, MSNs) 共装载SF和Tim-3单抗(ST-MSNs), Tim-3单抗通过MMP2敏感肽连接于MSN表面作为封堵外壳(示意图 1)。在肿瘤微环境高MMP2浓度中Tim-3单抗“响应脱壳”, 实现SF和Tim-3单抗定位分离释放和对肿瘤细胞/T细胞的药物分别递送。本研究通过细胞共培养实验和肿瘤组织切片, 观察SF和Tim-3单抗对肿瘤细胞和T细胞的递送能力; 通过荷瘤小鼠体内药效实验, 评价ST-MSNs的体内药效学性质; 通过测定血清和瘤内的相关细胞因子和效应细胞, 评价ST-MSNs调节肿瘤免疫的能力; 通过给药后小鼠体重变化、溶血实验和组织H&E染色, 评价ST-MSNs的初步安全性。
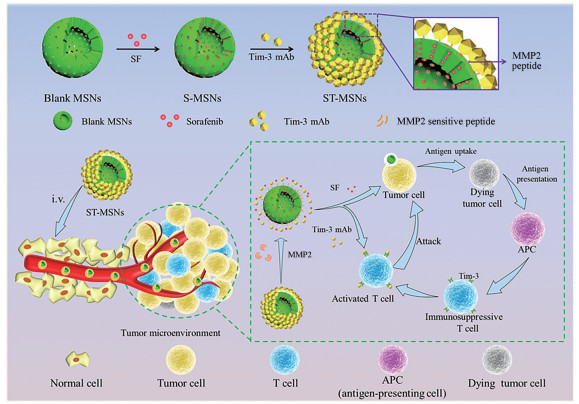
|
Scheme 1 Illustration of the preparation of sorafenib (SF) and anti-Tim-3 monoclonal antibody (Tim-3 mAb) co-loaded matrix metalloproteinase 2 (MMP2) responsive mesoporous silica nanoparticles (ST-MSNs) for cancer chemoimmunotherapy. Tim-3 mAb was capped on the surface of ST-MSNs through MMP2 sensitive peptides. When ST-MSNs entered to the tumor microenvironment, the responsively crack of MMP2 sensitive peptide induce the responsively release of Tim-3 mAb and SF, therefore, SF could be delivered to tumor cells and Tim-3 mAb could be delivered to T cells, respectively. The enhanced chemoimmunotherapeutic was achieved |
材料 四乙氧基硅烷(TEOS, 上海国药化学试剂有限公司); 十六烷基三甲基溴化铵(CTAB, 天津大茂化学试剂厂); 3-氨基丙基三乙氧基硅烷(APTES)、香豆素6 (C6, 上海阿拉丁生物化学技术有限公司); SF (上海Biochempartner公司); MMP2敏感肽、Mal-pep-COOH (南京莱昂生物科技有限公司); 大鼠抗小鼠Tim-3单抗、FITC标记抗小鼠Tim-3单抗、Alexa Fluor 647标记的抗小鼠Tim-3单抗(美国BioLegend公司); CD3抗体(塞维尔生物科技有限公司); 2-亚氨基硫烷盐酸盐(Traut's试剂, 美国Sigma公司); 3-(4, 5-二甲基噻唑-2)-2, 5-二苯基四氮唑溴盐(MTT)、1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC)、牛血清白蛋白(BSA, 美国Sigma-Aldrich公司); DiI细胞膜红色荧光探针、增强型BCA试剂盒(碧云天生物技术有限公司); 小鼠IL-12 p70 ELISA试剂盒(美国ABclonal Biotechnology公司); 所有其他化学品均为分析试剂级。
仪器 TU-1810型紫外可见分光光度计(北京普析通用仪器有限责任公司); 1200 series高效液相色谱仪(美国安捷伦公司); 电泳仪、凝胶成像系统(美国Bio-Rad公司); 激光共聚焦显微镜(confocal laser scanning microscope, CLSM, 德国ZEISS公司); MultiskanTM GO全波长酶标仪(赛默飞世尔科技有限公司); 小动物近红外荧光活体成像系统(美国Caliper Life Science公司); 高分辨透射电镜(transmission electron microscope, TEM, JEM-1200EX, 日本电子公司); zeta电位分析仪(Nano ZS-90, 英国Malvern公司); 氮气吸附及比表面分析仪(Autosorb-iQ, 美国康塔公司); 傅里叶变换红外光谱法(Fourier transform infrared, FTIR, 6700 FTIR NXRFT-Raman, 美国赛默飞公司); 热重分析仪(thermal gravimetric analyzer, TGA, Diamond TG/DTA, 美国PerkinElmer公司); 小角度X射线散射仪(X-ray diffraction, XRD, SAXSess mc2, 奥地利安东帕公司); 脱盐柱(Thermo Scientific-Pierce公司)。
ST-MSNs的合成
MSNs的合成 取CTAB 0.2 g、H2O 100 mL和2 mol·L-1 NaOH 720 μL加入250 mL烧瓶中, 搅拌并加热至80 ℃, 缓慢滴加TEOS 1.0 mL (0.05 mL·min-1) 并剧烈搅拌, 滴加结束后继续恒温搅拌2 h, 离心收集白色固体沉淀物, 用水和乙醇各洗涤3次, 真空干燥, 在550 ℃下煅烧5 h, 去除CTAB。
MSNs-NH2的合成 取MSNs 40 mg超声分散于蒸馏水中, 加热至80 ℃, 在MSNs悬浮液中加入0.06 mmol APTES, 于80 ℃、N2保护下搅拌反应1 h, 8 000 r·min-1离心20 min收集固体产物, 用乙醇洗涤, 5 000 r·min-1离心10 min, 真空干燥, 得到氨基修饰MSNs (MSNs-NH2)。
MSNs-pep的合成 将0.02 mmol Mal-pep-COOH溶解于少量的二甲基甲酰胺中, 加入0.044 mmol EDC搅拌30 min。然后, 向上述Mal-pep-COOH溶液中加入MSNs-NH2 40 mg和0.044 mmol三乙胺, 在氮气保护下反应过夜。反应结束后, 用乙醇洗涤, 5 000 r·min-1离心10 min, 收集沉淀, 得MSNs-pep。
S/MSNs-pep的制备 取MSNs-pep 40 mg超声分散于10 mL SF甲醇溶液(1 mg·mL-1) 中, 室温搅拌24 h, 离心分离得到装载SF的MSNs (S/MSNs-pep), 甲醇冲洗。采用高效液相色谱法测定离心上清液中SF的浓度。
ST-MSNs的制备 首先使用Traut's试剂对Tim-3单抗进行巯基化。Tim-3单抗与Traut's试剂在磷酸缓冲盐溶液(PBS, pH 7.8~8.0, 含4 mmol·L-1 EDTA) 中以摩尔比1∶20在室温下反应1 h, 用脱盐柱纯化得到硫基化Tim-3单抗。然后, 取S/MSNs-pep 40 mg超声分散在含4 mmol·L-1 EDTA的PBS缓冲液(pH 7.8~8.0) 中, 加入硫基化Tim-3单抗5 mg, 4 ℃反应过夜, 8 000 r·min-1离心去除游离Tim-3单抗, 得到ST-MSNs。用增强型BCA试剂盒测定原液和上清液中Tim-3单抗的浓度。同法利用BSA代替Tim-3单抗制备单载SF纳米系统(S-MSNs)。
表征 通过TEM观察纳米粒外观形态及粒径; zeta电位分析仪测定zeta电位; 氮气吸附及比表面分析仪表征孔径及孔体积; FTIR表征载体的构建; TGA测定纳米粒失重百分数; XRD表征MSNs介孔有序性。
酶消化法 用Ⅳ型胶原酶酶解MMP2敏感肽, 将1 mg·mL-1 MMP2敏感肽与Ⅳ型胶原酶在pH 7.4 PBS中37 ℃孵育24 h, Ⅳ型胶原酶浓度分别设为0、1、10和50 μg·mL-1。采用高效液相色谱法在214 nm波长处测定MMP2敏感肽的含量变化。
SF和Tim-3单抗的体外释放 使用透析法考察SF溶液、S-MSNs和ST-MSNs中SF的释放性质。首先, SF溶液、S-MSNs和ST-MSNs分散于释放介质(含30%异丙醇的PBS溶液, pH 7.4) 并置于透析袋中(MWCO 8 000~14 000 Da); 然后, 将上述透析袋置于10 mL释放介质, 于37 ℃恒温水浴中震荡(100 r·min-1)。在预定时间点, 取出全部透析袋外释放介质, 更换新鲜释放介质10 mL。采用高效液相色谱法测定SF的含量。同时各组设置加酶(50 μg·mL-1 Ⅳ型胶原酶) 对照组, 研究MMP2敏感释药性质。
采用离心法考察Tim-3单抗的释放性质。将ST-MSNs分散在1 mL含或不含50 μg·mL-1 Ⅳ型胶原酶的PBS (pH 7.4) 中, 置于37 ℃、100 r·min-1的恒温水浴震荡仪。在预定的时间点, 2 000 r·min-1离心分离上清液, 分别使用增强型BCA试剂盒和聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis, SDS-PAGE) 方法对Tim-3单抗的释放进行测定。
细胞与细胞培养 人肝癌细胞HepG2和人白血病T细胞Jurkat使用含10%胎牛血清的RPMI-1640培养基培养。培养条件为37 ℃、5% CO2。小鼠肝癌细胞H22在小鼠腹水中培养。实验中使用的细胞均处于对数生长期。
细胞毒性实验 MSNs、SF、Tim-3单抗、S-MSNs和ST-MSNs的细胞毒作用使用MTT法测定。HepG2细胞以5×103个/孔细胞数接种于96孔板中, 培养12 h使细胞贴壁。H22细胞以1×104个/孔细胞数接种于96孔板中。各孔加入相应浓度的样品, 孵育48 h后, 每孔加入20 μL MTT溶液(5 mg·mL-1) 继续孵育4 h, 离心弃除上清液, 每孔加入DMSO 150 μL, 置摇床上振荡10 min以充分溶解甲臜结晶。使用酶标仪测定570 nm波长下各孔吸光度(A) 值, 计算各组细胞存活率。
共培养实验 首先制备共载DiI和FITC标记Tim-3单抗的纳米系统(DT-MSNs) 用于共培养实验, 其中DiI代替SF。HepG2细胞培养过夜, 使细胞贴壁后, 将Jurkat细胞以2∶1的细胞比例加入HepG2细胞中。DT-MSNs与50 μL·mL-1 Ⅳ型胶原酶在37 ℃孵育4 h后加入共培养的细胞中。培养2 h后, 分离Jurkat细胞和HepG2细胞, 分别使用CLSM和CytoFLEX流式细胞仪进行定性定量分析。
动物和肿瘤模型 6~8周龄的BALB/c小鼠, 雌雄各半, 由山东大学医学动物实验中心提供。于小鼠右腋皮下注射含1×106 H22的细胞悬液0.1 mL, 建立小鼠荷瘤模型, 用于小动物成像及药效实验。所有动物实验均按《中华人民共和国卫生部动物管理办法》和《山东大学动物实验伦理审评》 (19030号) 执行。通过测量肿瘤的长度(L) 和宽度(W), 根据公式(1) 计算肿瘤体积(V); 采用抑瘤率(IR) 来评价其抗肿瘤效果, IR按照公式(2) 计算。
| $ V = (L × W^{2}) / 2 $ | (1) |
| $ {\rm{IR}} (\%) = (W_{{\rm{C}}} - W_{t}) / W_{{\rm{C}}} × 100\% $ | (2) |
其中, Wt和WC分别是治疗组和生理盐水对照组的平均肿瘤重量。
小动物活体成像 通过小动物成像实验考察ST-MSNs的体内分布情况。选择具有良好的皮肤穿透性的疏水性染料IR780代替疏水药物SF制备I-MSNs和IT-MSNs, 待荷瘤小鼠肿瘤长至200~300 mm3左右时, 分别尾静脉注射0.1 mL的IR780溶液、I-MSNs和IT-MSNs (每只30 μg)。在4、8、12和24 h后, 将小鼠麻醉放入扫描观察。24 h后将小鼠处死并分离主要脏器及肿瘤, 再次扫描观察。结果使用Living Image 3.1处理。
肿瘤切片分析 H22荷瘤小鼠尾静脉注射CT-MSNs (香豆素-6取代SF, FITC标记Tim-3单抗), 8 h后处死小鼠。剥离肿瘤, 以10 μm厚度进行环切, 切片分别用Alexa Fluor647标记的Tim-3二抗、CD3抗体和Cy3标记的CD3二抗进行染色, 细胞核用DAPI染色。染色后, 采用激光共聚焦扫描显微镜成像。
体内抗肿瘤效果 将荷瘤小鼠随机分为8组, 分别为NS (每只0.2 mL)、MSNs (每只0.2 mL)、SF溶液、Tim-3单抗、SF+Tim-3单抗、T-MSNs (仅装载Tim-3单抗的MSNs)、S-MSNs和ST-MSNs组, 每组6只。采用尾静脉注射, SF剂量为10 mg·kg-1, Tim-3单抗剂量为7.5 mg·kg-1, 每7天给药1次。每4天记录1次体重和肿瘤大小。25天后, 所有小鼠眼球采血, 3 000 r·min-1离心分离血清。取肿瘤和主要器官, 称重量。
取肿瘤及主要脏器(心、肝、脾、肺、肾) 用4%甲醛固定, 石蜡包埋。用H&E染色检测脏器组织和肿瘤组织的组织学变化。通过Ki-67法、H&E染色法及TUNEL染色法对肿瘤细胞增殖及凋亡能力进行评价。
肿瘤中CD3+CD4+细胞和CD3+CD8+细胞的检测 使用流式细胞仪检测肿瘤组织中CD3+CD4+细胞和CD3+CD8+细胞的百分率。取上述肿瘤组织, 通过铜网挤压后分散于pH 7.4的PBS中, 100 ×g离心5 min。取上清液后, 于600 ×g离心5 min, 收集沉淀细胞, 以60% Percoll溶液重新分散, 800 ×g离心25 min后吸取提纯的T细胞层。加入PBS (pH 7.4) 重新分散, 800 ×g离心5 min, 沉淀为提纯的T细胞。加入大鼠血清10 μL, 4 ℃封闭30 min, 进行相应的抗体标记后, 采用流式细胞仪检测。
IFN-γ和IL-12测定 采集血清和新鲜脾脏组织, 用于细胞因子浓度的定量测定。采用酶联免疫吸附(ELISA) 试剂盒检测细胞因子IFN-γ和白细胞介素-12 (interleukin-12, IL-12) 浓度。取上述小鼠脾脏组织和血清标本。将脾脏组织匀浆后反复冻融破细胞膜。将破细胞膜后的匀浆液于3 000 ×g离心5 min, 取上清检测; 血清样品离心后即可检测。
溶血实验 取添加肝素抗凝的新鲜兔血, 购自山东大学实验动物中心, 通过1 000 ×g离心收集红细胞, 并将其重新悬浮在生理盐水中, 制成2%红细胞悬液。将不同浓度的ST-MSNs样品与相同体积的2%红细胞悬液混合。设蒸馏水为阳性对照, 生理盐水为阴性对照。所有样品在37 ℃下温育3 h, 100 ×g离心5 min, 用紫外-可见分光光度计测定上清液中血红蛋白的A值。
统计学分析 使用ANOVA进行统计分析, 定量数据均以平均值±标准差(
将Tim-3单抗通过MMP2敏感肽连接到S-MSNs表面制备ST-MSNs。透射电子显微镜显示空白MSNs、S-MSNs和ST-MSNs均呈球形, 粒径分别为115、115和150 nm (图 1A)。空白MSNs显示出良好的介孔结构(图 1A-a) 和高度有序的晶格阵列(图 1B)。ST-MSNs (图 1A-c) 与空白MSNs相比, 孔道结构模糊, 表面较粗糙, 表明药物的成功装载。与S-MSNs (图 1A-b) 相比, ST-MSNs的粒径从115 nm增大到150 nm, 而在50 μg·mL-1 Ⅳ型胶原酶作用下, ST-MSNs的粒径又减小到115 nm (图 1A-d), 表明Tim-3单抗的成功修饰与响应脱离。

|
Figure 1 Successful preparation of ST-MSNs. A: Transmission electron microscope (TEM) images of blank MSNs (a), S-MSNs (b), ST-MSNs (c) and ST-MSNs pre-incubated with 50 μg·mL-1 collagenase type Ⅳ for 4 h to cleave SF the peptide linker (d); B: Low angle X-ray diffraction (XRD) patterns; C: Fourier transform infrared (FTIR) spectra; D: Nitrogen adsorption-desorption isotherms (STP, standard temperature and pressure); E: Barrett-Joyner-Halenda pore size distribution; F: Thermal gravimetric analyzer (TGA) curves |
采用FTIR技术对ST-MSNs的制备过程进行表征(图 1C)。与空白MSNs相比, MSNs-NH2在1 557 cm-1处有一个新的吸收峰, 这归因于酰胺和-NH2弯曲的伸缩振动, 证实了MSNs-NH2表面存在氨基。MSNs-pep在1 646和1 547 cm-1处出现新的谱带, 分别归因于MMP2敏感肽肽键的二级酰胺C=O伸缩振动和N-H弯曲振动。此外, ST-MSNs在2 851和2 952 cm-1处出现了代表Tim-3单抗中C-H键骨架振动的峰, 证实了Tim-3单抗的共轭作用, 表明MMP2敏感肽和Tim-3单抗已成功连接到空白MSNs的表面。
空白MSNs的N2吸附脱附等温线呈现典型的Ⅳ型等温线(图 1D)。空白MSNs孔径分布较窄, 其中孔尺寸为3.4 nm (图 1E), 而ST-MSNs中孔尺寸无法检测, 说明SF装载和Tim-3单抗封堵了ST-MSNs的介孔。热重分析实验结果也证实MSNs系统中有机物的存在(图 1F), 根据失重结果可推测S-MSNs-pep中装载了14.86% SF, ST-MSNs中装载了10.5% Tim-3单抗。
2 SF和Tim-3单抗的响应释放肿瘤微环境中高表达的MMP2触发SF和Tim-3单抗的定位分离。为评价MMP2多肽的敏感性, 采用高效液相色谱进行酶解实验(图 2A)。在HPLC图谱中观察到两个新的峰(tR = 8.6和10.8 min), MMP2敏感肽的峰(tR = 17.4 min) 随着Ⅳ型胶原酶浓度的增加而消失, 表明MMP2敏感肽在Ⅳ型胶原酶的存在下具有“裂解性”[22]。
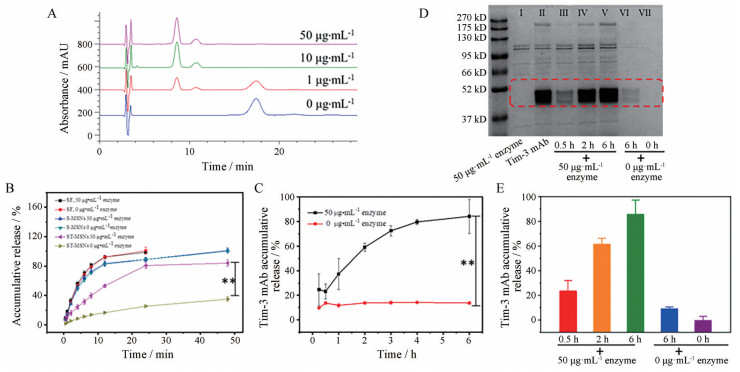
|
Figure 2 SF and Tim-3 mAb showed enzyme-sensitive in vitro release property from ST-MSNs. A: Cleavage assays of the MMP2 sensitive peptide. The HPLC chromatograms of the peptide pre-treated with the collagenase type Ⅳ at different concentrations (0, 1, 10 and 50 μg·mL-1) in phosphate-buffered saline (PBS) buffer at 37 ℃ for 24 h; B: The release profiles of SF from SF solution, S-MSNs and ST-MSNs in PBS buffer (pH 7.4, containing 30% isopropanol); C: The release profiles of Tim-3 mAb from ST-MSNs in PBS buffer (pH 7.4) with or without the collagenase type Ⅳ; D: The representative SDS-PAGE image of Tim-3 mAb released from ST-MSNs in PBS buffer (pH 7.4) with or without the collagenase type Ⅳ; E: Semi-quantitative analysis of Tim-3 mAb from SDS-PAGE electrophoresis strip by Image Lab. n = 3, |
为考察MMP2介导的SF和Tim-3单抗的释放, 在有或无Ⅳ型胶原酶的情况下测定体外释放, 酶浓度参考肿瘤微环境中的MMP2浓度。在Ⅳ型胶原酶存在时, ST-MSNs的SF释放在48 h内显著高于无酶的ST-MSNs (P < 0.01), 表明Ⅳ型胶原酶触发SF的释放(图 2B)。同样, 在无Ⅳ型胶原酶时, 6 h内只有13.7%的Tim-3单抗被检测到, 而在与Ⅳ型胶原酶孵育前15 min, 24.7% Tim-3单抗从ST-MSNs中释放出来, 近84.3% Tim-3单抗在6 h内被释放(图 2C)。结果表明, Tim-3单抗和MSNs之间的特异性MMP2敏感肽链可以被Ⅳ型胶原酶有效地切割, 从而致使Tim-3单抗的酶敏感“响应脱壳”和快速释放。SDS-PAGE检测释放的Tim-3单抗(图 2D), 释放的Tim-3单抗条带与天然Tim-3单抗的条带一致, 说明这种酶催化的多肽降解对Tim-3单抗的分子质量没有影响。此外, 使用Image Lab软件对条带进行半定量(图 2E)。50 μg·mL-1酶作用6 h后Tim-3的累积释放量明显高于未加酶组(P < 0.01)。
3 异靶点共递送评价以人白血病T细胞Jurkat细胞作为肿瘤浸润T细胞模型, 进行T细胞与肿瘤细胞的共培养实验(图 3A)。首先, 通过免疫荧光法测定Jurkat细胞和HepG2细胞表面Tim-3表达情况(图 3B)。结果发现, Jurkat细胞膜上有明显的Tim-3绿色荧光, 而HepG2膜上无明显的Tim-3绿色荧光, 表明Jurkat细胞为Tim-3高表达细胞, 表达量高于HepG2。
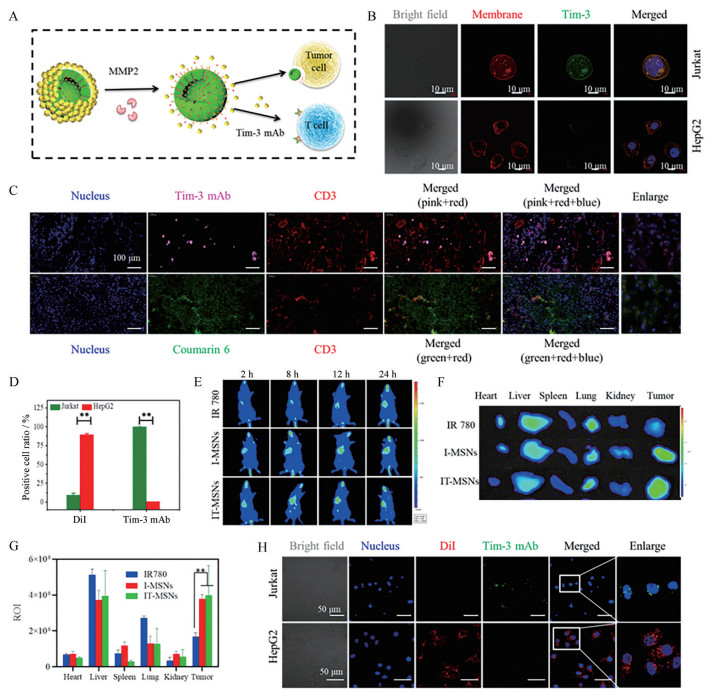
|
Figure 3 SF and Tim-3 mAb showed xenotype cell delivery to tumor cells and T cells, respectively, by ST-MSNs both in vitro and in vivo. A: Schematic diagram of ST-MSNs delivery to tumor cells and T cells; B: Tim-3 expression on HepG2 and Jurkat cells. Representative confocal laser scanning microscope (CLSM) images of the Jurkat and HepG2 cells after immunofluorescence staining with the FITC labeled Tim-3 antibody. The cell membranes were stained with DiI, the cell nucleuses were stain with Hochest 33342. Green: Tim-3. Red: Cell membrane. Blue: Cell nucleus. Scale bars indicate 10 μm; C: CLSM images of tumor cryo-sections. SF was substituted by coumarin 6. Tim-3 mAb was visualized by staining with Alexa Fluor 647 labeled Tim-3 mAb secondary antibody. The T cells were stained with the CD3 antibody and the Cy3 labeled CD3 secondary antibody. Pink: Tim-3 mAb. Green: Coumarin 6. Red: CD3. Blue: Cell nucleus. The magnification was 200×. Scale bars indicate 100 μm; D: The flow cytometry analysis of co-culture assay; E: In vivo imaging of mice after administration with free IR780, I-MSNs, and IT-MSNs at different time intervals; F, G: Ex vivo imaging (F) and relative fluorescence intensity (ROI, region of interest) (G) of main organs and tumor after mice were sacrificed at 24 h post administration; H: CLSM images of co-culture assay of Jurkat cells and HepG2 cells incubated with DT-MSNs. SF was substituted by DiI. Tim-3 mAb was labeled with FITC. Green: Tim-3. Red: DiI. Blue: Cell nucleus. Scale bars indicate 50 μm. n = 3, |
Jurkat细胞和HepG2细胞与DT-MSNs共培养2 h后, 激光共聚焦显微镜观察到DT-MSNs携带的DiI和Tim-3单抗在HepG2和Jurkat细胞中的分布有明显差异(图 3C), 绿色荧光主要出现于Jurkat细胞, 而红色荧光主要出现于HepG2细胞, 这说明DT-MSNs中Tim-3单抗主要靶向于Jurkat细胞, 而DiI主要被HepG2细胞摄取或吸收, 表明DT-MSNs具有异靶点药物共递送能力。此外, 通过流式细胞仪对DT-MSNs的异靶点递送能力进行定量分析(图 3D), Jurkat细胞中FITC阳性细胞比例显著高于HepG2细胞(P < 0.01), 且HepG2细胞中DiI阳性细胞比例显著高于Jurkat细胞(P < 0.01), 与共聚焦定性结果一致。以上结果说明, 本课题设计的MMP2酶响应型药物控释系统具有将化疗药物SF递送至肿瘤细胞, 而将免疫检验点抑制剂Tim-3单抗递送至T细胞的潜力, 可实现药物的异靶点共递送。
采用小动物成像对ST-MSNs的体内分布进行考察(图 3E~G)。由图可知, I-MSNs组(包载IR780) 和IT-MSNs组(共载IR780和Tim-3单抗) 在肿瘤部位的荧光强度显著高于IR780组(P < 0.01), 表明ST-MSNs可以增加SF和Tim-3单抗的肿瘤靶向递送。此外, 在小鼠体内考察了ST-MSNs的异靶点递送能力(图 3H)。将疏水染料C6装载到MSNs中以代替SF, 用AF647标记的Tim-3单抗。小鼠尾静脉注射8 h后, 取肿瘤组织进行切片和免疫荧光观察, T细胞使用CD3+细胞表示。如图 3H所示, 粉色荧光与绿色荧光分布情况不同, 表明Tim-3单抗和C6在肿瘤部位实现了分离。粉色荧光与红色荧光具有良好的重合性, 表明Tim-3单抗可作用于肿瘤部位的T细胞; 绿色荧光与蓝色荧光分布相似, 表明C6主要分布于肿瘤细胞, 以上结果验证了ST-MSNs的体内异靶点递送能力。
4 ST-MSNs抑瘤效果评价采用MTT法测定ST-MSNs对HepG2和H22细胞的体外杀伤作用。首先考察Tim-3单抗的体外细胞毒性。游离Tim-3单抗在各实验浓度下, 细胞存活率均高于80%, Tim-3单抗对肿瘤细胞增殖无明显影响。然后, 分别测定SF、S-MSNs和ST-MSNs对HepG2细胞和H22细胞的体外细胞毒作用(图 4A、B)。HepG2细胞和H22细胞存活率均随SF浓度升高而下降, 表现为明显的剂量依赖性, 与SF组相比, S-MSNs和ST-MSNs在所有浓度下48 h的细胞存活率无显著性差异(P > 0.05)。ST-MSNs对HepG2细胞的半数抑制浓度(IC50 = 10.09 ± 0.50) 与游离SF的IC50 (9.36 ± 0.16) 相似(P > 0.05), 且与S-MSNs组的IC50 (9.23 ± 0.79) 相似, 说明SF在ST-MSNs中的装载不影响SF的细胞毒性。
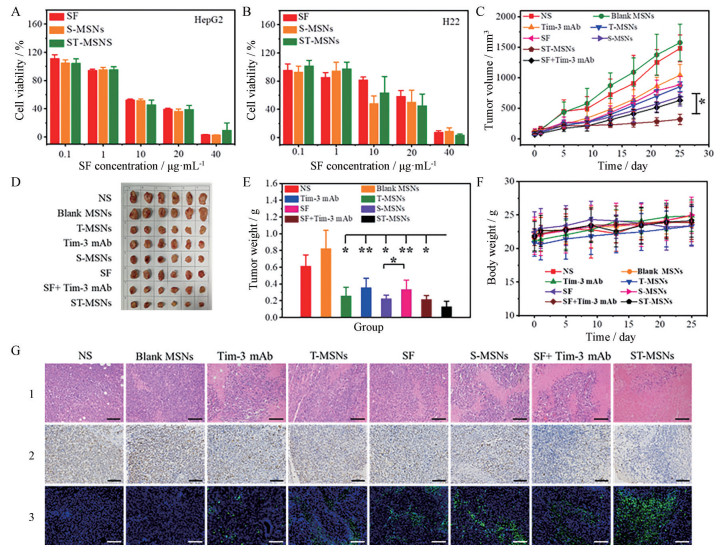
|
Figure 4 ST-MSNs significantly enhanced in vitro and in vivo antitumor efficiency. A: Cell viability on the human hepatocarcinoma cell line HepG2; B: Cell viability on the mouse hepatocarcinoma cell line H22; C: The tumor growth curves of tumor-bearing mice; D: Photograph of tumors excised from each treatment group in vivo tumor inhibition experiments; E: Variation of tumor weight; F: Mice body weight changes; G: Cell proliferation and apoptosis analyses of tumor tissues. 1: H&E; 2: Ki-67; 3: TUNEL. Scale bars indicate 100 μm. n = 6, |
利用荷H22肿瘤BALB/c小鼠模型评价ST-MSNs的体内抗肿瘤效果(图 4C)。与NS组相比, SF组、S-MSNs组、Tim-3单抗组、T-MSNs组、SF+Tim-3单抗溶液组和ST-MSNs组均能明显抑制肿瘤生长(P < 0.05)。SF+Tim-3单抗溶液组的抑瘤率为65.3%, 明显高于SF组(抑瘤率45.6%) (P < 0.05), 说明Tim-3单抗能增强抗肿瘤作用, 同时, ST-MSNs组(抑瘤率79.4%) 与S-MSNs组(抑瘤率63.7%) 比较也具有明显增强作用(P < 0.05)。与SF+Tim-3单抗溶液组相比, ST-MSNs组的抑瘤率显著提高(P < 0.05), 说明ST-MSNs能够增强协同治疗效果。药效结束后, 小鼠肿瘤拍照结果和瘤重结果同样表明ST-MSNs具有最佳抗肿瘤效果(图 4D、E)。同时, 在ST-MSNs治疗过程中, 小鼠体重未发生明显变化(图 4F)。
为进一步评价ST-MSNs在动物体内的肿瘤抑制效率, 通过Ki-67法、H&E染色法及TUNEL染色法对肿瘤细胞增殖及凋亡能力进行评价(图 4G)。在ST-MSNs治疗后, H&E染色的肿瘤组织图像(图 4G-1) 显示, 肿瘤细胞大量消退; Ki-67图显示ST-MSNs组肿瘤细胞增殖受到明显抑制(图 4G-2); TUNEL染色的荧光图像显示(图 4G-3), FITC染色的凋亡DNA片段化程度最高。
5 ST-MSNs的免疫治疗评价为评价肿瘤部位ST-MSNs对T细胞增殖的影响, 采用流式细胞仪检测肿瘤组织中CD3+CD4+ T细胞和CD3+CD8+ T细胞的含量(图 5A、B)。与NS组比较, SF组和S-MSNs组肿瘤组织中CD3+CD4+ T细胞和CD3+CD8+ T细胞明显减少(P < 0.05), 表明SF能够明显抑制T细胞增殖。Tim-3单抗组和T-MSNs组肿瘤组织中的CD3+CD4+ T细胞和CD3+CD8+ T细胞百分率明显高于NS组(P < 0.05), 表明Tim-3单抗对瘤内T细胞的增殖有促进作用。SF+Tim-3单抗组和ST-MSNs组CD3+CD4+ T细胞百分比与Tim-3单抗组和T-MSNs组比较无显著性差异(P > 0.05)。SF+Tim-3单抗组和ST-MSNs组肿瘤组织中CD3+CD8+ T细胞百分率明显高于Tim-3单抗组和T-MSNs组(P < 0.01), 表明SF与Tim-3单抗联合具有逆转SF诱导的T细胞增殖抑制的能力。与SF+Tim-3单抗组相比, ST-MSNs组CD3+CD8+ T细胞比例明显增高, 这可能是由于ST-MSNs在体内具有更好的协同递送能力导致。
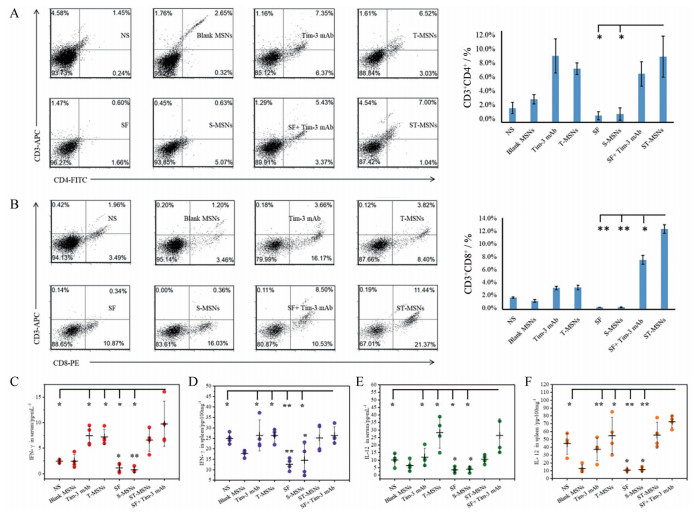
|
Figure 5 The percentage of CD3+CD4+ cells (A) and CD3+CD8+ cells (B) in tumors after purified by Percoll gradient; C: IFN-γ concentration in serum; D: IFN-γ concentration in spleen tissue; E: IL-12 concentration in serum; F: IL-12 concentration in spleen tissue. n = 4, |
作为系统性免疫激活的典型标志物, 利用酶联免疫吸附实验测定了血清和脾脏中IFN-γ和IL-12的浓度(图 5C~F)[23]。SF组和S-MSNs组小鼠血清和脾脏组织中IFN-γ和IL-12浓度均显著低于NS组(P < 0.05), 表明SF治疗后存在明显的免疫抑制作用。联合应用Tim-3单抗后, ST-MSNs组小鼠血清和脾脏中IFN-γ和IL-12水平明显高于SF组和S-MSNs组(P < 0.05)。ST-MSNs组脾脏IL-12水平、血清中IFN-γ和IL-12水平均显著高于NS组(P < 0.05)。以上结果表明, ST-MSNs可提高促炎细胞因子IFN-γ和IL-12表达水平, 缓解SF的系统免疫抑制作用[24]。
6 ST-MSNs的初步安全性评价采用MTT法、体外溶血实验和H&E染色法评价空白MSNs和ST-MSNs的初步安全性(图 6)。在给药浓度下, 空白MSN在HepG2和H22细胞上的存活率均高于80%, 表明空白MSNs在治疗剂量下对HepG2和H22细胞没有明显的细胞毒作用(图 6A)。此外, 通过测定释放的血红蛋白在576 nm处的A值测定红细胞溶血率。SF质量浓度在50~250 μg·mL-1内, ST-MSNs的溶血率均小于5%, 且未见明显的红细胞溶血(图 6B)。此外, 用ST-MSNs治疗后的小鼠的主要器官(心、肝、脾、肺和肾, 图 6C) 的H&E染色显示, 与NS组相比, 所有器官均未见明显的病理异常。
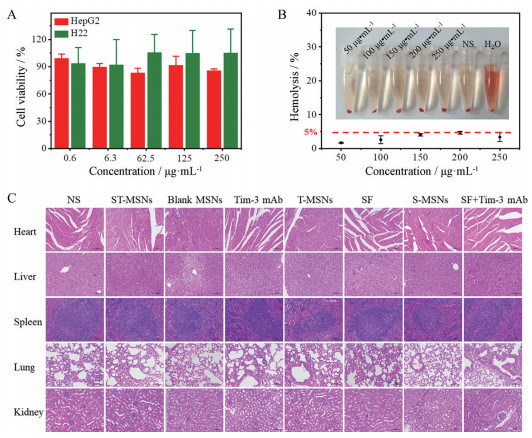
|
Figure 6 Preliminary safety evaluation. A: In vitro cytotoxicity of blank MSNs in the mouse hepatocarcinoma cell line H22 and the human hepatocarcinoma cell line HepG2 for 48 h (n = 3, |
本研究构建一种“响应脱壳”介孔二氧化硅纳米系统实现SF和Tim-3单抗的异靶点药物体内共递送, 达到提高肝癌化学免疫联合治疗的目的。本课题研究发现Tim-3单抗可以逆转SF诱导的免疫抑制, 通过刺激抗肿瘤免疫发挥其协同作用机制, 为临床肝癌治疗提供了具有良好应用前景的化学免疫联用药物组合。ST-MSNs利用MMP2敏感肽修饰的Tim-3单抗封堵MSNs, 制备简单, 可实现Tim-3单抗和SF在肿瘤部位的响应释放和T细胞/肿瘤细胞分别递送, 为临床化学免疫联合治疗药物载体构建提供了一种巧妙的设计思路。
作者贡献: 慕升君负责构思项目、设计实验和完成主要研究; 桑晓负责构思项目和参与抗肿瘤活性实验, 对研究数据进行分析解释和撰写初稿; 牟伟伟参与抗肿瘤活性实验和流式细胞仪检测; 王天琪参与抗肿瘤活性实验; 杨锐对流式细胞术有贡献; 张自鹏对细胞培养有贡献; 刘永军负责构思项目和设计实验; 张娜负责构思项目、设计实验和撰写草稿。
利益冲突: 作者声明本论文没有任何利益冲突。
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68: 394-424. DOI:10.3322/caac.21492 |
| [2] |
Yan SJ, Liu XY, Wan GH. Review on clinical research progress of immunotherapy in liver cancer[J]. Acta Pharm Sin (药学学报), 2019, 54: 1749-1754. |
| [3] |
Silva C, Rueda F, Löwik CW, et al. Combinatorial prospects of nano-targeted chemoimmunotherapy[J]. Biomaterials, 2016, 83: 308-320. DOI:10.1016/j.biomaterials.2016.01.006 |
| [4] |
Mokhtari RB, Homayouni TS, Baluch N, et al. Combination therapy in combating cancer[J]. Oncotarget, 2017, 8: 38022-38043. DOI:10.18632/oncotarget.16723 |
| [5] |
Meyer T. Treatment of advanced hepatocellular carcinoma: beyond sorafenib[J]. Lancet Gastroenterol Hepatol, 2018, 3: 218-220. DOI:10.1016/S2468-1253(17)30255-8 |
| [6] |
Ogasawara S, Chiba T, Ooka Y, et al. Post-progression survival in patients with advanced hepatocellular carcinoma resistant to sorafenib[J]. Investig New Drugs, 2016, 34: 255-260. DOI:10.1007/s10637-016-0323-1 |
| [7] |
Llovet JM, Zucman-Rossi J, Pikarsky E, et al. Hepatocellular carcinoma[J]. Nat Rev Dis Primers, 2016, 2: 16018. DOI:10.1038/nrdp.2016.18 |
| [8] |
Galle PR, Forner A, Llovet JM, et al. EASL clinical practice guidelines: management of hepatocellular carcinoma[J]. J Hepatol, 2018, 69: 182-236. |
| [9] |
Schwartz JD. Sorafenib in advanced hepatocellular carcinoma[J]. N Engl J Med, 2008, 359: 378-390. DOI:10.1056/NEJMoa0708857 |
| [10] |
Sacco R, Granito A, Bargellini I, et al. Clinical outcomes with long-term sorafenib treatment of patients with hepatocellular carcinoma: a multicenter real-life study[J]. Future Oncol, 2018, 14: 3049-3058. DOI:10.2217/fon-2018-0281 |
| [11] |
Keating GM. Sorafenib: a review in hepatocellular carcinoma[J]. Target Oncol, 2017, 12: 243-253. DOI:10.1007/s11523-017-0484-7 |
| [12] |
Chen Y, Ramjiawan RR, Reiberger T, et al. CXCR4 inhibition in tumor microenvironment facilitates anti-programmed death receptor-1 immunotherapy in sorafenib-treated hepatocellular carcinoma in mice[J]. Hepatology, 2015, 61: 1591-1602. DOI:10.1002/hep.27665 |
| [13] |
Iyer RV, Maguire O, Kim M, et al. Dose-dependent sorafenib-induced immunosuppression is associated with aberrant NFAT activation and expression of PD-1 in T cells[J]. Cancers, 2019, 11: 681. DOI:10.3390/cancers11050681 |
| [14] |
Lu LC, Lee YH, Chang CJ, et al. Increased expression of programmed death-ligand 1 in infiltrating immune cells in hepatocellular carcinoma tissues after sorafenib treatment[J]. Liver Cancer, 2019, 8: 110-120. DOI:10.1159/000489021 |
| [15] |
Burugu S, Dancsok AR, Nielsen TO, et al. Emerging targets in cancer immunotherapy[J]. Semin Cancer Biol, 2018, 52: 39-52. |
| [16] |
Friedlaender A, Addeo A, Banna G, et al. New emerging targets in cancer immunotherapy: the role of TIM3[J]. ESMO Open, 2019, 4: e000497. DOI:10.1136/esmoopen-2019-000497 |
| [17] |
Eftekhari RB, Maghsoudnia N, Samimi S, et al. Co-delivery nanosystems for cancer treatment: a review[J]. Pharm Nanotechnol, 2019, 7: 90-112. |
| [18] |
Wang Y, Yu H, Zhang D, et al. Co-administration of combretastatin A4 nanoparticles and sorafenib for systemic therapy of hepatocellular carcinoma[J]. Acta Biomater, 2019, 9: 229-240. |
| [19] |
Wang Q, Zhang XY, Liao HZ, et al. Multifunctional shell-core nanoparticles for treatment of multidrug resistance hepatocellular carcinoma[J]. Adv Funct Mater, 2018, 28: 1706124. DOI:10.1002/adfm.201706124 |
| [20] |
Mu W, Jiang D, Mu S, et al. Promoting early diagnosis and precise therapy of hepatocellular carcinoma by glypican-3-targeted synergistic chemo-photothermal theranostics[J]. ACS Appl Mater Interfaces, 2019, 11: 23591-23604. DOI:10.1021/acsami.9b05526 |
| [21] |
Wan X, Beaudoin JJ, Vinod N, et al. Co-delivery of paclitaxel and cisplatin in poly(2-oxazoline) polymeric micelles implications for drug loading, release, pharmacokinetics and outcome of ovarian and breast cancer treatments[J]. Biomaterials, 2019, 192: 1-14. DOI:10.1016/j.biomaterials.2018.10.032 |
| [22] |
Mu S, Liu Y, Wang T, et al. Unsaturated nitrogen-rich polymer poly(l-histidine) gated reversibly switchable mesoporous silica nanoparticles using "graft to" strategy for drug controlled release[J]. Acta Biomater, 2017, 63: 150-162. DOI:10.1016/j.actbio.2017.08.050 |
| [23] |
Liang J, Wang H, Ding W, et al. Nanoparticle-enhanced chemo-immunotherapy to trigger robust antitumor immunity[J]. Sci Adv, 2020, 6: eabc3646. |
| [24] |
He Q, Zhang Z, Liu H, et al. Relieving immunosuppression during long-term anti-angiogenesis therapy using photodynamic therapy and oxygen delivery[J]. Nanoscale, 2020, 12: 14788-14800. DOI:10.1039/D0NR02750B |
 2022, Vol. 57
2022, Vol. 57


