铂类药物是一类基础化疗药物, 应用于80%以上的临床治疗方案中[1, 2]。奥沙利铂是铂类药物中的第三代明星产品, 其可显著改善铂类产品的不良反应, 提高疗效。然而, 奥沙利铂的化学性质也不是非常稳定, 其静脉注射后易在体内多种环境下(H2O、NaCl) 发生水解, 脱去草酸基团后转化为含Cl和OH的活性化合物, 随后与血液或组织液中的蛋白或细胞结合引起血液或器官的毒性[3], 导致实际到达肿瘤部位的药量大大减少。因此, 通过采用不同制剂学策略, 如前药改造、利用纳米粒和聚合物胶束等纳米载体荷载奥沙利铂来改善其递送过程中的稳定性, 降低不良反应, 增强药物对肿瘤组织的特异性靶向蓄积, 已成为现阶段提高奥沙利铂临床疗效、减少不良反应的关键。
相对于传统化疗药物, 纳米药物递送系统的应用能够显著延长药物的血浆半衰期、减少药物对正常组织的不良反应[4], 并且能够通过肿瘤组织的增强渗透和滞留(enhanced permeability and retention, EPR) 效应促进药物在肿瘤部位的被动靶向蓄积, 提升药物的抗肿瘤治疗效果[5], 目前已有包括Abraxane和Doxil等在内的数十种药物纳米递送系统产品成功上市, 展现出良好的应用前景[6]。与此同时, 通过对纳米载体进行表面靶向基团修饰, 能够赋予纳米载体对靶部位的特异性靶向, 增加纳米制剂的肿瘤靶向蓄积, 实现更好的肿瘤杀伤[7, 8]。此外, 运用刺激响应型纳米递送系统进行药物递送的方式在近年来也得到了广泛发展, 通过响应肿瘤微环境低pH值、肿瘤细胞内高氧化还原状态及肿瘤组织高表达某些酶等微环境特征, 实现药物的响应触发释放, 大幅度提高药物的递送效率[9, 10]。
磁性四氧化三铁纳米粒是目前少数几种美国FDA批准可用于临床的纳米材料之一, 其化学性质安全稳定、生物相容性较好, 同时还具有一定的刚性强度, 在肿瘤诊断治疗、靶向药物递送及核磁共振成像方面都已得到了广泛的应用[11-13]。同时, 四氧化三铁纳米粒内富含的Fe2+和Fe3+为缺电子状态, 能够与富含孤对电子的有机分子形成配位键, 从而轻松地实现对四氧化三铁纳米粒的表面改性或表面药物荷载, 而经表面修饰后的四氧化三铁纳米粒更加不易被血浆蛋白包绕, 从而规避网状内皮系统吞噬, 降低其清除速率, 延长血液中的循环时间[14, 15]。此外, 四氧化三铁纳米粒还可用于肿瘤的定点磁热治疗, 在外加交变磁场的作用下, 磁性纳米粒可被定向引导蓄积在特定的组织区域, 随后在磁场的作用下产生热量, 实现对肿瘤的定点加热、增敏化疗的肿瘤杀伤效果[16, 17]。
因此, 在本研究中, 作者拟构建一种胞内还原响应奥沙利铂释放的载药四氧化三铁纳米粒: 通过将奥沙利铂设计成还原响应前药并共价连接到聚乙二醇聚氨基酸嵌段聚合物上, 最大程度减少活性药物在递送过程中的泄露; 通过聚合物末端连接的富含电子的邻苯二酚将载药聚合物吸附到四氧化三铁纳米粒表面构建载药四氧化三铁纳米粒, 并且通过click反应, 在聚合物的聚乙二醇端修饰肿瘤高表达的α-烯醇化酶的靶向多肽[18], 实现对肿瘤组织的主动靶向。最后, 在体内外水平对靶向载药纳米制剂的还原响应释药特性及肿瘤靶向和体内药动学行为进行考察, 探索其改善奥沙利铂体内递送的可能性。
材料与方法材料和试剂 奥沙利铂(OXA, 大连美仑生物技术有限公司); 30%过氧化氢溶液、水合氯醛(中国医药上海化学试剂公司); 丁二酸酐、N6-苄氧羰基-L-赖氨酸、三光气、三氟乙酸(TFA)、碘化亚铜(CuI)、抗坏血酸钠(VcNa)、异硫氰酸荧光素(FITC) (阿拉丁试剂有限公司); Cy5.5-NHS (APExBIO公司); 3, 4-二羟基苯乙酸(DHAC)、2-(7-偶氮苯丙三氮唑-1-基)-N, N, N', N'-四甲基脲六氟磷酸酯(HATU)、N, N-二异丙基乙胺(DIPEA)、氢溴酸(33%醋酸溶液)、1, 1, 4, 7, 7-五甲基二亚乙基三胺(PMDETA) (百灵威科技有限公司); α-甲基-ω-氨基-聚乙二醇5000 (CH3O-PEG5k-NH2)、α-叠氮-ω-氨基-聚乙二醇5000 (N3-PEG5k-NH2) (北京键凯科技有限公司); 氮端己炔酸修饰的α-烯醇化酶靶向多肽[ETP, 序列: SSMDIVLRAPLM-(5-hexynoic acid), 上海强耀生物科技有限公司]; SnakeSkin透析袋(截留分子质量3.5 kD、20 kD)、4', 6-二脒基-2-苯基吲哚(DAPI)、无菌细胞培养皿[赛默飞世尔科技(中国) 有限公司]; 油酸修饰的四氧化三铁纳米粒(oleic acid-Fe3O4, 由山东大学杨志杰教授友情馈赠, 粒径8 nm, 油酸含量15%); 胎牛血清(FBS)、RPMI 1640干粉培养基、0.25%胰蛋白酶-乙二胺四乙酸溶液(0.25% trypsin-EDTA) (Gibco公司); 异氟烷(瑞沃德生命科技有限公司)。
主要仪器 Mercury Plus 400 MHz超导核磁共振波谱仪(美国Varian公司); 安捷伦1260高效液相色谱(HPLC, 美国Agilent公司); PhenogelTM 500A凝胶渗透色谱柱(GPC, 美国Phenomenex公司); 马尔文3600 Nano-ZS激光粒度仪(英国Malvern Panalytical公司); Tecnai G2 Spirit BioTWIN 120 kV生物型透射电镜(TEM, 美国FEI公司); BioTek多功能酶标仪(美国BIOTEK公司); 等离子体电感耦合质谱(ICP-MS, 美国PerkinElmer公司); 流式细胞仪(FACS, 美国Becton Dickinson公司); 三维小动物活体多模态成像系统(IVIS, 美国PerkinElmer公司)
细胞 鼠源三阴性乳腺癌细胞株(4T1) 购自上海科远迪生物公司, 用含10%胎牛血清、100 μg·mL-1青霉素、100 μg·mL-1链霉素的RPMI 1640培养基培养于37 ℃的含5% CO2的细胞培养箱中; 用0.25%胰蛋白酶消化传代。
动物 BALB/c小鼠(雌性, 体重20 g左右) 购自上海斯莱克实验动物有限公司, 于复旦大学药学院实验动物中心饲养, 许可证号码SCXK (沪) 2017-0005。动物于SPF级条件下饲养及进行实验操作(温度25 ℃左右, 湿度50%~60%)。所有动物实验操作均通过复旦大学药学院实验动物伦理委员会批准并遵循相关管理规定。
还原响应奥沙利铂前药OXA-COOH的合成与表征 称取奥沙利铂原料药1 g, 加入30%过氧化氢水溶液10 mL, 室温避光反应过夜。反应结束后, 冷冻干燥除去水分, 得到白色粉末(OXA-OH), 采用核磁表征产物, δ: 2.70~2.57 (m, 2H)、2.12~2.02 (m, 2H)、1.50~1.29 (m, 4H)、1.12~1.00 (m, 2H)。
称取OXA-OH 500 mg, 丁二酸酐135 mg, 加入50 mL无水二甲亚砜(DMSO) 使其溶解。向反应液中加入三乙胺5 mg后, 在常温下反应24 h。反应结束后, 反应液由浊变清, 将反应液缓慢滴到700 mL冷乙醚中析出固体沉淀, 抽滤得到乳白色固体(OXA-COOH), 采用核磁和质谱表征产物, δ: 2.84~2.71 (m, 2H)、2.62~2.44 (m, 4H)、2.30~2.15 (m, 2H)、1.63~1.41 (m, 4H)、1.29~1.08 (m, 2H); 加氢准分子离子峰([OXA-COOH+H]+: 532.0) 和加钠准分子离子峰([OXA-COOH+Na]+: 554.0)。
聚合物N3-/PEG-pLys (NH2)-DHAC的合成与表征 按Fuchs-farthing法合成Lys(Z)-NCA。称取N6-苄氧羰基-L-赖氨酸5 g, 三光气2.25 g, 加入无水四氢呋喃(THF) 50 mL, 50 ℃油浴内反应5 h。等恢复至室温后, 过滤除去不溶物。接着将反应液滴加到700 mL预冷的无水正己烷中析出固体沉淀, 抽滤得到白色的块状固体[Lys(Z)-NCA], 采用核磁表征产物, δ: 7.38~7.25 (m, 5H)、5.00~4.97 (m, 2H)、4.44~4.39 (s, 1H)、3.02~2.93 (m, 2H)、1.80~1.20 (m, 6H)。
准确称量CH3O-PEG-NH2或N3-PEG-NH2 500 mg, Lys(Z)-NCA 398 mg, 加20 mL无水DMSO置于50 ℃油浴中反应48 h。待反应液恢复室温后, 将反应液转移至SnakeSkin透析袋(MWCO: 3.5 kD) 中, 置于高纯水里透析除去未反应的原料, 每隔12 h换水1次, 共4次。之后, 将液体转移至离心管内, 冷冻干燥, 得到白色絮状固体[CH3O-PEG-pLys(Z)n-NH2或N3-PEG-pLys(Z)n-NH2], 采用核磁表征产物, δ: 7.38~7.25 (m, 60H)、5.00~4.97 (m, 24H)、3.54~3.45 (m, 448H)、3.25~3.23 (m, 3H)、3.01~2.89 (m, 24H)、1.70~1.10 (m, 72H)。
称量DHAC 1.8 mg, HATU 45.6 mg, 加入5 mL无水DMSO于室温条件下活化羧基。待反应1 h后, 加入500 mg溶于DMSO中的CH3O-PEG-pLys(Z)n-NH2或N3-PEG-pLys(Z)n-NH2, DIPEA 15.5 mg继续室温反应24 h。待反应液结束, 将转移至SnakeSkin透析袋(MWCO: 3.5 kD) 中, 置于高纯水里透析除去未反应的原料, 最后冷冻干燥得到白色絮状固体[CH3O-PEG-pLys(Z)n-DHAC或N3-PEG-pLys(Z)n-DHAC], 采用核磁表征产物, δ: 7.38~7.25 (m, 60H)、6.63~6.39 (m, 3H)、5.01~4.98 (m, 24H)、3.54~3.45 (m, 448H)、3.25~3.23 (m, 3H)、3.01~2.89 (m, 24H)、1.70~1.10 (m, 76H)。
称取500 mg CH3O-PEG-pLys(Z)n-DHAC或N3-PEG-pLys(Z)n-DHAC溶于10 mL TFA, 加33%氢溴酸溶液500 μL, 室温条件下反应3 h。随后, 将反应液滴到100 mL -20 ℃预冷的无水乙醚中析出沉淀, 离心得到淡黄色固体[CH3O-/N3-PEG5K-pLys(NH2)n-DHAC], 采用核磁表征产物, δ: 6.63~6.39 (m, 3H)、3.54~3.45 (m, 448H)、3.25~3.23 (m, 3H)、2.83~2.69 (m, 18H)、1.70~1.10 (m, 60H)。
载药聚合物(CH3O-/N3-PEG5K-OXA-DHAC) 的合成与表征 称取111 mg OXA-COOH, HATU 79.8 mg, 加入5 mL无水DMSO后在室温条件下活化羧基。待反应1 h后, 加入200 mg溶于DMSO中的CH3O-/N3-PEG5K-pLys(NH2)n-DHAC, DIPEA 15.5 mg, 继续高纯氩气保护情况下反应24 h。待反应结束, 将反应液转移至SnakeSkin透析袋(MWCO: 3.5 kD) 中, 置于高纯水里透析除去未反应的原料, 最后冷冻干燥, 得到淡黄色固体(CH3O-/N3-PEG5K-OXA-DHAC, 化合物1), 采用核磁和GPC表征产物, δ: 6.63~6.39 (m, 3H)、3.54~3.45 (m, 448H)、3.25~3.23 (m, 3H)、3.01~2.89 (m, 20H)、2.74~2.64 (m, 18H)、2.50~2.22 (m, 36H)、2.18~2.05 (m, 18H)、1.70~1.00 (m, 114H)。
同时, 在上述的合成过程中, 通过加入1 e.q.荧光探针(Cy5.5-NHS或FITC), 对载药聚合物进行荧光标记, 得到Cy5.5或FITC修饰的载药聚合物[PEG-OXA(Cy5.5)-DHAC或PEG-OXA(FITC)-DHAC]。
靶向载药聚合物(ETP-OXA-DHAC) 的合成与表征 采用一价铜催化叠氮-炔基click反应将N3-PEG5K-OXA-DHAC与靶向多肽偶联。称取50 mg N3-PEG5K-OXA-DHAC, 靶向多肽SSMDIVLRAPLM-(5-hexynoic acid) 14.3 mg, CuI 2 mg, PMDETA 5 mg, 加入5 mL无水DMSO, 于室温条件下避光反应24 h。待反应结束, 转移至SnakeSkin透析袋(MWCO: 3.5 kD) 中, 在含10 mmol·L-1 EDTA-2Na的水溶液中透析24 h, 之后再换到纯水中透析48 h, 每隔12 h换1次纯水。最后, 将透析袋中液体进行冷冻干燥处理, 得到淡黄色固体(ETP-OXA-DHAC, 化合物2), 采用核磁、红外光谱和GPC表征产物, δ: 8.50~6.81 (m, H-amido bonds and aromatic rings)、6.63~6.39 (m, H-protons of dihydroxybenzene)、3.01~2.89 (m, H-protons of L-lysine)、2.50~2.05 (m, H-protons of prodrug)、1.70~1.00 (m, H-protons of L-lysine and prodrug)、0.90~0.75 (m, H-protons of peptide)。
载药纳米粒的制备 通过相转透析法, 制备了肿瘤靶向多肽修饰和未修饰的载药四氧化三铁纳米粒(ETP-PtFeNP/PtFeNP)。首先, 将靶向多肽修饰或未修饰的载药聚合物(ETP-OXA-DHAC/CH3O-PEG5K-OXA-DHAC) 按一定的比例加无水N, N-二甲基甲酰胺(DMF) 配制成浓度为0.001 mmol·L-1的溶液A。同时, 将油酸修饰的四氧化三铁纳米粒(oleic acid-Fe3O4) 溶于无水THF中配制成浓度为0.004 mmol·L-1的溶液B。随后, 取一定体积的溶液B置于15 mL离心管中, 在超声条件下, 向1体积的溶液B中加入1/3体积的溶液A, 同时振摇离心管。随后, 将离心管置于涡旋仪上涡旋反应2 h, 之后, 将反应液转移至20 kD的SnakeSkin透析袋中, 先在无水DMF中透析48 h, 然后再转移到纯水中继续透析48 h。最后将溶液转移至50 mL离心管内, 冷冻干燥得到棕色絮状载药四氧化三铁纳米粒(ETP-PtFeNP/PtFeNP)。
同样, 按上述方法, 在配制载药聚合物储备液A时, 用PEG-OXA(Cy5.5)-DHAC或PEG-OXA(FITC)-DHAC替换其中10%的非靶向修饰载药聚合物(PEG-OXA-DHAC), 从而实现对载药纳米粒的荧光标记(Cy5.5或FITC)。
粒径和zeta电位的测定 取一定量的ETP-PtFeNP/PtFeNP纳米粒溶于纯水中, 通过动态光散射技术(dynamic light scattering, DLS) 测量粒径和聚合物分散性指数(polymer dispersity index, PDI), 同时测定纳米粒的zeta电位。
透射电镜 取上述两种胶束溶液, 滴加到碳支持铜网正面, 待其自然晾干后, 于120 kV的生物TEM下观察纳米粒形貌并拍照记录。
包封率和载药量的测定 文献报道, 奥沙利铂前药(Ⅳ) 能够在还原性物质如VcNa的作用下被还原成奥沙利铂(Ⅱ), 实现药物以原型药形式的释放[19]。因此, 运用HPLC检测ETP-PtFeNP中奥沙利铂的包封率和载药量。
首先精确称取奥沙利铂原料药, 加水溶解配制成710 μg·mL-1的标准储备液, 然后再倍比稀释配制一系列浓度的奥沙利铂标准溶液。利用HPLC测定并建立奥沙利铂标准曲线。HPLC色谱条件: 色谱柱: Agilent C18, 250 mm × 4.6 mm, 流动相: 90%甲醇-10%水, 流速: 1 mL·min-1, 进样量: 10 μL, 检测器: 紫外检测器, 波长250 nm。
随后, 精确称量PtFeNP和ETP-PtFeNP, 直接加入400 μL 100 mmol·L-1 VcNa溶液溶解, 在室温条件下, 于涡旋仪上剧烈涡旋2 h使奥沙利铂完全释放。随后反应液以12 000 r·min-1离心5 min, 取上清进行HPLC检测, 通过代入标准曲线计算得到其中的奥沙利铂浓度。
最后, 通过公式(1) 计算载药纳米粒的包封率(entrapment efficiency, EE), Wn为冻干后载药纳米粒中所含的奥沙利铂的总质量, Ws为参与纳米粒制备的载药聚合物中的奥沙利铂的总质量。
| $ \mathrm{E}\mathrm{E}\left(\mathrm{\%}\right)=\frac{Wn}{Ws}\times 100\mathrm{\%} $ | (1) |
同时, HPLC法测定载药纳米粒的载药量(drug loading capacity, DLC), 见公式(2), 其中C (drug) 为测量的奥沙利铂质量浓度, C (nanoparticle) 为待测样品中纳米粒的质量浓度。
| $ \mathrm{D}\mathrm{L}\mathrm{C}\left(\mathrm{\%}\right)=\frac{C\left(\mathrm{d}\mathrm{r}\mathrm{u}\mathrm{g}\right)}{C\left(\mathrm{n}\mathrm{a}\mathrm{n}\mathrm{o}\mathrm{p}\mathrm{a}\mathrm{r}\mathrm{t}\mathrm{i}\mathrm{c}\mathrm{l}\mathrm{e}\right)}\times 100\mathrm{\%} $ | (2) |
体外释放度的测定 透析法考察ETP-PtFeNP中药物的还原响应释放。将500 μL ETP-PtFeNP水溶液(质量浓度为16 mg·mL-1) 密闭在SnakeSkin透析袋(MWCO: 3.5 kD) 中, 并立即放入到装有10 mL释放介质[分别为: 不含VcNa的pH = 7.4 PBS、不含VcNa的pH = 5.5 PBS、含10 mmol·L-1 VcNa的pH = 7.4 PBS (模拟肿瘤细胞质内还原状态)、含10 mmol·L-1 VcNa的pH = 5.5 PBS及含2 mmol·L-1 VcNa的pH = 5.5 PBS (模拟肿瘤细胞溶酶体内还原状态)] 的15 mL离心管中, 放置在37 ℃摇床中, 设定摇床转速为100 r·min-1。在设置的时间点从释放介质中吸取200 μL液体, 同时马上补加等体积置于37 ℃孵育的新鲜释放介质。采用HPLC法测定样品中奥沙利铂原型药的释放情况。
细胞摄取及抑制 将4T1细胞以3×104个细胞/孔的密度接种到24孔板内, 当细胞融合度达80%时, 移除培养液, 加Hank's清洗3次后, 加入溶于无血清RPMI 1640培养基中荧光探针标记的载药纳米粒(ETP多肽修饰度分别为0%、10%、20%、40%), 各组荧光探针终浓度当量为1 μg·mL-1。孵育1 h后, 撤去药液, 添加Hank's洗涤3次, 用0.25%胰酶消化后流式细胞仪分析摄取情况或加入200 μL Hank's后CLSM下观察摄取情况。
为了进一步考察细胞摄取载药纳米粒的机制, 先用过量的ETP多肽(5 mg·mL-1, 考察是否是受体依赖的) 及多种内吞抑制剂[秋水仙碱(1 μg·mL-1) 阻断巨胞饮途径; 渥曼青霉素(1 μg·mL-1) 阻断巨胞饮途径; 氧化苯砷(0.4 μg·mL-1) 阻断网格蛋白依赖性途径; 氯丙嗪(5 μg·mL-1) 阻断网格蛋白依赖性途径; 菲律宾菌素(0.5 μg·mL-1) 阻断小窝蛋白介导的内吞作用] 对细胞进行10 min预孵育处理, 随后撤去, Hank's洗涤3次, 再加探针标记的载药纳米粒(探针浓度: 1 μg·mL-1) 在37 ℃培养箱中处理30 min。同时, 另有加载药纳米粒的细胞被置于4 ℃孵育30 min, 考察摄取途径是否是能量依赖的。最后, 撤去纳米粒溶液, 用Hank's清洗3次后, 加0.25%胰酶消化3~5 min后, 用等量的Hank's终止细胞消化, 转移至96孔板内(200 μL/孔), 流式细胞仪定量分析摄取抑制情况。
然后考察不同时间点细胞摄取载药纳米粒的情况, 用荧光探针标记的载药纳米粒分别孵育细胞15、30、60和90 min, 然后用Hank's清洗3次后, 加0.25%胰酶消化3~5 min后, 用等量的Hank's终止细胞消化, 转移至96孔板内(200 μL/孔), 流式细胞仪定量分析摄取抑制情况。
药物动力学 有别于传统的仅针对药物的体内血液浓度进行考察的药动学评价方式, 希望能对载药纳米粒的各个组成部分进行一个整体性的体内行为评价。因此, 用Cy5.5-NHS探针对聚合物材料进行荧光标记(通过检测Cy5.5的荧光信号强弱来代表聚合物材料的浓度), 同时, 通过ICP-MS测定血液样品中铂元素和铁元素的含量, 分别代表奥沙利铂和Fe3O4。基于上述设计, 可以最大程度地对所构建的载药纳米粒递送系统进行全面的体内药动学行为评价。
将雌性BALB/c小鼠分4组, 每组3只。实验前24 h内仅给予5%葡萄糖水饮用。各组通过尾静脉注射游离Cy5.5探针(66 μg·kg-1), 游离奥沙利铂(5 mg·kg-1), Cy5.5标记的PtFeNP纳米粒(Cy5.5探针: 66 μg·kg-1), Cy5.5标记的ETP-PtFeNP纳米粒(Cy5.5探针: 66 μg·kg-1; 奥沙利铂: 5 mg·kg-1; 铁元素: 4.7 mg·kg-1)。在静脉注射后的各设定时间点, 小鼠尾静脉取血约80 μL, 置于含10 μL 10%肝素的采血管(已称重记录质量) 中, 补加生理盐水至总血样体积达150 μL。5 000 r·min-1转速离心5 min后准确吸取80 μL血浆暂存在4 ℃冰箱中。
首先, 以空白血浆配制Cy5.5的标准曲线, 浓度范围在1~1 250 ng·mL-1。取50 μL标准曲线样品置于96孔板中, 酶标仪检测670 nm/700 nm的荧光信号, 对浓度作图拟合得到Cy5.5在血浆中的标准曲线。然后, 取50 μL各组各时间点的血浆样品置于96孔板中, 酶标仪检测670 nm/700 nm的荧光信号, 再通过代入标准曲线计算得各组各时间点的Cy5.5浓度。
通过ICP-MS检测各组血浆样品中Pt和Fe元素的含量。首先, 用100 mg·L-1的Pt标准储备溶液和100 mg·L-1的Fe标准储备溶液分别配制浓度为0.2~1 000 μg·L-1的Pt标准样品和1 μg·L-1~10 mg·L-1的Fe标准样品。通过ICP-MS检测Pt元素和Fe元素的响应值, 分别对浓度作图拟合得到Pt元素和Fe元素的标准曲线。血浆样品需经过前处理后才可进ICP-MS系统检测, 具体方法: 取各组各时间的血浆样品50 μL置于已知质量的15 mL离心管内, 加浓硝酸950 μL, 加盖后, 置于95 ℃水浴中高温消解4 h, 随后再在室温放置7天, 最后, 加水定容至10 mL后上机检测。
体内肿瘤靶向性考察 取荷4T1肿瘤的BALB/c小鼠8只随机分为2组, 每组4只。分别按每千克0.1 mg Cy5.5尾静脉注射Cy5.5标记的ETP-PtFeNP和PtFeNP, 通过IVIS Spectrum CT小动物活体成像系统考察纳米粒在不同时间点的在体分布情况。在给药24 h后, 麻醉后脱颈处死小鼠, 快速取出主要脏器和肿瘤置于IVIS中拍摄离体组织的荧光信号。
为了进一步考察纳米粒的瘤内分布情况, 在给予Cy5.5标记的纳米粒24 h后, 将小鼠麻醉并快速取出肿瘤组织, 用4%多聚甲醛固定24 h。然后, 再转移到蔗糖中脱水, 最后加OCT包埋, 在-20 ℃环境中用冷冻切片机将肿瘤组织切割成10 μm厚的冷冻切片, 置于-20 ℃冰箱中保存。
将冷冻切片从-20 ℃冰箱中取出, 于室温放置30 min待其恢复至室温。用等渗DPBS (pH = 7.4) 漂洗5 min × 3次后, 置于暗盒中, 利用免疫组化笔将组织圈出, 避免抗体溶液的倾漏。随后, 每个组织加入30 μL溶于含0.3% TritonX-100及10%山羊血清的DPBS溶液中的CD34抗体(1∶1 000), 4 ℃冰箱孵育过夜。次日, 从冰箱中取出切片, 用DPBS洗涤3次后, 加30 μL溶于DPBS的Alexa Fluor® 488山羊抗兔二抗(1∶1 000) 常温避光孵育2 h。孵育结束, 加DPBS洗涤3次, 最后, 加30 μL DAPI溶液(5 μg·mL-1) 染色细胞核后, 每个样品加10 μL抗荧光淬灭封片剂后盖上盖玻片, 于CLSM下观测。同时, 通过Image J对检测到的Cy5.5荧光信号进行半定量分析(DAPI: 405 nm/461 nm; Alexa Fluor® 488: 488 nm/525 nm; Cy5.5: 638 nm/700 nm)。
制剂安全性考察 按照“体内肿瘤靶向性考察”中种瘤, 然后待肿瘤体积长到约100 mm3时, 将荷瘤小鼠按每组3只均分成3组, 每组按5 mg·kg-1奥沙利铂剂量尾静脉注射ETP-PtFeNP、PtFeNP或生理盐水150 μL, 给药频率每隔两天1次, 共5次, 结束后次日将小鼠处死取出脏器, 利用4%多聚甲醛进行固定制成石蜡切片, 利用苏木精-伊红染色, 用倒置显微镜观察。
数据分析 通过Living Image软件处理小动物活体成像仪获取的结果, ROI工具半定量离体组织荧光信号, GraphPad Prism 5.0处理数据并绘制柱状图, t-test分析组间差异。用DAS 2.0软件分析拟合药动学数据, 获得相应的药动学参数, 数据以
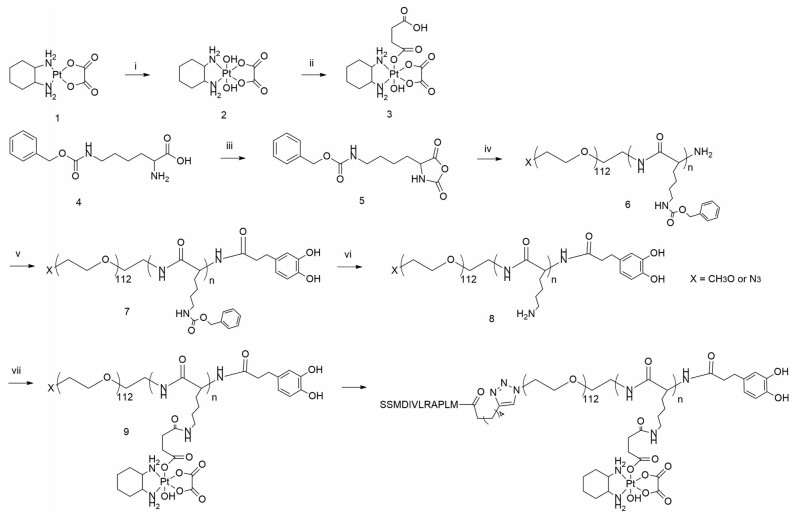
首先, 通过双氧水氧化及酸酐开环反应, 将奥沙利铂氧化成四价前药并修饰上具有反应活性的羧基官能团, 见合成路线1A所示。在核磁结果中(图 1A), 在化学位移2.62~2.44处观察到丁二酸酐上(-CH2-) 氢的特征峰, 同时, 在质谱结果中(图 1B) 检测到目标产物加氢的准分子离子峰([OXA-COOH+H]+: 532.0)。上述结果表明, 奥沙利铂前药OXA-COOH合成成功。
|
Scheme 1 A: The synthetic routes and structures of oxaliplatin prodrug. B: The synthetic routes and structures of polyethylene glycol5k-oxaliplatin-3, 4-dihydroxyphenyl acetic acid (PEG5K-OXA-DHAC, compound 1) and polymer α-enolase targeted peptide-oxaliplatin-3, 4-dihydroxyphenyl acetic acid (ETP-OXA-DHAC, compound 2) |
|
Figure 1 The 1H nuclear magnetic resonance (NMR) spectrum of oxaliplatin-COOH in D2O (A); the mass spectrometry-electrospray ionization spectrum of OXA-COOH (B) |
接着, 基于开环聚合反应、酰胺化反应、亲核取代反应及click反应等, 合成了靶向/非靶向载药聚合物(ETP-OXA-DHAC/PEG-OXA-DHAC), 见合成路线1B所示。通过核磁共振氢谱(图 2A), 计算出该载药聚合物的赖氨酸单体连接个数约为10个, 奥沙利铂前药连接个数约为7个, 相对分子质量约为10 024。通过GPC对载药聚合物进行分析, 结果显示, 聚合物呈单峰分布, 载药聚合物GPC测定的分子质量(图 2B) 与核磁共振氢谱计算的结果相吻合。并且, 相对于未进行靶向修饰的载药聚合物, 连接靶向多肽后的ETP-OXA-DHAC在GPC柱里的保留时间变短(图 2C), 表明ETP-OXA-DHAC分子质量的增加。

|
Figure 2 A: The 1H NMR spectrum of ETP-OXA-DHAC in DMSO-δ6. B: Gel permeation chromatography (GPC) elution time of PEG5K-OXA-DHAC. C: GPC elution time of N3-PEG5K-OXA-DHAC and ETP-OXA-DHAC. The increase of elution time indicated the successful synthesis of ETP-OXA-DHAC |
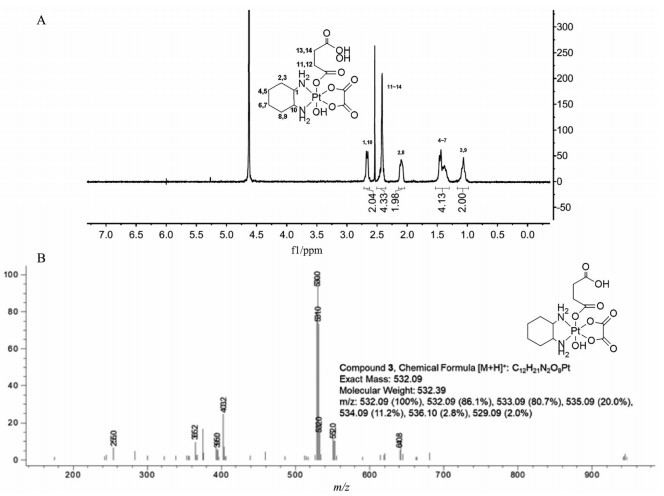
采用相转透析法制备载药纳米粒后, 首先通过DLS测量靶向(ETP-PtFeNP) 和非靶向(PtFeNP) 纳米粒的粒径分布和zeta电势, 结果如图 3A和表 1所示。ETP-PtFeNP的平均水化粒径为26.65 ± 3.13 nm, PtFeNP的平均水化粒径为24.27 ± 3.81 nm。TEM结果显示, 两种纳米粒分散均匀、形貌圆整。Zeta电位结果表明, ETP-PtFeNP和PtFeNP表面均呈弱负电性, 有利于纳米粒在水中和生理环境下的稳定存在。
|
Figure 3 A: Transmission electron microscope photograph and DLC result of PtFeNP and ETP-PtFeNP, respectively. Scale bars: 10 nm. B: The diameters and zeta-potential of ETP-PtFeNP and PtFeNP stored in phosphate buffered saline 7.4 for 7 days. n = 3, |
|
Table 1 Summary of formulation properties and drug loading content (DLC) and entrapment effciency (EE) of formulations. n = 3, |
同时, 还对载药纳米粒在PBS 7.4缓冲液条件中的放置稳定性进行了考察。结果如图 3B所示, 虽然放置7天后各载药纳米粒的粒径略有增大, 但均小于30 nm, 同时仍维持较适中的表面负电性, 表明PtFeNP和ETP-PtFeNP具有较好的体外放置稳定性。
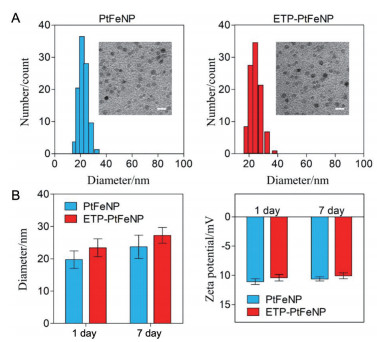
3 载药纳米粒的载药特性及其体外释放通过HPLC法考察ETP-PtFeNP和PtFeNP的载药量和包封率, 具体结果见表 1。从整体结果来看, ETP-PtFeNP和PtFeNP均呈现较高的载药量(大于20%), 整体的包封率在80%左右。载药纳米粒的体外释放结果显示(图 4), 相较于不含VcNa的空白PBS 7.4或PBS 5.5条件, 在含10 mmol·L-1 VcNa的PBS 7.4细胞浆微环境的模拟条件及含有2 mmol·L-1 VcNa的PBS 5.5溶酶体微环境的模拟条件下, 载药纳米粒均可实现快速的奥沙利铂响应释放(3 h内药物释放量可达80%以上), 表明载药纳米粒具有良好的胞内还原响应快速释药性能。
|
Figure 4 The accumulated oxaliplatin release of ETP-PtFeNP under different medium. n = 3, |
通过流式细胞仪检测4T1细胞摄取不同靶向修饰度的载药纳米粒的荧光值。结果显示(图 5A), α-烯醇化酶靶向多肽ETP能够显著提高肿瘤细胞对载药纳米粒的摄取, 同时, 随着ETP多肽修饰度的提高(0%、10%、20%、40%), 细胞流式仪检测到的细胞荧光强度随之增大。根据上述实验结果, 选择40%多肽修饰的载药纳米粒作为靶向制剂开展后续的各项研究。
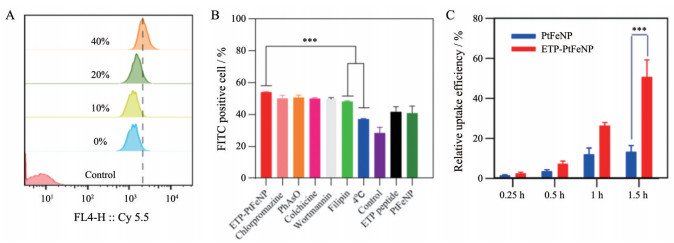
|
Figure 5 A: Cellular uptake of ETP-PtFeNP with increased ETP peptide modification degree on 4T1 cells. B: Cellular uptake of ETP-PtFeNP with 40% ETP modified under different inhibitive conditions. C: Cellular uptake of ETP-PtFeNP and PtFeNP at different time points. n = 3, |
通过将细胞与多种内吞抑制剂预孵育或将细胞置于4 ℃条件下孵育一定时间进一步考察ETP多肽修饰的靶向载药纳米粒的摄取途径, 结果如图 5B所示。相对于37 ℃孵育30 min, 在4 ℃条件下孵育可显著降低细胞对ETP-PtFeNP的摄取量, 表明细胞对ETP-PtFeNP的摄取是能量依赖的。此外, 菲律宾菌素预孵育可显著减少细胞对ETP-PtFeNP的摄取, 而另4个内吞抑制剂几乎没有抑制效果, 表明ETP-PtFeNP主要通过小窝蛋白介导型的内吞入胞途径被4T1-luci细胞摄取。作者还对4T1-luci细胞预先处理过量的游离ETP多肽, 结果显示ETP多肽预处理也可抑制ETP-PtFeNP的细胞摄取, 表明ETP-PtFeNP的细胞摄取与ETP多肽和α-烯醇化酶的结合相关。为了更清晰表征纳米粒的细胞摄取状态, 通过考察不同时间点4T1-luci细胞对ETP-PtFeNP和PtFeNP的摄取情况, 结果显示(图 5C), ETP-PtFeNP相对于PtFeNP摄取有显著增多, 并且在考察时间范围摄取增多。
5 药物动力学研究由于在药效实验中选用的实验动物是BALB/c小鼠, 因此, 为了能更好地反映纳米制剂在治疗小鼠上的药动学性质, 选用健康的BALB/c小鼠作为实验动物来进行纳米粒的体内药物动力学行为评价。如图 6A所示, 通过酶标仪检测血液中Cy5.5荧光信号代表聚合物材料在血液中的分布情况, ICP-MS检测铂元素和铁元素的含量分别来代表荷载药物奥沙利铂及核心载体Fe3O4纳米粒在血液中的分布情况。随后, 根据各时间点获得的血药浓度数据绘制了各组的Cy5.5探针浓度、奥沙利铂浓度和铁元素浓度与时间的关系曲线, 结果如图 6B所示。相较于游离奥沙利铂, ETP-PtFeNP可稍微延长奥沙利铂的血液半衰期。运用DAS 2.0软件对测得的血液浓度和时间进行房室拟合的结果显示(表 2), 将奥沙利铂以前药的形式荷载到载药纳米粒中, 可显著增加奥沙利铂的平均药时曲线下面积(AUC0-∞), 约为游离奥沙利铂的5倍, 同时药物的血液半衰期显著延长。
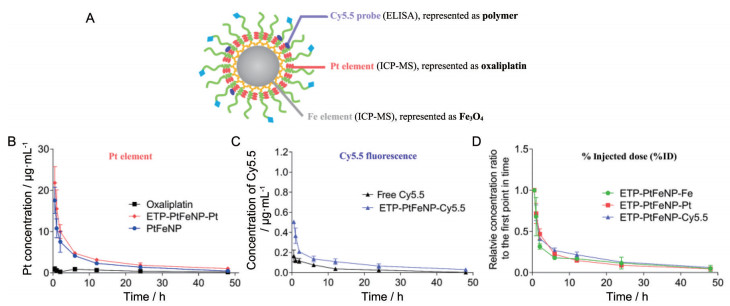
|
Figure 6 In vivo pharmacokinetic study of ETP-PtFeNP and PtFeNP formulations. A: Illustration of methods for in vivo nanoparticle tracing; B: Plasma Pt concentration in BALB/c mice after injection with different oxaliplatin formulations; C: Plasma Cy5.5 concentration in BALB/c mice after injection with different Cy5.5-labled formulations; D: Relative % injected dose from different aspects. n = 4, |
|
Table 2 Pharmacokinetic parameters of different formulations in BALB/c mice. n = 3, |
此外, 为了提高用共价连接荧光探针来示踪聚合物材料体内行为这一方法的说服力, 同时也考察了游离Cy5.5探针的体内行为, 结果如图 6C所示。游离Cy5.5探针在注射入动物体内后, 发生了快速的清除代谢, 而标记到聚合物上的探针的血药浓度-时间行为与游离Cy5.5探针不同, 表明标记到聚合物上的探针在体内并未发生明显的脱落现象, 该结果从侧面证明用荧光探针标记来示踪聚合物材料体内行为的可行性。
最后, 将从Cy5.5探针、奥沙利铂及铁元素3个方面所获得的血药浓度-时间曲线进行处理和比较(将除30 min点外的其他时间的血药浓度除以30 min点的血药浓度获得各时间点的相对初始浓度比, 将该比值与时间作图), 结果如图 6D所示。由图可知, 从Cy5.5探针、奥沙利铂及铁元素这三个方面获得的3组相对初始浓度比值-时间曲线具有较高的吻合度, 表明这三个参数所代表的聚合物材料、荷载药物及Fe3O4纳米粒内核具有相近的实时血药相对初始浓度比值, 而这三部分构成了载药纳米粒, 因此, 结果表明载药纳米粒具有良好的体内整体稳定性。
6 体内靶向及成像研究采用活体成像的方法研究了靶向及非靶向载药纳米粒在荷瘤小鼠的体内靶向性及组织分布, 结果如图 7所示。在尾静脉给药后的8、12和24 h时, ETP-PtFeNP实验组模型小鼠(图 7A中各小图的左侧) 肿瘤部位(红色虚线圈标记处) Cy5.5荧光的信号明显强于非靶向的PtFeNP给药组(图 7A中各小图的右侧)。且随着时间的进展, ETP-PtFeNP在肿瘤部位的蓄积量逐渐增加。在24 h时, 麻醉后处死实验小鼠, 快速地将其主要脏器和肿瘤组织取出, 利用小动物活体成像对离体组织的荧光信号进行监测。实验结果显示, ETP-PtFeNP实验组模型小鼠的肿瘤部位具有更强的荧光信号(图 7B中的左侧)。离体组织的荧光信号进行ROI半定量分析的结果(图 7C) 同样也表明: 肿瘤靶向的ETP-PtFeNP与非靶向的PtFeNP在肿瘤部位的蓄积量存在显著性差异, ETP-PtFeNP具有更好的肿瘤靶向蓄积效果, 显示出利用ETP多肽靶向肿瘤细胞表面高表达的α-烯醇化酶而使得制剂具有主动靶向性。
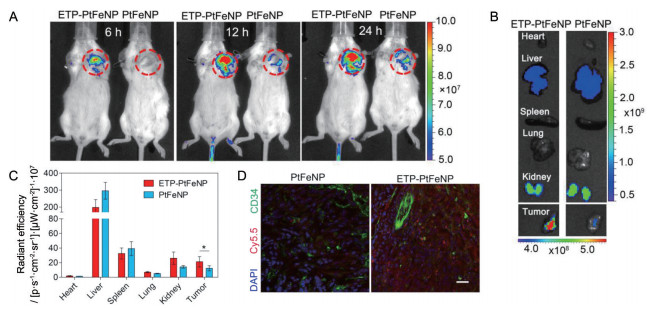
|
Figure 7 In vivo tumor-targeting evaluation of formulations. A: In vivo photographs of tumor-bearing mice administrated with Cy5.5-labeled formulations at 8, 12 and 24 h post-injection; B: Ex vivo photographs of excised organs and tumor tissue by the In Vitro information System at 24 h post-injection; C: Semi-quantitative biodistribution of nanoparticles at 24 h post-injection. n = 4, |
随后, 将肿瘤组织固定在4%的多聚甲醛中, 于-20 ℃的条件下, 制备肿瘤组织的冰冻切片, 并用CD34对肿瘤部位的血管进行免疫荧光染色。结果如图 7D所示, 在两个血管分布相近的视野中(CD34的染色结果相近), ETP-PtFeNP相较于PtFeNP在肿瘤组织具有更明显的蓄积分布。此外, 还发现大部分的ETP-PtFeNP荧光信号分布在血管信号(CD34信号) 的外侧, 表明ETP-PtFeNP此时已跨过血管上皮, 正在向肿瘤深部穿透。结果表明, ETP-PtFeNP对TNBC肿瘤具有较好的穿透性。
7 体内安全性考察给药结束后的各组小鼠, 取不同脏器切片后用苏木精-伊红染色评价了制剂安全性, 结果(图 8) 显示, ETP-PtFeNP和PtFeNP实验组各器官形态及染色状况良好, 没有明显的器官毒性, 显示了具有良好的体内安全性。
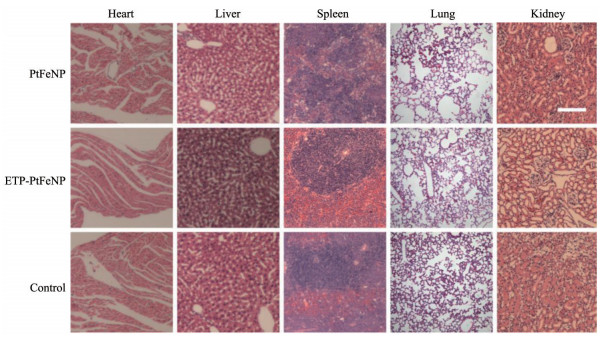
|
Figure 8 H&E staining of organs from 4T1 tumor-bearing mice with different treatment. Scale bar: 200 μm |
利用纳米技术将化疗药物纳米制剂化是目前抗肿瘤药物制剂开发的一大研究热点。本研究在传统的纳米制剂化基础上引入了响应性释药和肿瘤主动靶向机制, 构建了载奥沙利铂的还原敏感型四氧化三铁纳米粒, 对其改善药物药动学行为及肿瘤靶向蓄积的情况进行探究。首先, 通过前药改造方式引入响应性释药机制, 利用双氧水将奥沙利铂中的二价态铂氧化成四价态, 并且暴露出羟基官能团, 能够与丁二酸酐反应后得到羧基修饰的奥沙利铂前药, 随后通过酰胺化反应制备共价荷载奥沙利铂前药的聚乙二醇聚氨基酸嵌段聚合物; 接着, 利用聚合物末端的邻苯二酚结构与油酸修饰的四氧化三铁表面的油酸发生竞争置换, 制备得到载药四氧化三铁纳米粒。DLS和TEM结果显示, 载药纳米粒形态圆整, 具有较好的溶液稳定性。体外的药物响应性释放实验结果显示, 在模拟肿瘤细胞内还原微环境的条件中, 载药纳米粒能实现快速的奥沙利铂响应释放。流式细胞术和在体靶向实验结果显示, 靶向载药纳米粒具有良好的肿瘤靶向性, 能够增加肿瘤细胞对载药纳米粒的摄取及促进载药纳米粒的肿瘤靶向蓄积。在体的药动学考察结果表明, 纳米制剂化能显著增加奥沙利铂AUC0-∞, 约为游离奥沙利铂的5倍, 但对于半衰期的影响并不是非常显著; 同时, 药动学结果还表明通过共价连接及螯合的方式所构建的载药四氧化三铁纳米粒具有较好的体内整体稳定性。综上, 本研究构建的还原响应载奥沙利铂的四氧化三铁纳米粒具有较好的还原响应释药特性、循环稳定性及肿瘤靶向性, 为提高奥沙利铂抗肿瘤治疗效果提供一种潜在的途径。
作者贡献: 蒋晨设计了该研究及指导论文的撰写; 孙涛设计了该研究的合成路线并指导纳米材料的合成; 汪瑜和陈钦俊共同完成了所有实验、数据归纳整理及撰写论文。
利益冲突: 本文所有作者声明无利益冲突。
| [1] |
Kelland L. The resurgence of platinum-based cancer chemotherapy[J]. Nat Rev Cancer, 2007, 7: 573-584. DOI:10.1038/nrc2167 |
| [2] |
Johnstone TC, Suntharalingam K, Lippard SJ. The next generation of platinum drugs: targeted Pt(Ⅱ) agents, nanoparticle delivery, and Pt(Ⅳ) prodrugs[J]. Chem Rev, 2016, 116: 3436-3486. DOI:10.1021/acs.chemrev.5b00597 |
| [3] |
Graham MA, Lockwood GF, Greenslade D, et al. Clinical pharmacokinetics of oxaliplatin: a critical review[J]. Clin Cancer Res, 2000, 6: 1205-1218. |
| [4] |
Overchuk M, Zheng G. Overcoming obstacles in the tumor microenvironment: recent advancements in nanoparticle delivery for cancer theranostics[J]. Biomaterials, 2018, 156: 217-237. DOI:10.1016/j.biomaterials.2017.10.024 |
| [5] |
Maeda H, Nakamura H, Fang J. The EPR effect for macromolecular drug delivery to solid tumors: improvement of tumor uptake, lowering of systemic toxicity, and distinct tumor imaging in vivo[J]. Adv Drug Deliv Rev, 2013, 65: 71-79. DOI:10.1016/j.addr.2012.10.002 |
| [6] |
Xin Y, Yin M, Zhao L, et al. Recent progress on nanoparticle-based drug delivery systems for cancer therapy[J]. Cancer Biol Med, 2017, 14: 228-241. DOI:10.20892/j.issn.2095-3941.2017.0052 |
| [7] |
Bertrand N, Wu J, Xu X, et al. Cancer nanotechnology: the impact of passive and active targeting in the era of modern cancer biology[J]. Adv Drug Deliv Rev, 2014, 66: 2-25. DOI:10.1016/j.addr.2013.11.009 |
| [8] |
Rosenblum D, Joshi N, Tao W, et al. Progress and challenges towards targeted delivery of cancer therapeutics[J]. Nat Commun, 2018, 9: 1410. DOI:10.1038/s41467-018-03705-y |
| [9] |
Liu D, Yang F, Xiong F, et al. The smart drug delivery system and its clinical potential[J]. Theranostics, 2016, 6: 1306-1323. DOI:10.7150/thno.14858 |
| [10] |
Mura S, Nicolas J, Couvreur P. Stimuli-responsive nanocarriers for drug delivery[J]. Nat Mater, 2013, 12: 991-1003. DOI:10.1038/nmat3776 |
| [11] |
Laurent S, Forge D, Port M, et al. Magnetic iron oxide nanoparticles: synthesis, stabilization, vectorization, physicochemical characterizations, and biological applications[J]. Chem Rev, 2008, 108: 2064-2110. |
| [12] |
Da Costa GM, Blanco-Andujar C, De Grave E, et al. Magnetic nanoparticles for in vivo use: a critical assessment of their composition[J]. J Phys Chem B, 2014, 118: 11738-11746. DOI:10.1021/jp5055765 |
| [13] |
Hu Y, Mignani S, Majoral JP, et al. Construction of iron oxide nanoparticle-based hybrid platforms for tumor imaging and therapy[J]. Chem Soc Rev, 2018, 47: 1874-1900. DOI:10.1039/C7CS00657H |
| [14] |
Rezaei SJT, Malekzadeh AM, Ramazani A, et al. pH-sensitive magnetite nanoparticles modified with hyperbranched polymers and folic acid for targeted imaging and therapy[J]. Curr Drug Deliv, 2019, 16: 839-848. DOI:10.2174/1567201816666191002102353 |
| [15] |
Zhao S, Yu X, Qian Y, et al. Multifunctional magnetic iron oxide nanoparticles: an advanced platform for cancer theranostics[J]. Theranostics, 2020, 10: 6278-6309. DOI:10.7150/thno.42564 |
| [16] |
Pala K, Serwotka A, Jeleń F, et al. Tumor-specific hyperthermia with aptamer-tagged superparamagnetic nanoparticles[J]. Int J Nanomedicine, 2014, 9: 67-76. |
| [17] |
Kruse AM, Meenach SA, Anderson KW, et al. Synthesis and characterization of CREKA-conjugated iron oxide nanoparticles for hyperthermia applications[J]. Acta Biomater, 2014, 10: 2622-2629. DOI:10.1016/j.actbio.2014.01.025 |
| [18] |
Wu CH, Kuo YH, Hong RL, et al. α-Enolase-binding peptide enhances drug delivery efficiency and therapeutic efficacy against colorectal cancer[J]. Sci Transl Med, 2015, 7: 290ra291. |
| [19] |
Novohradsky V, Zerzankova L, Stepankova J, et al. Antitumor platinum (Ⅳ) derivatives of oxaliplatin with axial valproato ligands[J]. J Inorg Biochem, 2014, 140: 72-79. DOI:10.1016/j.jinorgbio.2014.07.004 |
 2022, Vol. 57
2022, Vol. 57


