2. 分子药剂学与新释药系统北京市重点实验室, 北京 100191
2. Beijing Key Laboratory of Molecular Pharmaceutics and New Drug Delivery System, Beijing 100191, China
近年来, 基于检查点抑制剂的癌症免疫治疗备受关注[1]。程序性细胞死亡受体-1 (programmed cell death protein 1, PD-1)/程序性死亡受体配体-1 (programmed death receptor-ligand 1, PD-L1) 免疫疗法通过阻断T细胞免疫检查点, 使免疫正常化, 提高了患者的生存率[2-4]。然而该疗法目前仅对部分癌症类型和20%~30%的患者有效[5], 全身性递送PD-1/PD-L1抗体还可能会出现免疫相关不良事件, 这限制了其进一步应用[6]。T细胞是抗肿瘤免疫的关键介质[7], 由免疫抑制性肿瘤微环境(tumor microenvironment, TME) 引起的有限的T细胞浸润是检查点抑制剂治疗失败的关键原因之一[8]。因此, 改善免疫抑制性TME或可增强检查点抑制剂的功效。
癌症相关成纤维细胞(cancer-associated fibroblasts, CAFs) 是TME中含量最丰富的基质细胞之一, 通过分泌多种细胞因子、蛋白酶和细胞外基质, 在塑造免疫抑制性TME中起着重要作用[9]。CAFs分泌的促炎介质C-X-C趋化因子配体12 (C-X-C chemokine ligand 12, CXCL12) 可以通过CXCL12/CXCR4信号通路加速肿瘤的生长和转移[10]。研究发现, CXCL12会抑制肿瘤内T细胞的浸润[8, 11, 12], 阻断CXCL12/CXCR4通路可以提高检查点抑制剂的疗效, 这种联合疗法已成为一种有前途的癌症治疗策略[13, 14]。
由此, 本研究构建了一种基于阳离子脂质体的共给药体系(图 1), 将针对CXCL12的基因疗法和针对PD-L1的免疫疗法联合起来, 以协同增强抗肿瘤免疫反应。选取阳离子脂质体作为共递送载体, 能够有效地将基因药物和多肽药物同时携载。作者将CXCL12 siRNA (siCXCL12) 包载进脂质体内部, 将抗PD-L1肽(NYSKPTDRQYHF) 通过基质金属蛋白酶-2 (matrix metalloproteinase-2, MMP-2) 底物肽CPLGVRGK共价连接至脂质体表面。进入TME后, PD-L1/siCXCL12-Lp响应过表达的MMP-2释放出抗PD-L1肽, 阻断PD-1/PD-L1相互作用; siRNA脂质体进入CAFs以沉默CXCL12基因, 将免疫调节与TME调控相结合, 增强T细胞浸润, 减少调节性T细胞(regulatory T cell, Treg) 的产生, 为癌症免疫治疗探索新的思路。
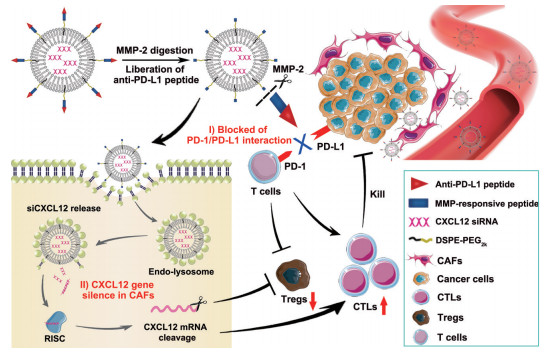
|
Figure 1 Schematic illustration of the mechanism of the tumor microenvironment (TME) responsive liposomes for synergistic treatment of cancer immunotherapy and TME regulation. Ⅰ: Liberation of the anti-programmed death receptor-ligand 1 (PD-L1) peptide due to specific cleavage by matrix metalloproteinase-2 (MMP-2) secreted in tumor region, leading to the blockade of PD-1/PD-L1 interaction; Ⅱ: Transfection of C-X-C chemokine ligand 12 (CXCL12) siRNA in cancer-associated fibroblasts (CAFs). CAF-secreted CXCL12 contributes to tumor metastasis by promoting migration and invasion of tumor cells. The liposome nanosystem is internalized into CAFs, and then the released siRNA leads to CXCL12 gene silencing. As a consequence, the immunosuppressive TME is improved, which contributes to the efficacy of anti-PD-1/PD-L1 therapy. RISC: RNA-induced silencing complex; mRNA: Messenger RNA; CTLs: Cytotoxic T lymphocytes; Tregs: Regulatory T cells |
材料与试剂 CXCL12 siRNA (sense 5'-UCGCCA GAGCCAACGUCAATT-3', antisense 5'-UUGACGUU GGCUCUGGCGATT-3')、羧基荧光素标记的siRNA (FAM-siRNA) (上海吉玛制药公司); 功能肽(pep, 上海强耀公司); (2, 3-二油酰基-丙基)-三甲基氯化铵(DOTAP, 美国MCE公司); 大豆卵磷脂(SPC)、DSPE-mPEG2000 (日本油脂株式会社); 胆固醇(Chol, 日本和光纯药株式会社); GelStain核酸染料(北京全式金公司); Hoechst 33342 (上海翊圣公司); Lysotracker red DND-99 (美国Invitrogen公司); 小鼠MMP-2重组蛋白(北京博知源公司); 小鼠PD-1重组蛋白(上海爱必信公司); 干扰素-γ (interferon-γ, IFN-γ, 北京义翘神州公司); qPCR引物(北京奥科鼎盛公司); Reverse Transcription System、GoTaq® qPCR Master Mix (美国Promega公司); 小鼠MMP-2、PD-1、CXCL12、白细胞介素-10 (interleukin-10, IL-10)、IFN-γ、肿瘤坏死因子-α (tumor necrosis factor-α, TNF-α) ELISA试剂盒(北京冬歌博业公司)。
主要仪器 MOLDI-TOF MS、LC-20A HPLC系统(日本岛津公司); MZ Nano-ZS型激光粒度仪(英国马尔文公司); JEM-200CX型透射电子显微镜(日本JEOL公司); BD Gallios流式细胞仪(美国BD公司); STED 3x型激光共聚焦显微镜(德国Leica公司); Mx3000pTM荧光定量PCR仪(美国安捷伦公司)。
实验细胞 小鼠黑色素瘤细胞(B16F10) 购自美国模式培养物集存库, 小鼠CAFs取自荷4T1乳腺癌的BALB/c雌性裸鼠[9], 在含10% FBS、1%青霉素和1%链霉素的DMEM培养液中于37 ℃、5% CO2条件下培养。
实验动物 雌性C57BL/6小黑鼠(18~20 g, 4~6周龄), 购自北京维通利华公司, 所有动物实验均在北京大学动物实验的指导原则下进行, 实验方案经由北京大学生物医学伦理委员会审查通过。
pep的合成 pep (CPLGVRGK-GGG-NYSKPTD RQYHF) 使用标准Fmoc固相肽合成方法获得[15]。SH-CPLGVRGK是MMP-2的底物肽, NYSKPTDRQYHF (D型氨基酸) 是PD-L1的抑制剂[16]。
DSPE-PEG2000-pep的合成 称取一定量pep和DSPE-PEG2000-Mal (多肽∶脂材= 1∶1.25, mol/mol), 溶于N, N-二甲基甲酰胺(DMF) 中, 加入三乙胺(TEA) (TEA∶pep = 5∶1, mol/mol), 氮气保护下避光反应24 h, 蒸馏水透析(3 500 Da) 48 h即得。取少量样品进行MALDI-TOF MS鉴定。
脂质体的制备及表征 将DOTAP∶SPC∶Chol∶DSPE-mPEG2000 (25∶40∶30∶5, mol/mol) 溶于氯仿/甲醇(4∶1, v/v), 旋蒸成膜, 加入siRNA的葡萄糖溶液水化, 探头超声3 min, 无菌滤膜过滤, 制得包载siRNA的脂质体(siCXCL12-Lp)。共递送siRNA和抗PD-L1肽的脂质体(PD-L1/siCXCL12-Lp) 采用同样方法制备, 不同的是DSPE-mPEG2000被DSPE-PEG2000-pep取代。使用激光粒度仪测定粒径分布、多分散指数(polymer dispersity index, PDI) 和zeta电位, 使用透射电镜(transmission electron microscopy, TEM) 观察形态。
凝胶电泳实验 制备不同N/P的PD-L1/siCXCL12-Lp和含有GelStain核酸染料的琼脂糖凝胶块, 将样品混合液(10 μL待测物+ 2 μL 5 × loading buffer) 加入各样品孔进行电泳, 使用凝胶成像仪拍摄胶片。
红细胞溶血实验 取新鲜大鼠血液8 mL, 放入有玻璃珠的三角瓶中振摇10 min以除去纤维蛋白, 加入生理盐水100 mL混匀。1 500 r·min-1离心15 min, 去上清。取沉淀的红细胞1.5 mL, 加入生理盐水100 mL摇匀, 制得1.5%的红细胞悬液。取4 mL EP管, 编号1~6, 其中1~4号为供试管, 5号为阴性对照, 6号为阳性对照。按表 1依次加入各组分, 混匀后置于37 ℃恒温水浴, 3 h后离心, 观察溶血情况。取上清, 用紫外分光光度计在540 nm下检测吸光度值, 计算溶血率。
| Table 1 Red blood cell hemolysis test. RBCs: Red blood cells |
细胞摄取实验 选取FAM-siRNA作为模型药物标记脂质体。将CAFs以2×105个/孔接种于6孔板中培养24 h。使用100 nmol·L-1的free siRNA、siRNA-Lp和PD-L1/siRNA-Lp与细胞共孵育4 h。磷酸盐缓冲液(phosphate buffered saline, PBS) 洗涤, 消化收集细胞, 使用流式细胞仪测定胞内荧光强度。
共聚焦观察 将CAFs以2×105个/皿接种于共聚焦小皿中培养24 h。使用100 nmol·L-1的free siRNA、siRNA-Lp和PD-L1/siRNA-Lp与细胞共孵育4 h。使用4%多聚甲醛固定, Hoechst 33342染细胞核。采用激光共聚焦显微镜(confocal laser scanning microscopy, CLSM) 观察。
溶酶体逃逸实验 将CAFs以2×105个/皿接种于共聚焦小皿中培养24 h。使用100 nmol·L-1的PD-L1/siRNA-Lp与细胞共孵育0.5和4 h。使用Hoechst 33342染细胞核, Lysotracker red染溶酶体。采用CLSM观察溶酶体逃逸情况。
pep响应MMP-2释放抗PD-L1肽 将pep溶液加入MMP-2缓冲液(15 ng·mL-1) 或预孵育12 h的B16F10细胞培养液中, 于37 ℃水浴, 在不同时间点取样进行HPLC分析检测抗PD-L1肽。色谱柱: Diamonsil C18柱(250 mm × 4.6 mm, 5 μm); 流动相: 乙腈/水在20 min内从17%∶83%到42%∶58%的线性梯度; 流速: 1 mL·min-1; 检测波长: 220 nm; 柱温: 25 ℃; 进样体积: 10 μL。
PD-1/PD-L1相互作用的阻断 使用小鼠MMP-2 ELISA试剂盒测量B16F10细胞培养液中MMP-2的浓度。在用IFN-γ (30 ng·mL-1) 体外上调PD-L1的表达后, 将B16F10细胞接种于6孔板中培养24 h。将培养基更换为含有游离肽、siN.C.-Lp或PD-L1/siN.C.-Lp的无血清培养基, 并加入重组小鼠PD-1蛋白(200 ng·mL-1) 孵育4 h。PBS洗3次, 加入RIPA细胞裂解液和蛋白酶抑制剂提取蛋白样品, 离心取上清, 使用小鼠CXCL12 ELISA试剂盒检测样品中CXCL12的浓度。
CXCL12蛋白表达的测定 将CAFs以2×105个/孔接种于6孔板中培养24 h。使用100 nmol·L-1的free siCXCL12、siCXCL12-Lp、PD-L1/siCXCL12-Lp和PD-L1/si N.C.-Lp与细胞共孵育4 h。PBS洗涤, 继续培养6 h后更换新的培养液培养24 h。使用小鼠CXCL12 ELISA试剂盒测量培养液中的CXCL12蛋白表达。
反转录-实时定量PCR 使用TRNzol Universal从细胞中分离总RNA。使用反转录试剂盒进行反转录过程以获得第一链cDNA。使用引物和GoTaq® qPCR Master Mix进行聚合酶链式反应, 通过实时定量PCR (real-time quantitative polymerase chain reaction, RT-qRCR) 对基因表达进行量化。3-磷酸甘油醛脱氢酶(glyceraldehyde 3-phosphate dehydrogenase, GAPDH) 引物: 正向5'-GGGTGTGAACCATGAGAAGT-3', 反向: 5'-GAC TGTGGTCATGAGTCCT-3'; CXCL12引物: 正向5'-CCTGACGGTAAACTCTTCCCT-3', 反向5'-GCTAGG CAGCTCCTCTTTGG-3'。选取GAPDH作为内参, 使用ΔΔC相对定量法分析。
细胞毒性实验 将CAFs和B16F10细胞分别以8 000个/孔接种于96孔板中培养24 h, 将细胞与free siCXCL12、free peptide、siCXCL12-Lp、PD-L1siCXCL12-Lp和PD-L1siN.C.-Lp共孵育48 h。使用CCK-8法检测细胞活性。
体内药效学考察 将1×106个B16F10细胞皮下注射到小鼠腋窝造模, 将荷瘤小鼠随机分成4组: PBS组、游离肽组、siCXCL12-Lp组和PD-L1/siCXCL12-Lp组, 每组5只。除游离肽组腹腔给药外, 其余组均尾静脉给药, siRNA浓度为1.33 mg·kg-1, 肽浓度为2 mg·kg-1。将初次给药定为第1天, 每隔两天给药1次。每日测量小鼠体重及肿瘤的长径(a) 和短径(b), 按V = 0.5 × a × b2 (mm3) 计算瘤体积。于第10天处死小鼠, 分离肿瘤及各脏器, 称重并进行苏木精&伊红(H&E) 染色观察。
体内免疫细胞分析 解剖小鼠, 分离腹股沟淋巴结、脾和肿瘤并提取淋巴细胞。对于T细胞的标记, 向脾和肿瘤淋巴细胞中加入FITC-CD3、APC-CD25、PerCP/Cyanine5.5-CD4和PE/Cyanine7-CD8a抗体, 孵育30 min, PBS洗涤2次。加入细胞固定液和破膜液孵育30 min, 离心去上清, 破膜液洗涤, 加入PE-FoxP3抗体孵育30 min。对于DC的标记: 向淋巴结和脾淋巴细胞中分别加入APC-CD11c和PE/Cyanine7-I-A/I-E抗体孵育30 min。通过流式细胞术分析T细胞和树突细胞(dendritic cell, DC) 的浸润情况。
趋化因子/细胞因子检测 解剖小鼠, 分离肿瘤, 加入一定量PBS研磨获得细胞悬液, 离心取上清, 使用小鼠CXCL12 ELISA试剂盒检测肿瘤内CXCL12的水平。收集全血, 室温静置后离心取上清, 使用小鼠IL-10、IFN-γ、TNF-α ELISA试剂盒检测血清中相关细胞因子的水平。
统计学方法 使用GraphPad Prism 7软件进行分析, 数据用
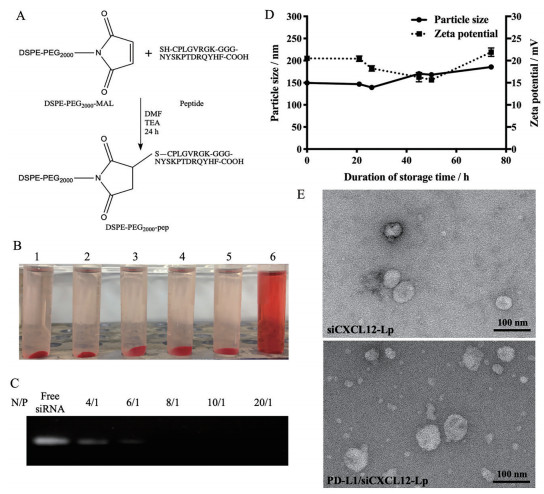
采用薄膜分散法制备了siRNA脂质体(siCXCL12-Lp)。为了制备抗PD-L1肽修饰的siRNA脂质体(PD-L1/siCXCL12-Lp), 根据已有方法[17], 将pep (CPLGVRGK-GGG-NYSKPTDRQYHF) 与DSPE-PEG2000-MAL的马来酰亚胺基团偶联, 合成了DSPE-PEG2000-pep以代替原处方中的DSPE-mPEG2000 (图 2A)。从图 2B可以观察到, 不同浓度PD-L1/siCXCL12-Lp (1~4号) 处理后的红细胞与阴性对照(5号) 相同, 上清无色澄明, 说明没有造成溶血, 与阳性对照(6号) 的全溶血形成鲜明对比。1~5号管的溶血率均几乎为0, 进一步说明PD-L1/siCXCL12-Lp没有造成溶血现象。凝胶电泳阻滞实验表明, siRNA可以以8/1或者更高的N/P有效包封在脂质体中(图 2C), 从而防止其在血液中过早释放, 因此本研究中载有siRNA的脂质体的N/P均设定为8/1。PD-L1/siCXCL12-Lp在4 ℃储存的74 h过程中, 外观无明显变化, 直径和电位保持稳定(图 2D), 表明其没有发生解散或聚集, 能够稳定储存至少3天。
|
Figure 2 Preparation and characterization of liposomes. A: Principle of the synthesis of DSPE-PEG2000-pep; B: Photos of PD-L1/siCXCL12-Lp treated RBCs in different concentrations after centrifugation; C: Gel retardation assay of PD-L1/siCXCL12-Lp at different N/P ratio; D: Particle size and zeta potential of PD-L1/siCXCL12-Lp during the storage for 74 h at 4 ℃; E: Photos of siCXCL12-Lp and PD-L1/siCXCL12-Lp by TEM |
siCXCL12-Lp和PD-L1/siCXCL12-Lp显示出均匀的尺寸分布和正zeta电位, 流体动力学直径在125~155 nm内, PDI小于0.25。TEM图像显示(图 2E), 脂质体呈球形, 直径为50~70 nm, 小于动态光散射测量的水合粒径。脂质体的正电荷由阳性脂材DOTAP提供, PD-L1/siCXCL12-Lp的zeta电位(20.1 mV) 小于siCXCL12-Lp (24.2 mV), 表明电负性多肽的表面修饰会对整体电荷起到一定屏蔽作用。制备的脂质体制剂直径小于200 nm且表面有亲水性PEG包覆, 可以有效减少调理素的识别及网状内皮系统的清除, 从而延长体内循环时间[18]。
2 细胞摄取与溶酶体逃逸为了研究针对CAFs的siRNA递送, 以FAM-siRNA为指标评估了siRNA的细胞内化情况。游离siRNA几乎无法进入细胞。siRNA-Lp和PD-L1/siRNA-Lp表现出显著增强的siRNA内化(图 3A), 表明阳离子脂质体能够促进siRNA内化到CAFs中。相应的结果通过CLSM观察到(图 3B), 与对照组相比, 在siRNA-Lp和PD-L1/siRNA-Lp处理的CAFs中观察到更多的FAM-siRNA (绿色), 发现siRNA-Lp组比PD-L1/siRNA-Lp组具有更强的siRNA摄取, 推测这可能是由于抗PD-L1肽的连接对细胞摄取产生了一定的不利影响, 而这种影响预计可通过肿瘤微环境中抗PD-L1肽的MMP-2响应性断裂得到改善。
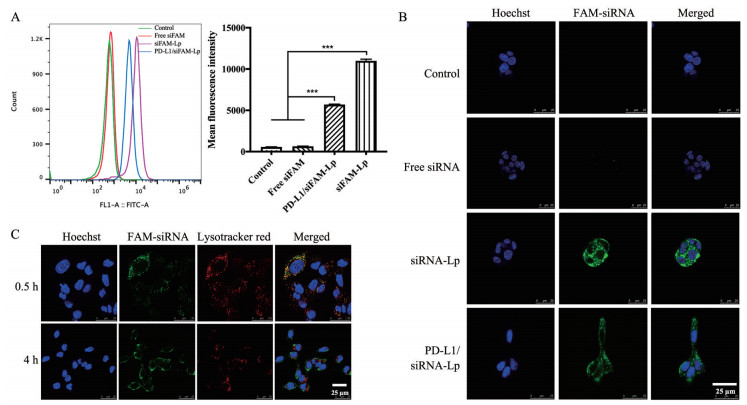
|
Figure 3 Cell uptake and intracellular distribution of liposomes with siRNA at a final concentration of 100 nmol·L-1 for 4 h. A: Mean fluorescence intensity of FAM-siRNA for different formulations. n = 3, |
siRNA被摄取入胞后必须从溶酶体中逃逸才能发挥其基因沉默作用[19]。将CAFs与PD-L1/siRNA-Lp共孵育, 并在CLSM成像前用Lysotracker red对溶酶体进行染色, 可以观察到FAM-siRNA (绿色) 在0.5 h时与溶酶体(红色) 有较强的共定位, 而在4 h时不再共定位(图 3C), 表明siRNA已成功从溶酶体中逃逸, 以发挥其后续的基因沉默作用。
3 体外阻断PD-1/PD-L1相互作用MMPs在TME中高表达, 已被广泛用作癌症的生物标志物和治疗靶标[20]。使用ELISA试剂盒测量B16F10细胞MMP-2的体外分泌情况, 12 h培养液中MMP-2达到91.5 ng·mL-1 (图 4A)。HPLC分析证实了pep的MMP-2敏感性裂解能力。pep在11.3 min出峰, 加入15 ng·mL-1的MMP-2缓冲液后, 随着时间延长, 原始峰不断减小, 在12.3 min处出现新的产物峰且不断增大, 说明pep在MMP-2的作用下出现时间依赖性断裂(图 4B)。在与MMP-2浓度为91 ng·mL-1的B16F10细胞培养液孵育10 min后, 在12.3 min处同样出现新的产物峰, 证明了pep能够有效响应MMP-2并释放出抗PD-L1肽。
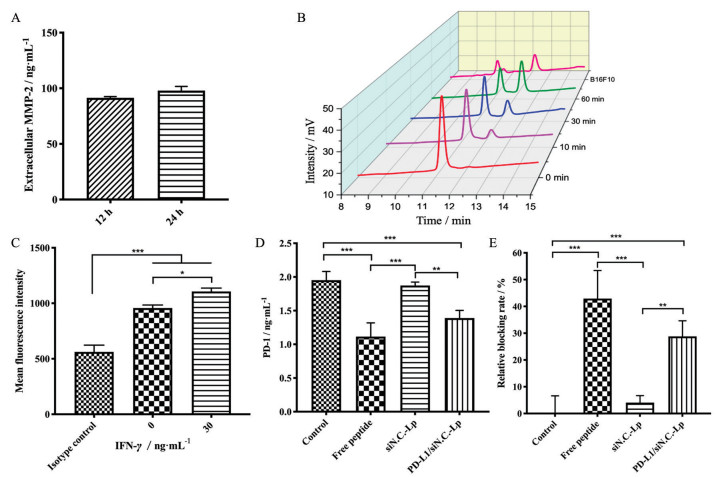
|
Figure 4 Blockade of PD-1/PD-L1 interaction in vitro. A: MMP-2 protein expression of B16F10 cells determined by ELISA; B: MMP-2 responsive cleavage of peptide in vitro determined by HPLC with MMP-2 buffer (15 ng·mL-1) or B16F10 cell culture medium (91.5 ng·mL-1); C: Flow cytometry analysis of the upregulation of PD-L1 on B16F10 cells treated with 30 ng·mL-1 interferon-γ (IFN-γ) for 24 h; D: The concentration of PD-1 in B16F10 cells; E: The PD1/PD-L1 interaction blockade in B16F10 cells. n = 3, |
由于PD-L1在体外肿瘤细胞培养过程中低表达[21], 使用IFN-γ体外上调了B16F10细胞上的PD-L1, 并通过流式细胞术进行了证实(图 4C)。据文献[16]报道, 抗PD-L1肽以高亲和力与PD-L1结合, 从而竞争性阻断PD-1与PD-L1的结合。将PBS、游离肽、siN.C.-Lp或PD-L1/siN.C.-Lp与重组小鼠PD-1蛋白共同给药, 通过测量与肿瘤细胞PD-L1结合的PD-1的量(图 4D) 推算PD-1/PD-L1的阻断效率(图 4E)。游离肽和PD-L1/siN.C.-Lp显著阻断了PD1/PD-L1的相互作用, 相比对照组, 分别达到了42.9%和28.8%的抑制率。结果表明, B16F10细胞分泌的MMP-2可以裂解pep并释放抗PD-L1肽, 在体外有效破坏PD-1/PD-L1的相互作用。
4 体外基因沉默效果和细胞毒性脂质体可以成功地将siRNA递送至CAFs并实现溶酶体逃逸, 因此作者进一步评估了其基因沉默效率。以GAPDH为内参基因, 使用RT-qPCR法研究了CXCL12 mRNA的相对表达量。PD-L1/siCXCL12-Lp和siCXCL12-Lp分别实现了38.0%和49.7%的基因沉默效率(图 5A)。mRNA的下调直接降低了CXCL12蛋白的表达(图 5B)。ELISA结果显示, siCXCL12-Lp和PD-L1/siCXCL12-Lp组中CXCL12的表达分别降低了36.4%和33.8%, 这与mRNA检测结果一致。结果表明, 设计的脂质体制剂能够有效沉默CAFs中CXCL12 mRNA的表达, 从而实现CXCL12蛋白表达的下调。为了评估细胞毒性, 将各给药制剂与CAFs和B16F10细胞共孵育, 使用CCK-8法研究了细胞活力, 在两种细胞中都未检测到明显的细胞毒性(图 5C)。
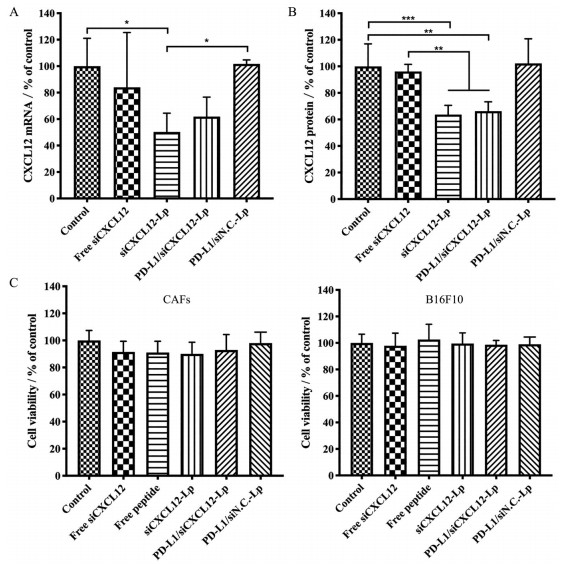
|
Figure 5 In vitro gene-silencing effect and cytotoxicity of different formulations. A: The level of CXCL12 mRNA determined by quantitative real-time PCR. CAFs were transfected with various samples carrying siCXCL12 or siN.C. at 37 ℃ for 4 h; B: CXCL12 protein expression determined by ELISA after culturing with various formulations carrying CXCL12 siRNA or siN.C. in CAFs; C: Cell viability of CAFs and B16F10 after treated with different formulations for 48 h with 0.1 mg·mL-1 peptide or 100 nmol·L-1 siCXCL12. n = 3, |
使用荷B16F10黑色素瘤的C57BL/6小鼠研究了PD-L1/siCXCL12-Lp的抗肿瘤效果和全身毒性。当肿瘤生长到100~200 mm3时, 将小鼠随机分成4组并分别给予PBS、游离肽、siCXCL12-Lp和PD-L1/siCXCL12-Lp治疗。PD-L1/siCXCL12-Lp的肿瘤体积(图 6A) 和重量(图 6B) 显著低于PBS组, 肿瘤生长抑制率达到52.08%。结果表明, PD-L1/siCXCL12-Lp联合了针对CXCL12的基因疗法和针对PD-L1的免疫疗法, 在体内实验中达到了最好的肿瘤治疗效果。
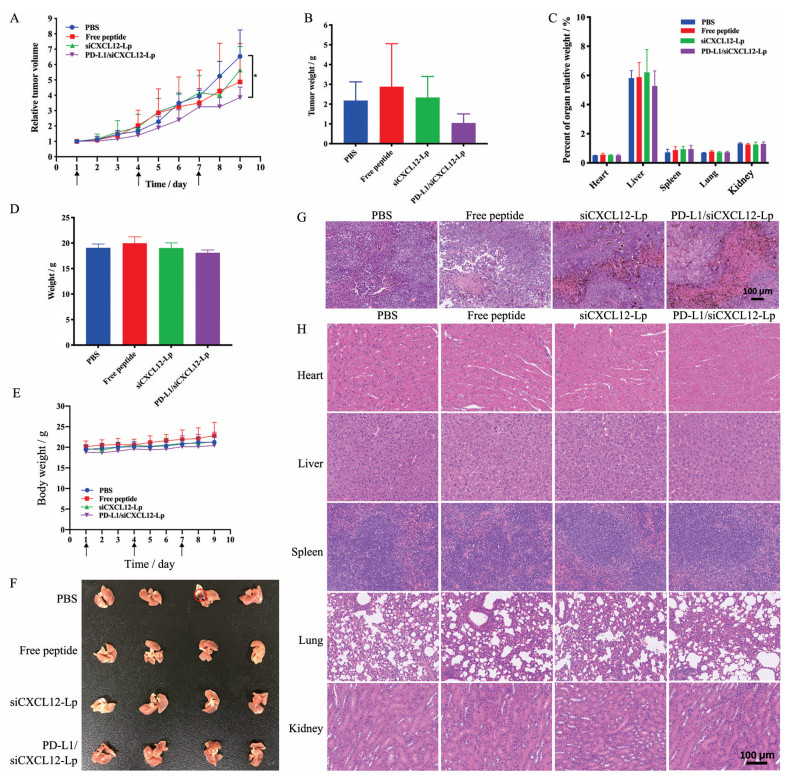
|
Figure 6 Tumor inhibition efficiency and systemic toxicity of different formulations using B16F10 tumor-bearing C57BL/6 mice. A: Relative tumor volume-time curve. n = 3, |
实验期间所有小鼠的脏器指数(图 6C) 无明显差异, 体重正常增加(图 6D), 净体重(图 6E) 无明显差异。观察肿瘤肺转移发现, 仅有PBS组出现1例(图 6F) 大面积的肿瘤转移, 其他组均未观察到明显的肺转移结节。各组肿瘤的H&E染色显示(图 6G), PBS组表现出明显的肿瘤快速增殖现象, siCXCL12-Lp和PD-L1/siCXCL12-Lp组则出现了一定程度上的核固缩和坏死现象。主要脏器H&E染色(图 6H) 显示, 与PBS组相比, 各给药组小鼠的心、肝、脾、肺和肾的图像均未显示出明显差异。结果表明, 各制剂对小鼠没有造成明显的系统毒性, 体内安全性良好。
6 体内免疫学分析为了进一步探究抗肿瘤免疫效果, 检测了小鼠免疫细胞和相关细胞因子的变化。CD4+ T、CD8+ T和Treg细胞是T细胞的主要亚群。分析给药后肿瘤和脾内T细胞的结果(图 7) 发现, 尽管各组制剂对CD4+和CD8+ T细胞未起到显著的促进作用, 但PD-L1/siCXCL12-Lp在一定程度上抑制了Treg的增殖, 从而导致CD8+/Treg有所提高。一般认为CD8+/Treg越高, 抗肿瘤效果越好[22], 联合给药抑制了Treg增殖, 改善了免疫抑制性TME, 有利于抗PD-L1免疫疗法更好地发挥作用。PD-L1/siCXCL12-Lp组的脾和淋巴结内DC表达的MHC-II相比其他组均有提高, 表明联合治疗增强了小鼠DC的成熟和抗原呈递能力, 进一步增强了免疫疗效。
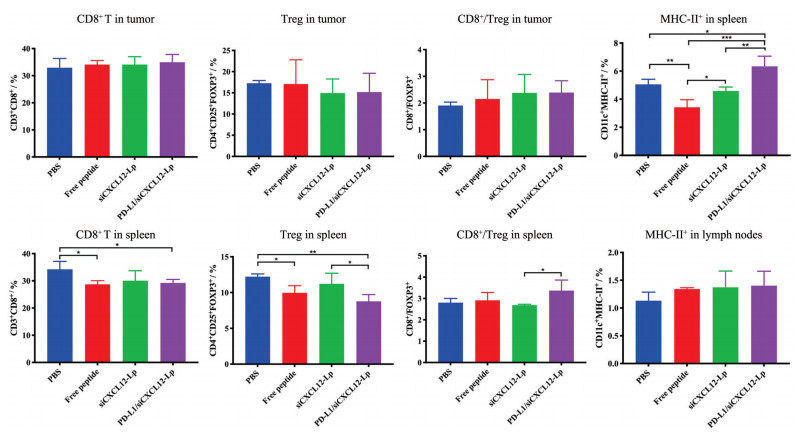
|
Figure 7 Flow cytometry analysis results of the changes of immune cells in tumor, spleen or lymph nodes. n = 3, |
检测肿瘤部位的CXCL12发现(图 8), siCXCL12-Lp和PD-L1/siCXCL12-Lp组的CXCL12水平均低于PBS组, 表明siCXCL12在体内发挥了基因沉默作用, 有效抑制了CXCL12分泌。IL-10是Th-2型细胞因子, 对癌症的免疫抑制和转移至关重要[23]。siCXCL12-Lp和PD-L1/siCXCL12-Lp都显著抑制了IL-10的分泌, 说明siRNA通过沉默CXCL12, 改善了免疫抑制性TME。IFN-γ和TNF-α是细胞毒性T细胞分泌的Th-1型细胞因子, 会促进T细胞对肿瘤的杀伤作用[24]。PD-L1/siCXCL12-Lp组IFN-γ和TNF-α的水平都显著高于PBS组, 说明其有效促进了T细胞的抗肿瘤活性。
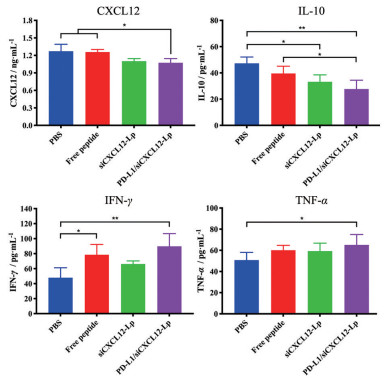
|
Figure 8 ELISA analysis results of the changes of cytokines. n = 3, |
本研究成功构建了共递送CXCL12 siRNA和抗PD-L1肽的阳离子脂质体(PD-L1/siCXCL12-Lp), 脂质体具有良好的制剂学性质、细胞摄取能力和溶酶体逃逸效果, 能够响应TME中高表达的MMP-2而释放出抗PD-L1肽, 以破坏PD-1/PD-L1的相互作用, 并且具有良好的基因沉默效果和安全性。在动物实验中, PD-L1/siCXCL12-Lp联合了针对CXCL12的siRNA疗法和针对PD-L1的免疫疗法, 改善了免疫抑制性TME, 提高了免疫细胞的浸润及抗肿瘤活性, 最终有效抑制了肿瘤生长, 并且具有良好的体内安全性。
作者贡献: 齐宪荣、仰浈臻和王如东提出研究的整体思路; 王如东负责主要实验操作及文章的撰写; 彭祎玮、杜祎甜、林萌和孙琪负责协助实验操作及数据分析; 齐宪荣负责最终版本修订。
利益冲突: 所有作者声明无利益冲突。
| [1] |
Morse MA, Hall JR, Plate JM. Countering tumor-induced immunosuppression during immunotherapy for pancreatic cancer[J]. Expert Opin Biol Ther, 2009, 9: 331-339. DOI:10.1517/14712590802715756 |
| [2] |
Rosenberg SA, Restifo NP. Adoptive cell transfer as personalized immunotherapy for human cancer[J]. Science, 2015, 348: 62-68. DOI:10.1126/science.aaa4967 |
| [3] |
Tumeh PC, Harview CL, Yearley JH, et al. PD-1 blockade induces responses by inhibiting adaptive immune resistance[J]. Nature, 2014, 515: 568-571. DOI:10.1038/nature13954 |
| [4] |
Yan SJ, Sun L, Wan GH. The mechanism and research progress of drug resistance of PD-1/PD-L1 immunotherapy in tumors[J]. Acta Pharm Sin (药学学报), 2019, 54: 1728-1734. |
| [5] |
Johnson DB, Balko JM, Compton ML, et al. Fulminant myocarditis with combination immune checkpoint blockade[J]. N Engl J Med, 2016, 375: 1749-1755. DOI:10.1056/NEJMoa1609214 |
| [6] |
Michot JM, Bigenwald C, Champiat S, et al. Immune-related adverse events with immune checkpoint blockade: a comprehensive review[J]. Eur J Cancer, 2016, 54: 139-148. DOI:10.1016/j.ejca.2015.11.016 |
| [7] |
Le DT, Jaffee EM. Harnessing immune responses in the tumor microenvironment: all signals needed[J]. Clin Cancer Res, 2013, 19: 6061-6063. DOI:10.1158/1078-0432.CCR-13-2424 |
| [8] |
Feig C, Jones JO, Kraman M, et al. Targeting CXCL12 from FAP-expressing carcinoma-associated fibroblasts synergizes with anti-PD-L1 immunotherapy in pancreatic cancer[J]. Proc Natl Acad Sci U S A, 2013, 110: 20212-20217. DOI:10.1073/pnas.1320318110 |
| [9] |
Pang N, Li J, Sun AN, et al. Prior anti-CAFs break down the CAFs barrier and improve accumulation of docetaxel micelles in tumor[J]. Int J Nanomedicine, 2018, 13: 5971-5990. DOI:10.2147/IJN.S171224 |
| [10] |
Dewan MZ, Ahmed S, Iwasaki Y, et al. Stromal cell-derived factor-1 and CXCR4 receptor interaction in tumor growth and metastasis of breast cancer[J]. Biomed Pharmacother, 2006, 60: 273-276. DOI:10.1016/j.biopha.2006.06.004 |
| [11] |
Vianello F, Papeta N, Chen T, et al. Murine B16 melanomas expressing high levels of the chemokine stromal-derived factor-1/CXCL12 induce tumor-specific T cell chemorepulsion and escape from immune control[J]. J Immunol, 2006, 176: 2902-2914. DOI:10.4049/jimmunol.176.5.2902 |
| [12] |
Jaafar F, Righi E, Lindstrom V, et al. Correlation of CXCL12 expression and FoxP3+ cell infiltration with human papillomavirus infection and clinicopathological progression of cervical cancer[J]. Am J Pathol, 2009, 175: 1525-1535. DOI:10.2353/ajpath.2009.090295 |
| [13] |
Guo F, Wang Y, Liu J, et al. CXCL12/CXCR4: a symbiotic bridge linking cancer cells and their stromal neighbors in oncogenic communication networks[J]. Oncogene, 2016, 35: 816-826. DOI:10.1038/onc.2015.139 |
| [14] |
Miao L, Li J, Liu Q, et al. Transient and local expression of chemokine and immune checkpoint traps to treat pancreatic cancer[J]. ACS Nano, 2017, 11: 8690-8706. DOI:10.1021/acsnano.7b01786 |
| [15] |
Liu Y, Chen XG, Yang PP, et al. Tumor microenvironmental pH and enzyme dual responsive polymer-liposomes for synergistic treatment of cancer immuno-chemotherapy[J]. Biomacromolecules, 2019, 20: 882-892. DOI:10.1021/acs.biomac.8b01510 |
| [16] |
Chang HN, Liu BY, Qi YK, et al. Blocking of the PD-1/PD-L1 interaction by a D-peptide antagonist for cancer immunotherapy[J]. Angew Chem Int Ed Engl, 2015, 54: 11760-11764. DOI:10.1002/anie.201506225 |
| [17] |
Yang ZZ, Li JQ, Wang ZZ, et al. Tumor-targeting dual peptides-modified cationic liposomes for delivery of siRNA and docetaxel to gliomas[J]. Biomaterials, 2014, 35: 5226-5239. DOI:10.1016/j.biomaterials.2014.03.017 |
| [18] |
Bae YH, Park K. Targeted drug delivery to tumors: myths, reality and possibility[J]. J Control Release, 2011, 153: 198-205. DOI:10.1016/j.jconrel.2011.06.001 |
| [19] |
Pecot CV, Calin GA, Coleman RL, et al. RNA interference in the clinic: challenges and future directions[J]. Nat Rev Cancer, 2011, 11: 59-67. |
| [20] |
Piperigkou Z, Manou D, Karamanou K, et al. Strategies to target matrix metalloproteinases as therapeutic approach in cancer[J]. Methods Mol Biol, 2018, 1731: 325-348. |
| [21] |
Dong H, Strome SE, Salomao DR, et al. Tumor-associated B7-H1 promotes T-cell apoptosis: a potential mechanism of immune evasion[J]. Nat Med, 2002, 8: 793-800. DOI:10.1038/nm730 |
| [22] |
Pedroza GA, Zhou G, Vargas ME, et al. Tumor-infiltrating plasmacytoid dendritic cells promote immunosuppression by Tr1 cells in human liver tumors[J]. Oncoimmunology, 2015, 4: e1008355. DOI:10.1080/2162402X.2015.1008355 |
| [23] |
Burkholder B, Huang RY, Burgess R, et al. Tumor-induced perturbations of cytokines and immune cell networks[J]. Biochim Biophys Acta, 2014, 1845: 182-201. |
| [24] |
Molavi O, Ma Z, Hamdy S, et al. Synergistic antitumor effects of CpG oligodeoxynucleotide and STAT3 inhibitory agent JSI-124 in a mouse melanoma tumor model[J]. Immunol Cell Biol, 2008, 86: 506-514. |
 2022, Vol. 57
2022, Vol. 57


