2. 新疆生产建设兵团总医院普外科, 新疆 乌鲁木齐 832002;
3. 北京大学药学院, 北京 100191
2. Department of General Surgery, Hospital of Xinjiang Production and Construction Corps, Urumchi 832002, China;
3. School of Pharmaceutical Sciences, Peking University, Beijing 100191, China
荧光成像作为一种实时、便捷、灵敏度高和无创伤的成像技术[1-8], 被用于成像引导的肿瘤手术治疗[9, 10]。荧光成像引导手术治疗的方法主要通过荧光成像设备和荧光探针来完成。具体而言, 在术前或术中向患者体内注射肿瘤特异性成像的荧光探针, 术中通过荧光成像设备照射并收集荧光探针发射的荧光, 通过影像方式帮助外科医生更好地切除肿瘤组织。目前已报道的肿瘤特异性成像荧光探针主要包括两类, 一类是针对肿瘤细胞表面多样的表面受体分子, 如叶酸受体α、表皮生长因子受体[11, 12]进行设计的靶向探针, 然而这类靶向标志物仅在部分肿瘤亚型中存在, 其相应探针无法对肿瘤进行广谱性成像[13, 14]; 另一类是针对肿瘤微环境中高表达的标志物, 如针对低pH、还原性谷胱甘肽及酶等设计的生物响应型荧光探针可对多种肿瘤模型进行成像, 受到广泛关注。
在生物响应型荧光探针中, 基于肿瘤偏酸性微环境[15, 16]而设计的超pH敏感(ultra-pH sensitive, UPS) 荧光纳米探针具有灵敏度超高、成像效果好和适用于多种肿瘤[17]等多重优势, 转化前景良好。UPS探针由亲水嵌段、疏水嵌段及同疏水嵌段偶联的荧光基团构成。每种UPS探针均存在特定的pH转变点(transition pH point, pHt), 即当环境pH > pHt时, UPS探针维持纳米粒结构, 偶联在其疏水性内核的荧光基团由于荧光共振能量转移而相互淬灭, 使UPS探针处于“非激活”状态, 不发荧光; 当环境pH < pHt时, UPS探针的纳米结构解散成单体形式, 纳米探针转变成“激活状态”, 发出强烈荧光(图 1A)。该类UPS探针对pH的响应非常灵敏, 可在0.3个pH单位内从“非激活”状态迅速转变成“激活”状态, 荧光增强倍数达到100倍[18]以上。目前文献[17]已报道了一种吲哚菁绿(indocyanine green, ICG) 偶联的UPS探针用于术中成像引导的肿瘤手术, 可实现对肿瘤组织更好更快的切除, 大大延长荷瘤小鼠术后生存期。
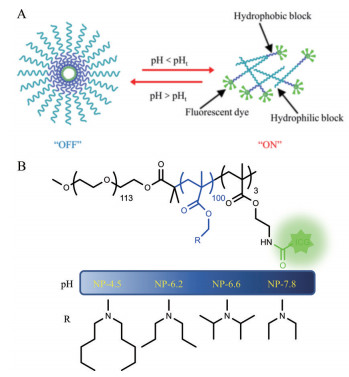
|
Figure 1 A: Formation and dissolution of ultra-pH sensitive nanoprobe. B: The structure of ultra-pH sensitive fluorescent nanoprobes with different hydrophobic blocks and various pH transition points (4.5, 6.2, 6.6, 7.8) |
虽然肿瘤组织的微环境偏酸性, 但肿瘤内部的酸度值极为复杂。首先, 造成肿瘤酸性pH环境的原因是复杂多样的, 如糖酵解[19]、乏氧[20]、呼吸作用及CO2的生成[21]、单羧酸转运体[22]等都可以使肿瘤部位pH呈酸性。正是因为各种不同原因, 使得肿瘤组织内部不同部位的pH值并不完全一致。其次, 尽管肿瘤微环境的pH值常处在6.8附近, 然而肿瘤内部不同细胞器之间pH亦不相同。因此, 在复杂的体内环境中, 究竟哪种pHt的UPS探针对荷瘤小鼠模型具有更好的成像效果, 尚不清楚。
基于这一点, 本研究以聚乙二醇5000 (PEG5000) 作为亲水嵌段, 2-(二戊基氨基) 甲基丙烯酸乙酯(D5A)、2-(二丙基氨基) 甲基丙烯酸乙酯(nDPA)、2-(二异丙基氨基)甲基丙烯酸乙酯(iDPA)或2-(二乙基氨基)甲基丙烯酸乙酯(DEA)作为疏水嵌段, ICG作为荧光分子, 设计合成了4种具有不同pH转变点(pHt 4.5、6.2、6.6、7.8) 的超pH敏感荧光纳米探针(图 1B), 研究不同探针对荷瘤小鼠模型中肿瘤成像效果的影响。
材料与方法药品与试剂 小鼠乳腺癌细胞(4T1, ATCC细胞库); DMEM培养基(北京中科迈晨科技有限公司); 青霉素-链霉素、胎牛血清(Thermo Fisher公司); 胰酶(北京鼎国昌盛生物技术有限责任公司); 聚乙二醇5000-甲氧基(PEG5000-OCH3)、溴化铜、偶氮二异丁腈(AIBN) (Aladdin公司); 三丙二醇甲醚醋酸酯(TPMA)、甲基丙烯酸烯丙酯(AMA)、2-(二异丙基氨基)甲基丙烯酸乙酯(iDPA) (Sigma公司); 2-(二戊基氨基) 甲基丙烯酸乙酯(D5A)、2-(二丙基氨基) 甲基丙烯酸乙酯(nDPA)、2-(二乙基氨基) 甲基丙烯酸乙酯(DEA)、吲哚菁绿-活性酯(ICG-OSU) (索莱宝科技有限公司); 2-溴异丁酰溴、芘(上海毕得医药科技有限公司); 三乙胺(TEA)、丙酮、甲苯、N, N-二甲基甲酰胺(DMF)、异丙醇、二氯甲烷(DCM)、四氢呋喃(THF)、氘代氯仿(伊诺凯科技有限公司); Amicon 50 mL超滤管(MWCO = 100 kDa, Merck公司); 纤维素透析袋(5 000 Da, 北京贝洛生物科技有限公司)。
仪器 小动物活体成像仪(IVIS Lumina LT Series III, 美国PerkinElmer公司); 激光粒度仪(Nicomp 380 N3000, 美国PSS公司); 核磁共振氢谱仪(AVANCE Ⅲ HD 400M, 瑞士Bruker公司); 荧光分光光度计(上海光棱技术有限公司); 场发射透射电镜(Tecnai G2F30, 荷兰FEI公司); 凝胶渗透色谱仪(LC20, 日本岛津公司)。
实验动物 SPF级BALB/c小鼠(雌性, 6~8周) 购自北京维通利华实验动物技术有限公司, 实验动物使用许可证: SYXK (京) 2017-0033, 饲养于北京大学基础医学院系统生物医学研究所SPF级饲养室, 所有动物实验均经北京大学医学部动物伦理委员会批准, 严格遵循北京大学医学部实验动物福利规定。
具有不同pH转变点的超pH敏感聚合物材料的合成 利用原子转移自由基聚合反应(atom transfer radical polymerization, ATRP) 合成超pH敏感高分子材料, 其中以2-(二丙基氨基) 甲基丙烯酸乙酯(nDPA)、2-(二异丙基氨基) 甲基丙烯酸乙酯(iDPA)、2-(二乙基氨基) 甲基丙烯酸乙酯(DEA) 或2-(二戊基氨基) 甲基丙烯酸乙酯(D5A) 为单体分别合成超pH敏感聚合物材料, 具体步骤如下: 称取0.6 μmol聚乙二醇5000-甲氧基(PEG5000-OCH3) 于圆底烧瓶当中, 取适量甲苯使其充分溶解, 120 ℃回流冷凝1 h。减压蒸馏除去甲苯, 取适量二氯甲烷完全溶解, 并向其中加入0.6 μmol 2-溴异丁酰溴和1.2 μmol三乙胺, 室温搅拌反应8 h。反应完成后, 减压蒸馏除去反应溶剂, 改用四氢呋喃进行溶解, 用去离子水透析48 h, 待四氢呋喃除去后, 冷冻干燥, 得到引发剂PEG5000-Br。称取0.04 mmol三丙二醇甲醚醋酸酯、0.04 mmol溴化铜、0.04 mmol PEG5000-Br、4 mmol不同聚合物单体于圆底烧瓶当中, 取适量N, N-二甲基甲酰胺和异丙醇(体积比1∶1) 完全溶解, 再向其中加入0.008 mmol偶氮二异丁腈, 0.12 mmol甲基丙烯酸烯丙酯, 70 ℃无氧条件下进行聚合反应48 h。待反应完成后, 产物用去离子水透析48 h, 冷冻干燥, 即得超pH敏感聚合物材料。采用核磁共振氢谱(proton nuclear magnetic resonance, 1H NMR) 和凝胶渗透色谱仪(gel permeation chromatograph, GPC) 对UPS聚合物材料进行表征。
具有不同pH转变点的超pH敏感荧光纳米探针材料的合成 称取ICG-OSU 1 mg和超pH敏感聚合物材料32 mg, 溶解于二氯甲烷, 室温避光搅拌反应24 h。减压蒸馏除去二氯甲烷, 取适量四氢呋喃溶解, 用去离子水透析48 h, 冷冻干燥, 即合成超pH敏感荧光纳米探针材料。
超pH敏感荧光纳米探针的制备 称取超pH敏感荧光纳米探针材料1 mg, 充分溶解于200 μL四氢呋喃中。水浴超声3~5 min, 同时向四氢呋喃中加入去离子水400~600 μL。将所得溶液转移至超滤管(MWCO = 100 kDa) 中, 4 ℃, 5 000 r·min-1, 离心20 min, 重复此步骤清洗4~5次。所得溶液用磷酸盐缓冲溶液(PBS) 定容至1 mL, 得到浓度为1 mg·mL-1的超pH敏感荧光纳米探针。
超pH敏感荧光纳米探针的表征 通过动态光散射法(dynamic light scattering, DLS) 对所制备超pH敏感纳米探针的粒径、多分散指数(polydispersity index, PDI) 及zeta电位进行测定。设置激光粒度仪入射光与散射光夹角为90°, 温度为23 ℃。
透射电镜的表征 利用透射电子显微镜考察所制备超pH敏感纳米探针形态及pH转变点下的解散情况。取适量所制备的超pH敏感纳米探针分别滴入具有不同pH值的PBS中, 静置1 min, 取10 μL上述溶液滴于铜网上, 吸附3 min后用滤纸吸干, 再滴加4%磷钨酸溶液负染90 s后用滤纸吸干, 重复此步骤1次, 铜网放置过夜自然挥干。所制备的超pH敏感纳米探针操作同上。
临界胶束浓度的检测 采用芘荧光探针法测定所制备超pH敏感纳米探针的临界胶束浓度(critical micelle concentration, CMC)。称取适量的芘, 配制浓度为2×10-4 mol·L-1的四氢呋喃溶液。取5 μL芘溶液于5 mL离心管中, 并向其中加入2 mL不同浓度(0.01~1 000 μg·mL-1) 的超pH敏感纳米探针溶液, 使溶液中芘的浓度最终为5×10-7 mol·L-1, 振荡混匀。设置激发波长335 nm, 发射波长为360~390 nm, 激发狭缝为10 nm, 发射狭缝为2 nm。
体外稳定性检测 取适量所制备的超pH敏感纳米探针加入到含10%胎牛血清的磷酸盐缓冲溶液(PBS, 0.1 mol·L-1, pH 7.4) 中, 分别在2、4、6、8和24 h对粒径大小进行检测, 0 h为所制备超pH敏感纳米探针未加入含10%胎牛血清磷酸盐溶液时的初始粒径。
超pH敏感荧光纳米探针体外成像效果评价 将50 μL 1 mg·mL-1超pH敏感荧光纳米探针分别加入到350 μL不同pH值的PBS, 涡旋混匀后, 对不同pH值下的超pH敏感纳米探针进行荧光激活效果和灵敏度的检测。为此, 通过标准化荧光强度[normalized fluorescence intensity, NFI = (F-Fmin) / (Fmax-Fmin)] 和ΔpH (ΔpH = pH10% NFI - pH90% NFI) 对UPS探针进行评价。其中, F为不同pH条件下UPS纳米探针的荧光强度, Fmax和Fmin分别为低pH环境下, “ON”状态的最大荧光强度和高pH环境下, “OFF”状态的最小荧光强度。ΔpH即标准化荧光强度由10%至90%时的pH变化。配制不同pH值0.2 mol·L-1 PBS, 将10 μL 1 mg·mL-1的超pH敏感纳米探针分别加入190 μL不同pH值的PBS, 涡旋混匀后, 将200 μL的溶液分别加入到96孔板中, 利用活体成像仪检测其荧光成像效果。
荷瘤小鼠模型的建立 用含10%胎牛血清、1%双抗(青霉素/链霉素) 的DMEM培养基培养小鼠乳腺癌细胞至稳定状态, 再用0.25%胰酶消化小鼠乳腺癌细胞形成单细胞悬液, 以2×106个/mL接种于BALB/c小鼠的右侧胸部皮下部位。待小鼠肿瘤形成(7~8天), 经尾静脉注射UPS纳米探针(1 mg·kg-1) 至小鼠体内。利用活体成像仪对BALB/c小鼠分别在不同时间点进行活体成像, 检测超pH敏感荧光纳米探针体内成像效果。
超pH敏感荧光纳米探针体内活体成像效果评价 待小鼠肿瘤形成, 经尾静脉注射UPS纳米探针溶液(1 mg·kg-1) 至小鼠体内。利用活体成像仪对BALB/c小鼠分别在2、4、6、8和24 h进行活体成像检测超pH敏感荧光纳米探针体内成像效果。24 h后, 取荷瘤小鼠肿瘤组织及正常器官组织进行离体荧光成像分析。
数据分析 实验数据以
将溴化铜作为催化剂和具有不同取代基的甲基丙烯酸酯单体通过原子转移自由基聚合(ATRP) 的方法合成超pH敏感聚合物材料。选择美国食品药品监督管理局(Food and Drug Administration, FDA) 批准的ICG为近红外荧光染料, 经N-琥珀酰亚胺酯活化后与UPS聚合物上游离氨基进行反应, 合成相应的荧光纳米探针(图 2)。通过核磁共振氢谱确证不同pHt的超pH敏感高分子材料的结构(图 3)。通过GPC测定不同材料的分子质量, 如表 1所示。
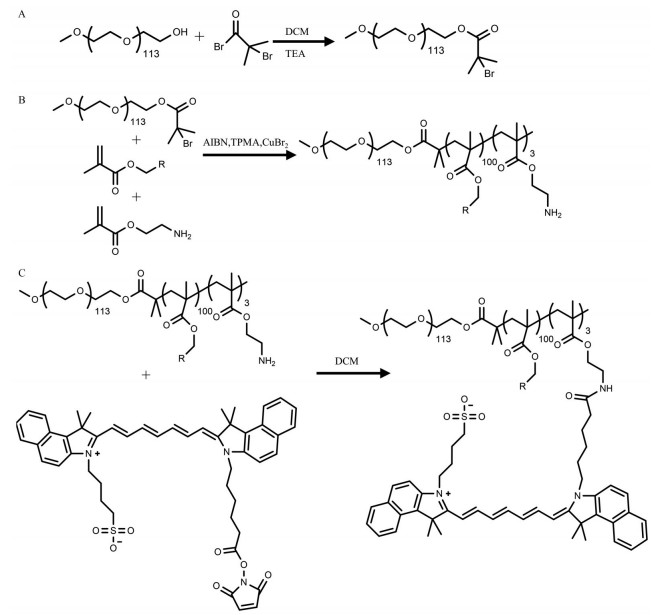
|
Figure 2 A: Synthesis of PEG5000-Br macroinitiator. B: Synthesis of ultra-pH sensitive materials. C: Synthesis of ultra-pH sensitive fluorescent nanoprobes. DCM: Dichloromethane; TEA: Triethylamine; AIBN: Azobisisobutyronitrile; TPMA: Tris (2-pyridylmethyl) amine |
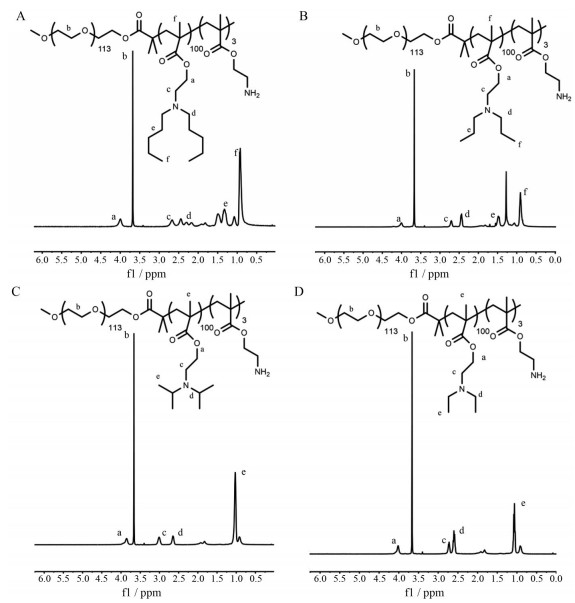
|
Figure 3 1H NMR spectra of different ultra-pH sensitive fluorescent nanoprobe materials. A: NP-4.5; B: NP-6.2; C: NP-6.6; D: NP-7.8 |
|
Table 1 Characterization of different ultra-pH sensitive fluorescent nanoprobes. n = 3, |
动态光衍射法测定超pH敏感纳米探针的粒径为35 nm左右, 粒径分布较为均匀(表 1)。透射电镜照片显示该探针在pH > pHt时呈圆球状, 形态完好, 大小均一(图 4A), 而在pH < pHt时, 透射电镜下无明显的纳米结构存在, 表明超pH敏感纳米探针发生解散(图 4B)。超pH敏感纳米探针材料的临界胶束浓度通过芘探针法测定。当超pH敏感探针材料形成胶束时, 可对原本不溶于水的芘起到一定的增溶效果, 芘在372 nm (I1) 和382 nm (I3) 的荧光强度比值可以反映这种增溶情况, 从而确定UPS的临界胶束浓度。通过此方法测得4种UPS纳米探针的临界胶束浓度(表 1) 为1~2 μg·mL-1左右, 极小的临界胶束浓度说明4种UPS纳米探针更易在低浓度下形成胶束, 有利于其保持纳米结构的稳定性。同时, 极低的临界胶束浓度也更能保证UPS纳米探针进入体内后, 不易受血液影响降至临界胶束浓度以下从而影响其在体内发挥作用。
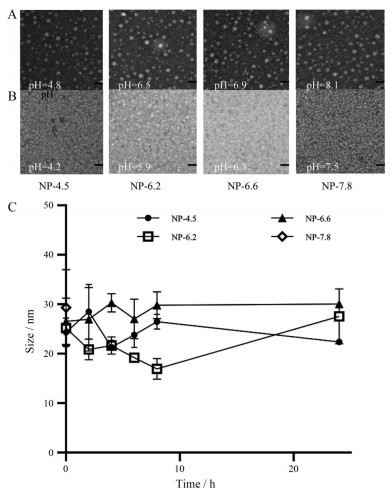
|
Figure 4 A: Transmission electron micrograph of ultra-pH sensitive fluorescent nanoprobes; pH > pHt. Scale bar = 50 nm. B: Transmission electron micrograph of ultra-pH sensitive fluorescent nanoprobes; pH < pHt. Scale bar = 50 nm. C: Size of ultra-pH sensitive fluorescent nanoprobe in 10% fetal bovine serum (FBS). n = 3, |
本文还考察了在含10%胎牛血清的PBS (pH 7.4, 模拟血清环境) 中超pH敏感纳米探针24 h内的胶束稳定性。粒径测定结果表明, NP-4.5、NP-6.2和NP-6.6三种纳米粒的粒径在24 h内变化不大, 而NP-7.8的粒径在Nicomp 380 N3000 (美国PSS公司) 激光粒径仪上无法测出, 表明其可能在pH 7.4的模拟血清介质中解散成聚合物(图 4C)。
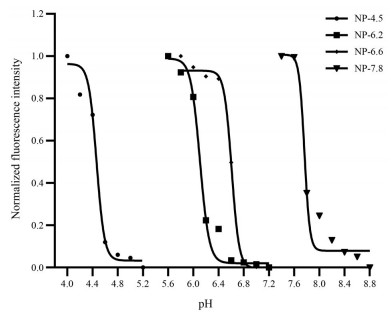
2 超pH敏感荧光纳米探针的pH激活和灵敏度检测通过检测不同UPS纳米探针荧光强度值随pH的变化情况, 评价UPS纳米探针对pH的激活和响应灵敏度。为了更好地评价UPS探针在不同pH环境下的激活情况, 将荧光强度统一进行标准化处理, 定义为NFI, 从而利用NFI更好地判断不同UPS探针具有的pHt。同时, 为了说明UPS探针的响应灵敏度, 利用ΔpH来进行描述。ΔpH值越小则说明探针荧光强度变化越迅速, 其pH灵敏度越高。
依据NFI的变化, 本研究所制备的4种超pH敏感荧光纳米探针分别在pH 4.4、6.2、6.6、7.8发生明显的“ON/OFF”状态的转变, 验证了4种UPS纳米探针具备的pH转变点。同时, 经过检测4种UPS纳米探针的ΔpH均小于0.3, 说明其质子浓度变化小于3倍。而其他pH敏感的小分子荧光染料[23]的ΔpH大多为2, 质子变化浓度约为100倍[24]。结果表明, 这4种UPS纳米探针具有极高的pH灵敏度, 远高于一般的pH敏感小分子荧光染料(图 5)。
|
Figure 5 Normalized fluorescence intensity of ultra-pH sensitive fluorescent nanoprobes in different pH values |
超pH敏感纳米探针极高的灵敏度和具有的不同pH转变点与UPS聚合物材料的设计相关。UPS聚合物材料中位于疏水嵌段的叔胺结构对pH变化极其敏感, 可在酸性环境中发生质子化[25], 破坏亲水/疏水平衡导致UPS纳米探针的解离。并且, 叔胺所具有的不同取代基可对质子化过程产生调控[26]。结合本研究中4种超pH敏感荧光纳米探针的pH灵敏度, 叔胺结构上的取代基碳链越长, 引发叔胺结构发生质子化需要的质子越多, 则影响该探针的pHt越低。相反, 该探针的pHt越高。
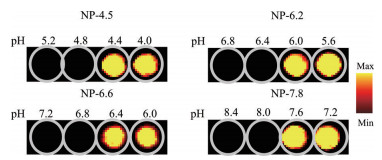
3 不同pHt的超pH敏感荧光纳米探针的体外成像效果通过观察超pH敏感荧光纳米探针在不同pH值下的荧光成像效果, 4种UPS纳米探针NP-4.5、NP-6.2、NP-6.6和NP-7.8分别在其pHt附近发生强烈荧光转变。在低于各自pHt的情况下, 每种超pH敏感荧光纳米探针均可产生良好的荧光成像效果(图 6)。
|
Figure 6 Imaging effect of ultra-pH sensitive fluorescent nanoprobes in vitro |
超pH敏感纳米探针之所以展现出荧光强度的明显变化, 主要是受所偶联的荧光染料ICG和具有不同pHt的高分子材料的影响。首先, ICG在水溶液中极易发生自聚现象, 影响本身的光学性质, 并使得其水溶液荧光稳定性较差[27-29]。在与超pH敏感高分子材料偶联后, 可以大大提高ICG产生荧光的稳定性, 增强成像效率。其次, UPS高分子材料对于pH变化的敏感性, 可以调控ICG在pHt附近的激活, 使得超pH敏感荧光纳米探针在激活后保持较高的荧光强度, 且不同pHt的UPS探针激活后荧光强度变化不大。
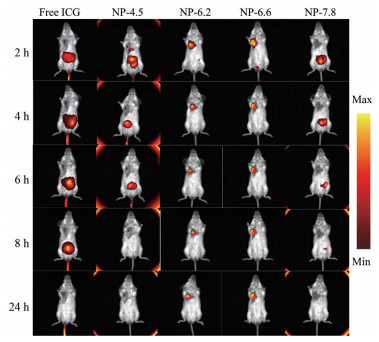
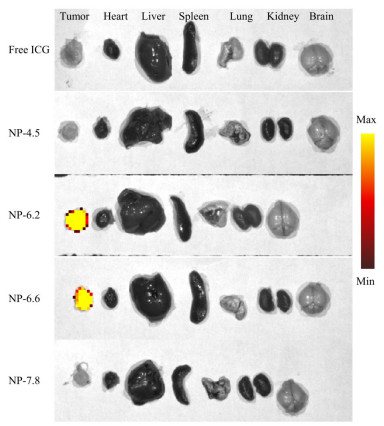
4 不同pHt的超pH敏感荧光纳米探针的体内成像效果通过活体成像仪检测UPS纳米探针在荷瘤小鼠体内的成像情况, 结果显示, NP-6.2和NP-6.6两种探针注射2 h后靶向聚集在肿瘤部位, 对荷瘤小鼠产生较为明显的肿瘤成像效果。而另外两种探针NP-4.5和NP-7.8在注射后对肿瘤部位没有产生强烈荧光, 并未获得理想的肿瘤成像效果(图 7)。同样, 在注射UPS纳米探针24 h后的离体肿瘤与正常器官组织的荧光对比检测中(图 8), 进一步证实了NP-6.2和NP-6.6两种探针良好的成像效果, 与正常器官组织的荧光强度相比, 具有显著性差异(图 9)。而NP-4.5和NP-7.8两种探针的荧光强度无明显差异, 其在肿瘤组织的荧光强度明显低于NP-6.2和NP-6.6。因此, pHt为UPS纳米探针的重要参数, 过高或过低的pHt都不能够取得理想的体内肿瘤成像效果。
|
Figure 7 Imaging effect of ultra-pH sensitive fluorescent nanoprobes in vivo. ICG: Indocyanine green |
|
Figure 8 Ex vivo imaging of the organs from 4T1-bearing mouse models with different ultra-pH sensitive fluorescent nanoprobes and free ICG after 24 h |
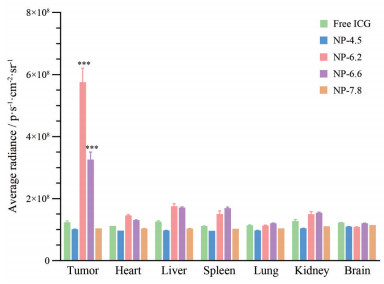
|
Figure 9 The fluorescent intensities of different organs after 24 h post-administration of different ultra-pH sensitive fluorescent nanoprobes and free ICG. n = 3, |
在实验中, 相比于正常的血液环境(pH 7.4), 超pH敏感荧光纳米探针NP-7.8的pH转变点过高。在进入体内后不能形成纳米结构, 无法在肿瘤部位实现酸触发的荧光激活, 从而无法放大荧光成像效果。而超pH敏感荧光纳米探针NP-4.5由于pH转变点过低, 可能在细胞内和细胞外都难以激活, 导致其不能产生理想的成像效果。
NP-6.2和NP-6.6两种探针呈现出较好的肿瘤成像效果, 可能是因为其可在胞内溶酶体环境中被激活的结果。两种探针经尾静脉注入荷瘤小鼠体内, 经血液循环累积在肿瘤部位并被激活。而游离的NP-6.2和NP-6.6被肝脏摄取, 经肠道快速排出体外[27]。这与荧光染料ICG的代谢途径相同, 从而使得游离的探针可以迅速被清除, 保证肿瘤部位荧光高亮, 呈现出理想的成像效果。
结合这两种探针的pHt和体内代谢情况, 作者认为不同pH转变点的UPS纳米探针发生激活的部位并不相同, NP-6.2和NP-6.6很有可能是通过胞内激活(pH 5.0~6.0) 发挥作用的。对于不同pHt的超pH敏感荧光纳米探针在肿瘤组织细胞内激活还是细胞间激活, 还有待于进一步研究。
结论在本研究中, 制备了4种具有不同pH转变点(4.5、6.2、6.6、7.8) 的超pH敏感荧光纳米探针, 其在体外具有相似的粒径, 且激活状态下荧光强度相差不大。然而, 在荷瘤小鼠模型体内成像效果差异明显。pHt为6.2和6.6的超pH敏感荧光纳米探针具有更强的成像效果, 而pHt过低(4.5) 和过高(7.8) 的UPS纳米探针成像效果均不理想。结果表明, 虽然此类超pH敏感纳米荧光探针均对酸环境敏感, 但是在实际应用时要着重考虑探针pHt对于成像效果的影响。体内实验结果亦表明, 具有合适pHt的UPS纳米探针在给药后2 h就能在肿瘤组织实现很好的成像效果, 且能稳定较长时间(实际稳定成像时间 > 24 h), 为手术治疗提供充分的时间窗。
本研究表明, pHt是影响UPS纳米探针体内行为的一个重要参数, 在其他相关研究中, 材料设计方面需要充分考虑pHt这一参数。此外, 对于其他类型的生物响应型(如温度响应型、还原响应型等) 材料, 相转变点或相关参数亦需要作为一个重要参数来进行体系的设计。本研究既筛选出具有良好成像效果的UPS纳米探针, 又为其他生物响应型纳米探针的设计和筛选提供思路。
作者贡献: 邸士鸣负责UPS探针的合成及动物实验内容; 龚礼栋负责UPS探针合成分析及表征; 庄峰和刘卫为实验提供修改意见; 林志强和张强全程指导。
利益冲突: 所有作者声明不存在利益冲突。
| [1] |
Huang JG, Li JC, Lyu Y, et al. Molecular optical imaging probes for early diagnosis of drug-induced acute kidney injury[J]. Nat Mater, 2019, 18: 1133-1143. DOI:10.1038/s41563-019-0378-4 |
| [2] |
Wang X, Li P, Ding Q, et al. Illuminating the function of the hydroxyl radical in the brains of mice with depression phenotypes by two-photon fluorescence imaging[J]. Angew Chem Int Ed, 2019, 58: 4674-4678. DOI:10.1002/anie.201901318 |
| [3] |
Hong GS, Alexander LA, Dai HJ. Near-infrared fluorophores for biomedical imaging[J]. Nat Biomed Eng, 2017, 10: 1-22. |
| [4] |
So MK, Xu CJ, Loening AM, et al. Self-illuminating quantum dot conjugates for in vivo imaging[J]. Nat Biotechnol, 2006, 24: 339-343. DOI:10.1038/nbt1188 |
| [5] |
Miao QQ, Xie C, Zhen X, et al. Molecular afterglow imaging with bright, biodegradable polymer nanoparticles[J]. Nat Biotechnol, 2017, 35: 1102-1110. DOI:10.1038/nbt.3987 |
| [6] |
Andrew MS, Michael CM, Nie SM. Second window for in vivo imaging[J]. Nat Nanotechnol, 2009, 4: 710-711. DOI:10.1038/nnano.2009.326 |
| [7] |
Nicolas G, Pierre M, Christian C. Radiologic imaging of the renal parenchyma structure and function[J]. Nat Rev Nephrol, 2016, 12: 348-359. DOI:10.1038/nrneph.2016.44 |
| [8] |
Zhang BB, Huang WL, Mei YY, et al. Smart fluorescent nano-delivery system for breast cancer cell tracing and growth inhibition[J]. Acta Pharm Sin (药学学报), 2019, 54: 1123-1131. |
| [9] |
Fu W, Yan CX, Guo ZQ, et al. Rational design of near-induced-emission-active probes: in situ mapping of amyloid-β plaques with ultrasensitivity and high-fidelity[J]. J Am Chem Soc, 2019, 141: 3171-3177. DOI:10.1021/jacs.8b12820 |
| [10] |
Zhang W, Wen Y, He DX, et al. Near-infrared AIEgens as transformers to enhance tumor treatment efficacy with controllable self-assembled redox-responsive carrier-free nanodrug[J]. Biomaterials, 2019, 193: 12-21. DOI:10.1016/j.biomaterials.2018.12.007 |
| [11] |
Gooitzen MD, George T, Lucia MAC, et al. Intraoperative tumor-specific fluorescence imaging in ovarian cancer by folate receptor-α targeting: first in-human results[J]. Nat Med, 2011, 17: 1315-1319. DOI:10.1038/nm.2472 |
| [12] |
Ke S, Wen XX, Michael G, et al. Near-infrared optical imaging of epidermal growth factor receptor in breast cancer xenografts[J]. Cancer Res, 2003, 63: 7870-7875. |
| [13] |
Soonmyung P, John B, Elizabeth TC, et al. HER2 and choice of adjuvant chemotherapy for invasive breast cancer: national surgical adjuvant breast and bowel project protocol B-15[J]. J Natl Cancer Inst, 2000, 92: 1991-1998. DOI:10.1093/jnci/92.24.1991 |
| [14] |
Timothy WJ, Allen MG, Hadi Y, et al. HER-2/neu protein expression in breast cancer evaluated by immunohistochemistry[J]. Am J Clin Pathol, 2000, 113: 251-258. DOI:10.1309/980M-E24R-V19K-595D |
| [15] |
Robert JG, Natarajan R, Maria GM, et al. pH imaging: a review of pH measurement methods and applications in cancers[J]. IEEE Eng Med Biol Mag, 2004, 23: 57-64. |
| [16] |
Hao DL, Wang J, Xie R, et al. pH responsive docetaxel micelles with improved therapeutic efficacy on mice xenograft tumor[J]. Acta Pharm Sin (药学学报), 2020, 55: 1914-1922. |
| [17] |
Zhao T, Huang G, Li Y, et al. A transistor-like pH nanoprobe for tumour detection and image-guide surgery[J]. Nat Biomed Eng, 2016, 1: 0006. |
| [18] |
Zhou KJ, Wang YG, Huang XN, et al. Tunable, ultrasensitive pH-responsive nanoparticles targeting specific endocytic organelles in living cells[J]. Angew Chem Int Ed Engl, 2011, 50: 6109-6114. DOI:10.1002/anie.201100884 |
| [19] |
Vadivel G, Muthusamy T, Putter DP. Nutrient transporters in cancer: relevance to Warburg hypothesis and beyond[J]. Pharmacol Ther, 2009, 121: 29-40. DOI:10.1016/j.pharmthera.2008.09.005 |
| [20] |
Brahimi-Horn MC, Jacques P. Hypoxia in cancer cell metabolism and pH regulation[J]. Essays Biochem, 2007, 43: 165-178. DOI:10.1042/bse0430165 |
| [21] |
Somayeh J, Michael K, Samantha A, et al. Hypoxia-induced carbonic anhydrase IX facilitates lactate flux in human breast cancer cells by noncatalytic function[J]. Sci Rep, 2015, 5: 13605. DOI:10.1038/srep13605 |
| [22] |
Sina IN, Steffen D, Hella H, et al. Analysis of the binding moiety mediating the interaction between monocarboxylate transporters and carbonic anhydrase Ⅱ[J]. J Biol Chem, 2015, 290: 4476-4486. DOI:10.1074/jbc.M114.624577 |
| [23] |
Yasuteru U, Daisuke A, Yukihiro H, et al. Selective molecular imaging of viable cancer cells with pH-activatable fluorescence probes[J]. Nat Med, 2009, 15: 104-109. DOI:10.1038/nm.1854 |
| [24] |
Atkins P, De P, et al. Physical Chemistry[M]. Oxford: Oxford University Press, 2009: 2729-2730.
|
| [25] |
Zhou KJ, Liu HM, Zhang SR, et al. Multicolored pH-tunable and activatable fluorescence nanoplatform responsive to physiologic pH stimuli[J]. J Am Chem Soc, 2012, 134: 7803-7811. DOI:10.1021/ja300176w |
| [26] |
Ma XP, Wang YG, Zhao T, et al. Ultra-pH-sensitive nanoprobe library with broad pH tunability and fluorescence emissions[J]. J Am Chem Soc, 2014, 136: 11085-11092. DOI:10.1021/ja5053158 |
| [27] |
Elena PP, Andera S, Elisabetta G, et al. Indocyanine green delivery systems for tumor detection and treatments[J]. Biotechnol Adv, 2016, 34: 768-789. |
| [28] |
Zhang HJ, Zhang XG, Zhu X, et al. NIR light-induced tumor phototherapy using photostable ICG delivery system based on inorganic hybrid[J]. Nanomedicine, 2018, 14: 73-84. DOI:10.1016/j.nano.2017.08.019 |
| [29] |
Fabien C, Lilianna FA, Pierre B, et al. Hepatocyte concentrations of indocyanine green reflect transfer rates across membrane transporters[J]. Basic Clin Pharmacol Toxicol, 2017, 120: 171-178. DOI:10.1111/bcpt.12671 |
 2022, Vol. 57
2022, Vol. 57


