2. 大理大学药学院, 云南 大理 671000;
3. 大理大学精准递送药物高端制剂省创新团队, 云南 大理 671000
2. College of Pharmacy, Dali University, Dali 671000, China;
3. Innovative Research Team of Precision and Targeted Drug Delivery of Yunnan Province, Dali 671000, China
单克隆抗体、重组蛋白和肽等生物大分子药物由于特异性高、亲和力高和生物学活性好等优点, 近几十年内在治疗自身免疫性疾病及肿瘤等方面有着突出的表现, 并且在医药领域进入了发展的快车道。但是因结构的复杂性和脆弱性, 使其在复杂的胃肠道(gastrointestinal tract, GIT) 环境中易于降解、难以跨过生物屏障[1], 其药物递送仍然以静脉注射(intravenous injection, iv) 和皮下注射(subcutaneous injection, sc) 为主。生物大分子药物半衰期较短、易被降解、生物利用率低、到病灶部位的浓度极低和免疫原性等限制了其使用。根据疾病的需要, 生物大分子药物递送系统的研发显得尤为重要, 但也面临着巨大挑战。
新生儿Fc受体(neonatal Fc receptor, FcRn) 是一个非常优质的载体膜蛋白, 广泛参与了体内的各种生物学及免疫过程。基于FcRn的药学研究最早主要集中于融合蛋白、IgG的Fc段工程化改造等提高生物药物半衰期方面, 尤其融合蛋白是目前在临床上最成功的应用。随着对FcRn的生物学功能进一步挖掘, 现在则更多倾向于用于靶向FcRn药物递送应用的研究和FcRn抗体的研发。本综述将从FcRn的特性、生物学功能、目前Fc药物开发和应用, 以及跨黏膜生物屏障给药、疫苗、肿瘤靶向等方面展开叙述。结合本团队研究的工作, 认为作用于FcRn的药物递送及免疫治疗应用将在未来有着非常广阔的应用前景。
1 FcRn概述 1.1 FcRnFcRn最早发现是新生儿肠道中的受体, 故称为新生儿Fc受体, 距今已有50多年的研究历史。在胚胎发育期, FcRn在胎盘-胎儿内皮细胞、胎盘合体滋养层细胞(syncytiotrophoblasts, STB)、CD68+巨噬细胞等中表达; 在妊娠晚期, 母体的免疫球蛋白G (IgG) 通过FcRn传递给胎儿[2, 3]; 在新生儿期, 母乳中的IgG从母体通过FcRn转运至新生儿后代体内, 为新生儿不成熟的免疫系统提供来自母体的免疫保护, 并在免疫系统完善过程中发挥着核心作用[4]; 在度过新生儿期后, 个体不再需要从母体获得IgG, 此时FcRn的功能从“免疫转运体”成为“免疫保持器”, 使得自身产生的IgG在体内不容易降解, 从而实现清除外来病原的作用。
人在成年后FcRn的表达水平依然与胎儿小肠上皮细胞的顶端区域中的表达水平相似, 并且在整个肠道中分布, 这种表达是终生的[5, 6]。FcRn在肠上皮、血管内皮、血脑屏障、胎盘、肾脏、肝脏、肺、乳房、生殖器、眼睛、皮肤、骨骼、抗原递呈细胞(antigen presenting cells, APC) 和整个造血系统等中均有表达[7]。NCBI基因数据库显示, 通过转录组测序(RNA-seq) 发现, 编码FcRn α链的FCGRT基因丰度排序依次是十二指肠、结肠、小肠和脾脏(https://www.ncbi.nlm.nih.gov/gene/2217/?report=expression)。在成人肠道中, FcRn mRNA由高到低的表达量分别是近端结肠 > 回肠 > 空肠 > 十二指肠[8]。FcRn在全身多组织中分布表达, 给予针对这些组织的药物递送很多设计的想象空间(图 1)。
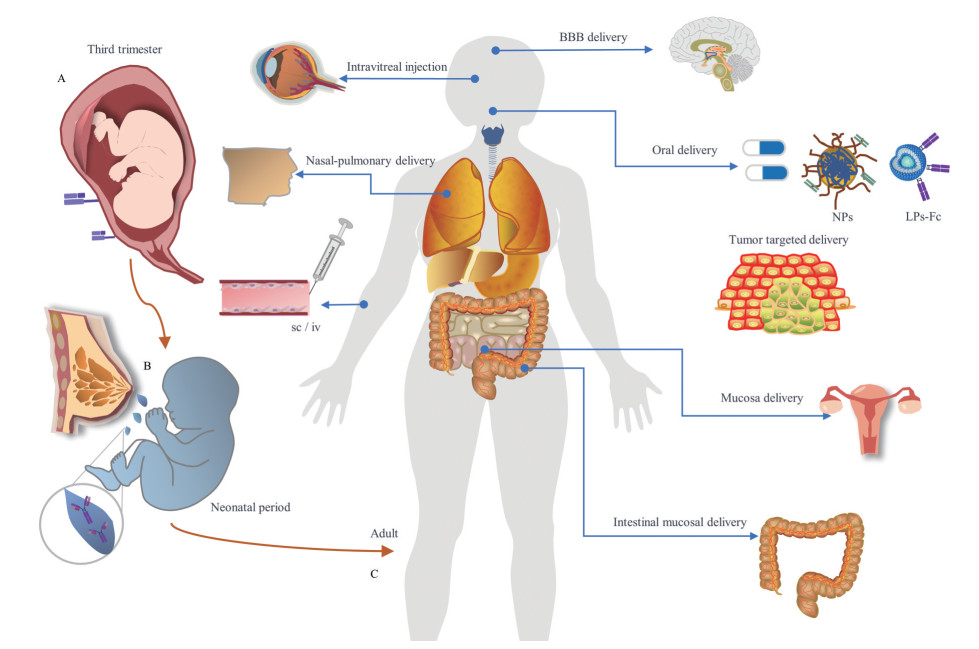
|
Figure 1 The biological role of neonatal Fc receptor (FcRn) in three different periods of human and FcRn targeted drug delivery systems. A: Third trimester. Maternal antibodies passively transferred across the placenta by Fc domain binding to the FcRn on syncytiotrophoblasts (STB), to achieve maternal immune transmission the first time; B: Neonatal period. Immunoglobulin G (IgG) in breast milk binds FcRn of neonatal intestinal epithelial cells, crosses the intestinal mucosal barrier and enters systemic circulation, realizing maternal immunity transmission again; C: In adults. FcRn is expressed in various tissues throughout life |
FcRn是一种独特的由α链重链和β2-微球蛋白(β2m) 轻链组成的异源二聚体, α链在结构上与主要的组织相容性复合物Ⅰ (MHC-Ⅰ) 家族相关, 但不能直接向T细胞提供抗原肽[6]。也有研究提示, FcRn的α链可以与IgG Fc片段相互作用, 但β2m也通过与α链的非共价组装影响FcRn的结构稳定性和功能[9]。
1.2 FcRn的生物学功能成年人体内FcRn的最主要生物学功能是保护IgG和血清白蛋白(human serum albumin, HSA) 避免在胞内降解, 从而延长半衰期作用和作为细胞内转运受体的转胞吞作用(transcytosis)。随着研究的深入, 发现FcRn在抗原递呈方面也有着极为重要的作用。
IgG和HSA是血液中最丰富的两种循环蛋白, 占血浆总蛋白的80%~90%。IgG由两条重链(H链) 和两条轻链(L链) 结合在一起, 由二硫键形成的Y型结构, 其中决定结合抗原特异性的是Fab可变区, Fc区是抗体的CH2-CH3区域, 可通过该区域与细胞表面的Fc受体[FcR, 包括FcγRⅠ (CD64)、FcγRⅡ (CD32)、FcγRⅢ (CD16)、FcεRⅠ、FcεRⅡ和FcRn] 结合。FcRn是维持体内IgG和HSA稳态的核心调节因子[10]。IgG与FcRn结合一般是2∶1或1∶1, 而HSA与FcRn一般是1∶1, 可以同时结合在FcRn的不同结合位点[11, 12]。IgG或HSA通过胞吞作用进入上皮细胞内, 在早期酸化(pH 6.0) 的内吞体(endosome) 中与FcRn相结合形成复合物, 从而逃避胞内溶解酶的降解, 使得IgG或HSA转运到细胞膜表面的其他位置或再次循环到同一个膜表面位置。在胞外pH为中性(pH 7.2) 时, IgG或HSA将脱离FcRn再次进入循环, 通过胞内转移-再循环机制, 人IgG和HSA的半衰期约为19~21天, 而其他血清蛋白如IgA的半衰期最长为5~7天[6, 13]。当然, 对于自身免疫性疾病患者来说, 由于FcRn介导的再循环机制使IgG在体内累积, 使免疫反应的“自我”攻击更加剧烈, 使疾病加重。
转胞吞作用是FcRn的第2个重要的生物学功能。作为一种独特的转胞吞受体, 除了上述介导IgG或HSA在血管上皮细胞的转胞吞以外, 还可介导IgG在其他腔内外表达FcRn的细胞转胞吞作用, 如胎盘、胃肠道、视网膜、泌尿生殖道、呼吸道、肝和肾上皮(足细胞) 中的运输, 尤其在母体胎盘、肠道、呼吸道和阴道等腔道中, IgG可以在极化的细胞屏障内双向运输, 既可以回到细胞膜表面又可以通过淋巴系统进入全身血液循环[14, 15]。
另外, FcRn在抗原呈递细胞APC如树突状细胞(dendritic cell, DC)、巨噬细胞和B细胞等终生高水平表达(主要表达在内吞体膜上)。当抗原-抗体复合物(immunocomplex, IC) IgG-IC与APC表面的FcγR结合, 启动了受体介导的胞吞作用, 进入细胞后形成溶酶体囊泡。这些囊泡在成熟过程中, 液泡ATP酶(V-ATPase) 募集导致环境偏酸性(pH 6.0), IgG-IC与FcγR解离, 并与胞内FcRn结合, 将IgG-IC分选、定向递送分别加载到MHC-Ⅰ (CD8+ T细胞识别) 和MHC-Ⅱ (CD4+ T细胞识别) 上, 启动T细胞介导的免疫反应[16]。可见, FcRn不仅可以结合、保护并传递配体, 还承担了一个免疫桥梁的作用, 既与机体自身IgG的稳态和分布直接相关, 又能参与抗原递呈并活化T细胞产生免疫应答。FcRn的3种生物学功能紧密相连, 有助于整合适应性免疫系统的体液免疫和细胞免疫, 并协调固有免疫系统, 从而促进机体保持免疫稳态, 最大程度地实现免疫保护(图 2)。
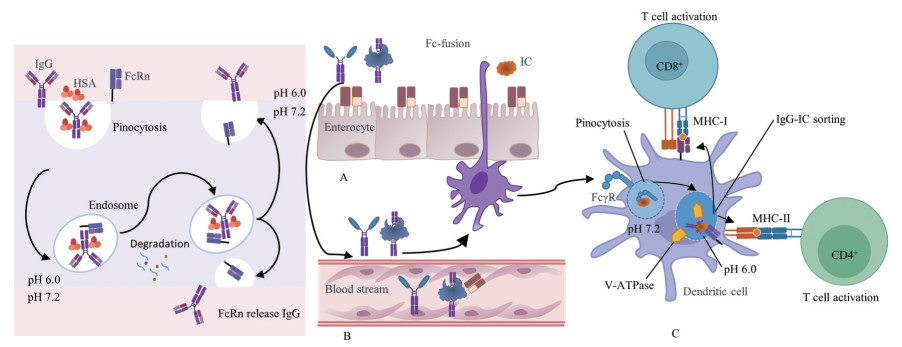
|
Figure 2 Mechanism of FcRn. A: Mechanism 1. Bidirectional Fc mediated transcytosis; B: Mechanism 2. Long-recycling IgG/HSA; C: Mechanism 3. Antigen presentation. HSA: Human serum albumin; IC: Immunocomplex; MHC-Ⅰ: Major histocompatibility complex-Ⅰ; MHC-Ⅱ: Major histocompatibility complex-Ⅱ |
FcRn是一个人体内非常重要的固有免疫与适应性免疫“边界点”, 既可作为治疗靶点, 又兼具转运的作用, 其应该可以作为“免疫治疗的复合体”, 实现靶点治疗和药物递送的综合作用。目前针对FcRn的药物主要还是集中在实现长循环的Fc融合蛋白、白蛋白融合蛋白及抗体药物Fc改造方面, 靶向FcRn开发治疗自身性免疫疾病的抗体药物也是最近的热点, 未来应该还会有更多的组合形式, 例如靶向同时又能实现半衰期的延长。
2.1 Fc融合(Fc-fusion) 和白蛋白融合(HSA-fusion) 提高半衰期Fc融合蛋白是FcRn在临床上最成功的应用, 其特点是将IgG的Fc段或HSA作为融合伴侣, 将功能性蛋白与Fc的序列融合表达。Fc与FcRn结合避免被降解及融合蛋白较大不易被肾小球滤过, 致使融合蛋白能显著延长血浆半衰期, 已经有12个Fc融合蛋白药物获批应用于临床(表 1), 有的在人体中的半衰期可达到13天[17]。这些功能蛋白可以是细胞因子、抗原肽、毒素、酶和活性功能肽等, 制备的Fc融合蛋白不仅能保留功能蛋白分子的生物学活性, 还能实现FcγR等介导的生物学效应[18]。该技术操作灵活, 产物均一、表达量高且易于纯化和质量控制[19]。依那西普(etanercept) 是1998年美国食品和药物管理局(FDA) 第1个获批的肿瘤坏死因子受体(tumor necrosis factor receptor, TNFR) 药物、也是目前最成功的Fc融合蛋白, 由人类TNFR-2 (p75 TNFR) 的胞外部分与人IgG1的Fc段相连形成。在治疗类风湿性关节炎等方面效果显著, 但其优先与游离TNF (sTNF) 相结合, 在治疗自身免疫性疾病溃疡性结肠炎(ulcerative colitis, UC) 和克罗恩病(Crohn's disease, CD) 上均不理想。
| Table 1 Approved Fc-fusion and HSA-fusion by Food and Drug Administration (FDA). TNFR: Tumor necrosis factor receptor; RA: Rheumatoid arthritis; JIA: Juvenile idiopathic arthritis; AS: Ankylosing spondylitis; PsA: Psoriatic arthritis; PsO: Plaque psoriasis; sc: Subcutaneous injection; LFA-3: Lymphocyte function associated antigen-3; im: Intramuscular injection; iv: Intravenous injection; CTLA-4: Cytotoxic T-lymphocyte associated protein 4; IL-1R: Interleukin-1 receptor; CAPS: Cryopyrin-associated periodic syndromes; TPO: Thrombopoietin; ITP: Immune thrombocytopenia; VEGFR-1/-2: Vascular endothelial growth factor receptor-1/-2; AMD: Age-related macular degeneration; RVO: Retinal vein occlusion; DME: Diabetic macular edema; DR: Diabetic retinopathy; mCRC: Metastatic colorectal cancer; GLP-1: Glucagon-like peptide 1; TNSALP: Tissue non-specific alkaline phosphatase; HPP: Hypophosphatasia; EMA: European Medicines Agency |
2021年我国获批上市的Fc融合蛋白药物为注射用重组人凝血因子IX-Fc融合蛋白(Alprolix)、B淋巴细胞刺激因子(BLyS) 受体跨膜激活剂及钙调亲环素配体相互作用分子(TACI)-Fc融合蛋白(RC18)。进入临床的Fc融合蛋白还有重组人促卵泡激素的Fc融合蛋白注射液(CXSL2000172, Ⅰ期临床试验)、靶向CD47的SIRPa-Fc融合蛋白(IMM01)、重组人血管内皮生长因子(VEGF)-Fc融合蛋白(HB002.1T) 和重组人生长激素-Fc融合蛋白(F-899) 等。针对新冠肺炎治疗的重组血管紧张素转化酶2 (ACE2)-Fc融合蛋白(HXL71) 已被批准临床研究。Clinictrials.gov显示有约40项进入临床试验的Fc融合蛋白。
HSA是另一个优秀的融合伴侣, 其作为药物载体有生物相容性好、稳定性好、半衰期长和可获取性等突出优势而备受关注[20, 21]。目前有两个HSA融合蛋白新药(表 1)。重组人白介素-2 (rIL-2)-HSA融合蛋白albuleukin与rIL-2相比, 显示出更好的药代动力学特性(半衰期延长至6~8 h, 总清除率是rIL-2的约1/50)[22]。Lombardi等[23]构建了凝血因子IX (FIX) 与HSA工程化突变体的融合蛋白, 凝血活性提高了8倍并在hFcRn转基因小鼠中延长半衰期超过2.5倍。我国批准进入临床的HSA融合蛋白有重组HSA-干扰素(IFN) α2a融合蛋白、白介素-21 (IL-21)-HSA融合蛋白注射液(JS014) 等。除了Fc融合或HSA融合等经典融合方式[17], 还有如FcRn结合肽融合、Fc多聚化和Fc-纳米粒等, 也有学者提出Fc六聚体比单体更能有效地被FcRn转胞吞[14, 15]。
2.2 拮抗FcRn治疗自身免疫性疾病自身免疫性疾病主要原因是机体免疫系统稳态被打破并“自我攻击”, 内源性IgG的大量蓄积, 导致了机体的过度免疫应答, 促进了疾病的发生和发展。治疗的思路一般是高剂量静脉注射IgG (使FcRn饱和并加速清除内源致病性IgG)、FcRn单克隆抗体、β2m单克隆抗体及竞争结合FcRn的小肽及小分子等[17]。通过拮抗IgG的Fc段与FcRn结合, 加快大量致病性IgG的清除速度, 使其不再在体内长循环和分布, 达到治疗如全身型重症肌无力(generalized myasthenia gravis, gMG)、原发免疫性血小板减少症(primary immune thrombocytopenia, ITP)、甲状腺相关性眼病(thyroid eye disease, TED)、寻常性天疱疮(pemphigusvulgaris, PV)、慢性炎性脱髓鞘性多发性神经病(chronic inflammatory demyelinating polyneuropathy, CIDP)、银屑病(psoriasis)、胎儿和新生儿溶血性疾病(haemolytic disease of the fetus and newborn, HDFN) 和温抗体型自身免疫性溶血性贫血(warm autoimmune haemolytic anaemia, WAIHA) 等自身免疫性疾病的目的。
FcRn目前被认为是下一个治疗自身免疫疾病的重要靶点, 随之其抗体药物已经成为研发的新热点, 这类药物包括洛利昔珠单抗(rozanolixizumab, Ⅲ期临床试验)、efgartigimad (Ⅲ期临床试验, 欧洲EMA已经准备批准, 正在接受FDA的审核)、巴托利单抗(batoclimab, HBM9161, Ⅱ/Ⅲ期临床试验)、SYNT001 (Ⅱ期临床试验) 等, ABY039 (Ⅰ期临床试验) 完成Ⅰ期临床试验后因潜在的免疫原性于2020年宣布终止, 还有因严重不良反应而停止开发的IMVT-1401 (全人源抗体, Ⅱb期临床试验)。2021年8月中国国家食品药品监督管理局药品审评中心(CDE) 公示, 首个进口FcRn抗体nipocalimab (M281, Ⅲ期临床试验) 注射液获得临床试验默示许可, 拟开发用于治疗gMG (表 2)。
| Table 2 Clinical trial of anti-FcRn drugs. gMG: Generalized myasthenia gravis; CIDP: Chronic inflammatory demyelinating polyneuropathy; PV: Pemphigusvulgaris; TED: Thyroid eye disease; WAIHA: Warm autoimmune haemolytic anaemia; CDE: Center for Drug Evaluation |
如前所述, 抗体药物在体内的半衰期与FcRn的结合作用有关[24]。对抗体的Fc序列进行改造可以进一步优化抗体的药代动力学特性。采用氨基酸点突变、酵母展示、噬菌体展示、细胞展示及计算机辅助设计等方法[25, 26], 构建和筛选Fc突变体, 优化pH依赖性的Fc-FcRn相互作用, 使其在pH 6.0条件下结合力更强, 而在pH 7.4条件下Fc能从FcRn上迅速解离, 避免被溶酶体等降解, 实现改造目的。2018年FDA批准了第1个Fc工程化突变体药物ravulizumab-cwvz, 半衰期长达42天, 患者只需每8周接受1次静脉注射治疗。此外, Xencor的LS变体(M428L/N434S), pH 6.0时与FcRn的亲和力提高了11倍[27], 突变体M252Y/S254T/T256E (YTE) 与hFcRn的结合亲和力提高了10倍[28], 还有AAA (T307A/E380A/N434A) 和KF (H433K/N434F) 等超过60种Fc突变体已经被报道[29]。使用这些突变技术, MEDI-524-YTE在食蟹猴体内半衰期延长近4倍[30]。抗体药物motavizumab-YTE在人体内的半衰期可达100天[31]。IL-6单克隆抗体新药WBP216 (MEDI5117, Ib/IIa期临床试验), 半衰期为40~60天。本实验室Qiu等[32]采用一种特异性识别hFcRn的单链抗体(scFv) F8, 也可以使其在食蟹猴体内的平均滞留时间延长到约200 h。
当然, 由于IgG-IC复合物的Fc段与DC、自然杀伤(natural killer, NK) 细胞、巨噬细胞和中性粒细胞等表面的FcγR结合, Fc的改造还期望实现如NK细胞介导的抗体依赖的细胞毒作用(antibody-dependent cell-mediated cytotoxicity, ADCC)、抗体依赖的细胞吞噬作用(antibody-dependent cellular phagocytosis, ADCP) 和补体依赖的细胞毒作用(complement-dependent cytotoxicity, CDC) 等作用的改变, 但FcγR具有基因多态性, 这些策略仍然有潜在的各种问题[33]。也有采用不同Fc亚类(交叉同种型) 的组合及单克隆抗体的Fc截断等策略, 来规避潜在的毒性。如2007年FDA批准的抗C5补体的eculizumab, 其结构加入了IgG2的118-260氨基酸序列和IgG4的264-447氨基酸序列, 使其ADCC作用非常小或者检测不到[34]。值得注意的是, FcγR基因的遗传变异可影响对多种抗体介导的自身免疫性和炎性疾病的易感性, 尤其像炎性肠病(inflammatory bowel disease, IBD) 中IgG糖基化异常、被动富集以及FcγR信号强度的改变等, 都会影响疾病的程度[35]。所以针对Fc序列的设计和改造, 需要全面评估IgG、药物、FcRn和FcγR等之间的交错复杂的效应关系。
3.2 口服-肠黏膜递送(oral-intestinal mucosal delivery)肠上皮细胞是限制生物大分子药物制剂跨肠运输的主要物理障碍, 药物通过被动扩散或主动转运穿过肠上皮细胞, 然后通过与上皮细胞基底膜相互作用的毛细血管吸收进入全身循环。生物大分子药物(如单克隆抗体) 在整个肠上皮的吸收可忽略不计[36]。完整肽和蛋白质通过口服给药的生物利用度低于1%, 有时甚至低于0.1%[37]。
由于FcRn在肠上皮细胞表达, 被认为可能作为药物跨肠黏膜的转运体, 如通过HSA的优化改造或增强纳米粒与FcRn的亲和性, 提高转运能力等。Azevedo等[38]采用生物降解和生物相容性好的聚乳酸-羟基乙酸共聚物-聚乙二醇(PLGA-PEG) 制备的纳米粒(nanoparticles, NPs) 与HSA变体偶联后, 对胰岛素进行了包封, 体外细胞实验显示, 跨极化细胞层的转运能力比野生型HSA-NPs增加了2倍, 研究发现hFcRn转基因小鼠糖尿病模型口服给药后, 能够在1 h后血糖降低约40%, 具有降血糖作用。
将纳米粒与Fc偶联, 还有很多学者做了不同的尝试, 如Pridgen等[39]制备的口服纳米粒表面偶联Fc (NPs-Fc), 证明在肠道的酸性区域(十二指肠和结肠部位), 与肠上皮细胞表面的FcRn高亲和力结合, 内吞后从基底外侧释放, 有效地通过肠上皮转运, 进入血液循环。在小鼠中, 口服靶向肠道FcRn的NPs-Fc (包封胰岛素) 穿过肠上皮并进入血液循环, 平均吸收率为13.7%·h-1, 而非靶向FcRn的纳米粒的平均吸收率仅为1.2%·h-1, 相差近12倍。在FcRn基因敲除小鼠体内证明了NPs-Fc发挥作用与FcRn的直接相关性。Qin等[40]采用可生物降解和生物相容的马来酰亚胺-聚乙二醇-聚己内酯共聚物(Mal-PEG-PCL) 与Fc偶联, 显著提高了小分子化合物的口服生物利用度, 延长了血清半衰期, 并增加了其在肿瘤和组织的积累。Shi等[41]制备了用Fc修饰的聚乙二醇-聚乳酸-羟基乙酸共聚物(PEG-PLGA) 纳米粒(NPs-Fc), 用于艾塞那肽口服给药, 其降糖效果优于皮下注射。顾臻团队[42]研发了一种葡萄糖响应性Fc-脂质体(liposomes, LPs) 口服胰岛素递送系统, 该脂质体具有葡萄糖敏感性透明质酸(HA) 壳, 口服给药后, 随着肠道葡萄糖浓度增加, 触发了葡萄糖与HA壳的竞争性结合, 导致其快速解离。LPs-Fc表面的Fc基团一旦暴露, 与肠道FcRn结合实现转运, 帮助药物在肠道吸收和分布。1型糖尿病小鼠模型口服给药后, 可以有效减少餐后血糖波动。Song等[43]构建了一种利用靶向FcRn的短肽FcBP修饰的聚乙二醇-聚ε-己内酯(PEG-PCL) 胶束, 以Caco-2细胞模拟肠道细胞, 在pH 6条件下可以高效率地摄取胶束并在pH 7.4环境中外排, 该胶束初步被证明有口服跨膜转运递送的潜力。与融合蛋白相比, 无论是NPs-Fc、LPs-Fc和胶束-Fc等, 可以看到组合设计药物递送体系的多样性, 而且这些递送系统还具有如转胞吞作用时NPs、LPs等可以包裹及保护大分子药物, 且实现大分子药物的跨膜转运, 减少对递送目的药物的改造等潜在优势。
另外, 本团队Wang等[44]在前期研究基础上, 通过同位数螯合标记等方法, 观察到与FcRn有良好结合能力的单链抗体F8在FcRn转基因小鼠口服给药后, 优先分布于肠道中, 经肠上皮细胞表达的FcRn结合, 单向转运至血液循环中, 可以长达172 h。为治疗胃肠道疾病尤其像IBD等自身免疫性疾病, 口服抗体或融合蛋白等的开发提供了更多的可能性。
值得关注的是, 在炎症发展过程中, 由于促炎物质和细胞因子可以上调或下调FcRn, 其在细胞中功能的作用可能会改变[10]。尤其在自身免疫性疾病IBD病理状态下, FcRn的表达和结合能力等是否发生改变还需要进一步研究。基于对FcRn的机制和理解, 虽然有一些新的肠黏膜递送策略被开发, 也被证明是具有可行性和应用前景的, 但是离真正应用到人体还有一段距离。
3.3 鼻-肺黏膜递送(nasal-pulmonary delivery)当黏膜发生感染时, FcRn在该部位的作用是使其配体穿梭于上皮细胞层, 可能增强生物药物穿过黏膜表面的转运[6]。有部分学者[7]认为, 这种策略有利于黏膜定位, 有利于生物药物的组织特异性积累。研究数据表明人鼻腔底层结缔组织中的纤毛上皮细胞、基底细胞、腺体细胞和内皮细胞均表达FcRn, 且稳态分布[45]。有研究探索了FcRn介导的鼻-肺黏膜递送, 如将促红细胞生成素(EPO) Fc融合蛋白(EPO-Fc) 通过吸入给药, 使药物通过与肺上皮细胞FcRn结合, 转运进入体循环, 其生物利用度类似于皮下给药(约35%), 比单独使用EPO增加约2倍[46]。Bern等[47]设计了一种人HSA变体E505Q/T527M/K573P (QMP), 改善与FcRn的结合能力, 从而提高鼻内递送时的跨生物膜转运, 并延长hFcRn转基因小鼠中HSA的血浆半衰期。QMP-重组活化凝血因子VⅡ融合蛋白的半衰期比野生型人HSA融合蛋白增加了3.6倍。
此外, Fc融合蛋白疫苗也被应用于黏膜免疫研究中。Ye等[48]研究表明, 用单纯疱疹病毒2型(herpes simplex viru-2, HSV-2) 糖蛋白gD与Fc融合后表达, 与免疫佐剂CpG一起鼻腔给药, 可以保护阴道内HSV-2186病毒进攻后的感染。这一策略能有效地诱导黏膜免疫和全身免疫反应, 但只能保护野生型小鼠, 但不保护FcRn敲除小鼠。Lu等[49]制备了艾滋病病毒HIV壳蛋白Gag (p24) 与Fc的融合蛋白(Gag-Fc), 证明可以通过肺上皮细胞转运。Gag-Fc与CpG鼻腔内联用后, 小鼠体内产生了局部和全身免疫应答, 诱导B细胞和T细胞的长期记忆免疫, 对远端阴道黏膜组织具有保护作用。最近, Ochsner等[50]设计了一种流感病毒血凝素(HA) 与Fc的可溶性三聚体HA-Fc融合蛋白, 可与FcR结合, 通过吸入递送, 在小鼠模型中显著抵抗A/PR/8/34流感病毒。随着FcRn抗原递呈机制的深入研究, 融合蛋白疫苗的鼻-肺黏膜递送不失为一种良好的递送策略, 甚至其他的黏膜递送(女性生殖系统黏膜、肠黏膜等) 也值得尝试。
3.4 跨血脑屏障递送(blood brain barrier delivery, BBB delivery)血脑屏障(blood brain barrier, BBB) 由紧密相连的内皮细胞构成, 保护大脑免受外界的侵害, 但是极大地限制了药物等向中枢神经系统(central nervous system, CNS) 的递送, 尤其是抗体药物静脉注射后在大脑中的浓度仅为血液中的0.1%[51]。Kariolis等[52]开发了一种转运载体(transport vehicle, TV), 由一个工程化的Fc片段与BBB中高表达的转铁蛋白受体(transferrin receptor, TfR) 相结合, 使抗体药物在静脉注射24~72 h后, 能在模型小鼠脑内达到10~40倍的浓度, 食蟹猴给药48 h后大脑广泛分布。Cavaco等[53]设计一种BBB穿梭肽(BBB peptide shuttle, BBBpS) PepH3与Fc的Fc-PepH3融合蛋白, 可以穿过体外BBB细胞膜并在脑部富集。跨血脑屏障递送一直是生物大分子药物递送领域的一个难以真正攻克的瓶颈, FcRn在递送系统里发挥的作用是以跨膜为主还是长循环富集药物浓度为主, 需要更多的研究来证明, 但是至少初步可以看到FcRn为跨血脑屏障递送提供了一种新的可能性。
3.5 肿瘤靶向递送(tumor targeted delivery)目前证明肿瘤组织中FcRn表达降低, 导致了HSA在体内循环的减少, 而在肿瘤部位的募集, 为肿瘤的代谢及生长提供了营养。另外, FcRn介导的半衰期延长可能会造成内源性HSA在肿瘤部位的被动蓄积, 将HSA递送至需要高代谢摄入的肿瘤组织中[54, 55]。HSA-药物偶联物也能利用这种机制。Liu等[56]分别考察了KRAS基因突变及FcRn表达减少的胰腺导管腺癌(pancreatic ductal adenocarcinoma, PDAC) 体内、体外模型, 发现使用HSA-多柔比星偶联物比多柔比星更加敏感。一方面, KRAS突变巨胞饮作用增加了肿瘤组织对HSA-多柔比星的摄取; 另一方面, 不存在FcRn介导的细胞胞吞和保护药物机制, HSA或HSA-药物偶联物以更大的速率降解, 偶联药物的释放随之增加, 协同实现递送并发挥抗肿瘤的功效。在肿瘤部位, FcRn与白蛋白偶联药物的摄取过程的关系还需要更多深入研究和证据, 但是初步可以看到HSA偶联药物、HSA的其他融合形式的大分子药物可能是一种可以利用FcRn改变而富集或被动转运的药物递送策略。
4 总结与展望基于FcRn介导的体内作用的复杂性和多样性, 虽然目前的研究大多聚焦于通过Fc融合或HSA融合来延长药物的半衰期, 但是作者认为未来基于FcRn介导的黏膜给药技术(表 3[27-32, 34, 38-44, 46-48, 50, 52, 53, 56]) 具有巨大的潜力。由于FcRn在黏膜上皮细胞中高表达, 使药物具有较大的可用吸收表面积和组织富集浓度。此外, 由FcRn介导的胞吞途径, 不影响黏膜屏障完整性, 避免了明显的毒性。但是开发基于FcRn的新型药物输送体系, 必须基于深入了解生理和疾病的生物机制, 尤其是对于针对黏膜炎性疾病的药物, 需要全面地考虑药物与体内IgG、黏膜免疫细胞和上皮细胞等不同影响因素的作用, 协同不同的机制, 优化治疗效果。
| Table 3 Different strategy of FcRn targeted drug delivery systems. ADCC: Antibody-dependent cell-mediated cytotoxicity; CDC: Complement-dependent cytotoxicity; HSV: Herpes simplex virus; HIV: Human immunodeficiency virus; CNS: Central nervous system; BBB: Blood brain barrier; PDAC: Pancreatic ductal adenocarcinoma |
作者贡献: 何苗负责文献检索及论文撰写; 彭保卫负责文献检索及修改文章; 徐宇虹负责文章选题、指导写作、修改及校对文章。
利益冲突: 所有作者声明本文无任何利益冲突。
| [1] |
Mitragotri S, Burke PA, Langer R. Overcoming the challenges in administering biopharmaceuticals: formulation and delivery strategies[J]. Nat Rev Drug Discov, 2014, 13: 655-672. DOI:10.1038/nrd4363 |
| [2] |
Malek A, Sager R, Schneider H. Maternal-fetal transport of immunoglobulin G and its subclasses during the third trimester of human pregnancy[J]. Am J Reprod Immunol, 1994, 32: 8-14. DOI:10.1111/j.1600-0897.1994.tb00873.x |
| [3] |
Kiskova T, Mytsko Y, Schepelmann M, et al. Expression of the neonatal Fc-receptor in placental-fetal endothelium and in cells of the placental immune system[J]. Placenta, 2019, 78: 36-43. DOI:10.1016/j.placenta.2019.02.012 |
| [4] |
Brambell FW. The transmission of immune globulins from the mother to the foetal and newborn young[J]. Proc Nutr Soc, 1969, 28: 35-41. DOI:10.1079/PNS19690007 |
| [5] |
Israel EJ, Taylor S, Wu Z, et al. Expression of the neonatal Fc receptor, FcRn, on human intestinal epithelial cells[J]. Immunology, 1997, 92: 69-74. DOI:10.1046/j.1365-2567.1997.00326.x |
| [6] |
Pyzik M, Sand K, Hubbard JJ, et al. The neonatal Fc receptor (FcRn): a misnomer?[J]. Front Immunol, 2019, 10: 1540-1563. DOI:10.3389/fimmu.2019.01540 |
| [7] |
Martins JP, Kennedy PJ, Santos HA, et al. A comprehensive review of the neonatal Fc receptor and its application in drug delivery[J]. Pharmacol Ther, 2016, 161: 22-39. DOI:10.1016/j.pharmthera.2016.03.007 |
| [8] |
Hornby PJ, Cooper PR, Kliwinski C, et al. Human and non-human primate intestinal FcRn expression and immunoglobulin G transcytosis[J]. Pharm Res, 2014, 31: 908-922. DOI:10.1007/s11095-013-1212-3 |
| [9] |
Praetor A, Hunziker W. β2-Microglobulin is important for cell surface expression and pH-dependent IgG binding of human FcRn[J]. J Cell Sci, 2002, 115: 2389-2397. DOI:10.1242/jcs.115.11.2389 |
| [10] |
Sand KM, Bern M, Nilsen J, et al. Unraveling the interaction between FcRn and albumin: opportunities for design of albumin-based therapeutics[J]. Front Immunol, 2014, 5: 682-702. |
| [11] |
Chaudhury C, Brooks CL, Carter DC, et al. Albumin binding to FcRn: distinct from the FcRn-IgG interaction[J]. Biochemistry, 2006, 45: 4983-4990. DOI:10.1021/bi052628y |
| [12] |
Sanchez LM, Penny DM, Bjorkman PJ. Stoichiometry of the interaction between the major histocompatibility complex-related Fc receptor and its Fc ligand[J]. Biochemistry, 1999, 38: 9471-9476. DOI:10.1021/bi9907330 |
| [13] |
Challa DK, Velmurugan R, Ober RJ, et al. FcRn: from molecular interactions to regulation of IgG pharmacokinetics and functions[J]. Curr Top Microbiol Immunol, 2014, 382: 249-272. |
| [14] |
Claypool SM, Dickinson BL, Wagner JS, et al. Bidirectional transepithelial IgG transport by a strongly polarized basolateral membrane Fc gamma-receptor[J]. Mol Biol Cell, 2004, 15: 1746-1759. DOI:10.1091/mbc.e03-11-0832 |
| [15] |
Foss S, Grevys A, Sand K, et al. Enhanced FcRn-dependent transepithelial delivery of IgG by Fc-engineering and polymerization[J]. J Control Release, 2016, 223: 42-52. DOI:10.1016/j.jconrel.2015.12.033 |
| [16] |
Baker K, Rath T, Pyzik M, et al. The role of FcRn in antigen presentation[J]. Front Immunol, 2014, 5: 408-419. |
| [17] |
Sockolosky JT, Szoka FC. The neonatal Fc receptor, FcRn, as a target for drug delivery and therapy[J]. Adv Drug Deliv Rev, 2015, 91: 109-124. DOI:10.1016/j.addr.2015.02.005 |
| [18] |
Czajkowsky DM, Hu J, Shao Z, et al. Fc-fusion proteins: new developments and future perspectives[J]. EMBO Mol Med, 2012, 4: 1015-1028. DOI:10.1002/emmm.201201379 |
| [19] |
Lei C, Gong R, Ying T. Editorial: antibody Fc engineering: towards better therapeutics[J]. Front Immunol, 2018, 9: 2450-2451. DOI:10.3389/fimmu.2018.02450 |
| [20] |
Bal W, Sokolowska M, Kurowska E, et al. Binding of transition metal ions to albumin: sites, affinities and rates[J]. Biochim Biophys Acta, 2013, 1830: 5444-5455. DOI:10.1016/j.bbagen.2013.06.018 |
| [21] |
Bhushan B, Khanadeev V, Khlebtsov B, et al. Impact of albumin based approaches in nanomedicine: imaging, targeting and drug delivery[J]. Adv Colloid Interface Sci, 2017, 246: 13-39. DOI:10.1016/j.cis.2017.06.012 |
| [22] |
Melder RJ, Osborn BL, Riccobene T, et al. Pharmacokinetics and in vitro and in vivo anti-tumor response of an interleukin-2-human serum albumin fusion protein in mice[J]. Cancer Immunol Immunother, 2005, 54: 535-547. DOI:10.1007/s00262-004-0624-7 |
| [23] |
Lombardi S, Aaen KH, Nilsen J, et al. Fusion of engineered albumin with factor IX Padua extends half-life and improves coagulant activity[J]. Br J Haematol, 2021, 194: 453-462. DOI:10.1111/bjh.17559 |
| [24] |
Higel F, Seidl A, Sorgel F, et al. N-Glycosylation heterogeneity and the influence on structure, function and pharmacokinetics of monoclonal antibodies and Fc fusion proteins[J]. Eur J Pham Biopharm, 2016, 100: 94-100. DOI:10.1016/j.ejpb.2016.01.005 |
| [25] |
Mackness BC, Jaworski JA, Boudanova E, et al. Antibody Fc engineering for enhanced neonatal Fc receptor binding and prolonged circulation half-life[J]. MAbs, 2019, 11: 1276-1288. DOI:10.1080/19420862.2019.1633883 |
| [26] |
Chen D, Zhao Y, Li M, et al. A general Fc engineering platform for the next generation of antibody therapeutics[J]. Theranostics, 2021, 11: 1901-1917. DOI:10.7150/thno.51299 |
| [27] |
Zalevsky J, Chamberlain AK, Horton HM, et al. Enhanced antibody half-life improves in vivo activity[J]. Nat Biotechnol, 2010, 28: 157-159. DOI:10.1038/nbt.1601 |
| [28] |
Dall'Acqua WF, Woods RM, Ward ES, et al. Increasing the affinity of a human IgG1 for the neonatal Fc receptor: biological consequences[J]. J Immunol, 2002, 169: 5171-5180. DOI:10.4049/jimmunol.169.9.5171 |
| [29] |
Gunn BM, Lu R, Slein MD, et al. A Fc engineering approach to define functional humoral correlates of immunity against Ebola virus[J]. Immunity, 2021, 54: 815-828. DOI:10.1016/j.immuni.2021.03.009 |
| [30] |
Dall'Acqua WF, Kiener PA, Wu H. Properties of human IgG1s engineered for enhanced binding to the neonatal Fc receptor (FcRn)[J]. J Biol Chem, 2006, 281: 23514-23524. DOI:10.1074/jbc.M604292200 |
| [31] |
Robbie GJ, Criste R, Dall'Acqua WF, et al. A novel investigational Fc-modified humanized monoclonal antibody, motavizumab-YTE, has an extended half-life in healthy adults[J]. Antimicrob Agents Chemother, 2013, 57: 6147-6153. DOI:10.1128/AAC.01285-13 |
| [32] |
Qiu Y, Lv W, Xu M, et al. Single chain antibody fragments with pH dependent binding to FcRn enabled prolonged circulation of therapeutic peptide in vivo[J]. J Control Release, 2016, 229: 37-47. DOI:10.1016/j.jconrel.2016.03.017 |
| [33] |
Nagelkerke SQ, Kuijpers TW. Immunomodulation by IVIg and the role of Fc-gamma receptors: classic mechanisms of action after all?[J]. Front Immunol, 2014, 5: 674-686. |
| [34] |
Rother RP, Rollins SA, Mojcik CF, et al. Discovery and development of the complement inhibitor eculizumab for the treatment of paroxysmal nocturnal hemoglobinuria[J]. Nat Biotechnol, 2007, 25: 1256-1264. DOI:10.1038/nbt1344 |
| [35] |
Castro-Dopico T, Clatworthy MR. IgG and Fc gamma receptors in intestinal immunity and inflammation[J]. Front Immunol, 2019, 10: 805-827. |
| [36] |
Nugent J, Po AL, Scott EM. Design and delivery of non-parenteral vaccines[J]. J Clin Pharm Ther, 1998, 23: 257-285. |
| [37] |
Shah DK, Betts AM. Antibody biodistribution coefficients: inferring tissue concentrations of monoclonal antibodies based on the plasma concentrations in several preclinical species and human[J]. MAbs, 2013, 5: 297-305. DOI:10.4161/mabs.23684 |
| [38] |
Azevedo C, Nilsen J, Grevys A, et al. Engineered albumin-functionalized nanoparticles for improved FcRn binding enhance oral delivery of insulin[J]. J Control Release, 2020, 327: 161-173. DOI:10.1016/j.jconrel.2020.08.005 |
| [39] |
Pridgen EM, Alexis F, Kuo TT, et al. Transepithelial transport of Fc-targeted nanoparticles by the neonatal fc receptor for oral delivery[J]. Sci Transl Med, 2013, 5: 167r-213r. |
| [40] |
Qin J, Wang W, Sarkar S, et al. Oral delivery of anti-MDM2 inhibitor SP141-loaded FcRn-targeted nanoparticles to treat breast cancer and metastasis[J]. J Control Release, 2016, 237: 101-114. DOI:10.1016/j.jconrel.2016.07.008 |
| [41] |
Shi Y, Sun X, Zhang L, et al. Fc-modified exenatide-loaded nanoparticles for oral delivery to improve hypoglycemic effects in mice[J]. Sci Rep, 2018, 8: 726-734. DOI:10.1038/s41598-018-19170-y |
| [42] |
Yu J, Zhang Y, Wang J, et al. Glucose-responsive oral insulin delivery for postprandial glycemic regulation[J]. Nano Res, 2019, 12: 1539-1545. DOI:10.1007/s12274-018-2264-9 |
| [43] |
Song XN, Li R, Zhang H, 等. The effect of pH and ligand density on the endocytosis and exocytosis process of FcBP decorated PEG-PCL micelles on Caco-2 cells[J]. Acta Pharm Sin (药学学报), 2017, 52: 1331-1336. |
| [44] |
Wang Q, Hai W, Shi S, et al. Oral uptake and persistence of the FnAb-8 protein characterized by in situ radio-labeling and PET/CT imaging[J]. Asian J Pharm Sci, 2020, 15: 752-758. DOI:10.1016/j.ajps.2020.03.002 |
| [45] |
Heidl S, Ellinger I, Niederberger V, et al. Localization of the human neonatal Fc receptor (FcRn) in human nasal epithelium[J]. Protoplasma, 2016, 253: 1557-1564. DOI:10.1007/s00709-015-0918-y |
| [46] |
Bitonti AJ, Dumont JA, Low SC, et al. Pulmonary delivery of an erythropoietin Fc fusion protein in non-human primates through an immunoglobulin transport pathway[J]. Proc Natl Acad Sci U S A, 2004, 101: 9763-9768. DOI:10.1073/pnas.0403235101 |
| [47] |
Bern M, Nilsen J, Ferrarese M, et al. An engineered human albumin enhances half-life and transmucosal delivery when fused to protein-based biologics[J]. Sci Transl Med, 2020, 12: eabb0580-0592. |
| [48] |
Ye L, Zeng R, Bai Y, et al. Efficient mucosal vaccination mediated by the neonatal Fc receptor[J]. Nat Biotechnol, 2011, 29: 158-163. DOI:10.1038/nbt.1742 |
| [49] |
Lu L, Palaniyandi S, Zeng R, et al. A neonatal Fc receptor-targeted mucosal vaccine strategy effectively induces HIV-1 antigen-specific immunity to genital infection[J]. J Virol, 2011, 85: 10542-10553. DOI:10.1128/JVI.05441-11 |
| [50] |
Ochsner SP, Li W, Rajendrakumar AM, et al. FcRn-targeted mucosal vaccination against influenza virus infection[J]. J Immunol, 2021, 207: 1310-1321. DOI:10.4049/jimmunol.2100297 |
| [51] |
Kingwell K. Drug delivery: new targets for drug delivery across the BBB[J]. Nat Rev Drug Discov, 2016, 15: 84-85. DOI:10.1038/nrd.2016.14 |
| [52] |
Kariolis MS, Wells RC, Getz JA, et al. Brain delivery of therapeutic proteins using an Fc fragment blood-brain barrier transport vehicle in mice and monkeys[J]. Sci Transl Med, 2020, 12: eaay1359. DOI:10.1126/scitranslmed.aay1359 |
| [53] |
Cavaco M, Frutos S, Oliete P, et al. Conjugation of a blood brain barrier peptide shuttle to an Fc domain for brain delivery of therapeutic biomolecules[J]. ACS Med Chem Lett, 2021, 12: 1663-1668. DOI:10.1021/acsmedchemlett.1c00225 |
| [54] |
Matsumura Y, Maeda H. A new concept for macromolecular therapeutics in cancer chemotherapy: mechanism of tumoritropic accumulation of proteins and the antitumor agent smancs[J]. Cancer Res, 1986, 46: 6387-6392. |
| [55] |
Swiercz R, Mo M, Khare P, et al. Loss of expression of the recycling receptor, FcRn, promotes tumor cell growth by increasing albumin consumption[J]. Oncotarget, 2017, 8: 3528-3541. DOI:10.18632/oncotarget.13869 |
| [56] |
Liu H, Sun M, Liu Z, et al. KRAS-enhanced macropinocytosis and reduced FcRn-mediated recycling sensitize pancreatic cancer to albumin-conjugated drugs[J]. J Control Release, 2019, 296: 40-53. |
 2022, Vol. 57
2022, Vol. 57


