2. 北京理工大学前沿交叉科学研究院, 北京 100081
2. Advanced Research Institute of Multidisciplinary Science, Beijing Institute of Technology, Beijing 100081, China
生命体由无数细胞的生命活动构成, 各部分细胞分工明确, 各司其职, 又互相联系, 协同合作, 共同维持着生命体内环境的稳态。细胞间精确、高效的信息传递在此过程中发挥着至关重要的作用。细胞间通讯依靠细胞的直接接触和细胞信号的传递来进行, 其中, 较远距离的信号传递大多以细胞外囊泡(extracellular vesicles, EVs) 的方式来进行[1]。细胞外囊泡呈球形, 由脂质双分子层包裹, 表面含有丰富的膜蛋白, 根据产生机制不同可分为外泌体、微泡和凋亡体[2]。其中外泌体由于其较小的粒径(30~150 nm)、丰富的生物学功能和潜在的用于药物递送的价值而倍受关注[3]。
外泌体存在于多种体液中, 包括血液、唾液、尿液、脑脊液、乳汁、羊水和腹水, 通过检测体液中的外泌体以实现疾病的早期筛查, 已经成为诊断学中一个新兴的领域[4, 5]。除此之外, 外泌体最令人兴奋的是在于其用作药物递送载体时表现出的优越性, 得益于其天然的递送细胞间信息分子的生物学职能, 当外泌体用于药物递送时: ①具有良好的生物相容性及低免疫原性。特别是当外泌体来自患者自身细胞或某些特定种类的细胞时, 如未成熟的树突细胞及间充质干细胞, 几乎无免疫原性, 有利于药效的发挥和减少不良反应[6]; ②外泌体含特定的磷脂和功能性膜蛋白, 使其能够高效地将内含物递送到靶细胞的胞质中。如外泌体可通过膜融合或间隙连接等途径向胞内递送内容物, 从而避开内涵体-溶酶体途径, 有利于提高递送效率[7, 8]; ③外泌体在一定程度上具有天然靶向的特性, 减少脱靶效应引起的不良反应[9, 10]。
目前, 肿瘤的药物治疗仍以清除肿瘤细胞、引起有效的抗肿瘤免疫反应等方法为主。如何提高药物的稳定性、靶向性和递送效率是最受关注的问题。外泌体的一系列优点契合抗肿瘤药物递送的需求, 引起了学者的广泛兴趣。在过去的10年中, 无数研究报道了基于外泌体的抗肿瘤治疗方案, 并取得了令人瞩目的成果, 本文对外泌体在抗肿瘤药物递送中的应用进行了综述, 并展望了外泌体作为下一代疗法的前景。
1 外泌体的生物起源和分离提取依据生物起源的不同, EVs可主要分为3种亚型, 即外泌体、微泡和凋亡体, 其中微泡在细胞膜上以直接出芽的形式产生[11], 凋亡体仅在细胞凋亡期间产生, 主要作用是包裹细胞碎片, 以防细胞毒性物质泄漏到细胞外环境中[12]。因为目前凋亡体作为药物递送载体的应用有限, 因此在本文中不做过多介绍。
简单地说, 外泌体起源于两次质膜内陷过程, 首先, 细胞质膜内陷形成早期内涵体, 随后早期内涵体膜继续内陷, 形成多囊泡体(multivesicular body, MVB), MVB有两种可能的命运, 与溶酶体融合, 导致其内容物酸化降解; 与细胞质膜相融合, 将内腔囊泡释放到细胞外, 最终形成外泌体[13]。深入了解外泌体形成过程的分子机制, 有利于人为调控其产量、蛋白组成和包载物, 然而具体的分子机制目前尚未完全阐述清楚, 但大体可分为依赖内涵体分选复合物(endosomal sorting complex required for transport, ESCRT) 的途径和非依赖ESCRT的途径。在依赖ESCRT的途径中, 4种复合蛋白(ESCRT-0、-I、-II和-III) 调控着外泌体的形成与运输, 其中ESCRT-0介导底物的识别和分选, ESCRT-I和ESCRT-II是介导内涵体膜向内出芽的关键, ESCRT-III负责剪切芽体的颈部, 从而使其脱落到内涵体腔内形成MVB, 更详细的分子机制可参阅文献[14, 15]。在非依赖ESCRT的途径中, 由其他一些蛋白和脂质来调节囊泡的出芽、移动和融合等过程[16], 如某些四跨膜蛋白[17]、神经酰胺[18]等。
开发快速、高效, 同时又能保持外泌体的完整性和生物活性的分离提纯方法仍然是限制外泌体进行临床转化的重要障碍[19]。差速离心法是目前应用最广泛的外泌体提取方法, 此方法利用外泌体和污染物大小和密度的不同, 使用梯度离心将二者分别沉降下来。通常从较低转速(约300 ×g) 开始以去除悬浮细胞, 然后梯度升高转速, 以去除细胞碎片等较大的颗粒, 最终以超速离心(约100 000 ×g) 结尾, 来收集外泌体[20]。然而此方法收集到的外泌体常伴随有大量脂蛋白和其他与外泌体共沉淀的生物分子的污染[21], 可以在超速离心后使用蔗糖或碘克沙醇密度梯度离心来进一步纯化所得外泌体[22]。基于差速离心的外泌体提取方法步骤简单、价格低廉, 但是耗时较长, 提取效率较低(可能造成40%以上的损失[23]), 由于高离心力, 也可能导致外泌体聚集[24]。因此, 人们也开发了一些其他的方法来分离提纯外泌体, 其中最具代表性的是尺寸排阻色谱法(size-exclusion chromatography, SEC) 和聚合物沉淀法。SEC利用混合物样品中各组分流体力学直径的不同来进行分离, 样品流经SEC色谱柱时, 较小的粒子将进入柱内更小的孔隙, 使通过路程增加, 从而增加其流出时间。相反, 较大的粒子则只能通过柱内较大的孔隙, 从而使其在较短的时间内洗脱下来[25]。SEC的主要优点是具有较好的分离效率和重现性, 在较低压力下能维持外泌体结构与功能的完整[26], 其局限性在于需要额外的浓缩步骤、分离时间较长和每次使用都需平衡色谱柱等[27]。基于聚合物(如聚乙二醇) 的沉淀方法常用于沉淀病毒和其他生物大分子[28], 在用于提纯外泌体时, 也显示出了不错的效果。加入聚合物溶液后, 外泌体会被困于聚合物网格中, 然后通过低速离心即可完成外泌体的回收[29]。此方法简单、快速和价格低廉, 然而所得外泌体污染物较多, 产品纯度较差[30]。此外, 不断有研究利用新技术完成外泌体的提取与分离, 并取得了令人振奋的结果, 例如超滤法[31]、免疫亲和捕获法[32]、基于微流控的分离方法[33]等。各种外泌体提取方法的总结见表 1[20, 26, 27, 30-32, 34-39], 由于不同提取方法有各自的优缺点, 国际细胞外囊泡协会(International Society for Extracellular Vesicles) 指出, 可以将不同提取方法组合使用, 以提高外泌体的收率和纯度[40]。
| Table 1 Comparison of isolation methods of extracellular vesicles (EVs) |
天然来源的外泌体含有众多内源性脂质、蛋白及核酸类物质, 其自身具有一定的成药潜力, 例如间充质干细胞来源的外泌体在组织修复领域获得了巨大成功[41]。当外泌体用作递送载体时, 一般还需人为装载药物。理想的载药方法不仅要实现较高的载药效率, 还应保留外泌体和药物的功能和完整性。目前, 在不破坏外泌体膜完整性的情况下将药物有效载入到外泌体中仍是一个巨大挑战。现有的载药方法可分为分泌前载药法和分泌后载药法。
分泌前载药法通常将亲代细胞与药物共孵育(一般需要加转染试剂), 使药物进入细胞质, 细胞质中的药物通过主动或被动的方式被分选到外泌体中, 然后通过合适的提取方法即可获得载药的外泌体。此方法只涉及对细胞的处理和改造, 而对提取的外泌体几乎不进行处理, 其优点是较好地保留了外泌体的完整性和功能性, 缺点是载药效率相对较低[12]。Pascucci等[42]将骨髓间充质干细胞与紫杉醇(paclitaxel, PTX) 共孵育, 然后在提取的外泌体中检测到了PTX的存在, 并且载PTX外泌体在体外表现出了显著的抗肿瘤细胞增殖的活性。Lee等[43]报道了一种基于脂质体的细胞工程方法, 载药脂质体可以与细胞膜融合从而将药物释放到细胞质中, 提取此细胞的外泌体即天然携带导入的药物。除了小分子药物, 蛋白和核酸等生物大分子也可通过分泌前载药法装载到外泌体中。Votteler等[44]设计了一种“包膜纳米蛋白笼”, 通过基因工程手段在细胞中导入相应基因, 模拟包膜病毒增殖的过程, 表达的蛋白可完成组装成笼和进入外泌体中, 电镜结果显示, 提取的外泌体中每个外泌体均含有数个“蛋白笼”, 利用“蛋白笼”可实现蛋白类分子的递送。Wang等[45]利用Tat蛋白可以特异性结合反式激活应答元件核糖核酸的特点, 通过融合蛋白的方式使外泌体携带Tat蛋白, 再将反式激活应答元件核糖核酸修饰到目的信使核糖核酸(messenger ribonucleic acid, mRNA) 的非翻译区, 所需要的mRNA即可被分选到外泌体中。
分泌后载药方法是目前最常用的外泌体载药策略, 通常需要先分离提纯外泌体, 再将药物载入其中, 其优点在于方法相对简单, 载药效率相对较高, 但载药过程可能会损害外泌体的完整性, 且需要额外的纯化步骤以除去未包载的药物。对于一些疏水性小分子, 可通过简单孵育的方法完成载药, 例如姜黄素[46]和紫杉醇[47]。对于亲水性分子和大分子, 由于外泌体脂质双分子层膜的屏障作用, 一般需要对膜造成瞬时缺陷来使药物进入外泌体内部, 可选择的方法包括使用转染试剂、电穿孔、表面活性剂处理、挤出、超声和冻融循环等(图 1)[48]。电穿孔是常见的载药手段, 其原理是通过瞬时电流在外泌体膜上产生孔洞以允许药物渗入其中, 此方法适用于小分子[49]和核糖核酸(ribonucleic acid, RNA) 类药物[6]。Kamerkar等[50]通过电穿孔的方法将小干扰RNA (small interfering RNA, siRNA) 导入到成纤维细胞来源的外泌体中, 然而导入效率只有约10%。Haney等[51]为了将过氧化氢酶包载到外泌体中, 对比了孵育、冻融循环、超声和挤出方法, 结果显示, 不同处理方法的包载效率为: 孵育 < 冻融循环 < 挤出≈超声, 其中超声处理后的外泌体载药量可达到每个外泌体中含有940 ± 15个过氧化氢酶分子。Kim等[52]分别使用了孵育、电穿孔及温和的超声法将紫杉醇载入到外泌体中, 结果证明, 温和的超声法载药效率最高。
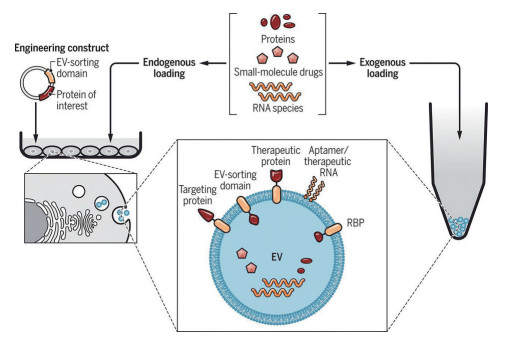
|
Figure 1 EV engineering and loading strategies. EVs can be loaded with therapeutic entities such as RNA species, proteins, and small-molecule drugs through exogenous loading (loading of isolated EVs) or endogenous loading (loading during EV biogenesis). (Adapted from Ref. 48 with permission. Copyright © 2019 the American Association for the Advancement of Science) |
外泌体丰富的膜蛋白及特殊脂质的存在赋予了其穿过生物屏障的能力, 外泌体已被证明可以穿过血脑屏障, 实现生物大分子药物的脑部递送[6, 53]。此外, 不同细胞来源的外泌体在体内也显示出了独特的组织选择性, T细胞分泌的外泌体可将信号分子单向传递给抗原呈递细胞。虽然研究表明静脉注射的外泌体会非特异性地聚集在肝脏、肺、脾和胃肠道中[54], 但外泌体通过配体受体介导的主动选择性也在很大程度上影响着其组织分布[55], B细胞来源的外泌体通过表面携带的唾液酸被高表达CD169 (唾液酸受体) 的巨噬细胞摄取[56]; 来自免疫细胞的外泌体表达CD47受体[57], 该受体与信号调节蛋白α相互作用, 产生“不吃我”信号, 阻止细胞摄取[50]。最近的一项研究指出间充质干细胞来源的外泌体比脂质体更容易逃脱应力松弛的水凝胶, 提示外泌体及靶细胞环境的机械刚度也是其选择性分布的一个影响因素[58]。由于外泌体所具有的这些丰富的生物学特性, 许多研究者尝试使用天然或改造后的外泌体进行药物递送(图 2)。
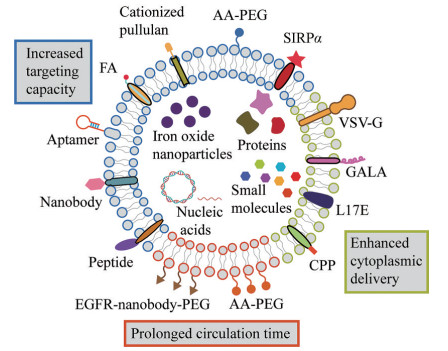
|
Figure 2 Schematic representation of functional ligands with divergent functions that can be introduced to EVs for improved delivery properties. FA: Folate; AA-PEG: Aminoethylanisamide-polyethylene glycol; SIRPα: Signal regulatory protein α; VSV-G: G protein of vascular stomatitis virus; GALA: GALA peptide; L17E: L17E peptide; CPP: Cell penetrating peptide; EGFR: Endothelial growth factor receptor. (Adapted from Ref. 3 with permission. Copyright © 2018 Elsevier) |
尽管外泌体可以用来递送各种各样的化疗药物, 但大多研究集中在递送多柔比星(doxorubicin, DOX) 和PTX上。众所周知, DOX最严重的不良反应来源于其心脏毒性。如何提高DOX对于肿瘤组织的靶向性, 减少其在心肌细胞的浓度是关键性问题。有研究证明, 将DOX包载到乳腺癌细胞源外泌体中, 增加了药物稳定性和肿瘤部位的积累, 并在小鼠模型中显著抑制了肿瘤生长同时降低了心脏毒性[59]。将外泌体来源更换为HEK 293细胞时也获得了类似的结果[60], 更进一步地, 作者证明了外泌体携带的膜蛋白CX43可能对于降低心脏毒性发挥着重要作用[60]。Yang等[61]证明, 在斑马鱼模型中, 来自脑内皮细胞的外泌体可以通过血脑屏障转运DOX和PTX, 从而抑制肿瘤生长。为了降低外泌体的分离难度和增加靶向性, Qi等[62]通过转铁蛋白使外泌体负载超顺磁纳米粒, 通过磁场分离得到了血浆中的外泌体, 并在体外载入了DOX, 静脉回输后通过体外施加磁场的方式增加了肿瘤靶向性。
同理, 对于PTX来说, 外泌体增加了药物在肿瘤部位的浓度, 降低了毒性和耐药性。利用牛奶源外泌体[63]、肿瘤细胞源外泌体[47]、M1型巨噬细胞源外泌体[64]和间充质干细胞源外泌体[42, 65]递送PTX时, 均观察到了备受鼓舞的结果。通过对外泌体进行靶向配基的修饰, 可以进一步增加其靶向性。Kim等[66]利用巨噬细胞来源的外泌体包载PTX, 并通过氨基乙基茴香酰胺聚乙二醇(aminoethylanisamide-polyethylene glycol, AA-PEG) 修饰的方法来靶向在肺肿瘤细胞中过表达的sigma受体。结果证明, 全身给药后AA-PEG修饰的外泌体显示出更强的肺部肿瘤靶向性, 有效抑制了肺肿瘤转移并延长了小鼠生存期。Zhu等[67]将一段肿瘤靶向肽(cRGD) 修饰到胚胎干细胞源外泌体表面, 用于递送PTX, 结果显示, 修饰后的外泌体有效地靶向胶质瘤细胞, 最终增强了PTX的疗效。
3.2 外泌体用于递送生物大分子抗肿瘤药物不同于小分子药物,蛋白、多肽及核酸类生物大分子药物在体内环境中易被降解失活, 若需进入细胞内发挥作用, 还面临着细胞膜和内涵体等一系列生物屏障的阻碍[68]。外泌体作为细胞间信息传递的载体, 天然肩负着递送生物信息分子的职能, 具备固有的跨过生物屏障的能力, 在递送生物大分子药物方面有突出优势。在递送蛋白多肽类药物方面, Barok等[69]将一种抗体-药物偶联物(曲妥珠单抗-DM1, T-DM1) 结合到携带人表皮生长因子受体-2的外泌体上, 利用外泌体可将内容物携带到其他细胞中的能力, 将细胞毒性药物DM1携带到肿瘤细胞中。结果显示, 外泌体成功将T-DM1递送至乳腺癌细胞中, 抑制了细胞活性。最近, 研究者开发了一种基于外泌体的仿生递送平台用于蛋白的递送[70], 在此递送策略中, 治疗性蛋白被包裹在金属-有机框架材料中作为内核, 外泌体包裹在内核材料表面, 这种递送系统不仅能保护蛋白不被降解, 还能靶向至肿瘤部位, 提高蛋白的治疗效果。
外泌体在用于核酸药物的递送方面也展现出了极大的优势。微小RNA (microRNA, miRNA) 是一种非编码型RNA, 通过结合在mRNA上来调控基因表达。外泌体天然携带多种miRNA, 并在免疫反应、肿瘤进展和神经退行性疾病等多种生理、病理条件下发挥着重要作用[71]。值得注意的是, 尽管研究尚不清晰, 但miRNA不是随机进入外泌体的, 细胞内存在特定的分选机制, 使不同种类的细胞, 或同种细胞在不同条件下可以释放载有不同miRNA的外泌体[72, 73]。目前已有人为提高外泌体中特定miRNA载量的报道, 例如Li等[74]将外泌体的特征蛋白CD9与一种RNA结合蛋白HuR融合, 转染细胞后, 在胞内表达的CD9-HuR融合蛋白即可将miR-155特异性地富集到外泌体中。
siRNA是一种短序列RNA, 用于基因沉默, 但极易降解, 使用外泌体来递送siRNA是一种可行的方法[75]。Kamerkar等[50]将siRNA装载到改造的外泌体中, 获得了与脂质体相当的基因沉默效率。为了改善癌细胞转移前肺部的药物递送, Zhao等[76]将外泌体膜包裹在阳离子牛血清白蛋白和siRNA的复合物表面, 提高了其肺部靶向能力, 获得了优秀的肺部基因沉默效果。Yang等[77]将抗血管内皮生长因子的siRNA装载到脑内皮细胞来源的外泌体中, 并观察到外泌体成功穿过斑马鱼的血脑屏障将siRNA递送到脑内, 抑制了肿瘤生长。
除了短链RNA之外, 外泌体也可以用于递送较大分子质量的脱氧核糖核酸(deoxyribonucleic acid, DNA) 或mRNA。Kim等[78]利用肿瘤细胞来源的外泌体装载了质粒DNA, 成功靶向卵巢癌细胞并敲除了PARP-1基因, 诱导了卵巢癌细胞凋亡同时增强了其对顺铂的敏感性。Yang等[79]通过瞬时电刺激的方法刺激细胞大量产生负载mRNA的外泌体, 使用此方法得到的外泌体平均每个携带2~10个mRNA, 比常规转染法提高了1 000倍。随后作者使用此方法制备了包载PTEN基因mRNA的外泌体, 给予PTEN缺陷的神经胶质瘤小鼠后抑制了肿瘤生长, 提高了存活率。Kojima等[80]将来源于细菌的核糖体蛋白L7Ae与外泌体标志性蛋白CD63融合, 使细胞分泌的外泌体内部携带L7Ae, 再在目的基因片段非翻译区内插入C/Dbox片段, 利用L7Ae特异性结合C/Dbox的能力成功将目的mRNA分选到外泌体中, 得到了天然负载完整目的mRNA的外泌体。
4 外泌体作为药物递送载体的修饰策略尽管特定细胞来源的外泌体具有内在的靶向性, 为了实现更有效的肿瘤靶向效果, 多数研究均对外泌体进行了一定的靶向修饰。目前, 外泌体的靶向修饰策略主要可分为分泌前的细胞水平修饰及分泌后的外泌体水平修饰两种[81]。细胞水平的修饰策略因利用细胞固有的蛋白表达机制及外泌体天然的生物形成过程, 有利于保留所表达的靶蛋白或多肽的天然构象及功能[82]。该修饰策略通常利用外泌体的一些高表达的膜蛋白作为靶蛋白的锚定位点。目前, 外泌体常用的锚定位点主要包括溶酶体相关膜蛋白2b (lysosome associated membrane glycoprotein 2b, Lamp2b)、乳凝集素、血小板源生长因子受体(platelet derived growth factor receptor, PDGFR) 及糖基磷脂酰肌醇(glycosylphosphatidylinositol, GPI) 等[3]。基于细胞水平的修饰策略可有效地将靶向配基修饰在外泌体上, 但是由于该策略涉及母细胞的转染, 因而相对耗时, 且该法不太适用于来自患者体液中外泌体的修饰[83]。应用该策略, 有研究将狂犬病病毒糖蛋白靶向多肽(rabies virus glycoprotein targeting polypeptide, RVG) 或可高效亲和整合素的靶向肽(iRGD) 融合到Lamp2b上, 从而得到了RVG或iRGD靶向多肽修饰的外泌体, 将其静脉注射后可有效提高siRNA或DOX在疾病部位的递送[6, 49]。然而, 有研究指出Lamp2b与配基的融合体在分选入外泌体之前易被内涵体中的蛋白酶降解。为减少Lamp2b与多肽融合体的降解, 有研究将糖基化的序列连接到Lamp2b上以保护该靶向配基[84]。在多种肿瘤组织中表皮生长因子受体(epidermal growth factor receptor, EGFR) 均高表达, 因而有研究以PDGFR作为锚定蛋白, 将EGFR的配体GE11肿瘤靶向多肽融合到PDGFR末端, 使得修饰后的外泌体可有效靶向肿瘤部位[85]。此外, 由于膜锚定蛋白GPI在外泌体上富集, 有的研究制备了EGFR纳米抗体与GPI融合蛋白的质粒并转染母细胞, 成功提取出EGFR靶向抗体修饰的外泌体, 其可有效提高外泌体靶向到肿瘤细胞上[86]。
外泌体水平的修饰策略通常在外泌体的分离提取后进行, 因而该修饰策略效率相对较高, 但修饰条件需要严格控制, 防止外泌体接触到过多的试剂、过高的温度或压力等, 以免破坏外泌体膜及蛋白结构和功能的完整性。目前, 该修饰策略可分为共价偶联和非共价偶联修饰策略。前者需使用化学交联剂将靶向配基偶联到外泌体膜上。例如, 将炔基偶联到外泌体上的氨基, 然后借助于点击化学反应, 即通过叠氮与炔烃间形成的共价键将靶向配基偶联到外泌体膜上[87]。基于该策略, 有研究通过生物正交化学(点击化学) 的手段开发出靶向修饰的外泌体。作者利用生物正交无铜叠氮炔环加成反应将功能靶向配体c(RGDyK) 偶联到间充质干细胞来源外泌体的表面, c(RGDyK) 偶联的外泌体(cRGD-Exo) 于静脉给药后, 可有效靶向缺血性脑损伤区域, 更进一步地, 将姜黄素包载到cRGD-Exo中, 给药后可强烈抑制病变区域的炎症反应和细胞凋亡[88]。然而, 点击化学的修饰策略由于缺乏反应的特异性, 可能会影响外泌体膜上其他膜蛋白的功能, 如细胞结合蛋白、介导免疫逃逸及胞内转运途径的蛋白等[83]。因此, 该策略需精准控制反应条件, 如靶向配基与外泌体的比例等。此外, 由于不同来源的外泌体蛋白谱差异较大, 因而偶联反应的效率也受外泌体来源的限制。
非共价偶联策略通常借助亲疏水或电荷相互作用将靶向配基修饰到外泌体膜上, 因而与共价偶联策略相比, 该策略的修饰条件相对更温和[81]。有研究[89]开发出一种脂质化适配体靶向修饰外泌体的方法, 作者将AS1411适配体作为靶向配基并连接到脂质上, 制备出脂质化的适配体, 其可通过与外泌体磷脂膜的相互作用插入到外泌体膜中, 从而制备出适配体靶向修饰的外泌体。通过类似的策略, 有研究将靶向EGFR的纳米抗体连接到脂质-聚乙二醇(polyethylene glycol, PEG) 衍生物的末端, 从而得到脂质化的EGFR-PEG靶向配基。通过与外泌体共孵育, 该靶向配基可自动插入外泌体的膜中[81]。最近, 有研究通过类似策略将亲脂性的荧光硼-二吡咯甲基(BODIPY)-PEG-cRGD通过疏水间相互作用插入外泌体膜中。BODIPY的引入可用于检测配基在外泌体中的保留动力学及外泌体在体内的生物分布和药代动力学性质[90]。总而言之, 通过对靶向配基进行脂质化或疏水化修饰, 可实现其在外泌体上的膜整合, 因而该策略具有一定的普适性。尽管如此, 基于膜内嵌入锚定的策略依赖于脂质或疏水基团与磷脂间的疏水键相互作用, 靶向配基的引入效率及结合的稳定性需要进一步优化。
5 总结与展望作为一种新型的药物递送系统, 与传统药物递送系统相比, 外泌体显示出了更高的生物相容性和安全性、更低的免疫原性、较好地穿越生物屏障的能力和一定的靶向性, 然而外泌体仍然存在着许多缺点限制着其临床转化(表 2)。制约其发展的问题主要包括: ①上游步骤的质量控制极大地影响外泌体的质量, 包括亲代细胞的选择和大规模培养[19], 选择亲代细胞, 需综合考虑外泌体的活性、组织归巢能力、免疫原性和致癌性等因素, 此外, 亲代细胞的基因稳定性、外泌体产量和污染物(如病毒污染) 等也需考虑。一旦确定亲代细胞, 大规模培养一般采用生物反应器(可至2 000 L), 并且需要密切监测基因漂移和污染物; ②缺乏经济高效的外泌体提取流程, 特别是缺乏保证外泌体产量、纯度和功能且重现性良好的标准化操作规范[91]; ③缺乏高效的外泌体载药方式; ④外泌体的储存也是一项难题, 4 ℃条件下保存外泌体会导致聚集和结构破坏[92], -80 ℃是较好的保存方式, 但也给运输和成本增加了负担; ⑤外泌体的体内功能与安全性问题仍存在许多争议, 由于外泌体自身的生物学活性, 将其用作递送载体时, 应充分考虑安全性, 例如由于间充质干细胞来源的外泌体具有抗炎和抑制免疫的作用, 基于此种外泌体的疗法有可能直接或间接诱发肿瘤或加速已有肿瘤的进程[93], 对外泌体进行载药等破坏膜的操作时, 存在改变膜蛋白方向的风险, 这可能造成免疫系统的识别继而引发不良反应[94]。
| Table 2 Advantages and limitations of extracellular vesicles for therapeutic delivery. (Adapted from Ref. 12 with permission. Copyright © 2017 Elsevier) |
目前只有少量基于外泌体的疗法走进了临床试验[19]。但令人高兴的是, 许多研究者在此方向上进行着不懈的努力, 并取得了瞩目的成果, 例如将脂质体与外泌体进行膜融合以提高载药能力并降低外泌体用量[94]或尝试外泌体的全人工合成[95]。除此之外, 不同于人工合成脂质体, 外泌体表面丰富的膜蛋白提供了一个很方便的改造平台, 通过简单的细胞工程手段即可使外泌体携带各种各样的功能性膜蛋白, 从而达到延长循环时间、促进细胞摄取和增加内涵体逃逸能力等目的[3], 这些改造与外泌体内部所载药物相互协同, 大大提高了整体的治疗效果。总而言之, 虽然对外泌体的研究仍处于初期阶段, 但无数的研究证明了无论直接用于治疗还是用作药物递送载体, 外泌体的应用前景都很乐观, 相信在不远的未来, 基于外泌体的疗法一定会大放光彩。
作者贡献: 邢昊楠和陆梅负责文章的撰写; 刘瑛琪负责文献收集; 董雨函负责排版和校对; 郑爱萍负责拟定文章框架及监督文章水平。
利益冲突: 作者声明本文无利益冲突。
| [1] |
Vader P, Mol EA, Pasterkamp G, et al. Extracellular vesicles for drug delivery[J]. Adv Drug Deliv Rev, 2016, 106: 148-156. DOI:10.1016/j.addr.2016.02.006 |
| [2] |
Tarasov VV, Svistunov AA, Chubarev VN, et al. Extracellular vesicles in cancer nanomedicine[J]. Semin Cancer Biol, 2021, 69: 212-225. DOI:10.1016/j.semcancer.2019.08.017 |
| [3] |
Lu M, Xing H, Xun Z, et al. Functionalized extracellular vesicles as advanced therapeutic nanodelivery systems[J]. Eur J Pharm Sci, 2018, 121: 34-46. DOI:10.1016/j.ejps.2018.05.001 |
| [4] |
Barile L, Vassalli G. Exosomes: therapy delivery tools and biomarkers of diseases[J]. Pharmacol Ther, 2017, 174: 63-78. DOI:10.1016/j.pharmthera.2017.02.020 |
| [5] |
Cappello F, Logozzi M, Campanella C, et al. Exosome levels in human body fluids: a tumor marker by themselves[J]. Eur J Pharm Sci, 2017, 96: 93-98. DOI:10.1016/j.ejps.2016.09.010 |
| [6] |
Alvarez-Erviti L, Seow Y, Yin H, et al. Delivery of siRNA to the mouse brain by systemic injection of targeted exosomes[J]. Nat Biotechnol, 2011, 29: 341-345. DOI:10.1038/nbt.1807 |
| [7] |
Soares AR, Martins-Marques T, Ribeiro-Rodrigues T, et al. Gap junctional protein Cx43 is involved in the communication between extracellular vesicles and mammalian cells[J]. Sci Rep, 2015, 5: 13243. DOI:10.1038/srep13243 |
| [8] |
Van den Boorn JG, Schlee M, Coch C, et al. SiRNA delivery with exosome nanoparticles[J]. Nat Biotechnol, 2011, 29: 325-326. DOI:10.1038/nbt.1830 |
| [9] |
Rana S, Zöller M. Exosome target cell selection and the importance of exosomal tetraspanins: a hypothesis[J]. Biochem Soc Trans, 2011, 39: 559-562. DOI:10.1042/BST0390559 |
| [10] |
Ye SJ, Hu KL. Research progress of exosomes as drug delivery systems in the treatment of brain diseases[J]. Acta Pharm Sin (药学学报), 2020, 55: 1540-1548. |
| [11] |
Hagmann J, Burger MM, Dagan D. Regulation of plasma membrane blebbing by the cytoskeleton[J]. J Cell Biochem, 1999, 73: 488-499. DOI:10.1002/(SICI)1097-4644(19990615)73:4<488::AID-JCB7>3.0.CO;2-P |
| [12] |
Lu M, Xing H, Yang Z, et al. Recent advances on extracellular vesicles in therapeutic delivery: challenges, solutions, and opportunities[J]. Eur J Pharm Biopharm, 2017, 119: 381-395. DOI:10.1016/j.ejpb.2017.07.010 |
| [13] |
Raposo G, Stoorvogel W. Extracellular vesicles: exosomes, microvesicles, and friends[J]. J Cell Biol, 2013, 200: 373-383. DOI:10.1083/jcb.201211138 |
| [14] |
Hanson PI, Cashikar A. Multivesicular body morphogenesis[J]. Annu Rev Cell Dev Biol, 2012, 28: 337-362. DOI:10.1146/annurev-cellbio-092910-154152 |
| [15] |
Hurley JH, Hanson PI. Membrane budding and scission by the ESCRT machinery: it's all in the neck[J]. Nat Rev Mol Cell Biol, 2010, 11: 556-566. DOI:10.1038/nrm2937 |
| [16] |
Kowal J, Tkach M, Théry C. Biogenesis and secretion of exosomes[J]. Curr Opin Cell Biol, 2014, 29: 116-125. DOI:10.1016/j.ceb.2014.05.004 |
| [17] |
Perez-Hernandez D, Gutiérrez-Vázquez C, Jorge I, et al. The intracellular interactome of tetraspanin-enriched microdomains reveals their function as sorting machineries toward exosomes[J]. J Biol Chem, 2013, 288: 11649-11661. DOI:10.1074/jbc.M112.445304 |
| [18] |
Kosaka N, Iguchi H, Yoshioka Y, et al. Secretory mechanisms and intercellular transfer of microRNAs in living cells[J]. J Biol Chem, 2010, 285: 17442-17452. DOI:10.1074/jbc.M110.107821 |
| [19] |
Herrmann IK, Wood MJA, Fuhrmann G. Extracellular vesicles as a next-generation drug delivery platform[J]. Nat Nanotechnol, 2021, 16: 748-759. DOI:10.1038/s41565-021-00931-2 |
| [20] |
Théry C, Amigorena S, Raposo G, et al. Isolation and characterization of exosomes from cell culture supernatants and biological fluids[J]. Curr Protoc Cell Biol, 2006. DOI:10.1002/0471143030.cb0322s30 |
| [21] |
Lener T, Gimona M, Aigner L, et al. Applying extracellular vesicles based therapeutics in clinical trials – an ISEV position paper[J]. J Extracell Vesicles, 2015, 4: 30087. DOI:10.3402/jev.v4.30087 |
| [22] |
Gudbergsson JM, Johnsen KB, Skov MN, et al. Systematic review of factors influencing extracellular vesicle yield from cell cultures[J]. Cytotechnology, 2016, 68: 579-592. DOI:10.1007/s10616-015-9913-6 |
| [23] |
Merchant ML, Rood IM, Deegens JKJ, et al. Isolation and characterization of urinary extracellular vesicles: implications for biomarker discovery[J]. Nat Rev Nephrol, 2017, 13: 731-749. |
| [24] |
Linares R, Tan S, Gounou C, et al. High-speed centrifugation induces aggregation of extracellular vesicles[J]. J Extracell Vesicles, 2015, 4: 29509. DOI:10.3402/jev.v4.29509 |
| [25] |
Taylor DD, Shah S. Methods of isolating extracellular vesicles impact down-stream analyses of their cargoes[J]. Methods, 2015, 87: 3-10. DOI:10.1016/j.ymeth.2015.02.019 |
| [26] |
Welton JL, Webber JP, Botos LA, et al. Ready-made chromatography columns for extracellular vesicle isolation from plasma[J]. J Extracell Vesicles, 2015, 4: 27269. DOI:10.3402/jev.v4.27269 |
| [27] |
Böing AN, van der Pol E, Grootemaat AE, et al. Single-step isolation of extracellular vesicles by size-exclusion chromatography[J]. J Extracell Vesicles, 2014, 3: 23430. DOI:10.3402/jev.v3.23430 |
| [28] |
Hsu HTJP. Polyethylene glycol for purification of potato yellow dwarf virus[J]. Phytopathology, 1973, 63: 692. DOI:10.1094/Phyto-63-692 |
| [29] |
Vlassov AV, Magdaleno S, Setterquist R, et al. Exosomes: current knowledge of their composition, biological functions, and diagnostic and therapeutic potentials[J]. Biochim Biophys Acta, 2012, 1820: 940-948. DOI:10.1016/j.bbagen.2012.03.017 |
| [30] |
Gámez-Valero A, Monguió-Tortajada M, Carreras-Planella L, et al. Size-exclusion chromatography-based isolation minimally alters extracellular vesicles' characteristics compared to precipitating agents[J]. Sci Rep, 2016, 6: 33641. DOI:10.1038/srep33641 |
| [31] |
Nordin JZ, Lee Y, Vader P, et al. Ultrafiltration with size-exclusion liquid chromatography for high yield isolation of extracellular vesicles preserving intact biophysical and functional properties[J]. Nanomed Nanotechnol, 2015, 11: 879-883. DOI:10.1016/j.nano.2015.01.003 |
| [32] |
Clayton A, Court J, Navabi H, et al. Analysis of antigen presenting cell derived exosomes, based on immuno-magnetic isolation and flow cytometry[J]. J Immunol Methods, 2001, 247: 163-174. DOI:10.1016/S0022-1759(00)00321-5 |
| [33] |
Kanwar SS, Dunlay CJ, Simeone DM, et al. Microfluidic device (exochip) for on-chip isolation, quantification and characterization of circulating exosomes[J]. Lab Chip, 2014, 14: 1891-1900. DOI:10.1039/C4LC00136B |
| [34] |
Zarovni N, Corrado A, Guazzi P, et al. Integrated isolation and quantitative analysis of exosome shuttled proteins and nucleic acids using immunocapture approaches[J]. Methods, 2015, 87: 46-58. DOI:10.1016/j.ymeth.2015.05.028 |
| [35] |
Iwai K, Yamamoto S, Yoshida M, et al. Isolation of extracellular vesicles in saliva using density gradient ultracentrifugation[J]. Methods Mol Biol, 2017, 343-350. |
| [36] |
Lötvall J, Hill AF, Hochberg F, et al. Minimal experimental requirements for definition of extracellular vesicles and their functions: a position statement from the international society for extracellular vesicles[J]. J Extracell Vesicles, 2014, 3: 26913. DOI:10.3402/jev.v3.26913 |
| [37] |
Heinemann ML, Ilmer M, Silva LP, et al. Benchtop isolation and characterization of functional exosomes by sequential filtration[J]. J Chromatogr A, 2014, 1371: 125-135. DOI:10.1016/j.chroma.2014.10.026 |
| [38] |
Rider MA, Hurwitz SN, Meckes DG. Extrapeg: a polyethylene glycol-based method for enrichment of extracellular vesicles[J]. Sci Rep, 2016, 6: 23978. DOI:10.1038/srep23978 |
| [39] |
Tauro BJ, Greening DW, Mathias RA, et al. Comparison of ultracentrifugation, density gradient separation, and immunoaffinity capture methods for isolating human colon cancer cell line lim1863-derived exosomes[J]. Methods, 2012, 56: 293-304. DOI:10.1016/j.ymeth.2012.01.002 |
| [40] |
Théry C, Witwer KW, Aikawa E, et al. Minimal information for studies of extracellular vesicles 2018 (misev2018): a position statement of the international society for extracellular vesicles and update of the misev2014 guidelines[J]. J Extracell Vesicles, 2018, 7: 1535750. DOI:10.1080/20013078.2018.1535750 |
| [41] |
Rohban R, Pieber TR. Mesenchymal stem and progenitor cells in regeneration: tissue specificity and regenerative potential[J]. Stem Cells Int, 2017, 2017: 5173732. |
| [42] |
Pascucci L, Coccè V, Bonomi A, et al. Paclitaxel is incorporated by mesenchymal stromal cells and released in exosomes that inhibit in vitro tumor growth: a new approach for drug delivery[J]. J Control Release, 2014, 192: 262-270. DOI:10.1016/j.jconrel.2014.07.042 |
| [43] |
Lee J, Lee H, Goh U, et al. Cellular engineering with membrane fusogenic liposomes to produce functionalized extracellular vesicles[J]. ACS Appl Mater Inter, 2016, 8: 6790-6795. DOI:10.1021/acsami.6b01315 |
| [44] |
Votteler J, Ogohara C, Yi S, et al. Designed proteins induce the formation of nanocage-containing extracellular vesicles[J]. Nature, 2016, 540: 292-295. DOI:10.1038/nature20607 |
| [45] |
Wang Q, Yu J, Kadungure T, et al. Armms as a versatile platform for intracellular delivery of macromolecules[J]. Nat Commun, 2018, 9: 960. DOI:10.1038/s41467-018-03390-x |
| [46] |
Sun D, Zhuang X, Xiang X, et al. A novel nanoparticle drug delivery system: the anti-inflammatory activity of curcumin is enhanced when encapsulated in exosomes[J]. Mol Ther, 2010, 18: 1606-1614. DOI:10.1038/mt.2010.105 |
| [47] |
Saari H, Lázaro-Ibáñez E, Viitala T, et al. Microvesicle- and exosome-mediated drug delivery enhances the cytotoxicity of paclitaxel in autologous prostate cancer cells[J]. J Control Release, 2015, 220: 727-737. DOI:10.1016/j.jconrel.2015.09.031 |
| [48] |
Wiklander Oscar PB, Brennan Meadhbh Á, Lötvall J, et al. Advances in therapeutic applications of extracellular vesicles[J]. Sci Transl Med, 2019, 11: eaav8521. DOI:10.1126/scitranslmed.aav8521 |
| [49] |
Tian Y, Li S, Song J, et al. A doxorubicin delivery platform using engineered natural membrane vesicle exosomes for targeted tumor therapy[J]. Biomaterials, 2014, 35: 2383-2390. DOI:10.1016/j.biomaterials.2013.11.083 |
| [50] |
Kamerkar S, LeBleu VS, Sugimoto H, et al. Exosomes facilitate therapeutic targeting of oncogenic kras in pancreatic cancer[J]. Nature, 2017, 546: 498-503. DOI:10.1038/nature22341 |
| [51] |
Haney MJ, Klyachko NL, Zhao Y, et al. Exosomes as drug delivery vehicles for parkinson's disease therapy[J]. J Control Release, 2015, 207: 18-30. DOI:10.1016/j.jconrel.2015.03.033 |
| [52] |
Kim MS, Haney MJ, Zhao Y, et al. Development of exosome-encapsulated paclitaxel to overcome mdr in cancer cells[J]. Nanomed Nanotechnol, 2016, 12: 655-664. DOI:10.1016/j.nano.2015.10.012 |
| [53] |
Yuan D, Zhao Y, Banks WA, et al. Macrophage exosomes as natural nanocarriers for protein delivery to inflamed brain[J]. Biomaterials, 2017, 142: 1-12. DOI:10.1016/j.biomaterials.2017.07.011 |
| [54] |
Lai CP, Mardini O, Ericsson M, et al. Dynamic biodistribution of extracellular vesicles in vivo using a multimodal imaging reporter[J]. ACS Nano, 2014, 8: 483-494. DOI:10.1021/nn404945r |
| [55] |
Wiklander OPB, Nordin JZ, O'Loughlin A, et al. Extracellular vesicle in vivo biodistribution is determined by cell source, route of administration and targeting[J]. J Extracell Vesicles, 2015, 4: 26316. DOI:10.3402/jev.v4.26316 |
| [56] |
Saunderson SC, Dunn AC, Crocker PR, et al. Cd169 mediates the capture of exosomes in spleen and lymph node[J]. Blood, 2014, 123: 208-216. DOI:10.1182/blood-2013-03-489732 |
| [57] |
Kaur S, Singh SP, Elkahloun AG, et al. Cd47-dependent immunomodulatory and angiogenic activities of extracellular vesicles produced by T cells[J]. Matrix Biol, 2014, 37: 49-59. DOI:10.1016/j.matbio.2014.05.007 |
| [58] |
Lenzini S, Bargi R, Chung G, et al. Matrix mechanics and water permeation regulate extracellular vesicle transport[J]. Nat Nanotechnol, 2020, 15: 217-223. DOI:10.1038/s41565-020-0636-2 |
| [59] |
Hadla M, Palazzolo S, Corona G, et al. Exosomes increase the therapeutic index of doxorubicin in breast and ovarian cancer mouse models[J]. Nanomedicine, 2016, 11: 2431-2441. DOI:10.2217/nnm-2016-0154 |
| [60] |
Martins-Marques T, Pinho MJ, Zuzarte M, et al. Presence of Cx43 in extracellular vesicles reduces the cardiotoxicity of the anti-tumour therapeutic approach with doxorubicin[J]. J Extracell Vesicles, 2016, 5: 32538. DOI:10.3402/jev.v5.32538 |
| [61] |
Yang T, Martin P, Fogarty B, et al. Exosome delivered anticancer drugs across the blood-brain barrier for brain cancer therapy in danio rerio[J]. Pharm Res, 2015, 32: 2003-2014. DOI:10.1007/s11095-014-1593-y |
| [62] |
Qi H, Liu C, Long L, et al. Blood exosomes endowed with magnetic and targeting properties for cancer therapy[J]. ACS Nano, 2016, 10: 3323-3333. DOI:10.1021/acsnano.5b06939 |
| [63] |
Agrawal AK, Aqil F, Jeyabalan J, et al. Milk-derived exosomes for oral delivery of paclitaxel[J]. Nanomed Nanotechnol, 2017, 13: 1627-1636. DOI:10.1016/j.nano.2017.03.001 |
| [64] |
Wang P, Wang H, Huang Q, et al. Exosomes from M1-polarized macrophages enhance paclitaxel antitumor activity by activating macrophages-mediated inflammation[J]. Theranostics, 2019, 9: 1714-1727. DOI:10.7150/thno.30716 |
| [65] |
Brini AT, Coccè V, Ferreira LMJ, et al. Cell-mediated drug delivery by gingival interdental papilla mesenchymal stromal cells (GinPa-MSCs) loaded with paclitaxel[J]. Expert Opin Drug Deliv, 2016, 13: 789-798. DOI:10.1517/17425247.2016.1167037 |
| [66] |
Kim MS, Haney MJ, Zhao Y, et al. Engineering macrophage-derived exosomes for targeted paclitaxel delivery to pulmonary metastases: in vitro and in vivo evaluations[J]. Nanomed Nanotechnol, 2018, 14: 195-204. DOI:10.1016/j.nano.2017.09.011 |
| [67] |
Zhu Q, Ling X, Yang Y, et al. Embryonic stem cells-derived exosomes endowed with targeting properties as chemotherapeutics delivery vehicles for glioblastoma therapy[J]. Adv Sci, 2019, 6: 1801899. DOI:10.1002/advs.201801899 |
| [68] |
Xing H, Lu M, Yang T, et al. Structure-function relationships of nonviral gene vectors: lessons from antimicrobial polymers[J]. Acta Biomater, 2019, 86: 15-40. |
| [69] |
Barok M, Puhka M, Vereb G, et al. Cancer-derived exosomes from HER2-positive cancer cells carry trastuzumab-emtansine into cancer cells leading to growth inhibition and caspase activation[J]. BMC Cancer, 2018, 18: 504. DOI:10.1186/s12885-018-4418-2 |
| [70] |
Cheng G, Li W, Ha L, et al. Self-assembly of extracellular vesicle-like metal-organic framework nanoparticles for protection and intracellular delivery of biofunctional proteins[J]. J Am Chem Soc, 2018, 140: 7282-7291. DOI:10.1021/jacs.8b03584 |
| [71] |
Zhang J, Li S, Li L, et al. Exosome and exosomal microrna: trafficking, sorting, and function[J]. Genom Proteom Bioinf, 2015, 13: 17-24. DOI:10.1016/j.gpb.2015.02.001 |
| [72] |
Goldie BJ, Dun MD, Lin M, et al. Activity-associated miRNA are packaged in Map1b-enriched exosomes released from depolarized neurons[J]. Nucleic Acids Res, 2014, 42: 9195-9208. DOI:10.1093/nar/gku594 |
| [73] |
Skog J, Würdinger T, van Rijn S, et al. Glioblastoma microvesicles transport RNA and proteins that promote tumour growth and provide diagnostic biomarkers[J]. Nat Cell Biol, 2008, 10: 1470-1476. DOI:10.1038/ncb1800 |
| [74] |
Li Z, Zhou X, Wei M, et al. In vitro and in vivo RNA inhibition by CD9-HuR functionalized exosomes encapsulated with miRNA or CRISPR/dCas9[J]. Nano Lett, 2019, 19: 19-28. DOI:10.1021/acs.nanolett.8b02689 |
| [75] |
Chen M, Shen YJ, Yang R, et al. Research progress on the neurorestorative benefits of mesenchymal stem cell exosomes for the treatment of ischemic stroke[J]. Acta Pharm Sin (药学学报), 2020, 55: 2306-2313. |
| [76] |
Zhao L, Gu C, Gan Y, et al. Exosome-mediated siRNA delivery to suppress postoperative breast cancer metastasis[J]. J Control Release, 2020, 318: 1-15. DOI:10.1016/j.jconrel.2019.12.005 |
| [77] |
Yang T, Fogarty B, LaForge B, et al. Delivery of small interfering RNA to inhibit vascular endothelial growth factor in zebrafish using natural brain endothelia cell-secreted exosome nanovesicles for the treatment of brain cancer[J]. AAPS J, 2017, 19: 475-486. DOI:10.1208/s12248-016-0015-y |
| [78] |
Kim SM, Yang Y, Oh SJ, et al. Cancer-derived exosomes as a delivery platform of CRISPR/Cas9 confer cancer cell tropism-dependent targeting[J]. J Control Release, 2017, 266: 8-16. DOI:10.1016/j.jconrel.2017.09.013 |
| [79] |
Yang Z, Shi J, Xie J, et al. Large-scale generation of functional mrna-encapsulating exosomes via cellular nanoporation[J]. Nat Biomed Eng, 2020, 4: 69-83. DOI:10.1038/s41551-019-0485-1 |
| [80] |
Kojima R, Bojar D, Rizzi G, et al. Designer exosomes produced by implanted cells intracerebrally deliver therapeutic cargo for parkinson's disease treatment[J]. Nat Commun, 2018, 9: 1305. DOI:10.1038/s41467-018-03733-8 |
| [81] |
Kooijmans SAA, Fliervoet LAL, van der Meel R, et al. Pegylated and targeted extracellular vesicles display enhanced cell specificity and circulation time[J]. J Control Release, 2016, 224: 77-85. DOI:10.1016/j.jconrel.2016.01.009 |
| [82] |
Zhao C, Busch DJ, Vershel CP, et al. Multifunctional transmembrane protein ligands for cell-specific targeting of plasma membrane-derived vesicles[J]. Small, 2016, 12: 3837-3848. DOI:10.1002/smll.201600493 |
| [83] |
Kooijmans SAA, Schiffelers RM, Zarovni N, et al. Modulation of tissue tropism and biological activity of exosomes and other extracellular vesicles: new nanotools for cancer treatment[J]. Pharmacol Res, 2016, 111: 487-500. DOI:10.1016/j.phrs.2016.07.006 |
| [84] |
Hung ME, Leonard JN. Stabilization of exosome-targeting peptides via engineered glycosylation[J]. J Biol Chem, 2015, 290: 8166-8172. DOI:10.1074/jbc.M114.621383 |
| [85] |
Ohno SI, Takanashi M, Sudo K, et al. Systemically injected exosomes targeted to EGFR deliver antitumor microrna to breast cancer cells[J]. Mol Ther, 2013, 21: 185-191. |
| [86] |
Kooijmans SAA, Aleza CG, Roffler SR, et al. Display of GPI-anchored anti-EGFR nanobodies on extracellular vesicles promotes tumour cell targeting[J]. J Extracell Vesicles, 2016, 5: 31053. |
| [87] |
Smyth T, Petrova K, Payton NM, et al. Surface functionalization of exosomes using click chemistry[J]. Bioconjug Chem, 2014, 25: 1777-1784. |
| [88] |
Tian T, Zhang HX, He CP, et al. Surface functionalized exosomes as targeted drug delivery vehicles for cerebral ischemia therapy[J]. Biomaterials, 2018, 150: 137-149. |
| [89] |
Wan Y, Wang L, Zhu C, et al. Aptamer-conjugated extracellular nanovesicles for targeted drug delivery[J]. Cancer Res, 2018, 78: 798. |
| [90] |
Kang C, Han P, Lee JS, et al. Anchor, spacer, and ligand-modified engineered exosomes for trackable targeted therapy[J]. Bioconjug Chem, 2020, 31: 2541-2552. |
| [91] |
Witwer KW, Buzás EI, Bemis LT, et al. Standardization of sample collection, isolation and analysis methods in extracellular vesicle research[J]. J Extracell Vesicles, 2013, 2: 20360. |
| [92] |
Paganini C, Capasso Palmiero U, Pocsfalvi G, et al. Scalable production and isolation of extracellular vesicles: available sources and lessons from current industrial bioprocesses[J]. Biotechnol J, 2019, 14: 1800528. |
| [93] |
Rani S, Ryan AE, Griffin MD, et al. Mesenchymal stem cell-derived extracellular vesicles: toward cell-free therapeutic applications[J]. Mol Ther, 2015, 23: 812-823. |
| [94] |
Lu M, Huang Y. Bioinspired exosome-like therapeutics and delivery nanoplatforms[J]. Biomaterials, 2020, 242: 119925. |
| [95] |
Lu M, Zhao X, Xing H, et al. Liposome-chaperoned cell-free synthesis for the design of proteoliposomes: implications for therapeutic delivery[J]. Acta Biomater, 2018, 76: 1-20. |
 2022, Vol. 57
2022, Vol. 57


