2. 暨南大学药学院, 广东 广州 510632;
3. 广东省妇幼保健院, 广东 广州 511442
2. College of Pharmacy, Jinan University, Guangzhou 510632, China;
3. Guangdong Women and Children Hospital, Guangzhou 511442, China
疫苗是指用各类病原微生物及其代谢产物, 经过人工减毒、灭活或利用转基因等方法制成的用于预防接种的生物制品。疫苗保留了病原微生物刺激机体免疫系统的特性。当人体接种疫苗后, 免疫系统会产生相应免疫反应, 分化产生免疫细胞(如记忆T细胞和记忆B细胞) 和信号分子等。当人体再次接触同种抗原时, 机体通过免疫记忆效应, 触发免疫系统迅速增殖分化产生效应T细胞和效应B细胞, 从而快速清除抗原, 达到预防和治疗疾病的目的[1]。
疫苗接种是降低传染性疾病患病率和死亡率的有效方法。疫苗由于具有疗效确切、安全性高和成本较低的优势, 目前已成为人类抵御微生物感染最理想的“药物”。据世界卫生组织(World Health Organization, WHO) 报道, 疫苗的接种每年挽救了超过250万儿童的生命, 为人类健康做出了巨大的贡献[2]。当前新冠肺炎大流行除了物理隔绝外, 疫苗几乎成为唯一的医学防范方法。此外, 随着免疫治疗的兴起和对肿瘤发生发展机制的深入了解, 肿瘤疫苗凭借其特异性强、抗瘤谱广等优势而成为肿瘤免疫治疗的重要组成部分, 在临床上的应用也越来越广泛。
疫苗的接种效果与疫苗的成分(包括抗原与佐剂)、疫苗的剂型、接种部位及接种方式等密切相关。目前, 疫苗的接种方式主要包括肌肉注射和皮下接种两种: 肌肉注射主要借助注射器将疫苗注射在肌肉内, 这种方式适用于几乎所有类型的疫苗, 是一种直接、简单, 且应用广泛的接种途径; 皮下接种一般是利用注射器以45度角刺入皮肤并将疫苗注射到皮下脂肪组织, 适用于活疫苗的接种。然而, 通过注射接种疫苗的方式存在诸多问题: ①患者不能自行给药, 需要专业人员操作, 增加了医疗系统的负担; ②注射过程中引发的疼痛感大大降低了患者的顺应性, 也增加了一些血源性疾病的传播风险[3]; ③注射针头回收不可避免地带来医疗危害。因此, 亟需开发新型的疫苗接种技术, 以克服传统疫苗接种带来的问题。
皮肤作为人体一个重要的免疫器官, 主要由角质层、表皮、真皮、皮下组织和附属器等组成。其中, 表皮和真皮层分布有大量的免疫细胞, 主要包括表皮中的角质形成细胞和朗格汉斯细胞(Langerhans cells, LCs)、真皮中的树突细胞(dendritic cells, DCs)、T细胞和巨噬细胞等。LCs和DCs属于专职抗原提呈细胞(antigen-presenting cells, APCs), 能够捕获摄取抗原并将其呈递给T细胞识别, 从而启动多样性免疫应答过程[4]。
随着现代生物技术发展, 无针经皮免疫(needle-free transcutaneous immunization, NF-TCI) 接种技术逐渐成为研究热点。经皮免疫微针(microneedles, MNs) 是NF-TCI中发展较为迅速的一种疫苗递送系统(vaccine delivery system), 是由排列规整的微细针头矩阵和基底组成, 使用微针刺穿皮肤表皮层后可形成微米级的孔道, 药物可从孔道进入皮肤, 大大提高了药物经皮递送效率及生物利用度, 同时不会伤及真皮层内的神经和血管。微针用于递送疫苗时能够将疫苗有效地传递进入皮肤内部从而被APCs识别处理, 进而引发强烈体液免疫和细胞免疫过程[5]。近年来, 国内外围绕MNs经皮免疫研究日益增多, 并在动物实验和人体临床试验中取得了一定的进展和较好的效果。因此, 经皮免疫MNs作为一种高效的免疫接种新途径, 可代替传统的注射接种, 为疫苗接种提供了新思路。本文介绍了MNs用于经皮免疫的优势, 并针对MNs在NF-TCI技术中的发展背景、疫苗递送类型、影响因素、未来亟需解决的问题和发展方向等方面进行了综述和展望。
1 微针递送疫苗激活机体免疫应答的原理及优势微针定向突破皮肤角质层屏障, 将疫苗递送到皮下组织发挥免疫效应。首先, 微针刺入皮肤后将疫苗递送到表皮或真皮组织进而被抗原呈递细胞摄取; 然后, APCs将抗原呈递给T细胞启动机体的免疫应答, T细胞进一步激活B细胞, 使其转化为浆细胞并分泌出大量特异性抗体(图 1)。在这个阶段中, B细胞还会产生记忆B细胞, 当记忆B细胞再次接触相同抗原/病原体时会被激活, 并产生抗体来对抗病原体。
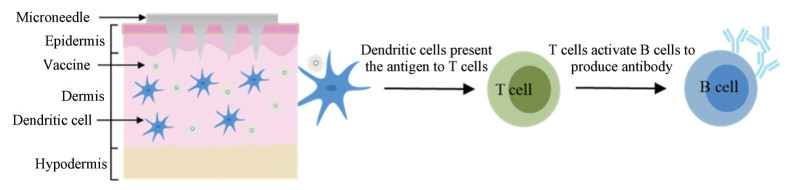
|
Figure 1 Schematic diagram of transcutaneous immunization mediated by microneedle vaccine |
与传统肌肉或皮下注射的疫苗接种方式相比, 经皮免疫MNs递送疫苗具有显著的优势: ①简单经济, MNs的给药方式类似创可贴, 患者可自行使用, 减少了对专业人员的需求, 人工成本降低; MNs经皮免疫大多以固态形式给药, 降低了运输储存过程中对低温冷链的要求, 减少了运输存储成本; ②便携性和患者顺应性高, MNs为微小的固体制剂, 便于运输和携带; 且由于微针的长度大多在25~1 000 μm, 使用时不会刺激真皮层的神经末梢和血管, 无明显痛感; ③免疫效果显著, 皮肤是人体最大的免疫器官, 含有多种免疫细胞, 经皮免疫MNs能够增加疫苗与免疫细胞的接触机率与时间, 提高免疫效果[6]; ④社会效益高, MNs减少了注射器的使用, 降低了资源的消耗和环境污染。此外, 由于MNs接种迅速高效, 能够大大提高接种速度, 建立群体免疫屏障。基于微针在疫苗递送方面的显著优势, 微针经皮免疫已成为生物医学领域的研究热点, 临床应用前景巨大。
2 微针递送疫苗的分类与应用目前微针已被用于递送多种疫苗, 如减毒活疫苗、灭活疫苗、DNA疫苗和亚单位疫苗等, 并表现出了良好经皮免疫效果, 在流感、结核病等传染性疾病及癌症疾病治疗方面发挥重要作用。
2.1 减毒活疫苗及其应用减毒活疫苗是致病特性已被去除或减弱的病原体, 一旦进入人体, 就会像正常病毒一样触发免疫反应, 但不会引起疾病的发生。由于减毒病原体与原始病原体具有相同的抗原, 因此当健康机体接种减毒活疫苗后会产生与自然感染病毒相当的免疫反应, 且不需要额外使用佐剂[7]。然而, 减毒活疫苗也有可能恢复原始毒力, 对于免疫力低下的群体可能造成致命的风险, 因此减毒活疫苗的处理和储存过程具有严格的要求。此外, 活病毒在8 ℃以上不稳定, 需要冷链保存, 这使得减毒活疫苗需要较高的成本投入, 因此开发一种能够在常温环境下保持病毒活力的减毒活疫苗制剂至关重要。
微针贴片可以使减毒活疫苗摆脱对冷链的依赖。用羧甲基纤维素和海藻糖制备登革热减毒活疫苗的涂层微针, 可显著提高登革热减毒活疫苗的稳定性, 使登革热病毒在室温下的生存能力成功地从数小时提高到数周, 并且在皮内接种后可达到与皮下注射接种疫苗相当的免疫效果, 能引发强烈中和抗体反应, 保护机体免受病毒攻击[8]。
将疫苗制备成冻干粉是保持疫苗稳定性的常用方法, 如卡介苗、水痘和甲型肝炎减毒活疫苗等。然而这种制剂在使用前需要专业人员将粉末溶解并在数小时内注射, 给疫苗使用带来诸多不便。为了避免这一过程, 用可溶性微针直接递送卡介苗粉末, 刺入皮肤后, 针尖溶解, 使卡介苗粉末暴露在皮肤组织间质液中, 粉末逐渐溶解并扩散, 产生的体液免疫和细胞免疫效果都与皮内免疫相当[9]。此外, 该产品在室温下贮藏2个多月后, 卡介苗存活率和微针机械强度均无明显变化。
2.2 灭活疫苗及其应用灭活病毒疫苗是通过在细胞系、组织或胚胎细胞等底物中培养病毒, 并通过化学、物理或辐射方法将其灭活, 破坏病毒在人体内复制的能力, 同时保留病毒结构中存在的所有抗原。通常灭活疫苗的免疫原性低于活病毒, 需要多次注射或与强效佐剂联合使用才能获得所需免疫力。此外, 灭活病毒疫苗不会恢复致病性, 比活疫苗更安全[10]。
由于表皮与真皮层中富含抗原呈递细胞, 相较传统的注射方式, 使用微针贴片递送灭活病毒具有明显的节省剂量和大大提高机体免疫应答潜能的优势。用壳聚糖微针对灭活的流感病毒进行包被和递送, 能够使抗原在皮肤中持续释放长达28天, 并且在小鼠中诱导流感病毒特异性IgG反应的效应显著高于肌肉注射, 从而显著提高疫苗诱导的体液免疫应答[11]。包裹灭活病毒疫苗的微针贴片进行经皮免疫可诱导更强的细胞免疫应答, 成功地刺激抗原特异性记忆B细胞应答, 为机体提供持久的保护作用。用灭活流感疫苗的微针贴片可以刺激局部皮肤早期的细胞因子如白细胞介素1β (interleukin-1β, IL-1β)、肿瘤坏死因子α (tumor necrosis factor-α, TNF-α)、粒细胞集落刺激因子(granulocyte colony-stimulating factor, G-CSF) 和中性粒细胞趋化因子1 (cytokine-induced neutrophil chemoattractant 1, CXCL-1) 等的表达水平提高, 而细胞因子对细胞免疫反应和持久的免疫保护至关重要[12]。
2.3 亚单位疫苗及其应用亚单位疫苗是通过提取病毒的特殊蛋白质结构, 筛选出具有免疫活性的片段制成的能诱发机体产生抗体的疫苗, 将其引入人体后能在不对受试者造成伤害的情况下触发所需的免疫反应。与灭活病毒疫苗类似, 亚单位疫苗的免疫原性低于活病毒, 因此安全性更高, 但需要多次注射才能达到所需的免疫应答水平。
最初, Weldon等[13]使用微针贴片递送流感亚单位疫苗, 并证实了微针可有效增强该疫苗的经皮免疫反应。微针皮内接种流感病毒的融合蛋白(这种融合蛋白由流感病毒的重复胞外区和鞭毛蛋白的Toll样受体5激动剂的结构域结合而成), 可提供针对流感病毒的广泛交叉保护作用[14]。涂在不锈钢微针上的H1N1流感亚单位疫苗在幼鼠身上可引发免疫反应, 产生的抗体效价高于肌内接种疫苗, 且可以增加滤泡辅助性T细胞的水平, 从而介导B细胞分化为抗体分泌细胞或记忆B细胞, 增强机体的免疫应答水平[15]。
针对目前在全球范围内流行的新型冠状肺炎病毒SARS-CoV-2, 研究者尝试使用微针递送新冠病毒疫苗来提高机体的免疫反应。Kim等[16]使用基于羧甲基纤维素的微针来递送SARS-CoV-2 S1亚单位疫苗, 引发了有效的抗原特异性抗体反应。Kuwentrai等[17]制备了透明质酸可溶性微针用于递送新冠病毒中含有免疫原性表位的核衣壳蛋白, 在小鼠模型中, 微针免疫相较皮下注射的对照组能够引起显著的B细胞抗体反应和基于干扰素-γ (interferon-γ, IFN-γ) 的T细胞反应。因此, 通过微针来递送亚单位疫苗是一种有效的建立群体免疫屏障和降低新型冠状病毒感染的策略。
2.4 DNA疫苗及其应用DNA疫苗是编码某种蛋白质抗原的重组真核质粒表达载体, 被注射到体内后, 进入细胞的质粒进行基因转录和产生抗原蛋白, 激活机体产生特异性的体液免疫和细胞免疫[10]。由于抗原编码的DNA能够直接在宿主细胞内合成表达, 因此DNA疫苗诱导的免疫与病原体自然感染产生的免疫应答极为相似。与传统疫苗相比, DNA疫苗具有稳定性好、易于制备和在小动物中诱导抗原特异性免疫反应等优点, 但DNA疫苗在非人灵长类动物和人类中的免疫原性较差[18]。
DNA疫苗的转染能力差被认为是产生免疫力低下的最关键原因之一, 而通过微针贴片递送DNA, 可以促进T细胞和体液免疫应答, 因此微针经皮接种是提高DNA疫苗免疫应答效应的一种有效方式。Mikszta等[19]早在2002年就利用微针将裸质粒DNA导入皮肤, 即通过将微针阵列浸入DNA溶液中, 并在小鼠皮肤上多次按压, 使用微针的方法与局部注射相比, 编码萤火虫荧光素酶的质粒DNA的表达增加了2 800倍。此外, 采用微针递送编码乙肝表面抗原的质粒DNA时, 微针给药诱导的免疫反应比皮下注射更强, 可通过更少的免疫次数来达到所需的血清抗体滴度。
基于微针的DNA疫苗一直是近年来的研究热点之一, 如表 1[20-24]所示。目前, DNA疫苗已被用于治疗多种传染性疾病及肿瘤。微针接种DNA疫苗具有操作简便、无痛、免疫反应强和易于大规模生产等优点, 尤其适用于流感、埃博拉和寨卡病毒等引起的感染性疾病。
| Table 1 Recent researches on the use of microneedles (MNs) to deliver DNA vaccines. pDNA: Plasmid deoxyribonucleic acid; PSCA: Prostate stem cell antigen; PVA: Polyvinyl alcohol; PLGA: Polylactic-co-glycolic acid; PLL: Poly-L-lysine; γ-PGA: Poly-γ-glutamic acid; PEI: Polyetherimide |
疫苗微针虽能够激活机体免疫应答反应, 但仅装载抗原的疫苗微针刺激机体产生的免疫应答往往有限, 因此, 为了增强疫苗微针的免疫效果, 研究者们从多方面提出了以下几类辅助措施: ①调整微针物理参数(针尖长度、形状, 阵列面积、密度等); ②抗原与佐剂共递送; ③联合纳米给药系统; ④联合使用物理促渗技术。
3.1 改变微针结构用于递送疫苗的微针阵列具有多种几何形状和排列方式, 针头的几何形状以及长度、密度, 微针贴片的表面积等参数不仅决定了载药量, 还影响微针的应力分布、机械性能和皮肤穿刺能力, 最终影响到疫苗的递送效率[25]。研究表明, 增大针的宽度、针尖长度和微针阵列密度可以提高药物的经皮渗透量, 这主要是由于其可以增加刺破皮肤后所形成孔道的尺寸、深度和密集度, 从而促进更多药物通过皮肤孔道渗透进入皮肤。然而, 微针阵列的密度也不能过大, 以防产生“钉床”效应(各个微孔道相互挤压而使孔道直径变小的现象)[26]。因此, 通过优化微针阵列的几何形状, 可以增加疫苗微针诱导机体免疫反应的效力, 如Römgens等[27]成功开发了一个计算模型来描述微针阵列递送后抗原在皮肤中的扩散及其动力学, 以优化微针的最佳几何参数和排列方式, 从而能够提高微针疫苗对抗原呈递细胞的激活和诱导机体免疫反应的能力。
3.2 添加佐剂佐剂是与抗原同时或预先注射入机体时, 可增强机体对抗原的免疫应答或改变免疫应答类型的非特异性免疫增强剂。将佐剂和疫苗进行共递送, 是目前常用的提高疫苗免疫应答的方法[28]。佐剂的种类有很多, 例如氢氧化铝佐剂、短小棒状杆菌、脂多糖、细胞因子、明矾、多肽和纳米粒等。目前用于疫苗微针的佐剂主要是一些分子免疫调节剂, 如CpG、poly(I: C)、单磷酸基脂质A和咪喹莫特等[29]。通常, 除减毒活疫苗不需使用佐剂外, 在微针疫苗中加入佐剂, 可以显著提高机体的免疫反应。已有研究表明在微针疫苗中添加佐剂能够有效提高灭活病毒疫苗[30]、亚单位疫苗[31]及DNA疫苗[32]等的免疫效应。
3.3 与纳米技术结合大量研究表明纳米技术是一种有效提高疫苗免疫效应的方法, 因此通过微针与纳米技术结合, 有望从多途径提高疫苗免疫应答效应: ①将抗原包裹在纳米粒中以提高疫苗在微针中的稳定性、经皮递送效率和皮肤滞留性, 同时降低抗原在皮肤中的降解和增强抗原呈递细胞对抗原的摄取能力, 进而提高机体的免疫应答; ②纳米粒充当抗原载体, 并可作为佐剂引发自身固有的免疫刺激特性, 与疫苗发挥协同的免疫应答效应。Tamayo等[33]的一项研究表明, 聚(酸酐) 纳米粒可以在免疫治疗中充当活性Th1佐剂, 发挥Toll样受体的激动剂功能, 触发Th1型细胞因子的释放。此外, 纳米粒的理化性能, 如粒径、电位、形状和表面亲疏水性等, 与其产生的免疫效应密切相关[34]。因此, 通过调节微针疫苗中的纳米粒的理化性能, 使机体产生所需的免疫反应, 达到更好的免疫效果。
3.4 与物理促渗方法结合将微针与其他物理经皮促渗方法相结合, 已被证实是一种有效提高药物经皮递送效率, 改善药物分布和增加药物的经皮吸收的方法。目前已有研究将微针与超声导入[35]、电穿孔[36]和离子电渗技术[37]等方法相结合用于药物经皮递送, 其中超声导入是通过空化作用影响皮肤毛孔大小, 增加皮肤渗透性; 电穿孔可以在角质层屏障的脂质区产生微小、短暂的水通道, 短时间(毫秒级) 内即可增强药物在皮肤的渗透; 而离子电渗技术利用低强度直流电场促进带电荷的药物成分穿过组织屏障进入体内, 从而达到提高药物经皮渗透能力的效果。Petchsangsai等[38]用微针联合超声导入和电穿孔等物理方法, 使得生物大分子荧光素异硫氰酸右旋糖酐的经皮渗透能力较单一促透方式提高约100倍。疫苗多为亲水性的生物大分子物质, 其皮肤渗透性和经皮吸收速率往往较差, 因此将微针与其他物理促渗方法结合使用, 有望成为提高微针疫苗的经皮递送效率和免疫应答的有效方法。
4 问题与展望疫苗微针贴片的临床前研究已涉及从啮齿类动物到灵长类动物的各种动物模型, 并且对不同种类的疫苗免疫效应进行了评价。疫苗微针与传统的肌肉注射或皮下注射接种途径相比, 显示出了相当或更好的免疫反应。然而, 疫苗微针面临的最大挑战是如何将研究转化为可改善患者预后的新型医疗产品。
微针的机械性能是限制微针疫苗临床转化的重要因素之一。足够强度的机械性能是微针顺利刺破皮肤进行疫苗递送, 发挥经皮免疫的关键。然而, 皮肤的状态(皮肤的水合、厚度和硬度等) 受到多种因素的影响, 如种属、年龄、性别、病理状况和皮肤部位等, 使得微针的经皮递送效率稳定性难以保证。因此, 需要对微针进行合理的设计, 使其具有足够的机械强度, 能够在不同皮肤状态的个体中进行疫苗的有效递送。此外, 迄今为止, 微针疫苗的体内经皮递送效率和经皮免疫效果的研究还局限在小鼠、大鼠和兔等小动物身上; 而这些动物皮肤的生理学和解剖学等性质异于人体皮肤, 因此疫苗微针亟需在人类受试者中进行进一步的临床研究, 为其临床转化提供必要的实验支持和理论依据。
微针的工业化生产是微针疫苗临床转化和未来商业化的主要限速步骤。目前, 微针疫苗的制备方法主要包括微成型法、光聚合法、拉延法、微滴吹制法和3D打印法等[39]。其中, 微成型法由于制备条件温和而被广泛应用, 其通过将聚合物溶液灌注入模具内并固化成型, 这一过程通常需要离心或抽真空来排除溶液中气泡, 随后再将溶液填充至微孔中, 但该方法只适用于实验室的小规模制备。为了提高离心法的工业化生产效率, Chen等[40]开发了一种双渗透阴模(double-penetration female mold, DPFM) 结合正压微灌注技术(positive-pressure microperfusion technique, PPPT), 有效避免了微针中的气泡或空腔残留(图 2), 并在此基础上设计了一种微针自动化生产设备。在贴剂生产线的基础上采用“涂布式”生产工艺, 开发了一种自动微灌注设备, 以简单且可重复的操作连续生产微针, 该设备每批次可生产126片微针阵列、机械化程度高且产业化集成容易。这种基于PPPT和DPFM的微针自动化生产设备有望以可控、高效、可扩展的方式实现微针从实验室研究到规模化制造的转变。
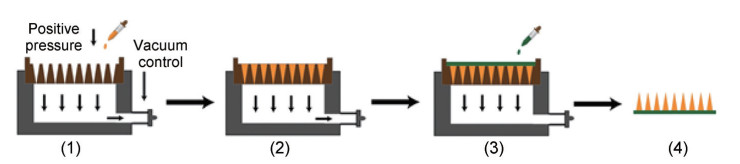
|
Figure 2 Schematic illustration of microneedle preparation based on double-penetration female mold (DPFM) and positive-pressure microperfusion technique (PPPT) technology. 1: Add tip solution; 2: Remove excess tip solution; 3: Add base solution; 4: Peel off from the female mold after drying |
为了扩大生产规模, 在生产过程中应尽量减少生产步骤, 最大限度地减少不同设备之间的转移, 创造无菌制造或终端灭菌的生产条件。此外, 质量控制检测、制造方法的一致性和安全性、包装材料的特性等也是需要考虑的问题, 以建立统一的生产规范和质量评价标准, 这对于微针产品的最终商业化是必不可少的。
疫苗微针质量标准体系的缺乏是限制其临床转化的另一个关键因素[41]。疫苗微针的关注点是剂量均匀性、合理的成本、大规模生产和良好的生产规范(good manufacture practice of medical products, GMP)[42]。供人体使用的疫苗要求无菌且不含热原, 目前市面上大多数疫苗使用过滤法除菌消毒, 然而由于微针的固态形式, 无法利用过滤除菌的方式消毒, 辐射消毒则可能会使疫苗失去抗原性。因此, 疫苗微针的制备可能需要在无菌条件下制备, 这大大增加了疫苗微针的生产成本。从监管的角度来看, 美国食品和药物管理局(Food and Drug Administration, FDA) 的最新文件中, 疫苗微针属于生物产品和机械设备的组合产品[42]。因此, 对于疫苗微针的监管应考虑其每个组成部分和整个产品相关的安全性和有效性问题。此外, 疫苗微针还应满足当前GMP和上市后从实验室到临床使用过渡的安全性要求。总之, 微针疫苗的转化不仅需要大量的科学研究和工艺设计, 还需要开发有效的药品质量生产和监管体系, 建立良好的生产规范和质量风险管理制度。
微针疫苗介导的经皮免疫在传染病的防治和肿瘤等重大疾病的治疗中发挥着重要作用, 且较传统注射接种疫苗的方式具有显著优势, 临床应用前景巨大。尽管当前微针疫苗从研究到临床转化还存在工业化生产难度大和质量标准体系缺乏等问题, 但在过去的几年间得到了不断的改良和创新, 涌现了一批具有显著临床应用前景的产品, 显示了微针疫苗未来广阔的应用前景。相信在研究人员、制造商和有关部门的共同努力下, 能够尽快突破微针疫苗的应用瓶颈, 并推动微针疫苗在更多医疗领域的应用, 造福人类健康。
作者贡献: 陈杨燕是综述的主要撰写人, 完成相关文献资料的收集、分析及论文初稿的写作; 黄瑶、胡婉姗和杜敏群参与文献资料的分析和整理; 彭婷婷、潘昕和吴传斌是项目的构思者及负责人, 指导论文写作和修改。
利益冲突: 所有作者声明本文不存在任何利益冲突。
| [1] |
Vetter V, Denizer G, Friedland LR, et al. Understanding modern-day vaccines: what you need to know[J]. Ann Med, 2018, 50: 110-120. DOI:10.1080/07853890.2017.1407035 |
| [2] |
Al-Zahrani S, Zaric M, Mccrudden C, et al. Microneedle-mediated vaccine delivery: harnessing cutaneous immunobiology to improve efficacy[J]. Expert Opin Drug Deliv, 2012, 9: 541-550. DOI:10.1517/17425247.2012.676038 |
| [3] |
Hossain MK, Ahmed T, Bhusal P, et al. Microneedle systems for vaccine delivery: the story so far[J]. Expert Rev Vaccines, 2020, 19: 1153-1166. DOI:10.1080/14760584.2020.1874928 |
| [4] |
Pielenhofer J, Sohl J, Windbergs M, et al. Current progress in particle-based systems for transdermal vaccine delivery[J]. Front Immunol, 2020, 11: 266. DOI:10.3389/fimmu.2020.00266 |
| [5] |
Rodgers AM, Cordeiro AS, Kissenpfennig A, et al. Microneedle arrays for vaccine delivery: the possibilities, challenges and use of nanoparticles as a combinatorial approach for enhanced vaccine immunogenicity[J]. Expert Opin Drug Deliv, 2018, 15: 851-867. DOI:10.1080/17425247.2018.1505860 |
| [6] |
D'amico C, Fontana F, Cheng R, et al. Development of vaccine formulations: past, present, and future[J]. Drug Deliv Transl Res, 2021, 11: 353-372. DOI:10.1007/s13346-021-00924-7 |
| [7] |
Lauring AS, Jones JO, Andino R. Rationalizing the development of live attenuated virus vaccines[J]. Nat Biotechnol, 2010, 28: 573-579. DOI:10.1038/nbt.1635 |
| [8] |
Turvey ME, Uppu D, Mohamed Sharif AR, et al. Microneedle-based intradermal delivery of stabilized dengue virus[J]. BioengTransl Med, 2019, 4: e10127. |
| [9] |
Chen F, Yan Q, Yu Y, et al. BCG vaccine powder-laden and dissolvable microneedle arrays for lesion-free vaccination[J]. J Control Release, 2017, 255: 36-44. DOI:10.1016/j.jconrel.2017.03.397 |
| [10] |
Shin CI, Jeong SD, Rejinold NS, et al. Microneedles for vaccine delivery: challenges and future perspectives[J]. Ther Deliv, 2017, 8: 447-460. DOI:10.4155/tde-2017-0032 |
| [11] |
Chen YH, Lai KY, Chiu YH, et al. Implantable microneedles with an immune-boosting function for effective intradermal influenza vaccination[J]. Acta Biomater, 2019, 97: 230-238. DOI:10.1016/j.actbio.2019.07.048 |
| [12] |
del Pilar Martin M, Weldon WC, Zarnitsyn VG, et al. Local response to microneedle-based influenza immunization in the skin[J]. mBio, 2012, 3: e00012-12. |
| [13] |
Weldon WC, Martin MP, Zarnitsyn V, et al. Microneedle vaccination with stabilized recombinant influenza virus hemagglutinin induces improved protective immunity[J]. Clin Vaccine Immunol, 2011, 18: 647-654. DOI:10.1128/CVI.00435-10 |
| [14] |
Wang BZ, Gill HS, He C, et al. Microneedle delivery of an M2e-TLR5 ligand fusion protein to skin confers broadly cross-protective influenza immunity[J]. J Control Release, 2014, 178: 1-7. DOI:10.1016/j.jconrel.2014.01.002 |
| [15] |
Koutsonanos DG, Esser ES, Mcmaster SR, et al. Enhanced immune responses by skin vaccination with influenza subunit vaccine in young hosts[J]. Vaccine, 2015, 33: 4675-4682. DOI:10.1016/j.vaccine.2015.01.086 |
| [16] |
Kim E, Erdos G, Huang S, et al. Microneedle array delivered recombinant coronavirus vaccines: immunogenicity and rapid translational development[J]. EBioMedicine, 2020, 55: 102743. DOI:10.1016/j.ebiom.2020.102743 |
| [17] |
Kuwentrai C, Yu J, Zhang BZ, et al. Induction of humoral and cellular immunity by intradermal delivery of SARS-CoV-2 nucleocapsid protein using dissolvable microneedles[J]. J Immunol Res, 2021, 2021: 5531220. |
| [18] |
Li J, Zeng M, Shan H, et al. Microneedle patches as drug and vaccine delivery platform[J]. Curr Med Chem, 2017, 24: 2413-2422. |
| [19] |
Mikszta JA, Alarcon JB, Brittingham JM, et al. Improved genetic immunization via micromechanical disruption of skin-barrier function and targeted epidermal delivery[J]. Nat Med, 2002, 8: 415-419. DOI:10.1038/nm0402-415 |
| [20] |
Cole G, Ali AA, Mcerlean E, et al. DNA vaccination via RALA nanoparticles in a microneedle delivery system induces a potent immune response against the endogenous prostate cancer stem cell antigen[J]. Acta Biomater, 2019, 96: 480-490. DOI:10.1016/j.actbio.2019.07.003 |
| [21] |
Yan Q, Cheng Z, Liu H, et al. Enhancement of Ag85B DNA vaccine immunogenicity against tuberculosis by dissolving microneedles in mice[J]. Vaccine, 2018, 36: 4471-4476. DOI:10.1016/j.vaccine.2018.06.025 |
| [22] |
Cole G, Ali AA, Mccrudden CM, et al. DNA vaccination for cervical cancer: strategic optimisation of RALA mediated gene delivery from a biodegradable microneedle system[J]. Eur J Pharm Biopharm, 2018, 127: 288-297. DOI:10.1016/j.ejpb.2018.02.029 |
| [23] |
Yang HW, Ye L, Guo XD, et al. Ebola vaccination using a DNA vaccine coated on PLGA-PLL/γPGA nanoparticles administered using a microneedle patch[J]. Adv Healthc Mater, 2017, 6: 1600750. DOI:10.1002/adhm.201600750 |
| [24] |
Seok H, Noh JY, Lee DY, et al. Effective humoral immune response from a H1N1 DNA vaccine delivered to the skin by microneedles coated with PLGA-based cationic nanoparticles[J]. J Control Release, 2017, 265: 66-74. DOI:10.1016/j.jconrel.2017.04.027 |
| [25] |
Li Y, Hu X, Dong Z, et al. Dissolving microneedle arrays with optimized needle geometry for transcutaneous immunization[J]. Eur J Pharm Sci, 2020, 151: 105361. DOI:10.1016/j.ejps.2020.105361 |
| [26] |
Makvandi P, Kirkby M, Hutton ARJ, et al. Engineering microneedle patches for improved penetration: analysis, skin models and factors affecting needle insertion[J]. Nano Micro Lett, 2021, 13: 93. DOI:10.1007/s40820-021-00611-9 |
| [27] |
Römgens AM, Bader DL, Bouwstra JA, et al. Predicting the optimal geometry of microneedles and their array for dermal vaccination using a computational model[J]. Comp Methods Biomech Biomed Engin, 2016, 19: 1599-1609. DOI:10.1080/10255842.2016.1173684 |
| [28] |
Di Pasquale A, Preiss S, Tavares Da Silva F, et al. Vaccine adjuvants: from 1920 to 2015 and Beyond[J]. Vaccines (Basel), 2015, 3: 320-343. DOI:10.3390/vaccines3020320 |
| [29] |
Leone M, Mönkäre J, Bouwstra JA, et al. Dissolving microneedle patches for dermal vaccination[J]. Pharm Res, 2017, 34: 2223-2240. DOI:10.1007/s11095-017-2223-2 |
| [30] |
Park S, Lee Y, Kwon YM, et al. Vaccination by microneedle patch with inactivated respiratory syncytial virus and monophosphoryl lipid A enhances the protective efficacy and diminishes inflammatory disease after challenge[J]. PLoS One, 2018, 13: e0205071. DOI:10.1371/journal.pone.0205071 |
| [31] |
Weldon WC, Zarnitsyn VG, Esser ES, et al. Effect of adjuvants on responses to skin immunization by microneedles coated with influenza subunit vaccine[J]. PLoS One, 2012, 7: e41501. DOI:10.1371/journal.pone.0041501 |
| [32] |
Qiu Y, Guo L, Zhang S, et al. DNA-based vaccination against hepatitis B virus using dissolving microneedle arrays adjuvanted by cationic liposomes and CpG ODN[J]. Drug Deliv, 2016, 23: 2391-2398. DOI:10.3109/10717544.2014.992497 |
| [33] |
Tamayo I, Irache JM, Mansilla C, et al. Poly(anhydride) nanoparticles act as active Th1 adjuvants through Toll-like receptor exploitation[J]. Clin Vaccine Immunol, 2010, 17: 1356-1362. DOI:10.1128/CVI.00164-10 |
| [34] |
Jacobson RM, Swan A, Adegbenro A, et al. Making vaccines more acceptable-methods to prevent and minimize pain and other common adverse events associated with vaccines[J]. Vaccine, 2001, 19: 2418-2427. DOI:10.1016/S0264-410X(00)00466-7 |
| [35] |
Han T, Das DB. Permeability enhancement for transdermal delivery of large molecule using low-frequency sonophoresis combined with microneedles[J]. J Pharm Sci, 2013, 102: 3614-3622. DOI:10.1002/jps.23662 |
| [36] |
Yan K, Todo H, Sugibayashi K. Transdermal drug delivery by in-skin electroporation using a microneedle array[J]. Int J Pharm, 2010, 397: 77-83. DOI:10.1016/j.ijpharm.2010.06.052 |
| [37] |
Wu XM, Todo H, Sugibayashi K. Enhancement of skin permeation of high molecular compounds by a combination of microneedle pretreatment and iontophoresis[J]. J Control Release, 2007, 118: 189-195. DOI:10.1016/j.jconrel.2006.12.017 |
| [38] |
Petchsangsai M, Rojanarata T, Opanasopit P, et al. The combination of microneedles with electroporation and sonophoresis to enhance hydrophilic macromolecule skin penetration[J]. Biol Pharm Bull, 2014, 37: 1373-1382. DOI:10.1248/bpb.b14-00321 |
| [39] |
Zhang L, Guo R, Wang S, et al. Fabrication, evaluation and applications of dissolving microneedles[J]. Int J Pharm, 2021, 604: 120749. DOI:10.1016/j.ijpharm.2021.120749 |
| [40] |
Chen H, Wu B, Zhang M, et al. A novel scalable fabrication process for the production of dissolving microneedle arrays[J]. Drug Deliv Transl Res, 2019, 9: 240-248. DOI:10.1007/s13346-018-00593-z |
| [41] |
Li RR, Wang Y, Liu Z, et al. Influencing factors and evaluation methods of skin microchannels formation and closure after microneedles application[J]. Acta Pharm Sin (药学学报), 2021, 56: 1293-1300. |
| [42] |
Nguyen TT, Oh Y, Kim Y, et al. Progress in microneedle array patch (MAP) for vaccine delivery[J]. Hum Vaccin Immunother, 2021, 17: 316-327. DOI:10.1080/21645515.2020.1767997 |
 2022, Vol. 57
2022, Vol. 57


