T细胞浸润与肿瘤预后紧密相关, 嵌合抗原受体T细胞(chimeric antigen receptor T cell, CAR-T) 疗法在血液型肿瘤的治疗中取得了突破性进展, 激起了肿瘤免疫治疗研究的新热潮[1]。自然杀伤(natural killer, NK) 细胞是固有免疫系统中对肿瘤细胞起到直接杀伤作用的重要组成成分, 与T细胞不同的是, NK细胞的杀伤不需要依赖抗原呈递细胞(antigen-presenting cells, APCs) 的刺激[2]。此外, NK细胞可产生细胞因子和趋化因子募集树突状细胞(dendritic cells, DCs), 并促进DCs的成熟, 增强适应性免疫反应应答。研究发现, 原位肿瘤的NK细胞浸润可有效抑制肿瘤生长, 高转移性器官的NK细胞浸润可有效维持肿瘤细胞休眠, 抑制肿瘤转移[3]。这些特性使NK细胞疗法成为目前肿瘤免疫治疗研究的新方向。
纳米给药系统在体内具有独有的减毒增效特性和高度的设计灵活性, 正逐渐成为新一代研究的药物递送系统[4]。然而, 有限的靶向效率、网状内皮系统的快速清除造成纳米给药系统的有效性和安全性下降[5]。表面修饰抗体、配体可提高纳米粒病灶部位靶向效率; 工程化修饰纳米粒可以改善纳米粒的体内分布, 如聚乙二醇化(polyethylene glycolated, PEGylated) 修饰可延长其体内血液循环时间[6]。但重复长期给药PEG化修饰的纳米粒会加速清除且诱导较强的体系免疫反应[7]。如何有效提高纳米给药系统的靶向效率、延长其血液循环时间是亟待解决的问题之一。
NK细胞具备独特的炎症趋向性, 可响应肿瘤微环境释放的细胞因子、趋化因子迁徙至肿瘤部位, 在肿瘤靶向治疗中体现出独特的优势[8]。NK细胞载体和NK细胞膜包被仿生化纳米载体、NK细胞外囊泡(NK cell extracellular vesicles, NKEVs) 等用于肿瘤靶向治疗, 相较于传统药物递送系统, 可减少单核吞噬细胞系统(mononuclear phagocyte system, MPS) 清除, 延长药物递送系统的血液循环, 靶向肿瘤部位发挥疗效[9-11]。本综述重点介绍NK细胞的抗肿瘤机制, 概述NK细胞肿瘤靶向治疗应用的研究进展。
1 NK细胞概述NK细胞是固有免疫的组成部分, 起着抗菌、抗病毒的重要作用, 同时越来越多研究发现NK细胞在肿瘤免疫监视有着显著意义。约20%成熟的NK细胞存在于外周血液循环, 占外周血单核细胞5%~10%的比例, 每2周更新1次[12]。大部分未成熟的NK细胞约80%滞留在肝脏、肾和淋巴组织[13]。
NK细胞来源于骨髓的CD34+造血干细胞和造血祖细胞。白介素(interleukins, IL-s) 如IL-3、IL-7和IL-15, 以及配体如Fms样酪氨酸激酶3-配体(Fms-like tyrosine kinase 3 ligand, FLT3L) 和kit配体(kit ligand, KL) 等, 诱导淋巴祖细胞分化为前NK细胞[14]。前NK细胞随后分化成高表达CD56的未成熟CD56bright NK细胞, CD56bright NK细胞的细胞毒性弱而增殖能力强, 与活化的DCs有较强相互作用[15]。当获得CD16和杀伤细胞抑制性受体(killer inhibitory receptor, KIR) 的表达而失去CD25和CD117时, 分化为CD56表达较低、细胞毒性较强的成熟CD56dim NK细胞[14]。而鼠源NK细胞可根据表面CD11b与CD27的表达, 区分成CD11blowCD27low、CD11blowCD27high、CD11bhighCD27high与CD11bhighCD27low 4大类, 鼠源的NK细胞成熟发育呈现4阶段CD11blowCD27low→CD11blowCD27high→ CD11bhighCD27high→CD11bhighCD27low, CD11b的高表达与CD27的低表达是鼠源NK细胞成熟的主要表现[8]。
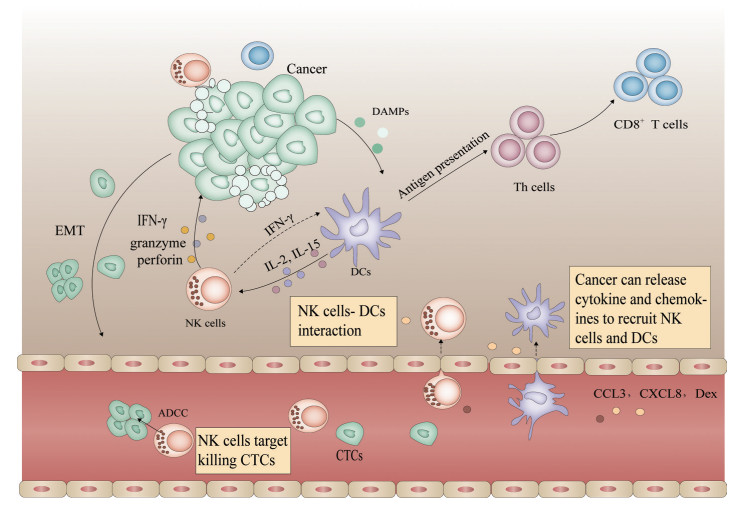
2 NK细胞的抗肿瘤作用NK细胞是固有免疫的重要组成部分, NK细胞的抗肿瘤作用不仅体现在对肿瘤细胞的杀伤, 且与肿瘤微环境中的DCs等免疫细胞存在关联, 可强化适应性免疫应答[16]。此外, NK细胞可靶向杀伤肿瘤干细胞(cancer stem cells, CSCs), 在抗肿瘤转移中发挥重要作用。NK细胞的抗肿瘤作用是利用NK细胞靶向治疗肿瘤的重要依据。NK细胞的抗肿瘤机制见图 1。
|
Figure 1 Schematic diagram of the antitumor mechanism of natural killer (NK) cells. The cytokines and chemokines such as chemokine (C-C motif) ligand 3-like 3 (CCL3) and C-X-C motif chemokine ligand 8 (CXCL8) released from cancer recruit immune cells such as NK cells and dendritic cells (DCs). NK cells can activate by ADCC effect and STING mechanism, kill cancer cells with granzyme and perforin or Fas/FasL. Dying cancer cells release damage associated molecular patterns (DAMPs), inducing DCs to phagocytose cancer antigen and present it to T cells, thus activating adaptive immune response. DCs can release interleukin-2 (IL-2) and IL-15, which can stimulate NK cells proliferation and enhance cytotoxicity. Moreover, IFN-γ released by NK cells can stimulate the maturation of DCs. In addition, when EMT process occurs in cancer, NK cells circulating in the blood can kill CTCs and inhibit tumor metastasis. ADCC: Antibody-dependent cellular cytotoxicity; STING: Stimulator of interferon genes; EMT: Epithelial-mesenchymal transition; IFN: Interferon; CTCs: Circulating tumor cells; Dex: DC-derived exosomes; Fas: Factor associated suicide |
NK细胞可直接杀伤肿瘤细胞。NK细胞通过表面抑制性受体与激活受体的协同作用, 活化并识别靶细胞后, 与靶细胞之间建立突触, 用于传递颗粒酶与穿孔素, 穿孔素可插入靶细胞的质膜并形成导致渗透溶解的孔洞, 颗粒酶可通过穿孔素形成的孔转移并激活胱天蛋白酶, 导致靶细胞凋亡[17]。
NK细胞由表面CD16受体介导活化, CD16受体与免疫球蛋白的恒定区结合后, 可诱导NK细胞中高亲和力IgE受体与CD3ζ的免疫受体酪氨酸激活基序(tyrosine activation motif of immune receptor, ITAM) 结构域磷酸化, 启动信号级联, 最终导致抗体包被细胞的杀伤, 这种杀伤机制称为抗体依赖性细胞毒性(antibody-dependent cellular cytotoxicity, ADCC) 效应[18]。NK细胞的直接杀伤也可以通过Fas配体(Fas ligand, FasL) 和肿瘤坏死因子相关凋亡诱导配体(TNF-related apoptosis-inducing ligand, TRAIL) 来实现[19]。
2.2 NK细胞与DCs产生信号交联, 增强适应性免疫应答固有免疫与特异性免疫在抗肿瘤免疫中都起着重要作用, 而NK细胞与DCs在固有免疫与特异性免疫应答中都承担着重要作用。NK细胞可通过颗粒酶、穿孔素等对肿瘤细胞进行直接杀伤。DCs是主要的专职抗原呈递细胞之一, 在不成熟的状态下, 拥有较强的吞噬能力。吞噬抗原后, 在细胞因子的刺激下成熟, 表达CD80/86/40等共刺激分子, 将抗原呈递给T细胞, 激活下游特异性免疫应答[20]。
肿瘤及其他炎症部位释放出炎性因子[干扰素-γ (interferon-γ, IFN-γ)] 和CX3C趋化因子配体(CX3C chemokine ligand 1, CX3CL1) 等, 刺激外周循环中的NK细胞和DCs活化, 高表达整合素黏附在血管内皮细胞表面, 通过爬行或变形进入病灶部位[21]。NK细胞、DCs进入肿瘤部位会发生一系列的信号交联, 这些信号交联促进NK细胞增殖和毒性增强, 同时也能促进DCs成熟, 建立更有效全面的固有免疫-特异性免疫应答网络, 抑制肿瘤细胞的生长。基于此, NK细胞与DCs之间的信号被广泛研究, 两者之间的交互作用主要通过细胞因子、外泌体和免疫突触等实现[22, 23]。
在肿瘤部位, NK细胞杀伤易感的肿瘤细胞, 释放出肿瘤细胞内容物、损伤相关分子模式(damage associated molecular patterns, DAMPs), 如热休克蛋白(heat shock proteins, HSPs)、高迁移率组蛋白1 (high mobility group box protein1, HMGB-1)、腺嘌呤核苷三磷酸(adenosine-triphosphate, ATP) 和钙网蛋白(calreticulin, CRT) 等, 这些分子信号可进一步促进DCs的募集和成熟。同时, 不成熟的DCs (immature dendritic cells, iDCs) 在吞噬坏死细胞释放出的内容物后活化, 释放IL-2和IL-15等细胞因子, 这些细胞因子与NK细胞的相互作用促进NK细胞的进一步分化、增殖[23, 24]。DCs释放的IL-2和IL-15上调NK细胞的细胞毒性并促进其分泌IFN-γ, 而释放的CCL3和CXCL8可促进血液循环中的NK细胞募集到肿瘤部位。
除细胞因子和趋化因子外, 研究发现DCs衍生的外泌体(DC-derived exosomes, Dex) 可活化NK细胞[25]。Dex中的肿瘤坏死因子(tumor necrosis factor, TNF) 与NK细胞表面的TNF受体结合, 可促进NK细胞分泌IFN-γ。利用Dex做肿瘤疫苗的I期临床试验发现, 一半患者体内的NK细胞数目增多, 而T细胞免疫反应缺失[26]。Viaud等[27]研究发现, Dex可促进NK细胞表面表达IL15Rα或NKG2D, 刺激NK细胞的增殖与活化, 并产生一定的抗肿瘤疗效。
当炎症应激过强时, NK细胞可杀伤iDCs维持免疫平衡, 抑制iDCs下游的信号级联反应, 下调免疫应答[28]。肿瘤组织免疫抑制微环境不仅可下调NK细胞与DCs的信号交联, 且可进一步促进NK细胞杀伤DCs抑制免疫反应。肿瘤组织中高表达环氧合酶-2 (cyclooxygenase-2, COX-2) 可促进前列腺素E2 (prostaglandin E2, PGE2) 的合成, PGE2可刺激吲哚胺2, 3-双加氧酶(indoleamine-2, 3-dioxygenase, IDO) 高表达, 消耗色氨酸产生过量犬尿氨酸, 导致未成熟的CD4+ T细胞分化为调节性T细胞[29]。Van Elssen等[30]研究发现, PGE2在体外可抑制NK-DCs的信号交联, PGE2抑制DCs成熟过程中CCL5、CCL19、CXCL10等趋化因子与IL-12、IL-18等细胞因子的产生, 不仅导致NK细胞毒性下降、IFN-γ合成减少, 且抑制NK细胞的募集。
2.3 NK细胞抑制肿瘤转移恶性肿瘤细胞迁徙到远端器官组织, 是肿瘤引起死亡的首要因素。而恶性细胞转移不仅与细胞内部的诱因相关, 与肿瘤转移前微环境中的变化也密切相关, 例如肿瘤微环境塑造的免疫抑制微环境, 可防止恶性肿瘤细胞在迁徙过程中被免疫细胞识别杀伤[13]。研究发现, NK细胞、DCs和T细胞分布于肾细胞癌与结直肠癌的肺转移灶中, 且NK细胞的浸润密度与肾细胞癌患者的生存期相关, 在转移灶中NK细胞数量增多, 可延长肾细胞癌患者的生存期[31]。Lin等[32]利用基因编辑的沙门氏菌YB1, 可明显抑制肿瘤转移, 研究发现在免疫缺陷的裸鼠(缺少胸腺, 无T细胞免疫, 但NK细胞、B细胞仍存在) 中也能起到抗转移的效果。该效果与沙门氏菌YB1促进IFN-γ的合成、募集更多NK细胞密切相关。NK细胞在抑制肿瘤转移中起着重要作用。
2.3.1 NK细胞具有CSCs靶向性CSCs是细胞干性强且处于休眠状态的肿瘤细胞, 被认为是肿瘤发生、复发和转移的因素之一[14]。靶向CSCs以抑制肿瘤生长、转移、复发是治疗肿瘤的另一策略与途径[33]。
研究发现, NK细胞具有靶向CSCs、清除CSCs的能力, 可在血液中有效杀伤CSCs, 且NK细胞过继性疗法治疗血液性肿瘤的临床试验取得一定的疗效, 但在实体瘤上效果不理想[34-36]。CSCs在乳腺癌、前列腺癌、结直肠癌和胰腺癌等肿瘤组织内有一些共同的标志物, 如CD133、CD166、CD44和CD29, 并高表达乙醛脱氢酶2 (aldehyde dehydrogenase-2, ALDH2)[37]。相较于非CSCs肿瘤细胞, CSCs表面低表达I类主要组织相容性复合体(class I major histocompatibility complex, MHC-I), 免疫原性弱, 因此不容易被CD8+ T细胞杀伤, 而MHC-I低表达的CSCs可减少对NK细胞的抑制。因此, 相较于非CSCs, CSCs对NK细胞更敏感[34]。
Tallerico等[35]研究发现, 体外提取纯化的NK细胞与结直肠癌细胞共培养, NK细胞更倾向于杀伤CD133+的CSCs细胞。共聚焦结果显示, CSCs低表达抑制NK细胞识别的MHC-I, 高表达激活性受体NKp30/NKp44的配体。Ames分选不同肿瘤组织样本中的CSCs, 大部分细胞表面上调NK细胞激活性配体MICA/B和Fas[36]。另有研究发现IL-2、IL-15活化后的NK细胞对CSCs的杀伤增强, CSCs对IL-2、IL-15激活的NK细胞更敏感[38]。因CSCs拥有很强的自我更新与分化能力, 可分化为在血液中的循环肿瘤细胞(circulating tumor cells, CTCs), 而NK细胞是清除血液中CTCs的关键防线, 这也为NK细胞在抑制肿瘤转移中提供了重要依据[13]。
NK细胞的杀伤会受到NK细胞肿瘤微环境的抑制, 且CSCs会对NK细胞杀伤产生抗性[34]。例如, Yin等[38]研究发现活性氧(reactive oxygen species, ROS) 高的肿瘤细胞可抑制NK细胞的杀伤, 用抗氧化酶抑制剂L-S, R-丁硫氨酸亚砜胺(抑制谷氨酸-半胱氨酸连接酶, 促进ROS产生) 或H2O2 (ROS诱导剂) 处理肿瘤细胞后, 可促进胞内ROS增加, 显著降低NK细胞的杀伤能力。Park等[39]将高表达上皮细胞黏附分子(epithelial cell adhesion molecule, EpCAM) 的肝癌CSCs与NK细胞共培养, 相较于低表达EpCAM的细胞, NK细胞对EpCAMhigh的CSCs杀伤弱, 而该结果可能与EpCAM诱导表达癌胚抗原相关细胞黏附分子1 (carcinoembryonic antigen related cell adhesion molecule 1, CEACAM1) 相关。CEACAM1是一种在内皮、上皮和免疫细胞上表达的跨膜糖蛋白, 在CEACAM家族成员中是唯一具有免疫受体酪氨酸抑制基序的糖蛋白。CEACAM1可黏附于T细胞免疫球蛋白黏蛋白分子3 (T cell immunoglobulin and mucin domain 3, Tim-3) 调节T细胞耐受和衰竭, 且促进肿瘤细胞逃逸NK细胞介导的细胞杀伤[40, 41]。
2.3.2 NK细胞维持肿瘤休眠肿瘤转移过程中, 浸润在其他组织器官的肿瘤细胞(disseminated tumor cells, DTCs), 为适应新环境, 提高生存优势, 常常进入长期但可逆的休眠状态, 处于细胞周期中的G0期, 这些细胞通常被称为休眠肿瘤细胞, 某些特性与CSCs相似[42]。当周围环境信号发生改变时, 休眠DTCs可被重新激活形成转移灶。
针对休眠肿瘤细胞, 目前研究提出3种治疗策略, 即: ①维持肿瘤细胞处于长期休眠状态从而抑制其被再度激活和转移性复发; ②激活休眠中的肿瘤细胞使其对细胞毒性化疗再度敏感; ③专门靶向作用并清除休眠肿瘤细胞[43]。Correia等[3]研究发现, NK细胞可维持肝脏中休眠DTCs处于休眠态, 抑制休眠态发展为转移灶。对比肝脏中肿瘤休眠区与转移灶中的NK细胞密度, 休眠区NK细胞比例明显高于转移灶。且通过注射IL-15 (该细胞因子可提高NK细胞的细胞毒性, 促进NK细胞增殖), 可进一步增强抗转移疗效。NK细胞维持休眠主要通过IFN-γ, 体外共培养肝细胞与少量肿瘤细胞, 给予IFN-γ可提高休眠DTCs的比例。该研究也发现, 肝损伤造成的肝星状细胞活化会通过CXCL12-CXCR4轴抑制NK细胞维持DTCs休眠的效果, 且促进DTCs的增殖。
目前, 关于NK细胞分泌IFN-γ抑制肿瘤转移的机制还不太深入。早于Correia等[3]研究, Glasner等[44]于2018年发现, NK细胞上NKp46受体可促进IFN-γ的产生, 以诱导细胞外基质蛋白纤连蛋白改变原发性肿瘤结构, 抑制转移。这些研究证明NK细胞在抗转移中具有重要地位, 不仅与NK细胞靶向杀伤表面低表达MHC-I的CTCs、CSCs等相关, 也在维持DTCs休眠态中起到关键作用。
NK细胞产生的IFN-γ也会促进肿瘤高表达免疫抑制性配体, 使CTCs逃脱免疫监视; NK细胞在入侵过程中高表达金属基质酶, 会促进肿瘤细胞脱落, 促进肿瘤转移[45]。针对复杂的肿瘤微环境, 在研究与应用NK细胞疗法时, 需要更全面的思考。
3 NK细胞在肿瘤靶向治疗中的应用统计发现注射后的纳米粒仅0.6%可以被动靶向到实体瘤, 主动靶向修饰仅可提高至0.9%, 大部分的纳米粒在体循环中被MPS清除, 分布到肝脏与肾脏, 该研究结果表明纳米技术在改变分布靶向递送上仍存在很多局限[11]。PEG化纳米粒是延长纳米粒血液循环, 避免MPS清除的传统方式。研究发现重复注射PEG化纳米粒最终由诱导机体产生抗PEG抗体, 加速纳米粒的清除[46]。而纳米粒靶向肿瘤所依赖的增强渗透滞留效应(enhanced permeability and retention effect, EPR) 在人体上的存在被质疑。
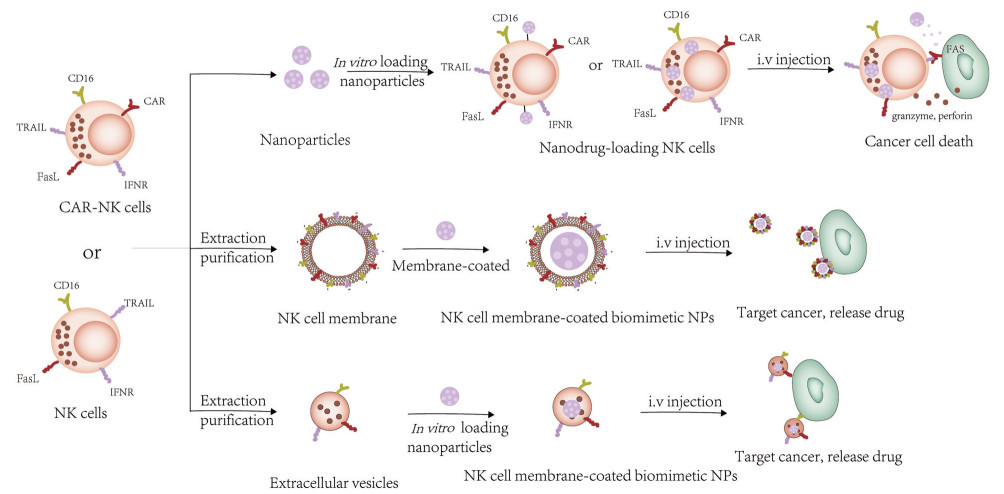
近年来, 基于免疫细胞的仿生化设计如免疫细胞载体、免疫细胞“搭便车”和免疫细胞膜包被等技术逐渐崭露头角。与纳米粒靶向肿瘤不同的是, 免疫细胞不依赖于被动灌注到达肿瘤组织, 而依赖于炎症招募机制, 响应炎性因子驱动活化, 黏附到血管穿过上皮, 到达炎症部位, 而这种募集靶向机制为免疫细胞仿生化设计与免疫细胞作为物载体提供灵感[11]。且作为自体成分, 可逃脱免疫系统的清除, 降低免疫原性, 延长血液循环。更重要的是, 肿瘤是一个慢性炎症部位, 释放的炎性因子会募集免疫细胞包括NK细胞、DCs、中性粒细胞、单核细胞和巨噬细胞等[47]。NK细胞可在血液中循环1周, 其表面多样的受体赋予NK细胞独特的细胞毒性作用以及CSCs靶向性, 使NK细胞载体、NK细胞膜包被仿生化载体和NKEVs在肿瘤靶向治疗中具备独特的优势[11], 3类NK细胞肿瘤靶向设计见图 2。
|
Figure 2 Application of NK cells in cancer targeted therapy. CAR-NK cells can conjugate or encapsulate with different types of drugs-loaded NPs in vitro. Once administrated, the released drugs, NK-TRAIL/Fas/CAR mediate cancer cell killing by inducing apoptosis and cytolysis. Biomimetic nanostructures designed by coating NPs with NK cell-extracted membrane displaying cell-death markers such as TRAIL and Fas to induce apoptosis, and CD16 to mediate ADCC process, which all can induce the killing of cancer cells in vivo. Biomimetic nanostructures also achieved by coating NPs with NK cell extracellular vesicles (NKEVs) displaying identifying marker (CD226), cell-death markers (TRAIL, Fas), containing granzyme and perforin for active targeting and killing of cancer cells. CAR: Chimeric antigen receptor; TRAIL: TNF-related apoptosis-inducing ligand; IFNR: Interferon receptor |
NK细胞靶向肿瘤主要依赖于免疫细胞的炎症靶向性。肿瘤是一个慢性炎症部位, 肿瘤组织释放的DAMPs可诱导组织中的免疫细胞释放细胞因子和前炎性因子以活化肿瘤微血管的内皮细胞, 使其高表达E选择素和P选择素。选择素可以捕获动态血流中的淋巴细胞, 这种瞬时的相互作用导致淋巴细胞在内皮细胞表面滚动。同时, 内皮细胞富集或分泌的细胞因子与趋化因子诱导淋巴细胞上的整合素活化, 而后整合素与内皮细胞表面的细胞间黏附分子1 (intercellular adhesion molecule 1, ICAM1) 和血管细胞黏附分子1 (vascular cell adhesion molecule 1, VCAM1) 结合可进一步加强淋巴细胞与内皮细胞之间的紧密联系, 使淋巴细胞在内皮细胞表面爬行直至穿过内皮细胞屏障到达肿瘤组织[21]。
分离纯化得到的NK细胞膜保留一部分NK细胞表面的功能蛋白, 因此在肿瘤靶向上具备潜力。而NKEVs作为细胞间传递生物信号的囊泡, 不仅保留了NK细胞上的功能蛋白质, 如典型的NK细胞标志物, 包含NKG2D和CD94、穿孔素、颗粒酶和FasL等细胞毒性分子, 在体外和体内展现抗肿瘤活性和靶向肿瘤细胞能力[10]。同时, NKEVs表达多种细胞黏附分子(cell adhesion molecule, CAMs), 在穿过体内屏障靶向肿瘤等炎症部位起重要作用。
3.1.2 靶向效率NK细胞的肿瘤靶向性在NK细胞过继性疗法的研究中得到验证。Melder等[48]通过正电子发射断层扫描(positron emission tomography, PET) 检测尾静脉注射的NK细胞在尾部FSaII纤维肉瘤中的分布量与全身分布。用[11C]甲基碘(一种正电子发射同位素) 标记NK细胞后, 将NK细胞注射至肿瘤远端侧尾静脉, 并监测30~60 min肿瘤内积累情况。结果显示, 肿瘤内滞留的NK细胞为(15.3 ± 4.9) %。未分布到肿瘤的NK细胞在肺、肝和脾中聚集。Uong等[49]采用ESNF13标记体外扩增的NK细胞, 静脉注入NK细胞后可通过近红外荧光成像技术追踪其体内分布。结果显示, 在30 min~4 h时NK细胞快速分布于肺部、肾脏、骨髓和肿瘤部位, 4 h主要分布于原位肿瘤。7天后基本不可见NK细胞在肺部、肾脏和骨髓的分布, 而肿瘤内依然滞留一定量的NK细胞。多个利用NK细胞膜包被仿生化设计的研究发现, NK细胞膜包被可提高药物的瘤内分布, 活体成像结果显示仿生化纳米粒在瘤内的分布和滞留显著提高[9, 50, 51], 而NKEVs静脉注射后的瘤内分布在24 h可达到12.6%, 24~48 h提高至18.8%[52]。
NK细胞的靶向效率不仅体现在原位瘤的靶向性, 在转移易感器官的靶向性上也体现出价值。Chandrasekaran等[53]在研究中将修饰TRAIL与成熟NK细胞表面抗原-NK1.1抗体的脂质体注入小鼠体内, 利用NK1.1抗体结合NK细胞, 通过NK细胞的淋巴引流靶向杀伤肿瘤引流淋巴结内的肿瘤细胞, 有效抑制肿瘤细胞通过淋巴结造成的转移。相较于只修饰TRAIL的脂质体, 该脂质体更多地结合在NK细胞表面, 更有效地抑制淋巴结的转移。
3.1.3 靶向影响因素不同亚型的NK细胞在肿瘤靶向能力上存在差异。NK细胞的体内迁徙主要依靠细胞因子与趋化因子驱动[8]。CD56bright NK细胞表面细胞因子和趋化因子受体(chemokine receptor, CXCR) 主要是CCR7、CXCR3和L-选择素(CD62L), CD56dim NK细胞的受体主要是CXCR1、CXCR2和CX3CR1等[13]。肿瘤微环境中的细胞因子和趋化因子可减少毒性NK细胞的密度, 提高未成熟NK细胞的密度, 并改变其表型转变为肿瘤相关细胞[13]。研究发现, 肿瘤细胞通过高表达CXCL9、CXCL19和CCL5等趋化因子, 诱导未成熟的CD56bright NK细胞分布到肿瘤及肿瘤引流淋巴结, 减少表达CXCL2、CX3CL1、CXCL1和CXCL8等趋化因子, 抑制细胞毒性强的CD56dim NK细胞分布至肿瘤。因此, 在肿瘤靶向中CD56bright NK细胞具有更强的肿瘤靶向性[12]。
不同肿瘤的分布靶向存在差异。免疫抑制的“冷”肿瘤组织如乳腺癌, 肿瘤细胞低表达MHC-I与NK细胞激活性受体配体, 高表达程序性死亡受体(programmed cell death-ligands, PD-Ls) 和B7-H3等免疫检查点配体, 分泌可溶性免疫调节分子PGE2、转化生长因子(transforming growth factor-β, TGF-β) 等免疫抑制条件, 造成肿瘤细胞逃逸NK细胞的免疫监视, 并低表达NK细胞迁移所需的细胞因子以减少NK细胞的分布[54-57]。
因此, NK细胞相关疗法可联用不同疗法以提高靶向性。NK细胞治疗可与细胞因子、免疫调节药物联合使用, 促进“冷”肿瘤转化为“热”肿瘤, 分泌NK细胞募集相关细胞因子提高NK细胞的肿瘤分布。例如, 放疗和化疗可诱导肿瘤细胞上NKG2D配体的表达增加, 增加NK细胞靶向。聚焦超声治疗乳腺癌可增加肿瘤浸润性淋巴细胞, 包括T细胞、B细胞和NK细胞[58]。
3.2 NK细胞作为药物载体 3.2.1 NK细胞作为药物载体的价值CAR-T在急性淋巴细胞白血病和B细胞淋巴瘤等血液型肿瘤的治疗中取得重大突破, 然而脱靶效应、细胞因子风暴(cytokine release syndrome, CRS)、移植物抗宿主病(graft versus host disease, GvHD) 等不良反应限制了CAR-T的临床应用[59]。NK细胞过继性疗法或CAR-NK细胞疗法几乎不产生GvHD与CRS, 且在实体瘤上的疗效强于CAR-T治疗[60, 61]。NK细胞疗法作为CAR-T的替代疗法, 逐渐变成肿瘤免疫治疗的热点研究方向。将CAR-NK或NK细胞作为细胞载体递送抗肿瘤药物, 可进一步增强抗肿瘤疗效。
肿瘤血管异质性导致纳米粒在肿瘤血管近端的细胞外基质聚集, 因此血管远端的肿瘤细胞往往不能被有效靶向清除, 表明传统纳米递送系统被动靶向策略仍存在一定局限性[62]。NK细胞递送可利用NK细胞炎症靶向作用, 以增强纳米粒靶向到肿瘤部位[12]。此外, 利用NK细胞作为载体, 可利用NK细胞本身的细胞毒性作用、CTCs靶向性和维持肿瘤休眠作用联用载药纳米粒起到更有效的抗肿瘤与抗肿瘤转移效果。
3.2.2 NK细胞作为药物载体的设计与应用NK细胞作为载体, 需要大量NK细胞, 这些NK细胞可从外周血中分离、体外扩增, 也可以从脐带血、胚胎干细胞和多功能干细胞诱导分化扩增得到。NK-92是一种人源性NK细胞系, 具有更强的细胞毒性, 且在临床试验中安全性得到确证, 因此也可利用NK-92细胞作为载体[63]。
目前利用NK细胞作为药物载体, 主要以表面嫁接装载药物的纳米载体、细胞内装载药物的纳米粒等两种方式实现。马来酰亚胺化的功能性纳米粒可与富含巯基的NK细胞膜反应, 将纳米粒嫁接在细胞表面, 实现细胞毒性药物通过NK细胞靶向肿瘤而不损伤NK细胞[64, 65]。细胞内装载纳米粒, 采用NK细胞与载药纳米粒共孵育实现, 但装载效率有限。随着对NK细胞摄取机制的研究深入, 细胞内载药方式需要进一步革新。以NK细胞作为药物载体, 载药纳米粒对NK细胞功能的影响值得关注。以往的研究发现, 装载Fe3O4磁性纳米粒、脂质体不会影响NK细胞分泌IFN-γ、颗粒酶和穿孔素的能力, 也不会改变NK细胞表面功能蛋白NKG2D、DNAX辅因子1 (DNAX accessory molecule 1, DNAM-1) 和CD16的表达[66]。
Siegler等[64]将马来酰亚胺化的交联多层脂质体(cross-linked multilamellar liposomal vasicles, cMLVs) 装载紫杉醇(paclitaxel, PTX) 后连接在CAR-NK细胞表面。该CAR-NK细胞在嫁接cMLVs后, 可有效增强cMLVs靶向到肿瘤部位, 且产生更强的肿瘤细胞杀伤作用。体内分布结果显示, CAR-NK细胞嫁接cMLVs可提高cMLVs的瘤内滞留量至接近3倍, 减轻肝脏部位分布造成的肝毒性。
而利用NK细胞和CAR-NK细胞的靶向治疗受限于注射细胞后的体内分布, 且CAR-NK细胞病毒转染效率低、冻融造成细胞毒性下降和实体瘤渗透性低, 依然是目前研究的主要挑战[61]。
3.3 NK细胞膜包被仿生化载体 3.3.1 NK细胞膜包被仿生化载体的价值近年来, 基于细胞膜包被的仿生化设计在纳米给药系统研究中应用广泛。最初基于细胞膜的纳米粒是将红细胞膜和聚乳酸-羟基乙酸[poly(lactic-co-glycolic acid), PLGA] 内核共挤出制备, 细胞膜包被纳米粒概念首次被提出[67]。这种细胞膜涂层到纳米粒表面的方法可以整合细胞膜表面功能性蛋白分子的优点, 赋予仿生纳米载体更好的生物相容性, 使其可伪装成自体成分, 逃脱免疫系统的清除, 降低免疫原性[68]。细胞膜包被纳米载体可保留细胞膜表面部分功能蛋白与受体, 赋予该仿生化纳米载体特定的功能和靶向能力, 该仿生化纳米载体相较于活细胞载体, 在减少活细胞引起的免疫反应、增加实体瘤渗透上具有一定的优势。
NK细胞膜包被仿生化载体可通过细胞膜表面蛋白NKG2D、NKp44、NKp46、NKp30和DNAM-1等靶向肿瘤细胞。例如, NKG2D是一种二硫键连接的同型二聚体, 可识别在肿瘤细胞上表达的几种配体, 包括UL16结合蛋白(UL16-binding protein, ULBP) 和MHC I类链相关基因A (MHC class I chain-related gene A, MICA)[69]。DNAM-1可诱导IFN-γ生成, 并刺激巨噬细胞从M2型分化为M1巨噬细胞[9]。此外, DNAM-1可作为肿瘤细胞迁移的调节剂, 与肿瘤细胞的CD155结合, 抑制肿瘤转移[70]。
3.3.2 NK细胞膜包被仿生化载体的设计与制备NK细胞膜包被仿生化载体的结构主要包括装载药物的核心与膜等两个部分, 其制备主要包括3个步骤: NK细胞膜的分离纯化、核心纳米粒的合成及将细胞膜与核心纳米粒融合[9]。
为了最大程度地减少膜表面蛋白的变性, 膜的提取必须尽可能温和, 通常包括细胞裂解和膜纯化等步骤。NK细胞膜可来源于人外周血中NK细胞, 脐带血、人胚胎干细胞、多功能干细胞诱导分化的NK细胞, 以及人源化NK细胞系-NK-92细胞。相较于诱导分化扩增体内来源的细胞, 由NK细胞系分离提取细胞膜更方便可行, 且NK-92细胞表面缺少抑制性配体表达, 具有更强的抗肿瘤疗效。首先, 收集目标细胞后可使用组合方法裂解细胞, 包括用低渗溶液处理, 反复冻融和机械破膜(挤出、超声等), 继续用不连续蔗糖梯度离心以除去细胞内的生物大分子、内囊泡和核。
细胞膜可以通过不同的方法融合到合成的载药核心纳米粒上, 挤出法、超声法和微流电穿孔法是目前主要使用的3种方法。挤出法是制备膜包被纳米粒最常采用的方法, 通过使用一系列孔径逐渐减小的多孔聚碳酸酯膜(400~100 nm) 挤出机挤出, 通过挤出器孔径控制粒径大小, 但是较为繁琐耗时[69]; 超声法是挤出法的有效替代方法。超声波会破坏膜结构, 通过膜囊泡和NP的简单共孵育而使NP周围的膜重新组装。这种方法方便省时, 但需优化超声处理的各种参数, 包括功率、频率和持续时间, 保证融合效率的同时减少蛋白质变性[71]; 在微流控芯片上, 电磁能在细胞膜上形成孔, 核心纳米粒与细胞膜囊泡混合时, 这些孔有助于纳米粒被囊泡包被。在此过程中, 也需优化工艺脉冲电压、持续时间和流速。这种方法制备的膜包被纳米粒具有完整涂层、分布均匀性和高重复性[72]。
3.3.3 NK细胞膜包被仿生化载体的应用Pitchaimani等[50]利用NK-92人源性NK细胞系提取NK细胞膜与装载多柔比星(doxorubcin, DOX) 脂质体融合得到仿生化NK细胞膜融合脂质体(NK cell membrane infused fusogenic liposome, NKsome), 后续评价CD56、NKG2D、NKp30、钙黏蛋白等功能蛋白稳定存在于NKsome表面, 且体外MCF-7细胞可靶向摄取NKsome, 入胞后释放DOX产生细胞毒效应, 在体内可达到78.5%的抑瘤率。
NK细胞表面蛋白核因子κB受体活化因子配体(receptor activator of nuclear factor-κB ligand, RANKL) 与DNAM-1, 可促进巨噬细胞分化为M1亚型[73]。光动力学疗法(photodynamic therapy, PDT) 在治疗肿瘤中应用广泛, 一方面PDT可通过光辐射产生ROS; 另一方面可诱导免疫细胞死亡(immunogenic cell death, ICD), 刺激分泌DAMPs, 但PDT不能诱导有效持久的免疫反应[74]。将NK疗法与PDT结合可有效增强抗肿瘤免疫应答, Deng等[9]构建了NK细胞膜包被中-四(4-羧基苯基) 卟吩[4, 4′, 4″, 4‴-(porphine-5, 10, 15, 20-tetrayl) tetrakis (benzoic acid), TCPP] 纳米粒, NK细胞膜包被可有效靶向肿瘤部位并诱导巨噬细胞极化为M1型, PDT可诱导肿瘤细胞ICD效应, 两者联用诱导有效持久的免疫效应。在荷瘤小鼠内静脉注射TCPP与NK-NPs, NK-NPs靶向肿瘤在肿瘤部位聚集的能力明显强于TCPP。小鼠心脏、肺、脾、肾和肝脏的HE染色切片显示, 细胞膜包被的仿生载体未造成这些主要脏器的损伤。
NK细胞膜包被纳米载体, 在肿瘤细胞靶向和提高抗肿瘤免疫疗效方面具备较好的疗效。但如何工业化提取细胞膜, 保证细胞内容物的去除及细胞膜蛋白的完整性, 以获得安全有效、完整的细胞膜, 仍面临挑战。
3.4 NK细胞膜外囊泡 3.4.1 NKEVs作为药物载体的价值细胞外囊泡(extracellular vesicles, EVs) 是细胞源性膜囊泡, 作为细胞间交流的一种机制被广泛研究。EVs包括外泌体和微泡等, 外泌体大小在40~100 nm之间, 微泡大小在50 nm~1 μm之间, 细胞间传递生物信号的特性使其作为药物递送系统具有独特的优势, 如体内屏障穿透性如血脑屏障穿透性, 固有的细胞靶向性与体循环稳定性等[75]。相较于细胞载体, EVs的实体瘤渗透性更好, 可避免细胞载体在药物递送过程中被肿瘤细胞改变特性。
NKEVs保留了NK细胞上的功能蛋白质, 如NKG2D和CD94、穿孔素、颗粒酶、FasL等细胞毒性分子, 在体外和体内展现抗肿瘤活性和靶向肿瘤细胞能力, 研究表明NKEVs可触发多种杀伤机制[10]。Zhu等[76]从NK-92细胞系中分离纯化得到NKEVs, 该外泌体表达FasL与颗粒酶, 可靶向胶质母细胞瘤细胞并被其摄取, 有效抑制肿瘤生长。NKEVs通过传递核酸抑制神经母细胞瘤生长与免疫逃逸, 研究发现NKEVs携带miRNA-186, 抑制MYCN基因[已发现MYCN表达与转移行为、上皮细胞-间充质转化(epithelial-mesenchymal transition, EMT)、受损免疫监测、细胞周期进展和干细胞样状态的维持呈正相关[77]]、转化生长因子β受体(transforming growth factor beta receptors, TGFBR) 的表达, 阻止肿瘤细胞通过TGF-β通路由NK细胞造成的免疫逃逸。
NKEVs表面的CD276 (B7-H3)、CD97、CD55等与免疫活化相关的分子可与肿瘤细胞和免疫细胞相互作用, 提高抗肿瘤效果[78]。Federici等[78]研究分析了NKEVs表面的蛋白组成, 发现NKEVs可刺激单核细胞表面共刺激分子CD80/CD86和T细胞表面CD25的表达, 同时在免疫抑制因子IL-10/TGF-β等存在的条件下, 仍能维持免疫刺激活性。进一步研究发现, NKEVs可提高CD56+ NK细胞比例。
此外, NKEVs表达多种CAMs, 在穿过体内屏障靶向肿瘤等炎症部位起重要作用。整合素是其中之一, 可促进细胞外基质的黏附并激活细胞内信号转导通路。整合素介导的肿瘤间质感知、硬化和重塑是支持肿瘤侵袭、获得肿瘤干细胞特征和耐药性的癌症进展的关键步骤[79]。NKEVs表达的几种整合素可能会干扰癌细胞表达的整合素, 如进入肿瘤微环境中与竞争整合素配体[80]。NKEVs表达的其他重要CAMs是选择素, 选择素是介导如炎症等病理反应过程中淋巴细胞归巢的分子[21]。肿瘤中选择素配体水平升高与不良预后有关, 选择素可以激活信号级联, 调节肿瘤微环境中的免疫反应。这些CAMs的表达意味着NKEVs参与了生理和病理条件下复杂的细胞信号交联。
NKEVs丰富的细胞毒性成分、免疫因子和CAMs等使NKEVs拥有靶向杀伤肿瘤细胞的作用, 装载治疗药借助NKEVs靶向肿瘤部位, 可进一步增强抗肿瘤效果。NKEVs表达的MHC-I比NK细胞少, 因此体内排异的现象也会减弱, 以NKEVs作为药物递送系统拥有良好的前景。
3.4.2 NKEVs作为药物载体的设计与制备NKEVs作为药物载体, 主要包括提取分离与载药两个步骤。NKEVs的提取与常规外泌体的分离一致, 主要包括超速离心、免疫亲和纯化等[81]。收集细胞上清后, 低转速除去细胞碎片, 高转速回收NKEVs。而后, 采用蔗糖密度梯度离心可根据密度分离囊泡类型, 进一步从蛋白质聚集物中纯化囊泡。该方法适用于大规模工业化生产, 但耗时, 且高转速可能破坏NKEVs。免疫亲和法可根据NKEVs表面蛋白选择性分离纯化, 但不适合大规模生产。
NKEVs的载药受到表面膜的限制, 如何保证不破坏NKEVs、不释放内容物并有效载药是利用NKEVs载药的一大挑战[74]。以往的研究中, 利用EVs载药分为提取EVs前与提取EVs后两类。小分子RNA可通过转染细胞, 成功装载入EVs[82]。Pascucci等[83]用高剂量PTX处理间充质干细胞, 成功将PTX装载入EVs。Lee等[84]研究发现装载药物的脂质体与细胞共孵育可将药物装载入EVs而后被释放。分离得到的EVs, 对于疏水药物, 直接混合即可实现一定的载药; 对于亲水药物, 需要通过电穿孔、超声、反复冻融和挤出等方式, 仍是一大挑战。利用NKEVs作为药物递送系统, 与CAR-NK细胞过继性疗法相比, 同样面临着体外扩增NK细胞与高效载药、维持体外稳定性等问题。
4 应用前景与挑战NK细胞作为固有免疫的重要组成部分, 在肿瘤免疫治疗的地位逐渐体现。NK细胞在血液中循环, 可结合来自肿瘤部位的细胞因子、趋化因子, 迁徙到肿瘤部位。当肿瘤细胞表面结合抗体或其他刺激性配体, NK细胞可识别并分泌颗粒酶和穿孔素, 杀伤肿瘤。由于CSCs表面低表达MHC, 更易被NK细胞靶向杀伤, 且NK细胞可维持肿瘤细胞休眠, 抗肿瘤转移。基于NK细胞的这些作用与肿瘤靶向能力, 在肿瘤靶向治疗中有较好的前景与优势, 包括NK细胞载体、NK细胞膜包被仿生化纳米载体和NKEVs等。
NK细胞应用于肿瘤靶向治疗, 仍面临诸多挑战。首先, 利用NK细胞作为载体或提取NK细胞膜包被, 不同亚型NK细胞的肿瘤靶向能力存在较大差异, 细胞毒性强的CD56dim NK细胞受到抑制, 而CD56bright NK细胞靶向能力更强, 但容易受到肿瘤微环境的影响, 增殖能力与细胞毒性下降, 如何选择合适亚型的NK细胞作为载体并有效杀伤肿瘤, 值得进一步研究[12]。NK细胞的体外扩增效率和体内外维持活性是利用NK细胞作为载体、提取NK细胞膜或NKEVs存在的普遍问题; 其次, 利用NK细胞作为载体, 存在细胞在体内分布分散、难以渗透到实体瘤深处的问题, 如何诱导体外注射的NK细胞靶向分布到肿瘤, 仍然值得关注[85]。NK细胞疗法与光热疗法、光动力学疗法等联用是解决上述问题的措施之一, 光热疗法、光动力疗法以及化疗可有效引起肿瘤ICD效应, 诱导分泌细胞因子、趋化因子, 促进NK细胞分布到肿瘤部位[86]。此外, 如何提高NKEVs高效载药, 也是限制其应用的主要问题。NK细胞载药剂量会影响注射量, 如何保证给药剂量而不过多注入NK细胞损伤体内细胞动态平衡, 值得思考。总体上, 利用NK细胞对肿瘤进行直接杀伤和抗转移治疗, 或提取NK细胞膜与NKEVs进行抗肿瘤靶向治疗, 是有价值的研究方向。
作者贡献: 张淑芬负责文献查阅、论文撰写和图片处理; 曾颖萍负责论文格式和内容合理性的初步检查; 孟廷廷和袁弘负责检查论文逻辑合理性; 胡富强提供撰写思路和论文最终审核。
利益冲突: 所有作者声明不存在任何利益冲突。
| [1] |
June CH, O'Connor RS, Kawalekar OU, et al. CAR T cell immunotherapy for human cancer[J]. Science, 2018, 359: 1361-1365. DOI:10.1126/science.aar6711 |
| [2] |
Demaria O, Cornen S, Daeron M, et al. Harnessing innate immunity in cancer therapy[J]. Nature, 2019, 574: 45-56. DOI:10.1038/s41586-019-1593-5 |
| [3] |
Correia AL, Guimaraes JC, Auf DMP, et al. Hepatic stellate cells suppress NK cell-sustained breast cancer dormancy[J]. Nature, 2021, 594: 566-571. DOI:10.1038/s41586-021-03614-z |
| [4] |
Wang C, Ye Y, Hu Q, et al. Tailoring biomaterials for cancer immunotherapy: emerging trends and future outlook[J]. Adv Mater, 2017, 29: 1606036. DOI:10.1002/adma.201606036 |
| [5] |
Poon W, Zhang YN, Ouyang B, et al. Elimination pathways of nanoparticles[J]. ACS Nano, 2019, 13: 5785-5798. DOI:10.1021/acsnano.9b01383 |
| [6] |
Sun T, Zhang YS, Pang B, et al. Engineered nanoparticles for drug delivery in cancer therapy[J]. Angew Chem Int Ed Engl, 2014, 53: 12320-12364. |
| [7] |
Ishida T, Ichihara M, Wang X, et al. Injection of PEGylated liposomes in rats elicits PEG-specific IgM, which is responsible for rapid elimination of a second dose of PEGylated liposomes[J]. J Control Release, 2006, 112: 15-25. DOI:10.1016/j.jconrel.2006.01.005 |
| [8] |
Chiossone L, Chaix J, Fuseri N, et al. Maturation of mouse NK cells is a 4-stage developmental program[J]. Blood, 2009, 113: 5488-5496. DOI:10.1182/blood-2008-10-187179 |
| [9] |
Deng G, Sun Z, Li S, et al. Cell-membrane immunotherapy based on natural killer cell membrane coated nanoparticles for the effective inhibition of primary and abscopal tumor growth[J]. ACS Nano, 2018, 12: 12096-12108. DOI:10.1021/acsnano.8b05292 |
| [10] |
Wu CH, Li J, Li L, et al. Extracellular vesicles derived from natural killer cells use multiple cytotoxic proteins and killing mechanisms to target cancer cells[J]. J Extracell Vesicles, 2019, 8: 1588538. DOI:10.1080/20013078.2019.1588538 |
| [11] |
Combes F, Meyer E, Sanders NN. Immune cells as tumor drug delivery vehicles[J]. J Control Release, 2020, 327: 70-87. |
| [12] |
Castriconi R, Carrega P, Dondero A, et al. Molecular mechanisms directing migration and retention of natural killer cells in human tissues[J]. Front Immunol, 2018, 9: 2324. DOI:10.3389/fimmu.2018.02324 |
| [13] |
Dianat-Moghadam H, Mahari A, Heidarifard M, et al. NK cells-directed therapies target circulating tumor cells and metastasis[J]. Cancer Lett, 2021, 497: 41-53. DOI:10.1016/j.canlet.2020.09.021 |
| [14] |
Dianat-Moghadam H, Rokni M, Marofi F, et al. Natural killer cell-based immunotherapy: from transplantation toward targeting cancer stem cells[J]. J Cell Physiol, 2018, 234: 259-273. |
| [15] |
Shimasaki N, Jain A, Campana D. NK cells for cancer immunotherapy[J]. Nat Rev Drug Discov, 2020, 19: 200-218. DOI:10.1038/s41573-019-0052-1 |
| [16] |
Viana I, Roussel S, Defrene J, et al. Innate and adaptive immune responses toward nanomedicines[J]. Acta Pharm Sin B, 2021, 11: 852-870. DOI:10.1016/j.apsb.2021.02.022 |
| [17] |
Prager I, Liesche C, van Ooijen H, et al. NK cells switch from granzyme B to death receptor-mediated cytotoxicity during serial killing[J]. J Exp Med, 2019, 216: 2113-2127. DOI:10.1084/jem.20181454 |
| [18] |
Bournazos S, Wang TT, Dahan R, et al. Signaling by antibodies: recent progress[J]. Annu Rev Immunol, 2017, 35: 285-311. DOI:10.1146/annurev-immunol-051116-052433 |
| [19] |
Finnberg N, Klein-Szanto AJ, El-Deiry WS. TRAIL-R deficiency in mice promotes susceptibility to chronic inflammation and tumorigenesis[J]. J Clin Invest, 2008, 118: 111-123. DOI:10.1172/JCI29900 |
| [20] |
Hashemi V, Farhadi S, Ghasemi-Chaleshtari M, et al. Nanomedicine for improvement of dendritic cell-based cancer immunotherapy[J]. Int Immunopharmacol, 2020, 83: 106446. DOI:10.1016/j.intimp.2020.106446 |
| [21] |
Vestweber D. How leukocytes cross the vascular endothelium[J]. Nat Rev Immunol, 2015, 15: 692-704. DOI:10.1038/nri3908 |
| [22] |
Mahmood S, Upreti D, Sow I, et al. Bidirectional interactions of NK cells and dendritic cells in immunotherapy: current and future perspective[J]. Immunotherapy, 2015, 7: 301-308. DOI:10.2217/imt.14.122 |
| [23] |
Moretta A. Natural killer cells and dendritic cells: rendezvous in abused tissues[J]. Nat Rev Immunol, 2002, 2: 957-964. DOI:10.1038/nri956 |
| [24] |
Vujanovic L, Szymkowski DE, Alber S, et al. Virally infected and matured human dendritic cells activate natural killer cells via cooperative activity of plasma membrane-bound TNF and IL-15[J]. Blood, 2010, 116: 575-583. |
| [25] |
Reiners KS, Dassler J, Coch C, et al. Role of exosomes released by dendritic cells and/or by tumor targets: regulation of NK cell plasticity[J]. Front Immunol, 2014, 5: 91. |
| [26] |
Chaput N, Flament C, Viaud S, et al. Dendritic cell derived-exosomes: biology and clinical implementations[J]. J Leukoc Biol, 2006, 80: 471-478. DOI:10.1189/jlb.0206094 |
| [27] |
Viaud S, Terme M, Flament C, et al. Dendritic cell-derived exosomes promote natural killer cell activation and proliferation: a role for NKG2D ligands and IL-15Ralpha[J]. PLoS One, 2009, 4: e4942. DOI:10.1371/journal.pone.0004942 |
| [28] |
Piccioli D, Sbrana S, Melandri E, et al. Contact-dependent stimulation and inhibition of dendritic cells by natural killer cells[J]. J Exp Med, 2002, 195: 335-341. DOI:10.1084/jem.20010934 |
| [29] |
Take Y, Koizumi S, Nagahisa A. Prostaglandin E receptor 4 antagonist in cancer immunotherapy: mechanisms of action[J]. Front Immunol, 2020, 11: 324. DOI:10.3389/fimmu.2020.00324 |
| [30] |
Van Elssen CH, Vanderlocht J, Oth T, et al. Inflammation-restraining effects of prostaglandin E2 on natural killer-dendritic cell (NK-DC) interaction are imprinted during DC maturation[J]. Blood, 2011, 118: 2473-2482. |
| [31] |
Remark R, Alifano M, Cremer I, et al. Characteristics and clinical impacts of the immune environments in colorectal and renal cell carcinoma lung metastases: influence of tumor origin[J]. Clin Cancer Res, 2013, 19: 4079-4091. DOI:10.1158/1078-0432.CCR-12-3847 |
| [32] |
Lin Q, Rong L, Jia X, et al. IFN-gamma-dependent NK cell activation is essential to metastasis suppression by engineered Salmonella[J]. Nat Commun, 2021, 12: 2537. DOI:10.1038/s41467-021-22755-3 |
| [33] |
Duan H, Liu Y, Gao Z, et al. Recent advances in drug delivery systems for targeting cancer stem cells[J]. Acta Pharm Sin B, 2021, 11: 55-70. DOI:10.1016/j.apsb.2020.09.016 |
| [34] |
Luna JI, Grossenbacher SK, Murphy WJ, et al. Targeting cancer stem cells with natural killer cell immunotherapy[J]. Expert Opin Biol Ther, 2017, 17: 313-324. DOI:10.1080/14712598.2017.1271874 |
| [35] |
Tallerico R, Todaro M, Di Franco S, et al. Human NK cells selective targeting of colon cancer-initiating cells: a role for natural cytotoxicity receptors and MHC class I molecules[J]. J Immunol, 2013, 190: 2381-2390. DOI:10.4049/jimmunol.1201542 |
| [36] |
Ames E, Canter RJ, Grossenbacher SK, et al. NK cells preferentially target tumor cells with a cancer stem cell phenotype[J]. J Immunol, 2015, 195: 4010-4019. DOI:10.4049/jimmunol.1500447 |
| [37] |
Zhao J. Cancer stem cells and chemoresistance: the smartest survives the raid[J]. Pharmacol Ther, 2016, 160: 145-158. |
| [38] |
Yin T, Wang G, He S, et al. Human cancer cells with stem cell-like phenotype exhibit enhanced sensitivity to the cytotoxicity of IL-2 and IL-15 activated natural killer cells[J]. Cell Immunol, 2016, 300: 41-45. DOI:10.1016/j.cellimm.2015.11.009 |
| [39] |
Park DJ, Sung PS, Kim JH, et al. EpCAM-high liver cancer stem cells resist natural killer cell-mediated cytotoxicity by upregulating CEACAM1[J]. J Immunother Cancer, 2020, 8: e000301. DOI:10.1136/jitc-2019-000301 |
| [40] |
Dupuis ML, Fiori V, Soriani A, et al. The human antibody fragment DIATHIS1 specific for CEACAM1 enhances natural killer cell cytotoxicity against melanoma cell lines in vitro[J]. J Immunother, 2015, 38: 357-370. DOI:10.1097/CJI.0000000000000100 |
| [41] |
Dankner M, Gray-Owen SD, Huang YH, et al. CEACAM1 as a multi-purpose target for cancer immunotherapy[J]. Oncoimmunology, 2017, 6: e1328336. |
| [42] |
Recasens A, Munoz L. Targeting cancer cell dormancy[J]. Trends Pharmacol Sci, 2019, 40: 128-141. DOI:10.1016/j.tips.2018.12.004 |
| [43] |
Phan TG, Croucher PI. The dormant cancer cell life cycle[J]. Nat Rev Cancer, 2020, 20: 398-411. DOI:10.1038/s41568-020-0263-0 |
| [44] |
Glasner A, Levi A, Enk J, et al. NKp46 receptor-mediated interferon-gamma production by natural killer cells increases fibronectin 1 to alter tumor architecture and control metastasis[J]. Immunity, 2018, 48: 107-119. DOI:10.1016/j.immuni.2017.12.007 |
| [45] |
Lee HH, Kang H, Cho H. Natural killer cells and tumor metastasis[J]. Arch Pharm Res, 2017, 40: 1037-1049. DOI:10.1007/s12272-017-0951-9 |
| [46] |
Yang Q, Lai SK. Anti-PEG immunity: emergence, characteristics, and unaddressed questions[J]. Wiley Interdiscip Rev Nanomed Nanobiotechnol, 2015, 7: 655-677. DOI:10.1002/wnan.1339 |
| [47] |
Elinav E, Nowarski R, Thaiss CA, et al. Inflammation-induced cancer: crosstalk between tumours, immune cells and microorganisms[J]. Nat Rev Cancer, 2013, 13: 759-771. DOI:10.1038/nrc3611 |
| [48] |
Melder RJ, Brownell AL, Shoup TM, et al. Imaging of activated natural killer cells in mice by positron emission tomography: preferential uptake in tumors[J]. Cancer Res, 1993, 53: 5867-5871. |
| [49] |
Uong T, Lee KH, Ahn SJ, et al. Real-time tracking of ex vivo-expanded natural killer cells toward human triple-negative breast cancers[J]. Front Immunol, 2018, 9: 825. DOI:10.3389/fimmu.2018.00825 |
| [50] |
Pitchaimani A, Nguyen T, Aryal S. Natural killer cell membrane infused biomimetic liposomes for targeted tumor therapy[J]. Biomaterials, 2018, 160: 124-137. DOI:10.1016/j.biomaterials.2018.01.018 |
| [51] |
Du W, Chen C, Sun P, et al. Eliciting an immune hot tumor niche with biomimetic drug-based multi-functional nanohybrids augments immune checkpoint blockade-based breast cancer therapy[J]. Nanoscale, 2020, 12: 3317-3329. DOI:10.1039/C9NR09835F |
| [52] |
Wu F, Xie M, Hun M, et al. Natural killer cell-derived extracellular vesicles: novel players in cancer immunotherapy[J]. Front Immunol, 2021, 12: 658698. DOI:10.3389/fimmu.2021.658698 |
| [53] |
Chandrasekaran S, Chan MF, Li J, et al. Super natural killer cells that target metastases in the tumor draining lymph nodes[J]. Biomaterials, 2016, 77: 66-76. DOI:10.1016/j.biomaterials.2015.11.001 |
| [54] |
Paczulla AM, Rothfelder K, Raffel S, et al. Absence of NKG2D ligands defines leukaemia stem cells and mediates their immune evasion[J]. Nature, 2019, 572: 254-259. DOI:10.1038/s41586-019-1410-1 |
| [55] |
Zhang Q, Bi J, Zheng X, et al. Blockade of the checkpoint receptor TIGIT prevents NK cell exhaustion and elicits potent anti-tumor immunity[J]. Nat Immunol, 2018, 19: 723-732. DOI:10.1038/s41590-018-0132-0 |
| [56] |
Castriconi R, Dondero A, Bellora F, et al. Neuroblastoma-derived TGF-beta1 modulates the chemokine receptor repertoire of human resting NK cells[J]. J Immunol, 2013, 190: 5321-5328. DOI:10.4049/jimmunol.1202693 |
| [57] |
Regis S, Caliendo F, Dondero A, et al. TGF-beta1 downregulates the expression of CX3CR1 by inducing miR-27a-5p in primary human NK cells[J]. Front Immunol, 2017, 8: 868. DOI:10.3389/fimmu.2017.00868 |
| [58] |
Sta MN, Barnes SR, Jacobs RE. In vivo monitoring of natural killer cell trafficking during tumor immunotherapy[J]. Magn Reson Insights, 2014, 7: 15-21. |
| [59] |
Chow VA, Gopal AK, Maloney DG, et al. Outcomes of patients with large B-cell lymphomas and progressive disease following CD19-specific CAR T-cell therapy[J]. Am J Hematol, 2019, 94: E209-E213. DOI:10.1002/ajh.25347 |
| [60] |
Schonfeld K, Sahm C, Zhang C, et al. Selective inhibition of tumor growth by clonal NK cells expressing an ErbB2/HER2-specific chimeric antigen receptor[J]. Mol Ther, 2015, 23: 330-338. DOI:10.1038/mt.2014.219 |
| [61] |
Wang W, Jiang J, Wu C. CAR-NK for tumor immunotherapy: clinical transformation and future prospects[J]. Cancer Lett, 2020, 472: 175-180. |
| [62] |
Prabhakar U, Maeda H, Jain RK, et al. Challenges and key considerations of the enhanced permeability and retention effect for nanomedicine drug delivery in oncology[J]. Cancer Res, 2013, 73: 2412-2417. DOI:10.1158/0008-5472.CAN-12-4561 |
| [63] |
Klingemann HG. Cellular therapy of cancer with natural killer cells-where do we stand?[J]. Cytotherapy, 2013, 15: 1185-1194. DOI:10.1016/j.jcyt.2013.03.011 |
| [64] |
Siegler EL, Kim YJ, Chen X, et al. Combination cancer therapy using chimeric antigen receptor-engineered natural killer cells as drug carriers[J]. Mol Ther, 2017, 25: 2607-2619. DOI:10.1016/j.ymthe.2017.08.010 |
| [65] |
Sanz-Ortega L, Rojas JM, Portilla Y, et al. Magnetic nanoparticles attached to the NK cell surface for tumor targeting in adoptive transfer therapies does not affect cellular effector functions[J]. Front Immunol, 2019, 10: 2073. |
| [66] |
Wu L, Zhang F, Wei Z, et al. Magnetic delivery of Fe3O4@polydopamine nanoparticle-loaded natural killer cells suggest a promising anticancer treatment[J]. Biomater Sci, 2018, 6: 2714-2725. |
| [67] |
Han X, Wang C, Liu Z. Red blood cells as smart delivery systems[J]. Bioconjug Chem, 2018, 29: 852-860. |
| [68] |
Luk BT, Zhang L. Cell membrane-camouflaged nanoparticles for drug delivery[J]. J Control Release, 2015, 220: 600-607. |
| [69] |
Gong P, Wang Y, Zhang P, et al. Immunocyte membrane-coated nanoparticles for cancer immunotherapy[J]. Cancers (Basel), 2020, 13: 77. |
| [70] |
Sloan KE, Eustace BK, Stewart JK, et al. CD155/PVR plays a key role in cell motility during tumor cell invasion and migration[J]. BMC Cancer, 2004, 4: 73. |
| [71] |
Bang KH, Na YG, Huh HW, et al. The delivery strategy of paclitaxel nanostructured lipid carrier coated with platelet membrane[J]. Cancers (Basel), 2019, 11: 807. |
| [72] |
Rao L, Cai B, Bu LL, et al. Microfluidic electroporation-facilitated synthesis of erythrocyte membrane-coated magnetic nanoparticles for enhanced imaging-guided cancer therapy[J]. ACS Nano, 2017, 11: 3496-3505. |
| [73] |
Wan L, Lin HJ, Huang CC, et al. Galectin-12 enhances inflammation by promoting M1 polarization of macrophages and reduces insulin sensitivity in adipocytes[J]. Glycobiology, 2016, 26: 732-744. |
| [74] |
Lu K, He C, Guo N, et al. Chlorin-based nanoscale metal-organic framework systemically rejects colorectal cancers via synergistic photodynamic therapy and checkpoint blockade immunotherapy[J]. J Am Chem Soc, 2016, 138: 12502-12510. |
| [75] |
Vader P, Mol EA, Pasterkamp G, et al. Extracellular vesicles for drug delivery[J]. Adv Drug Deliv Rev, 2016, 106: 148-156. |
| [76] |
Zhu L, Kalimuthu S, Oh JM, et al. Enhancement of antitumor potency of extracellular vesicles derived from natural killer cells by IL-15 priming[J]. Biomaterials, 2019, 190-191: 38-50. |
| [77] |
Huang M, Weiss WA. Neuroblastoma and MYCN[J]. Cold Spring Harb Perspect Med, 2013, 3: a14415. |
| [78] |
Federici C, Shahaj E, Cecchetti S, et al. Natural-killer-derived extracellular vesicles: immune sensors and interactors[J]. Front Immunol, 2020, 11: 262. |
| [79] |
Hamidi H, Ivaska J. Every step of the way: integrins in cancer progression and metastasis[J]. Nat Rev Cancer, 2018, 18: 533-548. |
| [80] |
Humphries JD, Byron A, Humphries MJ. Integrin ligands at a glance[J]. J Cell Sci, 2006, 119: 3901-3903. |
| [81] |
Elsharkasy OM, Nordin JZ, Hagey DW, et al. Extracellular vesicles as drug delivery systems: why and how?[J]. Adv Drug Deliv Rev, 2020, 159: 332-343. |
| [82] |
Akao Y, Iio A, Itoh T, et al. Microvesicle-mediated RNA molecule delivery system using monocytes/macrophages[J]. Mol Ther, 2011, 19: 395-399. |
| [83] |
Pascucci L, Cocce V, Bonomi A, et al. Paclitaxel is incorporated by mesenchymal stromal cells and released in exosomes that inhibit in vitro tumor growth: a new approach for drug delivery[J]. J Control Release, 2014, 192: 262-270. |
| [84] |
Lee J, Kim J, Jeong M, et al. Liposome-based engineering of cells to package hydrophobic compounds in membrane vesicles for tumor penetration[J]. Nano Lett, 2015, 15: 2938-2944. |
| [85] |
Yilmaz A, Cui H, Caligiuri MA, et al. Chimeric antigen receptor-engineered natural killer cells for cancer immunotherapy[J]. J Hematol Oncol, 2020, 13: 168. |
| [86] |
Chu D, Dong X, Zhao Q, et al. Photosensitization priming of tumor microenvironments improves delivery of nanotherapeutics via neutrophil infiltration[J]. Adv Mater, 2017, 29: 1701021. |
 2022, Vol. 57
2022, Vol. 57


