癌症是全球危害人类健康的重大疾病之一, GLOBOCAN 2020报道了2020年全球约有1 930万癌症新增病例和1 000万癌症死亡病例, 为全球社会经济带来巨大负担[1, 2]。传统的肿瘤治疗手段包括手术、化学疗法和放射疗法[3]。手术是多数实体瘤的主要治疗方式, 但是由于肿瘤组织与正常组织的界限难以分辨, 导致通过手术方式无法根除肿瘤病灶[4]。化学疗法和放射疗法都能够抑制肿瘤生长, 但是这些疗法的不良反应大, 导致最终疗效并不能让人满意[5]。因此, 寻找高效低毒的新型肿瘤治疗方案是当前研究的热点。
随着肿瘤生物学研究的不断深入, 已经证实肿瘤发生发展的复杂性与多种基因改变和蛋白功能障碍密切相关[6]。基因疗法通过将有效序列核酸物质导入细胞来纠正或修改遗传信息, 以达到肿瘤治疗的效果[7]。RNA药物的基因疗法可以调节肿瘤相关基因的表达, 已经在临床前和临床试验中展现出良好的抗肿瘤治疗潜力[8, 9]。治疗性的RNA药物包括信使RNA (messenger RNA, mRNA)、微小RNA (microRNA, miRNA)、小干扰RNA (small interfering RNA, siRNA) 和反义寡核苷酸(antisense oligonucleotides, ASO), 都可以调节肿瘤相关基因的表达, 实现对肿瘤的生长抑制[10]。mRNA是一类单链RNA分子, 由数百个到数千个核苷酸组成, 无需进入到细胞核就可以直接在细胞浆中翻译表达出特定的治疗性蛋白[11]; miRNA是一类内源性的长约20~24个核苷酸的单链RNA分子, siRNA是一类人工合成的长约20~25个核苷酸的双链RNA分子, 通过RNA干扰(RNA interfering, RNAi) 机制将同源mRNA特异性降解, 实现特定的“基因沉默”[12, 13]; ASO是一类长约15~25个核苷酸的单链RNA分子, 可以在核糖核酸酶H1的切割作用下对互补的mRNA进行降解, 抑制靶基因的表达[14, 15]。不同于小分子化疗药物, RNA药物必须进入到肿瘤细胞浆内才能发挥效用。然而, 多种细胞和组织屏障阻碍了RNA药物对肿瘤细胞的转染, 从而影响抗肿瘤疗效[16, 17]。首先, 裸露的RNA药物对血液和组织中的内源性核酸酶敏感, 并且在进入体内后会被免疫系统识别为外来物, 很容易被网状内皮系统清除; 其次, RNA药物由于其负电荷和高分子性质, 使其难以进入肿瘤细胞发挥效用[18, 19]。另外, 对于被内吞进入胞内的RNA药物会被滞留在内体/溶酶体中, 仅有效实现溶酶体中逃逸的RNA分子才能在细胞浆中真正发挥其生物学效应[20]。因此, 为了实现RNA药物在肿瘤治疗的成功应用, 需要设计安全高效的载体系统将其递送至靶细胞内发挥抗肿瘤效应。目前处于临床试验阶段的用于肿瘤治疗的RNA药物递送载体主要包括脂质体、聚合物、多肽和外泌体等(表 1)[21, 22]。
| 表 1 RNA therapeutics in clinical trials for tumor therapy. ASO: Antisense oligonucleotides; COX-2: Cyclo-oxygenase 2; EPHA2: Ephrin type-A receptor 2; GRB2: The growth factor receptor-bound protein-2; HSP27: Heat shock protein 27; KRAS G12D: Kirsten rat sarcoma viral oncogene G12D; PLGA: Poly(lactic-co-glycolic acid); KSP: Kinesin spindle protein; MAGE-A3: Melanoma antigen family A3; MAGEC1: Melanoma-associated antigen C1; MAGEC2: Melanoma-associated antigen C2; MUC1: Mucl protein 1; Neo-Ag: Neoantigens; NY-ESO-1: New York esophageal squamous cell 1; OX40L: OX40 ligand; PAP: Purple acid phosphatase; PKN3: Protein kinase N3; PLK1: Polo-like kinase 1; PSA: Prostate specific antigen; PSCA: Prostate stem cell antigen; PSMA: Prostate specific membrane antigen; STAT3: Signal transducer and activator of transcription 3; STEAP1: Six-transmembrane epithelial antigen of the prostate 1; TGF-β1: Transforming growth factor beta 1; TPTE: Transmembrane phosphatase with tensin homology; VEGF: Vascular endothelial growth factor. (Adapted from https://clinicaltrials.gov) |
目前临床试验中的RNA载体递送系统对肿瘤组织的靶向性和肿瘤细胞内药物利用效率仍然较弱, 常存在肿瘤组织中药物蓄积量不足或肿瘤细胞内释药量不足的问题。基于肿瘤组织在pH、特异性酶浓度或氧化还原梯度变化等微环境信号特征与正常组织存在差异性, 各类微环境响应型纳米载体正在被研究开发用于RNA药物对肿瘤组织与细胞的靶向递送, 提高RNA药物的肿瘤组织靶向能力、肿瘤细胞摄取能力、内体/溶酶体逃逸能力及胞内药物释放效率, 从而增强抗肿瘤疗效及降低不良反应。本文综述了肿瘤微环境的病生理特征及各类肿瘤微环境响应型载体策略, 旨在为设计安全高效的RNA药物肿瘤靶向递送系统提供参考。
1 肿瘤微环境的病生理特征肿瘤的微环境中包含免疫细胞、炎症介质及肿瘤细胞分泌的物质, 炎症介质细胞因子及肿瘤细胞分泌的抗原类成分, 共同影响肿瘤细胞的生长、侵袭和转移。肿瘤微环境是肿瘤得以发生、发展的土壤。研究表明, 肿瘤细胞内外微环境的生化反应会导致肿瘤组织发生显著的代谢异常, 从而导致其组织微环境在pH、特异性酶浓度、氧化还原梯度变化、能量供应方式和生物分子代谢等方面与正常的组织细胞产生差异[23]。图 1展示了肿瘤微环境特征, 并与正常的组织细胞进行比较。在正常生理情况下, 细胞外基质和血液中的pH约为7.4。然而, 由于肿瘤组织异常快速的增殖和代谢行为, 肿瘤细胞通过糖酵解途径产生大量的乳酸代谢物, 使得组织环境的pH值保持在偏酸性的6.2~6.9之间[24]。除了肿瘤细胞外偏酸性(pH = 6.2~6.9) 外, 肿瘤细胞内体/溶酶体的特殊酸化环境(pH = 4.5~6.0) 也可被作为pH响应型载体的设计对象。在肿瘤的发生发展过程中, 一些基因的异常表达会导致某些酶的活性和表达量发生改变, 在肿瘤组织中常见的过表达酶包括透明质酸酶、基质金属蛋白酶(matrix metalloproteinase, MMP)、组织蛋白酶和磷酯酶等。缺氧微环境常见于多种实体瘤组织, 与正常组织的氧分压(3.2~8.8 kPa) 相比, 肿瘤组织中的氧分压(< 2.7 kPa) 较低[25]。造成肿瘤组织中缺氧环境的原因在于快速增殖的肿瘤细胞过度增长的耗氧量及新生血管的异常结构与功能造成的氧气供应不足[26]。肿瘤的缺氧环境作为应激因素, 使得肿瘤细胞的侵袭、转移及抗凋亡能力增加, 导致病情加剧。肿瘤细胞内的缺氧性质会显著提高肿瘤组织中的活性氧(reactive oxygen species, ROS) 水平, 使得肿瘤细胞中的ROS水平(~100 μmol·L-1) 远高于正常组织(~20 nmol·L-1)[27]。常见于肿瘤细胞中ROS的类型主要包括过氧化氢(H2O2)、羟基自由基(·OH) 和单线态氧(1O2) 等。相较于正常组织细胞, 肿瘤细胞中的线粒体功能代谢处于紊乱状态, 使其呼吸链中的电子传递过程受到阻碍, 因此生成相对过量的ROS[28]。肿瘤细胞为了降低过量ROS对自身细胞的损伤作用, 会增加谷胱甘肽(glutathione, GSH) 等还原性物质的表达。文献[29]报道肿瘤组织中GSH的水平至少是正常组织的4倍, 并且细胞内GSH浓度(2~10 mmol·L-1) 比细胞外区域浓度(2~10 μmol·L-1) 高约100~1 000倍, 从而形成细胞内外的氧化还原梯度。此外, 肿瘤细胞内的ATP浓度(1~10 mmol·L-1) 远高于细胞外(< 5 μmol·L-1)[30]。ATP作为生物机体内的直接供能物质, 肿瘤细胞的增殖分化需要大量能量供给。上述生化特征为肿瘤细胞的增殖分化、侵袭转移及多药耐药等创造了良好的组织微环境。正是由于肿瘤组织与正常组织之间存在生化指标上的显著差异, 恰好可以利用这些差异性为设计微环境响应型RNA递送载体并实现肿瘤靶向治疗提供有效的解决方案。

|
Figure 1 Schematic diagram of pathophysiological characteristics of tumor microenvironment |
目前的RNA药物递送系统大多依赖于传统的阳离子载体负载RNA药物形成纳米复合物, 并通过高渗透和滞留(enhanced permeability and retention, EPR) 效应富集在肿瘤组织[31]。通常情况下, 为了规避阳离子载体的表面正电性质影响其在血液循环中的稳定性, 聚乙二醇(polyethyleneglycol, PEG) 或阴离子材料常被用于屏蔽或中和阳离子载体的表面电荷, 从而达到稳定负载RNA药物以及延长循环时间的效果[32]。然而, 当该类载体到达肿瘤组织后, PEG或阴离子材料的覆盖阻碍了RNA药物载体系统对肿瘤细胞进一步细胞摄取和内体逃逸。此外, RNA药物递送系统在肿瘤细胞内药物释放不足也会降低肿瘤治疗效果[33]。因此, 具有稳定负载和高效响应性释药特征的肿瘤微环境响应型载体是解决RNA药物在体内递送问题的关键环节。目前, 已有文献报道, 通过有效地对肿瘤微环境中单一或多重响应, 载体可用于RNA药物对肿瘤细胞的有效递送, 提高对肿瘤的治疗效果。表 2[26, 34-60]列举了各类肿瘤微环境响应型RNA药物递送载体策略。在这些载体中, 常见的响应策略包括: ①响应于肿瘤细胞外过表达特异性酶或pH环境, 通过“PEG脱壳”、电荷反转等方式增加肿瘤细胞对纳米粒子的摄取或通过尺寸转化增加纳米粒在肿瘤组织中的渗透和蓄积能力; ②响应于内体/溶酶体中的酸化环境, 通过可电离基团的质子化作用增强纳米粒的内体/溶酶体逃逸能力; ③响应于肿瘤细胞浆中缺氧环境或过表达的GSH、ROS和ATP等因子, 通过纳米粒的加速解散提高RNA药物在胞浆中的释放效率。在此, 将讨论各类肿瘤微环境响应型RNA药物递送载体的设计策略, 重点介绍RNA药物组装方式及微环境响应特征。
| Table 2 Tumor microenvironment-responsive RNA drug delivery systems developed in pre-clinical study. HSA: Human serum albumin; MMP: Matrix metalloproteinase; ROS: Reactive oxygen species; PEG: Polyethylene glycol |
肿瘤微环境的异常pH变化是设计刺激响应型RNA药物递送系统最常用的因素之一。响应肿瘤微环境pH变化刺激的纳米药物载体通过可电离基团或酸敏感化学键在环境pH值改变的时候引起载体构象或稳定性的改变, 实现所载药物的释放[61]。借助肿瘤组织和血液中pH的差异, 可以设计针对肿瘤微酸环境特异性响应的具有电荷反转功能的阳离子载体, 提高RNA药物的细胞摄取能力; 利用细胞液与酸性细胞器间的pH梯度, 则可调控药物的细胞内释放[62]。此外, 阳离子载体材料作为药物载体进入细胞后, 还可以借助质子海绵效应(通过吸收酸性环境中的氢离子增加渗透压导致溶酶体肿胀和破裂) 实现药物的胞内释放和靶细胞杀伤[63]。pH响应的纳米药物递释系统还能够通过改变载体表面的电荷或暴露出靶向配体, 促进药物的细胞摄取或进一步提高药物的靶向性。
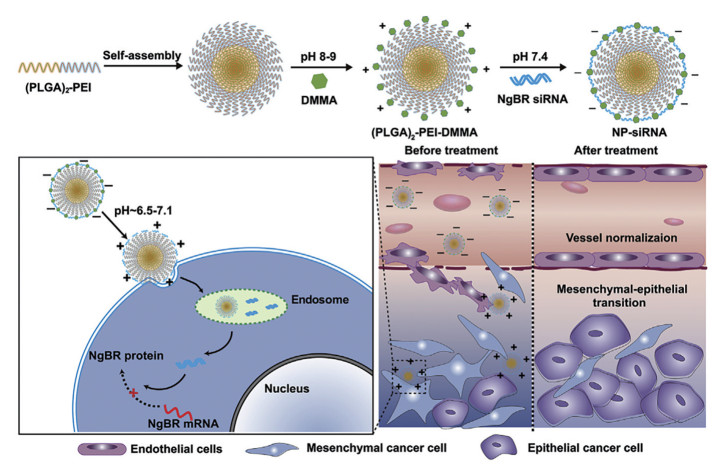
现有的pH响应模式主要分为两种模式, 一种为在材料结构中引入酸敏感可断裂的化学键; 另一种为在材料结构中引入“可电离”化学基团。常见的酸敏感可断裂的化学键包括腙键、亚胺键和缩酮等, 这些酸敏感的化学键在中性pH条件下稳定, 但是在酸性介质中会发生化学键的断裂[64]。利用含有这些酸敏感可断裂的化学键的载体材料组装形成的纳米载体在特定的pH条件下会发生电荷反转、尺寸转化或形态转化等结构变化, 从而引起细胞摄取增加或肿瘤组织深层渗透[65]。例如, Wang等[34]设计了一种pH响应型的纳米载体可递送靶向Nogo-B受体的siRNA (siNgBR), 实现肿瘤血管正常化和转移抑制(图 2)。在该项研究中, 聚乙烯亚胺(polyethyleneimine, PEI) 中的氨基与2, 3-二甲基马来酸酐(2, 3-dimethylmaleic anhydride, DMMA) 共轭形成酰胺键, 可以屏蔽部分正电荷。该载体剩余的正电荷能够吸附带有负电荷的siNgBR, 最终形成的纳米复合物在碱性和中性的情况下表现为负表面电荷, 有利于在血液循环过程中保持稳定。当到达偏酸性的肿瘤微环境时, 载体中含有的酸敏感键会发生水解, 裸露出氨基, 被屏蔽的正电荷再次暴露, 导致纳米粒的表面电荷从负电性转换为正电性, 增强了肿瘤细胞对其的摄取能力。
|
Figure 2 The charge switchable RNA drug delivery system that was sensitive to the acidic tumor microenvironment. DMMA: Dimethylmaleic anhydride; NgBR: Nogo-B receptor; PEI: Polyethyleneimine. (Adapted from Ref. 34 with permission. Copyright © 2014 Elsevier) |
“可电离”化学基团包括叔胺、咪唑和磷酸等, 这些具有不同pKa值的化学基团可以在特定pH条件下捕获或提供质子, 使得含有这些基团的载体材料在物理或化学性质方面发生pH依赖性变化, 导致载体系统的解散以及药物释放。Li等[38]开发了一种新型的三嵌段聚合物用于递送siRNA, 载体中的甲基丙烯酸二甲氨基乙酯-甲基丙烯酸二异丙酯共聚物[P(DPAx-co-DMAEMAy)] 具有pH敏感的可电离片段。DPA和DMAEMA结构中都含有叔胺结构, 在中性条件下表现出疏水性质, 在自组装过程中作为疏水核心稳定粒子结构, 当形成的聚合物/siRNA复合物进入到酸化的内体后, DPA和DMAEMA结构中的叔胺结构发生质子化, 整体结构的亲疏水性质发生变化, 导致纳米粒解散, 最终使得siRNA在胞质内释放发挥效应。
此外, 将两种pH响应模式结合在一种载体系统中可构建双重pH响应型RNA载体系统, 增强载体系统对肿瘤微环境的敏感性, 从而提高响应能力。Zhou等[41]开发了一种稳定的磷酸钙纳米复合物, 同时利用苯并氧杂硼结构用于pH响应性递送siRNA。在该研究中, 2-羟基苯基硼酸被修饰在嵌段聚合物的侧链, 再将其与具有核糖结构的siRNA进行交联, 自组装形成胶束复合物。为了进一步增强载体结构的稳定性, 利用钙离子和磷酸根离子的结合能力, 最终构建成为基于磷酸钙结构的siRNA纳米复合物。鉴于磷酸钙和苯硼酸酯的pH响应能力, 该载体具有胞外稳定、胞内解散的结构特性, 并且整体系统的负电荷表面性质使其在体内实验中表现出低毒高效的优异性能, 为siRNA响应型递送系统的设计提供新的视角。
2.2 酶响应型递送载体在癌症等病理条件下, 病变组织中的一些特异性酶类被过量表达, 这为酶响应的药物递释载体的设计提供了新的方法。目前研究多采用酯酶可断裂的酯键或者蛋白酶可断裂的短肽等修饰纳米药物载体, 从而在特定的生物靶点处实现药物的可控释放和积累。其中, MMP或组织蛋白酶已被广泛用于RNA纳米药物载体的设计[66]。与其他刺激条件相比, 大多数的酶促反应快速高效, 特异性高, 且反应条件温和, 基于酶响应的纳米载体能够表现出更高的响应效率[67, 68]。
MMP是一类参与肿瘤细胞外基质降解的蛋白酶, 与正常组织相比, 几乎在所有类型的肿瘤中都相对高表达。Zhu等[42]构建了一种含有MMP-2敏感肽的多功能聚合胶束, 用于siRNA和疏水性化疗药物的肿瘤靶向共递送, 可实现胞外的PEG脱壳, 增强载体系统的肿瘤细胞摄取能力。如图 3a所示, MMP-2敏感肽(GPLGIAGQ) 被用作阳离子聚合物PEI和PEG之间的连接臂, 合成得到两亲性的MMP-2敏感材料(PEG-pp-PEI-PE)。首先, PEG-pp-PEI-PE与疏水性化疗药物紫杉醇自组装形成胶束, 再通过静电相互作用负载具有负电荷性质的siRNA。由于PEG对PEI正电荷的屏蔽作用, 所形成的纳米复合物能够在血液循环中保持稳定, 当到达MMP-2高表达的肿瘤组织后, MMP-2敏感肽被响应性切割断裂, PEG脱去后暴露出正电荷, 增强肿瘤细胞对纳米粒的摄取, 促进基因疗法和化学疗法的联合抗肿瘤疗效。另外, MMP-7响应的纳米载体也常被用于递送RNA药物。Li等[44]报道了一种MMP-7响应的siRNA递送系统, 显示出对乳腺癌显著性的治疗效果(图 3b)。这种siRNA递送载体中含有MMP-7响应肽连接PEG的三嵌段阳离子聚合材料。在负载siRNA后所形成的载体系统到达肿瘤组织后, MMP-7响应肽被切割断裂, 脱去PEG屏蔽层, 增加了肿瘤细胞对纳米粒的摄取。

|
Figure 3 The RNA delivery strategies based on (a) matrix metalloproteinase-2 (MMP-2) triggered and (b) MMP-7 triggered PEG deshielding. BMA: Butyl methacrylate; DMAEMA: Dimethylaminoethyl methacrylate. DOPE: Dioleoyl phosphoethanolamine; FA: Folic acid; PAA: Propyl acrylic acid; PAT: Proximity-activated targeting; SPN: Smart polymer nanoparticle. (Adapted from Ref. 42 with permission. Copyright © 2014 Elsevier and Ref. 44 with permission. Copyright © 2015 American Chemical Society) |
组织蛋白酶在许多肿瘤组织中高度表达, 各类基于组织蛋白酶刺激响应的载体已用于RNA药物的肿瘤靶向递送[69]。聚谷氨酸(polyglutamic acid, PGA) 是一种合成的水溶性聚合物, 可被组织蛋白酶降解, 且不具有免疫原性和毒性[70]。Polyak等[45]报道了一种具有聚谷氨酸片段的siRNA递送载体, 可被组织蛋白酶响应性降解, 在卵巢癌的治疗中表现出良好的治疗效果。在该研究中, PGA中的羧基被修饰为带有正电荷的氨基, 使其具有负载siRNA的能力。这种PGA衍生物通过静电相互作用吸附siRNA后, 可形成在血浆中稳定的载体系统, 保护siRNA免受核酶的降解。当纳米粒通过EPR效应积累在肿瘤组织中并被肿瘤细胞摄取后, PGA在组织蛋白酶的作用下发生降解, 从而释放出siRNA效应分子, 发挥其抗肿瘤疗效。
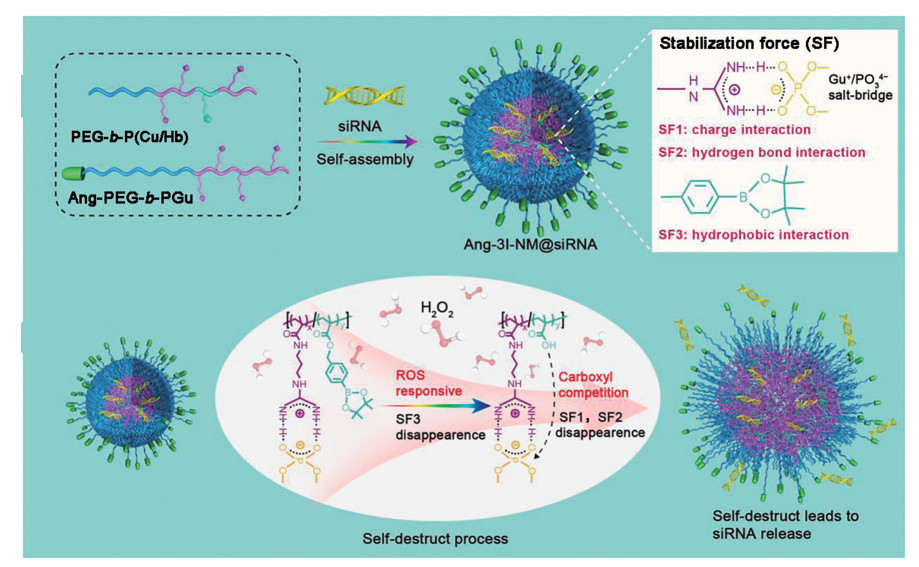
2.3 ROS响应型递送系统缩硫酮和苯硼酸酯等结构都会在ROS的作用下发生断裂[71], 因此常被引入到载体材料结构中构建ROS响应型递送系统。苯硼酸酯结构在ROS响应型RNA药物递送载体设计中应用最为广泛。Zheng等[50]构建了一类具有苯硼酸酯结构的ROS响应型siRNA递送系统(图 4)。该系统通过引入胍基和苯硼酸酯结构实现对siRNA的三重稳定负载, 胍基和siRNA的磷酸基团可形成盐桥, 通过静电相互作用和氢键相互作用吸附siRNA; 苯硼酸酯结构为整体系统的自组装提供疏水相互作用, 提高了载体系统的稳定性。当到达富含ROS的肿瘤细胞内时, 疏水性的苯硼酸酯结构对ROS响应性脱落后裸露出亲水性的羧基, 导致疏水作用力减弱。此外, 新产生的羧基会干扰胍基与siRNA的静电相互作用和氢键相互作用, 使得整体结构逐渐失稳而促进siRNA的胞内释放。此外, Mu等[51]开发了一种siPD-L1和多柔比星(doxorubicin, DOX) 共递送的ROS响应型纳米载体, 用于肿瘤的化疗免疫联合治疗。该研究中采用的载体是以壳聚糖为主链的阳离子材料, 再在其侧链修饰疏水性的苯硼酸酯结构。壳聚糖的主链可以通过静电相互作用吸附siRNA, 苯硼酸酯的修饰为整体纳米粒的自组装提供疏水力。当载体系统到达肿瘤细胞内时, 苯硼酸酯基团在ROS的作用下, 结构断裂的同时疏水作用力消失, 载体系统的自组装能力被破坏, 释放出siPD-L1和DOX分子。在siPD-L1促进T细胞增殖作用下, 共递送的化疗药物DOX表现出增强的抗肿瘤效应。
|
Figure 4 ROS-responsive polymeric siRNA nanomedicine stabilized by triple interactions. (Adapted from Ref. 50 with permission. Copyright © 2019 John Wiley and Sons) |
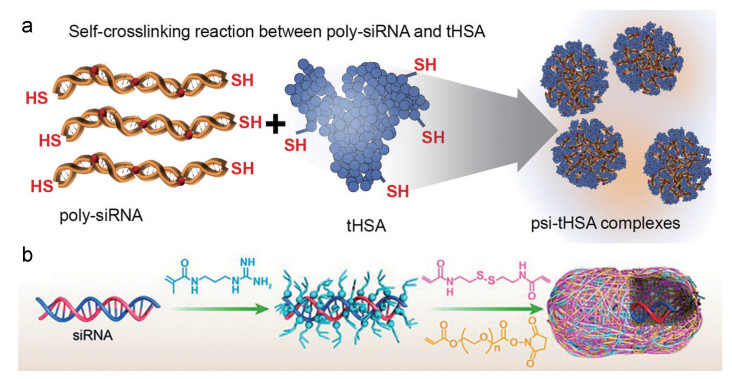
GSH是一种由谷氨酸、半胱氨酸和甘氨酸组成的三肽, 由于其在肿瘤组织和正常组织以及胞内外的浓度差异, 靶向GSH进行还原性响应成为RNA药物递送系统胞内解散的经典策略之一[72]。二硫键能够在GSH的作用下实现断裂, 因此研究人员设计了多种富含二硫键的载体结构用于构建还原响应型RNA药物递送系统[73, 74]。Son等[47]报道了一类通过二硫键将人血清白蛋白(human serum albumin, HSA) 和siRNA进行交联的纳米载体。如图 5a所示, HSA和siRNA进行硫醇化处理以提高两者之间的亲和作用, 并且能够通过化学交联和自交联的方式形成结构稳定的纳米复合物。该复合物富含具有还原响应的能力的二硫键, 在正常生理条件下能够稳定存在, 当被递送到肿瘤组织并被摄取进入到细胞浆时, 二硫键就会在GSH的作用下断裂, 整体结构发生解散而释放出具有生理活性的siRNA, 可显著抑制肿瘤的生长。此外, Zou等[48]开发了一种单个siRNA包封的纳米胶囊, 用于脑部胶质母细胞瘤的靶向治疗(图 5b)。该种胶囊的制备过程如下: 带正电荷的胍基丙烯酸酯作为锚定剂吸附在siRNA表面, 与带有二硫键的N, N'-双(丙烯酰基) 胱胺和带有琥珀酸酯官能端基的单体进行聚合交联形成胶囊的外壳。该类纳米胶囊在体循环过程中具有良好的稳定性, 对血脑屏障有高效的渗透能力, 进入肿瘤细胞后能够在GSH作用下响应性释放效应分子siRNA, 显著抑制原位U87MG异种移植肿瘤的生长。
|
Figure 5 Glutathione (GSH)-responsive RNA delivery systems. a: GSH-responsive self-crosslinked human serum albumin nanocarriers for siRNA delivery; b: GSH-responsive single siRNA nanocapsules. (Adapted from Ref. 47 with permission. Copyright © 2014 Elsevier and Ref. 48 with permission. Copyright © 2020 John Wiley and Sons) |
本课题组设计并合成了一种胆固醇修饰的聚酰胺-胺高分子材料(rPAA-Ch), 其聚合链中含有丰富的二硫键, 使其能够在特定的还原环境中实现聚合链的断裂[49]。rPAA-Ch结构中的叔胺基团通过静电相互作用负载siRNA形成纳米复合物, 表现出良好的细胞摄取能力和溶酶体逃逸能力。当siRNA被递送到胞质后, rPAA-Ch结构中富含的二硫键响应于GSH而断裂, 使得形成的纳米复合物发生解散, siRNA得以释放发挥沉默效应。此外, 本课题组开发了一种双子型阳离子脂质(ssGLCL) 用于siRNA的肿瘤递送治疗[75]。ssGLCL由3部分组成: ①亲水的阳离子头部, 可通过静电相互作用吸附siRNA; ②二硫键作为桥连结构; ③油酸尾链。将其与非还原型的碳碳键桥连的阳离子脂质(ccGLCL) 进行对比, ssGLCL表现出更强的沉默效率, 这可能归因于二硫键的响应性断裂增加了siRNA在胞质中的释放, 使其更好地发挥效应。
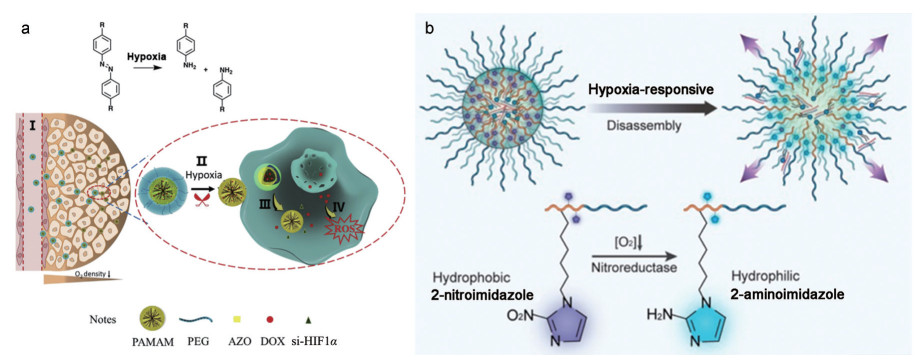
2.5 缺氧响应型递送载体针对肿瘤微环境中特异性的缺氧环境, 常见的缺氧响应结构包括硝基咪唑和偶氮苯[57, 76]。当暴露在缺氧环境中, 这些结构中可还原性基团会接受电子导致结构发生变化, 使得含有该类基团的响应型载体的物理化学性质发生显著变化[76]。Xie等[57]开发了一种含有偶氮苯结构的缺氧响应型载体, 用于共递送DOX和缺氧诱导因子1α的siRNA (siHIF-1α), 从而抑制肿瘤的增殖及逆转肿瘤细胞的耐药性(图 6a)。在该研究中, 使用偶氮苯作为连接键将PEG2000修饰到聚酰胺胺树枝状聚合物(PAMAM) 上, siHIF-1α通过静电相互作用吸附于PAMAM表面, DOX负载在PAMAM的疏水核中, 整体形成一个PEG屏蔽正电荷的纳米粒。当该系统进入到肿瘤组织中并受到缺氧微环境的影响时, 偶氮苯结构断裂导致PEG基团从PAMAM表面脱离, 有利于纳米粒在肿瘤组织中的渗透及对肿瘤细胞的摄取。此外, Li等[26]开发了一种硝基咪唑作为响应基团的阳离子材料, 用于递送siRNA以沉默缺氧相关的原癌基因CDC20, 表现出显著的抗肿瘤功效(图 6b)。该载体通过主链的阳离子基团负载siRNA后能在正常生理环境下稳定存在, 当到达缺氧的肿瘤环境时, 疏水性的硝基咪唑会转换为亲水性的氨基咪唑, 这种亲疏水性质的变化会导致载体系统的解散和随后快速的siRNA释放。
|
Figure 6 The hypoxia-responsive RNA drug delivery systems based on azobenzene (a) and nitroimidazole (b). DOX: Doxorubicin; HIF-1: Hypoxia inducible factor-1; PAMAM: Polyamidoamine. (Adapted from Ref. 57 with permission. Copyright © 2018 Elsevier and Ref. 26 with permission. Copyright © 2020 American Chemical Society) |
ATP结构中的核糖与苯硼酸具有较强的亲和能力(图 7a), 可以通过竞争性结合的方式使得苯硼酸酯结构断裂[77]。因此, 多种具有苯硼酸酯结构的RNA药物递送载体被设计用于肿瘤细胞内的ATP响应[78, 79]。例如, Yoshinaga等[54]报道了一类苯硼酸酯交联的ATP响应性复合胶束, 用于稳定递送mRNA并在肿瘤细胞内响应型释放mRNA (图 7b)。在该研究中, 苯硼酸和多元醇基团衍生的PEG化阳离子嵌段聚合物被合成用于稳定递送mRNA。首先, 带负电的mRNA与聚阳离子片段通过静电相互作用结合形成聚合物/mRNA复合物。然后, 材料中的苯硼酸结构和多元醇结构可交联形成苯硼酸酯, 使得整体复合物的稳定性得到显著提升。当该复合物到达肿瘤细胞内, ATP拥有的核糖结构会竞争性地与苯硼酸基团结合, 导致原有的苯硼酸酯键断裂, 响应性释放出mRNA效应分子。此外, Fan等[55]开发了一种含有苯硼酸酯结构的ATP响应型siRNA递送载体, 苯硼酸酯结构响应ATP的断裂可加速siRNA在胞浆内的释放。该载体的主体结构为带正电的低分子PEI聚合分子, 然后在侧链接枝上苯硼酸基团, 最后将多巴胺修饰的维生素E (VEDA) 分子通过形成苯硼酸酯连接到侧链的苯硼酸上。苯硼酸酯作为亲疏水结构的桥连部分, 在响应胞内的ATP后, 疏水片段消失导致整体粒子的解散, 从而释放负载的siRNA。
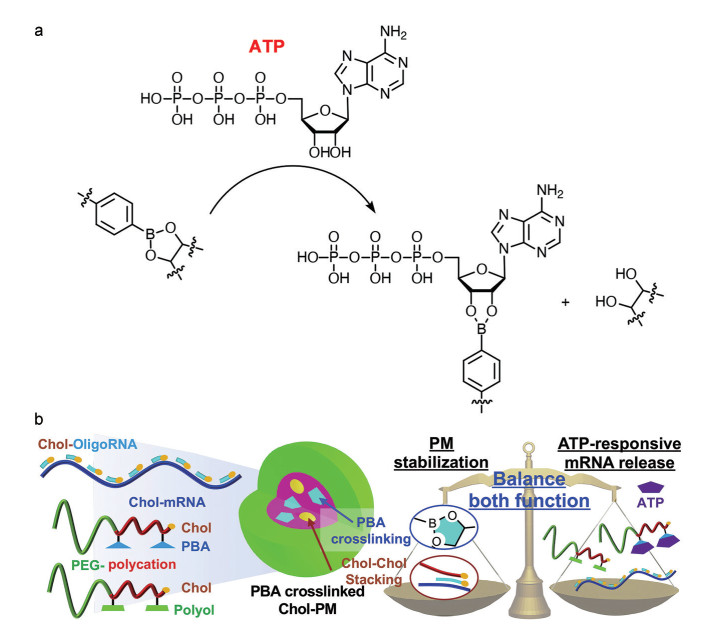
|
Figure 7 Design of ATP responsive delivery systems. a: The ATP-responsive mechanism of phenylborate; b: ATP-responsive polyplex micelles with optimal density of phenylboronate ester for mRNA delivery. PBA: Phenylboronic acid; PM: Polyplex micelle. (Adapted from Ref. 54 with permission. Copyright © 2021 Elsevier) |
为了进一步确保将RNA药物成功递送到靶部位并提高肿瘤部位的响应效率, 各类双重响应型载体被开发用于RNA药物的递送[58]。例如, Liang等[80]开发了一种还原/酶双响应的核壳纳米粒作为杀伤乳腺癌细胞的siRNA载体。该载体的核心是具有二硫键的阳离子片段, 用于负载siRNA。外层MMP-2响应性肽段连接的PEG作为电荷屏蔽层, 可响应于肿瘤微环境中过表达的MMP-2。这类具有双重响应能力的核壳纳米粒能够阶段性响应于肿瘤细胞外的特异性酶和肿瘤细胞内的还原环境, 从而达到有效摄取和药物释放的目的。首先, 该载体系统在肿瘤细胞外的MMP-2响应性PEG脱除增加siRNA的细胞摄取, 同时, 还原敏感响应的二硫键断裂能够加速纳米粒的解散和siRNA的释放。胞外的细胞摄取增加和胞内的药物释放能力增强有利于提高siRNA胞内的基因沉默效率及抗肿瘤疗效。此外, Gao等[59]开发了一种具有聚组氨酸片段和二硫键结构的pH/还原双响应型纳米复合物, 用于共递送siRNA和DOX杀伤耐药肿瘤细胞。当该载体系统进入到肿瘤细胞后, 聚组氨酸结构由于其咪唑基团能够在内体和溶酶体中发生质子化, 实现溶酶体逃逸。另外, 二硫键的引入增加了siRNA在胞质中的释放效率。这类具有双重响应能力的载体系统, 能够同时增强siRNA药物的溶酶体逃逸能力和释放效率, 从而提高抗肿瘤疗效。
3 总结和展望尽管用于肿瘤治疗的微环境响应型RNA递送载体在设计和应用方面取得了一定的发展, 但是仍存在一些关键问题有待解决。首先, 了解RNA载体系统在体内过程中是如何与生物成分相互作用至关重要, 这些生物成分在决定载体系统随后的生物分布和细胞作用中起关键作用; 其次, 由于人体生理系统的复杂性, 某些刺激响应条件有时存在非特异性分布。例如, 在一些正常细胞或非肿瘤组织中也可能存在低pH值、高浓度GSH或某些酶表达上调的情况, 可能会造成载体系统的非特异性响应或刺激敏感性不足的问题。此外, 患者的个体差异和肿瘤的异质性对于内部刺激响应的效率存在很大影响, 不同肿瘤类型和分期的肿瘤微环境之间也存在一定差异。随着研究者对肿瘤微环境的研究不断深入, RNA药物递送系统的设计逐渐从被动响应于肿瘤微环境中的特定因素转化为主动调控肿瘤微环境的异常指标, 以达到肿瘤治疗和降低不良反应的目标[81, 82]; 最后, 微环境响应型RNA载体结构的复杂设计为后续的规模化生产造成困难, 同时阻碍了其临床转化。因此, 如何优化结构复杂的响应型RNA药物递送载体的制备工艺, 使其制剂质量具有可重复性、可规模化生产能力, 是当下研究机构和制药企业亟需解决的问题。
作者贡献: 卢安负责文章撰写; 王向宇和闫仪负责文献检索; 王坚成进行文章的构思、布局和文章修改。
利益冲突: 所有作者声明本文不存在任何利益冲突。
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71: 209-249. DOI:10.3322/caac.21660 |
| [2] |
Ghosh S, Javia A, Shetty S, et al. Triple negative breast cancer and non-small cell lung cancer: clinical challenges and nano-formulation approaches[J]. J Control Release, 2021, 337: 27-58. DOI:10.1016/j.jconrel.2021.07.014 |
| [3] |
Luque-michel E, Imbuluzqueta E, Sebastian V, et al. Clinical advances of nanocarrier-based cancer therapy and diagnostics[J]. Expert Opin Drug Deliv, 2017, 14: 75-92. DOI:10.1080/17425247.2016.1205585 |
| [4] |
Chang D, Ma Y, Xu X, et al. Stimuli-responsive polymeric nanoplatforms for cancer therapy[J]. Front Bioeng Biotechnol, 2021, 9: 707319. DOI:10.3389/fbioe.2021.707319 |
| [5] |
Zhou Q, Zhang L, Yang T, et al. Stimuli-responsive polymeric micelles for drug delivery and cancer therapy[J]. Int J Nanomedicine, 2018, 13: 2921-2942. DOI:10.2147/IJN.S158696 |
| [6] |
Mainini F, Eccles MR. Lipid and polymer-based nanoparticle siRNA delivery systems for cancer therapy[J]. Molecules, 2020, 25: 2692. DOI:10.3390/molecules25112692 |
| [7] |
Singh A, Trivedi P, Jain NK. Advances in siRNA delivery in cancer therapy[J]. Artif Cells Nanomed Biotechnol, 2018, 46: 274-283. |
| [8] |
Ibba ML, CicconeI G, Esposito CL, et al. Advances in mRNA non-viral delivery approaches[J]. Adv Drug Deliv Rev, 2021, 177: 113930. DOI:10.1016/j.addr.2021.113930 |
| [9] |
Mirzaei S, Gholami MH, Hashemi F, et al. Employing siRNA tool and its delivery platforms in suppressing cisplatin resistance: approaching to a new era of cancer chemotherapy[J]. Life Sci, 2021, 277: 119430. |
| [10] |
Barata P, Sood AK, Hong DS. RNA-targeted therapeutics in cancer clinical trials: current status and future directions[J]. Cancer Treat Rev, 2016, 50: 35-47. DOI:10.1016/j.ctrv.2016.08.004 |
| [11] |
Hou X, Zaks T, Langer R, et al. Lipid nanoparticles for mRNA delivery[J]. Nat Rev Mater, 2021, 6: 1-17. DOI:10.1038/s41578-020-00267-8 |
| [12] |
Sun J, Ogunnaike EA, Jiang X, et al. Nanotechnology lights up the antitumor potency by combining chemotherapy with siRNA[J]. J Mater Chem B, 2021, 9: 7302-7317. DOI:10.1039/D1TB01379C |
| [13] |
Raue R, Frank AC, Syed SN, et al. Therapeutic targeting of microRNAs in the tumor microenvironment[J]. Int J Mol Sci, 2021, 22: 2210. DOI:10.3390/ijms22042210 |
| [14] |
Gagliardi M, AshizawaS AT. The challenges and strategies of antisense oligonucleotide drug delivery[J]. Biomedicines, 2021, 9: 433. DOI:10.3390/biomedicines9040433 |
| [15] |
Hammond SM, Aartsma-Rus A, Alves S, et al. Delivery of oligonucleotide-based therapeutics: challenges and opportunities[J]. EMBO Mol Med, 2021, 13: e13243. |
| [16] |
Liu Y, Wu W, Wang Y, et al. Recent development of gene therapy for pancreatic cancer using non-viral nanovectors[J]. Biomater Sci, 2021. DOI:10.1039/d1bm00748c |
| [17] |
Miele E, Spinelli GP, Miele E, et al. Nanoparticle-based delivery of small interfering RNA: challenges for cancer therapy[J]. Int J Nanomedicine, 2012, 7: 3637-3657. |
| [18] |
Romano G, Acunzo M, Nana-Sinkam P. MicroRNAs as novel therapeutics in cancer[J]. Cancers (Basel), 2021, 13: 1526. DOI:10.3390/cancers13071526 |
| [19] |
Tian Z, Liang G, Cui K, et al. Insight into the prospects for RNAi therapy of cancer[J]. Front Pharmacol, 2021, 12: 644718. DOI:10.3389/fphar.2021.644718 |
| [20] |
Barros SA, Gollob JA. Safety profile of RNAi nanomedicines[J]. Adv Drug Deliv Rev, 2012, 64: 1730-1737. DOI:10.1016/j.addr.2012.06.007 |
| [21] |
Winkle M, EI-Daly SM, Fabbri M, et al. Noncoding RNA therapeutics-challenges and potential solutions[J]. Nat Rev Drug Discov, 2021, 20: 629-651. DOI:10.1038/s41573-021-00219-z |
| [22] |
Liu Z, Wang S, Tapeinos C, et al. Non-viral nanoparticles for RNA interference: principles of design and practical guidelines[J]. Adv Drug Deliv Rev, 2021, 174: 576-612. |
| [23] |
Yang YQ, Gong F, Bai S, et al. Progress in tumor microenvironment responsive nano-platforms for cancer theranostics[J]. Acta Pharm Sin (药学学报), 2021, 56: 465-475. |
| [24] |
Liu J, Huang Y, Kumar A, et al. pH-Sensitive nano-systems for drug delivery in cancer therapy[J]. Biotechnol Adv, 2014, 32: 693-710. DOI:10.1016/j.biotechadv.2013.11.009 |
| [25] |
Vaupel P. Tumor microenvironmental physiology and its implications for radiation oncology[J]. Semin Radiat Oncol, 2004, 14: 198-206. DOI:10.1016/j.semradonc.2004.04.008 |
| [26] |
Li Y, Ding J, Xu X, et al. Dual hypoxia-targeting RNAi nanomedicine for precision cancer therapy[J]. Nano Lett, 2020, 20: 4857-4863. DOI:10.1021/acs.nanolett.0c00757 |
| [27] |
Xu X, Saw PE, Tao W, et al. ROS-responsive polyprodrug nanoparticles for triggered drug delivery and effective cancer therapy[J]. Adv Mater, 2017, 29: 1700141. DOI:10.1002/adma.201700141 |
| [28] |
Gao F, Xiong Z. Reactive oxygen species responsive polymers for drug delivery systems[J]. Front Chem, 2021, 9: 649048. DOI:10.3389/fchem.2021.649048 |
| [29] |
Xiong Y, Xiao C, Li Z, et al. Engineering nanomedicine for glutathione depletion-augmented cancer therapy[J]. Chem Soc Rev, 2021, 50: 6013-6041. DOI:10.1039/D0CS00718H |
| [30] |
Jiang C, Qi Z, Jia H, et al. ATP-responsive low-molecular-weight polyethylenimine-based supramolecular assembly via host-guest interaction for gene delivery[J]. Biomacromolecules, 2019, 20: 478-489. DOI:10.1021/acs.biomac.8b01395 |
| [31] |
Subhan MA, Attia SA, Torchilin VP. Advances in siRNA delivery strategies for the treatment of MDR cancer[J]. Life Sci, 2021, 274: 119337. DOI:10.1016/j.lfs.2021.119337 |
| [32] |
Chen X, Mangala LS, Rodriguez-aguayo C, et al. RNA interference-based therapy and its delivery systems[J]. Cancer Metastasis Rev, 2018, 37: 107-124. DOI:10.1007/s10555-017-9717-6 |
| [33] |
Schlich M, Palomba R, Costabile G, et al. Cytosolic delivery of nucleic acids: the case of ionizable lipid nanoparticles[J]. Bioeng Transl Med, 2021. DOI:10.1002/btm2.10213 |
| [34] |
Wang B, Ding Y, Zhao X, et al. Delivery of small interfering RNA against Nogo-B receptor via tumor-acidity responsive nanoparticles for tumor vessel normalization and metastasis suppression[J]. Biomaterials, 2018, 175: 110-122. DOI:10.1016/j.biomaterials.2018.05.034 |
| [35] |
Lim H, Noh J, Kim Y, et al. Acid-degradable cationic poly(ketal amidoamine) for enhanced RNA interference in vitro and in vivo[J]. Biomacromolecules, 2013, 14: 240-247. DOI:10.1021/bm301669e |
| [36] |
Hong BJ, Chipre AJ, Nguyen ST. Acid-degradable polymer-caged lipoplex (PCL) platform for siRNA delivery: facile cellular triggered release of siRNA[J]. J Am Chem Soc, 2013, 135: 17655-17658. DOI:10.1021/ja404491r |
| [37] |
Du Z, Xiang S, Zang Y, et al. Polyspermine imine, a pH responsive polycationic siRNA carrier degradable to endogenous metabolites[J]. Mol Pharm, 2014, 11: 3300-3306. DOI:10.1021/mp500169p |
| [38] |
Li C, Zhou J, Wu Y, et al. Core role of hydrophobic core of polymeric nanomicelle in endosomal escape of siRNA[J]. Nano Lett, 2021, 21: 3680-3689. DOI:10.1021/acs.nanolett.0c04468 |
| [39] |
Kim BS, Kim HJ, Osawa S, et al. Dually stabilized triblock copolymer micelles with hydrophilic shell and hydrophobic interlayer for systemic antisense oligonucleotide delivery to solid tumor[J]. ACS Biomater Sci Eng, 2019, 5: 5770-5780. DOI:10.1021/acsbiomaterials.9b00384 |
| [40] |
Qiu C, Wei W, Sun J, et al. Systemic delivery of siRNA by hyaluronan-functionalized calcium phosphate nanoparticles for tumor-targeted therapy[J]. Nanoscale, 2016, 8: 13033-13044. |
| [41] |
Zhou Q, Wang Y, Xiang J, et al. Stabilized calcium phosphate hybrid nanocomposite using a benzoxaborole-containing polymer for pH-responsive siRNA delivery[J]. Biomater Sci, 2018, 6: 3178-3188. |
| [42] |
Zhu L, Perche F, Wang T, et al. Matrix metalloproteinase 2-sensitive multifunctional polymeric micelles for tumor-specific co-delivery of siRNA and hydrophobic drugs[J]. Biomaterials, 2014, 35: 4213-4222. |
| [43] |
Zeng Y, Zhou Z, Fan M, et al. PEGylated cationic vectors containing a protease-sensitive peptide as a miRNA delivery system for treating breast cancer[J]. Mol Pharm, 2017, 14: 81-92. |
| [44] |
Li H, Mitena M, Kirkbride KC, et al. Dual MMP7-proximity-activated and folate receptor-targeted nanoparticles for siRNA delivery[J]. Biomacromolecules, 2015, 16: 192-201. |
| [45] |
Polyak D, Krivitsky A, Scomparin A, et al. Systemic delivery of siRNA by aminated poly(alpha)glutamate for the treatment of solid tumors[J]. J Control Release, 2017, 257: 132-143. |
| [46] |
Xin XF, Lin F, Kumar V, et al. Redox-responsive nanoplatform for codelivery of miR-519c and gemcitabine for pancreatic cancer therapy[J]. Sci Adv, 2020, 6: eabd6764. |
| [47] |
Son S, Song S, Lee SJ, et al. Self-crosslinked human serum albumin nanocarriers for systemic delivery of polymerized siRNA to tumors[J]. Biomaterials, 2013, 34: 9475-9485. |
| [48] |
Zou Y, Sun X, Wang Y, et al. Single siRNA nanocapsules for effective siRNA brain delivery and glioblastoma treatment[J]. Adv Mater, 2020, 32: e2000416. |
| [49] |
Chen CJ, Wang JC, Zhao EY, et al. Self-assembly cationic nanoparticles based on cholesterol-grafted bioreducible poly(amidoamine) for siRNA delivery[J]. Biomaterials, 2013, 34: 5303-5316. |
| [50] |
Zheng M, Liu Y, Wang Y, et al. ROS-responsive polymeric siRNA nanomedicine stabilized by triple interactions for the robust glioblastoma combinational RNAi therapy[J]. Adv Mater, 2019, 31: e1903277. |
| [51] |
Mu X, Zhang M, Wei A, et al. Doxorubicin and PD-L1 siRNA co-delivery with stem cell membrane-coated polydopamine nanoparticles for the targeted chemoimmunotherapy of PCa bone metastases[J]. Nanoscale, 2021, 13: 8998-9008. |
| [52] |
Xin X, Lin F, Wang Q, et al. ROS-responsive polymeric micelles for triggered simultaneous delivery of PLK1 inhibitor/miR-34a and effective synergistic therapy in pancreatic cancer[J]. ACS Appl Mater Interfaces, 2019, 11: 14647-14659. |
| [53] |
Chen L, Li G, Wang X, et al. Spherical nucleic acids for near-infrared light-responsive self-delivery of small-interfering RNA and antisense oligonucleotide[J]. ACS Nano, 2021. DOI:10.1021/acsnano.1c03072 |
| [54] |
Yoshinaga N, Uchida S, Dirisala A, et al. mRNA loading into ATP-responsive polyplex micelles with optimal density of phenylboronate ester crosslinking to balance robustness in the biological milieu and intracellular translational efficiency[J]. J Control Release, 2021, 330: 317-328. |
| [55] |
Fan X, Zhao X, Su W, et al. Triton X-100-modified adenosine triphosphate-responsive siRNA delivery agent for antitumor therapy[J]. Mol Pharm, 2020, 17: 3696-3708. |
| [56] |
Zhou Z, Zhang M, Liu Y, et al. Reversible covalent cross-linked polycations with enhanced stability and ATP-responsive behavior for improved siRNA delivery[J]. Biomacromolecules, 2018, 19: 3776-3787. |
| [57] |
Xie Z, Guo W, Guo N, et al. Targeting tumor hypoxia with stimulus-responsive nanocarriers in overcoming drug resistance and monitoring anticancer efficacy[J]. Acta Biomater, 2018, 71: 351-362. |
| [58] |
Wang N, Liu C, Yao W, et al. A traceable, GSH/pH dual-responsive nanoparticles with spatiotemporally controlled multiple drugs release ability to enhance antitumor efficacy[J]. Colloids Surf B Biointerfaces, 2021, 205: 111866. |
| [59] |
Gao Y, Jia L, Wang Q, et al. pH/redox dual-responsive polyplex with effective endosomal escape for codelivery of siRNA and doxorubicin against drug-resistant cancer cells[J]. ACS Appl Mater Interfaces, 2019, 11: 16296-16310. |
| [60] |
Choi KO, Huang X, Min KH, et al. Versatile RNA interference nanoplatform for systemic delivery of RNAs[J]. ACS Nano, 2014, 8: 4559-4570. |
| [61] |
Deng Y, Wang CC, Choy KW, et al. Therapeutic potentials of gene silencing by RNA interference: principles, challenges, and new strategies[J]. Gene, 2014, 538: 217-227. |
| [62] |
Liu Y, Zou Y, Feng C, et al. Charge conversional biomimetic nanocomplexes as a multifunctional platform for boosting orthotopic glioblastoma RNAi therapy[J]. Nano Lett, 2020, 20: 1637-1646. |
| [63] |
Saw PE, Yao H, Lin C, et al. Stimuli-responsive polymer-prodrug hybrid nanoplatform for multistage siRNA delivery and combination cancer therapy[J]. Nano Lett, 2019, 19: 5967-5974. |
| [64] |
Fang Z, Pan S, Gao P, et al. Stimuli-responsive charge-reversal nano drug delivery system: the promising targeted carriers for tumor therapy[J]. Int J Pharm, 2020, 575: 118841. |
| [65] |
Zhao M, Li J, Liu J, et al. Charge-switchable nanoparticles enhance cancer immunotherapy based on mitochondrial dynamic regulation and immunogenic cell death induction[J]. J Control Release, 2021, 335: 320-332. |
| [66] |
Cao M, Lu S, Wang N, et al. Enzyme-triggered morphological transition of peptide nanostructures for tumor-targeted drug delivery and enhanced cancer therapy[J]. ACS Appl Mater Interfaces, 2019, 11: 16357-16366. |
| [67] |
Hu Q, Katti PS, Gu Z. Enzyme-responsive nanomaterials for controlled drug delivery[J]. Nanoscale, 2014, 6: 12273-12286. |
| [68] |
Taghizadeh B, Taranejoo S, Monemian SA, et al. Classification of stimuli-responsive polymers as anticancer drug delivery systems[J]. Drug Deliv, 2015, 22: 145-155. |
| [69] |
Qi N, Tang B, Liu G, et al. Poly(gamma-glutamic acid)-coated lipoplexes loaded with doxorubicin for enhancing the antitumor activity against liver tumors[J]. Nanoscale Res Lett, 2017, 12: 361. |
| [70] |
Hattori Y, Nakamura A, Arai S, et al. In vivo siRNA delivery system for targeting to the liver by poly-l-glutamic acid-coated lipoplex[J]. Results Pharma Sci, 2014, 4: 1-7. |
| [71] |
Tao W, He Z. ROS-responsive drug delivery systems for biomedical applications[J]. Asian J Pharm Sci, 2018, 13: 101-112. |
| [72] |
Takemoto H, Miyata K, NishiyamaI N, et al. Bioresponsive polymer-based nucleic acid carriers[J]. Adv Genet, 2014, 88: 289-323. |
| [73] |
Mollazadeh S, Mackiewicz M, Yazdimamaghani M. Recent advances in the redox-responsive drug delivery nanoplatforms: a chemical structure and physical property perspective[J]. Mater Sci Eng C Mater Biol Appl, 2021, 118: 111536. |
| [74] |
Wang H, Li Y, Zhang M, et al. Redox-activatable ATP-depleting micelles with dual modulation characteristics for multidrug-resistant cancer therapy[J]. Adv Healthc Mater, 2017, 6: 1601293. |
| [75] |
Ma XF, Sun J, Qiu C, et al. The role of disulfide-bridge on the activities of H-shape gemini-like cationic lipid based siRNA delivery[J]. J Control Release, 2016, 235: 99-111. |
| [76] |
Thambi T, Park JH, Lee DS. Hypoxia-responsive nanocarriers for cancer imaging and therapy: recent approaches and future perspectives[J]. Chem Commun (Camb), 2016, 52: 8492-8500. |
| [77] |
Yoshinaga N, Ishil T, Naito M, et al. Polyplex micelles with phenylboronate/gluconamide cross-linking in the core exerting promoted gene transfection through spatiotemporal responsivity to intracellular pH and ATP concentration[J]. J Am Chem Soc, 2017, 139: 18567-18575. |
| [78] |
Naito M, Yoshinaga N, Ishii T, et al. Enhanced intracellular delivery of siRNA by controlling ATP-responsivity of phenylboronic acid-functionalized polyion complex micelles[J]. Macromol Biosci, 2018, 18: 1700357. |
| [79] |
Liu Y, Liu Y, Zang J, et al. Design strategies and applications of ROS-responsive phenylborate ester-based nanomedicine[J]. ACS Biomater Sci Eng, 2020, 6: 6510-6527. |
| [80] |
Liang J, Wu C, Zhou X, et al. Host-guest interaction-based dual response core/shell nanoparticles as efficient siRNA carrier for killing breast cancer cells[J]. Colloids Surf B Biointerfaces, 2021, 205: 111918. |
| [81] |
Chen X, Jin R, Jiang Q, et al. Delivery of siHIF-1alpha to reconstruct tumor normoxic microenvironment for effective chemotherapeutic and photodynamic anticancer treatments[J]. Small, 2021, 17: e2100609. |
| [82] |
Sun CX, ju YM, Dai JJ. Research progress in tumor microenvironmentally modulating nanostructures[J]. Acta Pharm Sin (药学学报), 2021, 56: 1016-1024. |
 2022, Vol. 57
2022, Vol. 57


