目前, 已有多种恶性肿瘤治疗方式应用于临床, 包括传统的治疗策略如手术、化疗、放疗及新兴的免疫疗法等[1]。但因传统治疗方式固有的局限性和肿瘤的异质性, 其临床疗效依然不尽人意。在过去的10年里, 虽然免疫疗法也成为一种具有潜力的癌症治疗方式, 但其抗肿瘤谱窄、潜在的毒性和自身免疫抑制等局限性极大地限制了在临床中的应用[2]。此外, 实体肿瘤内的药物递送障碍也导致肿瘤免疫治疗效果不佳[2]。因此, 面对严重威胁着人类健康的恶性肿瘤, 亟需一种更加安全有效的新型治疗模式。近年来, 新兴的生物医学的发展和技术创新为癌症的有效治疗提供了更多的可能。越来越多的研究表明诱导肿瘤细胞铁死亡是一种潜在的抗肿瘤新策略。
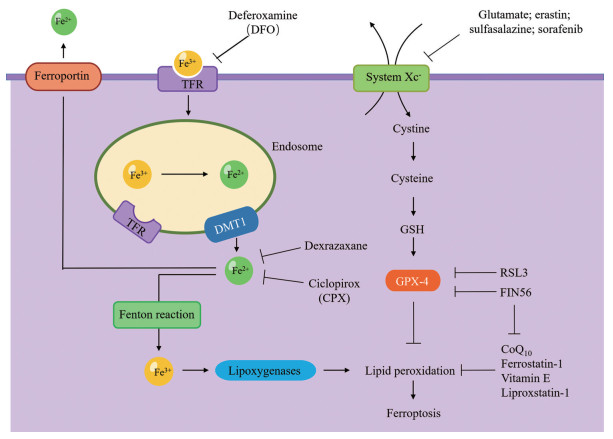
不同于细胞凋亡、焦亡、坏死和自噬等传统细胞死亡途径, 铁死亡是一种新型的细胞死亡类型, 其主要特征是细胞学改变, 包括细胞体积收缩和线粒体膜密度增加等[3]。铁死亡的主要作用机制(图 1): 由铁离子依赖性的细胞内脂质活性氧(reactive oxygen species, ROS) 生成与降解的平衡失调所致, 铁死亡诱导剂可以通过不同的通路直接或间接作用于谷胱甘肽过氧化物酶(glutathione peroxidases, GPXs), 使细胞抗氧化能力降低和胞内ROS堆积引起细胞发生氧化性死亡[3]。相比于传统的细胞死亡, 独特的诱导机制使铁死亡用于抗肿瘤治疗具有巨大的潜在优势。特别是, 对传统治疗方法有抵抗力或有很高转移倾向的癌细胞对于铁死亡敏感, 基于铁死亡的治疗能够展示出更好的治疗效果[4]。
|
Figure 1 The occurrence and regulatory mechanisms of ferroptosis in tumor cell. GSH: Glutathione |
2012年, Dixon等[3]首次使用“ferroptosis”一词来描述这种由铁依赖性的脂质过氧化物积累引起的细胞死亡类型。尽管铁死亡的概念最初是由Stockwell提出的, 但在这之前一些物质已被发现能够诱导铁死亡[3]。2003年, Dolma等[5]在筛选各种化合物对肿瘤细胞杀伤作用时, 发现了新的化合物爱拉斯汀(erastin) 可以特异性诱导Ras突变细胞的死亡。在该过程中, 肿瘤细胞以不同于传统的凋亡方式发生死亡。2008年, Yang等[6]发现了两种新的化合物RSL3和RSL5与爱拉斯汀具有相同的效果, 还确定由此产生的细胞死亡可以被铁螯合剂去铁氧胺b-甲烷磺酸盐和维生素E所抑制, 从而证实了这种形式的细胞死亡与细胞内的铁和ROS有关[6]。后来, 一些其他化合物包括索拉非尼(sorafenib)[7]、青蒿素[8]和1, 2-二氧环(FINO2)[9]等也被证实具有诱导铁死亡的能力。随后, 研究人员还发现了下调谷胱甘肽过氧化物酶4 (glutathione peroxidase 4, GPX-4) 或抑制胱氨酸/谷氨酸逆向转运蛋白(system Xc-) 也可以诱导铁死亡[10]。另外, 铁死亡作为一种铁依赖性细胞死亡方式, 其发生与生物可利用性的亚铁离子(Fe2+) 密切相关[11]。Fe2+能够与过氧化氢(H2O2) 发生芬顿(Fenton) 反应, 产生大量的ROS, 导致细胞膜上不饱和脂肪酸的脂质过氧化, 从而引起细胞死亡。此外, 脂肪酸的供应也是诱导铁死亡的关键[12, 13]。因此, 根据肿瘤特异性和相关机制特性调节并诱导铁死亡被认为是一种很有希望的癌症治疗策略。
随着纳米技术和生物材料的发展, 生物纳米技术已被广泛应用于纳米药物递送系统的开发, 该系统在药物的递送中具有改善水溶性、延长循环时间、增强肿瘤蓄积、提高细胞摄取及降低毒性等明显优势[14-17]。此外, 多种纳米制剂已被应用于临床实践, 如多柔比星脂质体(Doxil) 和紫杉醇白蛋白纳米粒(Abraxan) 等[18, 19]。因此, 生物纳米技术对疏水性小分子抗癌药物的递送具有重大意义, 可以提高治疗效率并减少不良反应等。这为水溶性差、系统毒性强和肿瘤递送效率低的铁死亡诱导剂的体内递送提供了新思路, 进一步为开发新型高效低毒的癌症治疗剂奠定了基础[20]。
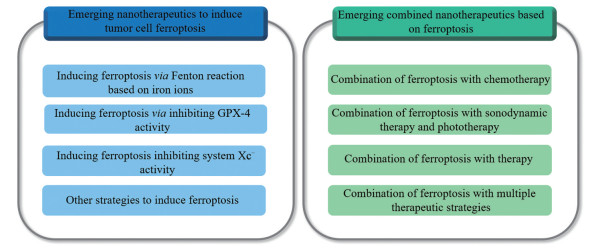
近年来, 铁死亡的纳米治疗策略受到了广泛关注, 将铁死亡诱导剂与生物纳米技术结合用于肿瘤治疗具有广阔的应用前景。作为生物医学的一个新发现, 现有研究已对铁死亡的机制、发展及在肿瘤治疗中的应用进行了研究和介绍[10-12]。然而, 目前对铁死亡的纳米治疗策略的最新研究进展概括总结较少, 亟需补充。本文概述了这一领域的研究前沿和发展趋势, 基于这些治疗策略的基本原理对其优点和局限性进行了系统比较与讨论(图 2)。
|
Figure 2 Schematic representation of emerging nanotherapeutics for inducing ferroptosis and emerging combined nanotherapeutics based on ferroptosis |
随着纳米技术和生物材料的快速发展, 纳米药物的合理设计能够极大改善铁死亡诱导剂在肿瘤部位的蓄积和释放, 从而发挥其治疗效果[21]。许多药物及策略均可诱导铁死亡, 其中细胞内ROS和脂质过氧化物的累积是诱导铁死亡的关键[22]。因此, 基于提高肿瘤细胞内ROS和脂质过氧化物的新型纳米制剂诱导铁死亡策略应运而生, 其中包括基于铁离子的诱导策略, 例如提高胞内铁离子的含量, 进而触发Fenton反应提高ROS水平; 抑制system Xc-活性以减少谷胱甘肽(glutathione, GSH) 合成或抑制GPX-4来提高细胞内ROS和脂质过氧化物的积累, 从而诱导铁死亡; 通过外源性脂肪酸的供应, 提高肿瘤细胞脂质过氧化水平, 从而诱导铁死亡。研究人员利用这些铁死亡策略显著提高了肿瘤治疗效果, 为开发高效低毒的新型纳米制剂提供了可能。
1.1 基于铁离子的芬顿反应诱导铁死亡细胞内铁离子的增加对于诱导铁死亡至关重要, 能与H2O2通过Fenton反应[Fe2+ + H2O2 → Fe3+ + (OH)- + •OH] 生成有毒的羟基自由基, 进而与细胞内多不饱和脂肪酸反应生成脂质过氧化物, 诱导铁死亡[13]。近年来, 人们设计了多种纳米治疗策略来触发肿瘤细胞中Fenton反应的发生, 包括基于纳米递药系统递送高性能的纳米催化剂或直接递送Fenton反应的反应物(如铁离子和H2O2)[23-26]。其中, 基于铁离子的有机纳米催化医学, 特别是以铁离子为核心的纳米有机金属框架(metal-organic framework, MOF) 的构建是一种比较常见的策略。Xu等[24]设计了一种以Fe2+为基础的纳米MOF, 将Fe2+递送到肿瘤细胞, 触发Fenton反应并产生过量的活性氧。所获得的纳米级MOF由乙酸亚铁和有机配体(BDC-NH2) 构成, 其在正常的生物介质和pH中具有良好的稳定性, 而在肿瘤酸性微环境中发生特异性响应降解并释放Fe2+, 释放的Fe2+能够催化Fenton反应并产生大量ROS诱导细胞铁死亡。在体内实验中, 基于Fe2+的金属有机框架纳米粒发挥了高效的细胞毒性作用, 显著抑制了荷瘤小鼠的肿瘤, 与对照组相比, 抗肿瘤效率提高至2倍左右。除了基于铁离子的有机纳米催化医学外, 基于铁离子的无机纳米催化医学也是纳米治疗策略的重要组成部分。Xie等[25]通过将Fe3O4纳米粒包封于1H-全氟戊烷(1H-PFP) 中, 并在外层修饰多肽, 构建了一种肿瘤特异性的热触发铁死亡的纳米药物递送平台(GBP@Fe3O4)。在808 nm激光照射下, 1H-PFP发生相变局部会升温(45 ℃), 导致Fe3O4在原位爆发性释放, 触发肿瘤微环境(tumor microenvironment, TME) 中的Fenton反应产生有效的活性氧。此外, 升温后热应激抑制了肿瘤的抗氧化反应, 增加了脂质过氧化物的积累, 显著地放大了诱导肿瘤发生铁死亡的效果并在体内实验中实现了高效协同的抗肿瘤作用, 最终小鼠的肿瘤体积被显著抑制并减小到不足原来的1/2。
Fenton反应的反应效率很大程度上受到H2O2水平的限制, 因此增加肿瘤组织中H2O2供应将提高其抗肿瘤效果。通过含铁MOF的H2O2递送也是铁死亡纳米治疗策略的另一研究方向, 因而受到广泛关注。Wan等[26]构建了一种基于MOF, 递送葡萄糖氧化酶(glucose oxidase, GOx) 的高效级联纳米反应器, 能发挥协同作用诱导铁死亡。GOx不仅能催化葡萄糖生成大量的H2O2并与释放的铁离子发生Fenton反应, 产生大量的ROS诱导肿瘤细胞发生铁死亡。此外, GOx还能够大量消耗葡萄糖, 形成另一种有吸引力的癌症治疗策略(饥饿疗法)。当纳米反应器到达肿瘤部位时, 高浓度的GSH还原Fe3+, 引起MOF结构坍塌, 释放Fe2+和GOx催化葡萄糖氧化产生H2O2。随后, 产生的H2O2和Fe2+发生Fenton反应, 产生羟基自由基(•OH), 促进肿瘤细胞铁死亡。在治疗期间, 纳米反应器治疗组的小鼠肿瘤体积几乎没有增长, 肿瘤重量仅为未治疗组的1/5, 实现了高效的协同抗肿瘤效果。
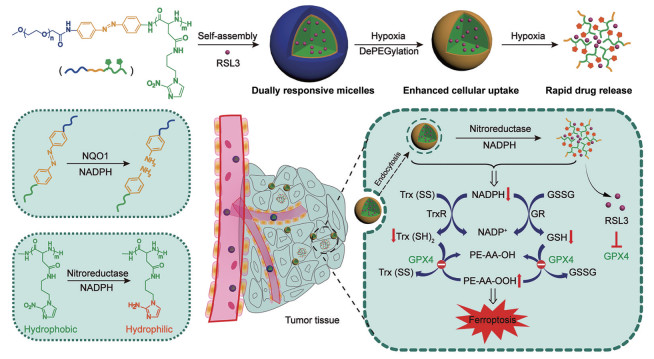
1.2 抑制GPX-4的活性诱导铁死亡除了调控肿瘤细胞内的Fenton反应外, 抑制GPX-4活性也是一种非常典型的诱导肿瘤细胞发生特异性铁死亡方式。GPX-4是体内重要的抗氧化系统成员之一, 是一种能特异性催化谷胱甘肽将脂质过氧化物转化为类脂醇的硒蛋白, 能够降解脂质过氧化物, 移除毒性的中间体, 在调节铁死亡方面发挥重要作用。目前, 抑制GPX-4活性的纳米疗法已被用于诱导铁死亡, 主要包括靶向递送GPX-4小分子抑制剂和合理设计具有GPX-4抑制功能的纳米载体材料[27, 28]。例如, RSL3是一种有效的铁死亡诱导剂, 以GPX-4为作用靶点, 可降低GPX-4的酶活性, 诱发肿瘤细胞死亡。Gao等[27]设计并制备了包载小分子铁死亡诱导剂RSL3的不饱和脂肪酸花生四烯酸两亲性聚合物胶束, 该胶束在肿瘤较高活性氧微环境中触发花生四烯酸发生脂质过氧化, 诱发胶束解组装并快速释放RSL3。在卵巢癌细胞模型中, 由于RSL3的铁死亡作用, 载药胶束表现出比空白胶束高30倍的细胞毒。在体内抗肿瘤实验中进一步验证了包载RSL3的胶束明显降低了GPX-4的表达, 进而诱导肿瘤细胞铁死亡, 显著抑制肿瘤的生长, 与未治疗组相比, 小鼠的肿瘤体积约为0.3倍, 并明显延长荷瘤小鼠的生存期至33天。除了GPX-4的小分子抑制剂外, 一些新型纳米载体材料也具有抑制GPX-4活性作用。例如, Guo等[28]设计了含有偶氮苯连接的亲水性聚乙二醇(polyethylene glycol, PEG) 端和由硝基咪唑共轭连接的多肽结构作为疏水端的低氧激活的两亲性聚合物胶束, 包载铁死亡诱导剂RSL3 (图 3)。该聚合物在肿瘤细胞的低氧环境中依赖还原型辅酶I (II) 醌氧化还原酶1 [NAD(P)H: quinone oxidoreductase 1, NQO1] 和烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate, NADPH) 的催化作用发生偶氮键的断裂, 暴露出氨基使纳米粒带正电促进纳米粒的摄取。同时, 在肿瘤细胞内高表达硝基还原酶和NADPH存在的情况下, 硝基咪唑结构会还原变为亲水性结构, 进而诱发胶束解组装和快速释药。重要的是, NADPH作为硫氧蛋白还原酶(thioredoxin reductase, TrxR) 和谷胱甘肽还原酶(glutathione reductase, GR) 的辅酶, NADPH的消耗会降低氧化型硫氧还蛋白[oxidized thioredoxin, Trx(SS)] 向还原型硫氧还蛋白[reduced thioredoxin, Trx(SH2)] 的转化和氧化型谷胱甘肽(oxidized glutathione, GSSG) 向还原型GSH的转化, 进而间接降低GPX-4酶的活性, 与RSL3发挥协同抑制作用。在小鼠乳腺癌(4T1) 荷瘤小鼠模型中, 设计的两亲性聚合物材料高效地增敏了RSL3诱发的肿瘤细胞铁死亡水平, 与对照组相比, 抗肿瘤效率提高两倍, 与未治疗组相比, 抗肿瘤效率提高近10倍, 显著增强了抗肿瘤效果。
|
Figure 3 Schematic illustration of responsive micelles-induced nicotinamide adenine dinucleotide phosphate (NADPH) depletion, GSH, and Trx(SH)2 diminishment and ferroptosis boosting under hypoxia. (Adapted from Ref. 28 with permission. Copyright © 2020, American Chemical Society) |
细胞内半胱氨酸的浓度是谷胱甘肽生成的关键步骤, 而半胱氨酸的合成与system Xc-密切相关[29, 30]。System Xc-是一种膜Na+依赖的半胱氨酸-谷氨酸交换转运体, 其可以将谷氨酸转运到细胞外, 并将胱氨酸转运到细胞内, 胞内胱氨酸进一步转化为半胱氨酸, 参与促进GSH的合成。因此, 下调system Xc-的表达能够降低胞内半胱氨酸的浓度, 进而限制GSH的合成效率, 提高细胞内ROS水平并增加脂质过氧化物的积累来诱导铁死亡。最近, 针对抑制system Xc-活性来诱导肿瘤细胞发生铁死亡的研究也逐渐成为热点。爱拉斯汀是一种典型的system Xc-小分子抑制剂, 能够通过抑制半胱氨酸的摄取来降低细胞内GSH的浓度, 进而钝化细胞内GR、GPXs等抗氧化系统。Zhu等[29]采用无载体纳米递药技术构建了爱拉斯汀和二氢卟吩e6 (chlorin e6, Ce6) 的纯药共组装纳米递药系统。纳米粒在肿瘤细胞内解体并快速释药, 爱拉斯汀显著抑制system Xc-的活性, 阻碍半胱氨酸的摄取, 导致细胞内的GSH浓度下降。同时, 光敏剂Ce6在激光照射下产生大量的ROS, 进一步增加了细胞内脂质过氧化物的蓄积, 极大发挥了铁死亡和光动力治疗(photodynamics therapy, PDT) 的协同治疗效果。Li等[30]也做了类似的研究, 通过纳米乳化法制备了爱拉斯汀和雷帕霉素的共组装纳米递药系统。爱拉斯汀作为一种RAS选择性致死小分子铁死亡激活剂, 在细胞内释放能够通过抑制system Xc-的活性诱导肿瘤细胞发生铁死亡; 雷帕霉素通过自噬相关的铁死亡途径下调GPX-4, 致使脂质过氧化积累, 从而协同爱拉斯汀诱导肿瘤细胞铁死亡。
索拉非尼既是一种多功能靶向性抗肿瘤化疗药, 又是一种有效的铁死亡激动剂, 可直接抑制system Xc-和间接失活GPX-4, 当其与大量的铁离子共存时, 会诱导肿瘤细胞发生高水平的铁死亡[31, 32]。Sang等[31]基于自组装纳米药物递送系统构建了一种线粒体膜靶向的氧化/还原反应敏感的磁驱动纳米光敏剂复合物(CSO-SS-Cy7-Hex/SPION/sorafenib)。磁驱动靶向性能够增加纳米粒在肿瘤部位的蓄积, 随后超顺磁性氧化铁纳米粒SPION在酸性环境中发生解体并释放Fe2+和Fe3+。在激光照射下, 近红外光敏剂Cy7-Hex固定在线粒体膜上产生大量的ROS, 与释放的索拉非尼协同促进脂质过氧化物的大量蓄积, 表现出高效的细胞毒性, 且在体内药效学实验中, 经过11天的治疗后, 小鼠的肿瘤体积从250 mm3下降到了50 mm3以下, 显著的抑制了肿瘤增长。在索拉非尼的后续研究中, Xu等[32]通过将血红蛋白与光敏剂Ce6连接, 构建负载索拉非尼的纳米药物递送平台, 能诱导高效的细胞铁死亡并协同PDT抗肿瘤, 提供了一种新的诱导铁死亡及联合治疗模式。
1.4 诱导铁死亡的其他策略除触发Fenton反应、抑制GPX-4活性和抑制system Xc-活性等常见诱导细胞铁死亡途径外, 直接下调GSH、抑制GR、外源补充不饱和脂肪和脂质过氧化物以及多种策略的联合诱导等其他策略也可以诱导细胞发生铁死亡[33-35]。纳米酶在肿瘤催化治疗中具有广阔的应用前景, Meng等[33]提出了一个黄铁矿过氧化物纳米酶, 与经典Fe3O4纳米酶和天然过氧化物酶相比, 黄铁矿纳米酶不仅能够高效产生H2O2, 还能催化还原型GSH到氧化态GSH (GSSG)。因此, 黄铁矿纳米酶具有双重的活性, 在产生丰富的•OH的同时还消耗还原型谷胱甘肽, 显著诱导肿瘤细胞发生凋亡及铁死亡。此外, 抑制抗氧化系统也是诱导铁死亡的重要途径之一, 抗氧化系统包括谷胱甘肽还原酶/谷胱甘肽/谷胱甘肽过氧化物酶(GR/GSH/GPx), 有研究[34]发现一种甲萘二酮羧酸衍生物6-[2-(3-甲基)-萘醌基] 己酸(NQA), 能够抑制细胞内的抗氧化系统。通过配位组装过程构建了Fe3+和NQA的自组装纳米粒, 不仅能够释放铁离子通过Fenton反应提高体内ROS水平, 释放的NQA还能够显著抑制体内的抗氧化系统(GR/GSH/GPx), 能够在双途径中诱导铁死亡, 显著地遏制了肿瘤的生长、转移和耐药。与之相似, Xu等[35]设计了一个pH敏感的金属有机纳米反应器, 同时负载生物碱荜拔酰胺。制备的纳米粒进入偏酸性的肿瘤细胞内后会快速地释放荜拔酰胺, 荜拔酰胺能够下调GSH, 抑制体内抗氧化系统, 加速诱导铁死亡, 提供了一种新型高效的治疗方案。
如前所述, 脂质过氧化物主要来源于氧化刺激下膜脂质中的多不饱和脂肪酸(PUFAs) 发生过氧化反应。因此, 通过外源性补充PUFAs来调节脂质过氧化, 对诱导细胞铁死亡也是一种有效的策略。例如, Beatty等[36]首先发现了三阴性乳腺细胞(TNBC) 内PUFAs水平与铁死亡的发生之间有密切的关系, 随后, 在筛选了一系列不饱和脂肪酸后, 发现共轭亚麻酸在诱导铁死亡水平上表现出最强的效果。这是由于亚麻酸化学结构中具有多重共轭双键, 且共轭的双键的位置和PUFAs的立体化学对其也有一定影响。这些结果为PUFAs诱导细胞铁死亡而进一步发挥抗肿瘤活性提供了有力的支持。在后续研究中, Gao等[27]设计了具有不饱和脂质侧链修饰的聚合物胶束, 包载铁死亡诱导剂RSL3。其中, 不饱和脂肪酸侧链的修饰能够提高体内脂质过氧化水平, 协同诱导铁死亡。类似地, Zhou等[37]也开发了一种基于类Fenton反应的纳米药物递送系统, 通过疏水过氧化亚油酸(LAHP) 和亲水低聚物在氧化铁纳米粒表面进行修饰, 实现了在肿瘤酸性微环境条件下按需释放Fe2+。随后, 释放的Fe2+与LAHP协同作用可显著生成1O2, LAHP修饰的氧化铁纳米粒可通过产生肿瘤特异性ROS, 从而诱导肿瘤细胞凋亡和铁死亡。
2 基于铁死亡联合治疗的新型纳米制剂越来越多的研究表明, 相比于单一治疗策略, 多种疗法联合治疗策略在临床的癌症治疗中优势更为明显, 例如高效协同治疗效果和减少单一剂量而减轻不良反应等。近些年, 纳米递药技术的发展为共载两种或两种以上的药物提供了多功能纳米平台, 为癌症的联合治疗提供了广阔的前景。在此, 综述了基于纳米技术的铁死亡与化疗、肿瘤特异性成像指导的治疗、光疗或免疫治疗等多种疗法联合应用的最新研究进展, 从而为癌症的有效治疗提供了一种新的纳米联合递送技术。
2.1 铁死亡联合化疗到目前为止, 化疗仍然是除手术外的肿瘤治疗最主要治疗方式之一[38]。然而, 化疗药物存在较差的理化性质、潜在的不良反应、狭窄的治疗窗及较差的肿瘤靶向能力等缺陷, 极大地限制了其治疗效果。装载于纳米递药系统中的化疗药物能够显著提高药物的递送效率和治疗效果, 然而, 由于单药的治疗效果不佳, 从而导致了临床中一些已上市的纳米制剂的治疗效率远远低于预期[38]。因此, 化疗联合其他疗法已成为肿瘤治疗的一个显著趋势, 其中, 顺铂是较为常见的与铁死亡疗法联用的化疗药物[39, 40]。Cheng等[39]设计了一个装载顺铂前药的锰沉积的氧化铁纳米平台(Pt-FMO)。如图 4所示, 首先Mn2+和Fe3+与PEI通过水热法进行纳米化, 随后装载顺铂前药, 并进行PEG化修饰得到Pt-FMO。Pt-FMO在肿瘤细胞的酸性环境中会发生解体, 释放出Mn2+、Fe3+/Fe2+和顺铂前药。Mn2+会发生类Fenton反应与Fe2+协同产生ROS进而形成脂质过氧化物, 释放的顺铂前药也会间接的促进H2O2的生成, 从而增强铁死亡。此外, 顺铂作为化疗药能够诱导肿瘤细胞发生明显的凋亡。在体内抗肿瘤实验中, Pt-FMO具有更低的全身毒性, 更高的化疗-铁死亡的联合治疗效率, 能有效的诱导肿瘤细胞死亡并抑制小鼠的肿瘤体积在100 mm3左右, 显著延缓了肿瘤的生长。类似地, Chen等[40]以Fe(III)-聚多巴胺(FeP) 为核心, 透明质酸交联的顺铂(PtH) 为外壳, 构建铁死亡与顺铂化疗联用的可降解的金属配合物纳米平台(PtH@FeP), 从而发挥铁死亡与顺铂化疗的协同治疗效果。

|
Figure 4 Schema of the preparation of magnetic Pt-FMO nanoparticles and its mechanism of inducing apoptosis and ferroptosis for the combined anti-tumor effect. (Adapted from Ref. 39 with permission. Copyright © 2021, Ivyspring International Publisher) |
除了顺铂外, 据报道, 其他化疗药例如多柔比星(doxorubicin, Dox) 也常与铁死亡联合应用[41-44]。Bao等[41]设计了一种Fe3+交联结构的纳米载体, 该纳米平台以上转换纳米粒(upconversion nanoparticles, UCNP) 为核心, Dox吸附在聚合物外壳中。氧化淀粉聚合物上的羧基与Fe3+发生配位反应, 随后进行进一步聚乙烯亚胺(PEI) 和2, 3-二甲基马来酸酐(DMMA) 的外壳修饰。DMMA在静脉注射后提供一个带负电荷的表面, 从而延长血液循环时间, 并通过实体瘤的高通透性和滞留(enhanced permeability and retention, EPR) 效应提供更多到达肿瘤部位的机会[41]。暴露于弱酸性的TME中, 纳米粒表面DMMA的转化不仅能促进肿瘤内化, 而且还诱导了随后的质子-海绵效应, 导致溶酶体逃逸。在近红外光(NIR) 照射下, 具有上转换特性的UCNP能使Fe3+还原为Fe2+, 铁离子价态的转换实现了铁离子和药物的快速释放。释放的Fe2+在细胞质中发生Fenton反应, 导致细胞铁死亡; 而释放Dox至细胞核, 诱导细胞凋亡。这种多重按需转换的纳米递送系统有效地实现了对肿瘤细胞的化疗和铁死亡的联合治疗。Mu和Xue等[42, 43]也报道过类似的Dox与铁死亡联用方案。不同于顺铂和Dox, 反式偶氮苯-康普瑞汀(trans-Azo-CA4) 是一种光开关微管抑制剂, 其药理活性仅依赖于构象稳定的顺式异构体来有效抑制微管蛋白聚合[44]。Zhu等[44]构建了一个装载trans-Azo-CA4的UCNP, 并在表面进行脂质壳(DOPA、lecithin和DSPE-PEG) 的修饰。纳米粒进入肿瘤细胞后, 经近红外光激发后, UCNP中的Fe3+转换为Fe2+, 进而发生Fenton, 导致脂质过氧化物的积累, 诱导肿瘤细胞铁死亡; 同时, trans-Azo-CA4转变成活性cis- Azo-CA4, 抑制微管, 从而使肿瘤细胞发生凋亡[44]。在体内抗肿瘤实验中, 发挥高效的化疗与铁死亡联合治疗效果且显著地延长了荷瘤小鼠的生存周期至50天。
2.2 铁死亡联合声/光治疗除了化疗外, 近些年关于声动力治疗(sonodynamic therapy, SDT) 和光学治疗(phototherapy) 的策略也备受关注。目前, 大部分光声治疗均需要依赖声敏剂或光敏剂的作用, 针对光敏剂和铁死亡诱导剂共递送的纳米递药系统已有广泛研究。声动力治疗是指用超声波对蓄积在肿瘤部位的声敏剂(如血卟啉) 进行激活而发挥抗肿瘤作用[45]。Zhou等[45]构建了一个基于声敏剂(PpIX) 的脂质体纳米递药系统, 并同时装载纳米氧化铁。脂质体进入肿瘤细胞后, 纳米氧化铁会诱导肿瘤细胞发生铁死亡, 释放的PpIX则会在超声波的作用下产生单线态氧造成肿瘤细胞氧化损伤使其凋亡。此外, SDT能够调控铁死亡检查点转铁蛋白的吞噬过程来提高铁死亡的敏感性, 从而发挥高效的协同治疗作用。不同于声动力疗法, 光学疗法是利用特定波长的光来激活光敏剂发挥抗肿瘤效果。光学疗法包括光动力学疗法和光热力学疗法。其中, 基于纳米技术的光动力学疗法与铁死亡联用的研究更为广泛。Li等[46]报道了一种由聚乙二醇化的聚半乳糖醛酸、光敏剂5, 10, 15, 20-四(4-氨基苯基) 卟啉(TAPP) 和Fe3+组成的纳米复合物(PAF)。PAF在肿瘤细胞内酸性条件下解体释放出Fe3+和TAPP, TAPP在酸性条件下被激活, 产生更高水平的单线态氧。此外, 产生的单线态氧还会下调GSH水平, 从而促进铁死亡过程。相比单一的治疗模式, PAF具有更加显著的抗肿瘤疗效, 这表明PDT增强的铁死亡模式可能是一种新型高效的纳米治疗策略。类似地, Zhu等[29]也报道了光敏剂Ce6与铁死亡诱导剂的共组装纳米粒, 论证了PDT与铁死亡的高效联合治疗效果。关于光热治疗(photothermal therapy, PTT) 与铁死亡的联合应用, Xue等[47]报道了一个聚多巴胺负载Fe2+和β-拉帕醌(LAP) 的纳米递药平台(FeIIPDA@LAP-PEG-cRGD)。在激光照射下, 聚多巴胺会产生PTT诱导肿瘤细胞凋亡, 同时PTT会诱导热休克蛋白的表达进而上调NQO1水平。NQO1激活LAP的生物还原反应产生H2O2促进铁离子介导的脂质过氧化和细胞铁死亡, 极大发挥了光热治疗和铁死亡的协同治疗效果。
一些光或声敏剂在发挥光或声治疗的同时具有良好的肿瘤成像潜力, 在发挥光动或声动联合铁死亡治疗的同时能够进行肿瘤成像。He等[48]设计了一个全氟正戊烷(PFP) 和Fe/Cu-SS混合的MOF, 外层用多巴胺和PEG进行修饰。Fe/Cu会通过Fenton反应的发生产生·OH。此外, 还可以通过二硫-硫醇交换显著下调细胞内GSH水平, 进而导致GPX-4失活和脂质过氧化物进一步积累。此外, 铜不仅是核磁共振成像的基础, 还能有效实现光热转换。在红外光的照射下, 纳米粒将产生光热效果, 并将封装的液体全氟戊烷转化为微泡, 用于超声成像。作为磁共振和超声成像指导的光热与铁死亡联合治疗的新模式, PFP@Fe/Cu-SS对于临床中诊疗一体化纳米制剂的开发具有重要意义。在最近的研究中, Chen等[49]设计了一种聚乳酸-羟基乙酸(PLGA) 修饰并共递送Fe3O4和Ce6的纳米递药系统。Fe3O4-PLGA-Ce6能在酸性TME中解离, 释放出Fe2+/Fe3+和Ce6, 释放的Fe2+/Fe3+与细胞内过量的H2O2之间可发生Fenton反应产生•OH诱导肿瘤细胞铁死亡。在激光照射下, 释放的Ce6可以产生大量的ROS, 进而促进肿瘤细胞的铁死亡。此外, 磁性的Fe3O4提供了T2-加权MRI特性。因此, Fe3O4-PLGA-Ce6纳米体系表现出荧光和磁共振双成像指导的PDT联合铁死亡抗肿瘤治疗的协同作用。
2.3 铁死亡联合免疫治疗近些年, 肿瘤的免疫治疗作为一种创新的治疗方式, 已成为肿瘤治疗领域的一大热点。目前, 多个PD-1抗体已获FDA批准应用于临床治疗。肿瘤免疫治疗通过刺激固有免疫系统来识别和杀死肿瘤细胞, 对正常组织损伤最小。尽管肿瘤免疫治疗在实现肿瘤的长期抑制方面具有广阔的应用前景, 但目前的免疫治疗策略仍存在一些不容忽视的问题, 如免疫应答仅对一小部分患者有效且存在潜在的不良反应, 以及因肿瘤细胞免疫原性不足而导致的效率较低等。此外, 免疫疗法的抗肿瘤效果通常不如化疗或放疗, 特别是对于实体肿瘤。因此, 免疫疗法和其他疗法联合应用是更有效的策略, 其中, 免疫疗法联合铁死亡已成为一种有前景的有效的癌症治疗组合。从联合机制上来看, 有研究表明免疫治疗激活的CD8+ T细胞能增强铁离子特异性介导的肿瘤细胞脂质过氧化, 反过来, 诱导铁死亡有助于提高抗肿瘤免疫治疗效果[50]。在机制上, 免疫治疗激活的CD8+ T细胞释放的干扰素γ下调了system Xc-的两个亚基SLC3A2和SLC7A11的表达, 抑制肿瘤细胞的胱氨酸摄取, 从而促进肿瘤细胞脂质过氧化和铁死亡; 肿瘤细胞发生铁死亡的同时也会释放出免疫原性抗原, 诱发肿瘤细胞免疫原性细胞死亡, 从而有助于免疫治疗的抗肿瘤疗效。
Xiong等[51]通过静电作用和π-π堆积作用制备了一种由Dox、单宁酸(TA) 和光敏剂IR820组装而成的纳米激活器(DAR)。DAR进入细胞被溶酶体内吞后, 在质子的攻击下, DAR再次组装形成更大的聚集体, 从而导致溶酶体破裂, 释放出铁离子。该设计可以利用细胞内溶酶体中储存的铁离子实现铁死亡和细胞内氧化应激的正反馈回路。DAR经激光照射后, 细胞内氧化应激反应增强, 产生的ROS有效分布于细胞内溶酶体和内质网中, 分别促进铁死亡和免疫原性细胞死亡; 随后产生的免疫应答也会反过来促进肿瘤细胞的铁死亡。此外, 类似的设计和结论也被Hsieh和Zhang等证明[52, 53]。Jiang等[54]构建的促进铁死亡-免疫治疗的新型仿生磁性纳米平台, 也证明了肿瘤细胞发生铁死亡的同时能够诱发免疫原性细胞死亡, 进而反过来促进铁死亡的发生。此外, 在体内抗肿瘤实验中, 该团队也将其纳米制剂与PD-1抗体联用, 相比于单一的纳米制剂或PD-1抗体, 联合给药组表现出更加显著的抗肿瘤效果, 小鼠的肿瘤几乎消失, 生存周期延长至80天以上。综上所述, 这些研究为铁死亡-免疫联合抗肿瘤治疗提供了一种创新的治疗策略。
2.4 铁死亡联合多种治疗策略由于某些特定的条件的限制及肿瘤异质性等原因, 单一的诱导铁死亡策略或联合其他单一疗法并不能得到预期的治疗效果。最近的几项研究将铁死亡与两种或多种治疗模式联合应用取得了突破性的进展[40, 51, 55, 56]。例如, Xiong等[51]联合铁死亡、化疗、PDT及免疫治疗策略, 取得了较为高效的联合抗肿瘤治疗效率。Chen等[40]设计了由铁离子/顺铂/聚多巴胺构成的纳米平台, 实现了铁死亡、化疗和PTT联合治疗效果, 显著抑制了荷瘤小鼠的肿瘤生长, 设计的纳米制剂治疗组小鼠的肿瘤经过治疗后几乎消失。此外, Zhang等[56]结合肿瘤细胞内外两个作用位点, 提出了用β-环糊精修饰肝素, 并同时负载Dox、二茂铁(ferrocene, Fc) 和TGF-β受体抑制剂SB431542的肝素酶驱动的级联释放的NLC/H (D + F + S) 纳米平台。Dox和Fc可有效提高细胞内ROS水平, 激活肿瘤细胞内的铁死亡通路, 同时产生的ROS能降低金属蛋白酶-2的表达阻止肿瘤转移; 在TME中由于载体对肝素酶的响应而快速释放出小分子抑制剂SB431542, 抑制TME中的TGF-β通路, 防止肿瘤发生转移, 协同提升Dox疗效。基于铁死亡的多模式联合应用治疗策略具有更高效的治疗效率, 为恶性肿瘤的治疗提供了一种更加可靠的新理念。
3 总结与展望综上所述, 新兴的生物技术创新与传统治疗方法相结合已经成为癌症治疗的趋势。铁死亡是近年来发现的一种铁依赖的脂质过氧化物引起的新型细胞死亡方式, 作为癌症治疗的新靶点, 在肿瘤生物学和抗肿瘤治疗中受到越来越多的关注。纳米技术因其独特的优势, 为铁死亡诱导剂的递送及多种疗法的联合应用奠定了基础。基于铁死亡的机制, 对目前基于纳米技术诱导肿瘤铁死亡的最新研究进行了总结概括, 并重点介绍了以铁死亡诱导剂为基础的纳米治疗方法的设计和基于纳米技术的铁死亡与其他治疗方式相结合的联合应用。经过研究者们对铁死亡的深入研究, 以铁死亡为基础的癌症治疗取得了诸多成果及研究进展。然而, 基于铁死亡的纳米疗法在临床中仍然存在诸多问题亟待解决, 依然具有较高的挑战性。首先, 这种非凋亡细胞死亡方式在动物和人类之间可能存在巨大差异, 需要进一步的研究; 其次, 铁死亡诱导剂的潜在的不良反应应做充分研究, 以保证肿瘤特异性触发铁死亡的同时能够避免对正常组织的脱靶毒性。此外, 基于铁死亡的联合纳米治疗方案的设计可能会产生叠加的毒性及工业可行性都需要进一步评估。因此, 还需更多的研究来深入了解探索铁死亡, 综合考虑多方面因素, 才能设计出能诱导铁死亡的安全有效的新型纳米制剂。
作者贡献: 孙新新和孔志强负责总结和归纳文献; 张申武和单新竹负责起草并撰写文章; 何仲贵和罗聪负责论文选题、指导、审阅文章和提供行政、技术上的支持。
利益冲突: 论文不涉及相关知识产权, 不存在利益冲突。
| [1] |
Cortez AJ, Tudrej P, Kujawa KA, et al. Advances in ovarian cancer therapy[J]. Cancer Chemother Pharmacol, 2018, 81: 17-38. DOI:10.1007/s00280-017-3501-8 |
| [2] |
Hamad M. Antifungal immunotherapy and immunomodulation: a double-hitter approach to deal with invasive fungal infections[J]. Scand J Immunol, 2008, 67: 533-543. DOI:10.1111/j.1365-3083.2008.02101.x |
| [3] |
Dixon SJ, Lemberg KM, Lamprecht MR, et al. Ferroptosis: an iron-dependent form of nonapoptotic cell death[J]. Cell, 2012, 149: 1060-1072. DOI:10.1016/j.cell.2012.03.042 |
| [4] |
Xu F, Chen WD, Guo MH, et al. Progress of ferroptosis mechanism and application in lung cancer therapy[J]. J Basic Clin Med, 2021, 41: 442. |
| [5] |
Dolma S, Lessnick SL, Hahn WC, et al. Identification of genotype-selective antitumor agents using synthetic lethal chemical screening in engineered human tumor cells[J]. Cancer Cell, 2003, 3: 285-296. DOI:10.1016/S1535-6108(03)00050-3 |
| [6] |
Yang WS, Stockwell BR. Synthetic lethal screening identifies compounds activating iron-dependent, nonapoptotic cell death in oncogenic-RAS-harboring cancer cells[J]. Chem Biol, 2008, 15: 234-245. DOI:10.1016/j.chembiol.2008.02.010 |
| [7] |
Louandre C, Ezzoukhry Z, Godin C, et al. Iron-dependent cell death of hepatocellular carcinoma cells exposed to sorafenib[J]. Int J Cancer, 2013, 133: 1732-1742. DOI:10.1002/ijc.28159 |
| [8] |
Eling N, Reuter L, Hazin J, et al. Identification of artesunate as a specific activator of ferroptosis in pancreatic cancer cells[J]. Oncoscience, 2015, 2: 517-532. DOI:10.18632/oncoscience.160 |
| [9] |
Abrams RP, Carroll WL, Woerpel KA. Five-membered ring peroxide selectively initiates ferroptosis in cancer cells[J]. ACS Chem Biol, 2016, 11: 1305-1312. DOI:10.1021/acschembio.5b00900 |
| [10] |
Cao JY, Dixon SJ. Mechanisms of ferroptosis[J]. Cell Mol Life Sci, 2016, 73: 2195-2209. DOI:10.1007/s00018-016-2194-1 |
| [11] |
Xie Y, Hou W, Song X, et al. Ferroptosis: process and function[J]. Cell Death Differ, 2016, 23: 369-379. DOI:10.1038/cdd.2015.158 |
| [12] |
Yu H, Guo P, Xie X, et al. Ferroptosis, a new form of cell death, and its relationships with tumourous diseases[J]. J Cell Mol Med, 2017, 21: 648-657. DOI:10.1111/jcmm.13008 |
| [13] |
Shan X, Li S, Sun B, et al. Ferroptosis-driven nanotherapeutics for cancer treatment[J]. J Control Release, 2020, 319: 322-332. DOI:10.1016/j.jconrel.2020.01.008 |
| [14] |
Zhang W, Wang F, Hu C, et al. The progress and perspective of nanoparticle-enabled tumor metastasis treatment[J]. Acta Pharm Sin B, 2020, 10: 2037-2053. DOI:10.1016/j.apsb.2020.07.013 |
| [15] |
Yang F, Zhao Z, Sun B, et al. Nanotherapeutics for antimetastatic treatment[J]. Trends Cancer, 2020, 6: 645-659. DOI:10.1016/j.trecan.2020.05.001 |
| [16] |
Lv DY, Huang S, Sha LP, et al. Preparation and evaluation of redox sensitive mixed micelles containing paclitaxel[J]. Acta Pharm Sin (药学学报), 2020, 55: 1320-1326. |
| [17] |
Ye L, Ye J, Lu JG, et al. The reversal of tumor drug resistance by liposomes containing docetaxel and verapamil[J]. Acta Pharm Sin (药学学报), 2020, 55: 1035-1041. |
| [18] |
Chen YJ, Tsai CY, Cheng YM, et al. Impacts of intralipid on nanodrug abraxane therapy and on the innate immune system[J]. Sci Rep, 2020, 10: 2838. DOI:10.1038/s41598-020-59813-7 |
| [19] |
Barenholz Y. Doxil®-the first FDA-approved nano-drug: lessons learned[J]. J Control Release, 2012, 160: 117-134. DOI:10.1016/j.jconrel.2012.03.020 |
| [20] |
Zhu M, Nie G, Meng H, et al. Physicochemical properties determine nanomaterial cellular uptake, transport, and fate[J]. ACC Chem Res, 2013, 46: 622-631. DOI:10.1021/ar300031y |
| [21] |
Liu M, Liu B, Liu Q, et al. Nanomaterial-induced ferroptosis for cancer specific therapy[J]. Coord Chem Rev, 2019, 382: 160-180. DOI:10.1016/j.ccr.2018.12.015 |
| [22] |
Chen X, Kang R, Kroemer G, et al. Broadening horizons: the role of ferroptosis in cancer[J]. Nat Rev Clin Oncol, 2021, 18: 280-296. DOI:10.1038/s41571-020-00462-0 |
| [23] |
Wen J, Chen H, Ren Z, et al. Ultrasmall iron oxide nanoparticles induced ferroptosis via beclin1/ATG5-dependent autophagy pathway[J]. Nano Converg, 2021, 8: 10. DOI:10.1186/s40580-021-00260-z |
| [24] |
Xu X, Chen Y, Zhang Y, et al. Highly stable and biocompatible hyaluronic acid-rehabilitated nanoscale MOF-Fe2+ induced ferroptosis in breast cancer cells[J]. J Mater Chem B, 2020, 8: 9129-9138. DOI:10.1039/D0TB01616K |
| [25] |
Xie S, Sun W, Zhang C, et al. Metabolic control by heat stress determining cell fate to ferroptosis for effective cancer therapy[J]. ACS Nano, 2021, 15: 7179-7194. DOI:10.1021/acsnano.1c00380 |
| [26] |
Wan X, Song L, Pan W, et al. Tumor-targeted cascade nanoreactor based on metal-organic frameworks for synergistic ferroptosis-starvation anticancer therapy[J]. ACS Nano, 2020, 14: 11017-11028. DOI:10.1021/acsnano.9b07789 |
| [27] |
Gao M, Deng J, Liu F, et al. Triggered ferroptotic polymer micelles for reversing multidrug resistance to chemotherapy[J]. Biomaterials, 2019, 223: 119486. DOI:10.1016/j.biomaterials.2019.119486 |
| [28] |
Guo X, Liu F, Deng J, et al. Electron-accepting micelles deplete reduced nicotinamide adenine dinucleotide phosphate and impair two antioxidant cascades for ferroptosis-induced tumor eradication[J]. ACS Nano, 2020, 14: 14715-14730. DOI:10.1021/acsnano.0c00764 |
| [29] |
Zhu T, Shi L, Yu C, et al. Ferroptosis promotes photodynamic therapy: supramolecular photosensitizer-inducernanodrug for enhanced cancer treatment[J]. Theranostics, 2019, 9: 3293-3307. DOI:10.7150/thno.32867 |
| [30] |
Li Y, Wang X, Yan J, et al. Nanoparticle ferritin-bound erastin and rapamycin: a nanodrug combining autophagy and ferroptosis for anticancer therapy[J]. Biomater Sci, 2019, 7: 3779-3787. DOI:10.1039/C9BM00653B |
| [31] |
Sang M, Luo R, Bai Y, et al. Mitochondrial membrane anchored photosensitive nano-device for lipid hydroperoxides burst and inducing ferroptosis to surmount therapy-resistant cancer[J]. Theranostics, 2019, 9: 6209-6223. DOI:10.7150/thno.36283 |
| [32] |
Xu T, Ma Y, Yuan Q, et al. Enhanced ferroptosis by oxygen-boosted phototherapy based on a 2-in-1 nanoplatform of ferrous hemoglobin for tumor synergistic therapy[J]. ACS Nano, 2020, 14: 3414-3425. DOI:10.1021/acsnano.9b09426 |
| [33] |
Meng X, Li D, Chen L, et al. High-performance self-cascade pyrite nanozymes for apoptosis-ferroptosis synergistic tumor therapy[J]. ACS Nano, 2021, 15: 5735-5751. DOI:10.1021/acsnano.1c01248 |
| [34] |
Zhang Z, Ding Y, Li J, et al. Versatile iron-vitamin K3 derivative-based nanoscale coordination polymer augments tumor ferroptotic therapy[J]. Nano Res, 2020, 14: 2398-2409. |
| [35] |
Xu R, Yang J, Qian Y, et al. Ferroptosis/pyroptosis dual-inductive combinational anti-cancer therapy achieved by transferrin decorated nanoMOF[J]. Nanoscale Horiz, 2021, 6: 348-356. DOI:10.1039/D0NH00674B |
| [36] |
Beatty A, Singh T, Tyurina YY, et al. Conrad, conjugated linolenic fatty acids trigger ferroptosis in triplenegative breast cancer[J]. bioRxiv, 2019. DOI:10.1101/556084 |
| [37] |
Zhou Z, Song J, Tian R, et al. Activatable singlet oxygen generation from lipid hydroperoxide nanoparticles for cancer therapy[J]. Angew Chem, 2017, 129: 6592-6596. DOI:10.1002/ange.201701181 |
| [38] |
Zhang S, Wang Z, Kong Z, et al. Photosensitizer-driven nanoassemblies of homodimeric prodrug for self-enhancing activation and synergistic chemo-photodynamic therapy[J]. Theranostics, 2021, 11: 6019-6032. DOI:10.7150/thno.59065 |
| [39] |
Cheng J, Zhu Y, Xing X, et al. Manganese-deposited iron oxide promotes tumor-responsive ferroptosis that synergizes the apoptosis of cisplatin[J]. Theranostics, 2021, 11: 5418-5429. DOI:10.7150/thno.53346 |
| [40] |
Chen G, Yang Y, Xu Q, et al. Self-amplification of tumor oxidative stress with degradable metallic complexes for synergistic cascade tumor therapy[J]. Nano Lett, 2020, 20: 8141-8150. DOI:10.1021/acs.nanolett.0c03127 |
| [41] |
Bao W, Liu X, Lv Y, et al. Nanolongan with multiple on-demand conversions for ferroptosis-apoptosis combined anticancer therapy[J]. ACS Nano, 2019, 13: 260-273. DOI:10.1021/acsnano.8b05602 |
| [42] |
Mu M, Wang Y, Zhao S, et al. Engineering a pH/glutathione-responsive tea polyphenol nanodevice as an apoptosis/ferroptosis-inducing agent[J]. ACS Appl Bio Mater, 2020, 3: 4128-4138. DOI:10.1021/acsabm.0c00225 |
| [43] |
Xue CC, Li MH, Zhao Y, et al. Tumor microenvironment-activatable Fe-doxorubicin preloaded amorphous CaCO3 nanoformulation triggers ferroptosis in target tumor cells[J]. Sci Adv, 2020, 6: eaax1346.. DOI:10.1126/sciadv.aax1346 |
| [44] |
Zhu J, Dai P, Liu F, et al. Upconverting nanocarriers enable triggered microtubule inhibition and concurrent ferroptosis induction for selective treatment of triple-negative breast cancer[J]. Nano Lett, 2020, 20: 6235-6245. DOI:10.1021/acs.nanolett.0c00502 |
| [45] |
Zhou L, Dong C, Ding L, et al. Targeting ferroptosis synergistically sensitizes apoptotic sonodynamic anti-tumor nanotherapy[J]. Nano Today, 2021, 39: 101212. DOI:10.1016/j.nantod.2021.101212 |
| [46] |
Li J, Li JH, Pu YJ, et al. PDT-enhanced ferroptosis by a polymer nanoparticle with pH-activated singlet oxygen generation and superb biocompatibility for cancer therapy[J]. Biomacromolecules, 2021, 22: 1167-1176. DOI:10.1021/acs.biomac.0c01679 |
| [47] |
Xue C, Li M, Liu C, et al. NIR-actuated remote activation of ferroptosis in target tumor cells through a photothermally responsive iron-chelated biopolymer nanoplatform[J]. Angew Chem Int Ed Engl, 2021, 60: 8938-8947. DOI:10.1002/anie.202016872 |
| [48] |
He H, Du L, Guo H, et al. Redox responsive metal organic framework nanoparticles induces ferroptosis for cancer therapy[J]. Small, 2020, 16: e2001251. DOI:10.1002/smll.202001251 |
| [49] |
Chen Q, Ma X, Xie L, et al. Iron-based nanoparticles for MR imaging-guided ferroptosis in combination with photodynamic therapy to enhance cancer treatment[J]. Nanoscale, 2021, 13: 4855-4870. DOI:10.1039/D0NR08757B |
| [50] |
Wang W, Green M, Choi JE, et al. CD8+ T cells regulate tumour ferroptosis during cancer immunotherapy[J]. Nature, 2019, 569: 270-274. DOI:10.1038/s41586-019-1170-y |
| [51] |
Xiong H, Wang C, Wang Z, et al. Self-assembled nano-activator constructed ferroptosis-immunotherapy through hijacking endogenous iron to intracellular positive feedback loop[J]. J Control Release, 2021, 332: 539-552. DOI:10.1016/j.jconrel.2021.03.007 |
| [52] |
Hsieh CH, Hsieh HC, Shih FS, et al. An innovative NRF2 nano-modulator induces lung cancer ferroptosis and elicits an immunostimulatory tumor microenvironment[J]. Theranostics, 2021, 11: 7072-7091. DOI:10.7150/thno.57803 |
| [53] |
Zhang F, Li F, Lu GH, et al. Engineering magnetosomes for ferroptosis/immunomodulation synergism in cancer[J]. ACS Nano, 2019, 13: 5662-5673. DOI:10.1021/acsnano.9b00892 |
| [54] |
Jiang Q, Wang K, Zhang X, et al. Platelet membrane-camouflaged magnetic nanoparticles for ferroptosis-enhanced cancer immunotherapy[J]. Small, 2020, 16: e2001704. DOI:10.1002/smll.202001704 |
| [55] |
Yao X, Yang P, Jin Z, et al. Multifunctional nanoplatform for photoacoustic imaging-guided combined therapy enhanced by CO induced ferroptosis[J]. Biomaterials, 2019, 197: 268-283. DOI:10.1016/j.biomaterials.2019.01.026 |
| [56] |
Zhang J, Yang J, Zuo T, et al. Heparanase-driven sequential released nanoparticles for ferroptosis and tumor microenvironment modulations synergism in breast cancer therapy[J]. Biomaterials, 2021, 266: 120429. DOI:10.1016/j.biomaterials.2020.120429 |
 2022, Vol. 57
2022, Vol. 57


