免疫力(immunity) 是指机体识别和清除外来入侵抗原及体内突变或衰老细胞并维持机体内环境稳定能力的总称。免疫力是人体自身的防御机制, 不仅针对外来性的病原微生物, 包括细菌、病毒和结核等侵入体内起防御的作用, 而且具有清除体内自身衰老细胞、癌变细胞或变异细胞的能力。所以免疫力对人体的健康非常重要, 其与肿瘤的发生、发展与免疫监视及清除功能密切相关, 免疫失调促进了肿瘤的发生与发展。
1.2 肿瘤免疫编辑2002年, 美国肿瘤生物学家希雷伯(Schreiber) 提出“肿瘤免疫编辑” (cancer immunoediting) 的假说。肿瘤细胞在机体内发生与发展是一个免疫系统与癌变细胞相互作用的动态过程, 免疫系统在清除一些肿瘤细胞的同时, 也对另一些肿瘤细胞的生物学特性(如肿瘤的抗原性) 进行重塑(reshape), 亦即“免疫编辑”[1, 2]。
免疫系统与肿瘤的免疫编辑关系分为三种不同的状态: ①第一种状态称为“清除” (elimination)。在这个状态下, 由于新生的肿瘤具有较强的抗原性, 较易被免疫系统识别并将其清除; ②一些变异的肿瘤细胞逃过了免疫编辑的“清除”作用而存活下来, 与免疫系统进入“平衡” (equilibration) 状态, 表现为早期肿瘤状态, 不易被检测到。获得性特异免疫反应是维持这种平衡状态的主要机制; ③第二种平衡状态是动态的, 基因突变可将这种平衡打破, 使免疫系统与肿瘤的关系进入第三个状态, 即“逃逸” (escape) 阶段。在这个阶段的肿瘤细胞可以产生一系列恶性表型, 如不能表达主要组织相容性复合体(major histocompatibility complex, MHC) 分子, 或不能产生肿瘤肽, 使其逃脱免疫杀伤。
此外, 肿瘤细胞的凋亡信号通路会发生变化, 使免疫细胞诱导的肿瘤细胞凋亡机制失效。同时, 肿瘤细胞快速生长形成的肿瘤会产生一个抑制免疫细胞的微环境, 在这个微环境中, 肿瘤细胞会释放一些具有免疫抑制功能的分子, 如转化生长因子β[3]、白细胞介素-10 (interleukin-10, IL-10)[4]等, 并能诱导产生表达细胞毒性T淋巴细胞相关分子4 (cytotoxic T-lymphocyte-associated protein 4, CTLA-4) 的调节T细胞, 对其他免疫细胞产生抑制作用, 导致免疫系统产生对肿瘤的免疫耐受, 肿瘤生长完全失控并广泛转移。
1.3 肿瘤免疫治疗肿瘤免疫治疗是指通过重新启动或激活人体免疫力, 恢复机体正常的抗肿瘤免疫反应, 从而控制与清除肿瘤的一种治疗方法, 包括单克隆抗体类免疫检查点抑制剂、治疗性抗体、癌症疫苗、细胞治疗和小分子抑制剂等。
近年来, 肿瘤免疫治疗已在多种肿瘤如黑色素瘤、非小细胞肺癌、肾癌和前列腺癌等实体瘤的治疗中展现出强大的抗肿瘤活性, 多个肿瘤免疫治疗药物已经获得美国食品药品监督管理局(Food and Drug Administration, FDA) 批准应用于临床。第1个实现临床应用的免疫检查点抗体药物是抗CTLA-4分子的单克隆抗体伊匹单抗(ipilimumab), 2011年获得美国FDA批准。2014年, FDA批准两个抗程序性死亡受体1 (programmed cell death protein 1, PD1) 单抗派姆单抗(pembrolizumab) 和纳武单抗(nivolumab) 上市, 抗细胞程序性死亡受体配体1 (programmed cell death 1 ligand 1, PDL1) 单抗阿特珠单抗(atezolizumab) 在2016年获批上市。
2 肿瘤免疫检查点治疗及其作用机制 2.1 抑制消极免疫调节机制日本京都大学医学院免疫学家本庶佑(Tasuku Honjo) 首次克隆并报道了PD1, 并证实PDL1可与PD1结合而抑制T细胞的功能。美国德克萨斯大学安德森癌症中心医学博士詹姆斯·艾利森(James Allison) 率先提出免疫检查点的概念, 首次在小鼠体内证实CTLA-4抗体的抗肿瘤作用。这两项发现共同促进了“抑制消极免疫调节机制”的肿瘤新疗法的产生[5], 即PD1/PDL1治疗策略。二人共同获得2018年诺贝尔生理学或医学奖。至此, 这种变革性免疫疗法改变了传统的癌症治疗格局, 其在提高晚期转移性癌症患者的总体生存率方面取得了巨大的成功。
2.2 肿瘤免疫检查点治疗免疫检查点疗法通过阻断或刺激这些免疫通路来发挥作用, 增强人体免疫系统对肿瘤的抑制或杀伤活性。目前, 表现最为突出、被广泛研究和认识的免疫治疗靶点为PD1、PDL1、CTLA-4及CD47。利用这些靶点开发出的治疗方法在非小细胞肺癌、黑色素瘤和头颈部鳞状细胞癌等肿瘤中显示出前所未有的疗效。多种新的抑制消极免疫通路正在研究: ① T细胞相关的通路: 淋巴细胞活化基因-3 (lymphocyte-activation gene 3, LAG3)[6]、T细胞免疫球蛋白-3 (T cell immunoglobulin mucin-domain protein 3, TIM3)[7]、免疫受体酪氨酸抑制位点结构域蛋白T细胞免疫受体(T cell immunoglobulin and immunoreceptor tyrosine-based inhibitory motif domain, TIGIT)[8]、T细胞活化的V域Ig抑制因子(V-domain Ig suppressor of T cell activation, VISTA)[9]、B7 homolog 3 (B7-H3)[10]、adenosine A2a receptor (A2aR)[11]、CD73[12]、B和T细胞淋巴细胞衰减器(BTLA)[13]等; ②非T细胞相关的通路: 转化生长因子β (transforming growth factor beta, TGF-β)[14]、杀伤免疫球蛋白样受体(killer immunoglobulin-like receptors, KIRs)[15]、磷脂酰肌醇3-激酶的γ异构体(phosphoinositide 3-kinase gamma, PI3Kγ)[16]和CD47[17]等; ③其他免疫相关通路: toll样受体(toll-like receptors, TLRs)[18]、吲哚胺2, 3-双加氧酶抑制剂(indoleamine 2, 3-dioxygenase, IDO)[19]和白介素-2受体(interleukin 2 receptor, IL-2 receptor)[20]。
2.3 PD1/PDL1免疫检查点治疗作用机制T细胞表面有一种名为PD1的蛋白。正常人体细胞的表面会表达PDL1蛋白。T细胞表面的PD1蛋白和正常细胞表面的PDL1蛋白结合后, 二者能够和谐相处、互不伤害。但是, 一旦出现肿瘤细胞, 其表面没有PDL1蛋白, T细胞便将不表达PDL1蛋白的肿瘤细胞识别并杀伤, 这是T细胞识别并杀伤肿瘤细胞的作用机制。
然而, 很多肿瘤细胞会进化, 在其表面也能很快表达PDL1蛋白, 类似于“伪装”成正常体细胞, 也可以与T细胞上PD1结合, 试图逃过T细胞对其免疫监视和杀伤作用。PD1/PDL1免疫治疗正是利用这个特点, 采取免疫检查点阻断策略: ① PD1免疫检查点阻断治疗, 利用PDL1蛋白药物与T细胞表面PD1受体结合, 从而阻断了T细胞PD1与肿瘤细胞PDL1结合, 使得T细胞能够重新识别并杀伤肿瘤细胞; ② PDL1免疫检查点阻断治疗, 利用PD1蛋白药物与肿瘤细胞PDL1结合, 阻断了T细胞PD1与肿瘤细胞PDL1结合, 使得T细胞能够重新识别并杀伤肿瘤细胞(图 1)。
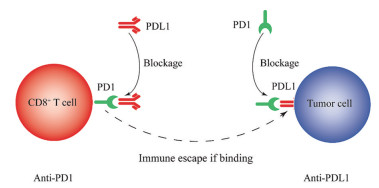
|
Figure 1 Mechanisms of programmed cell death protein 1 (PD1) and programmed cell death 1 ligand 1 (PDL1) immune checkpoint therapy |
肿瘤微环境中有许多免疫抑制分子存在, 通过调节这些抑制分子的功能进而改善肿瘤免疫微环境的免疫治疗策略也受到了重视。
CTLA-4是白细胞分化抗原, T细胞(胸腺依赖性淋巴细胞) 上的一种跨膜受体, 能调控T细胞功能, 其作用机制是通过与抗原细胞表面的受体结合, 从而起到开关作用, 终止免疫反应。而CTLA-4抑制剂通过抑制CTLA-4分子, 则能使T细胞大量增殖、攻击肿瘤细胞, 起到抗肿瘤效应(图 2)。
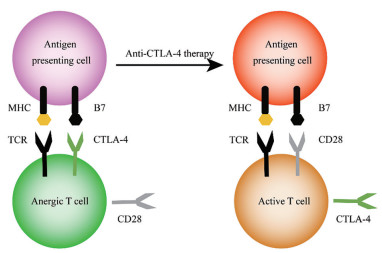
|
Figure 2 Mechanism of cytotoxic T-lymphocyte-associated protein 4 (CTLA-4) immune checkpoint therapy. MHC: Major histocompatibility complex; TCR: T cell receptor |
免疫检查点CD47在多种恶性肿瘤细胞表面过表达, 其与信号调节蛋白α (signal regulatory protein α, SIRPα) 相互作用, 作为“别吃我”的信号, 抑制抗原呈递细胞(antigen-presenting cells, APCs) 对肿瘤细胞的吞噬作用。利用CD47阻断剂可以有效地发挥抗肿瘤效应。
IDO是一种色氨酸降解酶, 能将色氨酸转化为犬尿氨酸。犬尿氨酸能促进Treg的分化和活性, 降低CD8 T细胞的数量和活性, 导致免疫抑制环境的恶化。IDO抑制剂能调节肿瘤微环境中色氨酸的含量, 避免肿瘤微环境中T细胞增殖受抑制, 成为潜在的免疫治疗策略。
3 免疫检查点治疗的临床应用及其药物 3.1 PD1/PDL1治疗的临床应用免疫治疗新药PD1抑制剂成功上市, 用于难治性晚期非小细胞肺癌治疗, 患者的5年生存率提高了4倍(4%升到16%), 用于晚期黑色素瘤治疗, 患者5年生存率也提高了近4倍(10%升到38.7%)[21]。目前, PD1/PDL1治疗已被批准用于15种以上的晚期实体瘤和血液瘤的治疗, 如黑色素瘤、非小细胞肺癌、乳腺癌、卵巢癌、肝癌、膀胱癌、尿路上皮癌、霍奇金淋巴瘤、结肠癌、前列腺癌、头颈癌、宫颈癌、肾癌、皮肤鳞状细胞癌和胃癌等。
3.2 PD1/PDL1治疗药物目前, 已上市PD1/PDL1治疗药物主要有两种类型: ① PD1免疫检查点阻断治疗药物; ② PDL1免疫检查点阻断治疗药物。
3.2.1 PD1免疫检查点阻断治疗药物利用PDL1蛋白药物, 使之与T细胞上PD1结合, 从而阻断肿瘤上PDL1与T细胞上PD1结合。治疗药物包括: ①纳武单抗, 一种人源化IgG4抗PD1单抗, 2015年FDA批准用于治疗非小细胞肺癌; ②派姆单抗, 一种人源化IgG4 kappa抗PD1单抗, 2014年FDA批准了用于治疗转移性黑色素瘤; ③西米普利单抗(cymplimab), 一种抗PD1单抗, 最近获FDA的批准专用于晚期皮肤鳞状癌治疗。
3.2.2 PDL1免疫检查点阻断治疗药物利用PD1蛋白药物, 使之与肿瘤上PDL1结合, 从而阻断T细胞上PD1与肿瘤细胞上PDL1结合。治疗药物包括: ①阿特珠单抗, 一种人源化IgG1单抗, 2016年FDA批准用于治疗尿路上皮癌PDL1抑制剂, 对肾癌、膀胱癌和乳腺癌等有效; ②阿维单抗(avelumab), 一种完全人源性抗PDL1的IgG1单抗。目前, FDA已接受阿维单抗用于治疗转移性默克尔细胞癌许可申请, 2021年1月欧盟批准其用于晚期尿路上皮癌治疗。
此外, PD1/PDL1治疗也与其他免疫抑制剂联合应用, 如PD1单抗和CTLA-4抑制剂联用, 用于黑色素瘤、肾癌、直肠癌、肝癌、非小细胞肺癌和胃癌等治疗。表 1[1, 22-24]总结了目前经FDA批准的抗PD1/PDL1治疗药物。
| Table 1 Summary of anti-PD1 and anti-PDL1 antibodies approved by the FDA. NSCLC: Non-small cell lung cancer; HCC: Hepatocellular carcinoma; HNSCC: Head and neck squamous-cell carcinoma; CSCC: Cutaneous squamous cell carcinoma; RCC: Renal cell carcinoma; TNBC: Triple-negative breast cancer; MCC: Merkel cell carcinoma; FDA: Food and drug administration |
尽管科学家提出多种方法, 使得免疫检查点抑制治疗取得了很大的成功, 但是只在有限数量的患者中表现出持续的临床治疗响应, 还有部分患者在初始治疗就对免疫治疗不敏感(原发性耐药) 或在疾病缓解一段时间后快速出现疾病的进展(获得性耐药)。
4.1 原发性免疫耐药性 4.1.1 肿瘤免疫原性不足PD1/PDL1阻断治疗所产生的抗肿瘤效果, 依赖于肿瘤微环境中抗原特异性T细胞响应性, 这需要树突状细胞(dendritic cells, DC) 呈递抗原、激活CD8+ T细胞和触发抗肿瘤活性。原发性树突状细胞、CD8+ T细胞激活不足, 导致PD1/PDL1治疗免疫耐药。采用适宜干预措施以增强肿瘤的免疫原性, 可提高PD1/PDL1治疗对肿瘤的免疫杀伤能力[25]。
4.1.2 原发性免疫功能障碍免疫功能障碍的形式有主要组织相容性复合体I (major histocompatibility complex I, MHC I) 功能障碍、干扰素γ (interferon γ, IFN-γ) 信号通路受损、丝裂原激活的蛋白激酶(mitogen-activated protein kinase, MAPK) 信号通路障碍等。
例如, MHC I功能障碍指在MHC I复合体失活的情况下, 肿瘤可逃脱T细胞的杀伤作用, 进而抵抗PD1/PDL1治疗[26]。肿瘤可通过引起B2M突变使MHC I复合体失活。通过PD1/PDL1阻断与过继性细胞联合治疗措施, 可增加T细胞的浸润和细胞毒性, 从而打破MHC I功能障碍。
又如, IFN-γ信号通路抑制指在某些高突变肿瘤中IFN-γ通路上游激酶JAK1/2突变, 而造成PD1/PDL1治疗耐药性, 其机制与部分被异常激活的IFN-γ基因(如CD274) 有关, 导致T细胞对肿瘤特异性杀伤效应降低[27]。通过PD1/PDL1与其他疗法联合, 如通过附加靶向BRAF基因突变, 可使得T细胞浸润和IFN-γ信号通路增强, 从而增强治疗效果[28]。
4.1.3 T细胞不可逆耗竭T细胞耗竭被认为是由于肿瘤抗原和肿瘤微环境长期免疫抑制而导致的一种功能失调状态[29]。耗尽的CD8+ T细胞表达多种抑制性受体, 包括PD1、T细胞免疫球蛋白和TIM3、LAG3和CTLA-4。抗PD1/PDL1抗体只能克服肿瘤微环境中的部分抑制信号, 而该环境中存在更多的其他抑制因子, 最终导致T细胞的功能丧失性耗竭[30]。
4.2 获得性免疫耐药性 4.2.1 免疫代偿性变化针对PD1或PDL1的免疫治疗只能阻断许多免疫检查点中的一个, 但肿瘤仍有可能通过激活额外的抑制信号或上调PDL1的表达来逃避免疫治疗。在抗PD1/PDL1治疗中, 产生耐药性的肿瘤常会伴有其他信号表达的上升, 这使得耐药机制发生代谢改变, 从而限制了PD1/PDL1疗效的持续性, 最终产生获得性耐药[31, 32]。
4.2.2 免疫治疗脱靶免疫靶向性不强是指通过静脉注射的PD1、PDL1蛋白药物, 在血液循环途中损失(被单核细胞吞噬)、或少量抗体药物到达目标位置后, 与治疗靶点结合性能弱, 难以达到有效剂量的PD1与PDL1结合, 从而降低了治疗效果, 导致免疫耐药, 产生免疫治疗脱靶。
4.2.3 诱发性免疫功能障碍诱发性免疫功能障碍往往是由于不足剂量的PD1/PDL1治疗导致的, 低剂量治疗诱发肿瘤细胞过度表达PDL1蛋白, 最终肿瘤细胞的PDL1蛋白通过与T细胞的PD1结合产生了免疫逃逸, 导致了与原发性免疫功能障碍相似的症状[33]。
4.3 逆转免疫耐药的策略针对肿瘤的免疫耐药现象, 科研人员将PD1/PDL1治疗与其他策略相结合实现了更好的临床结果[34, 35]。目前, 联合治疗策略主要集中在提高T细胞效应、逆转T细胞衰竭、增加T细胞浸润、改善T细胞功能及改善免疫抑制微环境等(表 2)[36-63]。
| Table 2 Strategies for overcoming anti-PD1/PDL1 resistance. T-VEC: Talimogene laherparepvec; HLA: Human leukocyte antigen; HMB: Melanoma marker (HMB45); NY-ESO-1: New york esophageal squamous cell carcinoma 1; GBM: Glioblastoma multiforme; PI3K: Phosphatidylinositol-3-kinase; TGF-β: Transforming growth factor beta; ICB: Immune checkpoint blockade; IDO: Indoleamine 2, 3-dioxygenase |
DNA编码的单克隆抗体(DNA-encoded monoclonal antibody, DMAb) 是一种序列优化的DNA编码质粒, 在进入人体后可提供遗传信息, 使患者自身产生治疗性单克隆抗体, 主动表达抗体蛋白。这种基于质粒载体表达抗体药物的方法, 可以改善目前免疫检查点药物制备复杂, 给药次数频繁的局限性。Duperret等[64]开发了一种用于体内递送抗CTLA-4单克隆抗体的DMAb技术平台, 其将经过精巧设计的可编码DMAb的质粒直接注射到肌肉中, 用电穿孔的方法将质粒电转入细胞内, 使质粒在细胞内能够稳定高效表达, 并将表达产物抗CTLA-4单克隆抗体分泌至胞外, 发挥其生物学效应, 其设计的单克隆抗体氨基酸序列来自于已公开的专利及数据库。对核苷酸序列进行了密码子的优化, 以增强质粒在哺乳动物中的表达。结果表明, 单剂量的工程化DMAb即可有效驱动抗CTLA-4单克隆抗体在体内表达, 并可持续表达数月而无需重复给药。同时, DMAb能够诱导有效的抗肿瘤免疫反应, CD8+ T细胞浸润明显增加, Treg细胞数量减少。
5.1.2 病毒载体RNA干扰(RNAi) 可有效沉默目的基因的表达。其中, 小干扰RNA (siRNA) 在转录水平上诱导靶mRNA降解是一种主要的沉默机制。但是外源siRNA的体内递送面临着表达时间短、易引发免疫不良反应的问题。研究证实, 基于人体内源性的miRNA-30, 将其部分序列用shRNA的双臂结构替换, 可尽可能地模拟体内正常情况而得到miRshRNA, 可以发挥与siRNA一样的功效。利用逆转录病毒复制载体(retroviral replicating vectors, RRV) 可将外源的遗传信息稳定地整合到宿主细胞的基因组中, 以减少脱靶的风险。基于此, Lin等[65]设计了一种由Pol II/III启动子可下调PDL1表达的逆转录病毒复制体系RRV-miRPDL1。结果显示, 该体系能够有效复制, 并且在PDL1高表达的细胞系中高效发挥基因沉默功能, 使PDL1蛋白表达下调量超过75%。对RRV-miRPDL1进行免疫学效应的评估, 体外数据显示, 与直接静脉注射PDL1免疫检查点抑制剂相比, 两种疗法均可以激活CD8+ T细胞, 恢复其生物学效能, 引发抗肿瘤免疫反应。因此, 逆转录病毒复制体系RRV-miRPDL1可作为PD1/PDL1免疫检查点抑制剂的潜在替代疗法。
腺相关病毒(adeno-associated virus, AAV) 载体作为高效的基因体内递送载体之一, 因缺乏对肿瘤细胞的靶向选择性而大大限制了其实际应用。Reul等[66]提出一种新的病毒载体修饰策略, 即将配体蛋白DARPins的基因序列与病毒衣壳蛋白VP2的基因序列融合, 并使该融合蛋白成功在病毒衣壳上表达。因其配体蛋白DARPins与Her2/neu+的乳腺癌细胞具有高亲和力而发生相互作用, 从而赋予病毒递送载体靶向于肿瘤细胞的特性。将免疫检查点抑制剂PD1的序列编码进病毒载体中, 构建Her2-AAV-PD1递送体系。在小鼠体内成像实验证实, 静脉给药后Her2-AAV-PD1可以特异性地靶向至肿瘤组织, 并显著降低在肝脏中的蓄积。单次给予Her2-AAV-PD1即可控制肿瘤生长, 并显著延长小鼠生存期。若将Her2-AAV-PD1与化学疗法联用, 则可进一步地延缓小鼠的肿瘤生长, 发挥更强的抗肿瘤功效。
5.1.3 细菌载体减毒沙门氏菌因具有自发在肿瘤缺氧部位富集的趋向性, 而被视为是一种优良的基因递送载体。Zhao等[67]将免疫检查点抑制剂PD1的siRNA序列插入到减毒沙门氏菌中, 利用细菌载体的潜在优越性, 将PD1-siRNA靶向递送到肿瘤区域, 当其与小分子药物匹莫齐特联合使用时, 既可诱导细胞发生凋亡, 亦能增强免疫功能, 进而发挥显著的抗肿瘤功效。
Gurbatri等[68]通过计算机模型优化了影响细菌裂解过程的参数, 使质粒基因能够在菌体中保持稳定, 避免突变事件的发生, 同时能够保持持续分泌蛋白的能力。当细菌在肿瘤部位繁殖达到种群临界密度时, 便可自动裂解释放PDL1和CTLA-4纳米抗体。与目前临床上所使用的抗体相比, 这种工程化细菌递送系统单次注射后即可产生较强的免疫反应。当其给药后, 可观察到小鼠全身性免疫反应增强, 如活化T细胞数目增加、全身记忆T细胞亚群数目增加和可产生远端免疫效应。并近一步将该纳米抗体与细胞因子、粒细胞-巨噬细胞集落刺激因子等其他免疫疗法联用, 发现可大大增强对小鼠的抗肿瘤治疗效果。
5.1.4 脂质纳米载体Oberli等[69]报告了一种用脂质纳米粒包载编码肿瘤相关抗原gp100和TRP2的mRNA的疫苗递送平台。固体脂质纳米粒包括可电离脂质、磷脂、胆固醇、含脂质的聚乙二醇及其他组成成分。可电离的脂质在低pH值时带正电, 可与带负电的mRNA缩合, 并有助于被肿瘤细胞摄取和从内涵体中逃逸。磷脂和胆固醇对于纳米粒的稳定性至关重要, 而聚乙二醇化的脂质可防止纳米粒聚集, 有助于其在体内的生物分布, 并减少粒子间的非特异性相互作用。在侵袭性B16F10黑色素瘤小鼠模型中测试了该固体脂质纳米粒载体疫苗的功效, 单次免疫后即可观察到大量的CD8+ T细胞被激活, 小鼠肿瘤体积显著缩小, 荷瘤小鼠总体存活率显著升高。
如何提高肿瘤组织的淋巴细胞浸润、增强肿瘤细胞对免疫检查点抑制剂的敏感性是提高免疫检查点药物治疗效果的关键。Song等[70]将免疫检查点PD1的胞外结构域通过铰链接头与软骨基质蛋白中的三聚体结构相融合, 设计得到了一种与肿瘤细胞表面的PDL1蛋白具有极高反应性的PDL1捕获蛋白(PD-L1 trap)。与市售的PDL1抗体相比, PD-L1 trap同PDL1的亲和力提高了1 000多倍。为实现该三聚体捕获蛋白在肿瘤组织中的特异性表达, 将PD-L1 trap质粒与阳离子鱼精蛋白缩合, 形成微阴离子核心, 再用阳离子的固体脂质纳米粒进行包被进行药物递送。在这项研究中, 研究人员采用的固体脂质纳米粒的材料主要包括(2, 3-二油酰基-丙基)-三甲基氯化铵(1, 2-dioleoyl-3-trimethylammonium-propane chloride, DOTAP)、胆固醇和二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000-氨乙基茴香酰胺(1, 2-distearoyl-sn-glycero-3-phosphoethanolamine-N-methoxy polyethyleneglycol2000-aminoethylanisamide, DSPE-PEG2000-AEAA)。氨乙基茴香酰胺(AEAA) 配体的修饰可实现纳米粒对肿瘤组织的进一步靶向性, 将该固体脂质纳米粒与奥沙利铂联用, 在小鼠的肿瘤部位观察到了PD-L1 trap的显著表达, 展现出良好的抗肿瘤免疫治疗效果。
5.2 免疫检查点抑制剂蛋白药物的递送策略 5.2.1 工程化囊泡载体基于生物工程策略的天然细胞膜工程化囊泡, 在生物医学领域展现出极大的优势。Zhang等[71]将含有DsRed蛋白标签的小鼠PD1蛋白cDNA序列克隆到质粒中, 并能在哺乳动物体内表达PD1蛋白。将该质粒转染至HEK 293T细胞以建立稳定的细胞系, 培养并裂解HEK 293T细胞以分离其细胞膜, 经聚碳酸酯膜的连续挤压, 即可得到表达PD1蛋白的工程化细胞纳米囊泡(PD1 NVs)。PD1 NVs通过阻断PD1/PDL1免疫抑制通路, 可有效恢复CD8+ T细胞的免疫力耗竭, 以增强抗肿瘤免疫反应。此外, PD1 NVs还可以作为其他治疗药物的递送载体进行联合给药。例如, 将IDO小分子抑制剂1-甲基-色氨酸(1-MT) 封装到PD1 NVs中, 可显著增强抗肿瘤免疫效应。IDO是一种必需氨基酸代谢的限速酶, 主要催化色氨酸降解为犬尿氨酸。当肿瘤微环境中色氨酸含量减少可抑制T细胞的分化增殖而抑制其免疫功能, 而犬尿氨酸的增多也抑制T细胞的免疫功能。因此, 将1-MT通过PD1 NVs递送到体内, 可抑制IDO活性, 减少色氨酸的降解以增强T细胞的分化增殖, 并且, PD1 NVs囊泡载体自身也发挥PD1单抗治疗效应, 从而可实现协同肿瘤免疫治疗效应。
对于实体瘤的治疗, 目前临床上仍然以手术根除为首选。然而, 手术治疗常常面临着局部复发和远端转移的问题, 需要采取一定的巩固治疗措施。而免疫检查点抑制剂因在多种恶性肿瘤的治疗中都得到了良好的治疗效果, 而被视为一种较为理想的术后巩固治疗新方法。基于此, Zhang等[72]对巨核细胞细胞(MK) 进行基因工程改造, 使其可以稳定表达PD1蛋白, 得到PD1-MK。PD1-MK可以在体外持续大量分泌成熟血小板, 该血小板膜上携带有PD1蛋白。表达PD1蛋白的血小板可以在肿瘤切除手术的伤口处积聚, 提高肿瘤组织中CD8+ T细胞的浸润, 从而根除手术中残留的肿瘤细胞。此外, 表达PD1蛋白的血小板还可以作为药物递送载体, 包载并运输低剂量的环磷酰胺, 进一步消耗肿瘤微环境中的Tregs数量, 从而降低肿瘤的复发率。
5.2.2 微针贴片载体透皮微针贴片应用于原发于皮肤表面的肿瘤治疗时具有显著的优势, 可以无痛地穿透皮肤, 将药物递送到肿瘤细胞内部。基于此, Wang等[73]报告了一种自降解微针贴片, 可以生理可控的方式持续递送免疫检查点抑制剂PD1。其微针是由生物相容性材料透明质酸与pH敏感的葡聚糖纳米粒组成, 微针内可同时包载PD1和葡萄糖氧化酶。葡萄糖氧化酶可将血液中的葡萄糖转化为葡萄糖酸, 进而促进微针中纳米粒的自解聚, 释放出其中携载的PD1蛋白。与非降解型微针制剂或直接瘤内注射游离PD1相比, 单次施用该微针贴片, 即可在荷黑色素瘤小鼠体内诱导强烈的免疫反应。并且, 这种递送策略可以与其他免疫调节剂(抗CTLA-4单克隆抗体) 联用, 以进一步提高抗肿瘤疗效。
Ye等[74]开发了一种微针贴片协同免疫治疗策略, 即通过微针局部靶向递送免疫检查点抑制剂PD1和IDO抑制剂1-MT, 用以治疗黑色素瘤。微针内部由表面修饰有1-MT的透明质酸纳米粒组成, PD1蛋白则嵌入在透明质酸纳米粒内部。这种以一种药物为载体递送另一种药物的微针贴片组合递送方式, 有利于提高治疗药物的负载能力。研究显示, 在黑色素瘤荷瘤小鼠模型中, 该微针贴片能够激活T细胞免疫能力、解除免疫抑制, 发挥较强效的抗肿瘤功效。
5.2.3 水凝胶载体虽然, PD1/PDL1阻断疗法在多种肿瘤治疗中显示出强大的治疗功效, 但是仍有一些肿瘤如晚期黑色素瘤, 因肿瘤相关抗原表达量较低而对该阻断疗法的治疗响应性较低。为此, 补充表观遗传调节剂如低甲基化剂(hypomethylation agents, HMA) 可以通过诱导肿瘤相关抗原的表达来增强抗肿瘤免疫反应。Ruan等[75]设计了一种双生物响应凝胶库, 用于免疫检查点抑制剂PD1和低甲基化调节剂zebularine的共同递送。该凝胶库在肿瘤微环境的酸性和高活性氧条件下, 可自发释放药物。凝胶库先用pH敏感的碳酸钙纳米粒包载PD1蛋白, 再将其与zebularine一起封装在活性氧(reactive oxygen species, ROS) 响应性水凝胶中。水凝胶材料由聚乙烯醇(polyvinyl alcohol, PVA) 和ROS响应性接头N1-(4-溴苄基)-N3-(4-溴苯基)-N1, N1, N3, N3-四甲基丙烷-1, 3-二胺交联而成。结果表明, 这种以水凝胶为载体免疫蛋白药物递送策略, 可增加黑色素瘤细胞的免疫原性, 并且有助于逆转病理微环境中的免疫抑制状况, 可显著抑制肿瘤生长并延长黑色素瘤荷瘤小鼠的生存期。
Song等[76]开发了一种可注射的聚乙二醇-b-聚(L-丙氨酸) 水凝胶, 用于肿瘤疫苗和双重免疫检查点抑制剂的共同递送, 以提高肿瘤免疫治疗效果。肿瘤疫苗由肿瘤细胞裂解物和粒细胞-巨噬细胞集落刺激因子组成。肿瘤疫苗在体内可持续性地招募并激活树突状细胞, 引发特异性的CD8+ T细胞反应。同时, 水凝胶中还包含两种免疫检查点抑制剂抗PD1单克隆抗体和抗CTLA-4单克隆抗体, 能够阻断肿瘤的免疫抑制通路, 激活对肿瘤免疫治疗效应。从结果上看, 单独使用疫苗或疫苗与单一的免疫检查点抑制剂联用, 都不能取得同样良好的抗肿瘤治疗效果。因此, 这种基于多肽的水凝胶递送体系可用作疫苗和双重免疫检查点抑制剂的递送载体, 为肿瘤治疗提供一种联合免疫治疗方法。
5.2.4 血小板载体血小板在体内的半衰期一般长达8~9天, 以血小板为免疫治疗蛋白药物的递送载体, 可显著改善蛋白药物的药代动力学行为, 并且, 血小板具有自发向伤口部位聚集、识别肿瘤循环细胞的能力, 以抑制肿瘤转移。受此启发, Wang等[77]将免疫检查点抑制剂PDL1通过马来酰亚胺基团共价连接到血小板表面, 利用血小板的天然特性, 主动靶向术后残余的肿瘤细胞, 以减少肿瘤手术切除后复发和转移的可能性。研究显示, 在荷黑色素瘤和三阴性乳腺癌的小鼠原位肿瘤模型上, PDL1药物可以从被激活的血小板上实现有效释放, 显著抑制肿瘤生长, 延长手术后小鼠的总体存活率, 并降低肿瘤转移扩散的风险。
对于复发性的急性髓系白血病的治疗, 临床上常采用造血干细胞移植策略, 虽然该策略取得了一定的治疗效果, 也往往会产生严重的免疫排斥反应。为此, 研究人员尝试免疫检查点抑制剂PD1/PDL1治疗策略以治疗急性髓系白血病。Hu等[78]报告了一种可全身性输送免疫检查点抑制剂PD1的仿生化血小板载体, 该载体通过点击化学反应, 将血小板与造血干细胞相连接, 进一步再将PD1共价连接在血小板膜上。静脉注射到白血病小鼠体内后, 该仿生制剂可迁移到骨髓处并局部释放PD1蛋白药物, 可提高T细胞活性、增加细胞因子及趋化因子的数量, 从而增强了抗白血病免疫反应。结果表明, 该仿生化血小板载体载药系统并可显著延长小鼠的生存期, 有效对抗白血病的复发。
5.2.5 复合物载体Sima等[79]合成了一种生物可降解的聚合物材料pLHMGA (polylactic-co-hydroxymethyl-glycolic acid), 相比于其骨架材料PLGA (polylactic-co-glycolic acid), pLHMGA更具亲水特性, 其可在降解时保护内部的蛋白多肽药物免于被酸性环境损害。使用溶剂蒸发法制备聚合物微粒, 获得多孔性聚合物微粒(12~15 μm), 该微粒可避免被巨噬细胞吞噬。微粒中包载两种不同的免疫调节性抗体, 抗CTLA-4抑制剂和CD40激动剂, 两种抗体的包载效率均可达85%以上。体外释放研究表明, 载有抗体的聚合物微粒在前0.5 h存在突释现象, 释放出20%的药物, 然后在30天内缓慢持续释放, 总释放量可达80%。在荷结肠癌小鼠模型中, 微粒复合物载体制剂表现出良好的抗肿瘤功效, 显著延长荷瘤小鼠的生存期。并且, 该微粒复合物可生物降解, 在体内被完全吸收。
基于肿瘤微环境中某些酶类高表达的特征, Wang等[80]设计了一种包载免疫检查点抑制剂PDL1的酶响应型纳米复合物载体, 以抑制免疫耐受性、防止肿瘤复发和转移。利用MMP-2响应性氨基酸片段, 将聚乙二醇长链和儿茶酚二聚体偶联, 然后再将偶联后的聚合物纳米粒与光敏剂吲哚菁绿和PDL1蛋白一同孵育, 自组装得到纳米复合物。该纳米复合物可在血液循环中逃避网状内皮系统的摄取、特异性富集于肿瘤组织, 并在肿瘤微环境中MMP-2酶的触发下, 释放PDL1蛋白药物。同时, 纳米复合物中的吲哚菁绿还可进一步介导光动力疗法所引发的抗肿瘤功效。基于免疫检查点抑制和光动力疗法的联合治疗, 可解除肿瘤的免疫抑制、促使肿瘤细胞发生免疫原性细胞死亡和激活抗肿瘤免疫应答, 可显著延长三阴性乳腺癌荷瘤小鼠的生存期、提高抗肿瘤效果。这种纳米复合物是一种具有普适性的免疫检查点递送载体, 有望实现多种免疫检查点抑制剂的高效递送、抑制免疫检查点阻断疗法的免疫耐受性。表 3[3, 4, 6-20]总结了各种药物载体及其优缺点。
| Table 3 Summary of advantages and drawbacks of delivery systems for agents of tumor immune checkpoint therapy |
本文对肿瘤免疫检查点治疗及其药物递送策略进行了综述和评述: ①免疫力与肿瘤治疗: 免疫力是人体重要的自身防御机制, 免疫失调会促进肿瘤的发生与发展。免疫编辑理论阐述了机体免疫系统与癌变细胞相互作用的动态过程; ②免疫检查点治疗及其作用机制: 抑制消极免疫调节机制的发现促进了肿瘤免疫检查点治疗策略的发展, 而肿瘤免疫检查点治疗策略则变革了传统的癌症治疗策略; ③免疫检查点治疗的临床应用及其药物: 以PD1/PDL1和CTLA-4为主的肿瘤免疫检查点治疗明显提高了患者的总体生存率, 目前至少在15种以上的肿瘤类型中表现出优于传统治疗策略的疗效。已上市PD1/PDL1治疗药物, 主要有两种类型, 包括PD1免疫检查点阻断治疗药物和PDL1免疫检查点阻断治疗药物; ④ PD1/PDL1治疗的免疫耐药性与对策: 免疫检查点治疗策略也面临新的挑战, 主要包括原发性免疫耐药性和获得性免疫耐药性。原发性免疫耐药与肿瘤免疫原性不足、原发性免疫功能障碍和T细胞不可逆耗竭有关, 而获得性免疫耐药性则与免疫代偿性变化、免疫治疗脱靶和诱发性免疫功能障碍有关。当前, 应对免疫耐药性的临床策略以连用其他药物为主; ⑤免疫检查点治疗药物的递送策略: 免疫检查点抑制剂基因药物的递送策略主要有基因重组质粒、病毒、细菌和脂质纳米粒为载体, 免疫检查点抑制剂蛋白药物的递送策略主要有工程化囊泡、微针贴片、水凝胶、血小板和复合物载体。
综上所述, 肿瘤免疫检查点治疗是一种变革性的免疫治疗新策略, 其在多种类型肿瘤治疗中同比表现出明显的治疗优效。虽然如此, 肿瘤免疫检查点治疗也面临很大的挑战, 即免疫治疗耐药性。随着肿瘤免疫检查点治疗新机制的不断发现, 新的治疗药物及其递送策略的不断研发, 可望进一步大幅度提升其临床疗效。
作者贡献: 本文以李佩珊、刘懿萱和谢英为并列第一作者, 承担文献研究和文章撰写, 任钰歆、陈铭和王桂玲参与研讨、撰写及图表制作, 由吕万良指导并修订完成。
利益冲突: 本文的作者和所涉及的内容不存在潜在的利益冲突。
| [1] |
Dunn G, Bruce A, Ikeda H, et al. Cancer immunoediting: from immunosurveillance to tumor escape[J]. Nat Immunol, 2002, 3: 991-998. DOI:10.1038/ni1102-991 |
| [2] |
O'Donnell J, Teng M, Smyth M. Cancer immunoediting and resistance to T cell-based immunotherapy[J]. Nat Rev Clin Oncol, 2019, 16: 151-167. DOI:10.1038/s41571-018-0142-8 |
| [3] |
Haque S, Morris JC. Transforming growth factor-β: a therapeutic target for cancer[J]. Hum Vaccin Immunother, 2017, 13: 1741-1750. DOI:10.1080/21645515.2017.1327107 |
| [4] |
Alotaibi MR, Hassan ZK, Al-Rejaie SS, et al. Characterization of apoptosis in a breast cancer cell line after IL-10 silencing[J]. Asian Pac J Cancer Prev, 2018, 19: 777-783. |
| [5] |
Vesely M, Kershaw M, Schreiber R, et al. Natural innate and adaptive immunity to cancer[J]. Annu Rev Immunol, 2011, 29: 235-271. DOI:10.1146/annurev-immunol-031210-101324 |
| [6] |
Workman CJ, Dugger KJ, Vignali DA. Cutting edge: molecular analysis of the negative regulatory function of lymphocyte activation gene-3[J]. J Immunol, 2002, 169: 5392-5395. DOI:10.4049/jimmunol.169.10.5392 |
| [7] |
Sakuishi K, Ngiow SF, Sullivan JM, et al. TIM3+FOXP3+ regulatory T cells are tissue-specific promoters of T-cell dysfunction in cancer[J]. Oncoimmunology, 2013, 2: e23849. DOI:10.4161/onci.23849 |
| [8] |
Yu X, Harden K, Gonzalez LC, et al. The surface protein TIGIT suppresses T cell activation by promoting the generation of mature immunoregulatory dendritic cells[J]. Nat Immunol, 2009, 10: 48-57. DOI:10.1038/ni.1674 |
| [9] |
Le Mercier I, Chen W, Lines JL, et al. VISTA regulates the development of protective antitumor immunity[J]. Cancer Res, 2014, 74: 1933-1944. DOI:10.1158/0008-5472.CAN-13-1506 |
| [10] |
Picarda E, Ohaegbulam KC, Zang X. Molecular pathways: targeting B7-H3(CD276) for human cancer immunotherapy[J]. Clin Cancer Res, 2016, 22: 3425-3431. DOI:10.1158/1078-0432.CCR-15-2428 |
| [11] |
Leone RD, Lo YC, Powell JD. A2aR antagonists: next generation checkpoint blockade for cancer immunotherapy[J]. Comput Struct Biotechnol J, 2015, 13: 265-272. DOI:10.1016/j.csbj.2015.03.008 |
| [12] |
Ghalamfarsa G, Kazemi MH, Raoofi Mohseni S, et al. CD73 as a potential opportunity for cancer immunotherapy[J]. Expert Opin Ther Targets, 2019, 23: 127-142. DOI:10.1080/14728222.2019.1559829 |
| [13] |
Paulos CM, June CH. Putting the brakes on BTLA in T cell-mediated cancer immunotherapy[J]. J Clin Invest, 2010, 120: 76-80. DOI:10.1172/JCI41811 |
| [14] |
Colak S, Ten Dijke P. Targeting TGF-β signaling in cancer[J]. Trends Cancer, 2017, 3: 56-71. DOI:10.1016/j.trecan.2016.11.008 |
| [15] |
Long EO, Barber DF, Burshtyn DN, et al. Inhibition of natural killer cell activation signals by killer cell immunoglobulin-like receptors (CD158)[J]. Immunol Rev, 2001, 181: 223-233. DOI:10.1034/j.1600-065X.2001.1810119.x |
| [16] |
Gyori D, Chessa T, Hawkins PT, et al. Class (Ⅰ) phosphoinositide 3-kinases in the tumor microenvironment[J]. Cancers (Basel), 2017, 9: 24. DOI:10.3390/cancers9030024 |
| [17] |
Liu X, Kwon H, Li Z, et al. Is CD47 an innate immune checkpoint for tumor evasion?[J]. J Hematol Oncol, 2017, 10: 12. DOI:10.1186/s13045-016-0381-z |
| [18] |
Lu H. TLR agonists for cancer immunotherapy: tipping the balance between the immune stimulatory and inhibitory effects[J]. Front Immunol, 2014, 5: 83. |
| [19] |
Moon YW, Hajjar J, Hwu P, et al. Targeting the indoleamine 2, 3-dioxygenase pathway in cancer[J]. J Immunother Cancer, 2015, 3: 51. DOI:10.1186/s40425-015-0094-9 |
| [20] |
Tomala J, Kovar M. IL-2/anti-IL-2 mAb immunocomplexes: a renascence of IL-2 in cancer immunotherapy?[J]. Oncoimmunology, 2015, 5: e1102829. |
| [21] |
Vesely M, Kershaw M, Schreiber R, et al. Natural innate and adaptive immunity to cancer[J]. Annu Rev Immunol, 2011, 29: 235-237. DOI:10.1146/annurev-immunol-031210-101324 |
| [22] |
Robert C, Ribas A, Schachter J, et al. Pembrolizumab versus ipilimumab in advanced melanoma (KEYNOTE-006): post-hoc 5-year results from an open-label, multicentre, randomised, controlled, phase 3 study[J]. Lancet Oncol, 2019, 20: 1239-1251. DOI:10.1016/S1470-2045(19)30388-2 |
| [23] |
Ishida Y, Agata Y, Shibahara K, et al. Induced expression of PD-1, a novel member of the immunoglobulin gene superfamily, upon programmed cell death[J]. EMBO J, 1992, 11: 3887-3895. DOI:10.1002/j.1460-2075.1992.tb05481.x |
| [24] |
Iwai Y, Ishida M, Tanaka Y, et al. Involvement of PD-L1 on tumor cells in the escape from host immune system and tumor immunotherapy by PD-L1 blockade[J]. Proc Natl Acad Sci U S A, 2002, 99: 12293-12297. DOI:10.1073/pnas.192461099 |
| [25] |
Iwai Y, Terawaki S, Honjo T. PD-1 blockade inhibits hematogenous spread of poorly immunogenic tumor cells by enhanced recruitment of effector T cells[J]. Int Immunol, 2005, 17: 133-144. |
| [26] |
Schumacher T, Schreiber R. Neoantigens in cancer immunotherapy[J]. Science, 2015, 348: 69-74. DOI:10.1126/science.aaa4971 |
| [27] |
Hulpke S, Baldauf C, Tampé R. Molecular architecture of the MHC I peptide-loading complex: one tapasin molecule is essential and sufficient for antigen processing[J]. FASEB J, 2012, 26: 5071-5080. DOI:10.1096/fj.12-217489 |
| [28] |
Ribas A. Adaptive immune resistance: how cancer protects from immune attack[J]. Cancer Discov, 2015, 5: 915-919. DOI:10.1158/2159-8290.CD-15-0563 |
| [29] |
Cooper Z, Juneja V, Sage P, et al. Response to BRAF inhibition in melanoma is enhanced when combined with immune checkpoint blockade[J]. Cancer Immunol Res, 2014, 2: 643-654. DOI:10.1158/2326-6066.CIR-13-0215 |
| [30] |
Wherry E, Kurachi M. Molecular and cellular insights into T cell exhaustion[J]. Nat Rev Immunol, 2015, 15: 486-499. DOI:10.1038/nri3862 |
| [31] |
Yeon S, Jung S, Jo Y, et al. Immune checkpoint blockade resistance-related B2M hotspot mutations in microsatellite-unstable colorectal carcinoma[J]. Pathol Res Pract, 2019, 215: 209-214. DOI:10.1016/j.prp.2018.11.014 |
| [32] |
Anagnostou V, Smith K, Forde P, et al. Evolution of neoantigen landscape during immune checkpoint blockade in non-small cell lung cancer[J]. Cancer Discov, 2017, 7: 264-276. DOI:10.1158/2159-8290.CD-16-0828 |
| [33] |
Gettinger S, Choi J, Hastings K, et al. Impaired HLA class Ⅰ antigen processing and presentation as a mechanism of acquired resistance to immune checkpoint inhibitors in lung cancer[J]. Cancer Discov, 2017, 7: 1420-1435. DOI:10.1158/2159-8290.CD-17-0593 |
| [34] |
Lei Q, Wang D, Sun K, et al. Resistance mechanisms of anti-PD1/PDL1 therapy in solid tumors[J]. Front Cell Dev Biol, 2020, 8: 672. DOI:10.3389/fcell.2020.00672 |
| [35] |
Jiang Y, Chen M, Nie H, et al. PD-1 and PD-L1 in cancer immunotherapy: clinical implications and future considerations[J]. Hum Vaccin Immunother, 2019, 15: 1111-1122. DOI:10.1080/21645515.2019.1571892 |
| [36] |
Paz-Ares L, Luft A, Vicente D, et al. Pembrolizumab plus chemotherapy for squamous non-small-cell lung cancer[J]. N Engl J Med, 2018, 379: 2040-2051. DOI:10.1056/NEJMoa1810865 |
| [37] |
Gandhi L, Rodriguez-Abreu D, Gadgeel SF, et al. Pembrolizumab plus chemotherapy in metastatic non-small-cell lung cancer[J]. N Engl J Med, 2018, 378: 2078-2092. DOI:10.1056/NEJMoa1801005 |
| [38] |
Long GV, Dummer R, Ribas A, et al. Efficacy analysis of MASTERKEY-265 phase 1b study of talimogene laherparepvec (T-VEC) and pembrolizumab (pembro) for unresectable stage ⅢB-IV melanoma[J]. J Clin Oncol, 2016, 34: 9568. DOI:10.1200/JCO.2016.34.15_suppl.9568 |
| [39] |
Gibney GT, Kudchadkar RR, DeConti RC, et al. Safety, correlative markers, and clinical results of adjuvant nivolumab in combination with vaccine in resected high-risk metastatic melanoma[J]. Clin Cancer Res, 2015, 21: 712-720. DOI:10.1158/1078-0432.CCR-14-2468 |
| [40] |
Ott PA, Hu Z, Keskin DB, et al. An immunogenic personal neoantigen vaccine for patients with melanoma[J]. Nature, 2017, 547: 217-221. DOI:10.1038/nature22991 |
| [41] |
Shaverdian N, Lisberg AE, Bornazyan K, et al. Previous radiotherapy and the clinical activity and toxicity of pembrolizumab in the treatment of non-small-cell lung cancer: a secondary analysis of the KEYNOTE-001 phase 1 trial[J]. Lancet Oncol, 2017, 18: 895-903. DOI:10.1016/S1470-2045(17)30380-7 |
| [42] |
Takeda Y, Kataoka K, Yamagishi J, et al. A TLR3-specific adjuvant relieves innate resistance to PD-L1 blockade without cytokine toxicity in tumor vaccine immunotherapy[J]. Cell Rep, 2017, 19: 1874-1887. DOI:10.1016/j.celrep.2017.05.015 |
| [43] |
Kapp K, Volz B, Oswald D. Beneficial modulation of the tumor microenvironment and generation of antitumor responses by TLR9 agonist lefitolimod alone and in combination with checkpoint inhibitors[J]. Oncoimmunology, 2019, 8: e1659096. DOI:10.1080/2162402X.2019.1659096 |
| [44] |
Liang Y, Tang H, Guo J, et al. Targeting IFNα to tumor by anti-PD-L1 creates feedforward antitumor responses to overcome checkpoint blockade resistance[J]. Nat Commun, 2018, 9: 4586. DOI:10.1038/s41467-018-06890-y |
| [45] |
Limagne E, Richard C, Thibaudin M, et al. Tim-3/galectin-9 pathway and mMDSC control primary and secondary resistances to PD-1 blockade in lung cancer patients[J]. Oncoimmunology, 2019, 8: e1564505. DOI:10.1080/2162402X.2018.1564505 |
| [46] |
Hung AL, Maxwell R, Theodros D, et al. TIGIT and PD-1 dual checkpoint blockade enhances antitumor immunity and survival in GBM[J]. Oncoimmunology, 2018, 7: e1466769. |
| [47] |
Ngiow SF, Young A, Blake SJ, et al. Agonistic CD40 mAb-driven IL12 reverses resistance to anti-PD1 in a T-cell-rich tumor[J]. Cancer Res, 2016, 76: 6266-6277. DOI:10.1158/0008-5472.CAN-16-2141 |
| [48] |
Tang H, Wang Y, Chlewicki LK, et al. Facilitating T cell infiltration in tumor microenvironment overcomes resistance to PD-L1 blockade[J]. Cancer Cell, 2016, 29: 285-296. DOI:10.1016/j.ccell.2016.02.004 |
| [49] |
Mariathasan S, Turley SJ, Nickles D, et al. TGFbeta attenuates tumour response to PD-L1 blockade by contributing to exclusion of T cells[J]. Nature, 2018, 554: 544-548. DOI:10.1038/nature25501 |
| [50] |
Martin CJ, Datta A, Littlefield C, et al. Selective inhibition of TGFβ1 activation overcomes primary resistance to checkpoint blockade therapy by altering tumor immune landscape[J]. Sci Transl Med, 2020, 12: eaay8456. DOI:10.1126/scitranslmed.aay8456 |
| [51] |
Zhu Y, Knolhoff BL, Meyer MA, et al. CSF1/CSF1R blockade reprograms tumor-infiltrating macrophages and improves response to T-cell checkpoint immunotherapy in pancreatic cancer models[J]. Cancer Res, 2014, 74: 5057-5069. DOI:10.1158/0008-5472.CAN-13-3723 |
| [52] |
Sugiyama D, Nishikawa H, Maeda Y, et al. Anti-CCR4 mAb selectively depletes effector-type FoxP3CCD4C regulatory T cells, evoking antitumor immune responses in humans[J]. Proc Natl Acad Sci U S A, 2013, 110: 17945-17950. DOI:10.1073/pnas.1316796110 |
| [53] |
Highfill SL, Cui Y, Giles AJ, et al. Disruption of CXCR2-mediated MDSC tumor trafficking enhances anti-PD1 efficacy[J]. Sci Transl Med, 2014, 6: 237ra267. |
| [54] |
De Henau O, Rausch M, Winkler D, et al. Overcoming resistance to checkpoint blockade therapy by targeting PI3Kgamma in myeloid cells[J]. Nature, 2016, 539: 443-447. DOI:10.1038/nature20554 |
| [55] |
Peng D, Kryczek I, Nagarsheth N, et al. Epigenetic silencing of TH1-type chemokines shapes tumour immunity and immunotherapy[J]. Nature, 2015, 527: 249-253. DOI:10.1038/nature15520 |
| [56] |
Spranger S, Koblish HK, Horton B, et al. Mechanism of tumor rejection with doublets of CTLA-4, PD-1/PD-L1, or IDO blockade involves restored IL-2 production and proliferation of CD8(C) T cells directly within the tumor microenvironment[J]. J Immunother Cancer, 2014, 2: 3. DOI:10.1186/2051-1426-2-3 |
| [57] |
Willingham SB, Ho PY, Hotson A, et al. A2AR antagonism with CPI-444 induces antitumor responses and augments efficacy to anti-PD-(L)1 and anti-CTLA-4 in preclinical models[J]. Cancer Immunol, 2018, 6: 1136-1149. DOI:10.1158/2326-6066.CIR-18-0056 |
| [58] |
Fong L, Hotson A, Powderly JD, et al. Adenosine 2A receptor blockade as an immunotherapy for treatment-refractory renal cell cancer[J]. Cancer Discov, 2020, 10: 40-53. DOI:10.1158/2159-8290.CD-19-0980 |
| [59] |
Hay CM, Sult E, Huang Q, et al. Targeting CD73 in the tumor microenvironment with MEDI9447[J]. Oncoimmunology, 2016, 5: e1208875. DOI:10.1080/2162402X.2016.1208875 |
| [60] |
Cooper ZA, Juneja VR, Sage PT, et al. Response to BRAF inhibition in melanoma is enhanced when combined with immune checkpoint blockade[J]. Cancer Immunol Res, 2014, 2: 643-654. DOI:10.1158/2326-6066.CIR-13-0215 |
| [61] |
Ribas A, Lawrence D, Atkinson V, et al. Combined BRAF and MEK inhibition with PD-1 blockade immunotherapy in BRAF-mutant melanoma[J]. Nat Med, 2019, 25: 936-940. DOI:10.1038/s41591-019-0476-5 |
| [62] |
Sivan A, Corrales L, Hubert N, et al. Commensal Bifidobacterium promotes antitumor immunity and facilitates anti-PD-L1 efficacy[J]. Science, 2015, 350: 1084-1089. DOI:10.1126/science.aac4255 |
| [63] |
Matson V, Fessler J, Bao R, et al. The commensal microbiome is associated with anti-PD-1 efficacy in metastatic melanoma patients[J]. Science, 2018, 359: 104-108. DOI:10.1126/science.aao3290 |
| [64] |
Duperret E, Trautz A, Stoltz R, et al. Synthetic DNA-encoded monoclonal antibody delivery of anti-CTLA-4 antibodies induces tumor shrinkage in vivo[J]. Cancer Res, 2018, 78: 6363-6370. DOI:10.1158/0008-5472.CAN-18-1429 |
| [65] |
Lin A, Twitty C, Burnett R, et al. Retroviral replicating vector delivery of miR-PDL1 inhibits immune checkpoint PDL1 and enhances immune responses in vitro[J]. Mol Ther Nucleic Acids, 2017, 6: 221-232. DOI:10.1016/j.omtn.2016.11.007 |
| [66] |
Reul J, Frisch J, Engeland C, et al. Tumor-specific delivery of immune checkpoint inhibitors by engineered AAV vectors[J]. Front Oncol, 2019, 9: 52. DOI:10.3389/fonc.2019.00052 |
| [67] |
Zhao T, Wei T, Guo J, et al. PD-1-siRNA delivered by attenuated Salmonella enhances the antimelanoma effect of pimozide[J]. Cell Death Dis, 2019, 10: 164. DOI:10.1038/s41419-019-1418-3 |
| [68] |
Gurbatri C, Lia I, Vincent R, et al. Engineered probiotics for local tumor delivery of checkpoint blockade nanobodies[J]. Sci Transl Med, 2020, 12: eaax0876. DOI:10.1126/scitranslmed.aax0876 |
| [69] |
Oberli M, Reichmuth A, Dorkin J, et al. Lipid nanoparticle assisted mRNA delivery for potent cancer immunotherapy[J]. Nano Lett, 2017, 17: 1326-1335. DOI:10.1021/acs.nanolett.6b03329 |
| [70] |
Song W, Shen L, Wang Y, et al. Synergistic and low adverse effect cancer immunotherapy by immunogenic chemotherapy and locally expressed PD-L1 trap[J]. Nat Commun, 2018, 9: 2237. DOI:10.1038/s41467-018-04605-x |
| [71] |
Zhang X, Wang C, Wang J, et al. PD-1 blockade cellular vesicles for cancer immunotherapy[J]. Adv Mater, 2018, 30: e1707112. DOI:10.1002/adma.201707112 |
| [72] |
Zhang X, Wang J, Chen Z, et al. Engineering PD-1-presenting platelets for cancer immunotherapy[J]. Nano Lett, 2018, 18: 5716-5725. DOI:10.1021/acs.nanolett.8b02321 |
| [73] |
Wang C, Ye Y, Hochu G, et al. Enhanced cancer immunotherapy by microneedle patch-assisted delivery of antiPD1 antibody[J]. Nano Lett, 2016, 16: 2334-2340. DOI:10.1021/acs.nanolett.5b05030 |
| [74] |
Ye Y, Wang J, Hu Q, et al. Synergistic transcutaneous immunotherapy enhances antitumor immune responses through delivery of checkpoint inhibitors[J]. ACS Nano, 2016, 10: 8956-8963. DOI:10.1021/acsnano.6b04989 |
| [75] |
Ruan H, Hu Q, Wen D, et al. A dual-bioresponsive drug-delivery depot for combination of epigenetic modulation and immune checkpoint blockade[J]. Adv Mater, 2019, 31: e1806957. DOI:10.1002/adma.201806957 |
| [76] |
Song H, Yang P, Huang P, et al. Injectable polypeptide hydrogel-based co-delivery of vaccine and immune checkpoint inhibitors improves tumor immunotherapy[J]. Theranostics, 2019, 9: 2299-2314. DOI:10.7150/thno.30577 |
| [77] |
Wang C, Sun W, Ye Y, et al. In situ activation of platelets with checkpoint inhibitors for post-surgical cancer immunotherapy[J]. Nat Biomed Eng, 2017, 2: 525-532. |
| [78] |
Hu Q, Sun W, Wang J, et al. Conjugation of haematopoietic stem cells and platelets decorated with anti-PD-1 antibodies augments antileukaemia efficacy[J]. Nat Biomed Eng, 2018, 2: 831-840. DOI:10.1038/s41551-018-0310-2 |
| [79] |
Sima R, Marieke F, Jan W, et al. Polymeric microparticles for sustained and local delivery of antiCD40 and antiCTLA-4 in immunotherapy of cancer[J]. Biomaterials, 2015, 61: 33-40. DOI:10.1016/j.biomaterials.2015.04.043 |
| [80] |
Wang D, Wang T, Yu H, et al. Engineering nanoparticles to locally activate T cells in the tumor microenvironment[J]. Sci Immunol, 2019, 4: eaau6584. DOI:10.1126/sciimmunol.aau6584 |
 2022, Vol. 57
2022, Vol. 57


