2. 中国药科大学, 药物质量控制与药物警戒教育部重点实验室, 江苏 南京 210009;
3. 国家药品监督管理局药物制剂及辅料研究与评价重点实验室, 江苏 南京 210009
2. Key Laboratory of Drug Quality Control and Pharmacovigilance, Ministry of Education, China Pharmaceutical University, Nanjing 210009, China;
3. NMPA Key Laboratory for Research and Evaluation of Pharmaceutical Preparations and Excipients, Nanjing 210009, China
根据2020全球癌症统计报告, 全球新增确诊癌症病例约1 930万例, 癌症死亡人数预计可达1 000万人, 恶性肿瘤的治疗仍然是全球医学领域竭力攻克的一大临床难题[1]。目前, 临床上肿瘤的常规治疗手段包括手术切除、放射治疗和化学治疗, 其中化学疗法也包括手术前进行的新辅助化疗及手术后进行的辅助化疗。近年来, 随着生物医学技术的不断发展, 分子靶向治疗和免疫治疗等新兴疗法也不断进入临床成为肿瘤治疗新策略。但由于肿瘤病理机制复杂, 无论是传统化药或新型生物药, 仅依靠单一抗肿瘤机制的单药治疗很难在临床上取得实际可观的获益[2]。单药使用也具有突出的限制因素, 包括高剂量带来的不良反应、易产生多药耐药性(multidrug resistance, MDR) 和治疗作用有限等[3]。基于肿瘤病理复杂性, 抗肿瘤药物联合使用已逐渐成为临床上新的治疗趋势[4]。
在临床及临床前研究中发现, 与单药疗法相比, 多药联用具有显著的优势: 其具有协同效应的潜力, 多药联用总体治疗益处大于单独药物作用的总和; 联合药物发挥协同作用的主要机制可能作用于相同或不同的信号通路, 可以较低剂量获得相等或更优的治疗获益[5]; 利用药物组合缓解或中和单药治疗引起的不良反应; 通过多种机制克服治疗相关的MDR等[6, 7]。截至2020年底, 有近6 000项肿瘤联合试验在Clinicaltrials.gov注册, 可见抗肿瘤联合用药在临床上已逐步得到重视并逐渐发展成为主流治疗方案。目前临床主要使用的联合用药策略为利用现有药物进行配伍并分别给药: 如肺癌的常见联合化疗方案TP [紫杉醇(paclitaxel, PTX)、顺铂或卡铂]; 针对胃癌的XELOX (卡培他滨、奥沙利铂); 针对胰腺癌的GEMOX [吉西他滨(gemcitabine, GEM)、奥沙利铂] 等[8, 9]。尽管联合治疗策略在一定程度上有助于更好地治疗癌症, 但目前的联用策略也有诸多不足: 由于不同药物的理化性质、药代动力学和组织分布差异, 按规定剂量给药时实际到达肿瘤部位发挥作用的药物量区别较大, 难以实现配伍比例的精准控制; 在药物治疗中, 由于化疗药物毒性较大且对细胞没有选择性, 因此不良反应较大, 使其应用受到了局限; 涉及到治疗靶点具有时间关系需要按照一定时序性或程序性释放时, 药物组合使用时间把控较为复杂, 患者依从性差。由此可见, 目前的多药联用策略仍存在很大的改善空间, 将多种药物体内过程均一化的递送策略亟待开发[10]。
随着纳米医学的快速发展, 纳米药物递送系统被寄望于改善现有抗肿瘤多药联用递送策略的不足, 提升治疗效果, 相关研究的深入为多种药物的共递送提供了更多新的可能[11, 12]。纳米药物递送系统可高选择性地将药物递送至特定的组织、器官, 甚至细胞、细胞内结构, 进而达到增强治疗效果、降低不良反应的目的[13, 14]。多种纳米药物载体, 如脂质体[15]、纳米胶束[16]、聚合物纳米粒[17]、树状大分子[13]和无机纳米粒[18, 19]等, 可通过巧妙的功能化设计达到不同目的: 设计不同药物组分的精准剂量调控可以提高药物联用效果, 使联用过程更精确; 应激可控药物释放可以提高药物作用的选择性, 提高安全性, 降低不良反应; 程序性药物联用可以通过控制两种或多种药物发挥作用的时间关系, 实现具有时序性治疗策略的实施。因为能够满足各类药物递送需求, 纳米药物递送系统在抗肿瘤药物递送和改善肿瘤治疗效果等方面均显示出极具潜力的应用价值和开发前景[20, 21]。因此, 开发多功能纳米粒以支持新型联合治疗方案可为未来的临床癌症治疗提供借鉴思路[22]。
1 剂量精准调控型药物联用纳米递送系统在肿瘤的联合治疗中, 药物的最佳配比是实现药物协同作用和预期治疗效果的关键。根据药品审评中心(CDE) 关于抗肿瘤药联合治疗的指导原则, 联合药物剂量的把控也作为肿瘤多药联用治疗的关注点之一。精准的配伍剂量把控可达到更好的治疗效果, 同时尽可能降低药物相关的不良反应。在纳米药物递送系统进行多药共载时, 可使得联用药物保持一致的药动学特征及体内分布, 在按特定比例制备纳米药物后, 联用药物能按照设定比例递送至病灶部位, 有利于发挥药物间协同作用。与此同时, 由于可通过体外筛选优化药物组合和比例, 为肿瘤个性化治疗提供可行方案[23]。
基于这一思路设计的脂质体药物Vyxeos于2017年8月正式获美国FDA批准上市, 用于两种成人初治急性髓性白血病的治疗。脂质体是一类由磷脂和胆固醇等脂质组分组成的, 具有特殊双分子层的球型囊泡[24]。当脂质体作为药物载体时, 脂溶性药物可被包封于脂质双分子层之间的封闭疏水腔中, 而脂质体囊泡内的亲水腔可用于水溶性药物的荷载[25]。由于组成可控, 具有仿生结构、承载能力高和毒性低等特点, 脂质体已经广泛用于肿瘤治疗的临床前及临床研究中。Vyxeos是一种由阿糖胞苷(cytarabine, Ara-C) 和柔红霉素(daunorubicin, DNR) 以5∶1的摩尔比组成的脂质体复方制剂。在III期临床试验中, Vyxeos治疗组与标准的Ara-C + DNR (7+3) 化疗方案进行对比。结果显示, Vyxeos治疗组总生存期(overall survival, OS) 实现了统计学意义的显著改善, 治疗组中位生存期为9.56个月, 对照组(7+3) 为5.95个月。治疗组患者1年存活率达41.5%, 2年存活率达31.3%, 而对照组(7+3) 分别为27.6%和12.3%。此外, 与对照组(7+3) 相比, Vyxeos治疗组死亡风险降低31%, 造血干细胞移植率显著提高(34% vs 25%)[26]。
在临床前研究阶段中, Zhang等[27]构建了一种可以按照精准比例荷载递送组合药物的大环两亲性自组装纳米粒(macrocyclic‐amphiphile‐based self‐assembled nanoparticle, MASN), 可将组合药物按最优比递送至肿瘤组织。MASN表面具有多个大环空腔, 且在常氧条件下对一系列化疗药物表现出强键合, 从而可以实现对多种药物的精准荷载, 并避免在血液循环过程中的泄漏。选择甲氨蝶呤(methotrexate, MTX)/苯丁酸氮芥(chlorambucil, Chl) 和PTX/IDO抑制剂NLG919两种药物组合验证可知, 当到达乏氧肿瘤组织时, 生物还原酶可还原MASN结构中的偶氮键, 从而导致键合常数急剧下降, 并自发快速释放负载药物(图 1a)。通过精确的载药和控释机制, MASN可筛选使两种协同作用达到最大的配伍比例(图 1b)。定量测定胞内/瘤内两种药物含量可知, 组合药物可按照特定比例递送至细胞及肿瘤组织(图 1c、d), 在体内药效学评价中获得了显著的抗肿瘤及免疫激活作用。

|
Figure 1 a: Schematic illustration of macrocyclic‐amphiphile‐based self‐assembled nanoparticle (MASN) to achieve precise loading and ratiometric delivery of therapeutic combinations to tumors. b: Combination index of methotrexate (MTX) and chlorambucil (Chl) in 4T1 cells and the corresponding color bar. c: Total concentrations of paclitaxel (PTX) and NL G919 in the tumors of the mice treated with different treatment groups. d: The molar ratios of PTX to NL G919 in the tumors of all the treatment groups. n = 3, |
此外, GEM和PTX的联用为一种临床常用的药物联用组合GT。Meng等[28]设计了一种脂质包裹的介孔二氧化硅纳米粒(LB-MSNP) 来共同递送GEM和PTX以治疗小鼠胰腺癌。介孔二氧化硅的尺寸和形貌可控性良好, 比表面积大, 可实现较高的载药量[18, 29]。GEM荷载于MSNP中, PTX荷载于脂质双层中, 两种药物的荷载互不影响, 可进行配伍比例的灵活调控。实验结果表明, GEM/PTX摩尔比为10时, 药物联合指数(combination index, CI) 为0.5, 具有显著协同作用。LB-MSNP共递送PTX/GEM可显著抑制胰腺癌基质体积和肿瘤大小, 在异种移植和原位动物模型中的治疗效果优于游离GEM和白蛋白结合型紫杉醇Abraxane。Miao等[30]利用溶剂置换法将二油酸磷脂酰磷酸-吉西他滨单磷酸酯(DOPA-GMP) 和DOPA涂层的顺铂沉淀纳米核以最佳协同摩尔比5∶1装载到同一PLGA纳米粒中。实验结果表明, 共载GMP和顺铂的PLGA纳米粒可达到超过70%的包封效率, 并且体外、体内均可按比例吸收, 在膀胱癌小鼠模型中表现出协同的抗癌作用, 单次注射即可显著抑制肿瘤生长, 说明纳米给药系统能在体内更好地保持联用药物的比例, 并展现出相较传统“鸡尾酒”式药物联用更好的治疗效果。该纳米药物递送系统解决了亲疏水性不同的药物按比例共载的问题, 并为不同性质药物的共递送提供了新的可能。
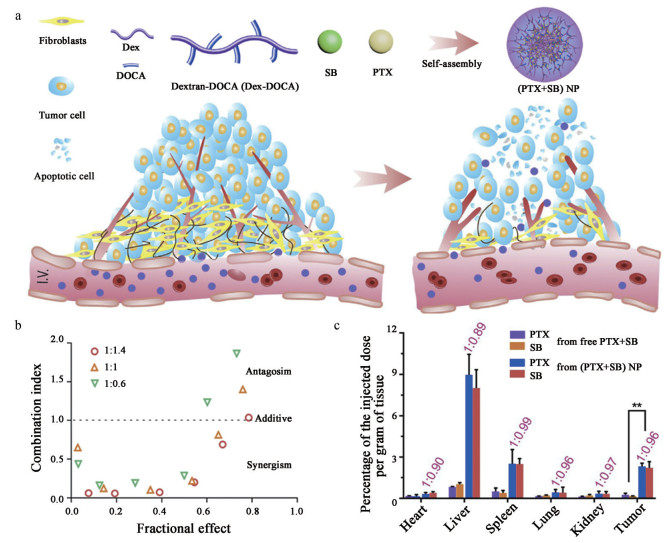
最近的研究表明, 水飞蓟宾(silybin, SB) 可通过抑制癌细胞的NF-κB通路调节肿瘤微环境(tumor microenvironment, TME), 同时起到化疗增敏的作用[31, 32]。Huo等[33]提出了一种基于纳米共递送系统共递送PTX和SB的联合疗法, 通过化学疗法敏化和微环境调节来发挥协同作用。研究者以基于葡聚糖的两亲聚合物(dextran-deoxycholic acid, Dex-DOCA) 为载体, “同步”PTX和SB的生物分布、转运和释放。并且Dex-DOCA对PTX和SB载量比可灵活调节, 以达到最佳的协同抗肿瘤活性(图 2a)。当将两种目标药物内化到肿瘤细胞中时, 可按照预期的剂量比特异性释放, 以获得最佳的协同作用。动物水平上, 组织分布定量结果显示, PTX和SB的肿瘤蓄积率可与预定的协同比保持一致。体内外实验均表明, 纳米药物递送系统可将PTX和SB两种药物按照固定比例递送至肿瘤部位, 并实现同步积累, 高效发挥抗肿瘤作用(图 2b、c)。
|
Figure 2 a: Schematic illustration of co-encapsulation of PTX and silybin (SB) into dextran-deoxycholic acid (Dex-DOCA) amphiphilic polymers to formulate co-encapsulated PTX and SB ((PTX+SB) NP). And (PTX+SB) NP worked as a robust nano-platform provided with prolonged circulation, eradicated stromal components and normalized tumor vessels for enhanced drug accumulation and potency in solid tumors. b: Fractional effect-combination index plot of PTX+SB at different combined ratios. c: The biodistribution of free PTX+SB and (PTX+SB) NP at 12 h post-i.v. injection measured by HPLC. n = 3, |
在肿瘤治疗中, 不良反应主要来源于药物对于健康组织、细胞的“无差别攻击”, 因此提高药物作用的选择性是抗肿瘤药物递送系统的一大发展趋势。应激可控释药的纳米递送系统可实现肿瘤组织或细胞特异性释药, 提高抗肿瘤药物选择性, 达到减毒增效的目的[34, 35]。应激可控释药过程主要可分为TME响应型及外源刺激响应型释药。
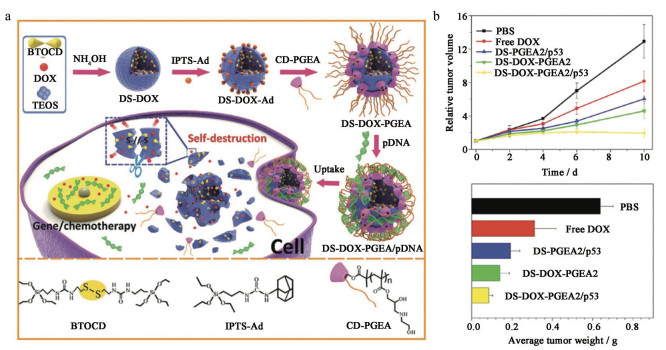
2.1 肿瘤微环境响应型纳米药物递送系统肿瘤在发生及发展的过程中, 伴随着具有乏氧、低pH值、氧化应激增加、高浓度谷胱甘肽(glutathione, GSH) 及相关酶的过表达等一系列异常特征的TME。区别于正常组织的TME为纳米药物递送系统提供了具有更高选择性的响应型释药策略, 如乏氧响应、pH响应、氧化还原响应、ATP响应和酶响应型释药等[36]。p53基因治疗作为最早的基因疗法之一, 与化疗药物联用可提高化疗敏感性, 已得到广泛验证[37], 近年来, 研究者们逐步开始着眼于其共递送系统的功能性研究。Zhang等[19]设计了一种还原响应型自降解二氧化硅纳米粒用于p53 pDNA和化疗药物多柔比星(doxorubicin, DOX) 的共递送。首先通过二硫键将DOX桥接至二氧化硅纳米粒上得到DS-DOX (DOX-embedded degradable silica nanoparticles)。为了实现基因药物的高效荷载, DS-DOX纳米粒的表面通过聚阳离子(assembled polycation, CD-PGEA) 进行功能化, 得到DS-DOX-PGEA (DOX-embedded degradable silica nanoparticles polycation), 进一步通过静电作用荷载p53质粒(plasmid DNA, pDNA), 得到的最终制剂DS-DOX-PGEA/pDNA在肿瘤高GSH环境下, DS-DOX中二硫键响应性断裂, DS-DOX-PGEA/pDNA从外部开始发生降解, 快速、可控释放DOX和p53 pDNA (图 3a), 该纳米药物递送系统在体内药效学评价中展现出显著的抑瘤作用(图 3b)。
|
Figure 3 a: Schematic of the preparation of DOX-embedded degradable silica nanoparticles polycation (DS-DOX-PGEA) nanoparticles and the resultant stimuli-responsive drug/gene codelivery process. b: Time-dependent growth curves, weights, and photographs of glioma tumors after the treatment with different groups. n = 4, |
研究表明癌症化疗出现不良后果的机制之一是在药物诱导下, 抗凋亡蛋白过表达, 从而阻止了癌细胞的凋亡[38], 因此, 敲低癌细胞中抗凋亡蛋白可以与化学疗法配合以优化癌症治疗。B细胞淋巴瘤-2 (B-cell lymphoma 2, Bcl-2) 是激活细胞抗凋亡的代表性Bcl家族蛋白之一, Bcl-2蛋白的过表达将导致某些化疗失败[39]。树状大分子是一类高度支化的单分散大分子, 从核心以迭代方式向外延伸形成的树枝状, 具有笼状结构的多价分支可用于疏水性和亲水性药物的共载[40]。另一团队以二代树状大分子(dendrimers of two generations, G2) 与含有二硫键的分支状聚乙二醇(branched polyethylene glycol, bPEG) 通过二硫键共价连接得到的复合物(bPEG-SS-linear PEG-G2, PSPG) 为载体, 疏水性药物DOX可被装载在G2树状大分子的分子内空隙和新形成的孔洞中, 表面伯胺能够通过静电作用荷载Bcl-2小干扰RNA (siBcl-2) 构建得到PSPG/DOX/siBcl-2纳米粒, 用以治疗乳腺癌。树状大分子内部提供了容纳疏水性药物的空腔, 中性的bPEG提供了一个屏蔽层来防止非特异性的血清相互作用, 并且可通过调节内部空隙的构型来增强药物的载量。当PSPG的阳离子层暴露在胞内高GSH环境下, G2从bPEG上脱落, 并实现高效的基因、化疗的同步释放。该纳米药物递送系统在动物水平起到了显著的DOX和siBcl-2的协同作用[41]。CRISPR/Cas9作为强大的基因组编辑工具, 近几年在肿瘤治疗中也展现出可观的潜力。该系统由两部分组成, 一个是“分子剪刀”Cas9核酸酶, 另一个是起到向导作用的sgRNA。目前最常用的递送方法为Cas9 mRNA和sgRNA的共递送[42]。Liu等[43]设计合成了疏水长链含有二硫键的阳离子脂质BAMEA-O16B, 通过静电作用荷载Cas9 mRNA及sgRNA, 制备成GSH响应型纳米药物BAMEA-O16B/Cas9 mRNA/sgRNA。在GSH存在下, 疏水尾部二硫键断裂, 脂质纳米粒发生降解, 实现mRNA和sgRNA的释放。该研究为生物大分子药物的共递送提供了一定依据。
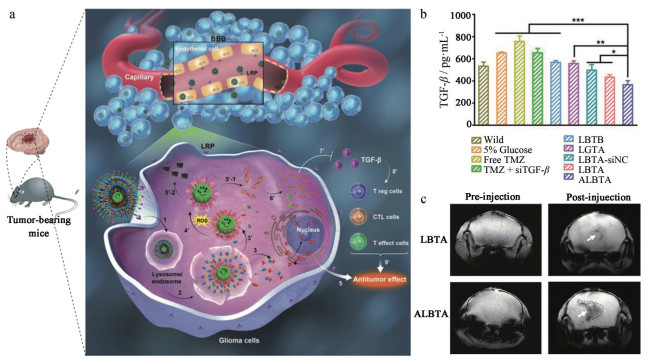
恶性脑胶质瘤化疗药物替莫唑胺(temozolomide, TMZ) 跨血脑屏障(blood brain barrier, BBB) 效率有限, 在外周有一定蓄积, 因此具有较大的胃肠道及血液系统不良反应。TMZ单药使用时, 由于受到肿瘤免疫抑制性微环境的严重阻碍, 治疗效果不甚理想。为了解决肿瘤免疫抑制, 提高TMZ疗效, 并提供纳米药物肿瘤特异性, Qiao等[44]构建了一种活性氧(reactive oxygen species, ROS) 响应型纳米药物递送系统, 用于化疗药物TMZ、调节免疫微环境的小干扰RNA (siRNA against tumor growth factor β, siTGF-β) 及起到成像作用的超顺磁性氧化铁(superparamagnetic iron nanocubes, SPIONs) 的共递送。实现肿瘤免疫微环境的调控联合化疗杀伤肿瘤细胞, 并可通过SPIONs增强核磁共振成像, 监测肿瘤发展情况。研究者首先合成了具有ROS响应性的两亲性嵌段聚合物BAP, 亲水端带有正电荷, 可用于siTGF-β的荷载, 疏水端可通过自组装荷载SPIONs, 得到AN@siTGF-β纳米粒。两性磷脂磷酸乙醇胺多羧基甜菜碱(distearoyl phosphoethanol-aminepolycarboxybetaine, DSPE-PCB) 包裹于BAP/SPIONs@siTGF-β (AN@siTGF-β) 纳米粒外, 并在疏水层中荷载TMZ, 在外层共价结合BBB及脑胶质瘤靶向肽angiopep-2, 得到angiopep LipoPCB (temozolomide+BAP/siTGF-β) (ALBTA) 纳米粒。当ALBTA进入肿瘤细胞后, DSPE-PCB可被质子化实现溶酶体逃逸, 释放TMZ的同时, AN@siTGF-β进入胞质; AN@siTGF-β暴露于高ROS环境后, 苄基硼酸酯被氧化, BAP电荷发生翻转, 纳米粒解体, 从而实现siTGF-β和SPIONs的快速释放(图 4a)。体内药效学结果表明, TMZ、siTGF-β和SPIONs在荷瘤小鼠体内成功发挥协同诊疗作用(图 4b、c)。
|
Figure 4 a: Schematic diagram of cellular uptake and subcellular drug delivery of angiopep lipoPCB (temozolomide+BAP/siTGF-β) (ALBTA). Temozolomide (TMZ) and siRNA against tumor growth factor β (siTGF-β) could be released after the nanoparticles being oxidized by reactive oxygen (ROS). SiTGF-β could down-regulate the secretion of TGF-β and further regulate the proliferation of the T cells. The synergistic effect could obtain by the combination of the antitumor effect of TMZ and the immune modulation of TGF-β. b: The regulation of TGF-β secretion after treatment with various formulations in vivo. n = 3, |
由于肿瘤细胞的异常增殖及代谢产物堆积, 胞内ATP水平显著高于胞外, 可作为纳米药物递送系统的响应性释药机制[45]。化疗药物易耐受为肿瘤化疗的一大难题, miR-34a为一种抑癌microRNA, 可通过间接调控p53等蛋白起到抑制肿瘤发生发展和侵袭迁移, 同时也可起到化疗增敏、抵抗MDR的作用。Wang等[46]以基因递送“金标准” PEI 25K作为载体, 构建了ATP触发的纳米药物递送系统。首先将ATP适体及其cDNA序列杂交以生成双链, DOX插入核酸双链GC碱基对之间, 然后将PEI 25K作为载体压缩载有DOX的核酸双链和miR-34a来构建三元纳米复合物PEI/DOX-duplex/miR-34a。在胞内高ATP (1~10 mmol·L-1) 环境下, 双链核酸适体分离, DOX快速释放; 而在低ATP环境下, DOX稳定存在于核酸适体双链中, 不发生作用, 以起到控释作用。
2.2 外源原位刺激响应型纳米药物递送系统除了基于TME的内源性刺激响应型纳米药物递送系统外, 肿瘤原位给予光照、热、磁性和超声等外源性刺激也可作为纳米药物递送系统的高效触发机制。Xiong等[47]设计了一种近红外(near infrared, NIR) 触发的用于雌激素受体阳性(ER+) 乳腺癌的三联疗法(化疗、“铁死亡”疗法、光热治疗) 纳米药物, 用于乳腺中发病率最高(80%) 的ER+乳腺癌联合治疗[48]。研究者基于配位化学将化疗药物DOX和“铁死亡”诱导剂氯化铁(FeCl3) 组装成DF络合物, 该DF配合物进一步通过π-π相互作用与超氧化物歧化酶反应活化剂鞣酸(tannic acid, TA) 组装在一起, 得到药物-有机物-无机自组装纳米系统(DFTA)。Fe3+和DOX的配位相互作用可能引起Fe3+ d轨道的分裂, 在NIR激发下发生电子跃迁及光吸收, 产生光热效应, 温度可达60 ℃。在电子跃迁和高温下, Fe3+和DOX的配位作用及TA的π-π相互作用受到破坏, 纳米复合物解体, 同时释放出DOX、FeCl3和TA。FeCl3和TA以级联放大的效果产生大量ROS, 从而耗竭GSH, 诱导细胞凋亡, 联合DOX对肿瘤细胞的直接杀伤作用, 在荷瘤小鼠体内观察到了显著的抑瘤效率。类似地, 另一团队构建了iRGD修饰的纳米粒, 用于光敏剂吲哚菁绿(indocyanine green, ICG) 和低氧激活的化疗药物替拉扎明(tirapazamine, TPZ) 的共递送。NIR激光照射后, ICG介导的光动力疗法消耗氧气, 引起乏氧, 进一步激活TPZ的抗肿瘤活性, 以进行协同治疗[49]。
3 智能程序释药型药物联用纳米递送系统纳米给药系统可以通过调节联用药物在不同刺激下的释放响应机制和释放速率, 从而控制药物联合治疗的顺序和时程, 以实现更为精准的给药过程, 提高联合作用的效果和特异性, 达到多种治疗增效目的。
3.1 纳米药物递送系统实现药物同步释放根据不同的治疗目的, 有时需要两种或多种药物同步释放或同步发挥作用以达到更佳的治疗效果。喜树碱(camptothecin, CPT) 作为一种拓扑异构酶I抑制剂, 可以非能量依赖的方式组织DNA的复制及RNA的合成; 顺氯氨铂(cis-platinum, CDDP) 可与DNA结合, 破坏DNA结构。两种药物可以分别抑制DNA的复制、转录, 以及破坏DNA结构促进细胞死亡, 同时作用可起到协同作用, 增强治疗效果。Li等[50]将CPT通过二硫键连接物接枝到聚乙二醇-聚谷氨酸嵌段共聚物上, 用于氧化还原触发的药物释放。随后通过CDDP的Pt-COOH螯合作用, 成功构建了具有杂化复合物作为稳定结构的CDDP交联的CPT-前药胶束(CPTP/CDDP)。纳米胶束是指由两亲性嵌段聚合物自组装形成具有“核-壳”结构的纳米粒, 在药物荷载时, 疏水性药物分子自发地与聚合物疏水段发生作用, 被包裹进疏水内核, 聚合物亲水段向外, 可保护疏水内核中药物的稳定。所得的双药荷载的CPTP/CDDP具有约50 nm的平均流体力学半径及狭窄的粒径分布, 有利于促进实体瘤的积累。该纳米药物递送系统巧妙利用了CDDP, 不仅作为辅助抗癌剂, 而且还充当交联剂, 以确保CPT和CDDP的同步释放。
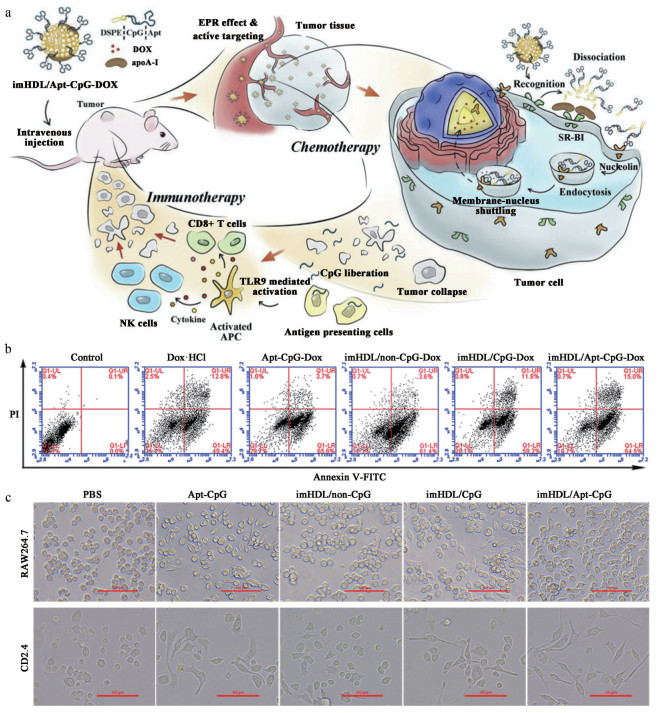
3.2 纳米药物递送系统实现药物顺序释放纳米药物递送系统可通过递送过程或释药过程的巧妙设计, 使联用药物按照一定顺序发挥作用。Han等[51]设计了一种基于高密度脂蛋白(high-density lipoprotein, HDL) 的纳米药物递送系统, 用于免疫、化药“接力式”药物共递送, 实现协同抗肿瘤作用。DOX可诱导肿瘤细胞发生免疫原性细胞死亡(immunogenic cell death, ICD), 产生抗原; 而胞嘧啶-鸟嘌呤寡核苷酸序列(oligodeoxynucleotides containing cytosine-guanine motifs, CpG ODN) 的非甲基化寡聚脱氧核苷酸可激活巨噬细胞和树突状细胞的抗原递呈, 有效激活肿瘤部位免疫作用[52, 53], 因此, 与DOX联用可以首先在肿瘤部位通过ICD产生抗原, 再利用CpG ODN的免疫调控作用促进免疫反应的发生。该纳米药物递送系统以天然HDL为结构基础, 以CpG ODN和具有核靶向作用的核酸适体AS1411的融合序列(Apt-CpG) 共价连接二硬脂酰磷脂酰乙醇胺(1, 2-distearoyl-sn-glycero-3-phosphoethanolamine, DSPE) (Apt-CpG-DSPE), 并将其修饰在HDL上。将DOX插入Apt-CpG的连续碱基对中, 以制得免疫HDL纳米药物imHDL/Apt-CpG-DOX。在递送至肿瘤细胞的过程中, imHDL/Apt-CpG-DOX首先通过HDL介导的SI-BR特异性结合发生结构解体, 释放载有DOX的Apt-CpG-DSPE, 在AS1411的作用下内吞进入细胞, 完成“接力式”的递送过程(图 5a)。两种药物释放后, DOX诱导ICD的发生, 促进肿瘤相关的抗原的释放(图 5b); 随后CpG调控巨噬细胞及树突状细胞促进抗原递呈, 实现增效的抗肿瘤作用(图 5c)。
|
Figure 5 a: Schematic of immune lipoprotein imHDL/Apt-CpG-DOX and the relay drug delivery for amplifying antitumor therapy. After i.v. injection, imHDL/Apt-CpG-DOX would target to tumor tissues and undergo extracellular collapse on the recognition of surface scavenger receptor class B type I (SR-BI). Apt-CpG-DOX would then be internalized in tumor cells and generate potent antitumor immune response. b: The flow cytometric of A549 cells apoptosis induced by various DOX preparations after 12 h. c: The morphologic of RAW264.7 and DC2.4 cells after treated with formulations for 24 h. Scale bar: 100 μm. (Adapted from Ref. 51 with permission. Copyright © 2018 Elsevier) |
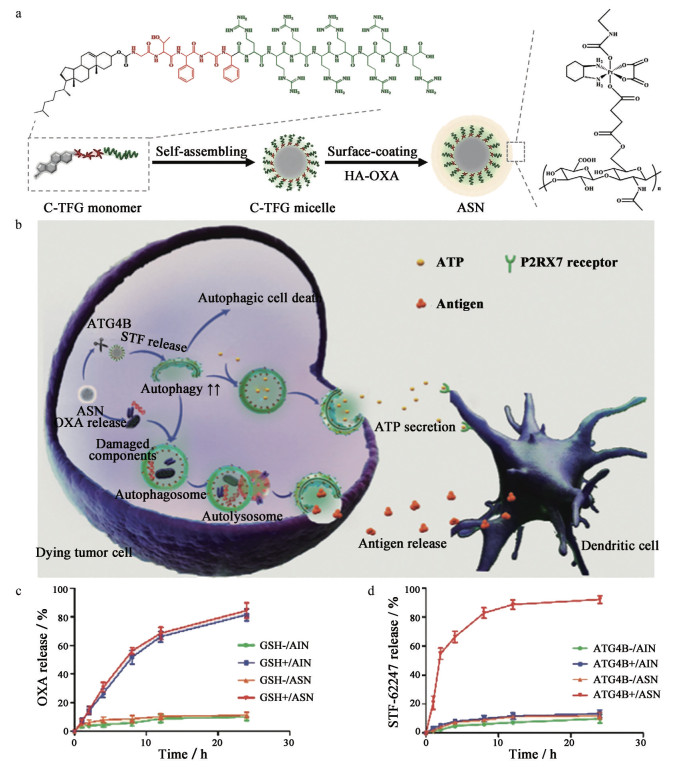
不同于上述研究的“接力式”递送, Hao等[54]利用作用效果的“接力”达到更优的药物联用效果。研究者构建了负载有铂纳米酶(platinum nanozyme, PtNP) 的活性氧ROS响应型前药纳米粒(CPT-TK-HPPH/PtNP)。ROS响应型前药由CPT和光敏剂[2-(1-hexyloxyethyl)-2-devinyl pyropheophorbide-a, HPPH] 通过酮缩硫醇键桥联合而成。CPT-TK-HPPH/PtNP进入肿瘤细胞后, PtNP首先有效催化过氧化氢(H2O2) 分解, 产生的氧气可以满足660 nm激光照射下HPPH生成ROS, 再进一步实现CPT的按需释放, 以达到增效化疗-光动力治疗联合疗法的目的。由于该过程高度依赖于肿瘤自噬, 化学疗法诱导的免疫原性细胞死亡对免疫系统的激活作用极为有限[55], 而适度的自噬可协助受损的肿瘤细胞对抗药物治疗[56]。基于此背景, Wang等[57]构建了肿瘤还原环境和自噬水平双响应壳核结构纳米粒(autophagy cascade amplification nanoparticle, ASN)。首先将亲水的自噬酶ATG4B可裂解肽TGF和疏水的胆固醇共价偶联得到(cell-penetrating peptide based amphiphilic peptide, C-TFG) 单体, C-TFG单体经自组装形成带正电的自噬酶响应性胶束C-TFG, 疏水内核荷载自噬诱导剂STF-62247; 外层通过静电作用结合负电性的透明质酸-奥沙利铂前药(oxaliplatin grafted hyaluronic acid prodrug, HA-OXA), 得到最终制剂ASN。进入肿瘤细胞后, ASN的HA-OXA外壳首先对还原微环境作出反应并释放OXA以触发肿瘤ICD, 从而轻度激活肿瘤自噬。随后, 暴露的C-TFG胶束可以敏感地响应OXA诱导的自噬并释放STF-62247, 该诱导剂依据化疗诱导的自噬程度, 将其转化为“过度活化”状态, 从而导致肿瘤细胞自噬死亡, 并增强随后的肿瘤抗原递呈(图 6a、b)。如图 6c所示, 在GSH存在下, OXA缓慢释放, 近25 h时累计释放量达到80%以上, 留有时间发生ICD, 并激活自噬; ATG4B达到一定水平时, STF-62247快速释放, 10 h内释放达到80% (图 6d), 可见两种药物在逐级触发下释放, 并按照时序性发挥作用。体内药效学实验结果表明, 该双响应、具有时序性的纳米药物递送系统在CT26荷瘤小鼠中, 相较于单药使用, 产生了更为显著的免疫激活和抗肿瘤效率。
|
Figure 6 Schematic of the autophagy responsive nanoparticle for cancer immunotherapy by immunogenic cell death induction and intelligent autophagy enhancement. a: Preparation of autophagy cascade amplification nanoparticle (ASN); b: Mechanism of oxaliplatin (OXA)-induced immunogenic cell death and autophagy-mediated Dendritic cells recruitment; c: OXA release profiles of nanoparticles in the presence or absence of glutathione (GSH); d: STF-62247 release profiles of nanoparticles in the presence or absence of ATG4B enzyme. n = 3, |
多种药物的顺序联用过程还可设计增加细胞选择性。如Shen等[58]为克服肿瘤干细胞的化疗抵抗, 设计了低氧敏感的硝基咪唑修饰的HA和CPT偶联形成的前药, 物理包埋全反式维甲酸(all-transretinoic acid, ATRA) 作为分化诱导剂, 构建了自组装聚合物胶束ATRA/CPT-NPs。其中, ATRA和CPT分别通过物理包封和化学偶联方式荷载, 作为循时自控释药物共递送系统。在肿瘤干细胞的低氧环境下, 聚合物胶束先释放ATRA, 诱导肿瘤干细胞向非干性细胞分化, 提高其化疗敏感性。在分化过程中, 胞内线粒体生物合成加快, 活性氧升高, 聚合物胶束响应活性氧变化, 适时释放CPT, 高效诱导分化的肿瘤干细胞凋亡。而在肿瘤非干性细胞中, 聚合物胶束可直接响应低氧和高活性氧微环境快速释放两药, 杀伤细胞。
新型药物载体无限配位聚合物(infinite coordination polymers, ICP) 是一种直接由药物和金属形成的“无载体型”纳米药物体系, 其利用配位键直接连接药物和金属离子, 并能根据需要调节药物比例, 可在三维空间内无限延伸。肿瘤光热治疗和化疗的联合疗法在临床前研究中广受关注, 然而常由于载药量低、光热转换效率低或者光热破坏了化疗药物等问题, 达不到理想的疗效。为了解决光热/化疗联合治疗的这些问题, Luo等[59]提出了一种“两期双增效型肿瘤治疗”的新策略用于肿瘤协同治疗。研究者将天然抗肿瘤药物棉酚和绿茶多酚与Fe3+结合, 制备无限配位聚合物, 其中掺杂1.3%光热剂IR780, 再包封具有肿瘤靶向能力的HA外壳, 制备得到负载IR780的透明质酸包裹棉酚-Fe(III)-儿茶酚无限配位聚合物纳米粒(HA@IRGFE ICP NPs), 实现两阶段的光热/化疗联合治疗: 第一阶段, 纳米粒先释放IR780和ICPs, 进行短期的光热联合ICPs进行协同治疗; 第二阶段, ICPs中两种化疗药物释放, 实现长期的联合化疗, 从而实现两阶段双协同的肿瘤治疗策略。
4 总结和展望多药联用是提高抗肿瘤疗效的重要手段之一, 也是当今抗肿瘤药物研发领域的大趋势。临床前研究中, 纳米给药系统在抗肿瘤药物联合治疗方面已被开发为用于癌症药物递送的强大工具。基于纳米药物递送系统的肿瘤多药联用策略与传统“鸡尾酒”疗法相比具有更多元化的功能性, 且已显示出更佳的治疗效果。通过巧妙的设计, 同步递送多种不同药物的同时, 可实现联用药物的精准配伍, 外部刺激或肿瘤微环境特异性的刺激响应性释放, 时间及空间上的程序性可控释放等。此外, 通过药物靶点、作用机制的巧妙组合实现治疗增效、降低不良反应、改变肿瘤组织和细胞对药物的敏感性、抵抗多药耐药等作用, 从而优化药物联用的效果, 并为患者提供一个疗效更优而不良反应更小的治疗策略, 极具临床应用前景。但纳米药物的研发和临床转化是挑战与机遇并存的, 需要对纳米化技术、组分配比、载药工艺和药物稳定性等多因素进行优化和更为严密的监控, 同时也需要国际药监机构建立纳米药物的监管标准, 引导药物研发[60]。现有的临床前研究成果及获得的经验需进一步服务于临床研究的推进, 为临床研究及其相关的监管决策提供依据, 这是基于纳米药物递送系统的肿瘤多药联用治疗策略临床转化的必然步骤。2021年4月, CDE对《纳米药物质量控制研究技术指导原则(试行) 》、《纳米药物非临床安全性研究技术指导原则(试行) 》和《纳米药物非临床药代动力学研究技术指导原则(试行) 》公开征求意见, 此为我国纳米药物临床转化颇具意义的一步。随着纳米药物递送系统相关研究的发展, 以及药品注册与监管政策的不断完善, 未来将会有更多纳米药物递送系统用于多药联用策略下的肿瘤治疗中。
作者贡献: 江文心和张华清完成本综述的提纲、撰写及修改; 周建平和丁杨对本文提出重要的指导意见。
利益冲突: 所有作者声明不存在任何利益冲突。
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71: 209-249. DOI:10.3322/caac.21660 |
| [2] |
Del Fabbro E. Combination therapy in cachexia[J]. Ann Palliat Med, 2019, 8: 59-66. DOI:10.21037/apm.2018.08.05 |
| [3] |
Nanayakkara AK, Follit CA, Chen G, et al. Targeted inhibitors of P-glycoprotein increase chemotherapeutic-induced mortality of multidrug resistant tumor cells[J]. Sci Rep, 2018, 8: 967. DOI:10.1038/s41598-018-19325-x |
| [4] |
Xu HT, Wu YH, Shi JF, et al. Progress in antitumor research of photothermal therapy combined with chemotherapy based on nanoscale co-loading strategy[J]. Acta Pharm Sin (药学学报), 2020, 55: 86-95. |
| [5] |
Wang F, Zhang D, Zhang Q, et al. Synergistic effect of folate-mediated targeting and verapamil-mediated P-gp inhibition with paclitaxel-polymer micelles to overcome multi-drug resistance[J]. Biomaterials, 2011, 32: 9444-9456. DOI:10.1016/j.biomaterials.2011.08.041 |
| [6] |
Milane L, Duan Z, Amiji M. Development of EGFR-targeted polymer blend nanocarriers for combination paclitaxel/lonidamine delivery to treat multi-drug resistance in human breast and ovarian tumor cells[J]. Mol Pharm, 2011, 8: 185-203. DOI:10.1021/mp1002653 |
| [7] |
Xiong XB, Lavasanifar A. Traceable multifunctional micellar nanocarriers for cancer-targeted co-delivery of MDR-1 siRNA and doxorubicin[J]. ACS Nano, 2011, 5: 5202-5213. DOI:10.1021/nn2013707 |
| [8] |
Quan Q, Wang Y, Wang F, et al. Real world first-line treatments and outcomes of Nab-paclitaxel plus gemcitabine, mFOLFIRINOX and GEMOX in unresectable pancreatic cancer from a Chinese single institution[J]. Curr Oncol, 2020, 28: 209-219. DOI:10.3390/curroncol28010023 |
| [9] |
Jin G, Wu Y, She Z, et al. Prophylactic Administration of recombinant human thrombopoietin in the secondary prevention of thrombocytopenia induced by XELOX adjuvant chemotherapy in patients with stage Ⅲ colorectal cancer[J]. Am J Ther, 2021, 28: e513-e516. DOI:10.1097/MJT.0000000000001331 |
| [10] |
Liu A, Wang H, Hou X, et al. Combinatory antitumor therapy by cascade targeting of a single drug[J]. Acta Pharm Sin B, 2020, 10: 667-679. DOI:10.1016/j.apsb.2019.08.011 |
| [11] |
Wang R, Han Y, Sun B, et al. Deep tumor penetrating bioparticulates inspired burst intracellular drug release for precision chemo-phototherapy[J]. Small, 2018, 14: e1703110. DOI:10.1002/smll.201703110 |
| [12] |
Zhang H, Jin Y, Chi C, et al. Sponge particulates for biomedical applications: biofunctionalization, multi-drug shielding, and theranostic applications[J]. Biomaterials, 2021, 273: 120824. DOI:10.1016/j.biomaterials.2021.120824 |
| [13] |
Parhi P, Mohanty C, Sahoo SK. Nanotechnology-based combinational drug delivery: an emerging approach for cancer therapy[J]. Drug Discov Today, 2012, 17: 1044-1052. DOI:10.1016/j.drudis.2012.05.010 |
| [14] |
Li X, Yu C, Meng X, et al. Study of double-targeting nanoparticles loaded with MCL-1 siRNA and dexamethasone for adjuvant-induced arthritis therapy[J]. Eur J Pharm Biopharm, 2020, 154: 136-143. DOI:10.1016/j.ejpb.2020.07.009 |
| [15] |
Lakkadwala S, Rodrigues BDS, Sun C, et al. Dual functionalized liposomes for efficient co-delivery of anti-cancer chemotherapeutics for the treatment of glioblastoma[J]. J Control Release, 2019, 307: 247-260. DOI:10.1016/j.jconrel.2019.06.033 |
| [16] |
Wang Q, Jiang H, Li Y, et al. Targeting NF-κB signaling with polymeric hybrid micelles that co-deliver siRNA and dexamethasone for arthritis therapy[J]. Biomaterials, 2017, 122: 10-22. DOI:10.1016/j.biomaterials.2017.01.008 |
| [17] |
Yadav S, van Vlerken LE, Little SR, et al. Evaluations of combination MDR-1 gene silencing and paclitaxel administration in biodegradable polymeric nanoparticle formulations to overcome multidrug resistance in cancer cells[J]. Cancer Chemother Pharmacol, 2009, 63: 711-722. DOI:10.1007/s00280-008-0790-y |
| [18] |
Luther DC, Huang R, Jeon T, et al. Delivery of drugs, proteins, and nucleic acids using inorganic nanoparticles[J]. Adv Drug Deliv Rev, 2020, 156: 188-213. DOI:10.1016/j.addr.2020.06.020 |
| [19] |
Zhang Q, Shen C, Zhao N, et al. Redox-responsive and drug-embedded silica nanoparticles with unique self-destruction features for efficient gene/drug codelivery[J]. Adv Funct Mater, 2017, 27: 12. |
| [20] |
Li M, Yang YT, He Q, et al. Research progress of nanocarriers in tumor immunotherapy[J]. Acta Pharm Sin (药学学报), 2017, 1839-1848. |
| [21] |
Hu H, Lin Z, He B, et al. A novel localized co-delivery system with lapatinib microparticles and paclitaxel nanoparticles in a peritumorally injectable in situ hydrogel[J]. J Control Release, 2015, 220: 189-200. DOI:10.1016/j.jconrel.2015.10.018 |
| [22] |
Guidolin K, Zheng G. Nanomedicines lost in translation[J]. ACS Nano, 2019, 13: 13620-13626. DOI:10.1021/acsnano.9b08659 |
| [23] |
Li X, He G, Su F, et al. Regorafenib-loaded poly (lactide-co-glycolide) microspheres designed to improve transarterial chemoembolization therapy for hepatocellular carcinoma[J]. Asian J Pharm Sci, 2020, 15: 739-751. DOI:10.1016/j.ajps.2020.01.001 |
| [24] |
Li M, Du C, Guo N, et al. Composition design and medical application of liposomes[J]. Eur J Med Chem, 2019, 164: 640-653. DOI:10.1016/j.ejmech.2019.01.007 |
| [25] |
Peng JQ, Zou Y, Xu JZ, et al. Preparation of dihydroartemisinin liposomes and evaluation of their antitumor activity in vitro[J]. Chin Tradit Herb Drugs (中草药), 2020, 51: 4151-4159. |
| [26] |
Liu X, Tang I, Wainberg ZA, et al. Safety considerations of cancer nanomedicine-a key step toward translation[J]. Small, 2020, 16: e2000673. DOI:10.1002/smll.202000673 |
| [27] |
Zhang Z, Yue YX, Xu L, et al. Macrocyclic-amphiphile-based self-assembled nanoparticles for ratiometric delivery of therapeutic combinations to tumors[J]. Adv Mater, 2021, 33: e2007719. DOI:10.1002/adma.202007719 |
| [28] |
Meng H, Wang M, Liu H, et al. Use of a lipid-coated mesoporous silica nanoparticle platform for synergistic gemcitabine and paclitaxel delivery to human pancreatic cancer in mice[J]. ACS Nano, 2015, 9: 3540-3557. DOI:10.1021/acsnano.5b00510 |
| [29] |
Li R, Wu R, Zhao L, et al. P-glycoprotein antibody functionalized carbon nanotube overcomes the multidrug resistance of human leukemia cells[J]. ACS Nano, 2010, 4: 1399-1408. DOI:10.1021/nn9011225 |
| [30] |
Miao L, Guo S, Zhang J, et al. Nanoparticles with precise ratiometric co-loading and co-delivery of gemcitabine monophosphate and cisplatin for treatment of bladder cancer[J]. Adv Funct Mater, 2014, 24: 6601-6611. DOI:10.1002/adfm.201401076 |
| [31] |
Mateen S, Raina K, Agarwal R. Chemopreventive and anti-cancer efficacy of silibinin against growth and progression of lung cancer[J]. Nutr Cancer, 2013, 65(Suppl 1): 3-11. |
| [32] |
Zhu XX, Ding YH, Wu Y, et al. Silibinin: a potential old drug for cancer therapy[J]. Expert Rev Clin Pharmacol, 2016, 9: 1323-1330. DOI:10.1080/17512433.2016.1208563 |
| [33] |
Huo M, Wang H, Zhang Y, et al. Co-delivery of silybin and paclitaxel by dextran-based nanoparticles for effective anti-tumor treatment through chemotherapy sensitization and microenvironment modulation[J]. J Control Release, 2020, 321: 198-210. DOI:10.1016/j.jconrel.2020.02.017 |
| [34] |
Yin T, Chu X, Cheng J, et al. Hypoxia-sensitive zwitterionic vehicle for tumor-specific drug delivery through antifouling-based stable biotransport alongside PDT-sensitized controlled release[J]. Biomacromolecules, 2021, 22: 2233-2247. DOI:10.1021/acs.biomac.1c00301 |
| [35] |
Liu YH, Zhou JP, Huo MR. Research progress of tumor microenvironment-responsive intelligent nanomedicine carriers[J]. J China Pharm Univ (中国药科大学学报), 2016, 47: 125-133. |
| [36] |
Hu C, Gao HL. Advances in tumor microenvironment responsive and regulatory drug delivery system[J]. Acta Pharm Sin (药学学报), 2020, 55: 1520-1527. |
| [37] |
Davoodi P, Srinivasan MP, Wang CH. Synthesis of intracellular reduction-sensitive amphiphilic polyethyleneimine and poly(epsilon-caprolactone) graft copolymer for on-demand release of doxorubicin and p53 plasmid DNA[J]. Acta Biomater, 2016, 39: 79-93. DOI:10.1016/j.actbio.2016.05.003 |
| [38] |
Chen W, Yuan Y, Cheng D, et al. Co-delivery of doxorubicin and siRNA with reduction and pH dually sensitive nanocarrier for synergistic cancer therapy[J]. Small, 2014, 10: 2678-2687. DOI:10.1002/smll.201303951 |
| [39] |
Delbridge AR, Grabow S, Strasser A, et al. Thirty years of BCL-2:translating cell death discoveries into novel cancer therapies[J]. Nat Rev Cancer, 2016, 16: 99-109. DOI:10.1038/nrc.2015.17 |
| [40] |
Song C, Ouyang Z, Guo H, et al. Core-shell tecto dendrimers enable enhanced tumor MR imaging through an amplified EPR effect[J]. Biomacromolecules, 2021, 22: 2181-2188. DOI:10.1021/acs.biomac.1c00262 |
| [41] |
Wang K, Hu Q, Zhu W, et al. Structure-invertible nanoparticles for triggered co-delivery of nucleic acids and hydrophobic drugs for combination cancer therapy[J]. Adv Funct Mater, 2015, 25: 3380-3392. DOI:10.1002/adfm.201403921 |
| [42] |
Wang Y, Huang G, Yang H, et al. Advances on nonviral vectors of CRISPR/Cas9 system for genome editing[J]. Acta Pharm Sin (药学学报), 2020, 55: 2606-2617. |
| [43] |
Liu J, Chang J, Jiang Y, et al. Fast and efficient CRISPR/Cas9 genome editing in vivo enabled by bioreducible lipid and messenger RNA nanoparticles[J]. Adv Mater, 2019, 31: e1902575. DOI:10.1002/adma.201902575 |
| [44] |
Qiao C, Yang J, Shen Q, et al. Traceable nanoparticles with dual targeting and ROS response for RNAi-based immunochemotherapy of intracranial glioblastoma treatment[J]. Adv Mater, 2018, 30: e1705054. DOI:10.1002/adma.201705054 |
| [45] |
Zhang Y, Lu Y, Wang F, et al. ATP/pH dual responsive nanoparticle with d-[des-Arg(10)] kallidin mediated efficient in vivo targeting drug delivery[J]. Small, 2017, 13: 14. |
| [46] |
Wang Y, Chen J, Liang X, et al. An ATP-responsive codelivery system of doxorubicin and MiR-34a to synergistically inhibit cell proliferation and migration[J]. Mol Pharm, 2017, 14: 2323-2332. DOI:10.1021/acs.molpharmaceut.7b00184 |
| [47] |
Xiong H, Wang C, Wang Z, et al. Intracellular cascade activated nanosystem for improving ER+ breast cancer therapy through attacking GSH-mediated metabolic vulnerability[J]. J Control Release, 2019, 309: 145-157. DOI:10.1016/j.jconrel.2019.07.029 |
| [48] |
Gawrzak S, Rinaldi L, Gregorio S, et al. MSK1 regulates luminal cell differentiation and metastatic dormancy in ER+ breast cancer[J]. Nat Cell Biol, 2018, 20: 211-221. DOI:10.1038/s41556-017-0021-z |
| [49] |
Wang Y, Xie Y, Li J, et al. Tumor-penetrating nanoparticles for enhanced anticancer activity of combined photodynamic and hypoxia-activated therapy[J]. ACS Nano, 2017, 11: 2227-2238. DOI:10.1021/acsnano.6b08731 |
| [50] |
Li Y, Lu H, Liang S, et al. Dual stable nanomedicines prepared by cisplatin-crosslinked camptothecin prodrug micelles for effective drug delivery[J]. ACS Appl Mater Interfaces, 2019, 11: 20649-20659. DOI:10.1021/acsami.9b03960 |
| [51] |
Han Y, Ding B, Zhao Z, et al. Immune lipoprotein nanostructures inspired relay drug delivery for amplifying antitumor efficiency[J]. Biomaterials, 2018, 185: 205-218. DOI:10.1016/j.biomaterials.2018.09.016 |
| [52] |
Shao K, Singha S, Clemente-Casares X, et al. Nanoparticle-based immunotherapy for cancer[J]. ACS Nano, 2015, 9: 16-30. DOI:10.1021/nn5062029 |
| [53] |
Chen N, Wei M, Sun Y, et al. Self-assembly of poly-adenine-tailed CpG oligonucleotide-gold nanoparticle nanoconjugates with immunostimulatory activity[J]. Small, 2014, 10: 368-375. DOI:10.1002/smll.201300903 |
| [54] |
Hao Y, Chen Y, He X, et al. Polymeric nanoparticles with ROS-responsive prodrug and platinum nanozyme for enhanced chemophotodynamic therapy of colon cancer[J]. Adv Sci (Weinh), 2020, 7: 2001853. DOI:10.1002/advs.202001853 |
| [55] |
Bezu L, Gomes-de-Silva LC, Dewitte H, et al. Combinatorial strategies for the induction of immunogenic cell death[J]. Front Immunol, 2015, 6: 187. |
| [56] |
Zhong Z, Sanchez-Lopez E, Karin M. Autophagy, inflammation, andimmunity: a troika governing cancer and its treatment[J]. Cell, 2016, 166: 288-298. DOI:10.1016/j.cell.2016.05.051 |
| [57] |
Wang X, Li M, Ren K, et al. On-demand autophagy cascade amplification nanoparticles precisely enhanced oxaliplatin-induced cancer immunotherapy[J]. Adv Mater, 2020, 32: e2002160. DOI:10.1002/adma.202002160 |
| [58] |
Shen S, Xu X, Lin S, et al. A nanotherapeutic strategy to overcome chemotherapeutic resistance of cancer stem-like cells[J]. Nat Nanotechnol, 2021, 16: 104-113. DOI:10.1038/s41565-020-00793-0 |
| [59] |
Luo S, Wang Y, Shen S, et al. IR780-loaded hyaluronic acid@gossypol-Fe(Ⅲ)-EGCG infinite coordination polymer nanoparticles for highly efficient tumor photothermal/coordinated dual drugs synergistic therapy[J]. Adv Funct Mater, 2021, 9: 2100954. |
| [60] |
Zhou JP. Application and prospect of nanotechnology in drug delivery[J]. J China Pharm Univ (中国药科大学学报), 2020, 51: 5-8. |
 2022, Vol. 57
2022, Vol. 57


