2. 中国医学科学院、北京协和医学院药用植物研究所, 北京 100193;
3. 西北大学生命科学学院, 陕西 西安 710069
2. Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100193, China;
3. College of Life Sciences, Northwest University, Xi'an 710069, China
山楂叶为蔷薇科植物山楂(Crataegus pinnatifida Bge.) 或山里红(C. pinnatifida Bge. var major N. E. Br) 的干燥叶, 山楂为野生, 主要分布于东北和华北, 山里红为山楂的栽培变种, 主要栽培于华北和东北, 主要为水果应用。山楂叶于2005年收入《中国药典》, 具有活血化瘀、理气通脉、化浊降脂的功效[1], 临床常用于治疗气滞血瘀、胸闷憋气、心悸健忘、眩晕耳鸣、高脂血症等[2, 3]。山楂叶主要含有黄酮类、有机酸类以及三萜酸类成分[4-8], 已有的研究认为黄酮类成分是其主要的活性成分[9, 10]。
欧洲使用欧山楂叶的历史悠久, 《欧洲药典》和《美国药典》均收载欧山楂叶, 来源为欧山楂C. monogyna Jacq.和光滑山楂C. laevigata DC. (C. oxyacantha L.) 的叶和花。现代研究[11]也肯定了其在治疗心血管疾病等方面的传统功效。山楂属植物在国外极少栽培, 药用资源来自当地的野生资源, 而我国使用的山楂叶资源, 90%以上来自栽培变种山里红, 水果应用为主, 各地的山里红为满足食用需求培育有多个栽培品种。虽然山楂叶最早记载于《本草纲目》, 但被充分认识和应用, 基本上参照了欧山楂叶在欧美的应用, 因此国内基原山楂叶的质量研究基础较薄弱, 多为采用紫外分光光度法、高效液相色谱法对山楂叶中单一或几个黄酮类成分进行定性和定量分析[12-18], 而对山楂叶全成分的分析与鉴定以及对不同资源类型(野生山楂、栽培山里红) 的山楂叶药材化学成分的对比分析研究较少, 因此非常必要开展相关的研究。
超高效液相色谱串联四极杆飞行时间质谱(UHPLC-Q-TOF/MSE) 结合主成分分析(PCA) 等多元统计分析方法不仅可以快速鉴定药材中的化学成分, 更能从大量信息中了解多基原、多产地等中药所含化学成分的差异等信息[19, 20]。本文应用UHPLC-Q-TOF/MSE技术结合UNIFI数据分析平台对药典来源的山楂叶化学成分进行分析, 表征鉴定了包括黄酮、萜类、有机酸等共58个化学成分, 几乎涵盖了指纹图谱中可见的色谱峰, 利用PCA及正交偏最小二乘判别分析(OPLS-DA) 对山楂和山里红两种来源山楂叶的化学成分进行对比分析, 明确了药典不同来源山楂叶的差异, 为山楂叶药材资源的合理开发利用以及质量控制提供科学依据, 为了便于区别两种来源, 本文称前者为野山楂叶, 后者为山里红叶。
材料与方法仪器 Waters ACQUITY I-Class超高效液相色谱系统(Waters公司, Milford, MA, 美国); VION-IMS-QTOF质谱系统(Waters公司, Wilmslow, 英国); UNIFI 1.9.4软件、Umetrics Ezinfo 3.0软件(Waters公司, Manchester, 英国); TBtools软件[21]。色谱柱: Waters ACQUITYTM HSS T3 C18 (2.1 mm × 100 mm, 1.8 μm, Waters公司, 爱尔兰); Sartorius BP211D 1/10万电子天平(Sartorius公司, 美国); 舒美KQ-600E数控超声波清洗器(昆山市超声仪器有限公司, 江苏); 0.22 μm微孔滤膜(上海兴亚净化材料厂)。
试剂与样品 乙腈(色谱纯, Fisher, 美国); 甲酸(色谱纯, Acros Co. Ltd., NJ, 美国); 屈臣氏蒸馏水(广州屈臣氏蒸馏水有限公司)。其他试剂均为市售分析纯。
对照品绿原酸、表儿茶素、原花青素B2、(6S, 7E, 9R)-6, 9-dihydroxy-4, 7-megastigmadien-3-one-9-O-β-D-glucopyranoside、nikoenoside、牡荆素、牡荆素-4''-O-葡萄糖苷、牡荆素-2''-O-鼠李糖苷、金丝桃苷、槲皮素-3-O-β-D-葡萄糖苷、epicatechin-(4β→8)-epiafzelechin、icariside B6、byzantionoside B、linalyl rutinoside、2α, 3β, 19α-三羟基熊果酸、坡模酸、山楂酸、科罗索酸和熊果酸均为实验室自制, 经HPLC-CAD面积归一化法测定其纯度均大于98%。
26批不同来源山楂叶样品信息见表 1, 其中山楂样品均为野生, 山里红的栽培品种包括了大金星(编号SLH-31-3、SLH-J)、小金星(编号SLH-47-26、SLH-47-28、SLH-47-36)、铁山楂(编号SLH-47-10、SLH-47-11、SLH-47-30、SLH-7)、雾灵红(编号SLH-47-19、SLH-47-23、SLH-31-29、SLH-31-22) 等4个目前市场上最常见的品种。实验室前期对山里红叶化学成分分析发现不同产地以及不同品种山里红叶化学成分组成差异较小, 从而确保本文所选样品的代表性。所用样品均由中国医学科学院药用植物研究所郭宝林研究员鉴定为山楂(C. pinnatifida Bge.) 和山里红(C. pinnatifida Bge. var major N. E. Br) 的干燥叶。每个样品来自一个植物个体, 采集鲜叶于50 ℃条件下烘干。
| Table 1 Summary of analyzed samples |
供试品溶液的制备 精密称取山楂叶药材粉末0.5 g (过40目筛), 放置于100 mL锥形瓶中, 精密加入70%甲醇溶液25 mL, 密塞, 摇匀, 超声提取30 min, 待其冷却至室温, 0.22 μm针式过滤器滤过, 取续滤液, 即得。分别取各样品的续滤液200 μL混匀作为质量控制样品(quality control, QC), 在UHPLC-Q-TOF/MSE分析过程中, 每6个样品中插入QC样品, 以确定检测结果的准确性。
混合对照品溶液的制备 分别称取绿原酸、表儿茶素、原花青素B2、(6S, 7E, 9R)-6, 9-dihydroxy-4, 7-megastigmadien-3-one-9-O-β-D-glucopyranoside、nikoenoside、牡荆素、牡荆素-4''-O-葡萄糖苷、牡荆素-2''-O-鼠李糖苷、金丝桃苷、槲皮素-3-O-β-D-葡萄糖苷、epicatechin-(4β→8)-epiafzelechin、icariside B6、byzantionoside B、linalyl rutinoside、2α, 3β, 19α-三羟基熊果酸、坡模酸、山楂酸、科罗索酸和熊果酸各0.3 mg, 加入甲醇1 mL溶解, 超声摇匀, 得到各对照品储备液。再分别量取各对照品储备液100 μL, 混匀即得。
色谱条件 色谱柱: Waters ACQUITYTM HSS T3 C18 (2.1 mm × 100 mm, 1.8 μm); 流动相: 0.1%甲酸水溶液(A)-乙腈(B); 梯度洗脱(0~6 min, 5%~16% B; 6~8 min, 16% B; 8~12 min, 16%~47% B; 12~15 min, 47%~48% B; 15~17 min, 48%~49% B; 17~18 min, 49%~54% B; 18~20 min, 54%~56% B; 20~22 min, 56%~78% B; 22~23 min, 78%~95% B; 流速0.5 mL·min-1; 柱温40 ℃; 进样量0.5 μL。
质谱条件 离子源为电喷雾电离离子源(ESI), 离子化模式为正离子模式和负离子模式, 离子源温度110 ℃, 脱溶剂气体为氮气, 流速850 L·h-1, 温度450 ℃。正离子模式下毛细管电压3 kV, 负离子模式下毛细管电压2.5 kV, 锥孔电压50 V, 分子质量扫描范围100~1 500 Da。正负离子低能量扫描时能量均为4 eV, 负离子高能量扫描时能量为30~50 eV, 正离子高能量扫描时能量为20~40 eV。准确质量数用leucineenk ephalin液校正。
UNIFI数据库与分析方法的建立 由于山楂叶与山楂果来源相同且文献报道山楂叶与山楂果有相似的化学成分[22, 23], 为了保证数据库的完整性, 应用UNIFI 1.9.4软件的数据库管理系统, 建立山楂叶与山楂果化学成分数据库(249个化合物), 包括化合物中英文名称、分子式、化学结构式、碎片离子信息等, 并导入UNIFI软件中, 构建山楂叶与山楂果化学成分数据库。分析方法中对3D峰检测参数的强度阈值进行设定, 其中高能量以25计数, 低能量以200计数, 分子质量误差及碎片离子匹配误差均设置为10 mDa, 负离子模式下加合离子峰的种类为[M-H]-、[M+HCOO]-和[M-H+2H2O]-, 正离子模式下加合离子峰的种类为[M+H]+、[M+Na]+和[M+H-H2O]+。
PCA分析 利用Umetrics Ezinfo 3.0软件对采集到的所有山楂叶样品在0~24 min内的UHPLC-Q-TOF/MSE指纹图谱进行主成分分析, 得到PCA得分图以便更直观地了解山里红与山楂样本间的差异情况。
结果 1 山楂叶化学成分的鉴定采用所建立的UHPLC-Q-TOF/MSE方法快速分析不同来源(山楂和山里红) 山楂叶样品, 代表性样品BPI色谱图见图 1。由于山楂叶中化合物在负离子模式下有较高的响应, 因此主要选择负离子模式进行分析, 正离子模式辅助进行化合物结构鉴定。

|
Figure 1 Base peak intensity (BPI) chromatograms of hawthorn leaves in negative ion mode by UHPLC-Q-TOF/MSE analysis. A: C. pinnatifida (SZ-1); B: C. pinnatifida var. major (SLH-31-3); The peak numbers hereby are consistent with those in Table 2 |
| Table 2 Identification of chemical constituents in hawthorn leaves. *Compound identified by comparing with reference standard. (-): Negative ion mode; (+): Positive ion mode |
在UNIFI软件中创建分析方法并对采集数据进行分析, UNIFI软件会对样品中的色谱峰与数据库中化合物进行自动匹配同时给出经处理后的可信数据, 包括化合物名称、保留时间、质量数误差、标识的高能量碎片数目以及化学式等信息。通过确证UNIFI鉴定结果与该类型化合物裂解规律以及相关文献, 鉴定各色谱峰所对应的化合物; 对于未从UNIFI数据库中匹配出的成分, 可通过UNIFI 1.9.4软件中的“Elemental Composition”工具来确定其可能分子式, 将该分子式输入ChemSpider、Scifinder等在线数据库中搜索可能的化学结构式并结合该化合物的质谱裂解碎片对其进行鉴定。通过上述方法, 共从山楂叶中鉴定58个化合物, 基本涵盖了液质指纹图谱中绝大多数色谱峰, 包括黄酮类成分16个、有机酸类成分6个、三萜酸类成分24个, 以及其他类型化合物12个, 突破了人们普遍认为山楂叶中主要含黄酮的认识, 化合物具体质谱裂解信息见表 2[6-8, 24-27]。
1.1 黄酮类化合物山楂叶中黄酮类化合物包括黄酮碳苷、黄酮醇氧苷、黄烷及其聚合物这三种类型, 其中黄酮碳苷类化合物中与C直接相连的糖基多为葡萄糖, 且该葡萄糖在裂解过程中容易发生糖基内部断裂, 从而在负离子模式下产生m/z 311、293以及283等特征碎片; 黄酮醇氧苷类化合物在裂解过程中容易产生脱糖、CO以及CO2等一些中性分子丢失。
峰18、20、21、22、24、28、31属于黄酮碳苷类化合物, 18、20和21通过与对照品比对, 分别为牡荆素-4''-O-葡萄糖苷、牡荆素和牡荆素-2''-O-鼠李糖苷。以峰18为例, 在负离子低能量时, 色谱峰18给出m/z 593.150 3 [M-H]-的准分子离子峰, 在负离子高能量时给出C-8位糖基断裂脱去180、102和120 Da所产生的特征碎片离子峰m/z 413.086 5 [M-H-C6H12O6]-、311.054 1 [M-H-C6H12O6-C4H6O3]-以及293.043 3 [M-H-C6H12O6-C5H12O3]-。在正离子低能量时, 峰18给出m/z 595.166 3 [M+H]+的准分子离子峰, 在正离子高能量时给出一系列糖基断裂产生的特征碎片离子峰m/z 433.113 5 [M+H-glc]+、313.070 5 [M+H-glc-C4H8O4]+以及271.060 7 [M+H-glc-C4H8O4-C2H2O]+。峰22在负离子和正离子低能量时分别给出m/z 577.151 7 [M-H]-以及579.171 0 [M+H]+的准分子离子峰, 推测其分子式为C27H30O14。在负离子高能量时出现m/z 413.085 9 [M-H-C6H12O5]-、311.051 7 [M-H-C6H12O5-C4H6O3]-以及293.044 8 [M-H-C6H12O6-C4H8O4]-的特征碎片离子; 在正离子高能量时先给出脱去一分子鼠李糖所产生的碎片离子峰m/z 433.110 9 [M+H-rha]+, 随后分别给出糖基内部脱去120、30及42 Da后产生的特征碎片离子m/z 313.070 5 [M+H-rha-C4H8O4]+、283.058 9 [M+H-rha-C4H8O4-CH2O]+以及271.060 7 [M+H-rha-C4H8O4-C2H2O]+。通过以上质谱裂解行为结合UNIFI匹配结果, 峰22鉴定为异牡荆素-2''-O-鼠李糖苷。峰31在负离子和正离子低能量时分别给出m/z 473.108 6 [M-H]-以及475.122 4 [M+H]+的准分子离子峰, 推测其分子式为C23H22O11。在负离子模式下分别给出脱去60和120 Da所产生的m/z 413.086 5 [M-H-C2H4O2]-以及m/z 293.043 3 [M-H-C2H4O2-C4H8O4]-的碎片离子峰。在正离子高能量时出现分别脱掉60、102、120、30及42 Da所产生的m/z 415.102 1 [M+H-C2H4O2]+、313.070 5 [M+H-C2H4O2-C4H6O3]+、295.059 4 [M+H-C2H4O2-C4H8O4]+、283.058 9 [M+H-C2H4O2-C4H6O3-CH2O]+以及271.060 7 [M+H-C2H4O2-C4H6O3-C2H2O]+的碎片离子峰, 说明该化合物是以牡荆素为母核的黄酮化合物, 并在糖基上有乙酰基取代。通过以上质谱裂解行为结合UNIFI匹配结果, 峰31鉴定为2''-O-乙酰基牡荆素或其同分异构体, 其可能的裂解途径见图 2。根据黄酮碳苷类化合物的裂解规律结合UNIFI匹配结果, 峰24和28分别鉴定为异牡荆素和apigenin-8-C-β-D-(2''-O-acetyl)-glucopyranoside。

|
Figure 2 The proposed fragmentation pathway of 2''-O-acetyl vitexin or its isomers (peak 31) in positive ion mode |
峰15、19、23、25和26属于黄酮醇氧苷类化合物。23和25通过与对照品比对, 分别为金丝桃苷和槲皮素-3-O-β-D-吡喃葡萄糖苷。峰15在负离子和正离子低能量时分别给出m/z 755.201 2 [M-H]-以及757.215 9 [M+H]+的准分子离子峰, 推测其分子式为C33H40O20。在负离子高能量时出现m/z 301.043 1的特征母核碎片, 在正离子高能量时出现m/z 611.159 6 [M+H-rha]+、465.103 1 [M+H-rha-rha]+和303.050 5 [M+H-rha-rha-glc]+的特征碎片离子峰, 说明峰15是以槲皮素为母核的黄酮类化合物, 并连有2分子鼠李糖和1分子葡萄糖。通过该化合物质谱裂解行为结合UNIFI匹配结果, 峰15鉴定为芦丁-4'-O-鼠李糖苷。峰19在负离子和正离子低能量时分别给出m/z 609.145 1 [M-H]-以及611.159 6 [M+H]+的准分子离子峰, 推测其分子式为C27H30O16。在负离子高能量时出现m/z 301.031 8的特征母核碎片, 在正离子高能量时出现m/z 465.103 1 [M+H-rha]+和303.050 5 [M+H-rha-glc]+的特征碎片离子峰, 说明峰19是以槲皮素为母核的黄酮类化合物, 并连有1分子鼠李糖和1分子葡萄糖。通过该化合物质谱裂解行为结合UNIFI匹配结果, 峰19鉴定为芦丁。峰26只在负离子模式下有响应, 在负离子低能量时给出m/z 505.098 8 [M-H]-的准分子离子峰, 推测其分子式为C23H22O15。在负离子高能量时出现m/z 300.026 7 [M-H-Ac-glc]-、271.022 1 [M-H-Ac-glc-CO]-和255.027 8 [M-H-Ac-glc-CO2]-的特征碎片离子峰, 说明峰26是以槲皮素为母核的黄酮类化合物, 并连1分子葡萄糖, 该葡萄糖上有1分子乙酰基取代。通过该化合物质谱裂解行为结合UNIFI匹配结果, 峰26鉴定为槲皮素-3-O-β-D-6''-乙酰基吡喃葡萄糖苷。
色谱峰9、10、13和14属于黄烷及其聚合物。峰9、10和13通过与对照品比对, 分别为原花青素B2、表儿茶素和epicatechin-(4β→8)-epiafzelechin。峰14在负离子和正离子低能量时分别给出m/z 865.195 3 [M-H]-和867.208 9 [M+H]+的准分子离子峰, 推测其分子式为C45H38O18。在负离子高能量下出现m/z 577.139 0 [M-H-C15H12O6]-的碎片离子峰(脱去了一分子表儿茶素), 随后出现的一系列碎片离子m/z 425.085 1、407.073 3以及289.070 8与原花青素B2的质谱裂解碎片一致, 结合UNIFI匹配结果, 峰14鉴定为原花青素C1。
1.2 有机酸类化合物色谱峰1、2、4-7为有机酸类成分, 该类成分在负离子模式下易丢失H2O、-COOH, 且易在羰基处断裂形成碎片离子。以峰1和峰6为例说明该类化合物鉴定过程。峰1在负离子低能量时给出m/z 191.054 8 [M-H]-的准分子离子峰, 推测其分子式为C7H12O6, 在负离子高能量时给出m/z 173.043 9 [M-H-H2O]-和85.028 9 [M-H-C3H4O3]-的碎片离子峰, 通过UNIFI数据库的匹配以及相关文献的比对[18], 确定峰1为奎尼酸。色谱峰6在负离子和正离子低能量下分别给出m/z 353.086 8 [M-H]-和355.103 0 [M+H]+的准分子离子峰, 推测其分子式为C16H18O9。在负离子高能量下给出碎片离子峰m/z 191.054 8 [M-H-C9H6O3]-和178.841 3 [M-H-C7H11O5]-, 在正离子高能量时给出m/z 163.039 7 [M+H-C7H12O6]+的碎片离子峰。通过与对照品保留时间、分子质量以及质谱裂解碎片对比可知色谱峰6为绿原酸。
1.3 三萜酸类化合物山楂叶中三萜酸类成分主要以五环三萜酸为主, 常见的类型有乌苏烷型和齐墩果烷型。该类化合物在负离子模式下均能给出[M-H]-的准分子离子峰, 正离子模式下, 可观察到[M+H]+的准分子离子峰, 有的显示较高丰度的[M+Na]+的加合离子峰。由于闭环型三萜的结构比较稳定, 因此在正负离子高能量下仅观察到H2O、-COOH和-CO的丢失以及侧链的断裂, 其中-COOH的断裂有两种方式, 一种是-COOH一起脱掉(脱掉44 Da), 另一种是-COOH中的羟基会先以H2O的形式脱去, 随后再脱去-COOH中的CO (先脱掉18 Da, 再脱去28 Da)。
峰41、49、50、51和58通过与对照品比对, 分别确定为2α, 3β, 19α-三羟基熊果酸、坡模酸、山楂酸、科罗索酸和熊果酸。峰35~38互为同分异构体, 在负离子低能量时均给出m/z 503.336 9 [M-H]-的准分子离子峰, 在正离子低能量时均给出m/z 527.334 3 [M+Na]+的加合离子峰, 利用软件推测其分子式为C30H48O6。峰35、36在负离子高能量时均给出m/z 485.326 8 [M-H-H2O]-、453.299 5 [M-H-H2O-CH2O]-和409.308 6 [M-H-H2O-CH2O-COOH]-的碎片离子峰; 在正离子高能量时均给出m/z 487.342 1 [M+H-H2O]+、469.330 9 [M+H-2H2O]+、451.321 2 [M+H-3H2O]+、423.324 9 [M+H-3H2O-CO]+和405.313 1 [M+H-3H2O-CO-H2O]+的碎片离子峰。峰37、38在负离子高能量时均给出m/z 485.326 8 [M-H-H2O]-、459.349 5 [M-H-COOH]-和457.326 4 [M-H-2H2O-CO]-、439.313 5 [M-H-2H2O-CO-H2O]-、421.310 1 [M-H-2H2O-CO-2H2O]-、403.297 6 [M-H-2H2O-CO-3H2O]-的碎片离子峰; 在正离子高能量时均给出m/z 487.342 1 [M+H-H2O]+、469.330 9 [M+H-2H2O]+、451.321 2 [M+H-3H2O]+和407.329 2 [M+H-3H2O-COOH]+的碎片离子峰, 以上说明峰35~38所对应的化合物均含有1个羧基和4个羟基。由于色谱峰35~38并未与UNIFI数据库中化合物成功匹配, 因此将其分子式输入ChemSpider、Scifinder等在线数据库中进行化学结构式的搜索并结合其质谱裂解碎片, 推测峰35~38为羟基积雪草酸或其异构体。峰42~44的分子式与峰41一致, 且质谱裂解规律与三萜酸类成分吻合, 推测峰42~44为2α, 3β, 19α-三羟基熊果酸的同分异构体。其余三萜酸类成分的鉴定过程同上。
1.4 其他类化合物除上述三类成分外, 山楂叶中还有单萜类、木脂素类等成分, 这些成分的鉴定方法与上述三类成分鉴定方法类似, 通过与对照品的保留时间和质谱裂解碎片比对、UNIFI数据库匹配以及在线数据库的搜索等方法对化合物进行鉴定, 各鉴定成分具体结构如图 3所示。以色谱峰11和33为例说明鉴定过程。通过与对照品分子质量、保留时间以及质谱裂解碎片比对, 确定色谱峰11为(6S, 7E, 9R)-6, 9-dihydroxy-4, 7-megastigmadien-3-one-9-O-β-D-glucopyranoside, 属于单萜类化合物, 该类化合物在负离子低能量时易出现较高丰度的[M+HCOO]-和[M-H+2H2O]-的加合离子峰, 在正离子低能量时给出丰度较高的[M+Na]+的加合离子峰。峰11在负离子低能量时, 产生m/z 385.184 2 [M-H]-的准分子离子峰, 且伴随较高丰度的m/z 431.192 4 [M+HCOO]-以及m/z 421.163 9 [M-H+2H2O]-的加合离子峰, 在负离子高能量时出现m/z 205.120 7 [M-H-C6H12O6]-的碎片离子峰。在正离子低能量时出现m/z 387.202 4 [M+H]+的准分子离子峰和较高丰度的m/z 409.183 3 [M+Na]+的加合离子峰以及m/z 225.148 8 [M+H-glc]+和m/z 207.138 6 [M+H-glc-H2O]+的碎片离子峰。峰33在负离子低能量时产生m/z 407.132 3 [M-H]-的准分子离子峰, 在正离子低能量时给出m/z 431.129 5 [M+Na]+的加合离子峰, 推测其分子式为C20H24O9。在负离子高能量下给出一系列碎片离子峰m/z 245.080 1 [M-H-glc]-、230.055 8 [M-H-glc-CH3]-和215.032 8 [M-H-glc-2CH3]-, 在正离子高能量时给出m/z 247.095 9 [M+H-glc]+的碎片离子峰。通过该化合物质谱裂解行为结合UNIFI匹配结果, 峰33鉴定为山楂叶苷A。
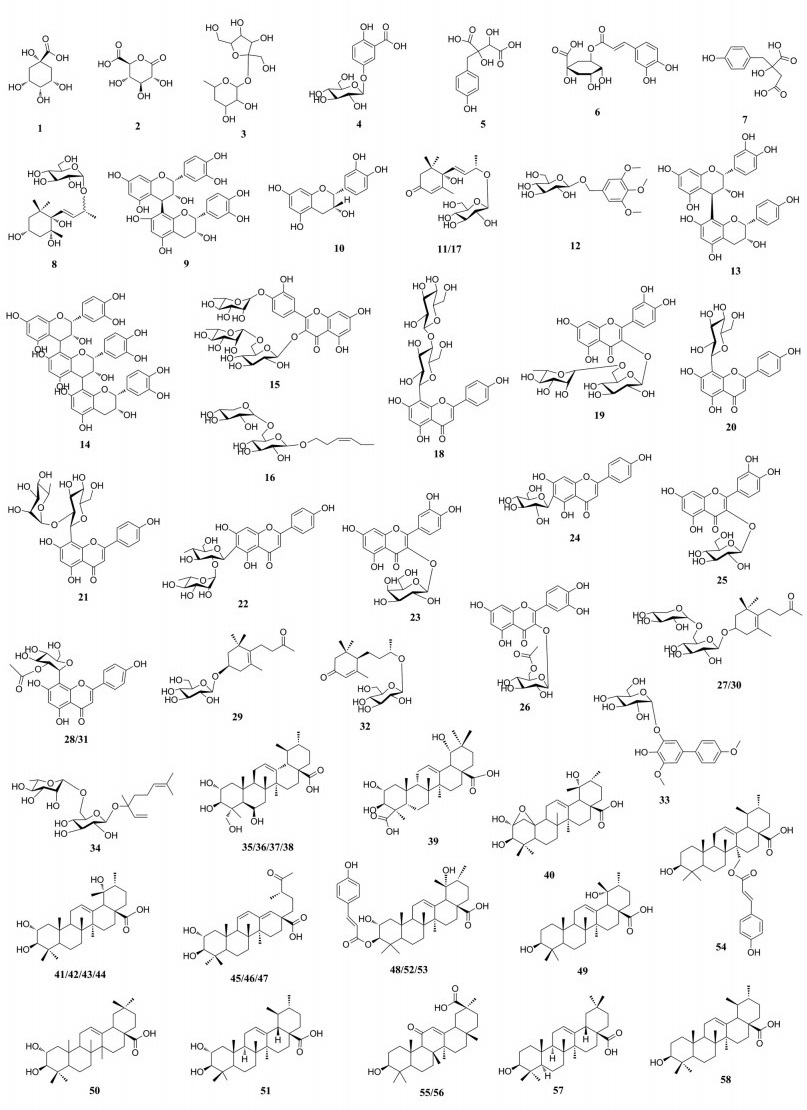
|
Figure 3 Structures of identified components in hawthorn leaves |
采用所建立的UHPLC-Q-TOF/MSE方法, 得到26批山楂叶样品的液质指纹图谱, 将指纹图谱进行PCA分析, 所得PCA得分图见图 4, 图中的点代表不同的样品, 较为聚集则表示其化学成分整体组成相似, 反之, 则差异较大。图中野山楂叶样品聚集在二、三象限, 山里红叶样品聚集在一、四象限, 说明野山楂叶与山里红叶化学成分具有一定差异, 从图中也可以看出野山楂叶样品分布较分散, 说明野山楂叶个体成分组成差异较大。为进一步分析野山楂叶与山里红叶的差异, 采用OPLS-DA分析, 得到S-Plot图, 并选择VIP值大于7的点进行分析, 这些点代表对两者差异贡献较大的成分, 确定了24个主要的差异性化学成分, 并鉴定了其中的20个, 见表 3 (表中色谱峰编号与表 2一致, 但由于色谱保留时间为7.74、7.82、9.56、9.87的成分未鉴定出来, 因此这4个成分用罗马数字I、II、III、IV来编号)。通过提取色谱峰, 得到24个差异性成分的峰面积, 对其进行标准化处理后绘制热图, 如图 5所示, 可直观反映差异成分在各样品中含量高低。

|
Figure 4 PCA/scores plot of leaves of C. pinnatifida and C. pinnatifida var. major |
| Table 3 Identification of markers from leaves of C. pinnatifida and C. pinnatifida var. major. The peak numbers are consistent with Table 2. The numbers I-IV indicate the components that have not been identified |

|
Figure 5 Heatmap of the 24 different markers of two sources of hawthorn leaves. (sample numbers and peak numbers are consistent with Table 1 and Table 2, respectively) |
通过统计分析可知, 野山楂叶与山里红叶的差异性成分主要为黄酮类和三萜酸类成分, 野山楂叶中黄酮醇氧苷(如色谱峰19、23、25) 和黄酮碳苷(如色谱峰21、22) 类成分的含量均比山里红叶高, 但山里红叶中牡荆素-4''-O-葡萄糖苷含量较高; 三萜酸类成分中山楂酸、科罗索酸以及熊果酸在野山楂叶中含量较高, 2α, 3β, 19α-三羟基熊果酸在山里红叶中含量较高。
讨论查阅文献[24-26]可知, 国外对山楂属植物化学成分的报道较国内更加全面, 包括了糖和糖醇类、有机酸、萜类、苯丙素类、黄酮类等成分, 但对野山楂叶和山里红叶的质量仅有少量研究[9, 28, 29], 尚无对不同来源山楂叶化学成分的全面比较研究。本研究首先通过UHPLC-Q-TOF/MSE结合UNIFI数据分析平台对山楂叶中化学成分进行分析鉴定, 共从山楂叶中鉴定化学成分58个, 首次发现、报道了山楂叶含有种类丰富的三萜酸类成分(共24个), 国内、外从山楂属植物各个部位(果实、花、茎、叶) 报道的三萜酸类成分有20余个, 而《中国药典》收载的山楂和山里红的叶中仅报道有13个[3, 8, 22, 30]。进一步, 利用PCA及OPLS-DA分析方法, 从整体上对比野山楂叶和山里红叶化学成分的差异, 结果表明野山楂叶和山里红叶化学成分具有一定差异, 根据24个主要的差异成分可知野山楂叶中黄酮类成分组成和含量(如色谱峰19、21、22、23、25) 和三萜酸类(如色谱峰50、51、58) 均比山里红叶丰富, 因此建议加强对野山楂叶质量的研究以及资源的开发利用。
此外, 国外使用的山楂叶是当地的野生物种资源: C. monogyna Jacq.和C. laevigata DC. (C. oxyacantha L.), 主要用于心血管疾病、癌症和糖尿病的治疗[24, 25], 而我国使用栽培变种山里红的叶作为山楂叶的主要来源, 研究与应用也主要关注心血管疾病及糖脂代谢的相关疾病。且大量的药理研究多集中总黄酮, 由于黄酮类成分是山楂叶中主要的活性成分, 这也说明野山楂叶有更好的临床应用价值和资源开发前景。然而通过本研究发现, 除黄酮外, 萜类成分尤其是三萜酸类成分也是山楂叶中组成丰富的一类成分, 但仅有少数研究关注其中萜类成分对活性的影响, Abu-Gharbieh等[31]从山楂属植物中分离得到的3β-O-乙酰熊果酸具有抗高血糖和抗高血脂潜力, 此外, Wen等[32]提取山楂果中的熊果酸及三萜类组分, 发现此类成分对HepG2、MCF-7和MDA-MB-231人类癌细胞系均有显著抗增殖作用, 表明山楂中三萜类成分具有潜在的抗癌活性, 然而对山楂中三萜酸类活性的研究也主要集中在熊果酸等常见的三萜酸类成分, 可见对山楂叶深入的成分研究将更好的促进其临床应用的开发。通过文献调研, 由于山楂属植物达千种以上(《中国植物志》)[24], 国内外不同物种间差异, 以及国内主流的野生山楂和栽培山里红果实及其叶的成分组成及活性差异研究都很少, 可见对国内外使用的不同来源山楂叶化学成分进行深入的比较研究对于全面评估山楂叶药材质量是非常必要的。
本文通过对野山楂叶和山里红叶化学成分的鉴定和对比分析, 实现了对山楂叶表征的全成分鉴定, 明确了野山楂叶和山里红叶化学成分的差异, 为药用山楂叶基原的选择和资源的合理开发利用提供了依据, 也为后续的药理研究提供了理论依据。
作者贡献: 郑伟、周茗负责实验研究工作及数据分析处理, 并撰写稿件; 王双艳、李齐负责实验所需对照品的制备; 张洁参与研究工作的思路设计; 赵晔、郑晓晖为研究工作提供了部分原药材及研究思路; 郭宝林参与山楂叶部分样品收集、品种的鉴定及文章的修改; 马百平对研究工作进行设计、监督、指导, 对工作各个方面承担责任。
利益冲突: 本文的研究无任何利益冲突。
| [1] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典) [S]. Beijing: China Medical Science Press, 2020: 33.
|
| [2] |
Wang LD, Zang YR, Pan WD, et al. Evaluation of difference of hawthorn leaf quality based on fingerprint combined with multivariate statistical analysis[J]. Mod Chin Med (中国现代中药), 2017, 19: 1692-1696. |
| [3] |
Wu JQ, Peng W, Qin PX, et al. Crataegus pinnatifida: chemical constituents, pharmacology, and potential applications[J]. Molecules, 2014, 19: 1685-1712. DOI:10.3390/molecules19021685 |
| [4] |
Duan ZW, Wang SY, Pang X, et al. Terpenoids from leaves of Chinese hawthorn[J]. China J Chin Mater Med (中国中药杂志), 2021, 46: 2830-2836. |
| [5] |
Song SJ, Li LZ, Gao PY, et al. Isolation of antithrombotic phenolic compounds from the leaves of Crataegus pinnatifida[J]. Planta Med, 2012, 78: 1967-1971. DOI:10.1055/s-0032-1327877 |
| [6] |
Li CR, Hou XH, Xu YY, et al. Manual annotation combined with untargeted metabolomics for chemical characterization and discrimination of two major Crataegus species based on liquid chromatography quadrupole time-of-flight mass spectrometry[J]. J Chromatogr A, 2020, 1612: 460628. DOI:10.1016/j.chroma.2019.460628 |
| [7] |
Huang XX, Niu C, Gao PY, et al. Chemical constituents from the leaves of the Crataegus pinnatifida Bge.[J]. J Shenyang Pharm Univ (沈阳药科大学学报), 2010, 27: 615-617. |
| [8] |
Wang SY. Study on the Constituents of the Leaves of Crataegus pinnatifida Bge. var. major N. E. Br. (山楂叶的化学成分研究) [D]. Tianjin: Tianjin University of Traditional Chinese Medicine, 2020.
|
| [9] |
Gao DY, Liu J, Li WP, et al. Protective effect and the mechanisms of harthorn leaves flavonoids on myocardial ischemia in rats[J]. Chin Med Pharmacol Clin (中药药理与临床), 2012, 28: 64-66. |
| [10] |
Hu HM, Guan Y, Weng JJ, et al. Effects of hawthorn leaf flavonoids on regulating lipid and protecting liver and the expression of HMGCR and LDLR in hyperlipidemia mice[J]. Chin J Mod Appl Pharm (中国现代应用药学), 2020, 37: 2599-2604. |
| [11] |
Graja IP. Polyphenolic-polysaccharide conjugates from flowers and fruits of single-seeded hawthorn (Crataegus monogyna Jacq.): chemical profiles and mechanisms of anticoagulant activity[J]. Int J Biol Macromol, 2018, 116: 869-879. DOI:10.1016/j.ijbiomac.2018.05.101 |
| [12] |
Wang X, Du YL, Zhao SN, et al. Dynamic analysis of total flavonoids and five flavonoid components in hawthorn leaves from Chengde[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2013, 19: 171-175. |
| [13] |
Pan HF, Wang LD, Li YR, et al. Simultaneous determination of eight components in Shanmei Capsules by HPLC[J]. Chin J Pharm Anal (药物分析杂志), 2012, 32: 1962-1967. |
| [14] |
Ma KF, Wang DW, Du XH, et al. Determination of total flavonoids in leaves of Crataegus pinnatifida by HPLC[J]. J China Pharm (中国药房), 2008, 19: 2599-2602. |
| [15] |
Zou LH, Qiu L, Jiao Y, et al. Study on the characteristic chromatogram of hawthorn berries by SPE-HPLC-UV method[J]. Chin J Pharm Anal (药物分析杂志), 2014, 34: 1597-1600. |
| [16] |
Li H, Yang B. RP-HPLC analysis of flavonoids in hawthorn fruits[J]. Chin J Pharm Anal (药物分析杂志), 2006, 26: 881-883. |
| [17] |
Pan HF, Yang MY, Xu BX, et al. Comparison of eight components in hawthorn leaves from different habitats by HPLC-MS/MS[J]. Chin J Pharm Anal (药物分析杂志), 2017, 37: 2173-2179. |
| [18] |
Liu RH, Jiang AL, Bian LL, et al. The comparison between LC-UV and LC-MS in analysis of polyphenolic components from leaves of Crataegus L.[J]. J Chin Med Mater (中药材), 2007, 3: 285-289. |
| [19] |
Guo LX, Li R, Liu K, et al. Structural characterization and discrimination of Chinese medicinal materials with multiple botanical origins based on metabolite profiling and chemometrics analysis: Clematidis Radix et Rhizoma as a case study[J]. J Chromatogr A, 2015, 1425: 129-140. DOI:10.1016/j.chroma.2015.11.013 |
| [20] |
Zheng W, Wang FX, Sun XG, et al. Analysis of chemical markers in sulfur-fumigated Anemarrhenae Rhizoma[J]. China J Chin Mater Med (中国中药杂志), 2017, 42: 3530-3536. |
| [21] |
Chen CJ, Chen, Zhang Y, et al. TBtools: an integrative toolkit developed for interactive analyses of big biological data[J]. Mol Plant, 2020, 13: 1194-1202. DOI:10.1016/j.molp.2020.06.009 |
| [22] |
Liu J. Preliminary Study on the Plants of Crataegus L. in Gansu province (甘肃省山楂属植物的初步研究) [D]. Lanzhou: Lanzhou University, 2013.
|
| [23] |
Liu RH, Shao F, Deng YQ, et al. Research advance of hawthorn berry chemical composition[J]. Chin Med Mater (中药材), 2008, 31: 1100-1103. |
| [24] |
Jennifer EE, Paula NB, Nadia T, et al. A review of the chemistry of the genus Crataegus[J]. Phytochemistry, 2012, 79: 5-26. DOI:10.1016/j.phytochem.2012.04.006 |
| [25] |
Dinesh K, Vikrant A, Zulfiqar AB, et al. The genus Crataegus: chemical and pharmacological perspectives[J]. Rev Bras Farmacogn Braz J Pharmacogn, 2012, 22: 1187-1200. DOI:10.1590/S0102-695X2012005000094 |
| [26] |
Karar MGE, Kuhnert N. UPLC-ESI-Q-TOF-MS/MS characterization of phenolics from Crataegus monogyna and Crataegus laevigata (hawthorn) leaves, fruits and their herbal derived drops (Crataegutt Tropfen)[J]. J Chem Biol Ther, 2015, 1: 102. |
| [27] |
Rao SGSR, Prasanna S, Kumar VPS, et al. Bartogenic acid, a new triterpene acid from Barringtonia speciosa[J]. Phytochemistry, 1981, 20: 333-334. DOI:10.1016/0031-9422(81)85119-9 |
| [28] |
Guan RW, Guo RQ, Lin HB, et al. HPLC fingerprint analysis of crataegi folium from different germplasms[J]. Chin Arch Tradit Chin Med (中华中医药学刊), 2020, 3: 81-85. |
| [29] |
Gao J, Wang LD, Li YR, et al. HPLC fingerprint comparative analysis of the hawthorn leaf from different regions[J]. Anhui Med Pharm (安徽医药), 2018, 22: 38-42. |
| [30] |
Chu WC, Gao PY, Li LZ. Chemical constituents from the leaves of Crataegus pinnatifida Bge.[J]. Biochem Syst Ecol, 2019, 86: 103923. DOI:10.1016/j.bse.2019.103923 |
| [31] |
Abu-Gharbieh E, Shehab NG. Therapeutic potentials of Crataegus azarolus var. eu- azarolus Maire leaves and its isolated compounds[J]. BMC Complement Altern Med, 2017, 17: 218-230. DOI:10.1186/s12906-017-1729-9 |
| [32] |
Wen L, Guo R, You L, et al. Major triterpenoids in Chinese hawthorn "Crataegus pinnatifida" and their effects on cell proliferation and apoptosis induction in MDA-MB-231 cancer cells[J]. Food Chem Toxicol, 2017, 100: 149-160. DOI:10.1016/j.fct.2016.12.032 |
 2021, Vol. 56
2021, Vol. 56


