2. 神威药业集团有限公司, 河北 石家庄 051430
2. Shineway Pharmaceutical Group Co., Ltd., Shijiazhuang 051430, China
清燥救肺汤(Qingzao Jiufei Decoction) 是2018年国家中医药管理局发布的《古代经典名方目录(第一批)》百首方剂之一[1], 出自清代医学家喻嘉言所著《医门法律》, 原文记载: “桑叶三钱(去枝梗), 石膏二钱五分(煅), 甘草一钱, 人参七分, 胡麻仁一钱(炒, 研), 真阿胶八分, 麦门冬一钱二分(去心), 杏仁七分(炮, 去皮尖, 炒黄), 枇杷叶一片(刷去毛, 蜜涂炙黄), 治诸气膹郁, 诸痿喘呕”, 具有清宣燥热, 养阴益气之功, 是治疗秋燥致病的名方[2], 现广泛应用于肺系疾病慢性阻塞性肺病、支气管炎[2]、哮喘等[3]的治疗。
2019年, 国家药品监督管理局发布《古代经典名方中药复方制剂简化注册审批管理规定》[4], 提出“经典名方物质基准”的概念: 保证传统中药与现代剂型一致性的中间过渡对照物, 以评价现代中药复方制剂的质量。同时文件明确了中药经典名方复方制剂开发之前, 需要先进行物质基准部分研究的原则[5]。
目前, 有关清燥救肺汤的质量控制的研究很少, 仅Wu等[6, 7]采用HPLC法同时测定了清燥救肺汤中的苦杏仁苷, 绿原酸和甘草酸三种指标成分的含量, 并结合得膏率综合评价提取工艺, 未见更多的质量控制和质量标准的研究, 使其在临床应用的发展受到局限, 关于清燥救肺汤具有抗氧化活性的相关化学物质基础也未见报道。本研究采用UHPLC-DAD法对清燥救肺汤物质基准中的8个成分进行含量测定, 建立了标准、可靠的定量方法, 以期为清燥救肺汤物质基准的质量标准研究与制定提供参考; 通过2, 2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS+) 自由基清除法评价清燥救肺汤的抗氧化活性, 并初步探究8个指标性成分的含量与抗氧化活性的关系。
材料与方法仪器 Agilent 1290 Infinity II超高效液相色谱仪(美国Agilent公司), AB135-S十万分之一天平(瑞士METTLER TOLEDO公司), BP210S电子分析天平(德国Sartorius公司), KH200B型超声波清洗器(昆山禾创超声仪器有限公司), SHZ循环水式真空泵(巩义市予华仪器有限责任公司), DZ4-WS低速台式离心机(湖南湘仪实验室仪器开发有限公司), 多功能酶标仪(美国Thermo Fisher公司)。
试剂与样品 苦杏仁苷(CHB190116)、甘草苷(CHB180608)、芹糖甘草苷(CHB170901)、芦丁(CHB190110)、异槲皮苷(CHB180628)、甘草素(CHB180609)、甘草酸(CHB180610) 和芝麻素(CHB180323) 均购自成都克洛玛生物科技有限公司。乙腈(色谱纯, 美国Sigma公司), 磷酸(色谱纯, 天津科密欧公司), 水(纯净水, 杭州娃哈哈有限公司), 无水乙醇(色谱纯, 山东禹王实业有限公司), 2, 2-联氮-二(3-乙基-苯并噻唑-6-磺酸) 二铵盐(上海阿拉丁试剂有限公司), 过硫酸钾(天津大茂试剂厂)。桑叶、煅石膏、麦冬、黑芝麻、苦杏仁、甘草、阿胶、枇杷叶和人参均由神威药业集团有限公司提供, 经沈阳药科大学中药学院王东教授鉴定为桑科植物桑Morus alba L.的干燥叶、硫酸盐类矿物石膏族石膏(Gypsum Ustum)、百合科植物麦冬Ophiopogon japonicus (L.f) Ker-Gawl.的干燥块根、脂麻科植物脂麻Sesamum indicum L.的干燥成熟种子、蔷薇科植物杏Prunus armeniaca L.的干燥成熟种子、豆科植物甘草Glycyrrhiza uralensis Fisch.的干燥根和根茎、马科动物驴Equus asinus L.的干燥皮或鲜皮经煎煮浓缩制成的固体胶、蔷薇科植物枇杷Eriobotrya japonica (Thunb.) Lindl.的干燥叶、五加科植物人参Panax ginseng C. A. Mey.的干燥根和根茎。
UHPLC色谱条件① 色谱柱: Waters Cortecs RP Shield C18色谱柱(150 mm × 2.1 mm, 1.6 μm); 流动相: 0.1%磷酸水(A)-乙腈(B) 梯度洗脱(0~11 min, 5% B; 11~12 min, 5%~6.5% B; 12~16 min, 6.5% B; 16~17 min, 6.5%~8% B; 17~18 min, 8%~10% B; 18~26 min, 10%~14.5% B; 26~42 min, 14.5% B; 42~44 min, 14.5%~16.5% B, 44~47.5 min, 16.5% B; 47.5~48 min, 16.5%~90% B; 48~53 min, 90% B); 流速: 0.30 mL·min-1; 柱温: 30 ℃; 进样量: 1 μL; 检测波长: 210、237和358 nm。
UHPLC色谱条件② 色谱柱: Waters Cortecs RP Shield C18色谱柱(150 mm × 2.1 mm, 1.6 μm); 流动相: 0.1%磷酸水(A)-乙腈(B) 梯度洗脱(0~10 min, 25%~28% B; 10~11 min, 28%~33% B; 11~20 min, 33%~34% B; 20~22 min, 34%~36% B; 22~36 min, 36% B; 36~36.5 min, 36%~90% B, 36.5~41 min, 90% B); 流速: 0.30 mL·min-1; 柱温: 30 ℃; 进样量: 1 μL; 检测波长: 210、265 nm。
清燥救肺汤物质基准的制备 按照《古代经典名方目录(第一批)》制备清燥救肺汤物质基准。
供试品溶液的制备 精密量取清燥救肺汤物质基准10 mL, 置25 mL量瓶中, 加无水乙醇约10 mL, 超声20 min, 放冷, 定容, 摇匀, 离心取上清液, 过0.22 μm微孔滤膜, 弃去初滤液, 取续滤液备用。缺味对照溶液的制备: 照清燥救肺汤处方, 分别称取除苦杏仁外的其他药材, 按照清燥救肺汤物质基准制备方法, 同法制成缺苦杏仁的清燥救肺汤物质基准。按上述供试品溶液制备方法同法制成缺苦杏仁的对照溶液。缺甘草、缺桑叶、缺黑芝麻的对照溶液的制备同上。
混合对照品溶液①的配制 分别称取苦杏仁苷、甘草苷、芹糖甘草苷、芦丁和异槲皮苷对照品适量, 精密称定, 用甲醇溶解并制成每1 mL中含有苦杏仁苷609.0 μg、甘草苷178.0 μg、芹糖甘草苷121.5 μg、芦丁40.30 μg和异槲皮苷40.40 μg的混合对照品储备液①。
混合对照品溶液②的配制 分别称取甘草素、甘草酸和芝麻素对照品适量, 精密称定, 用甲醇溶解制成每1 mL中含有甘草素62.68 μg、甘草酸628.4 μg和芝麻素63.04 μg的混合对照品储备液②。
系统适用性 取两种混合对照品溶液, 分别按照上述两种UHPLC色谱条件, 连续进样6次, 记录待测成分色谱峰的分离度(R)、理论塔板数、信噪比、拖尾因子、计算重复性的RSD。
方法学考察专属性 按照色谱条件①进样分析混合对照品溶液①、供试品溶液、苦杏仁阴性对照溶液、桑叶阴性对照溶液及甘草阴性对照溶液。按照色谱条件②进样分析混合对照品溶液②、供试品溶液、甘草阴性对照溶液及黑芝麻阴性对照溶液, 在各色谱条件下比较色谱图。
线性与范围 精密量取混合对照品储备液① 0.5、1.0、2.0、3.0、4.0 mL置于5 mL量瓶中, 加甲醇定容至5 mL, 摇匀, 制成不同浓度的系列混合对照溶液, 与储备液共同作为系列混合对照溶液, 按色谱条件①进样测定, 记录各待测成分峰面积; 精密量取混合对照品储备液② 0.25、1.0、1.5、2.0、3.0 mL置于5 mL量瓶中, 加甲醇定容至5 mL, 摇匀, 制成不同浓度的系列混合对照溶液, 与储备液共同作为系列混合对照溶液, 按色谱条件②进样测定, 记录各待测成分峰面积。以浓度为横坐标, 峰面积为纵坐标进行线性回归, 计算线性回归方程和相关系数。
检测限和定量限 以对照品溶液逐级稀释法进样检测, 以信噪比为3∶1和10∶1为基准分别测得各化合物的检测限和定量限。
精密度 精密量取同一批清燥救肺汤物质基准5、10和15 mL, 按“供试品溶液的制备”项下操作, 制备成低、中、高3个浓度的供试品溶液, 每种浓度平行制备3份。分别按上述两种UHPLC色谱条件进样分析, 作为重复性实验, 测定各成分含量, 计算含量RSD。精密量取同一批清燥救肺汤物质基准10 mL, 按“供试品溶液的制备”项下操作, 制备相同浓度的供试品溶液3份, 在上述两种色谱条件下, 分别连续3天进样分析, 作为日间精密度实验。测定各成分的含量, 并计算RSD。
准确度 精密量取已知含量的清燥救肺汤物质基准9份, 每份5 mL置于25 mL量瓶中, 分别加入清燥救肺汤中相当于各待测成分的50%、100%和150%水平的对照品, 制备低、中、高供试品溶液, 每种浓度平行制备3份, 按上述两种色谱条件进样分析。
耐用性 取混合对照品溶液和同一批清燥救肺汤物质基准10 mL, 按“供试品溶液的制备”项下方法制备成供试品溶液, 按上述两种UHPLC色谱条件, 分别考察色谱条件的不同进样体积(0.8、1和1.2 μL), 不同检测波长(208、210和212 nm)、(235、237和239 nm)、(356、358和360 nm), 不同流速(0.29、0.30和0.31 mL·min-1), 不同柱温(29、30和31 ℃), 不同酸度(0.09%磷酸-水、0.10%磷酸-水和0.11%磷酸-水), 测定待测成分的含量并计算不同条件的RSD值。
稳定性 取同一批清燥救肺汤物质基准, 按“供试品溶液的制备”项下方法制备供试品溶液, 室温放置, 分别于0、2、4、6、8、12和24 h按上述两种色谱条件进样分析, 记录峰面积, 计算RSD值。
10批清燥救肺汤物质基准的制备 取清燥救肺汤处方中九种药味饮片桑叶、煅石膏、麦冬、枇杷叶人参、甘草、苦杏仁、黑芝麻和阿胶各10批, 生成随机混批表, 产地和批号信息见表 1, 按照《古代经典名方目录(第一批)》制备清燥救肺汤物质基准10批。
| Table 1 Information of random batches mixing. QZJFD: Qingzao Jiufei Decoction |
ABTS+自由基工作液的配制溶液a的配制: 精密称取ABTS+自由基固体粉末19.54 mg, 置于5 mL量瓶中, 蒸馏水溶解, 定容, 摇匀。溶液b的配制: 精密称取过硫酸钾固体粉末3.32 mg, 置于5 mL量瓶中, 蒸馏水溶解, 定容, 摇匀。ABTS+工作液: 将上述溶液a和溶液b等体积混合, 避光反应15 h, 即得ABTS+自由基储备液。将ABTS+自由基储备液稀释30倍, 即得ABTS+自由基工作液。
清燥救肺汤物质基准样品系列溶液的配制精密量取10 mL清燥救肺汤物质基准, 按“供试品溶液的制备”项下方法制备成供试品溶液。精密量取1 mL上述供试品溶液, 加5 mL体积分数为60%的乙醇, 即得60.96 mg·mL-1的样品溶液(按全方生药材量计算), 并逐级稀释为30.38、15.19、7.600、3.800和1.900 mg·mL-1的系列样品溶液。
ABTS+自由基清除率分别移取系列样品溶液25 μL至96孔板中, 每个浓度平行3份。每个孔分别加入等量的ABTS+工作液175 μL。避光30 min, 用酶标仪摇动5 s, 在734 nm处测定吸收度, 计算清除率。ABTS+自由基清除率= [1 - (A样品 - A空白)/A对照] × 100%, 其中A样品: 样品溶液25 μL + ABTS+工作溶液175 μL; A空白: 样品溶液25 μL + 水175 μL; A对照: 60%乙醇25 μL + ABTS+工作溶液175 μL。
数据处理 数据统计运算采用IBM SPSS Statistics 26统计软件进行处理。
结果 1 系统适用性两种混合对照品液在各色谱条件下各峰的理论塔板数分别不低于15 000 (以苦杏仁苷计) 和23 000 (以甘草素计); 各待测物色谱峰与其相邻色谱峰之间的分离度均大于1.5; 拖尾因子在0.80~1.20之间; 分别按两种色谱条件连续进样6次, 各成分峰面积的RSD%均小于2%, 表明系统适用性良好。
2 分析方法学验证 2.1 专属性待测样品在色谱条件①下的色谱图如图 1, 苦杏仁苷来自苦杏仁, 甘草苷和芹糖甘草苷来自甘草, 芦丁和异槲皮苷来自桑叶; 由色谱条件②下的色谱图, 甘草素和甘草酸来自甘草, 芝麻素来自黑芝麻, 各阴性对照溶液在测定成分出峰时间处均无干扰, 表明方法专属性良好。
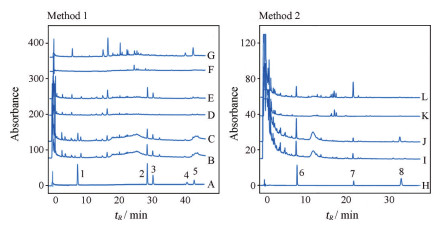
|
Figure 1 UHPLC chromatograms. Mixed standard solution ① under 210 nm (A). Negative control sample of QZJFD without Prunus armeniaca L. (B) and test solution (C) under 210 nm. Negative control sample of QZJFD without Glycyrrhiza uralensis Fisch. (D) and test solution (E) under 237 nm. Negative control sample of QZJFD without Morus alba L.(F) and test solution (G) under 358 nm. Mixed standard solution ② under 210 nm (H). Negative control sample of QZJFD without Sesamum indicum L. (I) and test solution (J) under 210 nm. Negative control sample of QZJFD without Glycyrrhiza uralensis Fisch. (K) and test solution (I) under 265 nm. 1: Amygdalin; 2: Liquiritin; 3: Liquiritin apioside; 4: Rutin; 5: Isoquercitrin; 6: Glycyrrhizin; 7: Glycyrrhizic acid; 8: Sesamin |
苦杏仁苷、甘草苷、芹糖甘草苷、芦丁、异槲皮苷、甘草素, 甘草酸和芝麻素在考察范围内线性关系良好, 相关系数均大于0.999。各待测成分的定量限(LOQ) 和检测限(LOD) 结果见表 2。
| Table 2 Linearity range, limit of detectron (LOD) and limit of quantitation (LOQ) of 8 constituents |
苦杏仁苷、甘草苷、芹糖甘草苷、芦丁、异槲皮苷、甘草素、甘草酸、芝麻素的RSD分别为1.2%、2.4%、2.1%、3.3%、2.6%、4.4%、0.6%、2.4%, 结果表明方法重复性良好。苦杏仁苷、甘草苷、芹糖甘草苷、芦丁、异槲皮苷、甘草素、甘草酸、芝麻素的RSD分别为2.9%、2.8%、2.3%、3.3%、5.4%、3.8%、0.3%、1.8%, 结果表明方法日间精密度良好。
2.4 准确度各成分的回收率在82.8%~112.4%内, 方法准确度良好。
2.5 耐用性含量水平在0.01%以上的苦杏仁苷、甘草苷、芹糖甘草苷、甘草酸、芝麻素RSD均不超过3.65%, 含量水平在0.01%~0.001%的芦丁、异槲皮苷、甘草素的RSD均不超过5.80%, 方法耐用性良好。
2.6 稳定性苦杏仁苷、甘草苷、芹糖甘草苷、芦丁、异槲皮苷、甘草素、甘草酸和芝麻素的含量RSD分别为0.8%、1.0%、2.1%、1.1%、1.9%、2.8%、0.2%和1.7%, 结果表明供试品溶液在24 h内稳定。
3 样品含量测定分别取混合对照品溶液、10批清燥救肺汤物质基准按“供试品溶液的制备”项下方法制备成供试品溶液, 按上述两种UHPLC色谱条件进样分析, 记录各成分峰面积, 采用外标法计算各批次样品中有效成分的含量, 结果见表 3。
| Table 3 Assay of 8 constituents in 10 batches of Qingzao Jiufei Decoction |
以样品的系列浓度为横坐标, 自由基清除率为纵坐标, 绘制曲线图, 见图 2。
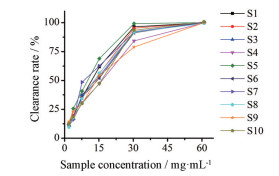
|
Figure 2 Ten batches of Qingzao Jiufei Decoction of series concentration-ABTS+ free radical scavenging rate (n = 3). ABTS+: 2, 2'-Azino-bis(3-ethylbenzothiazoline-6-sulfonate). S1-S10: 10 batches Qingzao Jiufei Decoction in Table 1 |
批清燥救肺汤样品溶液清除ABTS+自由基的半数清除率: IC50 (mg·mL-1), 结果见表 4, 10批样品清除ABTS+自由基的IC50值在10.42~16.32 mg·mL-1之间。
| Table 4 IC50 value of 10 batches Qingzao Jiufei Decoction to remove ABTS+ free radicals |
由上述样品测定结果可知10批清燥救肺汤8个成分的含量, 将各成分含量分别与清除ABTS+自由基的IC50值作Pearson相关性分析, 以探究各成分含量与抗氧化性的关系, 结果见表 5。芹糖甘草苷、芦丁、异槲皮苷、甘草素、甘草酸含量与清燥救肺汤清除ABTS+自由基的IC50值的相关系数为负, 呈负相关, 即含量越高, IC50值越小, 自由基清除能力越强; 其中桑叶中的芦丁与甘草中的甘草酸含量与IC50值呈显著性负相关, 即为清燥救肺汤的抗氧化活性与芦丁和甘草酸的含量呈显著性正相关, 芦丁和甘草酸的含量越高, 抗氧化活性越强。
| Table 5 The Pearson correlation test results. *Correlation and **correlation are respectively significant at the 0.05 and 0.01 level (2-tailed) |
本文在建立UHPLC含量测定分析方法时, 为达到最高的提取效率, 对前处理的溶剂、稀释倍数进行了考察和优化。结果表明, 采用无水乙醇稀释2.5倍时, 各待测成分的响应、峰形、分离度良好, 醇沉物较为完全, 杂质处理效果较好, 故选择加入无水乙醇稀释2.5倍作为样品前处理方法。
汤剂以水为溶剂, 考虑到提取液中的成分复杂, 且极性较大, 优先选择UHPLC系统进行分析方法开发。经过对不同色谱柱的考察, 最终选择Waters Cortecs RP Shield C18系列1.6 μm的色谱柱进行条件的进一步优化; 对水-乙腈, 水-甲醇的流动相体系进行了考察, 发现流动相中甲醇作为有机相时, 各色谱峰分离效果不佳, 基线不稳, 且色谱系统压力较大, 改用乙腈后各色谱峰分离良好, 基线较平稳, 色谱系统压力也在可接受范围内。流动相中纯水作为水相时, 部分色谱峰有拖尾现象, 且苦杏仁苷无法与相邻色谱峰完全分离, 因此进一步考察了在水相中加入0.01%、0.05%和0.1%的磷酸, 结果显示, 纯水中加入0.1%的磷酸时, 苦杏仁苷可完全分离, 各色谱峰峰形良好。本实验中, 考虑到各个成分的光谱吸收有较大的差异, 无法在单一波长下同时测定, 因此选择了多波长检测; 另一方面, 在优化梯度洗脱的过程中发现, 梯度越缓慢, 分析时间变长, 极性较小的成分分离效果并非越好, 因此设定两种梯度洗脱程序, 开发为两个分析方法, 以改善色谱分离效果, 提高分析效率。此外, 还考察了不同的柱温、不同流速, 最终选择柱温30 ℃, 流速0.30 mL·min-1为最佳色谱条件。
样品含量测定结果发现, S5批次中的芦丁和异槲皮苷含量较高, 一方面可能是由于药材的产地与批次不同所导致的, 另一方面, 相比于单味药, 中药复方经配伍后所含药味多, 成分更为复杂, 一些成分的含量水平可能会受其他成分的影响表现出差异。
有研究表明, 某些自由基在病毒性疾病中表达[8]; 肺部疾病患者在病毒和细菌感染的诱因下, 炎症细胞在细胞因子等刺激下活化, 导致释放氧化物质增多, 加重肺组织损伤和肺功能恶化[9]。抗氧化剂的使用可以抵御因病毒感染产生的氧化应激反应[10]。细胞因子风暴是新型冠状病毒肺炎(COVID-19) 中最常提及的病理学理论[11], 这些炎性细胞因子是蛋白质, 可作为信号分子, 将免疫细胞聚集到炎症部位, 诱导血管渗漏和渗出, 并刺激自由基和蛋白酶的产生。因此, 针对COVID-19, 可采用抗氧化治疗策略[12]。Ang等[13]搜集并总结了中国及其他国家发布的传统医学指南, 其中, 清燥救肺汤列入治疗配方, 模式识别为燥邪犯肺, 可以用于治疗中度阶段的COVID-19。因此, 本文对清燥救肺汤的抗氧化性进行了研究, 以探究清燥救肺汤是否存在通过清除患者体内的自由基以辅助治疗肺系疾病如COVID-19的可能。本研究以ABTS+自由基为实验对象, 测定10批清燥救肺汤清除自由基的IC50值, 并与8个成分的含量作相关性分析, 结果表明在一定质量浓度范围内, 清燥救肺汤的浓度越高, 自由基清除效果越强; S5批次的ABTS+自由基清除率较其他批次高, 可能与芦丁和异槲皮苷的含量水平较高有关。经过相关性分析, 芹糖甘草苷、芦丁、异槲皮苷、甘草素、甘草酸含量与IC50值呈反比, 即含量越高, IC50值越小, 自由基清除能力越强, 抗氧化活性越强, 特别是桑叶中的芦丁与甘草中的甘草酸, 呈显著性相关, 为两种成分分别作为药典中桑叶和甘草的指标性成分的合理性提供了依据。
结论本研究采用UHPLC-DAD法测定了清燥救肺汤中的苦杏仁苷、甘草苷、芹糖甘草苷、芦丁、异槲皮苷、甘草素、甘草酸和芝麻素8个成分的含量, 方法简便、快速、准确、可靠, 为清燥救肺汤进一步质量控制方法开发和质量标准的建立奠定了基础; 此外, 本研究还发现清燥救肺汤具有抗氧化活性, 且与芦丁和甘草酸的含量呈显著性正相关。
作者贡献: 李华主要进行了本文的选题与设计、方法建立、实验数据处理、撰写文章等。刘梓晗在抗氧化活性实验及数据处理方面提供了帮助。孟欣在含量测定样品的制备及测定、数据处理方面提供了帮助。许华容对仪器检修、本文的方法建立以及文章修改提供了宝贵意见。杨晓阳提供了本文选题的相关国家政策文件以及实验材料。李清对本文选题与设计、实验思路、方法建立及文章修改提供了宝贵意见。毕开顺从选题的设计、实验思路、方法建立及文章修改提供了专业的指导。
利益冲突: 无任何利益冲突。
| [1] |
National Administration of Traditional Chinese Medicine. Ancient Classic Prescription Catalogue (the first batch) [EB/OL]. Beijing: National Administration of Traditional Chinese Medicine, 2018 [2021-04-19]. http://kjs.satcm.gov.cn/zhengcewenjian/2018-04-16/7107.html.
|
| [2] |
Liu YP, Yang RY. Clinical analysis of Qingzao Jiufei Tang in treating acute exacerbation of chronic bronchitis in Qinghai Plateau[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2018, 24: 207-212. |
| [3] |
Xu YJ, Wan YX. Application of Qingzao Jiufei Decoction in treating pulmonary diseases[J]. World Chin Med (世界中医药), 2014, 9: 1509-1511. |
| [4] |
National Medical Products Administration. The Comprehensive Department of the State Food and Drug Administration publicly solicits the requirements for the declaration of Ancient Classic Prescription Chinese medicine compound preparations and their substance standards (draft for comments) [EB/OL]. Beijing: National Medical Products Administration, 2019 [2021-04-19]. https://www.nmpa.gov.cn/xxgk/zhqyj/zhqyjyp/20190327150101694.html.
|
| [5] |
Liu Y, Zhang J, Yang LY, et al. Research strategies and key problems analysis over substance benchmark of famous classical formulas[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志, 2020, 26: 1-9. |
| [6] |
Wu ZQ, Liu GH, Ping J, et al. HPLC simultaneous determination of three components in Qingzao Jiufei Decoction[J]. Chin Arch of Tradit Chin Med (中华中医药学刊), 2014, 32: 978-980. |
| [7] |
Wu ZQ, Ping J, Yu Y, et al. Optimization of extraction technology for Qingzao Jiufei Decoction by comprehensive scoring method[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2013, 19: 12-15. |
| [8] |
Akaike T, Suga M, Maeda H. Free radicals in viral pathogenesis: molecular mechanisms involving superoxide and NO[J]. Proc Soc Exp Biol Med, 1998, 217: 64-73. DOI:10.3181/00379727-217-44206 |
| [9] |
Wang CL, Cai RD, Kang J, et al. Correlation between cytokines and oxygen free radicals in patients with chronic obstructive pulmonary disease[J]. Chin J Gerontol (中国老年学杂志), 2010, 30: 310-312. |
| [10] |
Camini FC, Da silva Caetano CC, Almeida LT, et al. Implications of oxidative stress on viral pathogenesis[J]. Arch Virol, 2017, 162: 907-917. DOI:10.1007/s00705-016-3187-y |
| [11] |
Zong Y, Yao WF, Ju WZ. Exploring the antiviral traditional Chinese medicine for the treatment of coronavirus disease 2019 based on the cytokine storm and Chinese medicine theory "damp toxin invading the lung"[J]. Acta Pharm Sin (药学学报), 2020, 55: 1091-1097. |
| [12] |
Wu J. Tackle the free radicals damage in COVID-19[J]. Nitric Oxide, 2020, 102: 39-42. DOI:10.1016/j.niox.2020.06.002 |
| [13] |
Ang L, Lee HW, Choi JY, et al. Herbal medicine and pattern identification for treating COVID-19: a rapid review of guidelines[J]. Integr Med Res, 2020, 9: 100407-100420. DOI:10.1016/j.imr.2020.100407 |
 2021, Vol. 56
2021, Vol. 56


