2. 山西中医药大学, 基于炎性反应的重大疾病创新药物山西省重点实验室, 山西 晋中 030619
2. Shanxi Key Laboratory of Innovative Drug for the Treatment of Serious Diseases Basing on the Chronic Inflammation, Shanxi University of Chinese Medicine, Jinzhong 030619, China
炎症是机体组织在各种损伤因素刺激下的一种防御反应, 与动脉粥样硬化、糖尿病和关节炎等多种慢性疾病密切相关[1-4]。免疫细胞过量释放NO、IL-1β、IL-6和COX-2等炎症介质, 可导致细胞信号通路调控的改变, 进而改变机体的病理反应[5-7]。因此, 抑制炎症因子释放, 研发新型高效低毒的抗炎药物始终是医药领域的重要命题。小窝是一种直径为50~80 nm的细胞质膜结构, 主要由胆固醇、糖酯及小窝蛋白(caveolin) 组成[8]。CAV-1 (caveolin-1) 是位于小窝表面的标志性蛋白, 广泛分布于哺乳动物的内皮细胞、脂肪细胞和血管平滑肌细胞中, 近年发现, CAV-1还广泛表达于免疫细胞, 参与巨噬细胞分化与凋亡的调节、B淋巴细胞活化和抗原呈递过程、T淋巴细胞共刺激信号以及免疫突触活动、中性粒细胞介导的炎症反应[9]。
课题组前期合成了二苯甲酮、二苯甲烷、苯基呋喃甲酮等不同骨架类型的系列卤酚化合物, 通过体内外系统的活性筛选获得了苗头化合物2, 4', 5'-三羟基-5, 2'-二溴二苯甲酮(LM49, 图 1), 其具有很强的抗大鼠急性肾盂肾炎、动脉粥样硬化、糖尿病肾病等多种药理活性, 而抗炎、抗氧化应激和调节免疫是其发挥药理活性的主要机制, CAV-1是其抑制炎症保护细胞的关键蛋白[10-16]。二苯甲酰甲烷(DBM) 是从胀果甘草中提取的一种黄酮类天然产物, 其结构是与两个苯环共轭的1, 3-β-二酮, 与LM49的骨架结构高度相似, 较LM49更为柔性, 能与多种受体结合, 呈现出抗炎、抗氧化和抗肿瘤等广泛的生物活性[17-20]。本文以LM49为先导化合物, 以DBM骨架替代二苯甲酮, 在母核上引入羟基、卤素、甲基、乙基、叔丁基、三氟甲基等多种基团, 设计合成系列DBM类卤酚, 采用生物膜干涉(BLI) 技术[21], 定量研究化合物与炎症相关蛋白CAV-1的相互作用, 并评价其体外抗炎、抗氧化活性, 以期获得靶向CAV-1且具有强抗炎抗氧化活性的候选药物。

|
Figure 1 Chemical structure of the lead compound LM49 |
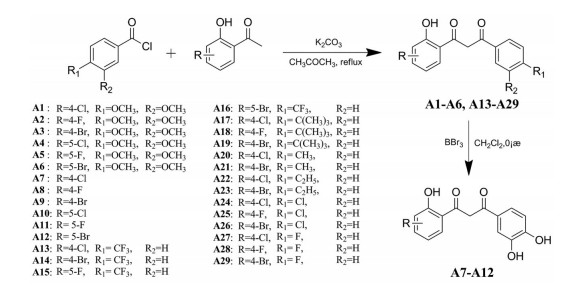
目标化合物A1~A29的合成见合成路线1, 3, 4-二甲氧基苯甲酰氯在无水碳酸钾的催化下和不同卤素取代的邻羟基苯乙酮发生Baker-ventaraman重排生成关键中间体A1~A6, 通过三溴化硼脱甲基获得A7~A12。以不同基团取代的邻羟基苯乙酮和苯甲酰氯为原料, 直接反应得到A13~A29。合成的化合物理化性质和波谱数据分别见表 1、2。
| Table 1 Physical properties and purities of target compounds. *New compound; aDetected by HPLC |
| Table 2 Spectra data of target compounds |
Baker-ventaraman重排是关键中间体邻酰氧基苯乙酮重排得到邻羟基苯基β-二酮, 常用碳酸钾、氢氧化钾、氢化钠、吡啶、三苯甲基钠等作为催化剂。本文选择碳酸钾为催化剂, 在制备DBM类卤酚的过程中, 发现取代的邻羟基苯乙酮与碳酸钾的最佳摩尔比为1∶6时, 产率较高。薄层色谱(TLC) 监控反应进程, 发现目标化合物会经历酯化、重排的反应过程, 表现在薄层色谱上即酚羟基显色从无到有, 并在365 nm波长下, 有强烈的黄色荧光。酰氯上的取代基团不同, 反应快慢差别较大, 当酰氯上有三氟甲基、卤素等吸电子基团时, 反应时间约需24 h; 酰氯上有甲基、乙基、叔丁基、邻二甲氧基等给电子基团时, 反应最慢, 需24~72 h反应才会结束。BBr3遇水会产生大量气体, 所以脱甲基反应所用溶剂要做除水处理, 且反应会大量放热, 需缓慢滴加BBr3。
|
Scheme 1 Synthesis route of target compounds A1-A29 |
DBM类卤酚属于β-二酮类化合物, 可能存在酮式-烯醇式的互变异构。以CDCl3作溶剂, 对目标化合物进行1H NMR、13C NMR表征时, 发现其并不是β-二酮结构, 而是烯醇式构型。但是, 并不能准确说明是结构上的哪个羰基形成烯醇式。因此, 进一步采取HMBC谱进行确证, 以化合物A26为例(图 2), 以CDCl3为溶剂, 一维氢谱显示在δ = 15.40和δ = 12.15处有两个羟基的吸收峰, δ = 7.59 (d, J = 8.7 Hz, 1H) 是A环上6号位的氢; 碳谱上只在δ = 195.0位移处出现一个羰基碳; HMBC谱图结果表明: 羰基碳(δ = 195.0) 与δ = 7.59 (d, J = 8.7 Hz, 1H) 处的氢远程相关, 与B环上氢未见相关。由此可说明, 羰基碳紧邻A环, 化合物A26在CDCl3中主要以烯醇式结构存在。其他所有目标化合物在CDCl3溶剂中表征时都出现了同样的情况。

|
Figure 2 Keto-enol tautomerism of compound A26 |
CAV-1参与动脉粥样硬化、糖尿病肾病、急性肾损伤等疾病的发生、发展过程, 并在免疫细胞活化引起的炎症过程中发挥重要作用[9]。通过采用BLI技术, 定量研究化合物与CAV-1的相互作用, 发现DBM类卤酚能够与CAV-1特异性结合, 具有较强的亲和力(表 3)。亲和力强弱通过结合解离平衡常数KD表达, KD越小, 表示化合物与CAV-1的亲和力越大, 结果显示, 在10-4 ~ 10-7 mol·L-1内, 有12个目标化合物与CAV-1的结合有明确的浓度依赖性, 其亲和力顺序为A16 > A18 > A27 > A26 > A22 > A13 > A20 > A29 > A17 > A6 > A1 > A3。图 3所示为与CAV-1有较强亲和力的化合物的结合动力学过程, 横坐标前60 s表示化合物与蛋白缓慢结合, 后60 s表示化合物与蛋白缓慢解离, 结合响应信号值随化合物浓度的升高而浓度依赖性的增强, 表明化合物与CAV-1为特异性结合, 提示该类化合物可直接作用于炎症相关蛋白CAV-1。
| Table 3 The dissociation equilibrium constant of target compounds and CAV-1 |

|
Figure 3 BLI analysis of compounds binding to CAV-1 |
CAV-1在小鼠巨噬细胞中广泛表达, 并在LPS诱导的免疫调节中具有重要作用[9]。DBM可下调小鼠RAW264.7细胞中iNOS的表达, 显著抑制LPS诱导的NO产生, 有效抑制促炎细胞因子TNF-α、IL-6和IL-1β的释放, 还可剂量依赖性的降低COX-2的产生[17]。考虑到目标化合物与CAV-1存在特异性结合, 而CAV-1与炎症有重要关联, 因此, 进一步评价了该类化合物的体外抗炎活性。
3.1 细胞毒性检测目标化合物对小鼠巨噬细胞RAW264.7活力的影响结果表明(表 4): 在20 μmol·L-1时, 与空白对照组相比, 16个目标化合物A2、A6、A7、A8、A9、A10、A12、A14、A17、A18、A19、A20、A22、A23、A24、A29的细胞存活率在80%以上, 在该浓度下基本没有细胞毒性, 安全性较高。
| Table 4 The survival rate of target compounds at 20 μmol·L-1 (n = 3). aAverage value by three independent experimental measurements |
采用LPS诱导的小鼠巨噬细胞RAW264.7为炎症模型, 以塞来昔布为阳性对照, 采用Griess法测定16个在20 μmol·L-1时无细胞毒性的化合物对NO释放量的影响[15]。表 5结果显示, 5个化合物A7、A8、A10、A12、A29在20 μmol·L-1时均可显著抑制NO的释放, 对NO抑制率大于70%, 显著高于阳性对照塞来昔布(抑制率为58%)。在1.25~20 μmol·L-1的浓度梯度下测定其IC50值, 化合物A7、A10、A12均可剂量依赖性的抑制NO释放, 活性顺序为A10 > A12 > A7, A7、A10、A12对NO的IC50值分别为6.51 ± 0.36 μmol·L-1、3.93 ± 0.24 μmol·L-1、5.36 ± 0.26 μmol·L-1, 高于阳性药物塞来昔布(IC50为17.89 ± 3.19 μmol·L-1)。而化合物A8和A29在1.25~20 μmol·L-1的浓度内量效关系不明显。
| Table 5 The inhibitory effects of target compounds on NO release. Celecoxib was used as a positive reference compound. aAverage value by three independent experimental measurements at 20 μmol·L-1. bMeans ± SD (n = 3). N.D.: Not detected |
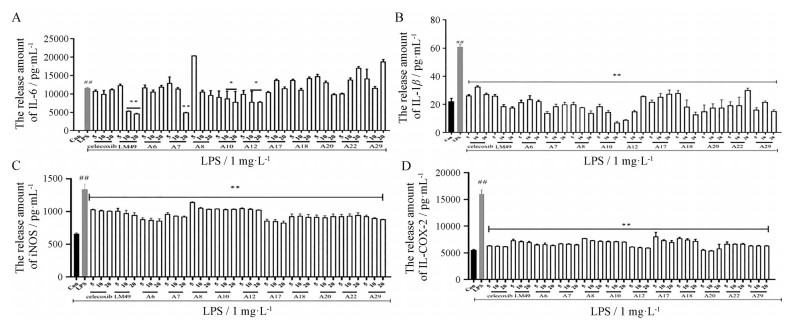
考虑到其他化合物虽对NO没有显著的抑制活性, 但可能通过其他途径抑制炎症。因此, 选择20 μmol·L-1时无细胞毒性, 且与CAV-1特异性结合的5个化合物A6、A17、A18、A20、A22及在20 μmol·L-1时对NO抑制率大于70%的5个优选化合物A7、A8、A10、A12、A29共10个化合物, 采用ELISA法测定其对LPS诱导的RAW264.7细胞培养上清中IL-6、IL-1β、iNOS和COX-2释放量的影响(图 4)。与空白对照组相比, LPS可诱导IL-6、IL-1β、iNOS和COX-2的释放。图 4A表明: 在5~20 μmol·L-1内, A7、A10、A12可剂量依赖性的显著抑制IL-6释放; 图 4B~D表明: 10个化合物均能显著抑制IL-1β、iNOS和COX-2的释放, 在5~20 μmol·L-1之间, A8、A10、A18可剂量依赖性地抑制IL-1β; A6、A7、A8、A17、A29可浓度依赖性地抑制iNOS释放; A8、A12、A17、A18可剂量依赖性地抑制COX-2释放。化合物A8对IL-1β、iNOS和COX-2均有显著的抑制作用。化合物A10对NO、IL-6及IL-1β均有显著的抑制作用。化合物A12可同时抑制NO和COX-2。化合物A17可同时抑制iNOS和COX-2。化合物A18可同时抑制IL-1β及COX-2。
|
Figure 4 The inhibitory effects of target compounds on the release of IL-6, IL-1β, iNOS, and COX-2. n = 3, |
二苯甲酰甲烷类卤酚能够与CAV-1特异性结合, 提示该类化合物可能在抑制炎症、抗氧化应激中起着重要的作用。因此, 通过测定化合物对DPPH和ABTS自由基的清除能力, 进一步评价其抗氧化活性。表 6结果表明: 不同浓度的化合物对DPPH自由基都具有清除作用, 随着浓度提高, 清除率也随之不断增加, 23个化合物呈现出较好的DPPH自由基清除活性, 并具有浓度依赖性。其活性顺序为A18 > A14 > A3 > A26 > A20 > A23 > A16 > A29 > A15 > A25 > A19 > A28 > A5 > A6 > A24 > A22 > A17 > A4 > A21 > A13 > A1 > A2 > A27, 其中A18的DPPH自由基清除能力最强, 与阳性对照trolox (0.18 ± 0.05 mg·mL-1) 相当, 优于先导物LM49。20个化合物有ABTS自由基清除活性, 其活性顺序为A8 > A10 > A13 > A22 > A20 > A23 > A24 > A28 > A1 > A29 > A2 ≈ A3 > A18 > A14 > A26 > A16 > A6 > A15 > A17 > A19, 9个化合物的清除能力优于阳性对照trolox, 其中A8、A10、A13的清除能力最强, 与先导化合物LM49相当。
| Table 6 Scavenging ability of target compounds on DPPH and ABTS free radical |
本文合成的29个二苯甲酰甲烷类卤酚中, 27个未见文献报道。12个化合物与CAV-1存在特异性结合, 其中, 化合物A6、A17、A18、A29既与CAV-1有特异性结合, 又具有很强的抗炎和抗氧化作用, 化合物A18可显著抑制IL-1β, 化合物A6、A17、A29可显著抑制iNOS, 化合物A17、A18可显著抑制COX-2, 这些化合物可能是通过特异性结合CAV-1, 进而影响炎症和氧化应激相关的信号通路。此外, 化合物A7、A8、A10、A12虽与CAV-1没有直接相互作用, 但是, 也显示了很强的抗炎作用, 可同时抑制IL-6和COX-2的释放, 化合物A8、A10可显著抑制IL-1β, A7、A8、A12可有效抑制iNOS, 而且, 结构中含有邻位酚羟基的化合物A8、A10同时具有最强的ABTS自由基清除活性。值得注意的是, 该类化合物对IL-1β和COX-2的抑制作用最为明显, 而IL-1β是关节炎发生的驱动因素, 在关节炎发作期间产生的大量促炎细胞因子中, IL-1β充当着关键的调控角色[22]。因此, 该类化合物在防治关节炎方面可能有重要的研究价值。
实验部分化合物熔点采用X-4显微熔点仪测定(温度未经校正); 化合物纯度采用Waters Acquity Arc型高效液相色谱仪检测; 核磁共振氢谱、碳谱采用Bruker-Avance 600NMR核磁共振仪测定(TMS为内标); 质谱采用WatersZQ-2000质谱仪测定; BLI实验采用Forte Bio Octet Red 96e型生物膜干涉仪; 吸光度的测定选用Epoch型酶标检测仪。
薄层色谱用硅胶GF254购于青岛海洋化工厂; CAV-1蛋白购自武汉云克隆科技股份有限公司; 标准胎牛血清、DMEM高糖、RAW264.7细胞均由武汉博士德生物工程有限公司提供; NO测试盒由北京普利莱生物公司提供; IL-6、IL-1β、iNOS和COX-2试剂盒均由武汉博士德生物工程有限公司提供; 主要试剂5-氯-2-羟基苯乙酮、5-氟-2-羟基苯乙酮、5-溴-2-羟基苯乙酮、4-氯-2-羟基苯乙酮、4-三氟甲基苯甲酰氯、4-叔丁基苯甲酰氯购自北京百灵威有限公司, 4-氟-2-羟基苯乙酮、4-溴-2-羟基苯乙酮、4-甲基苯甲酰氯、4-氯苯甲酰氯、4-氟苯甲酰氯、3, 4-二甲氧基苯甲酰氯购自上海迈瑞尔有限公司, 4-乙基苯甲酰氯购自上海阿拉丁有限公司, 其他常规化学试剂均为国产分析纯或化学纯。
1 化学合成 1.1 1-(3, 4-二甲氧基苯基)-3-(4-氯-2-羟基苯基)-1, 3-丙二酮(A1)将0.77 mL (5.8 mmol) 4-氯-2-羟基苯乙酮溶于12 mL无水丙酮, 加入无水碳酸钾4.8 g (34 mmol), 将2.7 mL (17 mmol) 3, 4-二甲氧基苯甲酰氯缓慢加入反应体系中。加热回流, TLC监控反应进程, 搅拌24 h, 反应结束后抽滤, 收集固体, 用少量丙酮洗涤后, 加至100 mL 10%乙酸中, 充分搅拌, 有气体逸出, 停止冒泡后抽滤, 收集固体, 真空烘箱干燥, 乙醇重结晶, 得到亮黄色粉末0.82 g, 产率为41.7%。类似方法制备得到目标化合物A2~A6、A13~A29, 产率为9.3%~55.8%。
1.2 1-(3, 4-二羟基苯基)-3-(4-氯-2-羟基苯基)-1, 3-丙二酮(A7)取50 mg化合物A1溶于少量无水二氯甲烷, 在-30 ℃下, 滴加1.0 mol·L-1的BBr3/CH2Cl2溶液1.0 mL, 反应30 min后, 升至室温反应2 h, TLC监测, FeCl3溶液显色, 反应结束后, 将反应液倒入冰水淬灭, 抽滤, 真空烘箱干燥, 乙醇重结晶, 得到22 mg黄色固体, 产率为12.7%。类似方法制备得到A8~A12, 产率为10.1%~15.6%。
2 目标化合物的纯度测定采用Waters Acquity Arc型高效液相色谱仪测定化合物纯度, 色谱条件: Diamonsil C18 (250 mm × 4.6 mm, 5 µm) 色谱柱, 甲醇/水为流动相进行线性梯度洗脱: 5∶95洗脱40 min, 95∶5洗脱10 min, 5∶95洗脱10 min; 化合物A1~A29的检测波长分别为251.0、251.0、268.0、384.9、384.0、254.0、385.0、379.0、346.0、348.0、385.0、390.0、261.6、262.8、247.2、363.0、234.0、234.0、234.0、363.5、363.0、363.0、363.0、363.0、360.0、363.0、361.0、358.0、363.0 nm, 流速1.0 mL·min-1, 柱温30 ℃, 进样体积10 μL。
3 BLI实验采用Forte Bio Octet Red 96e型生物膜干涉仪, 含有5% DMSO的PBS作为工作液。将带有His标签的CAV-1蛋白包被至Ni-NTA生物传感器上, 将获得的传感器分别浸没至含有不同浓度目标化合物的溶液中(化合物浓度为3.13、6.25、12.5、25、50和100 µmol·L-1) 60 s作为结合步骤, 然后将传感器浸没至空白对照溶液中60 s作为解离步骤。实验中, 未包被CAV-1的传感器作为空白对照以消除背景信号; 包被CAV-1浸没在空白对照溶液中, 而未与小分子溶液接触的传感器用以消除信号基线漂移。使用Forte Bio Data Analysis软件(v.11.1.0.4) 分析所得数据, 计算结合解离常数。
4 细胞毒性检测取对数生长期的细胞接种于96孔板中, 5% CO2、37 ℃孵箱中培养24 h, 然后分别加入样品(终浓度为20 μmol·L-1) 和脂多糖(LPS) (终质量浓度为1 mg·L-1) 处理24 h吸净细胞上清液后, 在各孔中加入5 g·L-1甲基噻唑基四唑(MTT) 10 μL及无血清培养基100 μL, 继续避光培养4 h后, 轻轻吸弃孔内液体, 每孔加入100 μL二甲基亚砜(DMSO), 振荡使细胞内结晶充分溶解, 于酶标仪490 nm波长处测定各孔的吸光度A值。通过以下公式计算出各组的存活率: 存活率(%) = A样品组/A空白组×100%。
5 体外抗炎活性研究取对数生长期的细胞接种于96孔板, 5% CO2、37 ℃孵箱中培养24 h, 设空白对照组、LPS模型组(1 mg·L-1)、化合物(20 μmol·L-1) 和LPS共同作用组、阳性药物和LPS共同作用组, 在细胞培养箱内继续培养24 h后取细胞培养上清液, 采用Griess法测定NO释放量。按“抑制率(%) = (A模型组-A样品组)/(A模型组-A空白组)×100%”计算样品对LPS诱导的小鼠巨噬细胞NO的抑制作用。
采用ELISA法测定RAW264.7细胞培养上清中IL-6、IL-1β、iNOS和COX-2的释放量。实验分组如下: 空白对照组、LPS模型组(1 mg·L-1)、化合物(5、10、20 μmol·L-1) 和LPS共同作用组、阳性对照和LPS共同作用组, 在细胞培养箱内继续培养24 h后取细胞培养上清液, 采用ELISA法测定IL-6、IL-1β、iNOS和COX-2释放量。按“抑制率(%) = (A模型组-A样品组)/(A模型组-A空白组)×100%”计算样品对LPS诱导的小鼠巨噬细胞炎症因子生成的抑制作用。
6 体外抗氧化活性研究将96孔板每孔加入120 μL DPPH乙醇溶液, 加60 μL不同浓度样品溶液, 混匀, 暗处静置30 min后, 在519 nm处测定样品的吸光值。清除率(%)= (A0-A样品)/A0×100%。
将96孔板每孔加入200 μL ABTS乙醇溶液, 加10 μL不同浓度样品溶液, 混匀, 室温避光静置5 min后, 在734 nm处测定样品的吸光值。抑制率(%) = (A0-A样品)/A0×100%。
7 统计软件数据以至少3个独立实验的平均值±标准差表示, 用GraphPad Prism 8.0检验评定各组间的统计显著性。
作者贡献: 刘恒江负责化合物的设计合成、抗氧化活性筛选, 程宁宁负责化合物与CAV-1的分子互作和纯度测定, 张梦如负责抗炎活性的筛选, 原红霞负责指导分子互作, 张圆琳负责指导化合物的纯度测定, 冯秀娥负责论文的设计、修改、构效关系分析, 李青山负责论文的整体构思。
利益冲突: 本文作者声明无任何利益冲突。
| [1] |
Zuo X, Luo JQ, Jiang XH, et al. The anti-atherosclerotic effect and mechanism study of berberine in hyperlipidemic ApoE-/- mice[J]. Acta Pharm Sin (药学学报), 2019, 54: 104-110. |
| [2] |
Hou BY, Li L, Zhang L, et al. The role of SIRT1 in the treatment of diabetic nephropathy[J]. Acta Pharm Sin (药学学报), 2014, 49: 1625-1630. |
| [3] |
Zhou YJ, Wang H, Li L, et al. Inhibitory effect of kaempferol on inflammatory response of lipopolysaccharide-stimulated human mast cells[J]. Acta Pharm Sin (药学学报), 2015, 50: 702-707. |
| [4] |
Zeng H, Bi HC, Huang M. A review on regulation of drug transporters during inflammation[J]. Acta Pharm Sin (药学学报), 2011, 46: 773-779. |
| [5] |
Yang L, Shi H, Li YL, et al. Synthesis and anti-inflammatory activity of novel isobutyl benzophenone derivatives[J]. Acta Pharm Sin (药学学报), 2018, 53: 256-262. |
| [6] |
Zhao B, Li DT, Luo JR, et al. Synthesis and in vitro anti-inflammatory activity of N-alkyl-4-alkoxyformylbenzoxazolone derivatives[J]. Chin J Med Chem (中国药物化学杂志), 2020, 30: 583-588. |
| [7] |
Xu J, Zhao Y, Aisa HA. Anti-inflammatory effect of pomegranate flower in lipopolysaccharide (LPS)-stimulated RAW264.7 macrophages[J]. Pharm Biol, 2017, 55: 2095-2101. DOI:10.1080/13880209.2017.1357737 |
| [8] |
Lu R, Tao LJ, Peng ZZ. Research progress of caveolin 1 in acute and chronic kidney diseases[J]. Chin J Crit Care Med (Electro Ed) (中国急救医学·电子版), 2020, 13: 63-69. |
| [9] |
Zhu Y, Qu C, Zou W. Role of caveolin-1 in regulation of immunity[J]. Chin J Biochem Mol Biol (中国生物化学与分子生物学报), 2016, 32: 267-273. |
| [10] |
Feng XE, Wang QJ, Gao J, et al. Synthesis of novel nitrogen-containing heterocycle bromophenols and their interaction with keap1 protein by molecular docking[J]. Molecules, 2017, 22: 2142. DOI:10.3390/molecules22122142 |
| [11] |
Zhang YL, Feng XE, Chang RR, et al. Therapeutic effects of 5, 2'-dibromo-2, 4', 5'-trihydroxydiphenylmethanone (LM49) in an experimental rat model of acute pyelonephritis by immunomodulation and anti-inflammation[J]. Int Immunopharmacol, 2018, 62: 155-164. DOI:10.1016/j.intimp.2018.07.001 |
| [12] |
Li QS, Feng XE, Chang RR, et al. Application of two halophenol compounds in the drug preparation against type Ⅱ diabetic nephropathy: CN, ZL201610278158.4 [P]. 2018-10-02.
|
| [13] |
Li QS, Feng XE, Ban SR. Application of polyhydroxy brominated benzophenone compounds and their derivatives in the treatment and prevention of atherosclerosis: CN, ZL201210565382.3 [P]. 2014-09-17.
|
| [14] |
Feng XE, Liang TG, Gao J, et al. Heme oxygenase-1, a key enzyme for the cytoprotective actions of halophenols by upregulating Nrf2 expression via activating Erk1/2 and PI3K/Akt in EA. hy926 cells[J]. Oxid Med Cell Longev, 2017, 2017: 7028478. |
| [15] |
Yang F, Cai HH, Feng XE, et al. 5, 2'-Dibromo-2, 4, 5-trihydroxydiphenylmethanone, a novel immunomodulator of T lymphocytes by regulating the CD4+ T cell subset balance via activating the mitogen-activated protein kinase pathway[J]. Int Immunopharmacol, 2019, 72: 487-495. DOI:10.1016/j.intimp.2019.04.034 |
| [16] |
Zhang YL. Polyphenol LM49 Protects Vascular Endothelial Cells from H2O2-induced Injury through Suppressing the Phosphorylation of Caveolin-1 (多酚化合物LM49通过抑制caveolin-1磷酸化发挥对H2O2诱导损伤的血管内皮细胞的保护作用) [D]. Taiyuan: Shanxi Medical University, 2018.
|
| [17] |
Kim JH, Kim CY, Kang B. Dibenzoylmethane suppresses lipid accumulation and reactive oxygen species production through regulation of nuclear factor (erythroid-derived 2)-like 2 and insulin signaling in adipocytes[J]. Biol Pharm Bull, 2018, 41: 680. DOI:10.1248/bpb.b17-00837 |
| [18] |
Kang B, Kim JH, Kim CY. Dibenzoylmethane, a component of licorice, suppresses monocyte-to-macrophage differentiation and inflammatory responses in human monocytes and mouse macrophages[J]. Biol Pharm Bull, 2018, 41: 1228-1236. DOI:10.1248/bpb.b18-00064 |
| [19] |
Cao MN, Wang HX. Dibenzoylmethane protects against CCl4-induced acute liver injury by activating Nrf2 via JNK, AMPK, and calcium signaling[J]. AAPS J, 2017, 19: 1703-1714. DOI:10.1208/s12248-017-0133-1 |
| [20] |
Lee ES, Kwon MH, Kim HM. Dibenzoylmethane ameliorates lipid-induced inflammation and oxidative injury in diabetic nephropathy[J]. J Endocrinol, 2019, 240: 169-179. DOI:10.1530/JOE-18-0206 |
| [21] |
Desai M, Di R, Fan HZ. Application of biolayer interferometry (BLI) for studying protein-protein interactions in transcription[J]. J Vis Exp, 2019, 149: e59687. |
| [22] |
Cao JM, Wang XX, Guo JY, et al. The proinflammatory role and clinical significance of IL-1 beta in gouty arthritis[J]. Chin J Clin (Electron Ed) (中华临床医师杂志·电子版), 2016, 10: 728-731. |
 2021, Vol. 56
2021, Vol. 56


