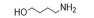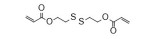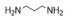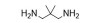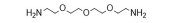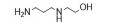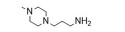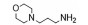基因治疗是一种将特定治疗基因如DNA、siRNA或miRNA等通过特定手段转移到特定的细胞中的治疗方法。基因导入通常需要病毒或非病毒载体进行递送。阳离子聚合物是非基因载体中最有潜力的类型, 常用聚合物有聚乙烯亚胺(polyetherimide, PEI)[1]、聚酰胺-胺[poly (amidoamine), PAMAM][2]、聚酰胺胺[poly (amino amine)s, PAAs][3]和聚(β氨基酯) [poly (β-amino ester)s, PβAEs][4]等, 其中PβAEs具有结构多样性、配体特异性摄取能力、可促进内体逃逸的缓冲能力、酯键水解产生的生物降解性、低细胞毒性和优良的转染能力等优点。PβAEs出色的基因转染性能引起了研究者的兴趣, 近些年来PβAEs用于基因递送的报道逐渐增多。本综述全面地介绍了PβAEs的发展背景、结构及性质, 并总结了不同类型PβAEs基因载体的研究进展。
1 PβAEs的基本介绍PβAEs是一类具有叔胺主链结构的生物可降解的阳离子聚合物。1970年, Danusso等[5]尝试在双丙烯酰胺中加入双官能胺, 通过迈克尔加成反应合成了骨架中含有叔胺的线性聚氨基胺。随后, 以此为启发, Galli等[6]于1983年首次合成了PβAEs。在2000年Langer实验室首次使用PβAEs作为转染试剂, 研究聚合物与DNA的自组装过程、复合物粒径和电位等物理性能、细胞毒性等生物性能, 引起了人们的兴趣[7]。
1.1 PβAEs的基本性质PβAEs可溶于0.1 mol·L-1乙醇钠溶液(pH 5.4) 等酸性水溶液和甲醇等有机溶剂中, 不溶于中性及碱性环境中。在生物应用时, 一般将PβAEs溶解在二甲基亚砜(DMSO) 中, 再使用25 mmol·L-1醋酸钠溶液(pH 5.0~5.2) 稀释。PβAEs的物理化学性质如疏水性、分子质量(molecular weight, Mr) 和电荷等, 在很大程度上取决于聚合反应中使用的单体。通过改变单体和合成条件, PβAEs的分子质量可以在2~120 kDa之间变化。根据化学计量过量单体的使用, PβAEs可有胺或二丙烯酸酯封端的结构。因此, PβAEs具有很强的化学结构灵活性, 可通过改变基础单体和侧链修饰调整聚合物结构和性能。
PβAEs的化学结构使其拥有良好的基因载体生物性能。PβAEs主链上不仅含有在生理pH值下可生物降解的酯键, 还有可质子化的氨基(如端链上的伯胺、仲胺和主链上的叔胺)。研究表明, PβAEs骨架上的叔胺基使其pH在3.5~7.2内显示出优越的pH敏感特性[8], 质子化的叔胺使得聚合物带正电和亲水性, 该过程通常是可逆的[9, 10], 因此具有“质子海绵效应”, 可以轻松逃逸溶酶体。PβAEs这个电荷特性使其有望成为控制释放和可编程释放的候选聚合物。通常, PβAEs在水性条件下降解非常快, 在磷酸盐缓冲液(PBS, 37 ℃) 中的半衰期为1.5~6 h不等; 在酸性条件下相对稳定。在生理环境条件下, PβAEs会降解产生惰性小分子如双(β-氨基酸)、二醇产物和聚(丙烯酸) 动力学链等[11]。研究证实, 这些降解产物对哺乳动物细胞无害, 对健康细胞的代谢活动影响甚微。Tzeng团队[12]研究表明, PβAEs在星形胶质瘤等癌细胞的转染效率达到10%~20%, 而在健康细胞中仅有0.3%~4.8%。该结果证明PβAEs具有良好的生物相容性。PβAEs的生物可降解性和较快的降解速率导致了较低的细胞毒性。在细胞毒性实验中, 通常在聚合物/DNA或聚合物/siRNA的重量比高达25∶1甚至70∶1时, 仍有80%以上的细胞活力[13, 14]。因此, PβAEs多用于可降解组织工程和水凝胶的应用。此外, 研究表明PβAEs的毒性明显低于其他阳离子聚合物, 如聚甲基丙烯酸N, N-二甲基氨基乙酯[poly (N, N-dimethylaminoethyl methacrylate), PDMAEMA]、PEI[15]和聚(L-赖氨酸)[15]等。另一方面, Andorko等[16]研究表明游离溶液形式的PβAEs在免疫学上是惰性的, 而PβAEs颗粒形式在初级免疫细胞和动物中都表现出内在的免疫原性, 引起的免疫原性随着降解时间的增加和Mr的降低而减弱。相反, 在小鼠中PβAEs颗粒会增加淋巴结中细胞的数量和激活状态。利用该免疫学特征可以开发靶向实体癌或传染病来促进治疗, 但可能不适用于减轻自身免疫性疾病的疫苗和免疫疗法。综上所述, PβAEs是一种细胞毒性低、生物相容性好的生物可降解性基因载体材料。
1.2 PβAEs的合成PβAEs通常通过分步生长聚合(如迈克尔加成反应) 或开环聚合反应来制备, 其中迈克尔加成反应是最常用的反应。PβAEs的合成原料来源简单, 所需单体大部分都已经商品化。合成可以在没有溶剂、催化剂或复杂的保护基策略的条件下进行。反应一般在无溶剂或无水有机溶剂中进行, 以减少聚合过程中的水解反应。常用的溶剂有DMSO、DMF、二氯甲烷和甲醇等。DMSO是细胞培养中广泛使用的溶剂, 可以与水混溶, 具有良好的耐受性, 常用于合成PβAEs的溶剂。在合成过程中溶剂的种类对合成的PβAEs的Mr有一定的影响。反应的原子利用率高, 反应后需要进行简单纯化。聚合结束后通常使用乙醚沉淀去除未反应的小分子, 或透析后在真空下干燥得到样品。得到的PβAEs一般立即使用或溶解在DMSO中, 并存储-20 ℃条件下, 储存时保持干燥, 防止酯键水解。
总的来说, PβAEs具有结构调节灵活性、合成简单和原子利用率高等优点和优良的基因载体生物性能, 作为非病毒基因载体具有很大的发展潜力, 有望成为最有希望的阳离子聚合物之一。
2 PβAEs的类型PβAEs根据其结构类型分为线性聚(β-氨基酯) [linear poly (β-amino ester)s, LPβAEs]、超支化聚(β-氨基酯) [hyperbranched poly (β-amino ester)s, HPβAEs]、共聚物、杂交纳米粒和水凝胶等类型。合成PβAEs常用的单体如表 1所示。
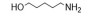
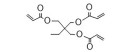
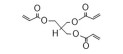
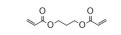
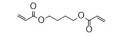
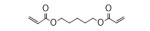
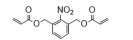
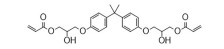
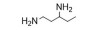
| Table 1 Commonly used A2-type amine monomer, B3-type triacrylate monomer, C2-type diacrylate monomer and end capping amines in the synthesis of poly (β-amino ester)s (PβAEs) |
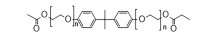
基础LPβAEs通常是双丙烯酸酯与侧链胺单体(伯胺或仲二胺) 反应生成的线性聚合物。随着研究发展, 发现末端修饰的LPβAEs具有更好的转染性能, 逐渐开发出不同胺单体封端的LPβAEs。末端修饰的LPβAEs通常使用两步法合成聚合物, 首先制备丙烯酸酯封端的聚合物, 然后使用不同的胺封端剂生成末端官能化的聚合物。基础LPβAEs和封端修饰LPβAEs的反应通式如图 1、2所示。
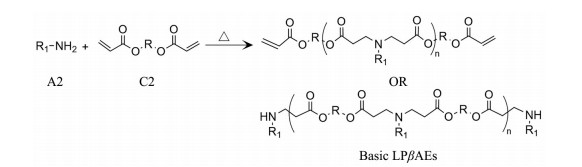
|
Figure 1 Synthesis of basic linear poly (β-amino ester)s (LPβAEs). A2: A2-type amine monomer; C2: C2-type diacrylate monomer |
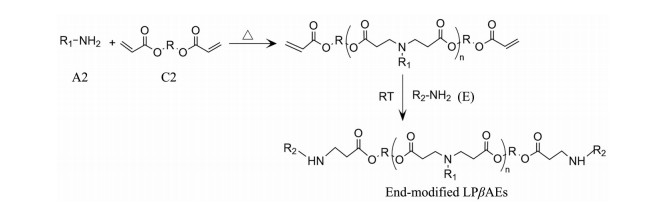
|
Figure 2 Synthesis of end-modified LPβAEs. RT: Room temperature; E: End capping amine |
Lynn等[7]在2000年首次通过共轭加成设计并合成了LPβAEs, 简单评价了其作为基因载体的性能, 开启人们对PβAEs在基因递送领域的研究。Anderson等[17]构建了二代LPβAEs组合库, 研究发现筛选的3种性能最高的聚合物(C32、JJ28、C28, 其单体结构见表 1) 都有醇羟基和疏水双丙烯酸酯结构, 其中C32具有最高的转染效率和较低细胞毒性[18]。Bishop等[19]采用计算机模拟PCA分析表明, 氨基醇/丙烯酸酯的比例、油水分配系数(logP*) 和Mr是影响末端修饰的PβAEs转染效率的3个重要的物理化学参数。氨基醇/丙烯酸酯的比例影响封端的结构, Akinc等[15]研究表明丙烯酸酯封端的聚合物转染效率不如胺封端的聚合物。因此, PβAEs通常在氨基醇/丙烯酸酯比为1.2∶1的条件下合成。而聚合物的疏水性会影响转染效率和细胞毒性。研究表明, 末端用亲水性胺或羟基修饰可增强细胞表面相互作用和细胞摄取的能力, 从而得到更高的转染效率[20], 而疏水性过高时会影响降解性, 增加细胞毒性。因此, PβAEs的亲水性和疏水性应该有一定的平衡。Mr对转染性能有显著的影响。研究表明, 只有平均Mr超过10 kDa的PβAEs才能达到最高转染水平[18, 21]。Keeney等[22]认为LPβAEs的摄取和转染性能与其封端结构密切相关, 而对聚合物的物理化学性质依赖性相对较小。Green等[21]研究显示聚合物末端附近同时具有伯胺和仲胺可显著改善递送。末端胺极大地影响了LPβAEs结合和包装DNA的能力, 以及缓冲内体以促进渗透性肿胀和破裂的能力[23]。Zugates等[20]组建了37种胺单体修饰主体C32的组合文库, 研究确定伯二胺是最有效的封端剂。综上所述, PβAEs的结构对聚合物与DNA的结合能力、细胞毒性和转染性能有很大的影响。影响递送性能的因素有单体类型、Mr、末端基团和亲水/疏水含量等物化因素, 还有细胞系/细胞类型等其他因素。聚合物通常在氨基醇/丙烯酸酯比为1.2∶1的条件下合成, 使用双丙烯酸酯(4~6个内部碳) 和短链氨基醇(4~5个直链碳) 合成基础聚合物, 再与封端剂(短链伯胺) 反应合成得到末端修饰的LPβAEs, 可以得到转染性能较好的基因载体。例如, Mangraviti团队[24]使用1-(3-氨丙基)-4-甲基哌嗪[1-(3-aminopropyl)-4-methylpiperazine, MPZ] 封端的聚合物C28得到聚合物PβAE-447, 结合单纯疱疹病毒I型胸苷激酶(herpes simplex thymidine kinase, HSVtk) DNA得到复合纳米粒(nanoparticles, NPs), 在两种体外神经胶质瘤细胞系中都显示出100%的癌细胞杀伤能力, 而编码GFP的对照NPs几乎没有细胞毒性。在体内评价中, 通过对流增强递送(convection-enhanced delivery, CED) 与更昔洛韦(GCV) 的全身给药相结合, 用PβAE/HSVtk输注进行治疗。结果显示, 在9 L大鼠神经胶质瘤模型中存活率显著增加(P = 0.001 2)。随后Smith等[25]使用PβAE-447作为T细胞靶向纳米载体的核心材料, 携带CD19特异性嵌合抗原受体(chimeric antigen receptors, CARs) 基因的纳米粒可选择性、快速地在体内编辑T细胞的特异性, 从而在小鼠体内实现白血病的治疗。在抗肿瘤活性实验中, 系统地将表达荧光素酶的Eμ-ALL01白血病细胞注入白化C57BL/6小鼠, 并使用生物发光成像来量化治疗组之间肿瘤进展的差异。当注射编程194-1BBz (+iPB7转座酶) 的PβAE纳米载体时, 10只小鼠中有7只肿瘤被根除, 其余的小鼠表现出实质性的退化, 存活率平均提高58天。Zhang等[26]还使用PβAE-447结合体外转录的编码M1极化转录因子的mRNA, 以重新编程肿瘤相关巨噬细胞(tumor-associated macrophages, TAM), 不会引起全身毒性。在卵巢癌、黑色素瘤和胶质母细胞瘤模型中, 小鼠被输注用编码干扰素调节因子5的mRNA及其激活激酶IKKβ配制的纳米粒可逆转免疫抑制和TAM的肿瘤支持状态, 将其重新编程为诱导抗肿瘤免疫并促进肿瘤消退的表型。
研究者为开发更强大的基因递送功能, 使用具有特殊结构的双丙烯酸酯, 或者使用甘露糖[27]、寡肽、膦酸酯[28]基团、季胺基团作为封端剂, 使得LPβAEs有更多的功能性。Jones等[29]对甘露糖基化的PβAEs库进行了开发和评估。该系统可以有效递送基因并且特异性激活抗原呈递细胞以及随后的免疫应答。在卵清蛋白(ovalbumin, OVA) 小鼠免疫模型中, 甘露糖化复合物均表现出比OVA蛋白加佐剂对照更高的标准化抗体滴度。该结果展现了甘露糖化复合物在较低抗原剂量且无需添加佐剂的情况下进行基因疫苗接种的潜力。Núñez-Toldrà小组[30]使用不同寡肽修饰C32得到LPβAEs, 并将治疗基因递送到牙髓多潜能干细胞促进其成骨分化。结果表明, LPβAEs/DNA复合物显著提高并加速了成骨标记物的表达, 同时终端分化细胞表现出更高的基质矿化和碱性磷酸酶活性。研究者也将二硫键引入LPβAEs的骨架中, 载体因而具有谷胱甘肽还原响应性、更好的生物降解性和更低的细胞毒性[31]。Karlsson实验室[32]自主合成了具有二硫键的双丙烯酸酯[2, 2-二硫二乙醇二丙烯酸酯, disulfanediyl bis(ethane-2, 1-diyl) diacrylate, DSDA] 将其与侧链单体4-氨基-1-丁醇(4-amino-1-butanol, S4/28) 聚合, 然后使用2-[3-(氨基丙基)-氨基] 甲醇[2-(3-aminopropylamino)ethanol, E6] 或3-吗啉代丙胺(3-morpholinopropylamine, MPA) 封端。结果表明, 将二硫键结合到PβAEs结构中可以触发siRNA的细胞内释放并减少潜在的细胞毒性, 聚合物成功将siRNA递送到健康的神经祖细胞和胶质母细胞瘤细胞, 体内实验也实现了siRNA基因沉默。实验表明, 复合纳米粒能以安全的方式在原位小鼠模型中敲除来源于人类患者的胶质母细胞瘤细胞中的报告基因。
2.2 HPβAEsHPβAEs可以通过明确三维结构、修饰多功能末端基团和灵活调整功能特性, 来克服LPβAEs性能优化的限制和正电荷密度低的缺点。此外, HPβAEs具有更低的细胞毒性和良好的生物相容性, 更利于基因有效递送。这可能是由于在生理pH值下存在更多质子化的胺, 可以增加聚合物和DNA的缩合能力[33]。传统上用于合成HPβAEs的ABn单体合成法由于单体选择的有限性和合成步骤的复杂性, 导致了聚合反应中支链结构的多样性和难控制性[34]。此外, 聚合过程中固有的凝胶化倾向也一直困扰着研究者。王文新课题组[35]提出了新型的“A2 + B3 + C2”型Michael加成策略: 以具有多个相同反应活性位点的丙烯酸酯为中心支化单体[如三羟甲基丙烷三丙烯酸酯(trimethylolpropane triacrylate, TMPTA)], 将伯胺(A2型单体)、三丙烯酸酯(B3型单体) 和双丙烯酸酯(C2型单体) 一锅共聚, 再用封端剂(end capping amines, E) 封端得到HβPAEs。该策略通过降低交联单体浓度来降低胶凝的风险, 同时可以进一步增强PβAEs作为基因载体的特性和功能。HPβAEs的反应通式如图 3所示。
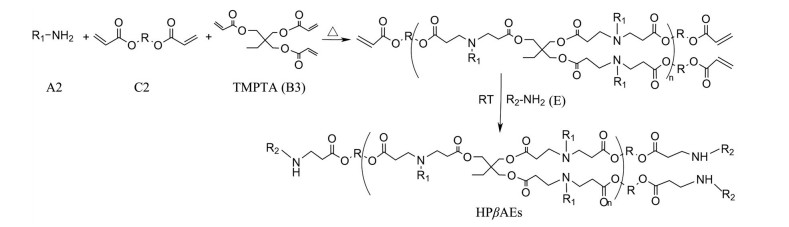
|
Figure 3 Synthesis of hyperbranched poly (β-amino ester)s (HPβAEs). B3: B3-type triacrylate monomer |
TMPTA具有3个反应位点, 作为中心支化单元可以赋予聚合物高度支化结构, 是构建HPβAEs最常用的支化单体。Cutlar等[36]通过TMPTA、双酚A乙氧酸二丙烯酸酯(bisphenol A ethoxylate diacrylate, BE) 和S4的共聚反应制备丙烯酸酯封端的基础聚合物, 然后使用功能性MPA封端得到HPβAEs。细胞毒性结果显示, 聚合物在30∶1 (w/w) 下, 仍然可以保持很高(> 75%) 的细胞活力。HPβAEs的转染效率比LPβAEs高3~8倍, 比商用脂质体转染剂SuperFect和PEI高5~41倍。HPβAEs转染后的GFP表达远高于LPβAEs、SuperFect和PEI。Zhou等[37]的研究显示最佳性能的HPβAEs介导了包括HeLa、rADSC和SHSY-5Y等12种细胞类型(干细胞和原代细胞等) 的高效基因转染。在体内实验中, 在人隐性营养不良性大疱性表皮松解症(RDEB) 皮肤移植的裸鼠模型中注入HPβAEs/COL7A1复合物。在注射复合物5天后检测到显著水平的重组VII型胶原(C7) 蛋白表达; 30天后, 剩余的重组蛋白仍处于显著水平。这展现了该聚合物在表皮基因治疗中的巨大应用潜力。三丙烯酸甘油酯(glycerol triacrylate, GTA) 与TMPTA结构只差一个乙基, 反应活性相似, 作为中心支化单元也具有良好的效果。Zhou等[38]基于GTA合成出来的甘油基共聚物(HBGC) 具有良好的生物相容性和很好的基因递送能力。该聚合物可以有效保护血清中的siRNA, 增强siRNA的细胞摄取且具有极低的细胞毒性。此外, 与商用转染剂Lipofectamine 2000和PEI 25 kDa相比, HBGC-siRNA复合物可有效下调A549癌细胞中p65的表达, 并增强细胞凋亡。除了TMPTA及GTA以外, 研究者也探索着其他支化单元, 如PAMAM和二胺(如1, 3-二氨基丙烷)[39]等。基于PAMAM作为支化单元的聚合物, PAMAM-PβAE显示出优良的基因递送潜力[40]。
HPβAEs的性能调整也可以通过引入有特殊结构双丙烯酸酯单体来进行, 如含有二硫键、硝基等结构的C2型单体。DSDA是具有二硫键结构的双丙烯酸酯单体, 常用于HPβAEs的合成, 可以赋予载体还原响应性和更高的转染性能[41]。2-硝基-1, 3-亚苯基双(亚甲基) 二丙烯酸酯[(2-nitro1, 3-phenylene) bis(methylene) diacrylate, NPBMDA] 是一种紫外线响应性单体, Duan等[42]基于NPBMDA合成了光响应性HPβAEs。在紫外光照射下, 聚合物骨架中2-硝基苯部分发生裂解, 迅速降解为低Mr片段, 从而促进了细胞内基因的释放并降低转染后聚合物的毒性, 因而具有很好的光控释基因递送效果。研究结果表明, 在多种哺乳动物细胞中, 在光照条件下该聚合物比市售试剂PEI 25 kDa和Lipofectamine 2000表现出显著性更高的DNA/siRNA转染效率和更低的细胞毒性。该研究为设计光控释基因载体提供了一种很好的思路。
引入含甘露糖[43]、胍基[44]、寡肽类似物[45]和叶酸等不同结构的封端剂, 可以增强HPβAEs的生物相容性、细胞摄取率或实现肿瘤靶向性, 这也是改造HPβAEs结构和性能的一种方式。增加聚合物的疏水性可以增强纳米粒的稳定性, 而增加端基的疏水性可以促进细胞内化及内体逃逸。羧酸盐配体既可以增加聚合物的疏水性, 又可以通过增加氢键作用、疏水作用及静电相互作用来增强与核酸的自组装能力。Rui等[45]通过将类似氨基酸的前体与丙烯酰氯的合成得到羧酸酯配体, 用于二次封端得到羧化的HPβAEs。该载体可以实现强大的蛋白递送和封装, 以及CRISPR-Cas9基因编辑功能。研究表明, 此包裹CRISPR-Cas9核糖核蛋白的NPs在HEK细胞和GL261鼠神经胶质瘤细胞等类型中诱导了强大的基因敲入(4%) 和基因敲除(> 75%)。单次颅内低剂量(3.5 pmol) 给药的纳米粒可在原位鼠神经胶质瘤的小鼠中产生强大的基因编辑功能。
2.3 共聚物PβAEs可以与多种聚合物相结合或混合形成共聚物, 常用的聚合物有聚乙二醇(PEG)、PDMAEMA、聚(乳酸-乙醇酸) [poly(lactic-co-glycolic acid), PLGA][46]、聚己内酯[47]和聚(L-赖氨酸) 等。共聚体有两亲性嵌段聚合物(常自组装成胶束)、三嵌段聚合物(多链体) 或共混物等类型。
PEG是一种低毒性的水溶性分子, 其亲水性和中性结构可以显著地增强载体的稳定性, 并且延长载体在系统循环中的半衰期。将PβAEs和PEG相嵌合可以提高生物稳定性, 同时解决“PEG困境”。Garcia团队[48]创建和评价了一个PEG-PβAE/ePβAE NPs库, 优化筛选的PEG-PβAE/ePβAE NPs制剂在人原发性脑肿瘤起始细胞GBM1A和BTIC375细胞中分别表现出54%和82%的转染效率。在人胶质母细胞瘤原位小鼠模型中, 与对照组相比, PEG-PβAE/pHSV-tk NPs和全身GCV治疗的中位生存期从53.5天增加到67天, 这证明了基于PEG-PβAE的NPs治疗人脑肿瘤的巨大潜力。
PDMAEMA是一种双响应(pH和温度) 聚合物, 在非病毒基因领域已经有广泛的研究, 且展现出巨大的基因传递能力。因此, 研究者将PDMAEMA和PβAEs结合起来发挥“1 + 1 > 2”的作用[49]。例如, Cordeiro等[50]基于PDMAEMA和不同链长的PβAEs制备出了一系列三嵌段聚合物PDMAEMA-b-PβAE-b-PDMAEMA。研究表明, 该系列共聚体具有良好的基因传递的理化特性, 在凝胶电泳实验展现出高度的DNA保护能力, 同时共聚体/DNA复合物具有较小的平均直径。细胞毒性实验表明多链体的细胞毒性比阳性对照支链PEI和商用转染剂TurboFect低得多。在HeLa和COS-7细胞系的转染实验中, 转染表达量高出阳性对照40~60倍。此外, PβAEs与其他聚合物也可以通过物理作用混合形成共混物。Balashanmugam等[51]通过W/O/W双乳液溶剂去除方法制备了装载pDNA的PLGA/PβAEs微粒制剂, 研究表明, 该微粒制剂具有靶向免疫细胞的固有能力和pH敏感性。在转染实验中, 相对于单独由PLGA制成的微粒, PLGA/PβAEs共混微粒制剂具有更高的转染效率和更好的DNA完整性, 该微粒制剂DNA疫苗递送中有高效的应用。
2.4 杂交纳米粒研究者尝试将PβAEs与其他类型的基因传递系统进行杂交, 以制备出多功能高性能载体系统。杂交方法有: ①将聚合物与金属(如金纳米粒)、磁性、介孔二氧化硅纳米粒杂交, 赋予载体高效运载能力或刺激响应性; ②将脂质包裹于聚合物外或与脂质结合, 使得载体有更好的生物相容性、细胞摄取率; ③与某些靶向受体共轭介导细胞受体、增强摄取率和靶向性。例如, Yu等[52]使用含酸可裂缩酮键的PβAEs [ketal containing poly(β-amino ester)s, KPAE] 结合siBCL-2, KPAE/siBCL-2配合物被含脂质的表柔比星(epirubicin, EPI) 包覆后, 形成EPI/siBCL-2双负载多聚体核心, 最后使用PEG化的脂质体涂层该核心。Western blot实验结果表明, EPI/siBCL-2共转染可以显著下调P-糖蛋白(P-gp) 的表达, 而游离EPI和载有EPI的脂质体则上调P-gp的表达。此外, 也有研究将PβAEs涂层于细菌(大肠杆菌) 内芯和外表面, 同时应用分子生物学和聚合物化学优势, 以解决抗原呈递细胞基因传递的障碍, 如细胞摄取、内化、吞噬体逃逸和细胞内浓度问题。
2.5 水凝胶PβAEs由于良好的生物相容性和生物降解性, 也被研究者用于水凝胶研究中。近些年的研究表明, 通过水凝胶进行局部和持续性递送siRNA, 可以克服siRNA稳定性低、提高抗肿瘤活性并降低全身毒性。但由于其结构中的酯键会发生水解而迅速降解, 因而不能实现持续性递送功能。针对这个问题, Segovia等[53]开发了一种基于精氨酸封端的PβAEs纳米粒和PAMAM: 葡聚糖水凝胶支架的新型siRNA局部持续递送平台。研究表明, 该递送系统拥有良好的细胞相容性, 细胞存活率高达96%, 同时在体外细胞转染实验中, 其沉默效率高于阳性对照商用转染剂Lipofectamine和INTERFERIN。包埋在水凝胶支架中的siRNA-PβAEs纳米粒, 在体内外都能实现小鼠乳腺癌小鼠模型的高沉默效率(体外为55%, 体内6天后为70%) 和长时间沉默效应。这说明了PβAEs在水凝胶基因递送有一定的发展潜力。
3 结语与展望PβAEs可以选用不同的双丙烯酸酯单体、侧链胺单体和封端剂来调整化学结构和性能, 因此具有化学结构多样性和高度可调节性, 可以根据获得所需的性能来定制聚合物, 实现高效和靶向的基因传递。PβAEs本身具有pH响应性, 通过选用有二硫键和O-硝基苄基单元等特殊结构的单体, 赋予载体以ROS响应性或紫外响应性等性能, 实现有效控制释放。近些年来, 研究者对PβAEs的研究已经逐渐由线性转移到超支化型, 开发了多种性能良好的超支化PβAEs。例如, PβAEs C32或C28在临床前研究中用于携带治疗性基因, 具有高效的转染能力。PβAEs不仅能在非病毒基因递送领域有良好的发展前景, 同时在药物和蛋白质输送、生物成像(封装荧光染料)、组织工程等多个领域中也有发展潜力。但PβAEs的发展也需要克服以下限制: ①发展更加可控的合成方法, 降低聚合物多分散性, 克服聚合反应的凝胶化问题; ②靶向性低。可以通过引入靶向性分子进行调整; ③应用先进的制造方法如3D打印技术, 融合出更高端高效的合成方法; ④扩大PβAEs的应用范围, 在生物检测和生物成像领域进行应用研究较少。综上所述, PβAEs是一种很有前途的生物材料。相信在不久的将来, 研究者能够克服PβAEs上述的限制, 取得更大的研究进展, 实现临床上的应用。
作者贡献: 刘颖诗完成综述的撰写与修改; 胡海梅提供基金支持。
利益冲突: 作者声明无任何利益冲突。
| [1] |
Jiang CP, Wang Y, Liu Q, et al. Recent progress of non-viral vector polyethylenimine in the application of gene delivery[J]. Acta Pharm Sin (药学学报), 2020, 55: 2869-2882. |
| [2] |
Ding RM, He H, Li J. Recent progress of polyamidoamine dendrimer in targeting drug delivery system[J]. Acta Pharm Sin (药学学报), 2011, 46: 493-501. |
| [3] |
Ma LY, Hu HM. Research progress of bioreducible poly(amino amine)s gene vector[J]. Chin New Drugs J (中国新药杂志), 2020, 29: 1615-1623. |
| [4] |
Li WN, Xu Q, Wang YH, et al. Poly (β-amino esters)-based barriers for tumor targeted delivery system[J]. Acta Pharm Sin (药学学报), 2015, 50: 434-439. |
| [5] |
Danusso F, Ferruti P. Synthesis of tertiary amine polymers[J]. Polymer, 1970, 11: 88-113. DOI:10.1016/0032-3861(70)90029-7 |
| [6] |
Galli G, Laus M, Angeloni AS, et al. Thermotropic poly (β‐aminoester)s containing azoxy groups[J]. Makromol Chem Rapid Comm, 1983, 4: 681-686. DOI:10.1002/marc.1983.030041009 |
| [7] |
Lynn DM, Langer R. Degradable poly (β-amino esters): synthesis, characterization, and self-assembly with plasmid DNA[J]. J Am Chem Soc, 2000, 122: 10761-10768. DOI:10.1021/ja0015388 |
| [8] |
Song W, Tang Z, Li M, et al. Tunable pH-sensitive poly (β-amino ester)s synthesized from primary amines and diacrylates for intracellular drug delivery[J]. Macromol Biosci, 2012, 12: 1375-1383. DOI:10.1002/mabi.201200122 |
| [9] |
Zhang Z, Ma R, Shi L. Cooperative macromolecular self-assembly toward polymeric assemblies with multiple and bioactive functions[J]. Acc Chem Res, 2014, 47: 1426-1437. DOI:10.1021/ar5000264 |
| [10] |
Gao H, Cheng T, Liu J, et al. Self-regulated multifunctional collaboration of targeted nanocarriers for enhanced tumor therapy[J]. Biomacromolecules, 2014, 15: 3634-3642. DOI:10.1021/bm5009348 |
| [11] |
Anderson DG, Tweedie CA, Hossain N, et al. A combinatorial library of photocrosslinkable and degradable materials[J]. Adv Mater, 2006, 18: 2614-2618. DOI:10.1002/adma.200600529 |
| [12] |
Tzeng SY, Guerrero-Cázares H, Martinez EE, et al. Non-viral gene delivery nanoparticles based on poly (β-amino esters) for treatment of glioblastoma[J]. Biomaterials, 2011, 32: 5402-5410. DOI:10.1016/j.biomaterials.2011.04.016 |
| [13] |
Sunshine JC, Akanda MI, Li D, et al. Effects of base polymer hydrophobicity and end-group modification on polymeric gene delivery[J]. Biomacromolecules, 2011, 12: 3592-3600. DOI:10.1021/bm200807s |
| [14] |
Zamboni CG, Kozielski KL, JJ Green, et al. Polymeric nanoparticles as cancer-specific DNA delivery vectors to human hepatocellular carcinoma[J]. J Control Release, 2017, 263: 18-28. DOI:10.1016/j.jconrel.2017.03.384 |
| [15] |
Akinc A, Anderson DG, Lynn DM, et al. Synthesis of poly(β-amino ester)s optimized for highly effective gene delivery[J]. Bioconjug Chem, 2003, 14: 979-988. DOI:10.1021/bc034067y |
| [16] |
Andorko JI, Hess KL, Jewell CM, et al. Intrinsic immunogenicity of rapidly-degradable polymers evolves during degradation[J]. Acta Biomater, 2016, 32: 24-34. DOI:10.1016/j.actbio.2015.12.026 |
| [17] |
Anderson DG, Peng W, Akin A, et al. A polymer library approach to suicide gene therapy for cancer[J]. Proc Natl Acad Sci U S A, 2004, 101: 16028-16033. DOI:10.1073/pnas.0407218101 |
| [18] |
Anderson DG, Akinc A, Hossain N, et al. Structure/property studies of polymeric gene delivery using a library of poly(β-amino esters)[J]. Mol Ther, 2005, 11: 426-434. DOI:10.1016/j.ymthe.2004.11.015 |
| [19] |
Bishop CJ, Abubaker-Sharif B, Guiriba T, et al. Gene delivery polymer structure-function relationships elucidated via principal component analysis[J]. Chem Commun, 2015, 51: 12134-12137. DOI:10.1039/C5CC04417K |
| [20] |
Zugates GT, Tedford NC, Zumbuehl A, et al. Gene delivery properties of end-modified poly (β-amino ester)s[J]. Bioconjug Chem, 2007, 18: 1887-1896. DOI:10.1021/bc7002082 |
| [21] |
Green JJ, Langer R, Anderson DG. A combinatorial polymer library approach yields insight into nonviral gene delivery[J]. Acc Chem Res, 2008, 41: 749-759. DOI:10.1021/ar7002336 |
| [22] |
Keeney M, Ong SG, Padilla A, et al. Development of poly(β-amino ester)-based biodegradable nanoparticles for nonviral delivery of minicircle DNA[J]. ACS Nano, 2013, 7: 7241-7250. DOI:10.1021/nn402657d |
| [23] |
Zhang J, Fredin NJ, Lynn DM, et al. Erosion of multilayered films fabricated from degradable polyamines: characterization and evidence in support of a mechanism that involves polymer hydrolysis[J]. J Polym Sci A Polym Chem, 2006, 44: 5161-5173. DOI:10.1002/pola.21613 |
| [24] |
Mangraviti A, Tzeng SY, Green JJ, et al. Polymeric nanoparticles for nonviral gene therapy extend brain tumor survival in vivo[J]. ACS Nano, 2015, 9: 1236-1249. DOI:10.1021/nn504905q |
| [25] |
Smith TT, Stephan SB, Stephan MT, et al. In situ programming of leukaemia-specific T cells using synthetic DNA nanocarriers[J]. Nat Nanotechnol, 2017, 12: 813-820. DOI:10.1038/nnano.2017.57 |
| [26] |
Zhang F, Parayath NN, Stephan MT, et al. Genetic programming of macrophages to perform anti-tumor functions using targeted mRNA nanocarriers[J]. Nat Commun, 2019, 10: 3974. DOI:10.1038/s41467-019-11911-5 |
| [27] |
Zou CM. The Preparation and Evaluation of Tumor Associated Antigen Polypeptide Loaded Poly(β-amino ester) Nano-Vaccines (装载肿瘤抗原多肽的聚(β-氨基酯) 纳米疫苗的制备及评价)[D]. Wuhan: Huazhong University of Science and Technology, 2019.
|
| [28] |
Akyol E, Tatliyuz M, Duman FD, et al. Phosphonate-functionalized poly(β-amino ester) macromers as potential biomaterials[J]. J Biomed Mater Res A, 2018, 106: 1390-1399. DOI:10.1002/jbm.a.36339 |
| [29] |
Jones CH, Chen M, Ravikrishnan A, et al. Mannosylated poly (beta-amino esters) for targeted antigen presenting cell immune modulation[J]. Biomaterials, 2015, 37: 333-344. DOI:10.1016/j.biomaterials.2014.10.037 |
| [30] |
Núñez-Toldrà R, Dosta P, Montori S, et al. Improvement of osteogenesis in dental pulp pluripotent-like stem cells[J]. Acta Biomater, 2017, 53: 152-164. DOI:10.1016/j.actbio.2017.01.077 |
| [31] |
Liu YC. The Design, Synthesis and Transfection of Disulfide-containing Polymer (含S-S聚合物的设计、合成和基因转染性能研究)[D]. Nanjing: Nanjing University of Science and Technology, 2016.
|
| [32] |
Karlsson J, Rui Y, Kozielski KL, et al. Engineered nanoparticles for systemic siRNA delivery to malignant brain tumours[J]. Nanoscale, 2019, 11: 20045-20057. DOI:10.1039/C9NR04795F |
| [33] |
Chew SA, Hacker MC, Saraf A, et al. Altering amine basicities in biodegradable branched polycationic polymers for nonviral gene delivery[J]. Biomacromolecules, 2010, 11: 600-609. DOI:10.1021/bm901147k |
| [34] |
Mather BD, Viswanathan K, Miller KM, et al. Michael addition reactions in macromolecular design for emerging technologies[J]. Prog Polym Sci, 2006, 31: 487-531. DOI:10.1016/j.progpolymsci.2006.03.001 |
| [35] |
Huang JY, Gao Y, Cutlar L, et al. Tailoring highly branched poly (β-amino ester)s: a synthetic platform for epidermal gene therapy[J]. Chem Commun (Camb), 2015, 51: 8473-8476. DOI:10.1039/C5CC02193F |
| [36] |
Cutlar L, Zhou DZ, Wang W, et al. Highly branched poly(β-amino esters): synthesis and application in gene delivery[J]. Biomacromolecules, 2015, 16: 2609-2617. DOI:10.1021/acs.biomac.5b00966 |
| [37] |
Zhou DZ, Cutlar L, Gao YS, et al. The transition from linear to highly branched poly(β-amino ester)s: branching matters for gene delivery[J]. ACS Appl Mater Interfaces, 2016, 8: 34218-34226. DOI:10.1021/acsami.6b12078 |
| [38] |
Zhou L, Qu X, Lei B, et al. Branched glycerol-based copolymer with ultrahigh p65 siRNA delivery efficiency for enhanced cancer therapy[J]. ACS Appl Mater Interfaces, 2018, 10: 4471-4480. DOI:10.1021/acsami.7b17109 |
| [39] |
Wang Y, Wang CF, Li M, et al. Effects of branching strategy on the gene transfection of highly branched poly(β-amino ester)s[J]. Chin J Polym Sci, 2020, 38: 830-842. DOI:10.1007/s10118-020-2393-y |
| [40] |
Gao X, Jin Z, Tan X, et al. Hyperbranched poly(β-amino ester) based polyplex nanopaticles for delivery of CRISPR/Cas9 system and treatment of HPV infection associated cervical cancer[J]. J Control Release, 2020, 321: 654-668. DOI:10.1016/j.jconrel.2020.02.045 |
| [41] |
Mao YM. Anti-inflammatory siRNA Delivery Mediated by Bioreducible Highly Branched Poly(β-amino ester)s towards the Treatment of Acute Lung Injury (还原响应型支化聚β-氨基酯siRNA递送载体及其用于急性肺损伤的抗炎治疗研究)[D]. Suzhou: Soochow University, 2019.
|
| [42] |
Duan S, Cao D, Li X, et al. Topology-assisted, photo-strengthened DNA/siRNA delivery mediated by branched poly(β-amino ester)s via synchronized intracellular kinetics[J]. Biomater Sci, 2020, 8: 290-301. DOI:10.1039/C9BM01452G |
| [43] |
Wang X. Anti-inflammatory siRNA Delivery Mediated by Stimuli-Responsive Polycations towards the Treatment of Myocardial Ischemia-Reperfusion Injury (刺激响应型阳离子siRNA递送载体及其用于心肌缺血再灌注损伤的抗炎治疗研究)[D]. Suzhou: Soochow University, 2018.
|
| [44] |
Liu S, Gao Y, Zhou D, et al. Highly branched poly(β-amino ester) delivery of minicircle DNA for transfection of neurodegenerative disease related cells[J]. Nat Commun, 2019, 10: 3307. DOI:10.1038/s41467-019-11190-0 |
| [45] |
Rui Y, Wilson DR, Choi J, et al. Carboxylated branched poly(β-amino ester) nanoparticles enable robust cytosolic protein delivery and CRISPR-Cas9 gene editing[J]. Sci Adv, 2019, 5: eaay3255. DOI:10.1126/sciadv.aay3255 |
| [46] |
Fields RJ, Cheng CJ, WM Saltzman, et al. Surface modified poly(β amino ester)-containing nanoparticles for plasmid DNA delivery[J]. J Control Release, 2012, 164: 41-48. DOI:10.1016/j.jconrel.2012.09.020 |
| [47] |
Capasso Palmiero U, Kaczmarek JC, Fenton OS, et al. Poly(β-amino ester)-co-poly(caprolactone) terpolymers as nonviral vectors for mRNA delivery in vitro and in vivo[J]. Adv Healthc Mater, 2018, 7: e1800249. DOI:10.1002/adhm.201800249 |
| [48] |
Garcia CA, Quiñones-Hinojosa A, Green JJ, et al. Poly(ethylene glycol)-poly(beta-amino ester)-based nanoparticles for suicide gene therapy enhance brain penetration and extend survival in a preclinical human glioblastoma orthotopic xenograft model[J]. ACS Biomater Sci Eng, 2020, 6: 2943-2955. DOI:10.1021/acsbiomaterials.0c00116 |
| [49] |
Santo D, Cordeiro RA, Sousa A, et al. Combination of poly[(2-dimethylamino) ethyl methacrylate] and poly (β-amino ester) results in a strong and synergistic transfection activity[J]. Biomacromolecules, 2017, 18: 3331-3342. DOI:10.1021/acs.biomac.7b00983 |
| [50] |
Cordeiro RA, Santo D, Farinha D, et al. High transfection efficiency promoted by tailor-made cationic tri-block copolymer-based nanoparticles[J]. Acta Biomater, 2017, 47: 113-123. DOI:10.1016/j.actbio.2016.10.015 |
| [51] |
Balashanmugam MV, Nagarethinam S, Jagani H, et al. Preparation and characterization of novel PβAE/PLGA polymer blend microparticles for DNA vaccine delivery[J]. Sci World J, 2014, 2014: 385135. |
| [52] |
Yu M, Han S, Kou Z, et al. Lipid nanoparticle-based co-delivery of epirubicin and BCL-2 siRNA for enhanced intracellular drug release and reversing multidrug resistance[J]. Artif Cells Nanomed Biotechnol, 2018, 46: 323-332. DOI:10.1080/21691401.2017.1307215 |
| [53] |
Segovia N, Pont M, Oliva N, et al. Hydrogel doped with nanoparticles for local sustained release of siRNA in breast cancer[J]. Adv Healthc Mater, 2015, 4: 271-280. DOI:10.1002/adhm.201400235 |
 2021, Vol. 56
2021, Vol. 56