中药黄芩(Scutellariae Radix) 始载于《神农本草经》, 是唇形科黄芩属多年生草本植物黄芩Scutellaria baicalensis的干燥根。《中国药典》记载其具有清热燥湿, 泻火解毒, 止血, 安胎之功效[1]。黄芩的主要活性成分为黄酮-O-葡萄糖醛酸苷[2]。葡萄糖醛酸苷在植物中比较少见, 仅分布于特定的种属, 如唇形科、豆科[3, 4]。目前, 从黄芩中已发现至少17种O-葡萄糖醛酸苷, 其中黄芩苷(baicalin) 含量最高, 具有抗病毒、抗炎、抗氧化、神经保护等显著的药理活性[4-6]。此外, 黄芩中还含有至少26种黄酮O-葡萄糖苷类成分, 具有抗高血压、抗糖尿病、保肝等药理活性[4, 5]。
在黄酮糖苷类成分的生物合成过程中, 糖基转移酶发挥着关键的后修饰作用。在糖基转移酶的作用下, 以UDP化糖基为糖供体、游离黄酮苷元为糖受体, 可直接将糖基转移至相应的位点[7]。黄芩根中的糖苷类成分多以5, 7-二羟基黄酮为骨架, 如黄芩素(baicalein)、汉黄芩素(wogonin)、千层纸素A (oroxylin A) 以及白杨素(chrysin) 等; 而黄芩地上部分的糖苷类成分多以5, 7, 4'-三羟基黄酮为骨架, 如野黄芩素(scutellarein)、4'-羟基汉黄芩素(4'-hydroxywogonin)、高车前素(hispidulin) 以及芹菜素(apigenin) 等[8]。这些游离黄酮很可能是被不同的糖基转移酶催化, 形成了黄酮糖苷的结构多样性。
近年来, 黄芩中黄酮和黄酮苷的生源合成途径已有报道, 糖基化作为黄酮糖苷生物合成的最后一步, 在黄酮糖苷的生物合成中发挥着重要作用[9]。目前, 已报道的黄酮7-O-葡萄糖转移酶(SbUBGT)[10]、黄酮7-O-葡萄糖醛酸转移酶(SbUBGAT)[11]、黄酮3-O-糖基转移酶(Sb3GT1)[12]以及黄酮碳糖基转移酶SbCGTa/SbCGTb[13]可能分别参与黄芩中黄酮葡萄糖苷、葡萄糖醛酸苷、黄酮醇苷以及黄酮碳苷类成分的生物合成。然而, 这些糖基转移酶的发现仍然不足以解释黄酮糖苷的结构多样性。比如, 黄芩根中的5, 7-二羟基黄酮糖苷以及叶中的5, 7, 4'-三羟基黄酮糖苷分别由哪些糖基转移酶催化生成尚不清楚。
本研究以黄芩为研究材料, 通过转录组分析, 挖掘出9条O-糖基转移酶候选基因, 通过序列分析, 初步预测其中7条为黄芩O-葡萄糖转移酶, 2条为黄芩O-葡萄糖醛酸转移酶。根据进化树分析和基因表达水平分析, 选择其中3条候选基因构建pET-28a (+) 重组质粒, 利用大肠杆菌进行外源表达, 利用黄芩内源性底物进行功能表征。结果表明, 这3种糖基转移酶对黄芩的内源性黄酮苷元具有葡萄糖基化或葡萄糖醛酸化催化活性, 可生成包括黄芩苷、汉黄芩苷在内的多种黄酮氧苷。
材料与方法菌株与质粒 E. coli Trans1-T1感受态细胞、E. coli DMT感受态细胞、E. coli BL21 (DE3) 感受态细胞、pEASY®-Blunt Simple质粒载体(TransGen Biotech, Beijing, China), pET-28a (+) Expression Vector (Invitrogen, USA)。
试剂与仪器 黄芩黄酮苷元和黄酮糖苷对照标准品购自成都德斯特科技有限公司或由实验室前期研究工作制备[6]。甲醇(Fisher Scientific, USA, HPLC grade), 咪唑、琼脂粉[生工生物工程(上海) 股份有限公司], 卡那霉素硫酸盐(Coolabor, Beijing, China), 氯化钠(北京市通广精细化工公司, 北京, 中国), 胰蛋白胨(LP0042)、酵母提取物(LP0021) (Oxoid, Thermo Fisher Scientific, USA), UDP-葡萄糖(UDPG)、UDP-葡萄糖醛酸(UDP-GluA) (上海源叶生物科技有限公司)。其他化学试剂均购自Sigma-Aldrich (St. Louis, MO, USA) 或北京化学工业集团有限责任公司(北京, 中国)。
2×PCR Mix (+Dye) (北京金普莱科技发展有限公司), TransStart®Fastpfu DNA Polymerase、500 bp (MD112) 与1 kb (MD111) DNA ladder、TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix、TIANprep Rapid Mini Plasmid Kit快速质粒小提试剂盒(离心柱型)、TIANgel Midi Purification Kit琼脂糖凝胶DNA回收试剂盒(离心柱型) (TransGen Biotech, Beijing, China), Q5® High-Fidelity DNA Polymerase (New England Biolabs, Beijing, China)。扩增引物由北京擎科生物科技有限公司合成。
JY-SPCT型水平电泳槽(北京君意东方电泳设备有限公司) 用于凝胶电泳; Bilon-650Y超声破碎机(上海比朗仪器制造有限公司) 用于细胞破碎; 小型高速控温离心机(5424R, Eppendorf, 北京, 中国); Agilent 1260高效液相色谱仪(Agilent Technologies, Waldbronn, Germany) 用于HPLC分析, 色谱柱为Agilent Zorbax SB C18 (4.6 mm × 250 mm, 5 μm); Q-Exactive混合四极轨道质谱仪(Thermo Fisher, CA, USA) 用于LC/MS分析。
候选基因的挖掘 以已知功能的O-糖基转移酶(包括O-葡萄糖醛酸糖基转移酶和O-葡萄糖糖基转移酶) 为参比基因序列, 包括SbUBGAT, AB479151.1 (accession number); SbUBGT, AB031274.1; PfUGT57, AB362992.1; AmUGTcg10, AB362988.1; UGT88D5, AB362989.1; SiUGT23, AB362990.1; PfUGT50, AB362991.1; VvGT6, AB499075.1; VvGT1, AF000372.1; VvGT5, AB499074.1。通过已报道的黄芩转录组(SRP156996) 数据[14]进行BLAST分析, 选择e-value小于e-21的序列, 作为候选的黄酮O-糖基转移酶基因序列, 用Snapgene软件进一步分析ORF是否含有起始密码子和终止密码子, 得到完整的ORF。
系统进化树构建 利用MEGA6软件, 基于JTT matrix-based模型, 使用Maximum Likelihood方法, 自展值重复检测次数为1 000次, 其他参数默认系统设置, 进行系统进化树的构建。
候选基因的克隆筛选 用Snapgene软件设计引物(表 1), 用于候选基因的PCR扩增; 用植物RNA提取试剂盒提取黄芩叶和根的RNA, 用TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix反转录试剂盒进行反转录, 得到cDNA; 使用TransStart® Fastpfu DNA Polymerase, 利用设计的特异性引物以得到的cDNA为模板进行PCR扩增, 并用TIANgel Midi Purification Kit琼脂糖凝胶DNA回收试剂盒对扩增的候选基因进行胶回收。在37 ℃孵育25 min, 将候选基因连接到pEASY®-Blunt Simple质粒载体上, 转化至E. coli Trans1-T1感受态细胞, 并于含有50 μg·mL-1卡那霉素的LB固体培养基上37 ℃过夜培养。随机选择单菌落, 使用2×PCR Mix (+Dye), 以引物M13F/M13R进行菌落PCR, 电泳检测筛选阳性菌落, 送测序验证序列。根据测序结果确认是否成功克隆得到糖基转移酶候选基因。
| Table 1 Specific primer sequences for gene amplification |
原核表达载体的构建与异源表达 用TIANprep Rapid Mini Plasmid Kit快速质粒小提试剂盒(离心柱型) 提取连接有候选基因的pEASY®-Blunt Simple质粒, 用特异性引物从pEASY®-Blunt Simple质粒中PCR扩增出候选基因, 并用TIANgel Midi Purification Kit琼脂糖凝胶DNA回收试剂盒进行胶回收。利用Q5® High-Fidelity DNA Polymerase, 通过Quick change法构建pET-28a (+) 重组表达载体; 加入Dpn I, 37 ℃孵育4 h, 进行去甲基化处理; 转化DMT感受态细胞, 并于含有50 μg·mL-1卡那霉素的LB固体培养基中37 ℃过夜培养。随机选择单菌落, 以引物T7/T7T进行菌落PCR, 电泳检测筛选阳性菌落, 送测序验证序列。用pET-28a (+) 重组质粒转化BL21 (DE3) 感受态细胞, 获得重组菌株[15], 并在含有50 μg·mL-1的卡那霉素的LB液体培养基中37 ℃、200 r·min-1条件下培养至吸光度值处于0.4~0.6区间, 加入IPTG至终浓度为0.1 mmol·L-1, 在18 ℃、200 r·min-1诱导表达18 h。菌液以8 000 r·min-1离心3 min, 收集菌体, 用15 mL缓冲液(20 mmol·L-1 Tris, 500 mmol·L-1 NaCl, 2%甘油, pH = 7.4) 悬浮菌体, 用超声破碎仪破碎, 再于8 000 r·min-1、4 ℃条件下离心45 min, 收集上清液。
蛋白纯化 利用镍亲和柱色谱法纯化目的蛋白: 先用30 mmol·L-1咪唑洗脱液(20 mmol·L-1 Tris, 500 mmol·L-1 NaCl, 2%甘油, 30 mmol·L-1咪唑, pH = 7.4) 对镍柱进行平衡, 再将超声破碎后菌液的上清液循环过镍柱3~4次, 用30 mmol·L-1咪唑洗脱除去杂蛋白, 直至洗脱液不能使考马斯亮蓝变蓝, 再用300 mmol·L-1咪唑洗脱液(20 mmol·L-1 Tris, 500 mmol·L-1 NaCl, 2%甘油, 300 mmol·L-1咪唑, pH = 7.4) 洗脱目的蛋白, 直至洗脱液不能使考马斯亮蓝变蓝, 收集300 mmol·L-1咪唑洗脱液洗下的流分。流分用超滤离心管(30 kDa) 浓缩, 4 ℃、4 000 r·min-1离心, 剩余0.5 mL, 加储存液(20 mmol·L-1 Tris, 500 mmol·L-1 NaCl, 20%甘油, pH = 7.4) 3 mL, 在4 ℃条件下4 000 r·min-1离心至剩余体积约0.5 mL, -80 ℃保存。蛋白纯度用SDS-PAGE检测。
体外功能验证 以DMSO为溶剂, 溶解底物白杨素(1)、芹菜素(2)、汉黄芩素(3)、4'-羟基汉黄芩素(4)、千层纸素A (5)、高车前素(6)、黄芩素(7)、野黄芩素(8), 终浓度为10 mmol·L-1。构建体外酶催化反应体系: 1 μL底物(10 mmol·L-1), 0.5 μL糖供体(UDP-Glc、UDP-GluA, 50 mmol·L-1), 纯化的蛋白(10 μg), 100 μL Tris-HCl缓冲液(pH = 8.0)。于37 ℃反应4 h, 加入200 μL甲醇终止反应, 涡旋振荡, 15 000 r·min-1离心15 min, 取80 μL上清液。利用HPLC和LC/MS检测。
催化产物的HPLC和LC/MS检测 HPLC分析使用Agilent 1260液相色谱仪, 色谱柱为Agilent Zorbax SB C18 (4.6 mm × 250 mm, 5 μm), 柱温30 ℃。流动相使用甲醇(A相) 和含0.1%体积分数甲酸的水(B相), 使用如下梯度洗脱方法: 0 min, 20% A; 20 min, 100% A; 25 min, 100% A; 26 min, 20% A; 31 min, 20% A, 流速1.0 mL·min-1。进样量为20 μL; 紫外检测波长为340 nm。LC/MS分析在配备有加热电喷雾电离(ESI) 源的Q-Exactive混合四极轨道质谱仪(ThermoFisher Scientific, US) 上进行[13], 参数为: 鞘气压力, 45 arb; 辅助气压力, 10 arb; 放电电压, 4.5 kV; 毛细管温度, 350 ℃; 一级分辨率70 000, 二级分辨率17 500。
结果与分析 1 候选基因筛选和进化树分析通过BLAST比对[14]、ORF分析, 得到9条具有完整ORF的序列, 推测为黄芩的糖基转移酶SbUGTs, 并经UGT命名委员会命名。这些蛋白不含跨膜区, 属于可溶性蛋白, 适合原核表达体系。根据唇形科植物黄酮O-葡萄糖醛酸转移酶和黄酮O-葡萄糖转移酶的关键氨基酸差异(PSPG motif中R残基提示为O-葡萄糖醛酸转移酶, W为O-葡萄糖转移酶)[11], 预测这9条基因中有2条为O-葡萄糖醛酸转移酶基因, 7条为O-葡萄糖转移酶基因。将这9条基因和已报道的SbUBGAT (黄芩素7-O-葡萄糖醛酸转移酶)、SbUBGT (黄芩7-O-葡萄糖转移酶) 等糖基转移酶基因一起进行进化分析(图 1), 结果表明SbUGT88D15、SbUGT88D16与7-O-葡萄糖醛酸转移酶基因SbUBGAT序列相近, 可能是O-葡萄糖醛酸转移酶, 其他候选基因预测为O-葡萄糖转移酶活性。保守区序列分析与进化树分析的预测结果一致。
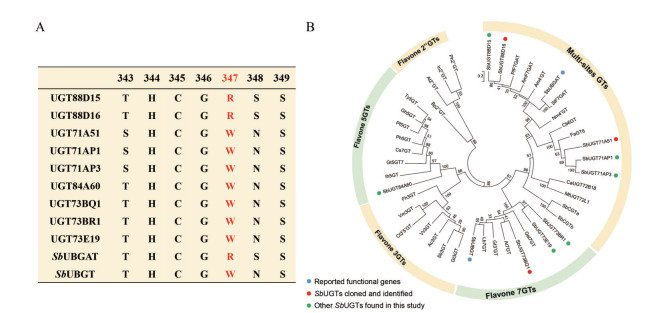
|
Figure 1 Conserved region and phylogenetic tree of the 9 SbUGTs discovered in this study. (A) Conserved region sequence analysis of SbUGTs. (B) Phylogenetic tree of SbUGTs (accession numbers are given). Am4′GT, accession number: Q33DV3, Antirrhinum majus; AmF7GAT (UGT88D4), accession number: BAG31945, Antirrhinum majus; PfF7GAT (UGT88D7), accession number: BAG31948, Perilla frutescens; SbUBGAT, accession number: BAH19313, Scutellaria baicalensis; SlF7GAT (UGT88D5), accession number: BAG31946, Scutellaria laeteviolacea var. yakusimensis; Nm4′GT, accession number: BBA68562, Nemophila menziesii; FaGT6, accession number: Q2V6K0, Fragaria x ananassa; CaUGT72B18, accession number: NP_001351694, Cicer arietinum; MtUGT72L1, accession number: ACC38470, Medicago truncatula; GeI7GT, accession number: BAC78438, Glycyrrhiza echinate; At7GT, accession number: NP_567955, Arabidopsis thaliana; Gt3′GT, accession number: BAC54092, Gentiana trifloral; Lb7GT, accession number: BAG80536, Lycium barbarum; SbUBGT, accession number: BAA83484, Scutellaria baicalensis; Ih5GT, accession number: BAD06874, Iris x hollandica; Gt5GT7, accession number: AB363839, Gentiana trifloral; Ph5GT, accession number: BAA89009, Petunia x hybrida; Gh5GT, accession number: BAA36423, Glandularia x hybrida; Pf5GT, accession number: Q9ZR27, Perilla frutescens; Ty5GT, accession number: BAC54093, Torenia hybrid cultivar; In2′′GT, accession number: BAD95883, Ipomoea nil; Ph2′′GT, accession number: LC387490, Petunia x hybrida; At2′′GT, accession number: NP_200212, Arabidopsis thaliana; Bp2′′GT, accession number: Q5NTH0, Bellis perennis; Fh3GT, accession number: ADK75021, Freesia hybrid cultivar; Gt3GT, accession number: Q96493, Gentiana trifloral; Sb3GT, accession number: QBL54224, Scutellaria baicalensis; Ac3GT, accession number: ADC34700, Actinidia chinensis; Vv3GT, accession number: AAB81682, Vitis vinifera; Ct3′5′GT, accession number: AB115560, Clitoria ternatea; Vm3GT, accession number: BAA36972, Vigna mungo. SbCGTa, accession number: MK894443, Scutellaria baicalensis; SbCGTb, accession number: MK894444, Scutellaria baicalensis |
由于根是黄芩的主要药用部位, 基于已报道的转录组数据SRP256996[14], 对9个糖基转移酶在根中的转录水平进行分析(图 2)。结果表明, SbUGTs候选基因在黄芩根中表达量不一。在O-葡萄糖转移酶候选基因中, SbUGT71A51表达量最高(FPKM value = 375.14), 高于已报道的SbUBGT基因; SbUGT73BQ1表达量也较高, 它们很可能在黄酮糖苷生物合成过程中发挥重要作用; 尽管O-葡萄糖醛酸转移酶候选基因表达水平相较于已报道的SbUBGAT基因低, 但它们也可能参与葡萄糖醛酸苷的生物合成。因此, 本文主要研究2条O-葡萄糖醛酸转移酶候选基因和2条表达量高的O-葡萄糖转移酶候选基因。
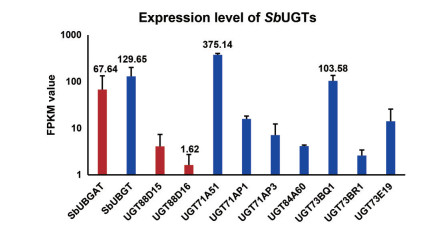
|
Figure 2 Expression levels of SbUGTs in the roots of Scutellaria baicalensis. The SbUGTs predicted to use UDP-glucuronic acid and UDP-glucose as sugar donors were labeled in red and blue, respectively |
利用设计的特异性引物, 在黄芩cDNA中PCR扩增SbUGTs候选基因, 成功扩增得到了O-葡萄糖醛酸转移酶候选基因SbUGT88D16 (GenBank accession number MZ751036) 和表达量较高的O-葡萄糖转移酶候选基因SbUGT71A51 (GenBank accession number MZ751037)、SbUGT73BQ1 (GenBank accession number MZ751039), 未扩增得到与SbUGT88D15序列一致的基因。进一步完成这3条SbUGTs候选基因pET28a (+) 表达载体的构建, 获得重组质粒。
3.2 SbUGTs蛋白表达纯化通过0.1 mmol·L-1的异丙基-β-D-硫代半乳糖苷诱导蛋白表达, 利用超声破碎仪进行细胞破碎, 取上清液用镍亲和柱色谱法纯化, 用30 mmol·L-1的咪唑洗脱液洗去杂蛋白, 用300 mmol·L-1的咪唑洗脱液洗下目的蛋白, 并收集。SDS-PAGE检测表明, 3个SbUGTs蛋白均显示有目的蛋白条带, 纯度较高。
3.3 SbUGTs的功能验证以UDP-Glc和UDP-GluA为糖供体, 以黄芩内源性黄酮苷元(白杨素、芹菜素、汉黄芩素、4'-羟基汉黄芩素、千层纸素A、高车前素、黄芩素、野黄芩素) 为底物, 利用SbUGTs进行催化反应, HPLC和LC/MS分析检测反应产物。酶催化反应结果显示, SbUGT88D16主要表现出O-葡萄糖醛酸转移酶活性, SbUGT71A51、SbUGT73BQ1表现出O-葡萄糖转移酶活性, 与保守区序列分析和进化树分析预测结果一致。这些SbUGTs在底物选择性、位点选择性、转化率等方面各有差异(图 3)。
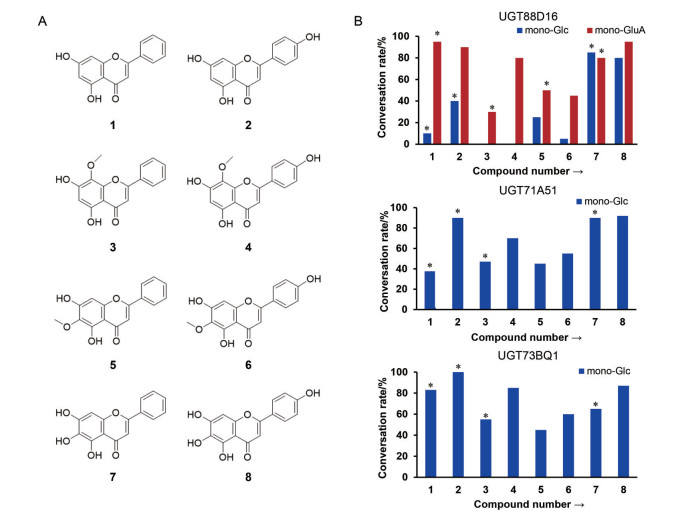
|
Figure 3 Functional characterization of 3 SbUGTs. (A) Chemical structures of the substrates. (B) Functional characterization of SbUGTs. For the products, mono-O-glucuronides are shown in red, and mono-O-glucosides shown in blue. '*' indicates the products were unambiguously identified by comparing with reference standards |
SbUGT88D16为植物中较少见的葡萄糖醛酸转移酶, 多催化形成葡萄糖醛酸单糖苷, 同时具有一定的葡萄糖转移酶活性。SbUGT71A51、SbUGT73BQ1均为O-葡萄糖转移酶, 无O-葡萄糖醛酸转移酶活性。这些糖基转移酶对黄酮苷元的催化活性, 与底物是否存在4'位羟基无明显相关性。
4 SbUGTs催化合成黄芩内源性黄酮糖苷类成分 4.1 SbUGTs催化合成黄芩苷、汉黄芩苷等黄芩葡萄糖醛酸苷黄芩中含量较高的糖苷类成分是黄芩苷和汉黄芩苷, 均为黄酮葡萄糖醛酸苷。本文发现的黄芩O-葡萄糖醛酸转移酶基因SbUGT88D16可催化形成汉黄芩苷(3a) 和黄芩苷(7a) (图 4)。SbUGT88D16位点选择性强, 催化汉黄芩素和黄芩素7位的葡萄糖醛酸化反应, 催化形成黄芩苷的转化率较高; 通过标准品比对和LC/MS分析的方法确认了产物汉黄芩苷(3a) 和黄芩苷(7a) 的结构。SbUGT88D16可能参与黄芩葡萄糖醛酸苷的生物合成。
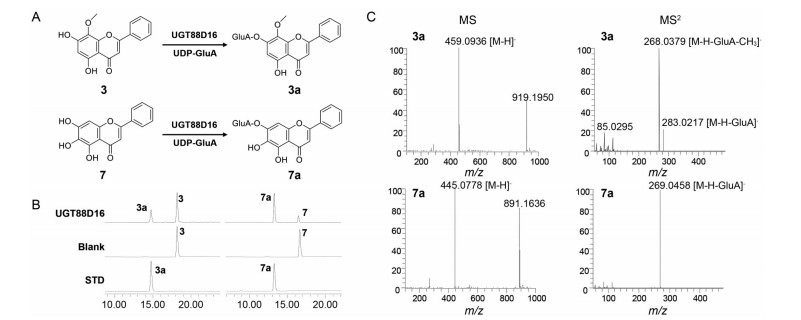
|
Figure 4 Functional characterization of UGT88D16. (A) Glycosylation reactions of wogonin (3) and baicalein (7) catalyzed by SbUGT88D16 using UDP-glucuronic acid as the sugar donor. (B) HPLC chromatograms of the enzymatic reaction mixtures, the substrates, and the reference standards. (C) Mass spectra of glycosylated products (3a and 7a) |
此外, SbUGT88D16还可催化白杨素(1)、千层纸素A (5) 等黄芩内源性黄酮苷元的7位O-葡萄糖醛酸化反应, 形成对应的7-O-黄酮葡萄糖醛酸苷。通过标准品比对的方法, 鉴定了催化反应的产物结构(图 5)。
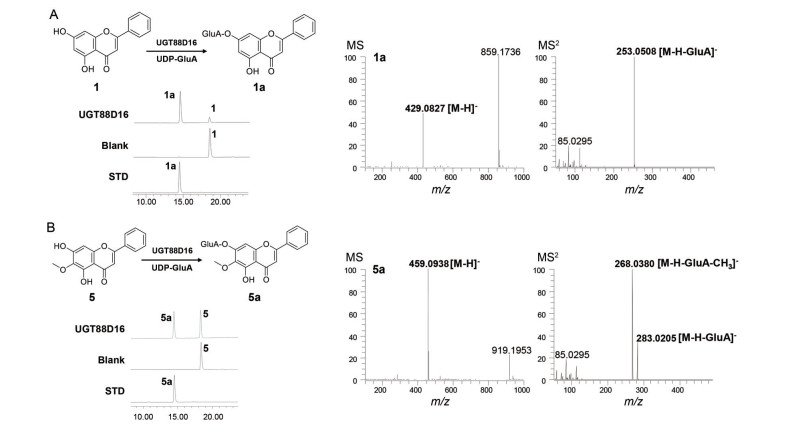
|
Figure 5 UGT88D16 catalyzed formation of flavone glucuronide. (A) Glycosylation reactions of chrysin (1) catalyzed by SbUGT88D16 using UDP-glucuronic acid as the sugar donor. (B) Glycosylation reactions of oroxylin A (5) catalyzed by SbUGT88D16 using UDP-glucuronic acid as the sugar donor |
本文鉴定了2条O-葡萄糖转移酶, 可催化形成黄芩内源性黄酮葡萄糖苷。通过标准品比对的方法, 确认了部分葡萄糖基化反应的产物结构(图 6)。这2个酶对多数黄酮苷元具有7-O-葡萄糖基化的活性, SbUGT71A51还可催化芹菜素的其他位点。此外, 葡萄糖醛酸转移酶SbUGT88D16也具有一定的葡萄糖转移酶活性。

|
Figure 6 Glycosylation reactions of chrysin (1, A), apigenin (2, B), wogonin (3, C) and baicalein (7, D) catalyzed by SbUGT71A51, SbUGT73BQ1 and SbUGT88D16 using UDP-glucose as the sugar donor |
本文从黄芩鉴定了3个糖基转移酶基因, 可催化形成黄芩的主要糖苷类成分。发现了2个O-葡萄糖转移酶SbUGT71A51、SbUGT73BQ1, 对多数黄酮苷元具有7位选择性; 发现了1个O-葡萄糖醛酸转移酶SbUGT88D16, 可催化形成汉黄芩苷和黄芩苷, 且SbUGT88D16位点选择性强、转化率较高。另外, 黄芩根的糖苷类成分以4'-无羟基取代的黄酮为主, 地上部分的糖苷类成分则以4'-羟基黄酮为主[8]。本研究发现的糖基转移酶的催化活性与黄酮苷元4'位羟基未表现出明显相关性, 提示黄芩地上地下部位黄酮糖苷的差异, 很可能是由于黄酮苷元合成途径的差异, 而与糖基化过程无关。
本研究发现的糖基转移酶参与黄芩苷、汉黄芩苷等黄芩活性成分的生物合成, 也为黄酮糖苷的合成提供了新颖、绿色、高效的酶催化方法。
作者贡献: 叶敏、乔雪设计实验。韩搏云、王子龙、王双进行生物信息学分析、蛋白表达纯化、功能表征。韩搏云、王子龙分析数据。韩搏云、王子龙、叶敏、乔雪撰写文章手稿。
利益冲突: 本文不存在利益冲突。
| [1] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典: 2020版)[S]. Beijing: China Medical Science Press, 2020: 314
|
| [2] |
Qiao X, Li R, Song W, et al. A targeted strategy to analyze untargeted mass spectral data: rapid chemical profiling of Scutellaria baicalensis using ultra-high performance liquid chromatography coupled with hybrid quadrupole orbitrap mass spectrometry and key ion filtering[J]. J Chromatogr A, 2016, 1441: 83-95. DOI:10.1016/j.chroma.2016.02.079 |
| [3] |
Song W, Qiao X, Chen K, et al. Biosynthesis-based quantitative analysis of 151 secondary metabolites of licorice to differentiate medicinal Glycyrrhiza species and their hybrids[J]. Anal Chem, 2017, 89: 3146-3153. DOI:10.1021/acs.analchem.6b04919 |
| [4] |
Wang ZL, Wang S, Kuang Y, et al. A comprehensive review on phytochemistry, pharmacology, and flavonoid biosynthesis of Scutellaria baicalensis[J]. Pharm Biol, 2018, 56: 465-484. DOI:10.1080/13880209.2018.1492620 |
| [5] |
Zhao Q, Chen XY, Martin C. Scutellaria baicalensis, the golden herb from the garden of Chinese medicinal plants[J]. Sci Bull, 2016, 61: 1391-1398. DOI:10.1007/s11434-016-1136-5 |
| [6] |
Ji S, Li R, Wang Q, et al. Anti-H1N1 virus, cytotoxic and Nrf2 activation activities of chemical constituents from Scutellaria baicalensis[J]. J Ethnopharmacol, 2015, 176: 475-484. DOI:10.1016/j.jep.2015.11.018 |
| [7] |
Tiwari P, Sangwan RS, Sangwan NS. Plant secondary metabolism linked glycosyltransferases: an update on expanding knowledge and scopes[J]. Biotechnol Adv, 2016, 34: 714-739. DOI:10.1016/j.biotechadv.2016.03.006 |
| [8] |
Zhao Q, Zhang Y, Wang G, et al. A specialized flavone biosynthetic pathway has evolved in the medicinal plant, Scutellaria baicalensis[J]. Sci Adv, 2016, 2: e1501780. DOI:10.1126/sciadv.1501780 |
| [9] |
Yang B, Liu HL, Yang JL, et al. New insights on bioactivities and biosynthesis of flavonoid glycosides[J]. Trends Food Sci Technol, 2018, 79: 116-124. DOI:10.1016/j.tifs.2018.07.006 |
| [10] |
Hirotani M, Kuroda R, Suzuki H, et al. Cloning and expression of UDP-glucose: flavonoid 7-O-glucosyltransferase from hairy root cultures of Scutellaria baicalensis[J]. Planta, 2000, 210: 1006-1013. |
| [11] |
Akio N, Manabu H, Yuko F, et al. Local differentiation of sugar donor specificity of flavonoid glycosyltransferase in Lamiales[J]. Plant Cell, 2009, 21: 1556-1572. DOI:10.1105/tpc.108.063826 |
| [12] |
Wang ZL, Wang S, Xu Z, et al. Highly promiscuous flavonoid 3-O-glycosyltransferase from Scutellaria baicalensis[J]. Org Lett, 2019, 21: 2241-2245. DOI:10.1021/acs.orglett.9b00524 |
| [13] |
Wang ZL, Gao HM, Wang S, et al. Dissection of the general two-step di-C-glycosylation pathway for the biosynthesis of (iso)schaftosides in higher plants[J]. Proc Natl Acad Sci U S A, 2020, 117: 30816-30823. DOI:10.1073/pnas.2012745117 |
| [14] |
Zhao Q, Yang J, Cui MY, et al. The reference genome sequence of Scutellaria baicalensis provides insights into the evolution of wogonin biosynthesis[J]. Mol Plant, 2019, 12: 935-950. DOI:10.1016/j.molp.2019.04.002 |
| [15] |
Liu M, Kong JQ. The enzymatic biosynthesis of acylated steroidal glycosides and their cytotoxic activity[J]. Acta Pharm Sin B, 2018, 8: 981-994. DOI:10.1016/j.apsb.2018.04.006 |
 2021, Vol. 56
2021, Vol. 56


