2. 中国中医科学院中药资源中心, 道地药材国家重点实验室培育基地, 北京 100700;
3. 浙江科技学院生物与化学工程学院, 浙江 杭州 310023;
4. 宁波易中禾药用植物研究院有限公司, 浙江 宁波 315010;
5. 云南野兰堂生物科技有限公司, 云南 昆明 650114;
6. 六安市农业科学研究院中药材研究室, 安徽 六安 237000
2. State Key Laboratory Breeding Base of Dao-di Herbs, National Resource Center for Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China;
3. School of Biological and Chemical Engineering, Zhejiang University of Science and Technology, Hangzhou 310023, China;
4. Ningbo Yizhonghe Medical Plant Research Institute Co., Ltd., Ningbo 315010, China;
5. Yunnan Yelantang Biological Technology Co., Ltd., Kunming 650114, China;
6. Laboratory of Traditional Chinese Medicine, Lu'an Academy of Agricultural Sciences, Lu'an 237000, China
铁皮石斛(Dendrobium officinale Kimura et Migo), 为兰科石斛属珍稀名贵草本植物, 分布于浙江、安徽、广西、云南、福建等地。铁皮石斛的药用历史悠久, 是我国传统的道地药材, 为中华九大仙草之首, 在我国民间应用广泛[1]。《中国药学大词典》称铁皮石斛“专滋肺胃之气液, 气液冲旺, 肾水自生”, 用于养阴生津, 治疗阴虚津亏诸症。现代科学研究表明, 铁皮石斛中的石斛多糖等多种有效成分可以增加体内T细胞和B细胞的代谢, 从而提高机体免疫能力[2]。同时, 铁皮石斛在抗氧化、抗肿瘤、抗疲劳、改善糖尿病等方面具有显著效果[3-6]。另外, 铁皮石斛也具有改善肝病变、抗高血压中风、抗炎、抗肿瘤、减少辐射、改善肠道微环境、促进心肌收缩等作用[7-13]。玫瑰石斛(Dendrobium crepidatum Lindl) 同属兰科石斛属, 主要分布于云南、贵州及东南亚等地。据中国植物物种信息数据库记载, 玫瑰石斛具有滋阴益胃、生津除烦、润肺止咳的功效, 用于口干烦渴、阴伤津亏、病后虚热、目暗不明、肺痨、食欲不振等症状。近年来, 随着石斛的广泛使用, 石斛属多种植物在民间被作为代替石斛的民间习用药材, 其中玫瑰石斛在云南南部地区被当作石斛来使用, 是一种地方用药[14]。因此, 研究铁皮石斛和玫瑰石斛茎叶间的化学成分差异, 对于玫瑰石斛资源的开发利用非常重要。
本研究主要采用超高效液相色谱-串联四级杆-飞行时间质谱(UPLC-Q-TOF-MS) 技术分别对铁皮石斛和玫瑰石斛的茎和叶进行化学成分分析, 进而利用主成分分析和偏最小二乘法分析法, 寻找两者之间的差异代谢物, 为石斛物种鉴别和资源开发等提供科学依据。
仪器与材料仪器 ACQUITYTM UPLC/Q-TOF/MS超高效液相色谱四极杆飞行时间高分辨质谱联用仪、MassLynx V4.1质谱工作站(美国Waters公司); 色谱柱: Waters ACQUITY UPLC HSS T3液相色谱柱(2.1 mm × 100 mm, 1.7 μm); Xevo G2-XS Q-Tof质谱检测器; SIMCA-P 14.1数据处理软件(瑞士Umetrics公司); GZX-9070ME电热鼓风干燥箱(上海博讯实业有限公司公司); Sartorius BT25S电子天平(德国Sartoriu公司); LG-01高速中药粉碎机(浙江瑞安市百信制药机械有限公司); KQ-400KDE型高功率数控超声波清洗器(昆山市超声仪器有限公司); Thermo Micro 21R台式高速冷冻离心机(美国Thermo公司); CR-SP412超纯水仪(上海力康生物医疗科技控股有限公司)。乙腈、甲酸、乙醇(色谱纯, Fisher Scientific, Fairlawn, NJ, 美国), 甲醇为质谱纯(美国Tedia公司)。
材料 铁皮石斛全草于2020年10月采自浙江宁波, 生长年限为2年, 玫瑰石斛全草于2020年10月采自云南昆明, 生长年限为2年, 所有样品均经浙江理工大学生命科学与医药学院张晓丹、杨东风教授鉴定为石斛属铁皮石斛(Dend-robium officinale Kimura et Migo) 和玫瑰石斛(Dendrobium crepidatum Lindl)。留样凭证保存于浙江省植物次生代谢重点实验室。取收集的铁皮石斛、玫瑰石斛鲜样, 分离茎和叶, 除去根和泥沙, 除净叶鞘, 将其剪碎后, 在55 ℃下烘干至恒重备用。
色谱条件 采用Waters ACQUITY UPLC HSS T3液相色谱柱(2.1 mm × 100 mm, 1.7 μm); 柱温40 ℃; 流速0.4 mL·min-1; 进样量1.0 μL; 检测波长254 nm; 流动相为水(A)-乙腈溶液(B), 梯度洗脱: 0~1 min为96%→96% A, 1~2 min为96%→50% A, 2~8 min为50%→30% A, 8~12 min为30%→5% A, 12~15 min为5%→5% A, 15~15 min为5%→96% A, 15~18 min为96%→96% A。
质谱条件 质谱检测以正离子电喷雾模式操作, 用四极杆飞行时间质谱仪Xevo G2-XS Q-Tof质谱检测器检测。氮气和氩气分别用作去溶剂化气体和碰撞气体。全扫描数据来自50至1 200 Da, 源温度为100 ℃, 去溶剂化温度为400 ℃, 扫描频率10.000 s, 锥电压为40.000 V。锁定喷雾标准为400 mg·mL-1, 低碰撞能量扫描的碰撞能量为6.000 V, 高碰撞能量扫描的碰撞能量为30至70 V质谱仪, UPLC系统由MassLynx4.1软件(Waters, MA, USA) 控制。采用MSE模式进行continue数据采集。
供试品溶液制备 将烘干的两种石斛茎、叶样品粉碎机粉碎, 过60目筛。精密称量0.02 g供试样品粉末, 加入体积分数70%的甲醇提取液1 mL, 振荡混匀2 min, 超声萃取45 min, 取出, 放冷, 然后8 000 r·min-1离心10 min, 取上清, 经0.22 μm的微孔滤膜过滤, 即得供试品溶液, 每组设置4个重复, 放置4 ℃冰箱备用。
数据处理与统计方法 质谱数据处理采用Waters公司QI软件进行色谱峰自动识别、峰匹配、峰对齐、峰提取、峰积分和归一化处理, 得到的二级质谱结合在线数据库[SciFinder、MassBank of North America (MoNA)] 及已报道的文献对代谢物进行鉴定, 推测可能的化合物裂解规律。得到的数据输入SIMCA-P 14.1软件进行无监督的主成分分析(PCA), 从总体上得到各组样本之间的总体代谢差异和组内样本之间的变异度大小。有监督的正交偏最小二乘判别分析(OPLS-DA), 获得导致两组之间显著差异的相关代谢物信息。
结果与分析 1 两种石斛茎叶化学成分定性分析采用UPLC-Q-TOF-MS/MS的方法分别对两种石斛的茎和叶进行分析, 通过比较两种石斛不同部位的总离子流图(图 1), 发现同种石斛的不同部位间成分差异较小, 而在同一部位中两种石斛的成分差异较大。从两种石斛总离子流图中分离出759个质量峰, 结合石斛文献和公共数据库MassBank of North America (MoNA), 根据UPLC-MS/MS矩阵中的保留时间、质荷比及碎片离子等信息对两种石斛茎叶中的代谢产物进行指认, 两种石斛中共鉴定58个代谢产物, 如表 1[15-37]所示, 其中生物碱34种, 黄酮类10种, 萜类7种, 联苄类5种, 菲类2种。
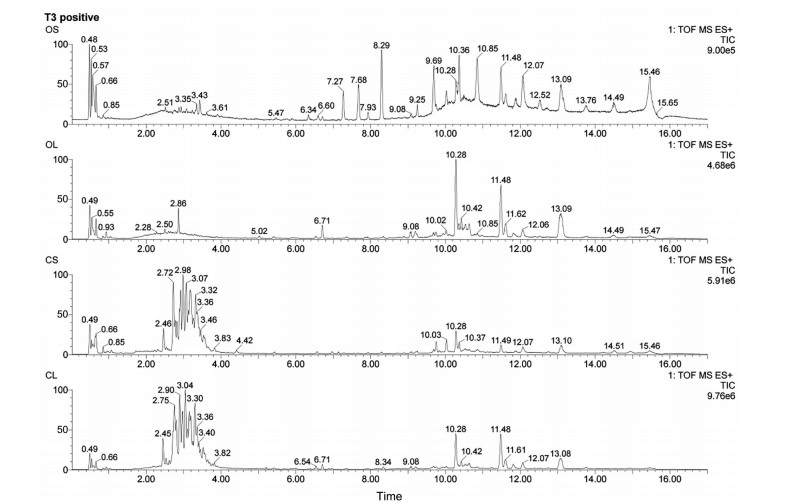
|
Figure 1 UPLC-Q-TOF-MS/MS chromatograms of Dendrobium officinale's stem (OS), Dendrobium officinale's leaf (OL), Dendrobium crepidatum's stem (CS), Dendrobium crepidatum's leaf (CL) |
| Table 1 Identification results of metabolites in stems and leaves of two Dendrobium species |
用峰面积分别计算两种石斛不同部位已经鉴定出的成分占58种物质总峰面积的百分比, 如表 2所示, 发现玫瑰石斛叶中生物碱峰面积比例为82.89%, 黄酮为3.95%, 萜类为10.96%, 联苄类为1.98%, 菲类为0.21%; 玫瑰石斛茎中生物碱峰面积比例为88.31%, 黄酮为1.30%, 萜类为8.46%, 联苄类为1.70%, 菲类为0.22%。玫瑰石斛中小分子成分以生物碱和萜类为主, 主要包括玫瑰石斛胺、玫瑰石斛碱B、C、E等生物碱, 以及萜类成分石斛苷D等。铁皮石斛茎中萜类成分占比最高, 达到70.56%, 主要为石斛苷D及其结构类似物; 黄酮类成分占比也较大, 达到22.90%, 主要包括芦丁、槲皮素等成分; 其生物碱、联苄类和菲类成分较少。铁皮石斛叶和茎成分组成差异不大。
| Table 2 Percentage of each component in the total peak area of identified substances (%) |
利用MasslynxV4.1软件进行质谱数据处理, 得到一级质谱精确相对分子质量, 其中选择碎片响应强度高的主要质谱峰进行鉴定, 再通过匹配二级质谱中的主要碎片离子, 结合在线数据库及已报道的文献对代谢物进行表征, 推测可能的化合物裂解规律。将文献中有关石斛成分的化合物数据进行收集整理, 共收录两百多种石斛化学成分信息, 通过比对, 初步鉴定出58种成分, 包括化合物名称、化学式、分子质量、保留时间、质谱类型等。
2.1 黄酮类通过质谱图可以看到, 在保留时间(tR) 为2.87 min时, 低能量通道下得到的精确质荷比m/z 303.051 9 [M+H]+, 其中m/z 304.053 7是m/z 303.051 9 [M+H]+的同位素峰。在高能量通道下得到二级质谱出现的275.059 4、257.049 5、229.053 3、201.057 4、153.056 5、125.080 0、109.396 4质谱峰特征碎片能进一步确认该化合物结构, 通过数据库匹配出分子式为C15H10O7, 推测该化合物为槲皮素(quercetin)。其中m/z 275.059 4为槲皮素去CO产生的碎片, m/z 257.049 5为m/z 275.059 4继续脱去一分子H2O后产生的碎片, m/z 229.053 3为m/z 257.059 4继续脱去CO后产生的碎片, m/z 201.057 4为m/z 229.053 3继续脱去CO后产生的碎片, 另一条裂解途径中m/z 153.056 5为槲皮素中间环发生逆Diels-Alder反应(RDA) 产生的碎片, m/z 125.080 0为m/z 153.056 5失去CO得到的碎片, m/z 109.396 4为m/z 153.056 5继续丢失CO2得到的碎片, 这符合黄酮类化合物一般裂解规律, 结合文献[38], 鉴定该化合物为槲皮素(quercetin), 裂解途径如图 2。
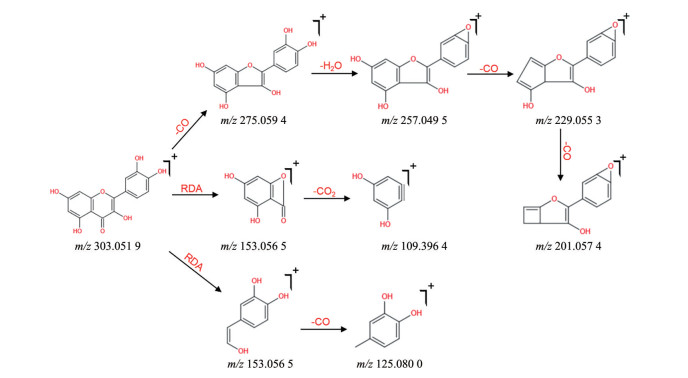
|
Figure 2 Fragmentation pathway of quercetin in positive ion mode |
通过质谱图可以看到, 在保留时间为6.34 min时, 低能量通道下给出的精确质荷比获得m/z 279.102 3 [M]+, m/z 302.087 4 [M+Na]+, m/z 580.103 5 [2M+Na]+的质谱信号, 其中m/z 301.085 3是m/z 302.087 4 [M+Na]+的同位素峰, m/z 579.173 6是m/z 580.103 5 [2M+Na]+的同位素峰。在高能量通道下产生二级质谱出现的261.097 1、233.096 8、219.084 3、190.079 1质谱峰特征碎片能进一步确认该化合物结构, 通过数据库匹配出分子式为C16H25O3N, 推测该化合物为2-羟基石斛碱(2-hydroxydendrobine)。其中m/z 261.097 1为2-羟基石斛碱脱去一分子H2O产生的碎片, m/z 233.096 8为m/z 261.097 1继续脱去两分子CH3后产生的碎片, m/z 219.084 3为m/z 233.096 8继续脱去CH3后产生的碎片, 另一条裂解途径中m/z 219.084 3为m/z 261.097 1继续脱去CO2后产生的碎片, m/z 190.079 1为m/z 219.084 3失去NH (CH3) 的碎片, 这符合生物碱类化合物一般裂解规律, 结合文献和数据库[39], 鉴定该化合物为2-羟基石斛碱(2-hydroxydendrobine), 裂解途径如图 3。
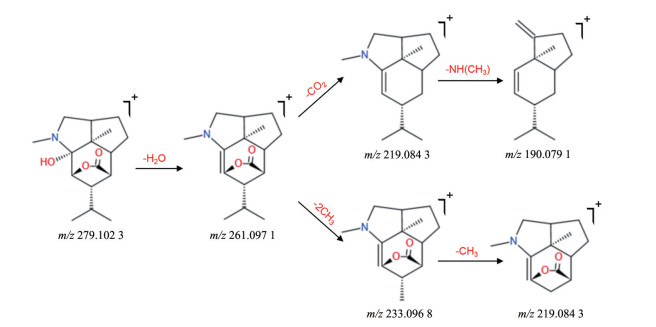
|
Figure 3 Fragmentation pathway of 2-hydroxydendrobine in positive ion mode |
通过质谱图可以看到, 在保留时间为2.74 min时, 低能量通道下给出的精确质荷比获得m/z 288.196 2 [M+H]+的质谱信号, 其中m/z 289.201 0是m/z 288.196 2 [M+H]+的同位素峰。在高能量通道下产生二级质谱出现的271.187 6、270.184 4、253.176 8、252.175 0、226.157 8、228.137 6、184.112 3等质谱峰特征碎片能进一步确认该化合物结构, 其中271.187 6是270.184 4的同位素峰, 253.176 8是252.175 0的同位素峰, 226.157 8是228.137 6的同位素峰, 通过数据库匹配出分子式为C18H25NO2, 推测该化合物为玫瑰石斛胺(crepidamine)。其中m/z 270.184 4为玫瑰石斛胺脱去一分子H2O后产生的碎片, m/z 252.175 0为m/z 270.184 4继续失去一分子H2O后产生的碎片, m/z 228.137 6为m/z 270.184 4脱去C2H2O后产生的碎片, m/z 184.112 3为m/z 228.137 6脱去C3H8后产生的碎片, 这与生物碱类中间环N原子比较活跃, 质谱碰撞与N连接的侧环容易断裂有关, 经过文献对比[21], 鉴定该化合物为玫瑰石斛胺(crepidamine), 裂解途径如图 4。

|
Figure 4 Fragmentation pathway of crepidamine in positive ion mode |
通过质谱图可以看到, 在保留时间为8.29 min时, 低能量通道下获得精确质荷比m/z 295.132 6 [M+H]+, m/z 317.113 9 [M+Na]+, m/z 611.239 0 [2M+Na]+的质谱信号, 其中m/z 296.135 3为m/z 295.132 6 [M+H]+同位素峰, m/z 318.120 3为m/z 317.113 9 [M+Na]+的同位素峰, m/z 612.241 0为m/z 611.239 0 [2M+Na]+的同位素峰。在高能量通道下产生二级质谱出现的280.111 6、277.123 2、262.099 9等质谱特征碎片峰能进一步确认该化合物结构, 通过数据库匹配出分子式为C15H18O6, 推测该化合物为钩状石斛素(aduncin)。其中m/z 277.119 8为m/z 295.132 6脱去一分子H2O产生的碎片, m/z 233.096 8为m/z 277.119 8脱去一分子CO2产生的碎片, m/z 189.070 5为m/z 233.096 8继续脱去一分子CO2产生的碎片, m/z 249.126 7为m/z 277.123 2脱去一分子C2H4产生的碎片。经过文献对比[30], 鉴定该化合物为钩状石斛素(aduncin), 裂解途径如图 5。
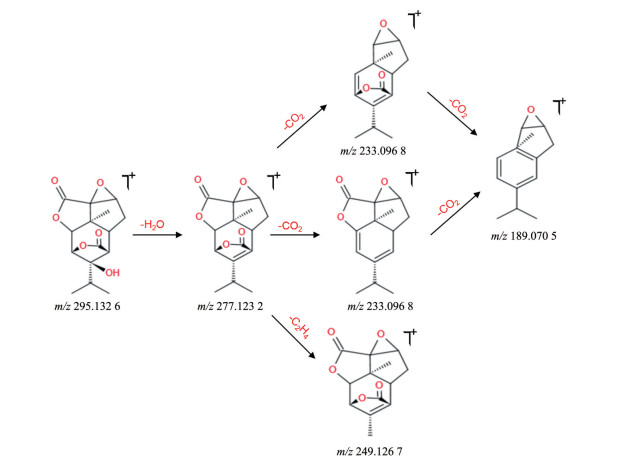
|
Figure 5 Fragmentation pathway of aduncin in positive ion mode |
利用SIMCA-P 14.1软件对预处理后的数据进行PCA和OPLS-DA分析, 并通过载荷图, 以变量投影重要性(VIP值) > 1、统计学t检验P < 0.05为阈值, 筛选差异代谢物。PCA分析的得分散点图能从整体上观察各组的分离情况, 直观地显示不同样品之间的整体差异。结果显示(图 6), 不同物种不同部位之间明显分离, 这表明两个物种不同部位之间存在明显差异。横坐标为描述多维数据矩阵中最显著的特性; 纵坐标为除横坐标以外的所能描述多维数据矩阵中最显著的特性。在横坐标上, 玫瑰石斛和铁皮石斛明显分离, 这说明物种间的差异是分离玫瑰石斛和铁皮石斛的最显著的特性。在纵坐标上, 两种石斛的茎与叶明显分离, 且茎、叶分别分布在同侧, 这说明部位之间的差异是第二显著的特性。铁皮石斛茎叶两组相距较近, 组间差异可能较小; 而玫瑰石斛茎叶两组相距较远, 组间差异可能较大。
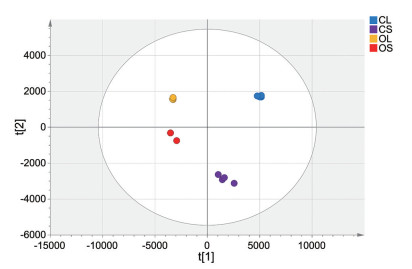
|
Figure 6 Scatter plot of PCA in different parts of two Dendrobium |
PCA作为一种反映原始数据状态的无监督方法, 环境等其他因素以及系统错误都会影响实验结果。为排除由与实验无关的某些因素引起的代谢变化, 并获得更准确的结果, 本研究使用有监督的OPLS-DA分析对数据进行进一步处理, 确定潜在的差异成分。建立OPLS-DA模型分别分析同种石斛不同部位和不同石斛同种部位的差异。OPLS-DA分析着重强调组间的差异, 通过拟合度(R2Y) 和预测度(Q2) 对模型准确性进行评价, 一般R2Y值较大, Q2 > 0.5表明该模型较好。其中叶组R2Y = 1, Q2 = 1; 茎组R2Y = 0.999, Q2 = 0.990; 玫瑰组R2Y = 1, Q2 = 0.997; 铁皮组R2Y = 1, Q2 = 0.999。对以下四个模型进行置换检验, 用于验证OPLS-DA模型的拟合程度, Q2截距值小于0, 表明模型有效, 可以进行后续的差异成分寻找。
3.1 玫瑰石斛茎叶之间差异代谢物分析根据S-plot图结合VIP值和t检验P值筛选差异代谢物(VIP值> 1, P值< 0.05) (图 7), 得到14种差异代谢物(表 3)。玫瑰石斛茎叶组间差异较大, 与PCA指示结果一致。玫瑰石斛胺、crepidatumines C、玫瑰石斛碱D、玫瑰石斛碱E等物质峰是造成玫瑰石斛茎叶差异的主要成分。其中crepidatumines C在茎叶中的比例分别为14.23%和7.53%; 玫瑰石斛碱E比例分别为13.52%和10.64%。

|
Figure 7 A: OPLS-DA of Dendrobium crepidatum leaves and stems; B: Permutation test of OPLS-DA model; C: S-plot based on OPLS-DA model |
| Table 3 Different metabolites between stem and leaf of D. crepidatum |
根据S-plot图结合VIP值和t检验P值筛选差异代谢物(VIP值> 1, P值< 0.05) (图 8), 得到3种差异代谢物(表 4)。铁皮石斛茎叶之间仅存在3个差异代谢物, 说明组间差异较小, 与PCA指示结果一致。对筛选到的差异代谢物的峰面积进行比较发现, 槲皮素、芦丁、石斛苷D在铁皮石斛叶中的占比明显高于茎。铁皮石斛茎中槲皮素、芦丁、石斛苷D的比例分别为2.32%、6.65%和45.65%; 在叶中的比例分别为9.33%、17.41%和55.63%。石斛苷D占铁皮石斛中已鉴定成分比例的一半左右。
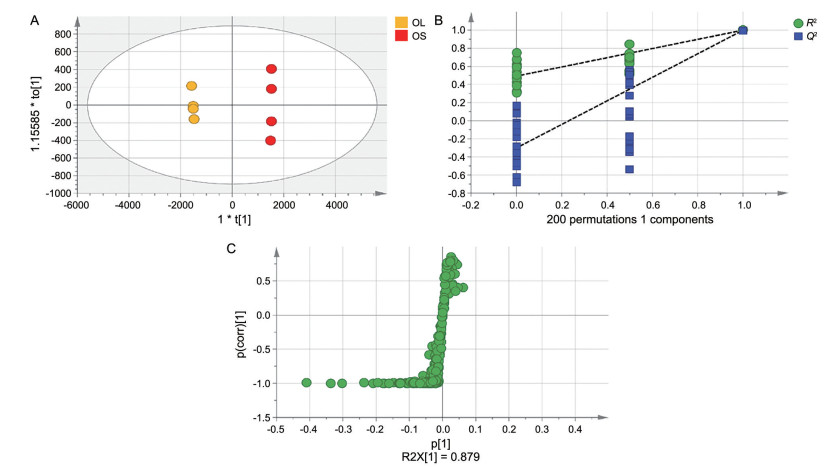
|
Figure 8 A: OPLS-DA of D. officinale leaves and stems; B: Permutation test of OPLS-DA model; C: S-plot based on OPLS-DA model |
| Table 4 Different metabolites between stem and leaf of D. officinale |
根据S-plot图结合VIP值和t检验P值筛选差异代谢物(VIP值> 1, P值< 0.05) (图 9), 得到16种差异代谢物(表 5)。对筛选到的差异代谢物在铁皮石斛茎和玫瑰石斛茎中的峰面积进行比较, 发现crepidatumines C、玫瑰石斛碱C、玫瑰石斛碱、N-甲基石斛碱、玫瑰石斛碱D、玫瑰啶碱B、2-羟基石斛碱、玫瑰石斛啶碱、玫瑰石斛碱B、石斛酚和山柰酚等成分只在玫瑰石斛茎中检测到, 在铁皮石茎中未检测到, 其中crepidatumines C、玫瑰石斛碱B、玫瑰石斛碱E、玫瑰石斛啶碱, 比例分别达到14.23%、13.16%、13.52%和8.94%。可以作为鉴别铁皮石斛和玫瑰石斛的关键差异代谢物。石斛苷D在玫瑰石斛茎和铁皮石斛茎中均能检测到, 且在玫瑰石斛中峰面积比例为7.03%, 明显低于铁皮石斛的45.65%。

|
Figure 9 A: OPLS-DA of D. crepidatum and D. officinale stems; B: Permutation test of OPLS-DA model; C: S-plot based on OPLS-DA model |
| Table 5 Different metabolites of D. officinale and D. crepidatum stems |
根据S-plot图结合VIP值和t检验P值筛选差异代谢物(VIP值> 1, P值< 0.05) (图 10), 得到22种差异代谢物(表 6)。对筛选到的差异代谢物在铁皮石斛叶和玫瑰石斛叶中的峰面积进行比较, 结果显示, 玫瑰石斛胺、crepidatumines C、山柰酚、玫瑰石斛啶碱、玫瑰石斛碱C、玫瑰石斛碱、N-甲基石斛季铵碱、玫瑰石斛碱B、玫瑰石斛碱D、玫瑰啶碱B、2-羟基石斛碱和石斛酚仅在玫瑰石斛叶中检测到, 在铁皮石斛叶中未检测到, 其中玫瑰石斛碱C比例达9.34%, 玫瑰石斛碱E比例达10.64%, 玫瑰石斛啶碱比例达9.05%, 槲皮素和芦丁在玫瑰石斛叶和铁皮石斛叶中均存在, 且铁皮石斛叶中峰面积明显高于玫瑰石斛, 其中铁皮石斛叶中槲皮素比例为9.33%, 芦丁比例为17.41%, 在玫瑰石斛中二者分别为0.07%和0.11%。
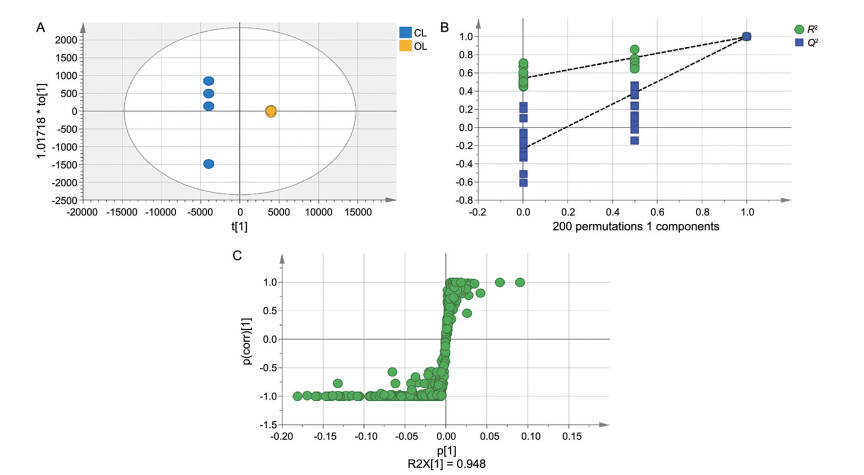
|
Figure 10 A: OPLS-DA of D. crepidatum and D. officinale leaves; B: Permutation test of OPLS-DA model; C: S-plot based on OPLS-DA model |
| Table 6 Different metabolites of D. officinale and D. crepidatum leaves |
石斛属植物种类繁多, 其中铁皮石斛、金钗石斛、霍山石斛、流苏石斛和鼓槌石斛被《中华人民共和国药典》收录[40]。药用石斛化学成分复杂, 主要包括多糖类、生物碱类、黄酮类、菲类、联苄类、挥发油类等多种活性物质[41], 具有抗血管生成、免疫调节、抗糖尿病、抑制白内障、神经保护、保肝、抗炎、抗血小板聚集等作用[42]。不同化学成分在不同石斛间的含量分布也存在较大差异。如生物碱在金钗石斛中的含量明显高于铁皮石斛, 尤其石斛碱成分含量是同属其他植物中最高的[43], 是金钗石斛的特征性成分。铁皮石斛中活性成分主要为黄酮和石斛多糖[44, 45], 生物碱成分与金钗石斛相比含量很低[46]。王再花等[47]采用热水浸提法和酸性染料比色法比较研究了26种野生石斛, 发现玫瑰石斛的生物碱含量为0.500%, 高于金钗石斛的0.415%, 而铁皮石斛中仅为0.068%。说明玫瑰石斛的生物碱含量极高, 可能是玫瑰石斛的主要药用成分, 具有极大的开发价值。本研究采用基于UPLC-Q-TOF-MS/MS技术分别对铁皮石斛和玫瑰石斛的茎和叶进行化学成分分析, 共鉴定或推断出58个代谢物, 其中生物碱34种, 黄酮类10种, 萜类7种, 联苄类5种和菲类2种。计算不同物质峰面积的相对比例, 发现玫瑰石斛叶中生物碱峰面积比例为82.89%, 黄酮为3.95%, 萜类为10.96%; 茎中生物碱比例为88.31%, 黄酮为1.30%, 萜类为8.46%。铁皮石斛叶生物碱比例为2.25%, 黄酮为31.33%, 萜类为64.84%; 茎生物碱比例为1.72%, 黄酮为22.90%, 萜类为70.56%。结合PCA和OPLS-DA多变量统计分析, 发现玫瑰石斛和铁皮石斛之间存在的种间差异较大。铁皮石斛中黄酮类和萜类成分显著高于玫瑰石斛, 主要包括槲皮素、芦丁和石斛苷D。其中石斛苷D及其异构体的面积比例在铁皮石斛叶中达到了63.59%, 茎中达到48.40%。这些成分具有抗氧化、抗肿瘤、抗炎症、抗菌、降血糖、保护心血管和免疫调节等药理作用[48-50]。玫瑰石斛碱、玫瑰石斛碱B、玫瑰石斛碱C、玫瑰石斛碱D、玫瑰石斛啶碱、玫瑰石斛胺、玫瑰啶碱B等玫瑰石斛特有的生物碱是造成玫瑰石斛和铁皮石斛差异的主要成分。同时, 这些化合物可以作为鉴别铁皮石斛和玫瑰石斛的标志性代谢物。李振坚等[21]的研究表明玫瑰石斛中的玫瑰石斛碱、玫瑰石斛啶碱、玫瑰石斛胺等生物碱为中氮茚生物碱, 与金钗石斛中倍半萜生物碱不同。目前分离到的中氮茚生物碱主要分布于石斛属、娃儿藤属和杜英属的植物中。现有的研究表明中氮茚及其衍生物具有抗结核、抗氧化、抗菌、抗癌、抗炎等药理活性[51]。结合对玫瑰石斛的抗炎[52]、抗氧化[53]、细胞毒性[53]、缓解急性肺损伤[54]、神经保护[55]等研究, 推测生物碱可能是玫瑰石斛中的主要药效成分。Hu等[54]提取了玫瑰石斛的总生物碱成分, 并发现玫瑰石斛总生物碱可通过下调tlr4介导的MyD88/MAPK信号通路, 抑制脂多糖(LPS) 激活的巨噬细胞中一氧化氮(NO) 的生成, 并对LPS诱导的小鼠急性肺损伤具有保护作用。虽然玫瑰石斛在云南地区被当作石斛来使用, 但其药效的物质基础并不明确, 由于玫瑰石斛的生物碱含量甚至高于《中国药典》中记载的金钗石斛, 因此, 玫瑰石斛具有极大的资源开发价值。目前玫瑰石斛已实现人工栽培, 对玫瑰石斛生物碱的药理活性仍需做进一步的研究。若能阐明玫瑰石斛中生物碱的药理活性, 将极大提升玫瑰石斛的药用价值。
综上, 本研究通过UPLC-Q-TOF-MS/MS技术, 对玫瑰石斛和铁皮石斛茎、叶的成分进行了鉴定与对比, 发现铁皮石斛中主要的小分子成分为萜类和黄酮, 玫瑰石斛中主要的小分子成分为生物碱和萜类。其中玫瑰石斛碱、玫瑰石斛碱B、玫瑰石斛碱C、玫瑰石斛碱D、玫瑰石斛碱E、玫瑰石斛啶碱、玫瑰石斛胺、玫瑰啶碱B等多种生物碱成分只存在于玫瑰石斛。对石斛属内多种药材的鉴别与资源利用具有指导意义, 同时为开发玫瑰石斛资源提供了新思路。
作者贡献: 娄港归、夏杰负责实验研究、数据分析及文稿撰写, 王宏鹏、施宛丽、杨健负责成分检测, 梁宗锁、肖艺、李振达、张煜、刘志超负责石斛样本采集和数据分析, 通讯作者张晓丹、杨东风负责项目总体设计、规划以及稿件修改。
利益冲突: 本文作者声明该论文没有涉及任何利益冲突。
| [1] |
Yan XM, Yang JY, Li Y, et al. Series of recent research situation of genuine regional drug (21) recent research situation of genuine regional drug Dendrobium officinale[J]. Guangming J Chin Med (光明中医), 2020, 35: 2783-2786. |
| [2] |
Wu BL, Wu YG, Zhao ZR, et al. Advances in immunoregulatory effects and bioactive compounds of polysaccharides from Dendrobium officinale[J]. Chin Tradit Herb Drugs (中草药), 2019, 50: 5373-5379. |
| [3] |
He TG, Yang LT, Li YR, et al. Effects of the polysaccharides DCPP1a-1 from suspension-cultured protocorms of Dendrobium candidum on oxygen radical and lipid peroxidation[J]. Nat Prod Res Devel (天然产物研究与开发), 2007, 3: 410-414. |
| [4] |
Jin LH, Liu CF, Tang T. The anti-tumor effect and mechanism of soluble polysaccharides from Dendrobium Candidum[J]. Health Res (健康研究), 2010, 30: 167-170. |
| [5] |
Zhou HT, Cao JM, Lin Q, et al. Effect of Dendrobium officinale Kimura et Migo on substance metabolism and exercise capacity in rats after exercise training[J]. Chin Pharm J (中国药学杂志), 2013, 48: 1684-1688. |
| [6] |
Wu HS, Xu JH, Chen LZ, et al. Studies on anti-hyperglycemic effect and its mechanism of Dendrobium candidum[J]. China J Chin Mater Med (中国中药杂志), 2004, 29: 69-72. |
| [7] |
Pang C, Zhang XL, Zhang XL. Research progress in inhibitory epithelium-derived malignant tumors by Dendrobium officinale[J]. Pract Oncol J (实用肿瘤学杂志), 2020, 34: 362-367. |
| [8] |
Sun J, Guo YD, Fu XQ, et al. Dendrobium candidum inhibits MCF-7 cells proliferation by inducing cell cycle arrest at G2/M phase and regulating key biomarkers[J]. Onco Targets Ther, 2016, 9: 21-30. |
| [9] |
Yin C, Xu YY, Chen GY, et al. Efficacy of compound Dendrobium on PI3K/AKT/eNOS signaling pathway in hypertensive rats induced by "dietary disorders"[J]. China J Chin Mater Med (中国中药杂志), 2018, 43: 2345-2351. |
| [10] |
Li YM. A Preliminary Study of Effects of Dendrobium officinale kimura et Migo on Lipid Metabolism and Inflammation in Apolipoprotein (铁皮石斛对ApoE基因敲除小鼠脂质代谢和炎症反应作用的初步研究)[D]. Changsha: Hunan University of Chinese Medicine, 2013.
|
| [11] |
Wang CD, Qiang YZ, Cui FM, et al. Researches on radioprotective effects of Dendrobium[J]. Radiat Protect (辐射防护), 2004, 6: 403-405. |
| [12] |
Cao R, Wang H, Wu WJ, et al. Effect of ultra-micro Dendrobium officinale powder on the intestinal microbiota and enzyme activities in mice with spleen-deficiency constipation[J]. Chin J Microecol (中国微生态学杂志), 2014, 26: 1011-1015. |
| [13] |
Chen H, Wang B, Tang HQ, et al. Effects of Dendrobium officinale polysaccharides on cardiac function and ability of myocardial contraction in rabbits with coronary heart disease[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2015, 21: 139-143. |
| [14] |
Li CB. Research on the Chemical Constituents from Dendrobium crepidatum and Flower of Dendrobium chrysotoxum (玫瑰石斛和鼓槌石斛花的化学成分研究)[D]. Changchun: Jilin Agricultural University, 2011.
|
| [15] |
Morita H, Fujiwara M, Yoshida N, et al. New picrotoxinin-type and dendrobine-type sesquiterpenoids from Dendrobium snowflake 'red star'[J]. Tetrahedron, 2000, 56: 5801-5805. DOI:10.1016/S0040-4020(00)00530-5 |
| [16] |
Zhang X, Tu FJ, Yu HY, et al. Copacamphane, picrotoxane and cyclocopacamphane sesquiterpenes from Dendrobium nobile[J]. Chem Pharm Bull, 2008, 56: 854-857. DOI:10.1248/cpb.56.854 |
| [17] |
Gawell L, Leander K. The constitution of aduncin, a sesquiterpene related to picrotoxinin, found in Dendrobium aduncum[J]. Pergamon, 1976, 15: 1991-1992. |
| [18] |
Ye QH, Qin GW, Zhao WM. Immunomodulatory sesquiterpene glycosides from Dendrobium nobile[J]. Phytochemistry, 2002, 61: 885-890. DOI:10.1016/S0031-9422(02)00484-3 |
| [19] |
Ye QH, Zhao WM. New alloaromadendrane, cadinene and cycloco-pacamphane type sesquiterpene derivatives and bibenzylsfrom Dendrobium nobile[J]. Planta Med, 2002, 68: 723-729. DOI:10.1055/s-2002-33786 |
| [20] |
Olesova D, Galba J, Piestansky J, et al. A novel UHPLC-MS method targeting urinary metabolomic markers for autism spectrum disorder[J]. Metabolites, 2020, 10: 443. DOI:10.3390/metabo10110443 |
| [21] |
Li ZJ, Zhou WY, Han B, et al. Study on alkaloids from stems of Dendrobium crepidatum based on UPLC-Q-TOF-MS[J]. Nat Prod Res Devel (天然产物研究与开发), 2020, 32: 482-488. |
| [22] |
Inubushi Y, Ishii H, Yasui B. Isolation and characterization of alkaloids of the Chinese drug Chin-Shih-Hu[J]. Chem Pharm Bull, 1964, 12: 1175-1180. DOI:10.1248/cpb.12.1175 |
| [23] |
Li MF, Hirata Y, Xu GJ, et al. Studies on the chemical constituents of Dendrobium loddigesii rolfe[J]. Acta Pharm Sin (药学学报), 1991, 26: 307-310. |
| [24] |
Granelli I, Leander K, Luning B. Studies on orchidaceae alkaloids. XVI. A new alkaloid, 2-hydroxydendrobine, from Dendrobium findlayanum par. et Rchb. f.[J]. Acta Chem Scandinav, 1970, 24: 1209-1212. DOI:10.3891/acta.chem.scand.24-1209 |
| [25] |
Inubushi Y, Nakano J. Structure of dendrine[J]. Tetrahedron Lett, 1965, 31: 2723-2728. |
| [26] |
Elander M, Leander K. Studies on orchidaceae alkaloids. XXI. 6-Hydroxynobiline, a new alkaloid from Dendrobium hildebrandii Rolfe[J]. Acta Chem Scandinav, 1971, 25: 717-720. DOI:10.3891/acta.chem.scand.25-0717 |
| [27] |
Chen XM, Zhang SS, Ma JS, et al. A simple, rapid and reliable UFLC-MS/MS method for the determination of dendrobine in rat plasma and its application to a pharmacokinetic study[J]. Anal Methods, 2014, 6: 1197-1202. DOI:10.1039/C3AY41743C |
| [28] |
Lu YL, He YQ, Wang M, et al. Characterization of nuciferine metabolism by P450 enzymes and uridine diphosphate glucuronosyltransferases in liver microsomes from humans and animals[J]. Acta Pharmacol Sin, 2010, 31: 1635-1642. DOI:10.1038/aps.2010.172 |
| [29] |
Ding YL. Analysis of Chemical Composition of Dendrobii officinalis caulis (中药铁皮石斛的化学成分分析)[D]. Shanghai: Shanghai University of Traditional Chinese Medicine, 2019.
|
| [30] |
Li Y. Studies on the Chemical Constituents of Dendrobium candidum (铁皮石斛的成分研究)[D]. Beijing: Peking Union Medical College, 2009.
|
| [31] |
Fan JJ, Guan L, Kou ZQ, et al. Determination of chrysotoxine in rat plasma by liquid chromatography-tandem mass spectrometry and its application to a rat pharmacokinetic study[J]. J Chromatogr, 2014, 967: 57-62. |
| [32] |
Sales QD, Mathias MD, De Oliveira RR. Determination of phenolic compounds in the methanolic extract of Pourouma guianensis leaves by UPLC-DAD-MS[J]. Nat Prod J, 2020, 10: 566-570. |
| [33] |
Ye Z, Dai JR, Zhang CG, et al. Chemical differentiation of Dendrobium officinale and Dendrobium devonianum by Using HPLC fingerprints, HPLC-ESI-MS, and HPTLC analyses[J]. Evid-Based Complement Altern Med, 2017, 2017: 8647212. |
| [34] |
Wu CF. Quality Research of Dendrobioum huoshanense and Dendrobium officinale Based on the UHPLC-MS Technology (基于液质联用技术的霍山石斛及铁皮石斛质量研究)[D]. Guangzhou: Guangzhou University of Chinese Medicine, 2016.
|
| [35] |
Xu HL, Zhou TT, Wen J, et al. Isolation and purification of three flavonoids from the hawthorn leaves by high speed countercurrent chromatography, combined with isocratic preparative reversed-phase high performance liquid chromatography[J]. J Liquid Chromatogr Related Technol, 2009, 32: 2216-2231. DOI:10.1080/10826070903163008 |
| [36] |
Bi ZM, Wang ZT, Xu LS, et al. Studies on the chemical constituents of Dendrobium fimbriatum[J]. Acta Pharm Sin (药学学报), 2003, 38: 526-529. |
| [37] |
Zhou XM, Zheng CJ, Gan LS, et al. Bioactive phenanthrene and bibenzyl derivatives from the stems of Dendrobium nobile[J]. J Nat Prod, 2016, 79: 1791-1797. DOI:10.1021/acs.jnatprod.6b00252 |
| [38] |
Ding LN, Qiu YY, Shu T, et al. Determination of flavonoids in the supercritical CO2 extract of sea buckthorn fruit by using ultra-high performance liquid chromatography-mass spectrometry[J]. Food Sci (食品科学), 2019, 40: 273-280. |
| [39] |
Yin TP, Li X, Wang Z, et al. A review on spectral characteristics of dendrobines from the Dendrobium plants[J]. Chin J Magn Reson (波谱学杂志), 2020, 37: 381-389. |
| [40] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. Beijing: China Medical Science Press, 2020: 94.
|
| [41] |
Tao ZX, Lu NS, Wu XQ, et al. Research progress on chemical constituents and pharmacological action of Dendrobium[J]. J Pharm Res (药学研究), 2021, 40: 44-51. |
| [42] |
Teixeira SJA, Ng TB. The medicinal and pharmaceutical importance of Dendrobium species[J]. Appl Microbiol Biotechnol, 2017, 101: 2227-2239. DOI:10.1007/s00253-017-8169-9 |
| [43] |
Zhang YX, Liu H, Ling L, et al. Advances in pharmacological effect of Dendrobium nobile Lindl. alkaloid[J]. Shanghai J Tradit Chin Med (上海中医药杂志), 2019, 53: 95-96. |
| [44] |
Sun L, Chen XM, Wu CM, et al. Advances and prospects of pharmacological activities of Dendrobium officinale Kimura et Migo polysaccharides[J]. Acta Pharm Sin (药学学报), 2020, 55: 2322-2329. |
| [45] |
Zeng YY, Nie XT, Li ZJ, et al. Research progress on active ingredients of flavonoids in traditional Chinese medicine Dendrobium[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2021, 27: 197-206. |
| [46] |
Xu YY, Wang LY, Huang B, et al. Comparison of contents of polysaccharides and alkaloids in Dendrobium from different harvest time[J]. West China J Pharm Sci (华西药学杂志), 2014, 29: 288-291. |
| [47] |
Wang ZH, Li J, Zhang JH, et al. Comparison of polysaccharide and alkaloid contents in Dendrobium[J]. Chin Agric Sci Bull (中国农学通报), 2015, 31: 242-246. |
| [48] |
Wu SQ, Li YS, Sun WF. Research progress on anti-lung cancer mechanism of quercetin and its derivatives[J]. Pharmacol Clin Chin Mater Med (中药药理与临床), 2021. https://doi.org/10.13412/j.cnki.zyyl.20210621.004.
|
| [49] |
Li YS. Progress on resources, pharmacological effect and major forms of rutin[J]. Biot Resour (生物资源), 2013, 35: 13-16. |
| [50] |
Wang XY, Meng CW, Zhou QM. Research progress of sesquiterpenoids from Dendrobium nobile[J]. Nat Prod Res Devel (天然产物研究与开发), 2019, 31: 1837-1845. |
| [51] |
Sharma V, Kumar V. Indolizine: a biologically active moiety[J]. Med Chem Res, 2014, 23: 3593-3606. DOI:10.1007/s00044-014-0940-1 |
| [52] |
Hu Y, Yang H, Ding XQ, et al. Anti-inflammatory octahydroindolizine alkaloid enantiomers from Dendrobium crepidatum[J]. Bioorg Chem, 2020, 100: 103809. DOI:10.1016/j.bioorg.2020.103809 |
| [53] |
Mukti RP, Mukesh BC, Basant P, et al. Assessment of antioxidant and cytotoxic activities of extracts of Dendrobium crepidatum[J]. Biomolecules, 2019, 9: 478-490. DOI:10.3390/biom9090478 |
| [54] |
Hu Y, Ren J, Wang L, et al. Protective effects of total alkaloids from Dendrobium crepidatum against LPS-induced acute lung injury in mice and its chemical components[J]. Phytochemistry, 2018, 149: 12-23. DOI:10.1016/j.phytochem.2018.02.006 |
| [55] |
Ng TB, Liu JY, Wong JH, et al. Review of research on Dendrobium, a prized folk medicine[J]. Appl Microbiol Biotechnol, 2012, 93: 1795-1803. DOI:10.1007/s00253-011-3829-7 |
 2021, Vol. 56
2021, Vol. 56


