2. 中国中医科学院中药资源中心, 北京 100700
2. National Resource Center for Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China
中药续断为川续断科植物川续断Dipsacus asper Wall. ex Henry的干燥根, 具有补肝肾、强筋骨、安胎的功效[1], 现代临床常用于骨科疾病的治疗。川续断皂苷Ⅵ是续断药材的主要活性成分, 属于齐墩果烷三萜皂苷类化合物。研究发现川续断皂苷Ⅵ可诱导成骨细胞成熟分化, 进而促进骨形成[2], 而且对小鼠急性肝损伤[3]及缺氧诱导的心肌细胞凋亡具有一定的保护作用[4]。
已有研究认为, 三萜皂苷类化学成分主要由甲羟戊酸(MVA) 途径合成[5], 主要包括三萜皂苷上游前体的形成、三萜皂苷骨架的构建、三萜皂苷骨架下游的修饰。三萜皂苷的生物合成受干旱、低温[6, 7]等调控, 植物合成三萜皂苷等次生代谢产物, 可抵御多种逆境胁迫环境。研究发现, 不同产地、不同海拔生长的川续断受逆境胁迫的影响各不相同, 其主要活性成分川续断皂苷Ⅵ在根部的积累也存在较大的差异[8, 9], 川续断皂苷Ⅵ的合成和积累与环境因子密切相关。作者前期研究发现, 茉莉酸甲酯可显著促进川续断中川续断皂苷Ⅵ的合成和积累, 有利于植物抵抗逆境环境的胁迫[10]。但是逆境胁迫如何调控三萜皂苷合成机制尚不明确。NAC基因是响应植物逆境胁迫应答反应中非常重要的一类转录因子[11]。已有研究发现, NAC-MYB-GRN基因调控网络调控木质素的生物合成, 促进植物对逆境环境的适应[12]。同时, NAC转录因子参与植物的耐旱、耐盐、耐低温等多种非生物逆境胁迫, 调节植物次生代谢产物的合成, 提高植物对多种逆境胁迫的抗性[13, 14]。因此, 推测NAC转录因子调控川续断皂苷Ⅵ的合成, 提高川续断对逆境环境的适应性。
本研究以川续断为研究材料, 在前期川续断全长转录组测序的基础上, 利用生物信息学分析技术挖掘川续断中逆境相关的DaNAC转录因子, 并对其氨基酸序列进行生物信息学分析, 采用qRT-PCR技术分析其在川续断不同组织中的表达模式, 探索DaNAC基因对低温胁迫及茉莉酸甲酯的应答, 为解析逆境胁迫调控川续断皂苷Ⅵ合成的分子机制奠定理论基础。
材料与方法材料 川续断(Dipsacus asperoides) 采集于贵州省毕节市威宁县梅花山, 栽培于贵州中医药大学试验田及温室中。试验田中新鲜根、茎、叶、叶柄、花、果实, 采集后在液氮中速冻。温室中苗期川续断一部分于15 ℃低温处理和23 ℃常温培养, 分别处理6 h、1 d、2 d; 一部分用MS培养液进行水培, 添加茉莉酸甲酯(MeJA) 进行处理, 对照处理加等量的乙醇, 分别处理6 h、1 d、3 d、5 d。处理后采集川续断根, 速冻于液氮中, 所有样品均于-80 ℃保存, 用于总RNA提取。
试剂 植物总RNA提取试剂盒购自普洛麦格(北京) 生物技术有限公司, 焦碳酸二乙酯(DEPC) 购自于西格玛奥德里奇(上海) 贸易有限公司, PrimeScript RT Reagent Kit和TB GreenTM Premix Ex TaqTM Ⅱ购自宝生物工程(大连) 有限公司, 所有引物均由生工生物工程(上海) 股份有限公司合成。
仪器 5810R型低温冷冻离心机(Eppendorf, 德国), Nano‐Drop2000分光光度计(Thermo Fisher Scientific, 美国), CFX96 PCR仪(Bio-Rad, 美国), 高灵敏发光成像系统(Bio-Rad, 美国)。
NAC蛋白序列的获得 从川续断全长转录组数据库中下载川续断NAC转录因子序列, 根据功能注释并利用SMART (http://smart.embl-heidelberg.de/) 分析蛋白结构域, 筛选获得具有NAC保守结构域的候选基因; 在TAIR和NCBI上下载拟南芥(Arabidopsis thaliana) 和水稻(Oryza sativa) 的NAC蛋白质序列(AT1G52890, ANAC019; AT3G15500, ANAC055; AT4G27410, ANAC72; AT5G63790, ANAC102; DQ394702.1, OsNAC1; AB028185.1, OsNAC6; AB028183.1, OsNAC4)。
NAC蛋白家族系统进化树分析 利用MEGA-X软件对获得的NAC蛋白序列进行比对, 根据多重序列比对的结果, 在MEGA-X软件中采用邻位相连法(neighbor-joining, NJ) 构建川续断、拟南芥、水稻NAC蛋白家族进化树。
NAC蛋白序列保守motif分析 利用MEME (http://meme-suite.org/) 分析NAC蛋白序列保守的motif, motif数量小于10个, 最大宽度值为200, 最小宽度值为6, 其余参数为默认设置。
川续断DaNAC基因的表达分析 通过川续断全长转录组数据库获得基因序列, 利用Primer5设计引物(表 1) 用于实时荧光定量分析。将-80 ℃保存的川续断样品在研钵中用液氮磨碎, 依据植物总RNA提取试剂盒的方法提取川续断RNA, 根据PrimeScript RT Reagent Kit试剂盒说明书的方法将川续断RNA反转录成cDNA, 利用DaACT103作为内参基因进行荧光定量PCR[15]。反应体系: cDNA 1 μL, TB GreenTM Premix Ex TaqTM Ⅱ 5 μL, Primer-L 0.3 μL, Primer-R 0.3 μL, ddH2O 3.4 μL, PCR反应条件依据TB GreenTM Premix Ex TaqTMⅡ试剂盒说明书, 每组设置3次生物学重复。
| Table 1 Primer information of qRT-PCR |
从川续断全长转录组数据库中下载川续断NAC转录因子具有完整ORF序列的有29个, 根据功能注释及SMART进行氨基酸结构域分析, 均含有保守NAM结构域。根据进化树结果分析(图 1), 可将川续断NAC蛋白家族分为6个亚家族(Ⅰ~Ⅵ)。其中, Group Ⅰ主要包含部分川续断蛋白及水稻、拟南芥逆境相关NAC蛋白, Group Ⅱ含有4个川续断NAC蛋白, Group Ⅲ含有3个川续断NAC蛋白, Group Ⅳ含有7个川续断NAC蛋白, Group Ⅴ仅含有1个川续断NAC蛋白, Group Ⅵ含有9个川续断NAC蛋白。在川续断中有5个DaNAC蛋白与拟南芥和水稻逆境胁迫相关的NAC蛋白聚在同一分支, 分别是34564NAC2、33883NAC48、32393NAC81、6187NAC14、6727NAC14。
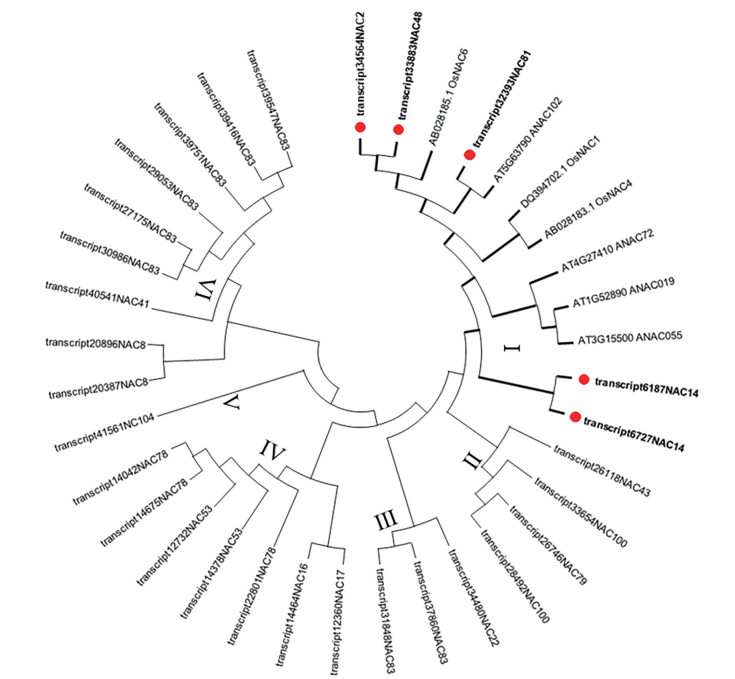
|
Figure 1 Phylogenetic analysis of DaNAC proteins from D. asper |
用MEME软件分析川续断DaNAC蛋白序列的保守motif, 根据E-value对川续断DaNAC家族成员蛋白序列的保守motif进行排序, motif 1和motif 2的保守性最强(图 2)。从川续断DaNAC家族成员保守motif结果分析可以看出, 保守motif (motif 1和motif 2) 主要集中分布在DaNAC蛋白序列的N端, 与NAC蛋白保守结构域NAM的位置一致。
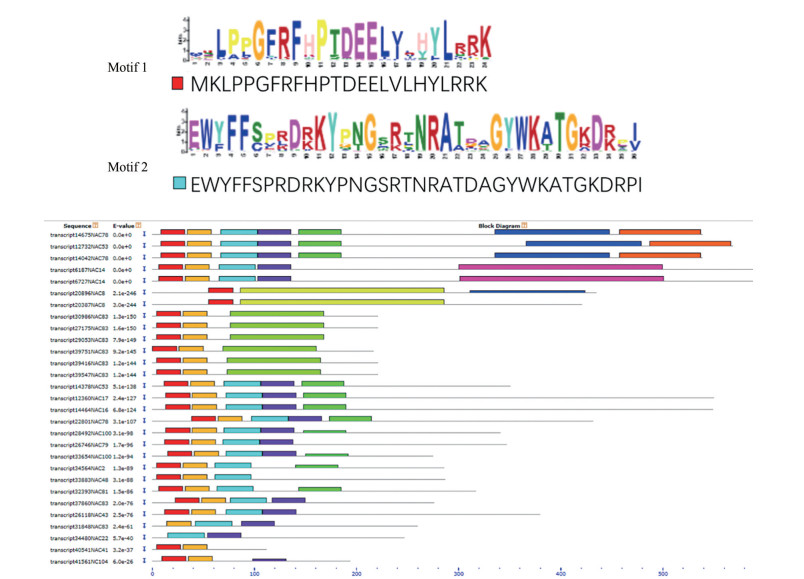
|
Figure 2 The conserved domains analysis of DaNAC proteins |
本文选取4个DaNAC基因, 分析其在川续断不同组织中的表达模式(图 3), 包括与拟南芥和水稻逆境胁迫相关NAC蛋白聚在同一分支, 且较为同源的34564NAC2、33883NAC48、6727NAC14, 以及与其聚在不同分支, 同源性较低的34480NAC22。上述4个DaNAC在川续断不同组织中均有表达, 在叶片中表达量最高, 在花和种子中表达量较低。其中, 6727NAC14在叶片、叶柄、根、茎中表达量较高, 在花、种子中有较低的表达; 34564NAC2、33883NAC48、34480NAC22主要在川续断的叶片中表达, 而在川续断其他组织中的表达量均较低。
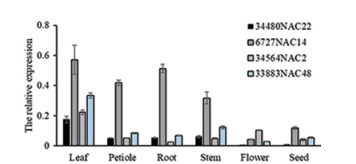
|
Figure 3 The expression patterns of DaNAC genes in different tissues of D. asper by qRT-PCR |
进一步分析发现, 4个DaNAC基因均受低温诱导表达(图 4)。与25 ℃正常温度培养的川续断相比, 在15 ℃低温胁迫6 h后, 4个基因的表达量均有不同程度升高。34564NAC2、33883NAC48、6727NAC14主要在15 ℃低温处理前期(6 h) 表达量有明显的升高, 而在15 ℃低温处理1 d后, 表达量升高得不明显; 在低温处理6 h到2 d, 34480NAC22均有一定的上调表达。因此, 结果说明川续断4个DaNAC基因均受低温的诱导上调表达, 但表达模式存在一定的差异。

|
Figure 4 The expression patterns of DaNAC genes under cold treatment by qRT-PCR |
150 μmol·L-1 MeJA处理后, 4个DaNAC基因的表达量均有一定的差异(图 5)。与对照相比, MeJA处理6 h至1 d后, 34564NAC2、33883NAC48基因上调表达; 在MeJA处理6 h时, 6727NAC14基因的表达量升高; MeJA处理过程中, 34480NAC22基因均受茉莉酸甲酯诱导下调表达。因此, 结果说明川续断4个NAC基因均受茉莉酸甲酯的诱导表达, 但是不同的基因诱导表达的模式存在差异。
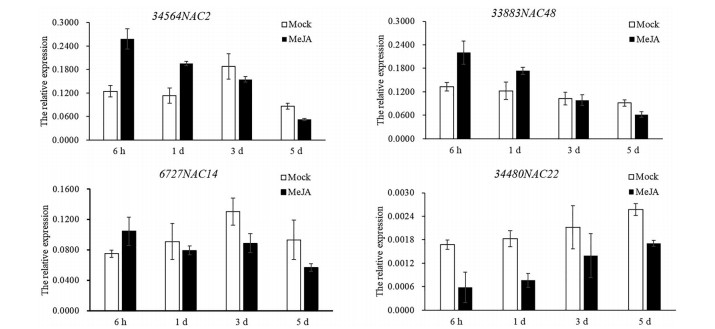
|
Figure 5 The expression patterns of DaNAC genes under MeJA treatment by qRT-PCR |
川续断皂苷Ⅵ主要在川续断的根中积累。Wang等[16]通过转录组等研究分析其生物合成相关酶的候选基因及川续断三萜皂苷合成途径。但是, 植物次生代谢产物的合成途径往往是一个复杂的调控网络, 转录因子发挥重要的调控作用。本研究通过全长转录组数据库筛选得到29个具有完整ORF的DaNAC转录因子序列, 其中, 有5个DaNAC与拟南芥和水稻中与逆境胁迫相关的NAC较为同源。已有研究证明, 拟南芥ANAC019、ANAC055和ANAC072较为同源, 作为转录因子调控茉莉酸信号并诱导防御基因的表达, 增强植物对逆境胁迫的防御反应[17]; 水稻SNAC1、OsNAC6等基因受茉莉酸、低温、干旱等逆境胁迫的诱导表达, 参与多种生物逆境和非生物逆境胁迫的响应, 过表达SNAC1显著提高水稻对干旱和盐碱的抗性[11]。川续断中这5个与逆境胁迫密切相关的NAC转录因子, 在川续断抵御低温、干旱等逆境胁迫中同样发挥着重要功能。
植物逆境应答是一个复杂的调控网络, 逆境胁迫能促进植物次生代谢产物的积累。研究发现, 在新疆紫草悬浮细胞中, 低温胁迫可促进紫草酸B、紫草呋喃A的积累[18]。在番茄中, 茉莉酸诱导番茄萜烯合成酶基因的表达, 促进番茄中萜烯的生物合成, 提高番茄对逆境胁迫的抗性[19]。本课题组前期研究发现15 ℃低温胁迫[20]、150 μmol·L-1茉莉酸甲酯[10]处理可增加川续断根中川续断皂苷Ⅵ的积累, DaNAC基因参与川续断响应低温及茉莉酸甲酯的逆境胁迫应答。组织表达分析显示, DaNAC基因在川续断根茎叶等组织中均有表达, 但其表达模式不同, 说明川续断对逆境胁迫应答存在一定的组织特异性。进一步对DaNAC基因进行不同非生物逆境诱导模式表达分析, 发现4个DaNAC基因均受低温诱导表达; 34564NAC2、33883NAC48基因受茉莉酸甲酯诱导上调表达, 34480NAC22基因受茉莉酸甲酯诱导下调表达。因此, 推测DaNAC基因参与调控川续断中川续断皂苷Ⅵ等次生代谢产物的合成, 促进川续断对非生物逆境胁迫的抵抗。后续将针对DaNAC基因如何调控川续断皂苷Ⅵ等次生代谢产物的合成开展进一步的研究。
作者贡献: 徐娇设计了本实验, 完成了数据分析、论文初稿的写作; 徐娇、胡正平、李良远和肖承鸿完成了川续断的种植、处理、qRT-PCR等相关实验; 何华、周涛、江维克及郭娟共同指导论文的写作与修改。
利益冲突: 本文的研究内容无任何利益冲突。
| [1] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. Vol 1. Beijing: China Medical Science Press, 2020: 343.
|
| [2] |
Niu Y, Li Y, Huang H, et al. Asperosaponin Ⅵ, a saponin component from Dipsacus asper wall, induces osteoblast differentiation through bone morphogenetic protein-2/p38 and extracellular signal-regulated kinase 1/2 pathway[J]. Phytother Res, 2011, 25: 1700-1706. DOI:10.1002/ptr.3414 |
| [3] |
Li C, Zhang X, Lu Y, et al. Hepatoprotective effect of akebia saponin D on the acute liver injury induced by CCl 4 in mice[J]. West China J Pharm Sci (华西药学杂志), 2012, 27: 257-259. |
| [4] |
Li C, Tian J, Li G, et al. Asperosaponin Ⅵ protects cardiac myocytes from hypoxia-induced apoptosis via activation of the PI3K/Akt and CREB pathways[J]. Eur J Pharmacol, 2010, 649: 100-107. DOI:10.1016/j.ejphar.2010.08.060 |
| [5] |
Wang X, Chen DJ, Wang YQ, et al. De novo transcriptome assembly and the putative biosynthetic pathway of steroidal sapogenins of Dioscorea composita[J]. PLoS One, 2015, 10: e0124560. DOI:10.1371/journal.pone.0124560 |
| [6] |
Zhang Y, Zhou ZY, Xia PG, et al. Expression of key enzyme genes and content of saikosaponin in saikosaponin biosynthesis under drought stress in Bupleurum chinense[J]. China J Chin Mater Med (中国中药杂志), 2016, 41: 643-647. |
| [7] |
Jiang M, Jia L, Quan X, et al. Different chilling stresses stimulated the accumulation of different types of ginsenosides in Panax ginseng cells[J]. Acta Physiol Plant, 2016, 38: 1-8. DOI:10.1007/s11738-015-2023-4 |
| [8] |
Jiang WK, Ai Q, Zhou T, et al. Analysis on geographical distribution trend of asperosaponin Ⅵ content in Dipsacus asper in Guizhou province[J]. Guizhou Agric Sci (贵州农业科学), 2013, 41: 19-22. |
| [9] |
Xiao CH, Zhou T, Jiang WK, et al. Phenotypic diversity and characteristic analysis of cultivated Dipsacus asper from Guizhou province[J]. Mol Plant Breeding (分子植物育种), 2018, 16: 6509-6516. |
| [10] |
Hu ZP, Xu J, Zhou T, et al. Methyl jasmonate stimulates the synthesis and accumulation of asperosaponin Ⅵ in the roots of Dipsacus asper[J]. Acta Pharm Sin (药学学报), 2021, 56: 2302-2307. |
| [11] |
Fang Y, You J, Xie K, et al. Systematic sequence analysis and identification of tissue-specific or stress-responsive genes of NAC transcription factor family in rice[J]. Mol Gen Genom, 2008, 280: 547-563. DOI:10.1007/s00438-008-0386-6 |
| [12] |
Yoshimi N, Masatoshi Y, Hitoshi E, et al. NAC-MYB-based transcriptional regulation of secondary cell wall biosynthesis in land plants[J]. Front Plant Sci, 2015, 6: 288. |
| [13] |
Hu H, Dai M, Yao J, et al. Overexpressing a NAM, ATAF, and CUC (NAC) transcription factor enhances drought resistance and salt tolerance in rice[J]. Proc Natl Acad Sci U S A, 2006, 103: 12987-12992. DOI:10.1073/pnas.0604882103 |
| [14] |
Diao P, Chen C, Zhang Y, et al. The role of NAC transcription factor in plant cold response[J]. Plant Signal Behav, 2020, 15: 1785668. DOI:10.1080/15592324.2020.1785668 |
| [15] |
Liang Q, Xu J, Xiao CH, et al. Cloning and expression stability analysis of actin, tublin and GAPDH genes in Dipsacus asper[J]. Chin Tradit Herb Drugs (中草药), 2020, 51: 5571-5578. |
| [16] |
Wang JY, Liang YL, Hai MR, et al. Genome-wide transcriptional excavation of Dipsacus asperoides unmasked both cryptic asperosaponin biosynthetic genes and SSR markers[J]. Front Plant Sci, 2016, 7: 339. |
| [17] |
Bu Q, Jiang H, Li CB, et al. Role of the Arabidopsis thaliana NAC transcription factors ANAC019 and ANAC055 in regulating jasmonic acid-signaled defense responses[J]. Cell Res, 2009, 18: 756-767. |
| [18] |
Xie T, Wang S, Zhang SS, et al. Effects of low temperature stress on secondary metabolites of Arnebia euchroma suspension cells[J]. Chin Tradit Herb Drugs (中草药), 2015, 46: 1525-1532. |
| [19] |
Hua B, Chang J, Wu ML, et al. Mediation of JA signalling in glandular trichomes by the woolly/SlMYC1 regulatory module improves pest resistance in tomato[J]. Plant Biotechnol J, 2021, 19: 375-393. DOI:10.1111/pbi.13473 |
| [20] |
Feng W, Xu J, Guo J, et al. Effect of low temperature stress on the accumulatim of asperosaponin Ⅵ of Dipsacus asper[J]. J Chin Med Mater (中药材), 2021, 44: 1079-1083. |
 2021, Vol. 56
2021, Vol. 56


