2. 南京中医药大学整合医学学院, 江苏 南京 210023;
3. 南京中医药大学, 江苏省中医药防治肿瘤协同创新中心, 江苏 南京 210023
2. School of Medicine & Holistic Integrative Medicine, Nanjing University of Chinese Medicine, Nanjing 210023, China;
3. Jiangsu Collaborative Innovation Center of Traditional Chinese Medicine Prevention and Treatment of Tumor, Nanjing University of Chinese Medicine, Nanjing 210023, China
2020年全球癌症统计报告表明, 乳腺癌已经超越肺癌成为发病率最高的癌症类型[1]。在40~50岁女性中, 超过1/4的女性在乳腺中存在原位良性结节[2]。而在此年龄区间内, 只有不足1%的女性被诊断患有乳腺癌[3]。此数据对比可知并非所有原位乳腺肿瘤都会发展为癌症, 发现乳腺癌恶性转变的病理机制及有效干预药物将有助于女性公共健康问题的解决。
丹参为唇形科鼠尾草属植物的干燥根部, 具有活血化瘀功效, 在活血化瘀成药的配伍使用中应用频率极高。丹参酮为丹参根部的乙醚或乙醇提取物, 丹参酮ⅡA (tanshinone IIA, TanIIA) 是丹参脂溶性有效成分的代表之一[4]。TanIIA目前在缺血性疾病的临床治疗中已有应用, 具有抗冠状动脉扩张、抗氧化和抗炎的治疗作用[5, 6]。此外, 有研究表明TanIIA具有抗肿瘤作用[7]。然而, 现有TanIIA的抗肿瘤药理研究实验数据均基于已经癌变的人源肿瘤细胞体外培养模型或肿瘤细胞异位种植小鼠体内模型得到, 针对TanIIA对良性肿瘤的化学预防作用尚未见报道。本研究利用自发乳腺癌转基因小鼠模型, 在乳腺上皮细胞尚未发生癌变前通过长时程不同剂量给药, 观察TanIIA在乳腺癌发生、发展过程中的作用, 评价其对乳腺癌的化学预防作用。本研究将为丹参防治乳腺癌的药理作用提供实验数据, 丰富中药丹参抗肿瘤的研究内容。
材料与方法实验动物 8周龄C57BL/6雌或雄性小鼠[北京维通利华实验动物技术有限公司, 动物许可证号SCXK (京) 2016-00060]; 8周龄FVB背景MMTV-PyMT (mouse mammary tumor virus-polyomavirus middle T antigen)转基因雄性小鼠(南京大学模式动物研究所)。将FVB雄性小鼠与C57BL/6雌性小鼠交配, 子代雄性MMTV-PyMT阳性小鼠再与C57BL/6回交6代以上, 获得C57BL/6背景的雌性MMTV-PyMT阳性小鼠用于药效评价。动物福利和实验过程均遵循南京中医药大学动物伦理委员会的规定(批准号: 202105A022)。
试剂和材料 TanIIA [568-72-9; 经高效液相色谱(high performance liquid chromatography, HPLC) 测定纯度≥ 98%]、羟甲基纤维素钠(简称CMCNa, 20160714) (上海源叶生物科技有限公司); 葡聚糖(D1822)、SyberSafe (S33102) (赛默飞世尔科技公司); 层黏连蛋白β1亚基(laminin subunit beta 1, LAMB1) 抗体(A9827, Abclonal公司); 增殖细胞核抗原(proliferating nuclear antigen, PCNA) 抗体(AF0239)、上皮细胞钙黏附蛋白(E-cadherin) 抗体(AF0131) (Affinity公司); 原癌基因c-Myc抗体(sc-40, Santa Cruz Biotechnology公司); 橄榄油(O108686, 阿拉丁公司); PCR (polymerase chain reaction) 引物(上海生物工程股份有限公司); 琼脂糖(111760, 上海鼓臣生物有限公司); 100 bp DNA marker (北京全式金生物技术有限公司); Tris (20160601, 国药集团化学试剂有限公司); Taq DNA聚合酶(p102-d1-AD, 南京诺唯赞生物科技有限公司); 胶原酶I (C0130, Sigma公司); 细胞周期与细胞凋亡检测试剂盒(C1052)、BeyoClickTM EdU-555细胞增殖检测试剂盒(C0075S) (上海碧云天生物技术有限公司)。
基因型鉴定 鼠尾DNA提取方法如下: 剪取小鼠尾尖5 mm, 放入1.5 mL的离心管中, 加入200 μL碱性裂解缓冲液, 将其置于恒温仪上, 95 ℃消化1 h, 向每管加入200 μL中和缓冲液混匀。以提取的DNA为模板, 通过PCR和琼脂糖凝胶电泳对小鼠进行基因型鉴定。阳性鼠基因组中特异性序列的PCR扩增引物序列为: 5'-GGAAGCAAGTACTTCACAAGGG-3' (正向); 5'-GG AAAGTCACTAGGAGCAGGG-3' (反向)。
分组及给药 将7~8周龄PyMT阳性雌鼠随机分为3组, 每组6只。根据TanIIA磺酸钠临床用量40~80 mg, 计算得到小鼠给药剂量为32.76~65.53 g·kg-1 [按如下公式进行换算: (40~80)/60 kg ×人与小鼠体表面积换算系数9.1 ×静脉注射与口服换算系数4 × (丹参酮IIA磺酸钠分子质量397.40 / 丹参酮IIA分子质量294.34)]。
按30 mg·kg-1·day-1 (低剂量组)、60 mg·kg-1·day-1 (高剂量组) 灌胃给药, 并设置橄榄油溶剂对照组, 隔日记录体重。给药5周后, 收集小鼠的肺、胸部乳腺及腹股沟乳腺, 固定、石蜡包埋并切片后进行苏木素-伊红(hematoxylin and eosin, HE) 染色, 在PerkinElmer多模式组织切片成像系统下观察组织病理变化。
免疫组织化学染色 组织浸入4%多聚甲醛溶液中固定、脱水、石蜡包埋、切片、脱蜡, 将切片浸入0.01 mol·L-1柠檬酸盐缓冲液(pH 6.0), 微波炉加热修复抗原; 磷酸缓冲盐溶液(phosphate buffered saline, PBS) 缓冲液清洗并用含3%牛血清白蛋白(bovine serum albumin, BSA) 的PBS溶液封闭, 滴加一抗, 4 ℃过夜; PBS清洗, 滴加二抗, 室温孵育1.5 h; 二氨基联苯胺(3, 3'-diaminobenzidine, DAB) 室温显色; 蒸馏水洗涤; 苏木素复染、脱水、透明、封片; 最后使用PerkinElmer多模式组织切片成像系统镜检并采集图像。使用ImageJ中的IHC Toolbox插件对图片进行定量分析。
免疫荧光化学染色 石蜡切片脱蜡复水, 柠檬酸钠抗原修复, 一抗孵育, 4 ℃过夜, PBS冲洗, 滴加FITC (fluorescein isothiocyanate) 荧光二抗, 避光室温孵育1 h。使用含有DAPI (4', 6-diamidino-2-phenylindole) 的抗荧光衰减封片剂避光封片, ZEISS活细胞成像分析系统拍照。
血管体内荧光标记实验 在收集动物组织前5~7 min, 将荧光素标记的葡聚糖按照21 μg·g-1剂量尾静脉注射入小鼠体内。收集组织后固定、石蜡包埋切片后DAPI复染, 使用ZEISS活细胞成像分析系统进行观察与拍照。详细方法可参见课题组前期文章[8]。
细胞周期分析 对照组(橄榄油, ctrl)和TanIIA低、高剂量组(30和60 mg·kg-1·day-1) 共3个组别的小鼠灌胃给药5周后, 每只小鼠各取一对右侧胸椎乳腺组织, 使用胶原酶I在37 ℃水浴消化1.5 h后, 100目筛网过滤, PBS清洗并离心, 弃上清液后加入DMEM吹匀成细胞悬液, 70%乙醇固定24 h, 碘化丙啶染色液染色, 37 ℃避光温浴30 min后, 应用CytoFLEX流式细胞仪进行细胞周期检测。使用Modfit软件处理计算细胞周期的分布, 并按以下公式计算增殖指数(proliferation index, PI): PI% = (S + G2/M) / (G0/G1 + S + G2/M) × 100%。
通过中药系统药理学数据库与分析平台(TCMSP) 数据库获得TanIIA治疗的潜在靶点, COSMIC (Catalogue of Somatic Mutations in Cancer) 数据库获得乳腺癌发展过程中突变频率最高的基因。使用Cytoscape中的Bisogene插件, 构建PPI (protein-protein interaction) 网络图。将TanIIA-乳腺癌潜在治疗靶点输入STRING网站(https://string-db.org), 获取蛋白相互作用关系。使用R包clusterProfiler、ggplot2进行GO (Gene Ontology)、KEGG (Kyoto Encyclopedia of Genes and Genomes) 富集分析及可视化。
统计学分析 应用GraphPad 8.0软件分析处理数据结果, 所有实验均独立重复3次, 数据均采用
对小鼠进行基因型鉴定结果如图 1A所示。实验期间小鼠体重稳定, 未出现不良反应(图 1B), 并且TanIIA对小鼠的毛色、活动水平等都未见显著影响。FVB背景的MMTV-PyMT小鼠的乳腺上皮细胞恶性转变的过程中会经历增生(hyperplasia, H)、腺瘤(adenocarcinoma, Ad)、早期癌(early carcinoma, EC)和晚期癌(late carcinoma, LC) 4个阶段, 每个阶段都有相应的组织学形态特征。癌前阶段包括增生与腺瘤, 此阶段乳腺细胞核质比正常, 基底膜保持完整, 其中腺瘤阶段乳腺导管被上皮细胞充满。早/晚期癌阶段, 乳腺上皮细胞突破基底膜, 癌细胞弥散分布, 细胞核变大。其中, 早期癌阶段腺泡结构尚在, 晚期癌阶段无腺泡结构[9] (图 1C)。HE染色结果显示(图 1D): 高剂量TanIIA (60 mg·kg-1·day-1) 给药组中, 乳腺细胞核质比正常, 基底膜完整, 肺部未见明显转移灶; 对照组和低剂量TanIIA (30 mg·kg-1·day-1) 给药组中, 肺部均有转移灶(图 1D箭头处; 对照组: 50%转移率; 低剂量组: 33.3%转移率)。

|
Figure 1 Tanshinone IIA (TanIIA) inhibits malignant transformation of breast cancer in MMTV-PyMT transgenic mice. A: Identification of MMTV-PyMT mice genotypes (lane 1: 100 bp DNA ladder; 2: Positive mouse of MMTV-PyMT; 3: Negative mouse of MMTV-PyMT); B: Growth curve of MMTV-PyMT mice in different groups (n = 6); C: Representative hematoxylin and eosin (HE) staining images of MMTV-PyMT at different tumor progression stages; D: Representative HE staining images of mammary glands (upper panel) and lungs (lower panel). Scale bar: 50 μm; E: The percentage of different tumor progression stages in each treatment group (n = 12). Data are presented as |
在对照组小鼠的乳腺中, 增生、腺瘤、早/晚期癌的发生率分别为0、33.3%、66.7%; 低剂量给药组中, 增生、腺瘤、早/晚期癌的发生率分别为8.3%、50%、41.7%; 高剂量给药组中, 增生、腺瘤、早/晚期癌的发生率分别为16.7%、75%、8.3%。将对照组与给药组中增生、腺瘤及早/晚期癌样本数进行费希尔精确检验, 结果表明, 腺瘤的发生率在对照组与高剂量(60 mg·kg-1·day-1) 给药组之间存在显著性差异(图 1E)。以上结果说明, TanIIA可抑制乳腺由腺瘤向早/晚期癌的恶变, 显著影响自发性乳腺癌的发展。
2 TanIIA抑制MMTV-PyMT小鼠乳腺组织PCNA、c-Myc和E-cadherin的表达基底膜标记抗体LAMB1荧光染色显示, 对照组和30 mg·kg-1·day-1给药组乳腺组织无基底膜完整形态, 60 mg·kg-1·day-1给药组的乳腺基底膜保持完整(图 2A)。为了进一步探讨TanIIA的药效, 通过免疫组化考察乳腺组织中PCNA、原癌基因c-Myc和E-钙黏蛋白(E-cadherin) 的表达(图 2B)。其中, PCNA参与DNA复制、损伤修复等多种细胞事件; c-Myc可使细胞无限增殖, 获永生化功能, 并促进细胞分裂, 在乳腺癌中常见c-Myc扩增和过表达; E-cadherin能够增强细胞之间的黏附, 从而抑制肿瘤细胞的侵袭和转移。免疫组化定量结果显示(图 2C): 在对照组和低剂量组中, PCNA和c-Myc均有较高表达量, 说明乳腺细胞存在异常增殖。与对照组和低剂量TanIIA给药组相比, 高剂量TanIIA给药组小鼠乳腺中, PCNA表达下降, c-Myc表达显著减少, 说明高剂量TanIIA抑制了乳腺细胞的异常增殖。此外, 在对照组和低剂量组中, E-cadherin表达缺失, 而高剂量给药组小鼠乳腺中, E-cadherin表达升高, 表明高剂量TanIIA抑制了乳腺上皮细胞的侵袭能力。
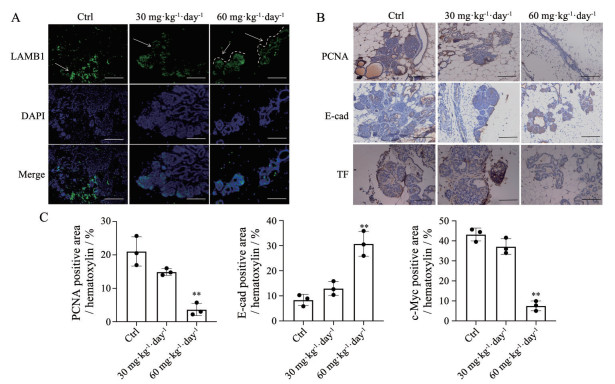
|
Figure 2 Histopathological analysis of TanIIA on breast cancer-related proteins in mammary glands. A: Representative images of laminin subunit beta 1 (LAMB1) staining of mammary gland of MMTV-PyMT transgenic mice. Arrows indicate basement membrane; B: Representative images of immunohistochemistry (IHC) staining of proliferating nuclear antigen (PCNA), E-cadherin (E-cad), and c-Myc in the mammary gland of MMTV-PyMT transgenic mice. Scale bar: 100 μm; C: Quantitative analysis of IHC in B. n = 3, |
血管生成是肿瘤发展过程中的一个重要特征。通过荧光素偶联的葡聚糖体内标记血管, 石蜡切片荧光显微镜观察拍照, ImageJ定量分析。实验结果表明, 与对照组相比, 低剂量(30 mg·kg-1·day-1) 给药对血管生成无显著影响, 而高剂量(60 mg·kg-1·day-1) 给药可显著抑制PyMT小鼠乳腺组织中的血管生成(P < 0.01) (图 3)。

|
Figure 3 TanIIA inhibits angiogenesis. A: Representative images of Texas red conjugated-dextran staining of blood vessel in the mammary gland of MMTV-PyMT transgenic mice. Scale bar: 200 μm; B: Vessel density quantification as the ratio of Texas red dextran intensity/DAPI nuclear counterstaining (vessel/nuclei) in mammary glands. n = 3, |
恶性的肿瘤细胞存在失控的增殖、异常的凋亡和紊乱的细胞周期等特征。本研究通过流式细胞术检测了3个实验组别的PyMT小鼠乳腺组织中提取的原代细胞的周期变化(图 4)。结果显示, 与对照组相比, 高剂量(60 mg·kg-1·day-1) TanIIA给药组G0/G1期细胞占比显著增多(P < 0.05), 增殖指数显著降低(P < 0.05), 说明高剂量给药组中的乳腺细胞周期被阻滞于G0/G1期。这种阻滞作用在低剂量(30 mg·kg-1·day-1) 组中并不明显。这些结果提示, 在PyMT小鼠中, TanIIA亦可通过干扰细胞有丝分裂发挥抗肿瘤作用。

|
Figure 4 TanIIA arrests cell cycle in G0/G1 phase in PyMT primary mammary cells. A: Representative cell cycle histogram results for PyMT primary mammary cells; B: Quantification of results of A; C: The proliferation index of primary mammary cells in A. n = 6, |
为进一步明确TanIIA预防乳腺癌发生的作用靶点, 通过TCMSP数据库获得了TanIIA 41个潜在靶点, 并从COSMIC数据库筛选出在乳腺癌发展过程中突变频率最高的20个基因, 结合Cytoscape中的Bisogene插件对其进行PPI网络构建, 根据degree、betweenness、closeness值筛选出68个显著相关的基因(图 5A)。随后, 使用Cytoscape中的Bisogene插件对TanIIA潜在的41个治疗靶点和乳腺癌突变相关的68个基因分别进行PPI网络构造, 合并后筛选出TanIIA治疗乳腺癌的潜在的39个作用靶点(图 5B), 并用String数据库绘制核心靶点的PPI网络(图 5C)。

|
Figure 5 Identification of the TanIIA and its mechanism on breast cancer based on network pharmacology. A: Hub nodes from breast cancer protein-protein interaction (PPI) network; B: TanIIA-targeted PPI network; C: PPI network of core protein; D: Gene Ontology (GO) map of putative core target genes; E: Kyoto Encyclopedia of Genes and Genomes (KEGG) pathway analysis of core target genes |
通过GO富集分析, 发现富集结果主要涉及蛋白修饰、DNA代谢调节和细胞周期调控等(图 5D)。KEGG通路分析结果表明, TanIIA可能通过作用于泛素介导的蛋白质降解、PI3K-AKT和细胞周期等信号通路达到治疗效果(图 5E)。
讨论本研究利用自发性乳腺癌小鼠MMTV-PyMT小鼠模型, 通过预防给药, 探讨TanIIA对于乳腺癌恶性转变的作用和机制。该模型小鼠是利用转基因技术在乳腺上皮细胞特异性表达MMTV-PyMT融合基因, 可快速形成原位乳腺癌并继而发展转移到肺部, 并在发生、发展过程中都伴随着炎性细胞的浸润及血管形成, 具有较好的乳腺癌发生发展病理特征和完整的免疫系统, 广泛用于乳腺癌发生、发展的病理机制研究与抗肿瘤药物药效评价[8-12]。由于不同品系背景的小鼠对肿瘤发展进程具有一定的影响, 本实验采用多次回交技术将FVB背景转为较为稳定的C57BL/6背景。
癌症化学预防被定义为使用天然或合成药物来逆转、抑制或阻止致癌(初级预防) 和/或恶性表型向侵袭性癌症(次级预防) 的进展[13]。数项临床试验结果表明雌激素受体调节剂如他莫昔芬、雷洛昔芬可显著降低乳腺癌高风险女性的癌症患病率, 抑制率接近50%[14]。而临床试验结果也显示长期使用此类合成药物会提高受试者血栓及患子宫内膜癌的风险[15]。药食同源天然产物中含有大量萜类、类胡萝卜素、黄酮类、酚类和其他化合物, 在癌症化学预防上展现出前景[16], 包括白藜芦醇[17]、姜黄素[18]、姜辣素[19]等。
研究表明TanIIA有抗肿瘤作用, 可通过线粒体依赖途径诱导多种人类癌细胞凋亡, 如可在体内、外通过PI3K/AKT/JNK信号通路引起人卵巢癌细胞凋亡, 对其生长和侵袭力有明显抑制作用[20]; 对人膀胱癌细胞具有细胞毒和诱导凋亡作用, 通过激活caspase-9和caspase-3进而诱导人膀胱癌细胞发生细胞凋亡[21]; 减少大肠癌促血管生成因子的分泌并抑制血管生成[22]; 通过下调FOXM1抑制胃癌细胞增殖和迁移[23]; 减少AKT-c-Myc信号介导的有氧糖酵解, 抑制口腔鳞状细胞癌代谢[24]; 激活JNK-MFF信号通路, 促进线粒体分裂, 降低SW837大肠癌细胞存活率[25]。Lv等[26]发现TanIIA (30 mg·kg-1, 5次/周, 连续2周) 给药可显著抑制人源乳腺癌细胞系MCF-7移植小鼠的肿瘤重量与体积, 其作用机制是协同Hsp90抑制剂、干扰MCF-7细胞有丝分裂过程中着丝粒蛋白的组装。本研究中, 30 mg·kg-1·day-1的TanIIA作用并不显著, 这应与两项研究所用动物品系不同有关, 且给药方式的不同对药物在体内的代谢动力学也会造成差异。本研究结果显示, 60 mg·kg-1·day-1的丹参酮可抑制乳腺由腺瘤向早期癌的恶变, 显著影响自发性乳腺癌的发展。该剂量下, 乳腺组织中PCNA和c-Myc的表达降低, E-cadherin的表达增多提示TanIIA的化学预防作用除了细胞周期阻滞外, 还包括抑制癌细胞的增殖、增强肿瘤之间的黏附, 从而抑制肿瘤细胞的侵袭和转移等。
尽管体内外实验数据表明TanIIA的药理作用明显, 但由于其水溶性差、生物利用度低等特点, 其应用受到限制。结合纳米技术、使用高效给药递送系统可提高药效、拓展新的临床应用[27]。综上所述, 本研究发现在自发乳腺癌小鼠模型中, TanIIA可抑制乳腺癌变发展, 抑制血管生成, 阻滞细胞周期, 将为TanIIA对乳腺癌的化学预防作用提供实验依据。
作者贡献: 王圆、孙烨、许俊德、吴一创、万朋、邓蕊、郑秀芹和吴媛媛主要负责实验操作; 王圆主要负责网络药理学内容和数据分析; 王圆、李晓风和吴媛媛完成文章初稿; 李晓曼和赵杨参与文章讨论; 吴媛媛和陆茵主要负责实验指导、文章修改和投稿。
利益冲突: 所有作者均声明无利益冲突。
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71: 209-249. DOI:10.3322/caac.21660 |
| [2] |
El-Wakeel H, Umpleby H. Systematic review of fibroadenoma as a risk factor for breast cancer[J]. Breast, 2003, 12: 302-307. DOI:10.1016/S0960-9776(03)00123-1 |
| [3] |
Ban KA, Godellas CV. Epidemiology of breast cancer[J]. Surg Oncol Clin N Am, 2014, 23: 409-422. DOI:10.1016/j.soc.2014.03.011 |
| [4] |
Zhao S, Zhang J, Yang L, et al. Determination and biosynthesis of multiple salvianolic acids in hairy roots of Salvia miltiorrhiza[J]. Acta Pharm Sin (药学学报), 2011, 46: 1352-1356. |
| [5] |
Shang Q, Xu H, Huang L. Tanshinone IIA: a promising natural cardioprotective agent[J]. Evid Based Complement Alternat Med, 2012, 2012: 716459. |
| [6] |
Ning J, He CL, Huang JJ. Anti-inflammatory effect of tanshinone IIA in vitro and in vivo[J]. Drugs Clin (现代药物与临床), 2019, 34: 292-298. |
| [7] |
Gong Y, Li Y, Lu Y, et al. Bioactive tanshinones in Salvia miltiorrhiza inhibit the growth of prostate cancer cells in vitro and in mice[J]. Int J Cancer, 2011, 129: 1042-1052. DOI:10.1002/ijc.25678 |
| [8] |
Wu YY, Nguyen AV, Wu XX, et al. Antiphospholipid antibodies promote tissue factor-dependent angiogenic switch and tumor progression[J]. Am J Pathol, 2014, 184: 3359-3375. DOI:10.1016/j.ajpath.2014.07.027 |
| [9] |
Lin EY, Jones JG, Li P, et al. Progression to malignancy in the polyoma middle T oncoprotein mouse breast cancer model provides a reliable model for human diseases[J]. Am J Pathol, 2003, 163: 2113-2126. DOI:10.1016/S0002-9440(10)63568-7 |
| [10] |
Yeo EJ, Cassetta L, Qian BZ, et al. Myeloid wnt7b mediates the angiogenic switch and metastasis in breast cancer[J]. Cancer Res, 2014, 74: 2962-2973. DOI:10.1158/0008-5472.CAN-13-2421 |
| [11] |
Lin EY, Pollard JW. Tumor-associated macrophages press the angiogenic switch in breast cancer[J]. Cancer Res, 2007, 67: 5064-5066. DOI:10.1158/0008-5472.CAN-07-0912 |
| [12] |
Wang C, Schwab LP, Fan M, et al. Chemoprevention activity of dipyridamole in the MMTV-PyMT transgenic mouse model of breast cancer[J]. Cancer Prev Res (Phila), 2013, 6: 437-447. DOI:10.1158/1940-6207.CAPR-12-0345 |
| [13] |
Landis-Piwowar KR, Iyer NR. Cancer chemoprevention: current state of the art[J]. Cancer Growth Metastasis, 2014, 7: 19-25. |
| [14] |
Korfage IJ, Fuhrel-Forbis A, Ubel PA, et al. Informed choice about breast cancer prevention: randomized controlled trial of an online decision aid intervention[J]. Breast Cancer Res, 2013, 15: R74. DOI:10.1186/bcr3468 |
| [15] |
Iqbal J, Ginsburg OM, Wijeratne TD, et al. Endometrial cancer and venous thromboembolism in women under age 50 who take tamoxifen for prevention of breast cancer: a systematic review[J]. Cancer Treat Rev, 2012, 38: 318-328. DOI:10.1016/j.ctrv.2011.06.009 |
| [16] |
Rabi T, Bishayee A. Terpenoids and breast cancer chemoprevention[J]. Breast Cancer Res Treat, 2009, 115: 223-239. DOI:10.1007/s10549-008-0118-y |
| [17] |
Sinha D, Sarkar N, Biswas J, et al. Resveratrol for breast cancer prevention and therapy: preclinical evidence and molecular mechanisms[J]. Semin Cancer Biol, 2016, 40: 209-232. |
| [18] |
Wang K, Zhang C, Bao J, et al. Synergistic chemopreventive effects of curcumin and berberine on human breast cancer cells through induction of apoptosis and autophagic cell death[J]. Sci Rep, 2016, 6: 26064. DOI:10.1038/srep26064 |
| [19] |
Choudhari AS, Mandave PC, Deshpande M, et al. Phytochemicals in cancer treatment: from preclinical studies to clinical practice[J]. Front Pharmacol, 2020, 10: 1614. DOI:10.3389/fphar.2019.01614 |
| [20] |
Zhang X, Zhou Y, Gu YE. Tanshinone IIA induces apoptosis of ovarian cancer cells in vitro and in vivo through attenuation of PI3K/AKT/JNK signaling pathways[J]. Oncol Lett, 2019, 17: 1896-1902. |
| [21] |
Chiu SC, Huang SY, Chang SF, et al. Potential therapeutic roles of tanshinone IIA in human bladder cancer cells[J]. Int J Mol Sci, 2014, 15: 15622-15637. DOI:10.3390/ijms150915622 |
| [22] |
Zhou L, Sui H, Wang T, et al. Tanshinone IIA reduces secretion of pro‑angiogenic factors and inhibits angiogenesis in human colorectal cancer[J]. Oncol Rep, 2020, 43: 1159-1168. |
| [23] |
Yu J, Wang X, Li Y, et al. Tanshinone IIA suppresses gastric cancer cell proliferation and migration by downregulation of FOXM1[J]. Oncol Rep, 2017, 37: 1394-1400. DOI:10.3892/or.2017.5408 |
| [24] |
Li M, Gao F, Zhao Q, et al. Tanshinone IIA inhibits oral squamous cell carcinoma via reducing Akt-c-Myc signaling-mediated aerobic glycolysis[J]. Cell Death Dis, 2020, 11: 381. DOI:10.1038/s41419-020-2579-9 |
| [25] |
Jieensinue S, Zhu H, Li G, et al. Tanshinone IIA reduces SW837 colorectal cancer cell viability via the promotion of mitochondrial fission by activating JNK-Mff signaling pathways[J]. BMC Cell Biol, 2018, 19: 21. DOI:10.1186/s12860-018-0174-z |
| [26] |
Lv C, Zeng HW, Wang JX, et al. The antitumor natural product tanshinone IIA inhibits protein kinase C and acts synergistically with 17-AAG[J]. Cell Death Dis, 2018, 9: 165-177. DOI:10.1038/s41419-017-0247-5 |
| [27] |
Waters ES, Kaiser EE, Yang X, et al. Intracisternal administration of tanshinone IIA-loaded nanoparticles leads to reduced tissue injury and functional deficits in a porcine model of ischemic stroke[J]. IBRO Neurosci Rep, 2021, 10: 18-30. DOI:10.1016/j.ibneur.2020.11.003 |
 2021, Vol. 56
2021, Vol. 56


