2. 江苏省中药高效给药系统工程技术研究中心, 江苏 南京 210023
2. Jiangsu Provincial TCM Engineering Technology Research Center of High Efficient Drug Delivery System, Nanjing 210023, China
脑胶质瘤是成人最常见的原发性脑瘤, 占所有原发性脑瘤的51.4%[1]。恶性脑胶质瘤具有快速浸润性生长、增殖迅速以及容易复发等特点, 临床治疗效果不佳, 复发率高, 病死率极高, 5年存活期仅为5%[2]。脑胶质瘤作为临床高死亡率、预后差、难治愈的肿瘤之一, 引发广大研究者开始寻找有效治疗脑胶质瘤的药物和方法。
肿瘤在中医病证中通常归属于“症瘕积聚”范畴, 血瘀证贯穿肿瘤发生、发展的始终[3]。因此, 活血化瘀是肿瘤的一种重要治法。丹参(Salviae Miltiorrhizae Radix et Rhizoma) 是临床常用的活血化瘀代表药, 在临床治疗肿瘤中, 常与其他中药配伍应用。已有研究表明, 丹参中的水溶性活性成分丹参多酚酸盐[4]、丹酚酸B[5]等, 以及脂溶性活性成分隐丹参酮[6]、丹参酮Ⅰ[7]、丹参酮ⅡA[8]、二氢丹参酮Ⅰ[9]均对脑胶质瘤细胞有直接杀伤作用, 显示出一定的抗脑胶质瘤活性, 有望成为脑胶质瘤的治疗药物。其中, 隐丹参酮(cryptotanshinone, CPT) 作为丹参的主要代表成分之一, 溶解度极低、口服生物利用度低等性质限制了其临床使用[10]。CPT能够透过血脑屏障(blood-brain barrier, BBB), 且显示出抑制脑胶质瘤C6、U251、T98G、U87细胞的增殖、侵袭和迁移作用[6, 11]。CPT对脑胶质瘤的抑制作用可能与抑制STAT3信号通路的激活有关, STAT3信号通路在脑胶质瘤细胞中呈持续激活状态[12]。实验研究表明, 灌胃给予80 mg·kg-1 CPT对原位U87脑胶质瘤裸鼠模型脑胶质瘤的发生发展具有抑制作用, 其作用机制可能与CPT上调蛋白酪氨酸磷酸酶SHP-2的活性、抑制STAT3信号通路的激活有关[13]。此外, 亦有研究表明, 抑制STAT3信号通路可以延长荷GL261胶质瘤小鼠中位生存期[14]。但由于脑部转运蛋白等作用, 限制了CPT的脑部渗透[15], 限制了其抗脑胶质瘤的活性。
因此, 本文设计靶向脂质体, 通过高效包载中药有效成分, 并在其表面修饰具有主动靶向脑胶质瘤的多肽, 有望解决CPT溶解性差、生物利用度低的问题[16], 且能够有效增加CPT瘤内蓄积[17]。tLyp-1肽氨基酸序列为Cys-Gly-Asn-Lys-Arg-Thr-Arg (CGNKRTR), 可与肿瘤新生血管和肿瘤细胞膜上高度表达的神经毡蛋白受体(neuropilin receptors, NRP) 高效结合, 产生跨膜血管渗透和肿瘤穿膜作用, 具有高BBB穿透性及肿瘤靶向性[18]; 同时脂质体的类脂质双分子层结构和纳米级别粒径使得活性成分能够顺利到达病灶部位发挥作用, 提高药物的生物利用度。构建修饰靶向肽tLyp-1的CPT脂质体—tLipo/CPT (tLyp-1 modified liposomes loaded with CPT), 对其制剂学进行表征; 利用靶向脂质体负载CPT透过BBB, 主动靶向脑胶质瘤, 最大程度地使得CPT在病灶部位积聚, 并对其体外抗脑胶质瘤作用进行考察。
材料与方法药品与试剂 CPT [纯度HPLC (high performance liquid chromatography) > 97%, 南京金益柏公司]; tLyp-1肽(序列CGNKRTR, 国平药业合成); 二肉豆蔻酰磷脂酰胆碱(DMPC)、DSPE-PEG2000-MAL (西安瑞禧公司); 香豆素6 (coumarin 6, C6)、三(2-羧乙基) 膦盐酸盐(TCEP·HCl) (翼飞雪公司); 荧光染料DiI、DiR (苏州宇恒生物科技有限公司)。
细胞株 小鼠脑胶质瘤GL261细胞、小鼠脑微血管内皮bEnd.3细胞(中国科学院细胞库)。
动物 BALB/c小鼠, SPF级, 18~20 g, 雄性(合格证号: 410983211100112883)。动物实验符合伦理学标准, 并得到南京中医药大学伦理委员会的批准。
DSPE-PEG2000-tLyp-1的制备 称取2 μmol DSPE- PEG2000-MAL、4 μmol tLyp-1和40 μmol TCEP·HCl至50 mL平底烧瓶中, 加入3 mL磷酸盐缓冲液(PBS, pH 6.5) 溶解后, 氮气保护, 室温搅拌48 h。48 h后, 将反应液吸出, 转至3 000 Da分子质量的透析袋中, 于足量超纯水中进行透析, 透析24 h后将溶液进行真空冷冻干燥, 即得DSPE-PEG2000-tLyp-1粉末。
tLipo/CPT的制备 称取适量DMPC、DSPE-PEG2000-tLyp-1、CPT溶解于氯仿中, 作为有机相, 将有机相逐滴加入水相(PBS) 中, 边滴加边搅拌, 滴加完毕, 搅拌30 min, 旋转蒸发抽去有机溶剂, 转至西林瓶中, 195 W, 冰水浴上进行超声破碎, 超声破碎1 s, 间歇2 s, 超声破碎一定时间, 过0.8 μm孔径滤膜, 除去游离的CPT, 即得tLipo/CPT。进一步以粒径、多分散系数(polymer dispersity index, PDI) 和包封率(encapsulation efficiency, EE, %) 为考察指标, 对DMPC与CPT的比例(mDMPC∶mCPT)、有机相与水相的体积比(Voragnic phase∶Vwater phase)、超声破碎的总时间(time/min) 以及DSPE-PEG2000-tLyp-1与磷脂DMPC的摩尔比进行优化考察, 得到最佳工艺制备的tLipo/CPT。
粒径检测 制备所得tLipo/CPT用PBS作适当稀释后, 混匀加入比色皿中, 利用马尔文纳米颗粒技术仪(Zetasizer Nano ZS90, Malvern) 测定粒径、PDI和zeta电位。
形态观察 采用负染色法, 置于透射电镜(transmission electron microscope, TEM) 下观察tLipo/CPT的形态。
EE的测定 采用高效液相色谱法(HPLC) 测定CPT的EE, 其计算方法如公式(1)。色谱方法: 色谱柱为Thermo BDS HYPERSIL C18 (4.6 mm × 250 mm); 流动相为乙腈(A)-0.02%磷酸溶液(B); 柱温为35 ℃; 检测波长270 nm; 进行梯度洗脱: 0~6 min, 61% A~61% A; 6~20 min, 61% A~90% A; 20~20.5 min, 90% A~61% A; 20.5~25 min, 61% A~61% A; 流速: 1 mL·min-1; 运行时间25 min。
| $ \mathrm{E}\mathrm{E}/\mathrm{\%}=\frac{\mathrm{C}\mathrm{P}\mathrm{T}\mathrm{的}\mathrm{包}\mathrm{载}\mathrm{质}\mathrm{量}}{\mathrm{C}\mathrm{P}\mathrm{T}\mathrm{的}\mathrm{投}\mathrm{入}\mathrm{量}}\times 100\mathrm{\%} $ | (1) |
稳定性考察 将最终制备所得的tLipo/CPT避光保存于4 ℃冰箱中, 每隔1天测定其粒径和PDI, 连续测定7天。
泄漏率考察 取新鲜制备的tLipo/CPT, 按照“EE的测定”项下色谱方法测定CPT含量, 计算贮存前tLipo/CPT包封的CPT的量, 将tLipo/CPT避光保存于4 ℃下, 7天后取出测定其CPT含量, 计算贮存7天后泄漏到介质中CPT的量, 计算泄漏率, 如公式(2)。
| $ \mathrm{泄}\mathrm{漏}\mathrm{率}/\mathrm{\%}=\frac{\mathrm{贮}\mathrm{存}\mathrm{后}\mathrm{泄}\mathrm{漏}\mathrm{到}\mathrm{介}\mathrm{质}\mathrm{中}\mathrm{的}\mathrm{药}\mathrm{量}}{\mathrm{贮}\mathrm{存}\mathrm{前}\mathrm{包}\mathrm{封}\mathrm{的}\mathrm{药}\mathrm{量}}\times 100\mathrm{\%} $ | (2) |
tLipo/CPT中CPT的体外释放考察 取制备所得的tLipo/CPT, 置于8 000 Da分子质量的透析袋中, 放入足量的pH 7.2~7.4和pH 5.4的PBS溶液中, 室温不断振摇, 分别于0、15 min、30 min、45 min、1 h、2 h、4 h、8 h、12 h和24 h时间点吸取释放介质, 每次取样完毕, 立即补入等体积的新鲜释放介质。各时间点的样品加入甲醇破乳, 按照“EE的测定”项下色谱方法测定CPT的含量, 计算CPT的累积释放百分率Qa, 如公式(3)。
| $ {\mathrm{Q}}_{\mathrm{a}}/\mathrm{\%}=\frac{{M}_{\mathrm{n}}}{M} ×100% $ | (3) |
Mn: 不同时间点测得的释放介质中CPT的量; M: tLipo/CPT中含有CPT的总量。
tLipo/CPT对肿瘤细胞的体外增殖抑制作用 采用MTT实验研究tLipo/CPT对GL261细胞的体外增殖抑制作用, 并计算其半数抑制浓度(half maximal inhibitory concentration, IC50)。
tLipo/CPT与GL261细胞共定位及摄取定量考察 以C6替代CPT, 按照tLipo/CPT的制备方法制备得到C6标记的靶向脂质体(C6 labeled tLyp-1 modified liposomes, tLipo/C6) 和不加肽C6标记的脂质体(C6 labeded liposomes not modified with tLyp-1, Lipo/C6), 将tLipo/C6和Lipo/C6与GL261细胞共孵育4 h后, 共聚焦显微镜下观察tLipo/C6和Lipo/C6与GL261细胞的共定位情况, 并利用多功能酶标仪(TECAN Infinite 200 PRO) 对细胞内摄取的tLipo/C6和Lipo/C6荧光强度进行定量。
GL261细胞摄取tLipo/CPT的机制研究 以不同的细胞内吞抑制剂: 5 mmol·L-1盐酸氯丙嗪、10 mmol·L-1甲基-β-环糊精、5 mmol·L-1阿米洛利预先处理GL261细胞30 min后, 给予以DiI荧光染料标记的靶向脂质体(DiI labeled tLyp-1 modified liposomes, tLipo/DiI) 处理细胞4 h, 测定细胞摄取tLipo/DiI的荧光强度; 以不同浓度的游离tLyp-1肽预先处理GL261细胞30 min后, 给予tLipo/DiI处理细胞4 h, 测定细胞摄取tLipo/DiI的荧光强度。
tLipo/CPT的体外BBB穿透能力及机制考察 bEnd.3细胞(1×105个) 接种于24孔Transwell小室(Millipore公司, 孔径0.4 μm, 直径6.5 mm) 中, 隔天更换细胞培养液, 测定跨膜电阻值(transendothelial electrical resistance, TEER), 待TEER超过200 Ω·cm2, 于下室接种GL261细胞(1×105个), 培养至细胞贴壁。吸去上室细胞培养液, 给予tLipo/C6和Lipo/C6, 于12 h后测定下室GL261细胞中摄取的荧光强度。以不同的细胞内吞抑制剂: 5 mmol·L-1盐酸氯丙嗪、10 mmol·L-1甲基-β-环糊精、5 mmol·L-1阿米洛利预先处理bEnd.3细胞30 min后, 给予tLipo/DiI处理细胞4 h, 测定细胞摄取tLipo/DiI的荧光强度。
tLipo/CPT的体内BBB穿透能力考察 以近红外染料DiR替代CPT, 按照tLipo/CPT的制备方法制备得到DiR标记的靶向脂质体(DiR labeled tLyp-1 modified liposomes, tLipo/DiR) 和不加肽DiR标记的脂质体(DiR labeled liposomes not modified with tLyp-1, Lipo/DiR)。小鼠背部及脑部脱毛后, 每只小鼠尾静脉注射荧光制剂0.2 mg·kg-1, 分别于注射后0.5、1、2、4、6、8、12和24 h进行活体成像, 拍摄小鼠体内荧光分布情况(IVIS spectrum; λEx/λEm: 745 nm/800 nm)。注射后8 h后脱颈椎处死小鼠, 取出脑组织, 进行离体脑组织荧光成像拍摄。将脑组织进行冷冻切片后, 于倒置荧光显微镜下观察tLipo/DiR和Lipo/DiR在脑内的DiR荧光分布情况。
数据分析 所得数据用平均值±标准差(
采用乳化蒸发法制备得到负载CPT的靶向脂质体tLipo/CPT。以EE、粒径及PDI为指标, 对制备时处方中CPT的投入量(mDMPC∶mCPT = 15∶1、20∶1、25∶1)、有机相与水相的体积比(VOrganic phase∶VWater phase = 1∶1、1∶2、1∶4)、超声破碎总时间(time/min = 5、10、15) 进行考察。综合不同指标, 当mDMPC∶mCPT为20∶1、VOrganic phase∶VWater phase = 1∶2、超声破碎总时间为10 min时, 制备所得tLipo/CPT的EE较高的同时, 粒径及PDI较小(图 1)。
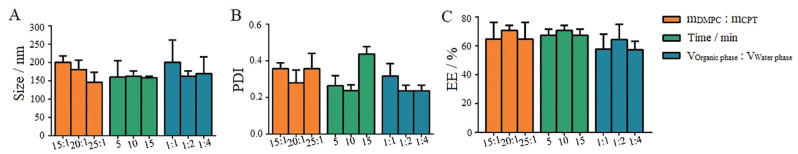
|
Figure 1 Size distribution (A), polymer dispersity index (PDI, B), and encapsulation efficiency (EE, C) of tLyp-1 modified liposomes loaded with cryptotanshinone (tLipo/CPT) in different prescriptions (n = 3, |
以巯基-马来酰亚胺迈克尔加成反应[19]为原理, 合成制备得到DSPE-PEG2000-tLyp-1 (图 2A)。向处方有机相中加入不同摩尔比的DSPE-PEG2000-tLyp-1和DMPC (0、0.5%、1%、3%), 用C6代替CPT加入处方有机相中, 按照CPT脂质体的制备方法得到修饰有不同摩尔比DSPE-PEG2000-tLyp-1的荧光脂质体Lipo/C6、0.5% tLipo/C6、1% tLipo/C6、3% tLipo/C6, 将上述不同多肽摩尔比的荧光脂质体与GL261细胞共孵育4 h后, 利用流式细胞仪检测不同组别细胞内摄取的荧光强度, 0.5% tLipo/C6组显示出最高的荧光强度(图 2B、C)。同时制备含有不同多肽摩尔比的tLipo/CPT, 并对其粒径、PDI进行了测定, 发现0.5% tLipo/CPT的粒径为(156.4 ± 7.1) nm, PDI为0.14 ± 0.05, 与载CPT脂质体组(liposomes not modified with tLyp-1 loaded with CPT, Lipo/CPT) 的粒径(156.1 ± 14.5) nm相近, 而1% tLipo/CPT和3% tLipo/CPT的粒径分别增大至(188.6 ± 16.5) nm、(192.2 ± 1.2) nm (表 1)。因此, 向处方有机相中加入0.5%的DSPE-PEG2000-tLyp-1作为最优的磷脂多肽修饰比例。最终确定tLipo/CPT的最优处方工艺为: 取DMPC、DSPE-PEG2000-tLyp-1、CPT (200∶23∶1, mol/mol/mol), 加1 mL氯仿溶解, 作为有机相, 将有机相逐滴加入2 mL水相(PBS) 中, 边滴加边搅拌, 滴加完毕, 搅拌30 min, 旋转蒸发抽去有机溶剂, 转至西林瓶中, 195 W, 冰水浴上进行超声破碎, 超声破碎1 s, 间歇2 s, 超声破碎10 min, 过0.8 μm孔径的滤膜除去游离CPT, 即得tLipo/CPT。所得最终制剂tLipo/CPT中CPT的EE为(70.06 ± 7.22) %。
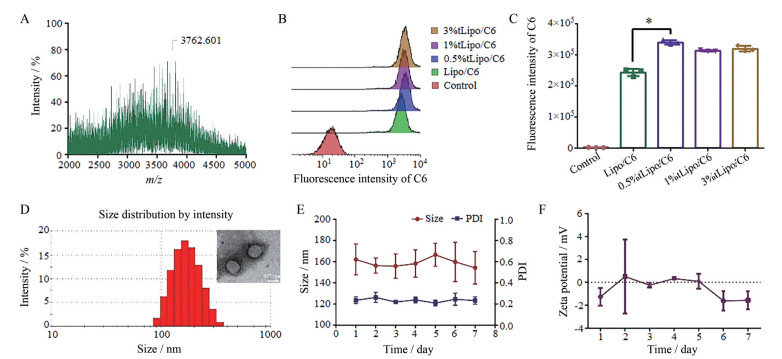
|
Figure 2 Preparation and characteristic analysis of tLipo/CPT. A: DSPE-PEG2000-tLyp-1 synthesized was analyzed by matrix-assisted laser desorption ionization time of flight mass spectrometer (MALDI-TOF MS); B: Fluorescence intensity of tLipo/C6 contain different molar ratio of DSPE-PEG2000-tLyp-1 after incubated with GL261 cells for 4 h was determined by flow cytometry; C: Quantification of intracellular fluorescence intensity of C6 after incubated with tLipo/C6 contain different molar ratio of DSPE-PEG2000-tLyp-1 (n = 3, |
|
Table 1 Size, PDI, and zeta potential of different molar ratio tLyp-1 modified Lipo/CPT detected by DLS (n = 3, |
以最优处方工艺制备得到的tLipo/CPT, 粒径大小为(162.2 ± 14.6) nm (图 2D), PDI为0.24 ± 0.03, zeta电位为(-2.3 ± 2.1) mV, TEM图显示tLipo/CPT为圆整球形(图 2D)。将新鲜制备所得tLipo/CPT贮存于4 ℃, 每天测定其粒径分布和电位, 连续测定7天, 观察其7天内4 ℃放置稳定性。结果显示, tLipo/CPT放置7天, 粒径、PDI及电位无明显变化(图 2E、F), 较为稳定。
为考察CPT在不同pH环境中从tLipo/CPT中的释放情况, 将tLipo/CPT置于分子质量8 000 Da透析袋中, 分别置于足量的pH 7.2~7.4和pH 5.4的PBS中, 测定0、15 min、30 min、45 min、1 h、2 h、4 h、8 h、12 h、24 h不同时间点CPT的Qa。结果表明(图 3), pH为7.2~7.4时, 在前2 h内, tLipo/CPT释放CPT的量为(40.0 ± 8.8) %, 12 h后释放CPT变缓, 24 h后有(89.2 ± 15.1) %的CPT从tLipo/CPT中释放出来(图 3)。而在pH 5.4下, tLipo/CPT具有快速和大量释药行为, 在2 h时, 释放出(76.0 ± 18.8) %的CPT, 在4 h后CPT的释放变缓, 且24 h后CPT的释放率达(95.9 ± 2.4) %, 这提示CPT可在进入肿瘤细胞核内体和溶酶体的酸性环境后从tLipo/CPT中快速并大量释放。将新鲜制备的tLipo/CPT贮存于4 ℃, 7天后取出, 利用HPLC测定贮存7天后泄漏到制剂介质中CPT的量, 7天后CPT的泄漏率为(24.7 ± 8.2) %, 表明tLipo/CPT在4 ℃放置下较为稳定。
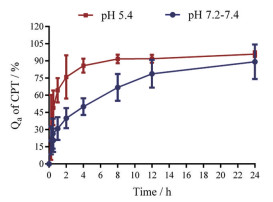
|
Figure 3 Cumulative release of CPT from tLipo/CPT in phosphate-buffered saline (PBS, pH 7.2–7.4 and pH 5.4) was detected by high performance liquid chromatography (HPLC) at different points of time (n = 3, |
为了探讨tLipo/CPT对胶质瘤GL261细胞的体外增殖抑制作用, 用tLipo/CPT处理GL261细胞后, 加入MTT检测GL261细胞的存活率。如图 4所示, tLipo/CPT组显示出较好的抗GL261细胞增殖作用, 当药物CPT浓度为7.5 μmol·L-1时, 游离CPT组(free CPT) GL261细胞存活率为(69.03 ± 4.31) %, Lipo/CPT组为(33.05 ± 3.88) %, 而tLipo/CPT组具有最低的细胞存活率, 为(26.90 ± 1.65) %。且结果显示, 不包载CPT的空白载体tLipo, 按照tLipo/CPT组同等浓度梯度配制后给予GL261细胞, 对其生长没有抑制作用, 细胞存活率为(106.53 ± 6.86) %, 表明该载体对GL261细胞生长没有毒性。此外, 与游离CPT组相比, tLipo/CPT对GL261细胞的杀伤作用较强, IC50值为5.7 μmol·L-1, 低于游离的CPT组和不加tLyp-1修饰的CPT脂质体组(表 2), 可能由于tLyp-1肽的修饰增加了GL261细胞对tLipo/CPT的摄取, 增加CPT在细胞内的蓄积, 从而产生更强的毒性。
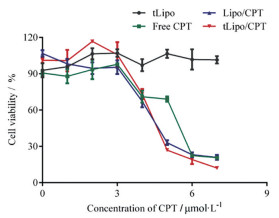
|
Figure 4 Cytotoxicity of different preparations on GL261 cells. GL261 cells were treated with free CPT, tLipo, Lipo/CPT, and tLipo/CPT for 24 h and the viability was detected by MTT (n = 4, |
| Table 2 IC50 of free CPT, Lipo/CPT, and tLipo/CPT |
作者进一步验证了tLyp-1的修饰是否赋予tLipo/CPT更强的被细胞摄取的能力。按照tLipo/CPT制备方法, 用C6代替CPT, 得到加tLyp-1肽修饰的荧光脂质体tLipo/C6和不加肽修饰的荧光脂质体Lipo/C6。将tLipo/C6和Lipo/C6与GL261细胞共孵育4 h后, 共聚焦下观察GL261细胞对tLipo/C6和Lipo/C6的摄取情况。结果显示, tLipo/C6和Lipo/C6均分布在细胞质内, 绿色荧光信号tLipo/C6组强于Lipo/C6组(图 5A)。tLipo/C6和Lipo/C6与GL261细胞共孵育4 h后, 对胞质内摄取的制剂荧光强度进行定量, 结果表明, GL261细胞对tLipo/C6的摄取量相较于Lipo/C6增加了67% (图 5B), 这表明tLyp-1肽修饰后增加了胶质瘤GL261细胞对制剂的摄取, 修饰后的脂质体具有更高效的靶向GL261细胞的能力。
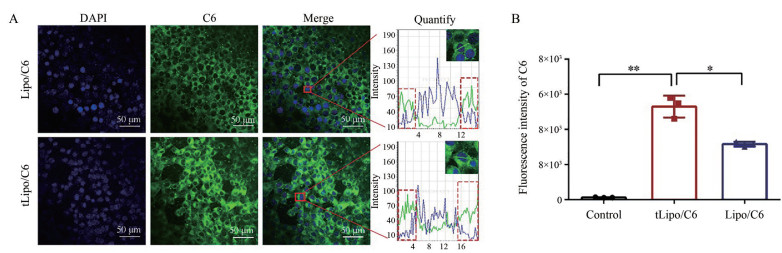
|
Figure 5 GL261 show more intake after modified with tLyp-1 on the surface of Lipo. A: Co-localization of tLipo/C6 and Lipo/C6 in GL261 cells after incubated for 4 h was observed and analyzed by Confocal Laser Scanning Microscopy (CLSM); B: The intracellular fluorescence intensity of tLipo/C6 and Lipo/C6 after incubated with GL261 for 4 h was determined (n = 3, |
已证明tLipo/CPT对GL261细胞显示出良好的体外杀伤作用, 加tLyp-1肽修饰的效果(IC50 = 5.70 μmol·L-1) 优于不加肽修饰组(IC50 = 6.20 μmol·L-1), 且加肽修饰后GL261细胞对其摄取更多(图 5)。为了阐明tLipo/CPT的细胞内化机制, 作者在GL261细胞中定量评估了不同内吞抑制剂对细胞摄取的影响。预先用5 mmol·L-1盐酸氯丙嗪(chlorpromazine) 抑制网格蛋白介导的内吞、10 mmol·L-1甲基-β-环糊精(M-β-CD) 抑制脂筏、5 mmol·L-1阿米洛利(amiloride) 抑制巨胞饮途径[20], 上述不同内吞抑制剂处理GL261细胞30 min后, 再给予tLipo/DiI与细胞共孵育4 h, 测定各组胞内的荧光强度。定量结果显示, 给予盐酸氯丙嗪处理后, GL261细胞对tLipo/DiI的摄取量降低10%, 给予甲基-β-环糊精和阿米洛利处理后, GL261对tLipo/DiI的摄取量与对照组相比没有变化(图 6A), 表明GL261细胞对tLipo/CPT的内化过程是网格蛋白介导的。

|
Figure 6 Endocytosis of tLipo/CPT is mediated by clathrin-mediated endocytosis and neuropilin receptor 1 (NRP-1). A: GL261 cells were pre-incubated with chlorpromazine, methyl-β-cyclodextrin (M-β-CD), and amiloride and the fluorescence intensity of DiI in GL261 cells was detected after incubated with tLipo/DiI for 4 h; B: GL261 cells were pre-treated with different concentration of free tLyp-1 peptide and intracellular DiI fluorescence intensity was quantified after 4 h (n = 3, |
为了进一步验证GL261细胞内吞tLipo/CPT后, 对细胞产生的优良杀伤效果和增强的靶向效率是否由于tLyp-1肽的修饰产生, 作者预先加入tLyp-1处理GL261细胞后, 再给予tLipo/DiI与GL261细胞共孵育, 利用荧光酶标仪检测细胞内DiI摄取量的变化。结果显示, 预先用tLyp-1处理细胞后, 再给予tLipo/DiI, 与未加肽处理组相比, 细胞的摄取量降低1/2 (图 6B), GL261细胞内tLipo/DiI的红色荧光信号减弱(图 6C)。由于GL261细胞上的NRP-1受体被预先加入的tLyp-1 (10 μg·mL-1) 所饱和, 再给予tLipo/DiI处理后并不能增加对tLipo/DiI的摄取, 以上结果进一步证明了GL261细胞摄取tLipo/DiI是通过NRP-1受体介导的内吞, tLyp-1肽的修饰赋予了tLipo/CPT增强的胶质瘤细胞靶向性和摄取效率。
6 tLipo/CPT体外BBB穿透能力考察由于BBB的存在, 使得药物难以透过并高效到达胶质瘤病变部位, 因此, 作者进一步探究了tLipo/CPT是否具备跨越BBB的能力。如图 7A所示, 建立体外BBB模型, 鼠脑内皮bEnd.3细胞接种于上室内, 形成紧密连接, GL261细胞接种于下室。tLipo/C6和Lipo/C6在12 h后从上室到下室GL261细胞中的运输情况用荧光酶标仪进行定量监测。结果表明, 给予tLipo/C6后, 其能够穿过BBB, 并且被GL261细胞所摄取, 相比于未加肽修饰的Lipo/C6组, GL261对tLipo/C6摄取量是Lipo/C6的1.2倍(图 7B), 说明tLipo/CPT能够穿透BBB, 并且具有更强的靶向GL261的能力。
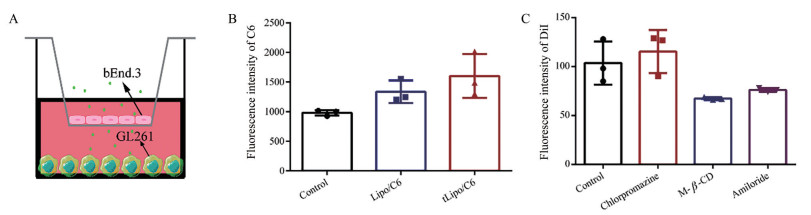
|
Figure 7 tLipo/CPT penetration across the blood-brain barrier (BBB) in vitro. A: Scheme of in vitro BBB model; B: Fluorescence intensity of C6 in GL261 cells cultivated in outside chamber after 12 h (n = 3, |
进一步对tLipo/CPT透过BBB的机制进行初步探讨, 用不同的细胞内吞抑制剂盐酸氯丙嗪、甲基-β-环糊精、阿米洛利预先处理bEnd.3细胞[21]30 min后再给予tLipo/DiI, 与细胞共孵育4 h, 测定bEnd.3细胞内摄取的tLipo/DiI荧光强度, 结果发现, 预先给予甲基-β-环糊精和阿米洛利处理后, bEnd.3胞内tLipo/DiI的荧光强度分别降低至64.95%和73.31% (图 7C), 提示tLipo/CPT透过BBB是通过非网格蛋白介导的内吞途径和巨胞饮途径。
7 tLipo/CPT体内BBB穿透能力考察作者进一步探究了tLipo/CPT跨越体内BBB的能力。按照tLipo/CPT的制备方法, 用近红外染料DiR代替CPT, 得到以DiR标记, 加tLyp-1修饰的脂质体tLipo/DiR和不加肽修饰的脂质体Lipo/DiR。小鼠背部及脑部剃毛后, 分为tLipo/DiR和Lipo/DiR两组, 分别尾静脉注射荧光制剂0.2 mg·kg-1, 于0.5、1、2、4、6、8、12和24 h时间点进行活体成像, 拍摄小鼠体内荧光分布情况(图 8A)。tLipo/DiR和Lipo/DiR两组在小鼠脑部均有荧光分布, 且相比于Lipo/DiR组, tLipo/DiR在各时间点脑部的荧光蓄积强于Lipo/DiR组, 肝脏部位的荧光分布弱于Lipo/DiR组, 说明用tLyp-1修饰后使得脂质体具有更强的脑部特异性。24 h后, 离体脑组织及心、肝、脾、肺、肾各脏器组织的荧光分布与在体荧光分布基本一致(图 8B)。对各离体脏器组织及脑组织的荧光强度进行定量, 结果显示, tLipo/DiR离体脑组织的荧光强度是Lipo/DiR的3.2倍(图 8D), 表明tLipo/DiR在小鼠脑部具有更强的蓄积能力。此外, 各组在8 h左右脑部的荧光分布较强, 于8 h后, 脱颈处死小鼠, 取出脑组织, 将全脑沿冠状切面冷冻切片后, 用倒置荧光显微镜观察各组脑切片中DiR的荧光分布情况, 可以观察到tLipo/DiR组的红色荧光信号要强于Lipo/DiR组(图 8C)。以上结果表明tLipo/DiR能够穿透体内BBB, 并在脑部有更多的蓄积, 也在一定程度上验证了tLyp-1修饰后制剂具有增强的脑靶向性。
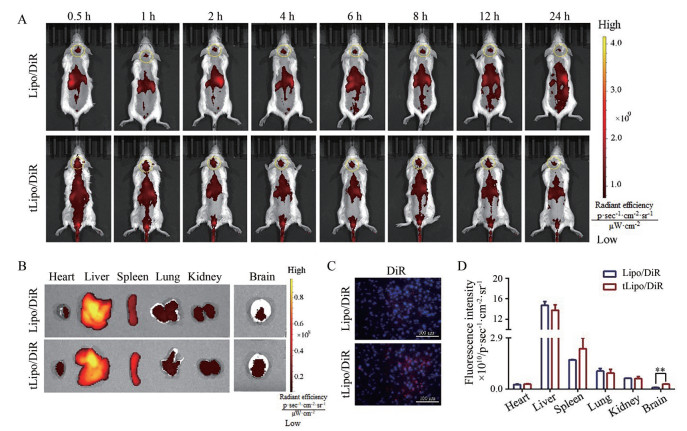
|
Figure 8 A: In vivo fluorescence imaging of BALB/c mice at timed intervals after intravenous injection of tLipo/DiR and Lipo/DiR; B: Ex vivo images of brain and other tissues at 24 h after injection; C: Brains were dissected 8 h after intravenous injection of tLipo/DiR and Lipo/DiR. Cell nucleus (blue fluorescence) was labeled with 4ʹ, 6-diamidino-2-phenylindole (DAPI) after preparing into 15 μm freezing microtome section and distribution of DiR (red fluorescence) was observed; D: Quantification of DiR in different mouse tissues after 24 h (n = 3, |
脑胶质瘤作为成人中最常见的恶性原发性脑肿瘤, 其侵袭性生长特性、手术切除不全、放疗和化疗不敏感等原因, 导致死亡率和复发率仍然很高, 更有效的治疗策略亟待开发。本文引入脂质纳米递送系统, 将CPT包载在脂质体中, 并在其表面修饰具有肿瘤靶向能力的穿膜肽tLyp-1, 制备所得CPT递送系统tLipo/CPT, 以期将CPT精准递送到达脑胶质瘤病变部位, 最大程度地发挥CPT的抗脑胶质瘤活性。作者发现, tLipo/CPT能够通过NRP-1受体介导的内吞, 被胶质瘤GL261细胞更多地摄取。tLipo/CPT具有更好的体外抗GL261增殖活性, 其IC50为5.70 μmol·L-1, 小于游离的CPT (IC50 = 9.31 μmol·L-1)。通过体外和体内BBB穿透性实验考察, 该靶向脂质体能够穿透BBB, 在小鼠脑部富集, 且24 h后仍表达荧光信号, 显示出良好的跨越体内BBB并有效蓄积的能力, 其穿透BBB的机制可能与非网格蛋白介导的内吞途径和巨胞饮途径有关。
目前, 针对CPT的新型递送系统报道较少, 多集中于传统剂型处方工艺的优化, 然而为解决其成药性、最大程度发挥其活性, 尤其是利用CPT抗肿瘤活性设计靶向递送系统的研究鲜有报道。开发新型靶向递送系统, 着力解决CPT成药性问题, 充分发挥其抗肿瘤药理活性将成为药剂学的研究热点。CPT纳米递药系统tLipo/CPT能够荷载CPT高效跨越BBB, 并富集于脑胶质瘤细胞, 具有良好的体外抑制脑胶质瘤GL261细胞活性作用, 且显示出较好的体内BBB跨越能力, 为脑胶质瘤的治疗提供了新思路和研究策略。
作者贡献: 赵华聪进行具体实验(制剂的制备与评价等), 完成撰写任务; 王永明、崔季维、封宽瀚进行具体实验(体外细胞实验及体内BBB跨越考察等), 并负责数据整理; 王若宁、狄留庆指导和设计本课题实验, 指导论文的写作与修改。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Xue S, Hu M, Lyer V, et al. Blocking the PD-1/PD-L1 pathway in glioma: a potential new treatment strategy[J]. J Hematol Oncol, 2017, 10: 81. DOI:10.1186/s13045-017-0455-6 |
| [2] |
Goodenberger ML, Jenkins RB. Genetics of adult glioma[J]. Cancer Genet, 2012, 205: 613-621. DOI:10.1016/j.cancergen.2012.10.009 |
| [3] |
Wang AY, Tao L, Lu Y, et al. Research progress on intervention by Salviae Miltiorrhizae Radix et Rhizoma on angiogenesis of tumor and ischemic disease[J]. Chin Tradit Herb Drugs (中草药), 2015, 46: 1399-1404. |
| [4] |
Zhang XL, Zhang WJ, Jiang F, et al. The experimental research of depsides salts from Salvia miltiorrhiza on autophagy in glioma cell[J]. Chin Arch Tradit Chin Med (中华中国医药学刊), 2016, 34: 972-975. |
| [5] |
Wang ZS, Luo P, Dai SH, et al. Salvianolic acid B induces apoptosis in human glioma U87 cells through p38-mediated ROS generation[J]. Cell Mol Neurobiol, 2013, 33: 921-928. DOI:10.1007/s10571-013-9958-z |
| [6] |
Lu L, Zhang SL, Li CX, et al. Cryptotanshinone inhibits human glioma cell proliferation in vitro and in vivo through SHP-2-dependent inhibition of STAT3 activation[J]. Cell Death Dis, 2017, 8: e2767. DOI:10.1038/cddis.2017.174 |
| [7] |
Jian SG, Chen L, Lian MX, et al. Tanshinone Ⅰ induces apoptosis and protective autophagy in human glioblastoma cells via a reactive oxygen species-dependent pathway[J]. Int J Mol Med, 2020, 45: 983-992. |
| [8] |
Dong WL, Zhang YK, Chen XM, et al. High-dose tanshinone ⅡA suppresses migration and proliferation while promoting apoptosis of astrocytoma cells via Notch-1 pathway[J]. Neurochem Res, 2018, 43: 1855-1861. DOI:10.1007/s11064-018-2601-0 |
| [9] |
Kumar V, Radin D, Leonardi D. Studies examining the synergy between dihydrotanshinone and temozolomide against MGMT+ glioblastoma cells in vitro: predicting interactions with the blood-brain barrier[J]. Biomed Pharmacother, 2019, 109: 386-390. DOI:10.1016/j.biopha.2018.10.069 |
| [10] |
Wang DF, Yu WB, Cao L, et al. Comparative pharmacokinetics and tissue distribution of cryptotanshinone, tanshinone ⅡA, dihydrotanshinone Ⅰ, and tanshinone Ⅰ after oral administration of pure tanshinones and liposoluble extract of Salvia miltiorrhiza to rats[J]. Biopharm Drug Dispos, 2020, 41: 54-63. DOI:10.1002/bdd.2213 |
| [11] |
Lu L, Li CX, Li D, et al. Cryptotanshinone inhibits human glioma cell proliferation by suppressing STAT3 signaling[J]. Mol Cell Biochem, 2013, 381: 273-282. DOI:10.1007/s11010-013-1711-x |
| [12] |
Piperi C, Papavassiliou KA, Papavassiliou AG. Pivotal role of STAT3 in shaping glioblastoma immune microenvironment[J]. Cells, 2019, 8: 1398. DOI:10.3390/cells8111398 |
| [13] |
Lu L, Zhang SL, Li CX, et al. Cryptotanshinone inhibits human glioma cell proliferation in vitro and in vivo through SHP-2-dependent inhibition of STAT3 activation[J]. Cell Death Dis, 2017, 8: e2767. DOI:10.1038/cddis.2017.174 |
| [14] |
Ott M, Kassab C, Marisetty A, et al. Radiation with STAT3 blockade triggers dendritic cell-T cell interactions in the glioma microenvironment and therapeutic efficacy[J]. Clin Cancer Res, 2021, 26: 4983-4994. |
| [15] |
Yu XY, Lin SG, Chen X, et al. Transport of cryptotanshinone, a major active triterpenoid in Salvia miltiorrhiza Bunge widely used in the treatment of stroke and Alzheimer's disease, across the blood-brain barrier[J]. Curr Drug Metab, 2007, 8: 365-377. DOI:10.2174/138920007780655441 |
| [16] |
Yang G, Chen XQ, Chen ZQ. Application of nano-system of active components of traditional Chinese medicine in anti-tumor[J]. J Jianghan Univ (Nat Sci Ed) (江汉大学学报(自然科学版)), 2020, 48: 33-40. |
| [17] |
Shi JF, Li J, Yang XQ, et al. Antitumor status analysis on the co-delivery systems regarding the active ingredients of Chinese herbs combined with chemotherapeutic drugs[J]. Acta Pharm Sin (药学学报), 2019, 54: 258-268. |
| [18] |
Wang YS, Yin S, Mei L, et al. A dual receptors-targeting and size-switchable "cluster bomb" co-loading chemotherapeutic and transient receptor potential Ankyrin 1 (TRPA-1) inhibitor for treatment of triple negative breast cancer[J]. J Control Release, 2020, 321: 71-83. DOI:10.1016/j.jconrel.2020.02.010 |
| [19] |
Yan Y, Li XQ, Duan JL, et al. Nanosized functional miRNA liposomes and application in the treatment of TNBC by silencing Slug gene[J]. Int J Nanomed, 2019, 14: 3645-3667. DOI:10.2147/IJN.S207837 |
| [20] |
Hu QY, Kang T, Feng JX, et al. Tumor microenvironment and angiogenic blood vessels dual-targeting for enhanced anti-glioma therapy[J]. ACS Appl Mater Interfaces, 2016, 8: 23568-23579. DOI:10.1021/acsami.6b08239 |
| [21] |
Ruan SB, Qin L, Xiao W, et al. Acid-responsive transferrin dissociation and GLUT mediated exocytosis for increased blood-brain barrier transcytosis and programmed glioma targeting delivery[J]. Adv Funt Mater, 2018, 28: 1802227. DOI:10.1002/adfm.201802227 |
 2021, Vol. 56
2021, Vol. 56


