2. 成都医学院药学院, 四川 成都 610500;
3. 成都大学食品与生物工程学院, 四川 成都 610106
2. College of Pharmacy, Chengdu Medical College, Chengdu 610500, China;
3. School of Food and Biological Engineering, Chengdu University, Chengdu 610106, China
近年来, 中药在肿瘤治疗方面展现出良好的疗效和独特的优势, 来源于中药的天然活性成分以其作用靶点广泛、不良反应小等优势, 已成为抗肿瘤领域的研究热点[1], 目前已有数百种中药来源的抗肿瘤活性成分被广泛报道[2]。雷公藤(Tripterygium wilfordii Hook f.) 别名黄藤, 卫矛科雷公藤属植物, 始载于《神农本草经》, 具有祛除风湿、通络消肿、解毒止痛的功效, 常用于湿热结节、癌瘤积毒。已有研究报道, 雷公藤甲素(triptolide, T) 和雷公藤红素(celastrol, C) 是雷公藤中最重要的两个抗肿瘤活性成分, 其中雷公藤甲素可通过抑制肿瘤细胞增殖、侵袭和迁移, 逆转肿瘤多药耐药, 抑制肿瘤免疫, 抑制肿瘤血管生成等起到抗肿瘤作用[3]; 雷公藤红素可通过抑制肿瘤细胞增殖、转移, 诱导肿瘤细胞自噬, 抑制炎症应激等起到抗肿瘤作用[4]。然而, 雷公藤甲素和红素存在治疗窗较窄、易引起不良反应等不足, 且单一药物仍难以应对恶性肿瘤的复杂病机。联合用药将不同作用靶点和机制的药物进行联合, 通过阻断多种信号通路, 提高抗肿瘤效果[5]。已有研究报道将雷公藤甲素和雷公藤红素联合应用, 通过阻滞细胞周期停滞、诱导细胞凋亡等作用发挥协同抑制肿瘤细胞生长的作用, 两者联用的抗肿瘤效果增强, 且药物剂量减少, 不良反应减小[6, 7]。
然而, 以雷公藤甲素、红素为代表的大多数天然抗肿瘤小分子成分水溶性较差, 对肿瘤组织选择性差, 容易对正常组织造成毒性; 且由于药物间体内分布行为差异, 药物以游离形式进行联合, 难以保证肿瘤组织细胞中达到最佳联合比例, 起到最佳抗肿瘤效果。近年来, 纳米递药系统与传统药物递送系统相比, 因其尺寸、形状、材料等特殊性, 可有效改善药物的药代动力学和药效学性能, 提高抗肿瘤疗效[8]。将纳米载体用于多种药物共同递送, 为药物联合抗肿瘤提供了有效途径[9]。然而, 有报道显示, 约95%的纳米制剂会被机体免疫系统清除[10], 进入肿瘤的纳米制剂剂量的中位数仅为注射剂量的0.7%。如何规避免疫系统的清除、提高制剂的肿瘤靶向性, 一直是纳米递药系统研究的热点与难点。脂质体因其生物相容性高、免疫原性低, 通过增强渗透和滞留效应(enhanced permeation and retention effect, EPR) 提高药物在肿瘤组织和细胞内的药物浓度, 是目前临床上最为成熟和公认的药物载体[11, 12], 但其具有易降解、体内循环时可被血浆蛋白非特异性吸附、易被巨噬细胞清除等缺点, 导致其难以在体内维持较长时间[13, 14]。目前常采用聚乙二醇(PEG) 修饰的长循环脂质体防止其与血浆调理蛋白黏合聚集及被网状内皮系统摄取, 增强体内循环时间, 但纳米载体经PEG化后, 进入肿瘤细胞的能力也显著减少[15]。
研究者们意识到源自生物本身的载体可有效躲过机体的识别, 由此将目光聚集于生物膜仿生型药物递送系统研究。红细胞是血液中最丰富、寿命最长的循环细胞, 具有良好的生物相容性、生物可降解性和长循环性。张良方教授等[16]采用天然红细胞膜对纳米载体进行表面修饰, 包被红细胞膜后的PLGA纳米载体体内半衰期显著延长。越来越多的研究证实, 利用红细胞膜包被纳米载体具有在体内长循环、生物相容性等方面的优势[17-19]。因此, 本研究在前期研究基础上, 首先制备雷公藤甲素-红素共载脂质体(C+T/Lip), 随后将红细胞膜包裹在共载脂质体表面, 构建共载雷公藤甲素-红素的红细胞膜仿生脂质体(C+T/RBCm@Lip), 以促进雷公藤甲素和红素在体内和肿瘤组织的共同递送, 延长循环时间、减少免疫原性, 为雷公藤甲素和红素联合应用抗肿瘤提供依据。
材料与方法仪器 UltiMate 3000型高效液相色谱(high performance liquid chromatography, HPLC) 仪(美国Thermo Fisher公司); DF-101S型集热式恒温加热磁力搅拌器(上海邦西仪器科技有限公司); Litesizer 500纳米粒度及zeta电位分析仪(上海安东帕商贸有限公司); YMNL-1000Y超声波细胞粉碎机(南京以马利仪器设备有限公司); 赫西H/T20M台式高速冷冻离心机(湖南赫西仪器装备有限公司); FV1200激光扫描共聚焦显微镜(日本Olympus公司); Facsverse流式细胞仪(美国BD公司)。
药品与试剂 雷公藤红素(纯度≥ 98%, 批号DST200715-035)、雷公藤甲素(纯度≥ 98%, 批号DST200801-034) (成都德思特生物技术有限公司); 蛋黄卵磷脂(批号AL20002, 上海艾伟拓医药科技有限公司); 胆固醇(批号C104028, 上海阿拉丁生化科技股份有限公司); DMEM培养液、0.25%胰蛋白酶、青-链霉素溶液(美国Gibco公司); 胎牛血清(fetal bovine serum, FBS; 杭州四季青公司); 细胞增殖-毒性检测试剂盒(cell counting kit-8, CCK-8; 武汉塞维尔生物科技有限公司); 小鼠白细胞介素-6 (interleukin-6, IL-6) 酶联免疫吸附测定(enzyme-linked immunosorbent assay, ELISA) 试剂盒、小鼠肿瘤坏死因子-α (tumor necrosis factor-α, TNF-α) ELISA试剂盒、小鼠γ-干扰素(γ-interferon, IFN-γ) ELISA试剂盒(上海酶联生物科技有限公司); BCA (bicinchoninic acid) 蛋白浓度测定试剂盒(碧云天生物技术有限公司); 激光共聚焦皿(北京硕华佰奥生物科技有限公司); 乙腈(色谱纯, 上海西格玛奥德里奇贸易有限公司); 磷酸(色谱纯, 成都市诺尔施科技有限责任公司); 水为超纯水; 其他试剂为分析纯。
细胞与动物 人肝癌细胞(HepG2细胞)、RAW264.7细胞(中国科学院细胞库)。雄性SD (Sprague Dawley) 大鼠, SPF (specific pathogen free) 级, 体重(250 ± 2) g, 成都达硕实验动物有限公司, 动物许可证号: SCXK (川) 2015-124。雄性ICR (institute of cancer research) 小鼠, SPF级, 体重(20 ± 2) g, 购于北京斯贝福生物技术有限公司, 动物许可证号: SYXK (川) 2015-030。饲养条件: 温度为18~24 ℃, 湿度为40%~50%。实验期间动物自由进食、饮水, 昼夜节律正常。动物实验经成都中医药大学实验动物伦理委员会批准(批准号: 2019BL-026、2019DL-131)。
HPLC色谱条件
雷公藤红素测定条件 色谱柱: Diamonsil TM C18 (250 mm × 4.6 mm, 5 μm); 流动相: 乙腈-0.1%磷酸水(80∶20); 流速: 1 mL·min-1; 柱温: 25 ℃; 进样量: 10 µL; 检测波长: 425 nm[20]。
雷公藤甲素测定条件色谱柱: Welch Ultimate XB-C18 (250 mm × 4.6 mm, 5 μm); 流动相: 甲醇-水(46∶54); 流速: 1.0 mL·min-1; 柱温: 25 ℃; 进样量: 10 μL; 检测波长: 220 nm[21]。
红细胞膜包裹脂质体的制备
脂质体的制备 课题组前期对雷公藤红素和雷公藤甲素的不同联用比例对肝癌细胞HepG2细胞增殖的抑制作用进行对比研究, 发现雷公藤红素与甲素摩尔比(C∶T) 为100∶1时, 协同抗细胞增殖作用最强。因此, 本研究选取雷公藤红素与甲素最佳摩尔比(C∶T = 100∶1) 进行共载脂质体的制备。采用有机溶剂注入法制备雷公藤甲素-红素脂质体(C+T/Lip)。称取胆固醇(2.625 mg)、蛋黄卵磷脂(10.5 mg) 溶于0.6 mL无水乙醇中, 取适量雷公藤甲素、雷公藤红素溶解于0.4 mL无水乙醇中, 将药物溶液与辅料溶液混合后缓慢滴入9 mL纯水中, 在磁力搅拌器上37 ℃恒温搅拌1 h, 随后用超声波细胞破碎仪探头超声6 min, 低温减压旋蒸5 min回收残留乙醇溶液, 0.45 μm微孔滤膜滤过, 即得显橙黄色乳光的C+T/Lip溶液。
红细胞膜的提取 采用低渗法制备红细胞膜[22, 23], 从SD大鼠腹主动脉取全血, 3 000 r·min-1离心5 min, 弃掉上层血浆、白细胞和血小板, 将得到的红细胞沉淀用1×磷酸盐缓冲液(phosphate buffered saline, PBS) 清洗3次, 直至上清液无色。用低渗溶液0.25×PBS以体积比1∶50重悬后, 在摇床中4 ℃、100 r·min-1孵育1 h, 使红细胞充分破裂。孵育结束后, 4 ℃、12 000 r·min-1离心5 min弃去释放出的血红蛋白。并重复用1×PBS溶液清洗至上清液无色, 得到淡粉色红细胞膜团块, PBS重悬(体积与取血体积相等), 即得红细胞膜(red blood cell membrane, RBCm) 溶液, 置于-80 ℃保存备用。
红细胞膜包裹脂质体的制备 为了获得红细胞膜仿生脂质体, 进一步将红细胞膜溶液探头超声处理3 min后得到红细胞膜纳米囊泡。取适量制备好的C+T/Lip与红细胞膜纳米囊泡混合均匀, 探头超声处理3 min, 过0.45 μm微孔滤膜得到粒径均一的脂质体, 即得红细胞膜包裹的雷公藤甲素-红素共载脂质体(C+T/RBCm@Lip), 4 ℃保存[24]。
细胞膜囊泡与脂质体溶液投料比考察 考察共载脂质体与红细胞膜的最佳比例, 量取C+T/Lip溶液2 mL, 分别与1、2、4和8 mL红细胞膜囊泡溶液混合后, 探头超声处理3 min, 过0.45 μm微孔滤膜制备得到4个红细胞膜脂质体, 通过粒径仪测定每个制剂的粒径分布情况, 根据粒径分布图确定脂质体溶液与细胞膜囊泡的最佳体积比。
红细胞膜包裹脂质体的基础表征 形貌、粒径、多分散指数(polydispersity index, PDI)与电位 取10 μL的脂质体样品液, 缓慢滴入具有支撑碳膜的200目铜网, 3%磷钨酸钠溶液染色后, 静置2 min, 在透射电镜下观察各自形态。分别吸取待测样品溶液1 mL, 利用粒度与zeta电位分析仪分别测定C+T/Lip和C+T/RBCm@Lip的平均水动力直径、PDI及zeta电位值。
包封率和载药量的测定 包封率[drug entrapment efficiency, %; 公式(1)] 和载药量[drug loading capacity, %; 公式(2)] 的测定均采用高效液相色谱法, 将制备好的脂质体溶液加入适量甲醇, 通过涡旋、超声等处理破坏脂质体, 溶解药物后, 过0.22 μm微孔滤膜, 测试药物含量。
| $ 包封率\% = ({\rm{W}}_{2} - {\rm{W}}_{1} )/{\rm{W}}_{2} × 100\% $ | (1) |
| $ 载药量\% = ({\rm{W}}_{2} - {\rm{W}}_{1} )/{\rm{W}}_{3} × 100\% $ | (2) |
式中, W1为游离药物含量, W2为投药总量, W3为载体和药物总投量。
储存稳定性 制备新鲜脂质体样品, 在4 ℃下储存, 连续1周测定脂质体样品的平均水动力直径及PDI。
凝胶蛋白电泳分析 采用BCA试剂盒测定RBCm、C+T/Lip、C+T/RBCm@Lip样品的蛋白质浓度, 并将所有样品(RBCm、C+T/Lip、C+T/RBCm@Lip)的蛋白质浓度调整为相同浓度, 分别吸取40 μL样品与10 μL上样缓冲液混合, 并在95 ℃沸水加热5 min使蛋白质充分变性。设置电压为80 V, 时间约为15~20 min, 等样品进入分离胶后, 增加电压为120 V, 时间设置为90 min。将分离胶加入染色液, 避光染色30 min后, 弃去染色液, 加入过量去离子水脱色, 在凝胶成像系统下拍摄。
体外药物释放 采用透析袋法对药物的体外释放量进行考察。以0.05%吐温80-PBS作为介质进行体外释放的考察, 分别取2 mL Free C+T、C+T/Lip、C+T/RBCm@Lip装入透析袋, 置于30 mL介质中, 100 r·min-1振荡释放(37 ℃), 分别在0.5、1、2、4、6、8、10、12、24、36、48 h取1 mL介质, 同时补充1 mL新鲜介质, 用HPLC法分别测定每个时间点雷公藤红素和甲素的释放量, 并分别计算各时间点两个药物的累积释放量。
免疫原性评价
血清稳定性 分别取空白NPs、RBCm@Lip与FBS溶液按比例1∶1混合, 混合后的样品置于摇床37 ℃轻轻震荡, 以FBS作为阴性对照组, 每组设置3个复孔。分别于0.5、1、1.5、2、2.5、3、3.5、4 h取样, 将样品加于96孔板中, 用酶标仪在560 nm波长处测定吸光度A值。
巨噬细胞摄取 取对数生长期的RAW264.7细胞接种于激光共聚焦皿, 每孔接种约1×105个细胞, 每组平行3孔, 于恒温培养箱培养12 h, 待细胞贴壁后, 弃去培养基, 以香豆素6 (coumarin 6, C6) 为探针, 分别加入新鲜的含C6/Lip、C6/RBCm@Lip的培养基(以C6计, 浓度为100 ng·mL-1)。于恒温培养箱中培养4 h后, 弃去培养基, 冷PBS洗3次, 加入10%多聚甲醛固定15 min后, 用冷PBS清洗, 加入10 μg·mL-1 Hoechst 33342, 用冷PBS清洗后, 加入防荧光淬灭剂。采用激光共聚焦显微镜观察定性分析巨噬细胞对脂质体的摄取情况。将RAW264.7巨噬细胞接种于6孔板, 每孔接种约3.5×105个细胞。过夜使细胞贴壁生长, 弃去培养基, 分别加入C6浓度为100 ng·mL-1的含C6/Lip、C6/RBCm@Lip培养基, 恒温培养箱孵育4 h。弃去培养基, PBS洗3次, 加入800 μL培养基, 用细胞刮刀轻轻刮下所有细胞, 离心(2 000 r·min-1, 4 min), 用PBS重悬细胞, 30 min内用流式细胞仪进行检测, 定量分析巨噬细胞对脂质体的摄取情况。
TNF-α、IL-6、IFN-γ致炎因子含量测定 将12只雄性ICR小鼠随机分为3组, 每组4只。在给药前禁食12 h, 可自由饮水。分别通过尾静脉注射0.2 mL生理盐水、空白Lip和RBCm@Lip (40 mg·kg-1), 注射2 h后, 摘眼球取血, 将血液静置30 min后, 1 000 r·min-1、4 ℃离心5 min, 小心吸取上层淡黄色血清, 样品准备好后, 按照ELISA试剂盒说明书分别测定每组血清中致炎因子含量。
体外实验研究
HepG2细胞摄取 取对数生长期的HepG2细胞接种于激光共聚焦皿, 每孔接种约1×105个细胞, 每组平行3孔于恒温培养箱中培养12 h。待细胞贴壁后, 分别加入新鲜的含Free C6、C6/Lip、C6/RBCm@Lip培养基(以C6计, 浓度为100 ng·mL-1)。于恒温培养箱中培养4 h后, 弃去培养基, 冷PBS洗3次, 加入10%多聚甲醛固定15 min后, 用冷PBS清洗, 加入10 μg·mL-1的Hoechst 33342, 用冷PBS清洗后, 加入防荧光淬灭剂。采用激光共聚焦显微镜观察定性分析HepG2细胞对脂质体的摄取情况。将HepG2细胞接种于6孔板, 每孔接种约2.5×105个细胞。过夜使细胞贴壁生长, 弃去旧培养基, 分别加入C6浓度为100 ng·mL-1的含Free C6、C6/Lip、C6/RBCm@Lip培养基, 恒温培养箱孵育4 h。弃去培养基, PBS洗3次, 加入400 μL胰酶消化3 min, 再加入400 μL培养基终止消化, 离心(2 000 r·min-1, 4 min), 然后用PBS重悬细胞, 30 min内用流式细胞仪进行检测, 定量分析HepG2细胞对脂质体的摄取情况。
细胞毒性实验 采用CCK8法检查脂质体对HepG2细胞的毒性, 取对数生长期的HepG2细胞, 接种于96孔板, 每孔接种约1×104个细胞, 在恒温培养箱中培养12 h, 待细胞贴壁后, 对照组加入新鲜培养基, 实验组加入同含药物雷公藤红素和甲素的培养基, 其中雷公藤红素浓度依次为2 000、1 500、1 000、750、500、250 nmol·L-1, 雷公藤甲素浓度依次为20、15、10、7.5、5、2.5 nmol·L-1, 每个浓度设置4个复孔, 再次置于恒温培养箱中培养。药物作用48 h后, 采用CCK8试剂检测, 并采用酶标仪在450 nm波长处测定A值。计算细胞存活率。
统计学分析 数据均以平均值±标准误[mean ± standard error of the mean (SEM)] 表示, 所有实验结果在相同条件下在至少3个独立实验中得到证实。统计学比较采用t检验, P < 0.05表示差异有统计学意义。
结果与讨论 1 细胞膜囊泡与脂质体溶液投料比考察分别采用冰浴探超法制备得到4个不同比例的红细胞膜脂质体, 用粒度仪测定每个制剂粒径分布情况(图 1), 由图可见, 当脂质体溶液与红细胞膜囊泡体积比为1∶0.5、1∶2、1∶4时, 粒径分布图存在小峰, 仅在脂质体溶液与红细胞膜囊泡体积比为1∶1时粒径分布图中无小峰出现。且粒径在110 nm左右, 该粒径范围能使脂质体通过EPR效应蓄积在肿瘤部位, 达到后续实验要求。

|
Figure 1 Particle size distribution of the biomimetic erythrocyte membrane liposome co-loaded with triptolide and celastrol (C+T/RBCm@Lip) with different Lip/RBCm ratios. Lip: Liposome; RBCm: Red blood cell membrane |
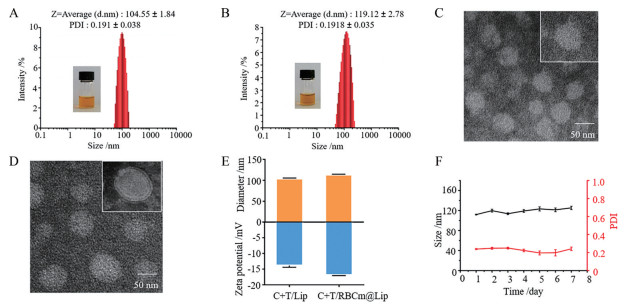
C+T/Lip和C+T/RBCm@Lip的粒径分布及PDI如图 2A、B所示, PDI均小于0.3, 粒径图线性良好, 分布均一。通过透射电镜对包裹红细胞膜前后的脂质体进行拍摄观察, 结果如图 2C、D中所示, C+T/Lip形态规整, 分散均匀。在冰浴探超包裹红细胞膜后, 观察到C+T/RBCm@Lip存在“核-壳”结构, 红细胞膜贴覆于脂质体表面。采用粒度与zeta电位分析仪对最终制剂红细胞膜仿生脂质体C+T/RBCm@Lip进行粒径以及zeta电位的测定, C+T/RBCm@Lip的平均水动力直径为119.12 ± 2.78 nm左右, zeta电位值为-16.9 ± 1.2 mV, 文献报道红细胞膜的电位约-15 mV左右, 包裹红细胞膜后的脂质体粒径增大约15 nm, 电位值更接近红细胞膜电位值(图 2E), 初步证明了红细胞膜的成功覆盖。红素和甲素包封率分别为87.4% ± 2.7%和88.1% ± 1.8%, 载药量分别为11.12% ± 1.9%和0.06% ± 0.002%。
|
Figure 2 Characterization of C+T/Lip and C+T/RBCm@Lip. A, B: Particle size and polydispersity index (PDI) images of C+T/Lip (A) and C+T/RBCm@Lip (B); C, D: Transmission electron microscope (TEM) images of C+T/Lip (C) and C+T/RBCm@Lip (D). Scale bar: 50 nm; E: Particle size, zeta potential changes after coated RBC membrane; F: Particle size, PDI changes of C+T/RBCm@Lip in a week. n = 3, mean ± standard error of the mean (SEM) |
将C+T/RBCm@Lip在4 ℃储存一周后, 外观上, 脂质体溶液未出现明显变化, 也没有沉淀产生。与初始粒径及PDI相比变化不大(图 2F), 结果表明所制备的C+T/RBCm@Lip具有一定的稳定性。
2.3 凝胶蛋白电泳分析利用SDS-PAGE (sodium dodecyl sulfate-polyacrylamide gel electrophoresis) 凝胶电泳考察细胞膜蛋白在RBCm及C+T/RBCm@Lip制备过程中是否会被损伤, 结果显示, RBCm组、C+T/RBCm@Lip组呈现相同的蛋白条带, 而C+T/Lip组呈现无蛋白条带(图 3A)。由此证明, RBCm及C+T/RBCm@Lip保留了天然红细胞膜上的蛋白, 并且在RBCm及C+T/RBCm@Lip制备过程中没有对膜蛋白造成显著损伤。

|
Figure 3 Characterization of C+T/Lip and C+T/RBCm@Lip. A: RBCm proteins verification in the RBCm, C+T/Lip and C+T/RBCm@Lip by sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE); B, C: Release curve of celastrol (B) and triptolide (C) in vitro; D: Stability of C+T/Lip, C+T/RBCm@Lip in fetal bovine serum (FBS). n = 3, mean ± SEM. *P < 0.05 |
与游离药物组合相比, C+T/Lip和C+T/RBCm@Lip组都表现出持续缓慢释放的特性。游离药物组释放最快, 游离雷公藤红素在6 h完全释放, 雷公藤甲素在10 h完全释放。如图 3B、C所示, 在4 h时, 游离组雷公藤红素和甲素各释放了89.5%和66.8%, C+T/Lip组雷公藤红素和甲素各释放了26%和17.21%, 表明制备成脂质体后, 药物具有缓释特性, 而同时C+T/RBCm@Lip组雷公藤红素和甲素各释放了13.28%和8.07%, 表明红细胞膜包被后的C+T/RBCm@Lip能在体内实现正常释放, 并具有缓释特性, 也证明红细胞膜的包被对脂质体起到了良好的保护作用。
3 免疫原性评价 3.1 血清稳定性当脂质体与FBS中的蛋白质结合后, 蛋白质之间相互作用形成蛋白簇, 引起脂质体团聚, 产生较高的光散射, 因此本文通过观察脂质体在560 nm处A值的变化来评价脂质体的稳定性。在4 h内, 脂质体A值变化都很小, 且C+T/RBCm@Lip组A值始终比C+T/Lip组小(图 3D), 证明红细胞膜的包被能够有效阻止脂质体与血清中的蛋白质结合。
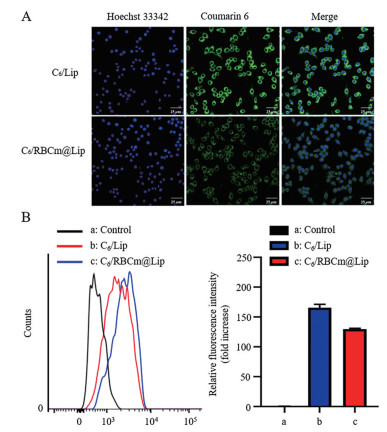
3.2 巨噬细胞的摄取巨噬细胞属于免疫细胞, 机体巨噬细胞能够识别并清除“非己”的外源物质, 采用激光共聚焦实验观察包载C6后的C6/Lip和C6/RBCm@Lip被RAW264.7细胞摄取的情况, 绿色荧光代表C6标记的脂质体, 蓝色代表细胞核。结果显示, RAW264.7细胞对C6/RBCm@Lip组的摄取量明显低于C6/Lip组, 流式细胞仪定量分析也得到相同结果(图 4), 证实了被红细胞膜包被后的脂质体具有免疫逃逸特性。
|
Figure 4 Cellular uptake qualitative and quantitative evaluation of different coumarin 6 (C6) formulations using RAW264.7 cells. A: Confocal image of cellular uptake of the C6/Lip and C6/RBCm@Lip on RAW264.7 cells. Scale bar: 25 μm; B: Intracellular fluorescence of RAW264.7 cells determined by flow cytometry (FCM) following treatment with C6/Lip and C6/RBCm@Lip respectively for 4 h. n = 3, mean ± SEM |
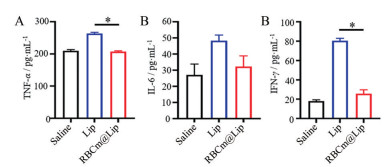
使用ELISA试剂盒测定小鼠血清中TNF-α、IL-6、IFN-γ致炎因子含量。TNF-α属于细胞信号转导蛋白, 既参与系统性炎症反应, 同时也是一种引起急性期反应的细胞因子[25]。IL-6是一种由活化单核细胞产生的细胞因子, 可以作为炎性因子参与炎症反应, 会在机体感染或组织损伤后迅速产生[26]。结果显示, 空白红细胞膜脂质体组中TNF-α、IL-6、IFN-γ炎症因子表达水平均低于空白脂质体组, 且与生理盐水组相近, 表明红细胞膜包被后的脂质体不会显著引起机体产生急性炎症反应, 可以更好地伪装自身进入机体, 躲避免疫系统的快速清除(图 5)。
|
Figure 5 Tumor necrosis factor-α (TNF-α, A), interleukin-6 (IL-6, B), and γ-interferon (IFN-γ, C) expression levels in serum of the animals after injection of saline, Lip, and RBCm@Lip were measured using enzyme-linked immunosorbent assay (ELISA) kits. n = 3, mean ± SEM. *P < 0.05 |
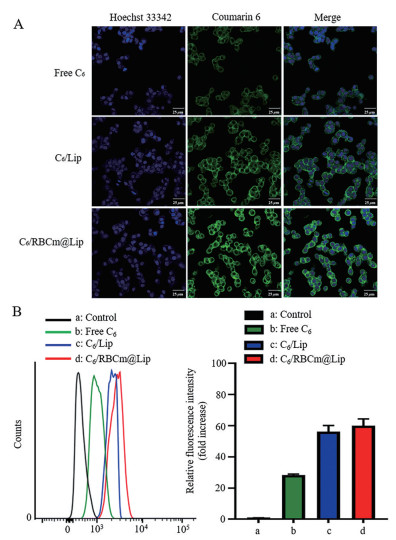
采用激光共聚焦显微镜观察HepG2细胞对游离C6、C6/Lip和C6/RBCm@ Lip的摄取情况, 结果显示, 相比游离药物, 脂质体能更好地被HepG2细胞摄取, 且HepG2细胞对C6/RBCm@Lip的摄取量略高于C6/Lip。流式细胞仪定量分析也得到相同结果(图 6)。
|
Figure 6 Cellular uptake qualitative and quantitative evaluation of different C6 formulations using HepG2 cells. A: Confocal image of cellular uptake of free C6, C6/Lip, and C6/RBCm@Lip with HepG2 cells. Scale bar: 25 μm; B: Intracellular fluorescence of HepG2 cells determined by FCM following treatment with free C6, C6/Lip, and C6/RBCm@Lip respectively for 4 h. n = 3, mean ± SEM |
采用CCK8法测定各药物对HepG2细胞生长的抑制作用, 结果显示, 在雷公藤红素浓度为250~2 000 nmol·L-1, 雷公藤甲素浓度为2.5~20 nmol·L-1的联合给药处理下, Free C+T组、C+T/Lip组、C+T/RBCm@Lip组对HepG2细胞生长的抑制作用比Free C组及Free T组效果强, 且在雷公藤红素浓度为250~2 000 nmol·L-1, 雷公藤甲素浓度为2.5~20 nmol·L-1的联合给药处理下, 联合给药组对HepG2细胞生长的抑制作用强度为C+T/RBCm@Lip组 > C+T/Lip组 > Free C+T组(图 7)。
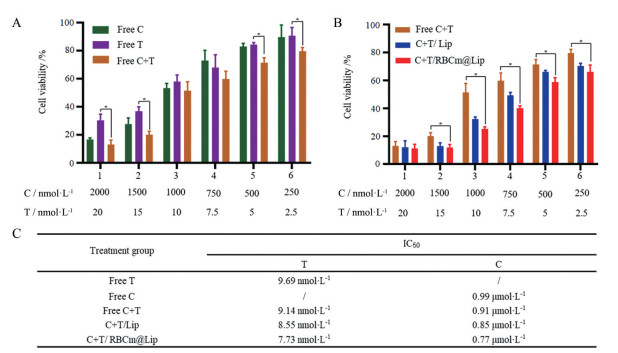
|
Figure 7 Various formulations inhibit the growth of HepG2 cells in vitro. A, B: Cell survival of HepG2 cells after treatment with various formulations at different concentrations for 48 h; C: The half maximal inhibitory concentration (IC50) values of various formulations in HepG2 cells after 48 h treatment. n = 3, mean ± SEM. *P < 0.05 |
红细胞膜包被纳米是近年来一种常用的仿生纳米载体[27, 28], 既保留了红细胞膜天然的特性, 又具有纳米粒子的优势, 其主要制备方法有挤压法、超声法。目前细胞膜仿生纳米的制备大多采用过膜挤压法, 但由于红细胞膜流动性差, 这种制备方法挤压过程十分费力、聚碳酸酯膜吸附药物量较大, 难以大批量制备, 基于文献报道及脂质体与细胞膜脂溶性的特性, 本研究最终采用超声法将红细胞膜覆盖到脂质体表面。通过粒径、电位、凝胶蛋白电泳等基础表征证明了红细胞膜包被成功。其中雷公藤红素和甲素包封率分别为87.4% ± 2.7%和88.1% ± 1.8%。C+T/RBCm@Lip稳定性考察中, C+T/RBCm@Lip在超纯水中一周内粒径及PDI均无明显变化。且体外释放结果表明红细胞膜的包被能够对脂质体起保护作用, 使C+T/RBCm@Lip具有持续缓慢释放的特性, 进一步通过巨噬细胞对C+T/RBCm@Lip摄取情况, 血清稳定性、血清中炎症因子表达水平表明C+T/RBCm@Lip通过红细胞膜的包被后, 一方面能够保护脂质体, 增强脂质体在血清中的稳定性。另一方面, C+T/RBCm@Lip具有低免疫原性, 可减少机体排异反应, 延长脂质体的血液循环时间, 具有更好的生物相容性, 提高药物的生物利用度。这些结果可能归因于红细胞膜表面的CD47可以与巨噬细胞表面的信号调节蛋白α (SIRP α) 相互作用来抑制巨噬细胞的吞噬[29]。体外毒性实验表明包被红细胞膜后的脂质体仍然对HepG2细胞的生长具有抑制作用, 且抑制效果较C+T/Lip好。这可能与红细胞膜的包被进一步提高了制剂的脂溶性, 且红细胞膜源自生物体细胞膜具有良好的生物相容性相关, 从而有利于肿瘤细胞利用膜流动性胞吞载药物制剂, 提高了肿瘤细胞对脂质体的摄取量, 增强对HepG2细胞生长的抑制作用[30]。
虽然研究显示PEG功能化纳米和细胞膜仿生技术都能延长纳米粒子在体内血液循环时间, 前者通过亲水性的PEG伸展于纳米粒表面, 形成厚的水化膜保护层, 从而提高纳米颗粒亲水性并造成空间位阻, 屏蔽网状内皮系统的识别, 延长血液循环[31]。后者通过源于生物体自身的细胞膜的包被, 使纳米颗粒向机体发出“别吃我”的信号, 有效伪装自身, 从而延长在体内的保留时间。但PEG功能化纳米会诱导机体产生抗PEG效应, 导致在第二次给药后, 纳米粒很快被机体清除, 在长期治疗中, 无法有效抗肿瘤。由于红细胞膜具有长循环特性和生物相容性, 以利用其自身的固有属性为解决传统纳米的缺陷带来了希望。
但是红细胞膜纳米制剂的质量控制是未来一个新的挑战, 如何减少实际生产中每批红细胞膜制剂的差异, 以及如何确保制剂不受污染, 消除已经变性的蛋白等是细胞膜仿生制剂的重大挑战。尽管目前细胞膜仿生制剂面临很多挑战, 但这种将天然细胞膜独特优势与人工合成纳米优势结合的新型制剂仍然是有意义的, 为临床药物的应用带来了新的思路。
作者贡献: 钟雪梅负责实验工作及撰写文章主体内容; 鲜静参与部分实验及数据分析; 石金凤和吴亿晗负责文章修改; 陈佳美和林洁参与部分实验并提供材料; 章津铭和邹亮负责提出研究思路、设计方案并指导实验实施。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Li XJ, Wu MX, Kong FM, et al. Review of anti-tumor activity and mechanism of Chinese materia medica active ingredients[J]. Chin Tradit Herbal Drugs (中草药), 2020, 51: 2587-2592. |
| [2] |
Yu M, Fu YS, Wang B, et al. Research progress on regulation of active constituents of Chinese materia medica on G2/M phase of tumor cells[J]. Chin Tradit Herbal Drugs (中草药), 2019, 50: 3707-3713. |
| [3] |
Shi JF, Luo YY, Li JX, et al. Research progress on anti-tumor effects and mechanisms of triptolide and its combined application[J]. China J Chin Mater Med (中国中药杂志), 2019, 44: 3391-3398. |
| [4] |
Xu ZY, Shi JF, Xian J, et al. Research progress on anti-tumor mechanism of celastrol alone and in combination[J]. Chin Tradit Herbal Drugs (中草药), 2021, 52: 4372-4385. |
| [5] |
Zhang D. Study on Anti-hepatocellular Carcinoma Activity of Chrysin Combined with Diosmetin or Triptolide In Vivo and In Vitro (白杨素联合香叶木素或雷公藤甲素体内及体外抗肝癌活性研究) [D]. Wuhan: Wuhan Polytechnic University, 2020.
|
| [6] |
Ding B, Wahid MA, Wang Z, et al. Triptolide and celastrol loaded silk fibroin nanoparticles show synergistic effect against human pancreatic cancer cells[J]. Nanoscale, 2017, 9: 11739-11753. DOI:10.1039/C7NR03016A |
| [7] |
Jiang QW, Cheng KJ, Mei XL, et al. Synergistic anticancer effects of triptolide and celastrol, two main compounds from thunder god vine[J]. Oncotarget, 2015, 6: 32790-32804. DOI:10.18632/oncotarget.5411 |
| [8] |
Zhou JP. Application and prospect of nanotechnology in the drug delivery system[J]. China Pharm Univ (中国药科大学学报), 2020, 51: 379-382. |
| [9] |
Zhang B, Zhang N. Research progress in co-delivery chemotherapeutic drugs with nanocarrier for cancer combination therapy[J]. Chin New Drug J (中国新药杂志), 2014, 23: 2514-2520. |
| [10] |
Wilhelm S, Tavares A, Dai Q, et al. Analysis of nanoparticle delivery to tumours[J]. Nat Rev Mater, 2016, 1: 16014. DOI:10.1038/natrevmats.2016.14 |
| [11] |
Olusanya TOB, Haj Ahmad RR, Ibegbu DM, et al. Liposomal drug delivery systems and anticancer drugs[J]. Molecules, 2018, 23: 907. DOI:10.3390/molecules23040907 |
| [12] |
Dianat-Moghadam H, Heidarifard M, Jahanban-Esfahlan R, et al. Cancer stem cells-emanated therapy resistance: implications for liposomal drug delivery systems[J]. J Control Release, 2018, 288: 62-83. DOI:10.1016/j.jconrel.2018.08.043 |
| [13] |
Liu T, Choi H, Zhou R, et al. Quantitative evaluation of the reticuloendothelial system function with dynamic MRI[J]. PLoS One, 2014, 9: e103576. DOI:10.1371/journal.pone.0103576 |
| [14] |
Haniffa M, Bigley V, Collin M. Human mononuclear phagocyte system reunited[J]. Semin Cell Dev Biol, 2015, 41: 59-69. DOI:10.1016/j.semcdb.2015.05.004 |
| [15] |
Xu H, Wang KQ, Deng YH, et al. Effects of cleavable PEG-cholesterol derivatives on the accelerated blood clearance of PEGylated liposomes[J]. Biomaterials, 2010, 31: 4757-4763. DOI:10.1016/j.biomaterials.2010.02.049 |
| [16] |
Hu CM, Zhang L, Aryal S, et al. Erythrocyte membrane-camouflaged polymeric nanoparticles as a biomimetic delivery platform[J]. Proc Natl Acad Sci U S A, 2011, 108: 10980-10985. DOI:10.1073/pnas.1106634108 |
| [17] |
Xia Q, Zhang Y, Li Z, et al. Red blood cell membrane-camouflaged nanoparticles: a novel drug delivery system for antitumor application[J]. Acta Pharm Sin B, 2019, 9: 675-689. DOI:10.1016/j.apsb.2019.01.011 |
| [18] |
Chu Y, Zhang J, Pan H, et al. Preparation and evaluation of long circulating erythrocyte membrane-cloaked anti-cancer drug delivery system[J]. Drug Deliv Transl Res, 2020, 10: 1278-1287. DOI:10.1007/s13346-020-00780-x |
| [19] |
Luk BT, Fang RH, Hu CM, et al. Safe and immunocompatible nanocarriers cloaked in RBC membranes for drug delivery to treat solid tumors[J]. Theranostics, 2016, 6: 1004-10011. DOI:10.7150/thno.14471 |
| [20] |
Jiang J, Yang C. Comparison on content of tripterine from different parts and sources upon Tripterygium wilfordii Hook. f.[J]. Asia Pac Tradit Med (亚太传统医药), 2019, 15: 65-67. |
| [21] |
Luo Y, Li J, Hu Y, et al. Injectable thermo-responsive nano-hydrogel loading triptolide for the anti-breast cancer enhancement via localized treatment based on "two strikes" effects[J]. Acta Pharm Sin B, 2020, 10: 2227-2245. DOI:10.1016/j.apsb.2020.05.011 |
| [22] |
Huang K, Wen S, Wang W, et al. Erythrocyte membrane coated nanoparticle-based control releasing hydrogen sulfide system protects ischemic myocardium[J]. Nanomedicine (Lond), 2021, 16: 465-480. DOI:10.2217/nnm-2020-0404 |
| [23] |
Rao L, Bu LL, Xu JH, et al. Red blood cell membrane as a biomimetic nanocoating for prolonged circulation time and reduced accelerated blood clearance[J]. Small, 2015, 11: 6225-6236. DOI:10.1002/smll.201502388 |
| [24] |
Qian K. Study on Red Blood Cell Membrane-coated Disc Nanocarriers for Hypoxia Regulation and Drug Resistance in Pancreatic Cancer Tumors (红细胞膜包裹盘状纳米载体用于胰腺癌肿瘤乏氧调节及耐药的研究) [D]. Shanghai: University of Chinese Academy of Sciences, 2020.
|
| [25] |
Bradley JR. TNF-mediated inflammatory disease[J]. J Pathol, 2008, 214: 149-160. DOI:10.1002/path.2287 |
| [26] |
Tanaka T, Narazaki M, Kishimoto T. IL-6 in inflammation, immunity, and disease[J]. Cold Spring Harb Perspect Biol, 2014, 6: a016295. DOI:10.1101/cshperspect.a016295 |
| [27] |
Jiang Q, Luo Z, Men Y, et al. Red blood cell membrane-camouflaged melanin nanoparticles for enhanced photothermal therapy[J]. Biomaterials, 2017, 143: 29-45. DOI:10.1016/j.biomaterials.2017.07.027 |
| [28] |
Piao JG, Wang L, Gao F, et al. Erythrocyte membrane is an alternative coating to polyethylene glycol for prolonging the circulation lifetime of gold nanocages for photothermal therapy[J]. ACS Nano, 2014, 8: 10414-10425. DOI:10.1021/nn503779d |
| [29] |
Hu CM, Fang RH, Luk BT, et al. 'Marker-of-self' functionalization of nanoscale particles through a top-down cellular membrane coating approach[J]. Nanoscale, 2013, 5: 2664-2668. DOI:10.1039/c3nr00015j |
| [30] |
Guo BR, Tong Y, Dong Y, et al. Preparation and in vitro evaluation of the anti-breast cancer effects of the red blood cell membrane-coated cucurbitacin B nanostructured lipid carriers[J]. J Int Pharma Res (国际药学研究杂志), 2020, 47: 989-994. |
| [31] |
Hou XP, Zhang JM, Lu XD. Study on the effect of PEG modified lipid membrane on prolonging the circulating time of liposome in blood[J]. Acta Pharm Sin (药学学报), 1996, 31: 451-454. |
 2021, Vol. 56
2021, Vol. 56


