2. 浙江省神经药理学与转化研究重点实验室, 浙江 杭州 310000;
3. 浙江中医药大学图书馆, 浙江 杭州 310000;
4. 金华市人民医院药学部, 浙江 金华 321000
2. Key Laboratory of Neuropharmacology and Translational Medicine of Zhejiang Province, Hangzhou 310000, China;
3. Libraries of Zhejiang Chinese Medical University, Zhejiang Chinese Medical University, Hangzhou 310000, China;
4. Department of Pharmacy, Jinhua People's Hospital, Jinhua 321000, China
肿瘤的多药耐药性是临床恶性肿瘤治疗失败、肿瘤复发的关键原因[1-4], 如何克服肿瘤多药耐药性已成为提高化疗药效的关键性科学问题。P-糖蛋白(P-glycoprotein, P-gp) 是一种具有三磷酸腺苷(adenosine triphosphate, ATP) 结合域的单向转运跨膜蛋白[5], 其利用ATP水解供能主动外排药物, 使细胞内药物浓度维持在较低水平, 产生肿瘤细胞耐药性[6]。线粒体在肿瘤的发生和发展中起着重要作用, 是细胞的代谢中心[7], 是生成ATP并最终氧化放能的场所, 破坏线粒体能够直接切断肿瘤细胞的能量供应[8]。因此, 通过线粒体靶向, 破坏线粒体功能, 降低P-gp活性, 是逆转肿瘤多药耐药现象的有效途径。金属离子在细胞代谢和增长过程中起着重要作用, 离子平衡的微妙变化可能引起一系列细胞内反应, 甚至导致细胞死亡[9]。有研究表明[10], 钙离子局部超载能够直接损伤线粒体呼吸链复合体Ι (complex Ι), 从而抑制ATP产生, 降低P-gp外排作用, 同时, 还能在基因水平上抑制P-gp合成[11], 逆转肿瘤耐药性。
多柔比星(doxorubicin, DOX) 是一种蒽环类抗肿瘤药物[12, 13], 作用靶点为细胞核[14, 15], 能够有效治疗癌症[16], 但随着长期使用, 可能刺激癌细胞过度表达P-gp、激活DNA修复、增加谷胱甘肽转移酶活性, 最终导致耐药性的产生[17]。三氧化二砷(arsenic trioxide, ATO) 是中药砒霜的有效成分, 其毒性明显[18-21], 作为聚ADP核糖聚合酶1 (poly ADP-ribose polymerase-1, PARP-1) 抑制剂, 可置换PARP-1中的Zn2+, 干扰PAR的合成和DNA损伤修复, 在细胞内产生DNA片段, 最终导致细胞凋亡[22]。不仅如此, ATO在非细胞毒性剂量下能够显著增加人乳腺癌耐药细胞(MCF-7/DOX) 对DOX的敏感性, 增强DOX的治疗效果[23], 但是ATO不具有分布特异性, 易产生不良反应[24, 25]。砷金属纳米粒具有良好的稳定性和pH响应性[26], 将Ca2+和亚砷酸根(AsO33-) 结合形成亚砷酸钙纳米粒(NPs-CaAs), 可改善ATO的体内分布特异性, 降低在正常组织中的蓄积; 同时表面带正电荷的DOX可通过静电作用与表面带负电荷的亚砷酸钙纳米粒相结合, 实现DOX的高效负载[27]。因此, ATO和DOX的共同递送可以联合Ca2+逆转肿瘤耐药性, 协同杀伤肿瘤细胞。
大部分药物进入肿瘤细胞后靠随机分布与包括线粒体在内的亚细胞器作用, 导致只有少量药物进入线粒体[28]。三苯基膦(triphenylphosphine, TPP) 是一种可穿透线粒体膜的双亲性阳离子化合物, 其化学结构中的3个苯基使其具有很强的脂溶性[29]。不仅如此, 磷原子上的正电荷能够分布到3个苯基上, 形成离域正电荷, 使其对线粒体具有亲和性[30]。因此, 可以通过TPP修饰来提高药物制剂载体的线粒体靶向性。
综上, 本文通过水热法制备亚砷酸钙纳米粒, 利用静电相互作用力将DOX负载至NPs-CaAs, 最终采用薄膜水化法制备线粒体靶向亚砷酸钙/多柔比星脂质纳米粒(TPP-LPs-CaAs/DOX)。该脂质纳米粒进入肿瘤细胞后, 将药物靶向递送至线粒体, 并通过以下机制逆转肿瘤耐药: ①引起线粒体中Ca2+局部超载, 破坏线粒体离子平衡, 抑制P-gp合成; ②抑制线粒体呼吸链复合体Ι活性, 减少细胞内ATP生成, 降低P-gp外排作用。最后, 释放出ATO和DOX, 协同杀死肿瘤细胞。详细作用机制见图 1。

|
Figure 1 Schematic diagram of TPP-LPs-CaAs/DOX treatment of drug-resistant breast cancer. P-gp: P-glycoprotein; ATP: Adenosine triphosphate; DOX: Doxorubicin; TPP-LPs-CaAs: Triphenylphosphine-liposome-calcium arsenite |
仪器 ICAP 7400等离子体发射光谱仪、1510酶标仪、311 CO2培养箱、超低温冰箱(美国Thermo Fisher公司); 反应釜(上海秋佐科学仪器有限公司); 水热釜磁力搅拌加热套(郑州碳邦仪器有限公司); 透射电子显微镜(transmission electron microscope, TEM; 日本日立公司); Nano-ZS90粒度分析仪(英国Malvern仪器有限公司); ZD-85恒温振荡器(上海力辰仪器科技有限公司); R-502旋转蒸发仪(上海申胜生物技术有限公司); FB-01T真空抽滤系统(上海摩速科学器材有限公司); 紫外可见近红外光谱仪(日本岛津公司); CP225D电子天平(德国Sartorius公司); Milli-Q超纯水仪(美国Millipore公司); DF-101S集热式恒温磁力搅拌器(郑州科创仪器有限公司); Optima Max超速低温离心机(美国Beckman公司); 超声波细胞粉碎仪(宁波新芝生物科技股份有限公司); SW-CJ-1FD超净工作台(苏州净化设备有限公司); HHS-11-1恒温水浴锅(上海博讯实业有限公司医疗设备厂); 激光共聚焦显微镜(德国Carl Zeiss公司)。
药品与试剂 亚砷酸钠(NaAsO2; 纯度: 97%; 山东西亚化学工业有限公司); 盐酸多柔比星(doxorubicin hydrochloride, DOX·HCl)、硝酸(65%~68%) (上海阿拉丁生化科技股份有限公司); 一水合醋酸钙[calcium acetate monohydrate, Ca(CH3COO)2·H2O; 上海凌峰化学试剂有限公司]; 胎牛血清(FBS; 杭州四季青公司); 磷酸盐缓冲液(PBS)、4%多聚甲醛(Biosharp生物科技公司); RPMI-1640培养基、0.25%胰蛋白酶(美国Gibco公司); 二甲基亚砜(DMSO; 广东光华科技股份有限公司); 合成磷脂(DSPC)、胆固醇和聚乙二醇化二硬脂酰磷脂酰乙醇胺(DSPE-PEG2000) (上海艾韦特医药科技有限公司); DSPE-PEG2000-TPP (上海炎怡生物科技有限公司); 二氯甲烷和无水乙醇(国药集团化学试剂有限公司); 2-(4-amidinophenyl)-6-indolecarbamidine dihydrochloride (DAPI)、线粒体绿色荧光探针(mito-tracker green) 和ATP检测试剂(S0026) (上海碧云天生物技术有限公司); 线粒体复合体Ι活性检测试剂盒(BC0515; 北京索莱宝科技有限公司); 超纯水由Milli-Q超纯水仪净化得到; 四甲基偶氮唑盐(MTT; 源叶生物科技有限公司); P-gp一抗(ab170904)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH) 一抗(ab181602)、二抗IgG (ab6721) (美国Abcam公司); 牛胰岛素(上海钰博生物科技有限公司)。
细胞 人乳腺癌耐药细胞(MCF-7/DOX; 上海钰博生物科技有限公司) 培养于含10% FBS、0.5 μg·mL-1 DOX、0.01 mg·mL-1牛胰岛素、100 u·mL-1青霉素和100 μg·mL-1链霉素的RPMI-1640培养基中, 置于37 ℃、5% CO2培养箱中避光培养。
水热法制备NPs-CaAs 精密称取30.00 mg NaAsO2和150.00 mg Ca(CH3COO)2·H2O, 分别溶于10 mL超纯水中, 混合后装入50 mL圆底烧瓶中, 常温下反应30 min。取出液体加入反应釜中, 在120 ℃下反应24 h。反应完成后冷却至室温, 于超速低温离心机中以10 000 ×g离心30 min, 收集沉淀, 用超纯水洗涤3次, 重复3次, 沉淀即为NPs-CaAs。
制备NPs-CaAs/DOX 在上述方法得到的NPs-CaAs溶液中缓慢加入2 mg·mL-1 DOX·HCl, 总计2 mL, 常温下持续搅拌12 h, 于超速低温离心机中以10 000 ×g离心30 min, 收集沉淀, 用超纯水洗涤3次, 直至上清液无色, 沉淀即为NPs-CaAs/DOX。
制备TPP-LPs-CaAs/DOX 精密称取DSPE-PEG2000 0.72 mg、DSPE-PEG2000-TPP 0.18 mg、DSPC 6.30 mg、胆固醇2.80 mg, 置于100 mL圆底烧瓶中, 加入5 mL二氯甲烷和10 mL无水乙醇, 超声至完全溶解。于40 ℃减压旋转成膜, 除去有机溶剂。加入一定量NPs-CaAs/DOX分散液, 于40 ℃水化20 min, 随后取出至EP管中超声4 min, 即得TPP-LPs-CaAs/DOX。脂质体悬液于8 000 ×g离心10 min, 除去空囊泡和磷脂碎片。
粒径、zeta电位及形态表征 配制一定浓度NPs-CaAs、NPs-CaAs/DOX和TPP-LPs-CaAs/DOX悬液, 采用马尔文粒度分析仪分别测定其粒径和zeta电位; 用100 μL移液枪吸取适量纳米悬液, 滴于100目碳支持膜铜网的有膜正面, 置于红外干燥箱中快速干燥, 随后通过TEM拍摄纳米粒的外貌形态。
紫外吸收测定 取一定量DOX·HCl、NPs-CaAs/DOX和TPP-LPs-CaAs/DOX悬液于石英比色皿中, 用紫外可见近红外光谱仪测200~700 nm处的紫外吸收曲线。
体外释放研究 选用pH值分别为7.4、5.0的PBS为释放介质, 精密量取含TPP-LPs-CaAs/DOX的悬液(DOX浓度50 μg·mL-1) 1 mL, 置于预处理的透析袋(相对分子质量8 000~14 000) 中, 排除气泡后密封, 置于10 mL释放介质中, 于(37.0 ± 0.5) ℃恒温水浴振荡(100 r·min-1), 分别于0、1、2、4、6、8、12、24 h取样1 mL, 并立即补加等量同温同pH值新鲜释放介质, 样品用酶标仪测450 nm处吸收值, 计算累积释药率并绘制释药曲线。
体外协同作用评价 取对数生长期的MCF-7/DOX细胞, 以1×104个/孔接种于96孔板上, 于37 ℃恒温培养箱中培养12 h, 除去培养基后加入含有不同DOX和ATO比例(1∶0.5、1∶1、1∶2, ATO以砷元素的量计算, 下同) 的不含FBS培养基, 培养12 h后更换培养基为含0.5 mg·mL-1 MTT的培养基, 继续培养4 h后除去培养基, 加入150 μL DMSO溶解甲瓒并用排枪吹匀; 用酶标仪测定490 nm处的吸光度, 并通过Chou-Talalay方法计算联合指数(combination index, CI), 分析两药协同作用效果。
体外毒性评价 取对数生长期的MCF-7/DOX细胞, 以1×104个/孔接种于96孔板上, 于37 ℃恒温培养箱中培养12 h, 除去培养基后加入含有DOX·HCl、ATO或各组纳米粒的不含FBS培养基(NPs-CaAs/DOX和TPP-LPs-CaAs/DOX), DOX含量分别为2、5、10、15、20 μg·mL-1。培养12 h后除去培养基, 加入含0.5 mg·mL-1 MTT的培养基, 继续培养4 h后除去培养基, 加入150 μL DMSO溶解甲瓒并用排枪吹匀; 用酶标仪测定490 nm处的吸光度, 并计算细胞存活率及药物抑制率。
细胞摄取 取对数生长期的MCF-7/DOX细胞, 以5×105个/孔接种于激光共聚焦皿中, 于37 ℃恒温培养箱中培养12 h, 加入含有DOX或各组纳米粒的不含FBS培养基(NPs-CaAs/DOX和TPP-LPs-CaAs/DOX), DOX含量为5 μg·mL-1, 对照组为不含药物和FBS的培养基组。培养6 h后除去培养基, PBS洗3次, 用线粒体绿色荧光探针(100 nmol·L-1) 染色45 min, 除去染料后, PBS洗3次, 4%多聚甲醛固定10 min, 随后吸除, 并用PBS洗3次; 然后加入含有核酸染料DAPI (0.25 μg·mL-1) 的培养基孵育20 min, PBS洗3次除去细胞表面的染料, 最后置于激光扫描共聚焦显微镜(confocal laser scanning microscope, CLSM) 下观察。
线粒体呼吸链复合体Ι活性测定 取对数生长期的MCF-7/DOX细胞, 以5×105个/孔接种于6孔板中, 于37 ℃恒温培养箱中培养12 h, 加入含有DOX或各组纳米粒的不含FBS培养基(NPs-CaAs/DOX和TPP-LPs-CaAs/DOX), DOX含量为15 μg·mL-1。培养12 h后除去培养基, PBS洗3次, 用细胞刮刀收集细胞于1 mL离心管中, 线粒体呼吸链复合体Ι活性检测用线粒体复合体Ι活性检测试剂盒测定。
细胞中ATP含量测定 取对数生长期的MCF-7/DOX细胞, 以1×105个/孔接种于6孔板中, 于37 ℃恒温培养箱中培养12 h, 加入含有DOX或各组纳米粒的不含FBS培养基(NPs-CaAs/DOX和TPP-LPs-CaAs/DOX), DOX含量为15 μg·mL-1。培养12 h后除去培养基, PBS洗3次, ATP含量用检测试剂盒进行测定。
蛋白免疫印迹杂交(Western blot) 法检测P-gp蛋白含量 取对数生长期MCF-7/DOX细胞, 以5×105个/孔接种于6孔板中, 于37 ℃恒温培养箱中培养12 h, 加入含有DOX或各组纳米粒的不含FBS培养基(NPs-CaAs/DOX和TPP-LPs-CaAs/DOX), DOX含量为15 μg·mL-1。培养12 h后除去培养基, 提取细胞内总蛋白, 用BCA法测定蛋白浓度, 取20 μg总蛋白进行SDS聚丙烯酰胺凝胶电泳(SDS polyacrylamide gel electrophoresis, SDS-PAGE), 转膜, 5%脱脂牛奶封闭非特异性抗原, 分别加入P-gp一抗(1∶1 000稀释) 于4 ℃孵育过夜, TBST洗膜后加入二抗(1∶5 000) 室温孵育2 h, TBST洗膜后用显影成像, 得到蛋白免疫印记条带, 以GAPDH蛋白条带作为参照。
结果与讨论 1 NPs-CaAs、NPs-CaAs/DOX和TPP-LPs-CaAs/DOX的形态表征TPP-LPs-CaAs/DOX制备过程见图 2A。首先, 通过水热法合成NPs-CaAs, 利用静电吸附作用负载DOX, 最后采用薄膜水化法制备TPP-LPs-CaAs/DOX。如图 2B所示, 透射电镜结果显示制备的NPs-CaAs、NPs-CaAs/DOX及TPP-LPs-CaAs/DOX均呈球状结构且粒径均一。采用动态光散射仪测定各组制剂平均水合粒径以及zeta电位, 如图 2C所示, NPs-CaAs的高表面能导致纳米粒呈团聚状态, 水合粒径为(921 ± 12) nm, zeta电位为(-23.3 ± 0.8) mV; 采用静电吸附法负载DOX, 负载DOX后NPs-CaAs/DOX的分散性有所改善, 水合粒径减少至(403 ± 19) nm, zeta电位为(-14.9 ± 0.9) mV; 经磷脂双分子层包裹后, TPP-LPs-CaAs/DOX的分散性进一步改善, 水合粒径为(261 ± 7) nm, zeta电位为(-9.6 ± 1.3) mV。如图 2D所示, TPP-LPs-CaAs/DOX中DOX的载药量和包封率分别为22.6%和84.0%, ATO的载药量和包封率为23.1%和75.2%。由紫外-可见光吸收谱可知(图 2E), NPs-CaAs/DOX与TPP-LPs-CaAs/DOX在450 nm处吸收值有所增加, zeta电位变化情况表明DOX的负载与脂质囊泡包裹成功。

|
Figure 2 Synthesis and characterization of NPs-CaAs, NPs-CaAs/DOX, and TPP-LPs-CaAs/DOX. A: Preparation process of NPs-CaAs, NPs-CaAs/DOX, and TPP-LPs-CaAs/DOX; B: Representative transmission electron microscope (TEM) images of various nano-formulations; C: Particle size and zeta potential of various nano-formulations (n = 3); D: Drug loading efficiency (DL) and encapsulation efficiency (EE) of ATO and DOX in TPP-LPs-CaAs/DOX; E: UV-vis spectrum of free DOX, NPs-CaAs/DOX, and TPP-LPs-CaAs/DOX; F: The pH-responsive DOX release from TPP-LPs-CaAs/DOX at different pH values. n = 3, |
为考察TPP-LPs-CaAs/DOX的pH响应释放DOX特性, 分别选用pH值为7.4、5.0的PBS作为释放介质。结果如图 2F所示, 在pH 7.4、5.0的PBS中DOX的释放百分率分别为15%、60%, 证明TPP-LPs-CaAs/DOX在酸性环境中具有良好DOX释放能力, 在正常生理环境pH条件下稳定。
3 DOX和ATO的细胞毒性及协同作用为了证明DOX和ATO的体外协同作用, 采用MTT法测试了单独DOX和ATO对MCF-7/DOX细胞的毒性作用, 并计算两种单药的IC50值。如图 3A~C所示, MCF-7/DOX细胞中DOX的IC50值为15.0 ± 0.6 μg·mL-1, ATO的IC50值为17.2 ± 1.8 μg·mL-1。接下来基于Chou-Talalay方法进一步研究了DOX和ATO的协同作用, 并利用CI进行系统评估。结果分析(图 3D) 显示, 在受累细胞分数(fraction affected) 等于0.5处, ATO和DOX的质量比为2∶1时具有最好的协同抑制效果, 比值为1∶1时次之, 0.5∶1时协同抑制效果最差; 由于载药量限制, TPP-LPs-CaAs/DOX中药物质量比只能达到1∶1, 但仍具有较好协同抑制效果。

|
Figure 3 Effects of DOX and ATO on the cell viability and half maximal inhibitory concentration (IC50) of MCF-7/DOX. After treated with various concentrations of DOX and ATO for 12 h, the cell viability (A, DOX; B, ATO) and IC50 (C) were examined, respectively; D: Trends of combination index (CI) with different ratiometric mixtures of DOX and arsenic (As) for MCF-7/DOX. n = 3, |
为研究细胞对药物的摄取情况, 采用激光共聚焦法观察药物在细胞中的分布情况。如图 4A所示, DOX组由于外排蛋白P-gp的存在, 只有少量药物进入细胞, 红色荧光极弱可忽略不计, NPs-CaAs/DOX组及TPP-LPs-CaAs/DOX组的红色荧光较强且分布在细胞质中, 证明纳米粒大部分被细胞摄取。由图 4B可知, NPs-CaAs/DOX组的红色荧光与绿色荧光强度曲线不同步, 表明药物虽被细胞摄取但只有少量进入线粒体, 而TPP-LPs-CaAs/DOX组的红色荧光和绿色荧光高度重叠, 证实了其良好的线粒体靶向效果。
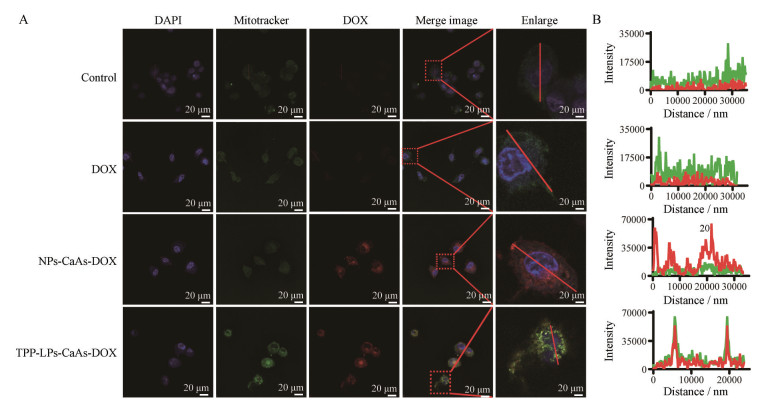
|
Figure 4 The distribution of drug in the MCF-7/DOX cells. A: Representative CLSM images of treated with DOX, NPs-CaAs/DOX, TPP-LPs-CaAs/DOX, respectively. All the groups have the same concentration of DOX. Cell nuclei: Blue fluorescence; DOX: Red fluorescence; Mitochondria: Green fluorescence; B: Fluorescence intensity profiles of regions of interest (along red lines in the images). The group of control treated with blank medium. Red channel: λex 514 nm (2%), λem 605 nm, detector gain 700; Green channel: λex 488 nm (5%), λem 514 nm, detector gain 700; Blue channel: λex 405 nm (2%), λem 453 nm, detector gain 500. CLSM: Confocal laser scanning microscope; DAPI: 2-(4-Amidinophenyl)-6-indolecarbamidine dihydrochloride |
采用MTT法考察NPs-CaAs/DOX和TPP-LPs-CaAs/DOX对MCF-7/DOX细胞的毒性作用和IC50。如图 5A所示, 当具有DOX耐药性的MCF-7/DOX细胞经不同组药物处理后, 均表现出一定的浓度依赖性肿瘤杀伤作用; 由于Ca2+的存在降低了细胞的耐药性以及ATO和DOX的联合用药, NPs-CaAs/DOX组的细胞存活率低于DOX组(图 5A、3A), 但由于缺乏线粒体靶向性, 只有部分Ca2+发挥作用; TPP-LPs-CaAs/DOX具有对细胞最强的杀伤效果, 由于TPP的修饰显著提高线粒体Ca2+局部浓度, 显著增加细胞损伤程度。图 5B表明, NPs-CaAs/DOX和TPP-LPs-CaAs/DOX的IC50分别为10.2 ± 0.5 μg·mL-1、6.47 ± 0.18 μg·mL-1, 其中TPP-LPs-CaAs/DOX组的毒性显著高于NPs-CaAs/DOX组, 其耐药逆转倍数相对于DOX组为2.33。

|
Figure 5 Cell viability (A) and IC50 (B) of MCF-7/DOX cells after treated with various concentrations nanoparticles for 12 h; C: The relative activity of complex I; D: ATP content of MCF-7/DOX cells; E: Western blot analysis of P-gp in MCF-7/DOX; F: Corresponding gray analysis of P-gp from Western blot. All the groups have the same concentration of DOX. n = 3, |
线粒体是细胞能量工厂, 线粒体呼吸链复合体Ι是氧化呼吸过程中起关键作用的酶, 一旦其活性降低, 下游呼吸链就会被阻断, 细胞内ATP产生受到抑制。如图 5C所示, DOX组复合体Ⅰ的活性变化甚微, 其他组处理后复合体Ⅰ的活性均有不同程度的降低, 而TPP-LPs-CaAs/DOX组对复合体Ⅰ的活性抑制率最大。外排蛋白P-gp转运至细胞膜发挥细胞对药物的外排作用需要依靠ATP供能, ATP的减少能够很大程度地抑制这种作用。图 5D显示不同组药物处理后细胞中ATP的变化, 结果表明DOX组ATP生成显著增多, 可能是DOX加入引起细胞的耐药反应所致, NPs-CaAs/DOX组能够在一定程度上抑制ATP的生成, 而TPP-LPs-CaAs/DOX组具有抑制ATP生成的最佳效果, 抑制率达到了94.22%。
6.2 细胞中外排蛋白P-gp表达外排蛋白P-gp作为肿瘤耐药性产生的关键蛋白, 其在肿瘤细胞中的表达高低可能直接影响药物能否更好发挥治疗效果。采用Western blot技术, 测定耐药细胞中P-gp蛋白的表达活性。如图 5E、F所示, DOX组对P-gp蛋白表达影响不明显, NPs-CaAs/DOX组对P-gp蛋白表达有一定的抑制作用(P-gp/GADPH = 0.65), TPP-LPs-CaAs/DOX组具有最强的抑制效果(P-gp/GADPH = 0.53)。结果表明, TPP-LPs-CaAs/DOX通过TPP的靶向作用将Ca2+输送至细胞线粒体中, 导致Ca2+失衡进而抑制P-gp蛋白的表达。
结论本研究构建了负载DOX的亚砷酸钙线粒体靶向脂质体, 达到克服耐药性以及联合治疗肿瘤的预期目标。该脂质体能够通过TPP+的线粒体靶向作用, 特异性递送Ca2+至线粒体, 破坏细胞水平的离子平衡, 抑制外排蛋白P-gp表达; 通过降低线粒体呼吸链复合体Ι酶的活性, 减少ATP生成, 阻止外排蛋白P-gp向细胞膜转运。除克服肿瘤耐药性之外, 利用Ca2+和AsO33-形成的纳米粒, 联用DOX协同杀死肿瘤细胞。结果表明, TPP-LPs-CaAs/DOX有良好的pH响应性, 较高的线粒体靶向性及摄取率, 从而显著降低ATP生成以及外排蛋白P-gp表达, 表明其能够克服肿瘤细胞耐药性。与单独使用DOX相比, TPP-LPs-CaAs/DOX对肿瘤细胞的杀伤程度更高, 证实DOX与ATO联用能够提高肿瘤的治疗效果。综上所述, 克服肿瘤耐药性以提高药物化疗效果是临床治疗癌症的关键, 本研究通过破坏Ca2+浓度平衡以克服肿瘤耐药性, 并进一步联用药物实现协同治疗, 为解决临床上肿瘤耐药性、联合用药问题提供新策略与新方法。
作者贡献: 张钶负责文献查阅、实验设计、实验操作、数据分析、论文初稿撰写及修改; 岳天祥负责实验操作、样品采集和论文后续修改; 程梦莹、梁曾颖、徐恒武负责实验操作、文章图表格式处理及论文修改; 李范珠、朴寄纲和郑红月参与理论指导、实验设计、论文修改及定稿。
利益冲突: 本文所有作者均同意发表, 所有作者均声明不存在利益冲突。
| [1] |
Szakács G, Paterson JK, Ludwig JA, et al. Targeting multidrug resistance in cancer[J]. Nat Rev Drug Discov, 2006, 5: 219-234. DOI:10.1038/nrd1984 |
| [2] |
Housman G, Byler S, Heerboth S, et al. Drug resistance in cancer: an overview[J]. Cancers (Basel), 2014, 6: 1769-1792. DOI:10.3390/cancers6031769 |
| [3] |
Steeg PS. Targeting metastasis[J]. Nat Rev Cancer, 2016, 16: 201-218. DOI:10.1038/nrc.2016.25 |
| [4] |
Zhou ML, Li LJ, Li L, et al. Overcoming chemotherapy resistance via simultaneous drug-efflux circumvention and mitochondrial targeting[J]. Acta Pharm Sin B, 2019, 9: 615-625. DOI:10.1016/j.apsb.2018.11.005 |
| [5] |
Chen ZL, Shi TL, Zhang L, et al. Mammalian drug efflux transporters of the ATP binding cassette (ABC) family in multidrug resistance: a review of the past decade[J]. Cancer Lett, 2016, 370: 153-164. DOI:10.1016/j.canlet.2015.10.010 |
| [6] |
Shi CJ, Fu LW. Advances in the study of expression and regulation of P-glycoprotein[J]. Acta Pharm Sin (药学学报), 2007, 42: 911-916. |
| [7] |
Paggio A, Checchetto V, Campo A, et al. Identification of an ATP-sensitive potassium channel in mitochondria[J]. Nature, 2019, 572: 609-613. DOI:10.1038/s41586-019-1498-3 |
| [8] |
Han K, Zhu JY, Jia HZ, et al. Mitochondria-targeted chimeric peptide for trinitarian overcoming of drug resistance[J]. ACS Appl Mater Interfaces, 2016, 8: 25060-25068. DOI:10.1021/acsami.6b06522 |
| [9] |
Yang D, Yang GX, Yang PP, et al. Assembly of Au plasmonic photothermal agent and iron oxide nanoparticles on ultrathin black phosphorus for targeted photothermal and photodynamic cancer therapy[J]. Adv Funct Mater, 2017, 27: 1700371. DOI:10.1002/adfm.201700371 |
| [10] |
Xu LH, Tong GH, Song QL, et al. Enhanced intracellular Ca2+ nanogenerator for tumor-specific synergistic therapy via disruption of mitochondrial Ca2+ homeostasis and photothermal therapy[J]. ACS Nano, 2018, 12: 6806-6818. DOI:10.1021/acsnano.8b02034 |
| [11] |
Yuan K, Fu RZ, Shi CW, et al. Progress in the study on reversal of multidrug resistance induced by P-glycoprotein[J]. Med Recapit (医学综述), 2006, 3: 168-170. |
| [12] |
Kuerban K, Gao XW, Zhang H, et al. Doxorubicin-loaded bacterial outer-membrane vesicles exert enhanced anti-tumor efficacy in non-small-cell lung cancer[J]. Acta Pharm Sin B, 2020, 10: 1534-1548. DOI:10.1016/j.apsb.2020.02.002 |
| [13] |
Wang PX, Wang MH, Hu YH, et al. Isorhapontigenin protects against doxorubicin-induced cardiotoxicity via increasing YAP1 expression[J]. Acta Pharm Sin B, 2021, 11: 680-693. DOI:10.1016/j.apsb.2020.10.017 |
| [14] |
Zhang RY, Li DL, Yang Z, et al. Mechanisms of doxorubicin resistance of breast cancer MCF-7 cells mediated by exosomes[J]. Acta Pharm Sin (药学学报), 2019, 54: 861-866. |
| [15] |
Li X, Wu XH, Yang HY, et al. A nuclear targeted Dox-aptamer loaded liposome delivery platform for the circumvention of drug resistance in breast cancer[J]. Biomed Pharmacother, 2019, 117: 109072. DOI:10.1016/j.biopha.2019.109072 |
| [16] |
Chen XJ, Zou JF, Zhang K, et al. Photothermal/matrix metalloproteinase-2 dual-responsive gelatin nanoparticles for breast cancer treatment[J]. Acta Pharm Sin B, 2021, 11: 271-282. DOI:10.1016/j.apsb.2020.08.009 |
| [17] |
Deffie AM, Alam T, Seneviratne C, et al. Multifactorial resistance to adriamycin: relationship of DNA repair, glutathione transferase activity, drug efflux, and P-glycoprotein in cloned cell lines of adriamycin-sensitive and -resistant P388 leukemia[J]. Cancer Res, 1988, 48: 3595-3602. |
| [18] |
Fu X, Li YS, Zhao J, et al. Will arsenic trioxide benefit treatment of solid tumor by nano-encapsulation?[J]. Mini Rev Med Chem, 2020, 20: 239-251. DOI:10.2174/1389557519666191018155426 |
| [19] |
Cioloboc D, Kurtz DM. Targeted cancer cell delivery of arsenate as a reductively activated prodrug[J]. J Biol Inorg Chem, 2020, 25: 441-449. DOI:10.1007/s00775-020-01774-3 |
| [20] |
Ye Y, Ricard L, Siblany L, et al. Arsenic trioxide induces regulatory functions of plasmacytoid dendritic cells through interferon-α inhibition[J]. Acta Pharm Sin B, 2020, 10: 1061-1072. DOI:10.1016/j.apsb.2020.01.016 |
| [21] |
Zhang YK, Dai CL, Yuan CG, et al. Establishment and characterization of arsenic trioxide resistant KB/ATO cells[J]. Acta Pharm Sin B, 2017, 7: 564-570. DOI:10.1016/j.apsb.2017.04.001 |
| [22] |
Liu HY, Zhang ZJ, Chi XQ, et al. Arsenite-loaded nanoparticles inhibit PARP-1 to overcome multidrug resistance in hepatocellular carcinoma cells[J]. Sci Rep, 2016, 6: 31009. DOI:10.1038/srep31009 |
| [23] |
Wang XL, Kong L, Zhao JY, et al. Arsenic trioxide in the mechanism of drug resistance reversal in MCF-7/ADM cell line of human breast cancer[J]. Chin J Oncol (中华肿瘤杂志), 2002, 4: 31-35. |
| [24] |
Yue QX, Yu H, He T, et al. Research progress on anti-cancer mechanisms of arsenic trioxide and artemisinin[J]. Acta Pharm Sin (药学学报), 2016, 51: 208-214. |
| [25] |
Pace C, Dagda R, Angermann J. Antioxidants protect against arsenic induced mitochondrial cardio-toxicity[J]. Toxics, 2017, 5: 38. DOI:10.3390/toxics5040038 |
| [26] |
Fei W, Li C, Tao J, et al. Construction of arsenic-metal complexes loaded nanodrugs for solid tumor therapy: a mini review[J]. Int J Pharm, 2020, 583: 119385. DOI:10.1016/j.ijpharm.2020.119385 |
| [27] |
Nguyen TN, Nguyen TT, Nghiem THL, et al. Optical properties of doxorubicin hydrochloride load and release on silica nanoparticle platform[J]. Molecules, 2021, 260: 3968. |
| [28] |
Qin JB, Gong NQ, Liao ZH, et al. Recent progress in mitochondria-targeting-based nanotechnology for cancer treatment[J]. Nanoscale, 2021, 13: 7108-7118. DOI:10.1039/D1NR01068A |
| [29] |
Liu AY, Hou XS, Ding Y. Advances of antineoplastic agents based on mitochondrial targeting mechanism[J]. Acta Pharm Sin (药学学报), 2017, 52: 879-887. |
| [30] |
Han X, Su RJ, Huang XQ, et al. Triphenylphosphonium-modified mitochondria-targeted paclitaxel nanocrystals for overcoming multidrug resistance[J]. Asian J Pharm Sci, 2019, 14: 569-580. DOI:10.1016/j.ajps.2018.06.006 |
 2021, Vol. 56
2021, Vol. 56


