2. 上海中医药大学, 上海中医健康服务协同创新中心, 上海 201203
2. Shanghai Innovation Center of TCM Health Service, Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China
脑胶质瘤是脑部肿瘤中最常见且恶性程度最高的肿瘤[1]。根据2013~2017年癌症数据统计报告显示, 全球每10万人中约有23.79人患有原发性脑肿瘤和其他中枢神经系统肿瘤, 其中29.7%为恶性肿瘤, 脑胶质瘤占恶性肿瘤的80%[2, 3]。脑胶质瘤的中位生存期极短, 在进行外科手术、放疗和化疗的情况下, 原发性胶质母细胞瘤的中位无进展生存期为6.9个月, 总生存期为14.6个月[4]。由于脑胶质瘤与正常脑组织界限不明显[5], 导致传统手术不能完全切除, 术后复发率高达100%。血脑屏障(BBB) 是中枢神经系统与毛细血管之间的高度选择性和相互作用的动态屏障, 其是中枢神经系统的半透性保护膜, 由于血脑屏障的存在, 药物递送入脑严重受限[6]。事实上, 超过98%的小分子药物和几乎100%大分子药物都不能通过BBB[7]。因此, 亟需高效的脑部靶向系统提高现有脑胶质瘤药物治疗效果。
为了克服这些问题, 目前采用脑部靶向的策略主要有细胞穿膜肽介导、纳米递药系统、鼻腔给药系统、P-gp (P-glycoprotein) 抑制, 以提高脑部疾病治疗效果[8, 9]。鼻腔给药是一种非侵入性给药方法, 可以绕过BBB将药物直接递送进入中枢神经系统[10]。药物经鼻给药后, 主要经过嗅球和三叉神经通路转运, 直接进入脑部[11]。来源于传统中药的芳香“开窍”药冰片(borneol, Bo) 是一种单萜类化合物, 可以有效促进药物入脑[12]。此外, Bo还能增加药物透过鼻腔黏膜渗透[13], 进而提高药物经鼻入脑转运及在脑组织中的分布。作者前期研究发现, 经Bo修饰的纳米粒可以通过调节P-gp, 促进纳米粒的经鼻入脑转运[14, 15]。RGD肽是一类广泛存在于体内, 含有精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp) 的短肽[16, 17]。其介导细胞间和细胞与细胞外基质间连接, 可与肿瘤细胞上高表达的整合素ανβ3受体相结合而被胶质瘤血管内皮或肿瘤细胞摄取[18]。因此, 将Bo的经鼻给药脑靶向性和RGD修饰纳米给药系统的肿瘤靶向性相结合, 有望进一步改善脑胶质瘤的治疗效果。
多烯紫杉醇(docetaxel, DTX) 是一种复杂的二萜生物碱, 具有广谱的抗实体瘤的作用, 如卵巢癌、乳腺癌、肺癌和脑肿瘤[19, 20]。文献报道DTX在体外胶质瘤模型上有良好的治疗效果, 但由于其水溶性差, 分子质量高, 导致在体内胶质瘤模型上的治疗效果较差[21]。因此, 设计脑部靶向的递药系统对于提高DTX的抗胶质瘤治疗至关重要。
本研究构建DTX-Bo-RGD-NPs给药系统, 以DTX为模型药物[22], 研究该系统对于脑胶质瘤的治疗效果, 并对DTX-Bo-RGD-NPs的粒径、电位、载药量、释放及稳定性进行表征。在16HBE细胞和C6细胞体外模型上, 研究Bo-RGD-NPs经鼻给药的体外脑肿瘤靶向效果。在体内脑胶质瘤模型中验证其体内靶向性并进行药效学研究。采用MPEG-PLGA聚合物作为载体, 修饰Bo和RGD, 利用Bo引药上行的特点, 发挥经鼻入脑靶向的作用, RGD可以将纳米粒进一步靶向至肿瘤部位。这一新型冰片/RGD双修饰纳米粒有望为难治性疾病脑胶质瘤的治疗提供一种新型的经鼻给药治疗手段, 提高难治性脑胶质瘤的治疗效果。
材料与方法药品与试剂 多烯紫杉醇(纯度 > 99.7%, 上海天伟生物制药有限公司); MPEG和NHS-PEG (北京键凯科技有限公司); 莰胺、DIPEA、HEPES、香豆素6 (coumarin-6, 纯度≥ 99%)、DAPI (4', 6-diamidino-2-phenylindole; 美国Sigma公司); 氯仿、乙醚、氘代氯仿、NaCl、Na2HPO4·7H2O和乙腈(国药集团化学试剂有限公司); 荧光染料DiR (1, 1-dioctadecyl-3, 3, 3, 3-tetramethylindotricarbocyaine iodide, 上海翊圣生物科技有限公司); DMEM高糖培养基、胎牛血清(FBS)、青霉素(100 u·mL-1) 和链霉素(100 μg·mL-1) (美国Gibco公司); RGD (杭州中肽生化有限公司); TUNEL试剂盒、BCA试剂盒(上海碧云天生物技术有限公司)。
仪器 HPLC (SPD-20AD) 高效液相色谱系统(日本岛津公司); NICOMPZLS 380激光粒径和zeta电位测定仪(美国Santa Barbara公司); Centrifuge 5810R低温离心机(德国Eppendorf公司); Buchi R-215旋转蒸发仪(瑞士步琪公司); JEM-1400透射电镜(日本电子公司); HEDA Class100细胞培养箱、Varioskan Flash全波长扫描仪(美国赛默飞世尔科技公司); Spectra MAX190酶标仪和高内涵成像仪ImageXpress Micro Confocal (美国Molecular Device公司); 小动物活体成像仪(美国MaestroTM EX-RRO公司)。
动物与细胞株 雄性SD (Sprague Dawley) 大鼠, SPF级, 220~250 g, 由上海中医药大学动物中心提供, 所有对动物的处理和操作均通过上海中医药大学伦理委员会的批准[许可证号: SYXK (沪) 2014-0008]; 16HBE细胞和C6细胞(上海中国科学院细胞库)。
DTX-NPs、DTX-RGD-NPs、DTX-Bo-NPs和DTX-Bo-RGD-NPs的制备 Bo-PEG-PLGA由课题组前期通过NHS-PEG-PLGA和莰胺反应制得(相对分子质量: 43 743)[14]。通过乳化-溶媒挥发法制备DTX-NPs、DTX-RGD-NPs、DTX-Bo-NPs和DTX-Bo-RGD-NPs。DTX-Bo-RGD-NPs制备方法如下: 精密称取10 mg MPEG-PLGA、Bo-PEG-PLGA和NHS-PEG-PLGA (8∶1∶1) 溶于含有0.75 mg DTX的1 mL乙腈溶液, 为有机相, 超声使其完全溶解。将有机相缓慢地滴入2 mL去离子水的水相中, 1 000 r·min-1室温搅拌1 h, 旋转蒸发完全除去乙腈, 加入30 μL 1 mg·mL-1 RGD, 室温300 r·min-1搅拌9 h, 即得DTX-Bo-RGD-NPs。DTX-NPs、DTX-RGD-NPs和DTX-Bo-NPs制备参照上述方法, 其中, DTX-NPs和DTX-RGD-NPs制备时材料为MPEG-PLGA∶NHS-PEG-PLGA (9∶1, w/w); DTX-Bo-NPs制备时材料为MPEG-PLGA∶Bo-PEG-PLGA (9∶1, w/w)。DTX-NPs和DTX-Bo-NPs搅拌过夜时以30 μL去离子水替代RGD肽。
DTX-NPs、DTX-RGD-NPs、DTX-Bo-NPs和DTX-Bo-RGD-NPs的表征 所制得DTX-NPs、DTX-RGD-NPs、DTX-Bo-NPs和DTX-Bo-RGD-NPs经1%~2% (w/v, pH 7.0) 磷钨酸负染色后, 透射电镜下观察纳米粒形态。使用美国NICOMPZLS 380激光散射粒度仪测定纳米粒的粒径和zeta电位, 观察其粒径分布情况。
DTX-NPs、DTX-RGD-NPs、DTX-Bo-NPs和DTX-Bo-RGD-NPs载药量测定 取制备得到的纳米粒溶液1 mL置于离心管中, 4 ℃、11 000 r·min-1离心30 min, 弃上清, 沉淀加入1 mL乙腈, 涡旋使其溶解, 4 ℃、11 000 r·min-1离心5 min, 取上清稀释, 进行含量测定。根据下列公式(1) 计算载药量(drug loading capacity, DLC):
| $ \mathrm{D}\mathrm{L}\mathrm{C}\left(\mathrm{\%}\right)=\left[\frac{{W}_{1}}{{W}_{1}+{W}_{2}}\right]\times 100\mathrm{ }\mathrm{\%} $ | (1) |
其中, W1指包裹进纳米粒中的DTX的量, W2指纳米材料的量。
HPLC测定使用5 μm Kromasil 4.6 mm × 250 mm色谱柱, 柱温30 ℃, 流速为1.0 mL·min-1。检测波长230 nm, 流动相为乙腈和水(55∶45, v/v)。
DTX-NPs、DTX-RGD-NPs、DTX-Bo-NPs和DTX-Bo-RGD-NPs粒径的稳定性 分别将制得的DTX-NPs、DTX-RGD-NPs、DTX-Bo-NPs和DTX-Bo-RGD-NPs纳米粒加入4和37 ℃的磷酸盐缓冲液(PBS, 含有0.2% Tween-80), 于设定时间点(1、2、4、8、12、24和48 h) 取样测定粒径, 观察其在4及37 ℃介质中粒径的稳定性。
DTX-NPs、DTX-RGD-NPs、DTX-Bo-NPs和DTX-Bo-RGD-NPs体外释药特性 采用透析法[23]考察所制得纳米粒的体外释药特性。取制得的纳米粒于4 ℃、11 000 r·min-1条件离心30 min后弃上清, 将沉淀用1 mL含0.2% Tween-80的PBS复溶(DTX浓度为22.5 μg·mL-1), 加入透析装置, 立即置于37 ℃、100 r·min-1恒温水浴摇床中, 并于1、2、4、8、12、24和48 h取样。根据不同时间点DTX释放量占DTX药物总量的比例, 计算DTX在0.2% Tween-80 PBS中的累计释放百分率。
Coumarin 6-NPs、coumarin 6-RGD-NPs、coumarin 6-Bo-NPs和coumarin 6-Bo-RGD-NPs的制备 Coumarin 6-Bo-RGD-NPs的制备方法如下: 与DTX-Bo-RGD-NPs制备方法一致, 制备过程中将0.75 mg DTX替换为0.02 mg coumarin-6, 除去乙腈后, 用10 mL PBS过葡聚糖凝胶柱除去游离coumarin-6, 而后离心, 弃上清, 复溶沉淀, 加入30 μL 1 mg·mL-1 RGD溶液, 搅拌9 h, 即得coumarin 6-Bo-RGD-NPs。Coumarin 6-NPs、coumarin 6-RGD-NPs和coumarin 6-Bo-NPs与上述制备方法一致, 材料比同DTX-NPs、DTX-RGD-NPs和DTX-Bo-NPs。
Coumarin 6-NPs、coumarin 6-RGD-NPs、coumarin 6-Bo-NPs和coumarin 6-Bo-RGD-NPs的体外摄取实验 将C6和16HBE细胞分别以每毫升1×105个的密度接种至24孔板中, 培养12 h后, 加入用HBSS稀释后的coumarin 6-NPs、coumarin 6-RGD-NPs、coumarin 6-Bo-NPs和coumarin 6-Bo-RGD-NPs (coumarin-6浓度为2.29 μg·mL-1) 的纳米粒孵育1 h后, 弃去纳米粒, 进行DAPI染色10 min, 于高内涵成像仪下观察细胞, 考察4种纳米粒被16HBE和C6细胞摄取的情况。取400 μL 1% Triton-X 100裂解液于冰上处理细胞, 取100 μL裂解液用Varioskan Flash全波长扫描式多功能读数仪测定coumarin-6浓度, 另取20 μL裂解液经BCA试剂盒用酶标仪测定细胞的蛋白浓度。以“摄取指数(uptake index)”作为评价指标, 即药物浓度与细胞蛋白浓度的比值(ng·mg-1), 表示单位浓度细胞蛋白中所含有的coumarin-6浓度。
NPs、RGD-NPs、Bo-NPs和Bo-RGD-NPs经鼻给药脑胶质瘤靶向性的体内评价 取处于对数生长期的C6细胞, 计数调节细胞浓度至每微升5×106个。雄性SD大鼠经腹腔麻醉(4%戊巴比妥钠溶液, 40 mg·kg-1) 后, 于前囟颅骨(+2 mm, -1 mm) 缓慢注入C6细胞悬液10 μL, 持针10 min后缓慢拔针, 缝合切口。荷瘤7天后, 随机分组, 经麻醉(4%戊巴比妥钠溶液, 40 mg·kg-1) 后, 大鼠鼻腔分别给予DiR-NPs、DiR-RGD-NPs、DiR-Bo-NPs和DiR-Bo-RGD-NPs溶液(DiR, 400 μg·kg-1), 8 h后处死大鼠, 收集脑组织, 生理盐水冲洗, 采用小动物活体成像仪观察各组织中DiR荧光信号, 并拍照记录。收集肿瘤组织称重, 加入10倍体积超纯水, 采用超声波细胞粉碎仪匀浆肿瘤组织, 用无水乙醇提取肿瘤组织中DiR后, 采用Varioskan Flash全波长扫描式多功能读数仪测定组织中DiR浓度。以单位质量脑肿瘤组织中DiR含量为评价指标(ng·g-1) 作为评价指标, 比较各组制剂经鼻给药后脑胶质瘤靶向性。
DTX-NPs、DTX-RGD-NPs、DTX-Bo-NPs和DTX-Bo-RGD-NPs经鼻给药抗脑胶质瘤作用的体内研究 取原位荷C6脑胶质瘤SD大鼠模型35只, 随机分成5组(每组7只), 于荷瘤后第7天开始给药, 大鼠鼻腔分别给予DTX-NPs、DTX-RGD-NPs、DTX-Bo-NPs和DTX-Bo-RGD-NPs溶液(DTX, 5 mg·kg-1), 3天1次, 共给5次, 记录各组荷瘤小鼠的死亡时间, 利用GraphPad Prism 8.0绘制生存曲线, 并计算比较各组的中位生存期。另取原位荷C6脑胶质瘤SD大鼠模型20只, 随机分成5组(每组4只), 给药方式如上所述, 给予载药纳米粒后, 处死大鼠, 收集脑组织, 制成石蜡切片, 进行TUNEL染色。
NPs、Bo-NPs、RGD-NPs和Bo-RGD-NPs纳米粒的体内体外安全性初步评价 将对数生长期的C6和16HBE细胞以每毫升1×105个的密度接种于96孔板中进行常规培养, 培养12 h后进行实验, 将材料浓度为0.1、0.25、0.5和1 mg·mL-1的未载药的NPs、RGD-NPs、Bo-NPs和Bo-RGD-NPs纳米粒溶液分别加入到铺有C6和16HBE的96孔板中, 孵育2 h, 取出纳米粒, 加入新鲜培液继续孵育22 h后, 弃去培液, 以MTT法评价纳米粒的体外安全性。
取SD大鼠模型30只, 随机分成5组(每组6只), 大鼠鼻腔分别给予DTX-NPs、DTX-RGD-NPs、DTX-Bo-NPs和DTX-Bo-RGD-NPs溶液(DTX, 5 mg·kg-1), 3天1次, 共给5次, 末次给药后第2天处死大鼠, 收集心肝脾肺肾各组织脏器, 制成石蜡切片, 进行H&E染色。
统计学分析 实验平均重复3次以上, 数据用
本课题采用的给药方式是鼻腔给药, 对于鼻腔给药的纳米制剂来说, 纳米粒的粒径越小越利于鼻腔吸收和脑内递送, 载药量越高对后续应用越有利。因此, 以粒径和载药量为指标, 考察对载药量和粒径影响较大的因素DTX投药量(mg)、有机相与水相比例和转速(r·min-1) 对所制得的纳米粒的粒径大小、分布以及载药量的影响, 对包载DTX的基本处方进行优化。如图 1所示, 有机相与水相比例和DTX投药量对纳米粒的粒径和载药量具有显著影响。转速对纳米粒的粒径和载药量影响不大。根据单因素试验结果(图 1), 确定DTX-Bo-RGD-NPs的最优处方如下: DTX投药量为0.75 mg, 有机相水相比例为1∶2, 转速为1 000 r·min-1。按照所得的最优处方和工艺, 制备3批DTX-Bo-RGD-NPs, 测定其粒径和载药量, 结果显示, 其粒径为140.50 ± 6.90 nm, 载药量为2.61% ± 0.29%, 电位为-28.28 ± 3.29 mV。
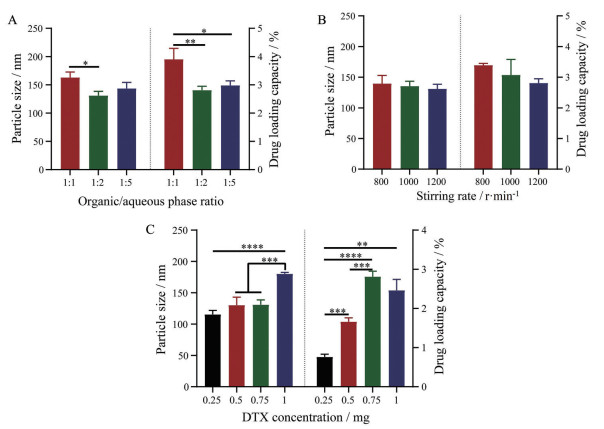
|
Figure 1 Effects of formulation factors on the particle size and drug loading capacity of nanoparticles. A: Organic phase and aqueous phase ratio; B: Stirring rate; C: Docetaxel (DTX) concentration. n = 3, |
透射电镜照片显示DTX-NPs、DTX-Bo-NPs、DTX-RGD-NPs和DTX-Bo-RGD-NPs四种纳米粒形态圆整、大小均一(图 2A)。不同时间点时纳米粒粒径的变化见图 2B, 结果显示纳米粒粒径在48 h内变化小于20%, 表明NPs具有良好的粒径稳定性。图 2C显示, DTX-NPs、DTX-Bo-NPs、DTX-RGD-NPs和DTX-Bo-RGD-NPs四种纳米粒48 h累积释放达80%, 表明纳米粒具有一定的缓释功能。

|
Figure 2 Characterization of DTX-NPs, DTX-Bo-NPs, DTX-RGD-NPs, and DTX-Bo-RGD-NPs. A: TEM photograph and size distribution, the scale bar is 500 nm; B: Size stability of different NPs at 4 ℃ and 37 ℃ PBS (containing 0.2% Tween-80); C: In vitro release of DTX, DTX-NPs, DTX-Bo-NPs, DTX-RGD-NPs, and DTX-Bo-RGD-NPs in 37 ℃ PBS (containing 0.2% Tween-80). n = 3, |
以荧光探针coumarin-6为示踪剂, 制备载coumarin-6的纳米粒, 用于观察不同修饰纳米粒在16HBE和C6细胞上的摄取情况(图 3)。透射电镜照片显示coumarin 6-NPs、coumarin 6-RGD-NPs、coumarin 6-Bo-NPs和coumarin 6-Bo-RGD-NPs纳米粒形态圆整、大小均一(图 3A)。纳米粒粒径、电位的变化见图 3B。所制得的4种纳米粒粒径均在140 nm左右, 呈高斯分布, 粒径分布较窄, 电位在-30 mV左右, 载药量均在0.11%左右。

|
Figure 3 Characterization of coumarin 6-NPs, coumarin 6-Bo-NPs, coumarin 6-RGD-NPs, and coumarin 6-Bo-RGD-NPs, and the uptake of NPs by 16HBE and C6 cells in vitro. A, B: TEM photograph and size-zeta potential distribution, the scale bar is 200 nm; C, D: Image and quantification of coumarin-6 fluorescence signal after uptake of different NPs by 16HBE; E, F: Image and quantification of coumarin-6 fluorescence signal after uptake of different NPs by C6. The scale bar is 100 μm. Blue: 4', 6-Diamidino-2-phenylindole (DAPI); Green: Coumarin-6. n = 6, |
鼻腔黏膜上皮细胞是纳米粒经鼻给药进入脑部的第一屏障[24]。Coumarin-6作为一种检测灵敏度很高的脂溶性荧光染料, 常作为探针被用来研究纳米递药系统的体内外行为[25, 26]。为了评价NPs的摄取, 以人类支气管上皮细胞16HBE作为鼻黏膜细胞模型, 由于它的细胞表面性质与鼻腔黏膜细胞类似, 故在研究药物鼻腔黏膜吸收时常用来作为体外模型[27], 研究coumarin 6-Bo-RGD-NPs纳米粒经鼻给药的体外靶向性能。
由给药1 h后16HBE和C6细胞上的coumarin-6荧光强度(图 3C、E), 可以看出, 在16HBE细胞上coumarin-6荧光信号以coumarin 6-Bo-RGD-NPs较强, 其次是coumarin 6-Bo-NPs、coumarin 6-NPs和coumarin 6-RGD-NPs组相当; 在C6细胞上coumarin-6荧光信号以coumarin 6-Bo-RGD-NPs较强, 其次是coumarin 6-Bo-NPs和coumarin 6-RGD-NPs, coumarin 6-NPs组最弱。
对coumarin-6的荧光信号定量分析结果显示(图 3D、F): ①在16HBE细胞上, 经Bo修饰后, 能够使载coumarin-6的纳米粒摄取增多, coumarin 6-Bo-RGD-NPs组的荧光信号强度最高, 是coumarin 6-Bo-NPs、coumarin 6-NPs和coumarin 6-RGD-NPs组的1.04、1.16和1.21倍; coumarin 6-Bo-NPs组的细胞摄取荧光信号强度是coumarin 6-NPs和coumarin 6-RGD-NPs组的1.12和1.17倍。②在C6细胞上, 经Bo和RGD修饰后, 能够使载coumarin-6的纳米粒摄取增多, coumarin 6-Bo-RGD-NPs组的摄取指数最高, 分别是coumarin 6-Bo-NPs、coumarin 6-NPs和coumarin 6-RGD-NPs组的1.19、2.02和1.23倍; coumarin 6-Bo-NPs和coumarin 6-RGD-NPs组的摄取指数分别是coumarin 6-NPs组的1.69和1.63倍。
3 DiR-Bo-RGD-NPs纳米粒的经鼻给药脑胶质瘤靶向性的体内研究采用活体成像研究载DiR的不同修饰纳米粒经鼻给药后的脑内分布。如图显示给予载DiR纳米粒8 h后, 在荷瘤大鼠的脑组织和脑肿瘤组织中观察到荧光(图 4A、B), 说明经Bo或RGD修饰后的纳米粒具有更好的靶向能力, 且经Bo和RGD双修饰后的纳米粒具有更好的脑靶向效果。对肿瘤组织内DiR荧光信号进行匀浆定量分析(图 4C), 结果显示DiR-Bo-RGD-NPs组脑肿瘤组织中DiR的累积量是control、NPs、Bo-NPs和RGD-NPs组的7.86、2.51、1.95和1.74倍; DiR-Bo-NPs和DiR-RGD-NPs组脑肿瘤组织中DiR的累积量分别是NPs组的1.29和1.45倍; DiR-RGD-NPs组脑肿瘤组织中DiR的累积量是DiR-Bo-NPs组的1.12倍。

|
Figure 4 Images of brain and brain tumor after administrated with DiR-NPs for 8 h treatment. The signal of DiR on orthotopic C6-bearing mice was monitored using IVIS spectrum. A: Brain; B: Brain tumor; C: Quantification of DiR fluorescence signals in brain tumor. n = 3, |
结果如图 5所示。原位荷瘤大鼠多次给予DTX-NPs、DTX-Bo-NPs、DTX-RGD-NPs和DTX-Bo-RGD-NPs后的生存曲线结果显示(图 5C), 生理盐水组大鼠最先开始死亡, 最后死亡组为DTX-Bo-RGD-NPs组。通过GraphPad Prism 8.0分析计算出每组的中位生存期为生理盐水组(9天)、DTX-NPs组(19天)、DTX-Bo-NPs组(18.5天)、DTX-RGD-NPs组(18.5天) 和DTX-Bo-RGD-NPs组(21天)。结果证实DTX-Bo-RGD-NPs纳米粒可以显著提高荷瘤大鼠的生存时间, 与生理盐水组相比中位生存期延长至2.33倍; 与DTX-NPs组相比中位生存期延长至1.11倍; 与DTX-Bo-NPs和DTX-RGD-NPs组相比中位生存期延长至1.14倍。

|
Figure 5 TUNEL staining of tumor sections after different treatments and survival curves of C6 tumor-bearing rats after administration of different formulations. A: TUNEL staining. Blue: DAPI; Green: Apoptosis cells. n = 4, the scale bar is 20 μm; B: Quantification of TUNEL fluorescence signal expressed as the percentage of total cell number (DAPI signal). n = 4, |
从TUNEL染色结果可以看出经Bo和RGD修饰的纳米粒组细胞凋亡数显著高于未修饰组, 其中DTX-Bo-RGD-NPs组凋亡信号最强, 其次是RGD与Bo单修饰组, 未修饰组最低(图 5A)。半定量结果表明(图 5B), DTX-Bo-RGD-NPs治疗组细胞凋亡数量是control、DTX-NPs、DTX-Bo-NPs和DTX-RGD-NPs组的7.15、3.26、1.77和1.40倍; DTX-Bo-NPs和DTX-RGD-NPs组细胞凋亡数是DTX-NPs组的1.84和2.34倍; DTX-RGD-NPs组细胞凋亡数是DTX-Bo-NPs组的1.27倍。
5 Bo-RGD-NPs纳米粒的体内外安全性初步研究在16HBE和C6体外模型上, 通过MTT法对未载药的4种纳米粒NPs、Bo-NPs、RGD-NPs和Bo-RGD-NPs进行体外安全性评价(图 6A、B)。结果表明, 1 mg·mL-1的NPs、Bo-NPs、RGD-NPs和Bo-RGD-NPs纳米粒并不会显著影响细胞活力, 具有较好的体外安全性。
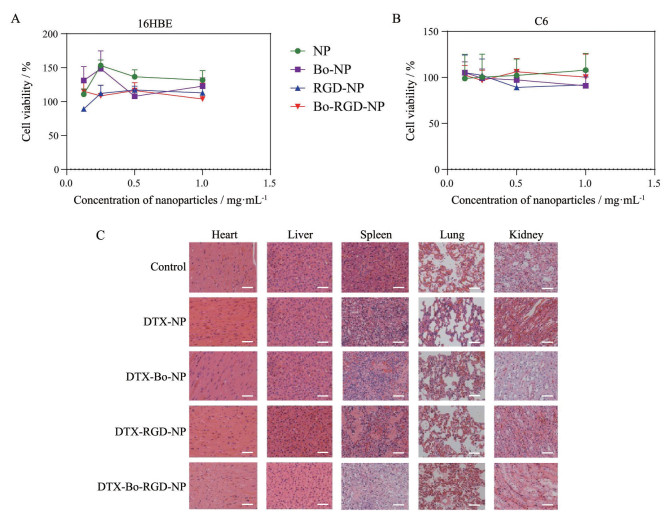
|
Figure 6 The cytotoxicity of nanoparticles on 16HBE and C6 cells in vitro and the hematoxylin-eosin (H&E) results of different tissues after intranasal administration of different NPs to rats. A: By 16HBE, treated with NPs, RGD-NPs, Bo-NPs, and Bo-RGD-NPs; B: By C6, treated with NPs, RGD-NPs, Bo-NPs, and Bo-RGD-NPs; C: H&E results, treated with DTX-NPs, DTX-RGD-NPs, DTX-Bo-NPs, and DTX-Bo-RGD-NPs (DTX, 5 mg·kg-1). n = 6, |
体内H&E染色结果表明(图 6C), DTX-NPs、DTX-Bo-NPs、DTX-RGD-NPs和DTX-Bo-RGD-NPs纳米粒经鼻给药后对组织器官无明显损伤, 初步证实Bo-RGD-NPs递药系统具有较好的安全性。
讨论脑胶质瘤是一种具有高发病率和致死率的原发性中枢神经系统肿瘤。由于BBB的存在以及化疗药物对肿瘤细胞的非特异性, 其治疗受到阻碍[28]。因此, 本课题构建冰片/RGD修饰经鼻给药的纳米靶向递药系统, 以提高DTX抗脑胶质瘤治疗效果。冰片是一种引经中药, 研究证明其能够改善BBB的渗透性, 促进药物入脑。临床上, 经常使用冰片治疗中枢神经系统疾病。此外, 冰片能透过鼻腔黏膜, 增加药物在脑组织中的分布。文献报道冰片可以增强人类鼻黏膜上皮细胞的转运, 增加药物经鼻给药后的脑部递送[29, 30]。
由于肿瘤细胞上高表达ανβ3受体, RGD可以与其结合, 因此作者希望通过RGD修饰进一步促进纳米粒在肿瘤部位聚集。体内外靶向性结果显示, 经冰片/RGD共修饰的纳米粒可以显著增加肿瘤细胞的摄取和脑部肿瘤部位的聚集, Bo和RGD的共修饰具有更好的脑胶质瘤靶向效果。
纳米粒具有高稳定性、高生物利用度、低毒性、缓释性能等优点。此外, 纳米粒的粒径大小影响药物的缓释行为和渗透鼻黏膜的能力。经鼻给药时, 粒径小于1 μm时可以有效穿透鼻黏膜, 粒径越小, 纳米粒越容易在肿瘤部位聚集[31]。此外, 成功的纳米系统标志之一是拥有较高的DLC, 同时给药时可以降低载体的量[32], 高DLC的纳米粒更利于鼻腔给药。因此, 以纳米粒的粒径和DLC为考察指标, 进行单因素筛选, 尽可能筛选出拥有较小的粒径和高DTX载药量的纳米粒处方。根据单因素试验, 确定最优处方制得的4种纳米粒粒径均在140 nm左右, 载药量均在2.6%左右, 适用于鼻腔给药。此外, DTX-Bo-RGD-NPs递药系统粒径大小均一, 粒径稳定性良好, 具有较好的缓释性能。在16HBE细胞模型上, 经Bo和RGD修饰的纳米粒的摄取能力是Bo和RGD单修饰纳米粒的1.04和1.21倍。在C6细胞模型上, 经Bo和RGD修饰的纳米粒的摄取能力是Bo和RGD单修饰纳米粒的1.19和1.23倍。
鼻腔递送是一种非侵入性的给药方式, 具有给药方便、起效迅速和避免首过代谢等优点[33], 能够绕过BBB, 将大部分药物经过嗅球和三叉神经通路转运直接递送入脑。经鼻给药相比静脉给药, 所需剂量更低。但鼻黏膜的生理特性, 限制药物吸收[34]。因此, 经鼻递药策略常常依赖渗透增强剂的修饰, 提高递药系统的入脑量[35]。本研究通过Bo的修饰增强纳米粒的鼻黏膜渗透性, 促进RGD的肿瘤靶向性, 体内Bo-RGD-NPs系统的经鼻递送入脑靶向性能评价结果表明, DiR-Bo-RGD-NPs组脑肿瘤组织中DiR的累积量比Bo-NPs和RGD-NPs组提高1.95和1.74倍, 证实经Bo和RGD修饰后的纳米系统具有协同靶向入脑肿瘤组织的效果, Bo-RGD-NPs具有较好的经鼻给药入脑胶质瘤靶向性。此外, MPEG-PLGA是经FDA (Food and Drug Administration) 认证的安全可降解的生物材料[36], 本研究体外安全性初步实验结果表明, 纳米制剂材料对鼻腔黏膜细胞模型活力无显著影响, 体内H&E染色结果证实体内给药后对各器官无明显损伤。制备成纳米系统后可减少抗肿瘤药物与鼻腔黏膜的直接接触, 减少抗肿瘤药物对鼻黏膜的损坏, 但少量释放出纳米系统的抗肿瘤药物对于鼻腔黏膜的安全性还有待于后续进一步研究。
DTX是一种半合成黄酮类化合物[37]。但DTX水溶性差、生物利用度低, 很难到达脑部。冰片/RGD修饰载DTX经鼻给药的纳米靶向递药系统可以解决DTX的水溶性差问题, 提高DTX的生物利用度, 增加DTX在肿瘤部位聚集。根据文献报道, RI-LP-M-DTX纳米系统静脉给予U87-MG荷瘤小鼠后, 小鼠的中位生存期与生理盐水组相比延长1.6倍[20]。本研究体内药效学结果显示DTX-Bo-RGD-NPs纳米粒可以显著提高荷瘤大鼠的生存时间, 与生理盐水组相比中位生存期延长2.33倍, 显著提高对脑胶质瘤的治疗效果。DTX-Bo-RGD-NPs治疗组细胞凋亡数量是DTX-Bo-NPs和DTX-RGD-NPs组的1.77和1.40倍, 证明冰片/RGD双修饰能进一步提高脑胶质瘤的治疗效果。体内外安全性研究结果初步证实Bo-RGD-NPs纳米系统具有较好的安全性。因此, Bo和RGD双修饰纳米粒是一种新型且有效的脑胶质瘤治疗策略, DTX-Bo-RGD-NPs为脑胶质瘤的治疗提供了一种新型靶向纳米递药系统。
作者贡献: 赵霄负责实验处理; 余双文和杜俊锋辅助完成部分实验内容; 赵霄、余双文分析实验数据; 胡凯莉提供指导性支持、实验材料研究和经费等; 胡凯莉和赵霄负责研究思路、实验设计方案和论文撰写; 倪淑婷负责论文修改。
利益冲突: 所有作者均声明均不存在利益冲突。
| [1] |
Sampson JH, Gunn MD, Fecci PE, et al. Brain immunology and immunotherapy in brain tumours[J]. Nat Rev Cancer, 2020, 20: 12-25. DOI:10.1038/s41568-019-0224-7 |
| [2] |
Ostrom QT, Patil N, Cioffi G, et al. CBTRUS statistical report: primary brain and other central nervous system tumors diagnosed in the United States in 2013-2017[J]. Neuro Oncol, 2020, 22: iv1-iv96. DOI:10.1093/neuonc/noaa200 |
| [3] |
Alifieris C, Trafalis DT. Glioblastoma multiforme: pathogenesis and treatment[J]. Pharmacol Ther, 2015, 152: 63-82. DOI:10.1016/j.pharmthera.2015.05.005 |
| [4] |
Cloughesy TF, Mochizuki AY, Orpilla JR, et al. Neoadjuvant anti-PD-1 immunotherapy promotes a survival benefit with intratumoral and systemic immune responses in recurrent glioblastoma[J]. Nat Med, 2019, 25: 477-486. DOI:10.1038/s41591-018-0337-7 |
| [5] |
Lima FR, Kahn SA, Soletti RC, et al. Glioblastoma: therapeutic challenges, what lies ahead[J]. Biochim Biophys Acta, 2012, 1826: 338-349. |
| [6] |
Tang W, Fan W, Lau J, et al. Emerging blood-brain-barrier-crossing nanotechnology for brain cancer theranostics[J]. Chem Soc Rev, 2019, 48: 2967-3014. DOI:10.1039/C8CS00805A |
| [7] |
Chen Y, Liu L. Modern methods for delivery of drugs across the blood-brain barrier[J]. Adv Drug Deliv Rev, 2012, 64: 640-665. DOI:10.1016/j.addr.2011.11.010 |
| [8] |
Terstappen GC, Meyer AH, Bell RD, et al. Strategies for delivering therapeutics across the blood-brain barrier[J]. Nat Rev Drug Discov, 2021, 20: 362-383. DOI:10.1038/s41573-021-00139-y |
| [9] |
Pasha S, Gupta K. Various drug delivery approaches to the central nervous system[J]. Expert Opin Drug Deliv, 2010, 7: 113-135. DOI:10.1517/17425240903405581 |
| [10] |
Illum L. Nasal drug delivery-possibilities, problems and solutions[J]. J Control Release, 2003, 87: 187-198. DOI:10.1016/S0168-3659(02)00363-2 |
| [11] |
Kumar NN, Lochhead JJ, Pizzo ME, et al. Delivery of immunoglobulin G antibodies to the rat nervous system following intranasal administration: distribution, dose-response, and mechanisms of delivery[J]. J Control Release, 2018, 286: 467-484. DOI:10.1016/j.jconrel.2018.08.006 |
| [12] |
Zhang QL, Fu BM, Zhang ZJ. Borneol, a novel agent that improves central nervous system drug delivery by enhancing blood-brain barrier permeability[J]. Drug Deliv, 2017, 24: 1037-1044. DOI:10.1080/10717544.2017.1346002 |
| [13] |
Lu Y, Chen X, Du S, et al. The in situ and in vivo study on enhancing effect of borneol in nasal absorption of Geniposide in rats[J]. Arch Pharm Res, 2010, 33: 691-696. DOI:10.1007/s12272-010-0507-8 |
| [14] |
Wang L, Xu L, Du J, et al. Nose-to-brain delivery of borneol modified tanshinone IIA nanoparticles in prevention of cerebral ischemia/reperfusion injury[J]. Drug Deliv, 2021, 28: 1363-1375. DOI:10.1080/10717544.2021.1943058 |
| [15] |
Wang L, Zhao X, Du J, et al. Improved brain delivery of pueraria flavones via intranasal administration of borneol-modified solid lipid nanoparticles[J]. Nanomedicine (Lond), 2019, 14: 2105-2119. DOI:10.2217/nnm-2018-0417 |
| [16] |
Zhu R, Tian Y. Preparation and evaluation of RGD and TAT co-modified docetaxel-loaded liposome[J]. Drug Des Devel Ther, 2017, 11: 3481-3489. DOI:10.2147/DDDT.S149620 |
| [17] |
Liu Q, Zheng S, Ye K, et al. Cell migration regulated by RGD nanospacing and enhanced under moderate cell adhesion on biomaterials[J]. Biomaterials, 2020, 263: 120327. DOI:10.1016/j.biomaterials.2020.120327 |
| [18] |
Cao Y, Zhou Y, Zhuang Q, et al. Anti-tumor effect of RGD modified PTX loaded liposome on prostatic cancer[J]. Int J Clin Exp Med, 2015, 8: 12182-12191. |
| [19] |
Shaw TK, Mandal D, Dey G, et al. Successful delivery of docetaxel to rat brain using experimentally developed nanoliposome: a treatment strategy for brain tumor[J]. Drug Deliv, 2017, 24: 346-357. DOI:10.1080/10717544.2016.1253798 |
| [20] |
Kang S, Duan W, Zhang S, et al. Muscone/RI7217 co-modified upward messenger DTX liposomes enhanced permeability of blood-brain barrier and targeting glioma[J]. Theranostics, 2020, 10: 4308-4322. DOI:10.7150/thno.41322 |
| [21] |
Tan Q, Liu X, Fu X, et al. Current development in nanoformulations of docetaxel[J]. Expert Opin Drug Deliv, 2012, 9: 975-990. DOI:10.1517/17425247.2012.696606 |
| [22] |
Jakate AS, Einhaus CM, DeAnglis AP, et al. Preparation, characterization, and preliminary application of fibrinogen-coated olive oil droplets for the targeted delivery of docetaxel to solid malignancies[J]. Cancer Res, 2003, 63: 7314-7320. |
| [23] |
Gradauer K, Dunnhaupt S, Vonach C, et al. Thiomer-coated liposomes harbor permeation enhancing and efflux pump inhibitory properties[J]. J Control Release, 2013, 165: 207-215. DOI:10.1016/j.jconrel.2012.12.001 |
| [24] |
Pires A, Fortuna A, Alves G, et al. Intranasal drug delivery: how, why and what for?[J]. J Pharm Pharm Sci, 2009, 12: 288-311. DOI:10.18433/J3NC79 |
| [25] |
Lu YJ, Wei KC, Ma CC, et al. Dual targeted delivery of doxorubicin to cancer cells using folate-conjugated magnetic multi-walled carbon nanotubes[J]. Colloids Surf B Biointerfaces, 2012, 89: 1-9. DOI:10.1016/j.colsurfb.2011.08.001 |
| [26] |
Zhang C, Wan X, Zheng X, et al. Dual-functional nanoparticles targeting amyloid plaques in the brains of Alzheimer's disease mice[J]. Biomaterials, 2014, 35: 456-465. DOI:10.1016/j.biomaterials.2013.09.063 |
| [27] |
Meng Q, Wang A, Hua H, et al. Intranasal delivery of huperzine A to the brain using lactoferrin-conjugated N-trimethylated chitosan surface-modified PLGA nanoparticles for treatment of Alzheimer's disease[J]. Int J Nanomedicine, 2018, 13: 705-718. DOI:10.2147/IJN.S151474 |
| [28] |
Luiz MT, Viegas J, Abriata JP, et al. Docetaxel-loaded folate-modified TPGS-transfersomes for glioblastoma multiforme treatment[J]. Mater Sci Eng C Mater Biol Appl, 2021, 124: 112033. DOI:10.1016/j.msec.2021.112033 |
| [29] |
Chen Z, Gong X, Lu Y, et al. Enhancing effect of borneol and muscone on geniposide transport across the human nasal epithelial cell monolayer[J]. PLoS One, 2014, 9: e101414. DOI:10.1371/journal.pone.0101414 |
| [30] |
Li F, Feng J, Cheng Q, et al. Delivery of 125I-cobrotoxin after intranasal administration to the brain: a microdialysis study in freely moving rats[J]. Int J Pharm, 2007, 328: 161-167. DOI:10.1016/j.ijpharm.2006.08.011 |
| [31] |
Alex AT, Joseph A, Shavi G, et al. Development and evaluation of carboplatin-loaded PCL nanoparticles for intranasal delivery[J]. Drug Deliv, 2016, 23: 2144-2153. DOI:10.3109/10717544.2014.948643 |
| [32] |
Kumari A, Yadav SK, Yadav SC. Biodegradable polymeric nanoparticles based drug delivery systems[J]. Colloids Surf B Biointerfaces, 2010, 75: 1-18. DOI:10.1016/j.colsurfb.2009.09.001 |
| [33] |
Samaridou E, Walgrave H, Salta E, et al. Nose-to-brain delivery of enveloped RNA - cell permeating peptide nanocomplexes for the treatment of neurodegenerative diseases[J]. Biomaterials, 2020, 230: 119657. DOI:10.1016/j.biomaterials.2019.119657 |
| [34] |
Grassin-Delyle S, Buenestado A, Naline E, et al. Intranasal drug delivery: an efficient and non-invasive route for systemic administration: focus on opioids[J]. Pharmacol Ther, 2012, 134: 366-379. DOI:10.1016/j.pharmthera.2012.03.003 |
| [35] |
Said Hassane F, Saleh AF, Abes R, et al. Cell penetrating peptides: overview and applications to the delivery of oligonucleotides[J]. Cell Mol Life Sci, 2010, 67: 715-726. DOI:10.1007/s00018-009-0186-0 |
| [36] |
Zhang M, Hagan CT 4th, Min Y, et al. Nanoparticle co-delivery of wortmannin and cisplatin synergistically enhances chemoradiotherapy and reverses platinum resistance in ovarian cancer models[J]. Biomaterials, 2018, 169: 1-10. DOI:10.1016/j.biomaterials.2018.03.055 |
| [37] |
Aiello P, Consalvi S, Poce G, et al. Dietary flavonoids: nano delivery and nanoparticles for cancer therapy[J]. Semin Cancer Biol, 2021, 69: 150-165. DOI:10.1016/j.semcancer.2019.08.029 |
 2021, Vol. 56
2021, Vol. 56


