2. 江苏省中医药研究院, 中药组分与微生态研究中心, 江苏 南京 210028
2. Multi-component of Traditional Chinese Medicine and Microecology Research Center, Jiangsu Provincial Academy of Chinese Medicine, Nanjing 210028, China
经典的肿瘤“种子-土壤”学说认为, 肿瘤微环境(tumor microenvironment, TME) 是肿瘤细胞赖以生存的土壤, 在肿瘤的发生、发展和转移进程中扮演关键角色[1]。TME是由肿瘤相关巨噬细胞(tumor associated macrophages, TAMs)、自然杀伤细胞(natural killer cells, NK)、T淋巴细胞、树突状细胞(dendritic cells, DC) 等免疫细胞, 与肿瘤相关成纤维细胞(cancer-associated fibroblasts, CAFs)、细胞外基质(extracellular matrix, ECM)、肿瘤血管以及各种炎性因子共组成的复杂系统[2]。TME的组成从免疫效应上可分为促瘤(如CAFs、肿瘤血管、M2型TAMs、Th2型细胞因子等) 和抑瘤(如T细胞、NK细胞、M1型TAMs、Th1型细胞因子等) 两大类, 当促瘤组成在数量及功能上呈压倒性优势时, TME即呈现出严重的免疫抑制状态, 这也是导致包括免疫治疗在内的多种抗肿瘤治疗失败的重要原因之一。寻找合理的药物干预TME, 以激活肿瘤免疫和改善药物递送通道为目的的治疗策略越来越受到抗肿瘤科研工作者的重视[3]。
天然多糖是一类由单糖通过糖苷键连接而成的大分子活性物质, 不仅具有独特的免疫调节作用, 还拥有较好的生物相容性[4, 5], 在临床上常用于提高化疗患者的免疫功能, 降低系统毒性, 逐渐成为一种重要的抗肿瘤辅助药物。但是, 天然多糖分子质量大、化学结构解析困难, 生物药剂学-免疫调节之间的相互作用机制尚不明晰[6, 7]。近年来, 新型纳米递药系统搭载活性天然多糖、基于多糖直接构建递药系统或以多糖作为肿瘤靶向配体提高纳米颗粒递药精准度的研究常见于报道。递送效率提高后的天然多糖与肿瘤免疫调节之间的作用关系正逐渐明晰, 为多糖的抗肿瘤研究打开了新的通道[8]。本文将从肿瘤微环境的组成及功能特点、天然多糖对TME的免疫调控作用以及多糖相关的抗肿瘤新型纳米递药系统进行综述, 并对基于多糖在抗肿瘤新型递药系统领域的发展前景和面临挑战展开讨论(图 1)。
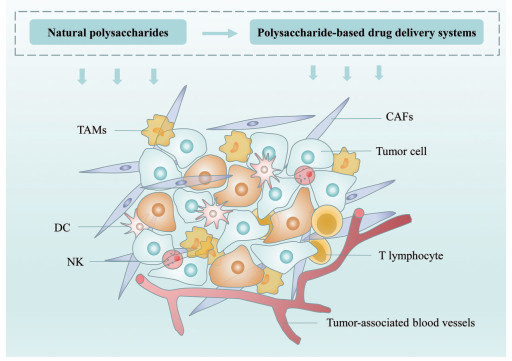
|
Figure 1 Regulation of natural polysaccharides and their nano-drug delivery systems on tumor microenvironment. CAFs: Cancer-associated fibroblasts; DC: Dendritic cells; NK: Natural killer cells; TAMs: Tumor-associated macrophages |
TME是由各类免疫细胞、基质细胞、肿瘤血管以及其间分泌的各种细胞因子组成, 是不同于正常组织环境的复杂生理系统。由于各类免疫抑制细胞过度增殖及Th2型细胞因子的过量分泌, TME中免疫细胞的数量及免疫清除功能均有所下降。TME中缺氧、微酸、高间质液体压以及异常化肿瘤血管之间相互对话机制, 可促进肿瘤组织的构建, 为肿瘤组织的发生、发展提供了有利的生存环境。此后肿瘤组织的构建有利于肿瘤细胞的增殖和免疫抑制细胞的招募, 其间形成的反馈回路将进一步恶化肿瘤免疫微环境[9]。因此, 肿瘤免疫抑制微环境已成为肿瘤主要治疗障碍之一, 针对TME组分的调控是非常有前景的治疗靶点。寻找合适的干预手段激活TME中各类细胞的免疫功能、调控各类细胞因子水平以抑制肿瘤细胞生长是今后抗肿瘤的“新常态”。
天然多糖是从高等植物、藻类、微生物和动物中提取的生物大分子, 由多个单糖通过糖苷键连接而成, 分子质量从几千到几百万道尔顿不等。许多天然多糖具有免疫调节和抗肿瘤的独特优势, 且相对安全、无不良反应。抗肿瘤治疗的临床及临床前的研究发现, 活性天然多糖激活免疫细胞并促进各类活化的免疫细胞向TME中浸润, 或通过调控干扰素(interferon, IFN)、白细胞介素(interleukin, IL)、肿瘤坏死因子(tumor necrosis factor, TNF) 和转化生长因子-β (transforming growth factor-β, TGF-β) 等细胞因子发挥免疫调节作用。此外, 天然多糖与化疗、放疗等其他疗法联合使用可缓解其他疗法对机体的不良反应, 在临床治疗中具有广阔前景。本章节以天然多糖对TME的调控作用为切入点, 从多糖对T淋巴细胞、TAMs、NK、DC、CAFs以及肿瘤血管的调控作用进行介绍。
1.1 天然多糖对T淋巴细胞的调控T淋巴细胞是免疫系统中重要的免疫应答细胞, 在肿瘤免疫治疗中起到核心作用。CD4+ T、CD8+ T淋巴细胞以及调节性T淋巴细胞(regulatory T cells, Treg) 是T淋巴细胞的重要表型。正常状态下, CD4+ T、CD8+ T淋巴细胞和Treg的数量和功能表达相互协调, 以维持机体免疫稳态。其中, CD4+ T淋巴细胞不仅具有抗肿瘤作用, 通过分泌TNF-γ、IL-2等Th1型免疫促进因子, 可促进TAMs和NK细胞等免疫细胞活化, 提高机体整体免疫功能; CD8+ T淋巴细胞识别抗原物质后, 发挥毒杀作用, 主要通过与肿瘤表面主要组织相容性复合体Ⅰ类分子(major histocompatibility complex class-I, MHC-I) 结合后行使功能[2]; Treg功能相反, 在TME中通过促进细胞毒性T淋巴细胞抗原4 (cytotoxic T lymphocyte-associated antigen-4, CTLA-4) 的表达、分泌IL-10、TGF-β等Th2型免疫抑制因子, 抑制促炎性免疫细胞的活性, 辅助肿瘤细胞发生免疫逃逸[2]。在绝大多数类型的肿瘤组织中, CD4+ T、CD8+ T淋巴细胞的数量和活性有所下降, 相反, Treg细胞数量和活性上升, 导致T淋巴细胞对肿瘤抗原识别与杀伤肿瘤的能力下降, 促进肿瘤细胞生长。
寻求合适的干预手段激活TME中T淋巴细胞的肿瘤细胞杀伤功能或促进活性T淋巴细胞向TME的浸润, 有望重新激活TME免疫自清除能力。许多活性天然多糖可调节T淋巴细胞分化以及肿瘤组织的浸润, 并提高促炎性细胞因子的分泌[6, 10]。例如, 从Porphyra haitanensis提取得到的多糖PHPS, 可促进T淋巴细胞的增殖以及TNF-α、IL-6、IL-10等促炎因子的分泌并增加抗肿瘤作用[11]。正常免疫状态中, CD4+ T淋巴细胞在数量上占有优势, 但在恶性肿瘤中, CD4+ T细胞可能是因为被诱发凋亡而导致了CD4+/CD8+ T淋巴细胞比例失调。Long等[12]研究发现, 黄精多糖通过提高CD4+/CD8+ T淋巴细胞比例增强机体免疫应答, 以抑制肿瘤组织的构建。肿瘤组织中Treg的高表达是TME中免疫细胞抗肿瘤功能表达的主要障碍之一, 抑制Treg的表达水平是改善肿瘤免疫抑制微环境的重要指标。Zheng等[13]从Codonopsis pilosula中提取分离出多糖CPPS可大幅下调Treg, 通过影响效应性T细胞的增殖和细胞极化而参与Treg介导的免疫。进一步机制研究表明, CPPS是通过抑制细胞表面Toll样受体4 (Toll-like receptor 4, TLR4) 信号通路降低Treg的表达。
1.2 天然多糖对TAMs的调控巨噬细胞作为机体的第一道防线, 防控病原体入侵, 清除异物, 识别和杀死癌细胞, 在维持内环境稳定、免疫反应和炎症反应方面发挥主要作用。TAMs是一类由肿瘤细胞自发从机体招募到肿瘤组织的巨噬细胞, 是TME中免疫细胞的重要组成[2]。经典学说将TAMs分为促瘤免疫抑制表型M2型和抑瘤免疫促进表型M1型, 不幸的是, M2型TAMs是多数肿瘤组织中TAMs的主要表型, 也是形成肿瘤免疫抑制和治疗抵抗的重要原因[14]。M2型TAMs招募到TME后, 通过分泌TGF-β、IL-10、前列腺素E2 (prostaglandin E2, PGE2) 等抗炎性细胞因子, 抑制CD4+ T细胞介导的Th1免疫应答以及NK细胞等对肿瘤细胞的细胞毒作用, 进而诱导新生血管生成、上调CAFs的水平, 整体上表现出肿瘤生长和转移的倾向[15]。相反, M1型TAMs具有促进免疫正向调节作用, 通过分泌一氧化氮(nitric oxide, NO)、IL-6、TNF-α等细胞因子抑制肿瘤的生长[16, 17]; 并且M1型TAMs可吞噬肿瘤相关抗原, 经处理后呈递给T淋巴细胞, 促进CD4+ T、CD8+ T淋巴细胞的激活, 激活的T淋巴细胞表达相应的细胞膜分子, 且分泌IL-6、TNF-α等细胞因子进一步激活巨噬细胞, 以增强其吞噬功能并释放各种活性物质, 形成促进免疫和杀伤肿瘤的免疫循环。
基于TAMs对肿瘤的生长、侵袭、转移、血管生成等具有双向调节作用, 降低TAMs中M2型TME的数量和比例, 积极诱导其向M1型极化是很有前景的免疫干预策略。研究发现, 调节TAMs的药物包括化疗药物、抗体或小分子抑制剂, 具有潜在的不良反应[18], 寻找新的、安全的药物以特异性地诱导TAMs参与抗肿瘤免疫反应是一种尚未得到满足的需求。近年来应用多糖调控TAMs的研究广泛报道, 如Wei等[19]报道了从Rhizopus nigricans提取的多糖RPS-1可活化巨噬细胞, 并且与化药5-氟尿嘧啶(5-fluorouracil, 5-FU) 联用可减轻化药的免疫系统毒性。天然多糖具有调控TAMs在M1型和M2型之间进行表型转换的药用潜力。Xie等[20]报道了从Aureobasidium pullulan提取的多糖PS可作为一种有效的免疫刺激剂, 调节M2型TAMs向M1型转变, 机制研究表明PS上调TLR1/3/4的表达, 促进蛋白激酶B (protein kinase B, PKB/Akt)、c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)、细胞外信号调节激酶(extracellular signal-regulated protein kinase, Erk) 的磷酸化从而导致TAMs向M1极化。Shu等[21]研究来源于Panax ginseng C.A. Meyer的多糖PSPJ对TAMs的调节作用, 发现PSPJ减少免疫抑制因子产生, 抑制TAMs的M2样极化。Bamodu等[22]报道了从Astragalus membranaceus提取的多糖PG2可刺激TAMs重排, 提高M1/M2巨噬细胞极化率以抑制肿瘤细胞增殖。Bi等[23]从Cordyceps militaris提取多糖CMPB90-1, 将M2型TAMs再教化成M1表型, 在与化疗药物联合使用前作为TLR2激动剂改造免疫微环境, 减少TAMs表面PD-L1的表达。
1.3 天然多糖对NK细胞的调控NK细胞是先天免疫系统的淋巴细胞, 构成机体免疫监视的第一道防线, 在抗肿瘤、抗病毒感染和免疫调节方面发挥重要作用。NK细胞通过释放穿孔素和颗粒酶诱导靶细胞凋亡, 介导肿瘤杀伤反应。NK细胞对靶细胞的激活和识别可有效诱导靶细胞的杀伤作用。此外, NK细胞分泌TNF-α、IFN-γ、IL-6、粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor, GM-CSF)、CC类趋化因子5 (CC chemokine ligand 5, CCL5) 等炎性细胞因子和趋化因子, 杀死病原体并诱导T淋巴细胞激活[6, 7]。然而在TME中, NK细胞的瘤免疫监控与抗肿瘤功能受到抑制[7, 24, 25], 寻找激活NK细胞抗肿瘤功能以解除TME的免疫抑制状态的药效物质是必要的。
研究发现许多活性天然多糖可激活NK细胞的免疫活性。例如, Xie等[26]从Strongylocentrotus nudus eggs中分离的多糖SEP通过TLR4/MAPKs/NF-κB信号通路激活NK细胞而抑制胰腺癌的生长。Xu等[25]研究了从Rehmannia glutinosa提取多糖RGP的免疫调节作用。RGP不仅可以激活T淋巴细胞, 还可以活化NK细胞, 促进IFN-γ的分泌, 抑制了肿瘤的生长, 其机制可能与刺激了TLR4有关。Lee等[27]从Panax ginseng C. A. Meyer中提取分离出多糖GBPP-I可激活NK细胞, 提高IFN-γ的分泌, 以杀伤肿瘤细胞。Dong等[28]从Castanea mollissima Blume提取的多糖CMP90可提高NK细胞的杀伤活性, 促进TNF-α、IL-2和IFN-γ的分泌, 此外还增加了TAMs、T淋巴细胞的数量和组织浸润。
1.4 天然多糖对DC的调控成熟的DC是专职的抗原呈递细胞, 吞噬死亡的肿瘤细胞或细胞碎片, 呈递肿瘤相关抗原给T淋巴细胞。具体表现为成熟DC将其识别的抗原片段分别以MHC-I或MHC-II的形式呈递给CD8+ T或CD4+ T细胞, 以启动和激活抗原特异性的细胞毒T细胞应答[29]。此外, DC细胞还可能触发NK细胞的免疫应答。研究发现, 在免疫抑制状态下的TME中, DC发育不成熟, 不具有抗原识别功能, 导致抗原无法递送到T淋巴细胞[30], 阻碍T淋巴细胞对肿瘤的杀伤作用。
许多活性天然多糖可以促进DC成熟, 主要是通过增强DC表面共刺激性分子CD80和CD86的表达和相关细胞因子的分泌, 促进肿瘤抗原有效的提呈。Wang等[31]从Epimedium koreanum Nakai中提取的多糖EPS可显著促进DC的成熟以及抗原呈递功能, 同时激活CD4+ T淋巴细胞分化。体内实验证实EPS可通过调节宿主免疫系统功能来抑制LLC小鼠的肿瘤生长。
1.5 天然多糖对CAFs的调控CAFs是TME中具有肌成纤维细胞表型的成纤维细胞亚群, 是肿瘤间质中的主要细胞类型。CAFs通过重塑肿瘤ECM, 诱导血管生成, 招募炎症细胞, 分泌生长因子、免疫抑制细胞因子和间充质-上皮细胞相互作用直接刺激癌细胞增殖, 促进肿瘤发展和侵袭。例如, CAFs合成多种细胞外基质成分, 如胶原、纤维连接蛋白和基质金属蛋白酶(matrix metalloproteinases, MMPs), 给肿瘤提供适宜的生长环境; 分泌血管内皮生长因子(vascular endothelial growth factor, VEGF)、成纤维细胞生长因子(fibroblast growth factor, FGF) 等生长因子诱导肿瘤细胞增殖、新生血管形成和肿瘤组织转移[32-34]; 此外, CAFs形成的致密结构多位于TME外围, 阻碍免疫细胞向肿瘤组织的浸润。寻找合适的药物干预CAFs与肿瘤细胞之间的对话网络是一种有前景的抗肿瘤治疗策略。
Hao等[34]报道了从Prunella vulgaris提取的多糖PVP可通过诱导细胞凋亡和阻滞细胞周期抑制CAFs的存活和迁移, 并且通过下调CAFs的mRNA表达和碱性成纤维蛋白生长因子(basic fibroblast growth factor, bFGF) 的分泌对乳腺癌产生治疗作用。MMPs是细胞外基质降解和转移过程中的血管生成过程的最重要的蛋白酶, 在多种恶性肿瘤类型中过表达, 其中, MMP2和MMP9在TME中高表达, 与肿瘤转移密切相关[35], 下调MMPs的表达可抑制癌细胞的迁移和侵袭。Ou等[36]从Sargassum thunbergii提取物分离出的水溶性多糖STPC2在转录水平和酶活性上抑制了MMPs基因表达, 并且通过降低内皮细胞中VEGF-A和低氧诱导因子-1α (hypoxia-inducible factor-1α, HIF-1α) 的相关mRNA和蛋白表达, 抑制内皮细胞迁移和肿瘤血管形成。
1.6 天然多糖对肿瘤血管的调控在实体瘤中, 肿瘤血管是TME的重要组成部分, 肿瘤新生血管的出现是肿瘤早期进展中的主要特征之一[37]。肿瘤血管为肿瘤细胞运输氧气和营养物质并清除废物, 充当肿瘤细胞转移扩散和免疫细胞浸润的通道。恶性肿瘤的转移是肿瘤患者预后差和死亡率高的原因, 开发能够抑制肿瘤转移的治疗药物对于改善肿瘤的治疗至关重要。抗血管生成治疗是抑制肿瘤生长和转移的主要方法之一。
Cong等[38]从Sargassum fusiforme提取分离出多糖FP08S2, 能明显抑制血管生成, 是一种有效的抗血管生成剂。Zong等[39]由Sepiella maindroni de Rochebruns提取了SIP-SII等一系列多糖, 发现SIP-SII有效抑制细胞间黏附分子-1 (intercellular adhesion molecule-1, ICAM-1) 和bFGF介导的血管生成, 降低了黑色素瘤的侵袭和迁移。有研究发现, 仅依靠抑制血管生成的抗肿瘤治疗可能会加剧肿瘤微环境缺氧, 反而抑制TME中免疫细胞正常功能的表达, 调控肿瘤血管系统正常化是一种抗癌治疗的新方法。Tang等[40]报道了黄芪多糖与姜黄素的联合使用可促进血管内皮细胞排列整齐并紧密连接, 趋于正常组织中脉管结构。光声层析成像和扫描电子显微镜分别表征了联合给药前后HepG2荷瘤小鼠体内肿瘤血管的形态结构及微观结构变化, 证实使用该组合物治疗的荷HepG2荷瘤小鼠的肿瘤血管密度大幅降低, 血管壁形态规则均匀的生长, 微小血管及芽生结构较少(表 1[11, 13, 19, 20, 22, 23, 25-28, 31, 36, 38, 39, 41-56])。
| Table 1 Regulatory effect of natural polysaccharides on tumor microenvironment (TME). TLR4: Toll-like receptor 4; NO: Nitric oxide; TNF: Tumor necrosis factor; IL: Interleukin; IFN: Interferon; NKG2D: Natural killer cell activating receptor; FasL: Fas ligand; PGE2: Prostaglandin E2; COX2: Cyclooxygenase 2; iNOS: Inducible nitric oxide; CTLs: Cytotoxic T lymphocytes; PD-1: Programmed cell death protein-1; CCL: CC chemokine ligand; NF-κB: Nuclear factor kappa-B; TGF: Transforming growth factor; Th1: T-helper 1; ROS: Reactive oxygen species; Akt: Protein kinase B; Erk: Extracellular signal-regulated protein kinase; JNK: c-Jun N-terminal kinase; MAPKs: Mitogen-activated protein kinases; MMP: Matrix metalloproteinase; ICAM-1: Intercellular adhesion molecule-1; bFGF: Basic fibroblast growth factor; VEGF-A: Vascular endothelial growth factor A; HIF-1α: Hypoxia-inducible factor-1α |
综上, 大量活性天然多糖具有可上调免疫激活型细胞数量和功能、降低瘤内CAFs丰度、促进肿瘤血管的正常化等作用, 通过优化肿瘤细胞生长的土壤, 为抗肿瘤治疗提供了有利的客观条件。然而, 天然多糖直接用于调控TME, 受体内分布、代谢等因素影响, 无法在TME中高效蓄积, 效价低。现阶段研究表明, 天然多糖对TME的调控往往是复杂多向的, 较难清晰阐明多糖对TME的调控, 其机制研究亟待开展。另外, 由于天然多糖相对分子质量的不均一性、糖基的种类和链连方式因素等的影响, 导致对多糖的结构表征及其构效关系的研究相对困难。
2 天然多糖纳米制剂在肿瘤免疫调控的作用纳米递药系统发展迅速, 在提高难溶组分的溶解度、延长血液循环时间、改善体内药动学行为以及克服药物体内递送面临的多级生理屏障等方面具有明显优势。合理设计多糖纳米递药系统有助于将所需的药物运送到肿瘤区域, 有望大幅提高多糖对TME的免疫干预作用。本章节综述多糖作为药效成分、药物载体以及靶向配体构建的纳米递药系统对TME的调控。首先, 基于纳米递药系统搭载活性天然多糖作为药效成分向肿瘤递送, 可激活TME中免疫细胞功能或促进免疫活性细胞的浸润、调控基质细胞以及肿瘤血管; 其次, 基于“药辅合一”理念, 许多天然多糖可承担药物载体或靶向配体的角色组建纳米递药系统, 促使药物向TME高效递送, 有效提高免疫干预的精准性。
2.1 天然多糖作为药效成分的纳米递药系统对TME的调控尽管活性天然多糖在抑制肿瘤生长、黏附、侵袭和迁移、调控TME方面具有独特优势, 囿于其构效关系复杂、体内药代动力学分布无序等缺点, 限制了其在肿瘤部位的聚集; 此外, 肿瘤组织间质压较高、肿瘤细胞密度较大以及致密的细胞外基质等多种因素, 阻碍了多种免疫细胞和药物渗透至肿瘤内部, 异常的肿瘤脉管系统既通过多路对话机制加速肿瘤生长和转移, 也为药物递送设置了诸多障碍[57, 58]。例如, Mao等[48]从Grifola frondose中提取多糖GP11, 通过与5-FU的联用增加IL-2和TNF-α的分泌, 一定程度上缓解了5-FU引起的血液生化指标恶化、超氧化物歧化酶(superoxide dismutase, SOD) 活性降低和丙二醛(malondialdehyde, MDA) 水平升高等不良反应。此类通过额外注射多糖溶液的干预方式或可延长生存曲线, 但其抗肿瘤效果仍有可提高空间。运用纳米递药系统将具有免疫调节作用的多糖物质递送到肿瘤组织, 是改善多糖TME调控的有效手段。例如, 脂质体是作为药物传递系统可提高药物在肿瘤组织的蓄积, Zhang等[59]制备了黄芪多糖脂质体, 经脂质体包裹后, 黄芪多糖在TME可有效蓄积, 由此改善DC中CD80和CD86的表达, 显著增强DC呈递抗原和激活T细胞增殖的能力, 上调IFN-γ和IL-2的分泌。
多糖作为药效成分在抗肿瘤治疗中通常发挥免疫佐剂的作用, 减缓因化疗、放疗导致的预后机体免疫系统受损。以多糖为药效成分构建的纳米递药系统同样可联合化疗、光热疗法等建立有效的肿瘤干预方案。金纳米材料是一类具有特殊的“光热效应”的新型材料, 可将吸收光子的能量转换成电子的动能, 最终释放热能用于消除肿瘤[60]。Zhang等[61]报道了包裹灵芝多糖(Ganoderma lucidum polysaccharide, GLP) 的金纳米复合物, 与化药多柔比星(doxorubicin, DOX) 联用时, 对4T1肿瘤的生长和肺转移具有强烈的抑制作用。这是因为GLP有效地诱导DC活化, 促进CD4+ T、CD8+ T淋巴细胞的增殖, 改善了TME的免疫抑制状态。
放射治疗是一种传统的癌症治疗方法, 但由于辐射诱导的免疫抑制, 放射治疗可能变得无效。重新激活肿瘤微环境中的免疫抑制是成功治疗癌症的一种策略。Yu等[62]利用硫化铋纳米颗粒(bismuth sulfide nanoparticles, BiNP) 偶联GLP, 制备成GLP-BiNP纳米粒。与BiNP相比, GLP-BiNP复合纳米粒在肿瘤组织蓄积更快。其中, 铋元素吸收X射线用于放射疗法杀伤肿瘤细胞, 而GLP可重塑TME免疫功能协同治疗, 通过诱导肿瘤细胞凋亡从而抑制肿瘤生长, 其作用机制可能与DC成熟水平增强、肿瘤组织CD8+ T淋巴细胞的活性和数量提高以及IFN-γ分泌增加相关。Pang等[63]将疏水的4-(n-辛氧基) 苯基硼酸与单糖单元上的邻位二醇发生反应, 偶联到黄芪多糖上, 而后在苯基硼酸的疏水作用下自组装得到黄芪多糖纳米粒(Astragalus membranaceus polysaccharide nanoparticle, ANP)。ANP与放射疗法相结合能明显延长荷瘤小鼠的存活率, 并且显著抑制原发肿瘤和远离原发灶的继发肿瘤的生长。进一步研究表明, ANP诱导DC活化成熟, 迁移至肿瘤引流淋巴结激活T淋巴细胞增殖, 导致CD4+/Treg和CD8+/Treg比值的增加, 整体上提高了机体免疫功能。机制研究表明ANP可能通过TLR4信号通路激活DC, 从而增强抗原提呈效应。
多糖纳米递药系统可用于肿瘤的诊疗领域, 增加递药系统的免疫调节功能和生物相容性。Xiong等[64]制备了载有黄芪多糖和金纳米棒的复合纳米颗粒, 辅助聚焦超声治疗。其中, 金纳米棒因为其特殊的性质作为造影剂用于光声成像, 黄芪多糖经脂质体包裹后免疫调节活性显著增强, 促进DC、CD8+ T淋巴细胞活化以及TNF-α、IFN-γ分泌。多糖作为免疫激活剂, 在基于多糖构建的纳米疫苗具有广泛研究前景。肿瘤纳米疫苗搭载肿瘤相关抗原物质, 通过MHC分子呈递给T淋巴细胞激发机体适应性免疫。天然多糖有助于DC细胞成熟和T淋巴细胞活化, 结合多糖的肿瘤纳米疫苗具有广阔的开发前景[65]。Luo等[66]将山药多糖和卵清蛋白(ovalbumin, OVA) 封装在PLGA纳米颗粒中, 制备了基于山药多糖的纳米疫苗, 在小鼠体内可促进更多OVA特异性IgG抗体的分泌, 并且CD4+ T、CD8+ T淋巴细胞显著活化。
2.2 多糖作为纳米递药系统载体以及靶向配体对TME的调控许多天然多糖药理活性不显著, 不能直接用于肿瘤免疫调控。然而, 由于其化学性质稳定、生物相容性高、可生物降解和低毒的特点, 可作为载体构建纳米递药系统, 应用于抗肿瘤的治疗。诸如壳聚糖、透明质酸(hyaluronic acid, HA)、海藻酸盐、环糊精、葡聚糖、淀粉、纤维素等天然多糖被广泛应用于药物缓释系统的设计中, 可提高递药系统的生物相容性[67-69]。多糖的基本组成大多是由葡萄糖、甘露糖、半乳糖等糖基构成, 可与在肿瘤细胞或TME中免疫细胞表面相关的糖蛋白受体结合, 具有一定的肿瘤靶向性。因此, 天然多糖作为药物载体或靶向配体组建纳米递药系统, 为研发“智能”递药系统提供了优质的天然来源材料。
2.2.1 壳聚糖壳聚糖是自然界唯一一类阳离子型多糖, 具有无毒、高生物相容性、可生物降解性和低免疫原性等有利特性。壳聚糖及其衍生物作为药物载体有益于药物控释以及药效延长, 广泛用于增加疏水药物的细胞膜通透性以提高药物的稳定性。近期作者设计并合成了一种茴香酰胺偶联的N-辛基-N, O-马来酰-O-磷酸化壳聚糖两亲性胶束, 用于负载紫杉醇[70]。在肿瘤微酸环境中, 该胶束在马来酰基和磷酰基协同作用下促使药物从亲水性转变为疏水性, 促进药物的pH响应性释放, 导致药物在肿瘤部位大量泄漏, 增强对前列腺肿瘤PC-3细胞的抑制作用。Walter等[71]报道壳聚糖纳米颗粒作为载体可将肿瘤特异性抗原递送到TME中, 降解后释放抗原激活并放大CD8+ T细胞诱导的肿瘤抗原特异性免疫应答。
值得注意的是, 本无免疫调节活性的壳聚糖在进行功能化修饰后, 其肿瘤免疫活性有很大程度提高。Jiang等[72]报道羧甲基化壳聚糖通过抑制肿瘤血管生成, 调节机制主要为下调VEGF和MMPs的表达, 激活免疫功能产生抗肿瘤作用。Yang等[73]制备了甘露糖修饰的硬脂酸接枝壳聚糖胶束, 可靶向到肿瘤引流淋巴结, 捕获内源性抗原后, 促进DC对抗原的摄取, 增强CD4+ T和CD8+ T淋巴细胞活性和组织浸润, 显著抑制了肿瘤生长。Wang等[74]由聚合物O-羧甲基-壳聚糖为载体构建了一种阳离子脂质基纳米颗粒, 具有抑制M2型TAMs极化协同抗肿瘤功效。Castro等[75]经共凝聚法制备的壳聚糖/聚(γ-谷氨酸) 纳米颗粒通过激活DC增强了共刺激分子CD86、CD80的表达, 并且诱导M2型TAMs向M1型转变, TAMs表型的改变进一步促进CD4+ T、CD8+ T淋巴细胞的活化、增殖。
2.2.2 环糊精环糊精及其衍生物在药剂学领域广泛使用。Rodell等[76]以β-环糊精为载体构建了负载Toll样受体TLR7和TLR8激动剂的纳米制剂, 通过促进肿瘤相关巨噬细胞向M1表型极化, 以杀伤肿瘤细胞。Jiang等[77]以羟丙基-β-环糊精丙烯酸酯和壳聚糖衍生物配制成具有TME响应特性的仿生纳米凝胶, 用于化疗和免疫联合抗肿瘤治疗。该系统在肿瘤微环境中敏感释放药物, 既提高了药物渗透性, 又可以诱导钙网蛋白暴露, 以此提高抗肿瘤免疫活性。Park等[78]以环糊精为载体制备了封装TGF-β抑制剂和IL-2的纳米凝胶系统, 可持续递送疏水性小分子TGF-β抑制剂和水溶性蛋白细胞因子IL-2至TME中。药物的持续释放诱导局部治疗性免疫反应, 激活TME的免疫清除能力。同时, NK活性和瘤内CD8+ T细胞的浸润显著增加, 提高了荷瘤小鼠的存活率。
2.2.3 透明质酸(HA)HA是天然存在的糖胺聚糖, 是细胞外基质和关节液的主要组分, 具有良好的生物相容性、无毒性和生物降解性, 是一种无免疫原性的水溶性阴离子多糖。HA作为递药载体可与阳离子材料相互作用形成复合物, 提高复合物的生物相容性和稳定性, 为解决生理环境中药物递送不稳定的输送问题提供思路。Xu等[79]以脂质体-鱼精蛋白-透明质酸为载体将siRNA运载到TME中用于下调TGF-β表达。随着TGF-β的下调, 肿瘤浸润性CD8+ T细胞水平增加, Treg水平下降, 微环境免疫清除功能得到一定程度的恢复。
HA同时具有靶向TME的特殊功能, 可与在肿瘤细胞和DC细胞表面高度表达的CD44受体特异性结合[80]。因此, 在载药系统表面包覆一层HA壳层可主动靶向TME, HA壳作为灵巧的“开关”和肿瘤靶向的“导向器”, 延长血液循环, 增强肿瘤特异性的蓄积。Sun等[81]将疏水性D-α-生育酚琥珀酸酯(D-α-tocopherol succinate, α-TOS) 封装在沸石咪唑骨架-8 (zeolitic imidazolate framework-8, ZIF-8) 中, 得到α-TOS@ZIF-8纳米制剂, 再由HA包裹在α-TOS@ZIF-8外表面, 靶向性和水溶性均有所提高, 形成HA/α-TOS@ZIF-8纳米平台。在TME中, HA被透明质酸酶分解, 暴露包裹的α-TOS@ZIF-8, ZIF-8结构在肿瘤酸性微环境中分解, 释放负载的α-TOS。Zhang等[82]构建了pH响应性的PEG化透明质酸纳米药物递送系统, 可有效地靶向CD44+ CT26细胞, 并且在TME弱酸性环境下分离具有pH响应性的PEG外壳, 可实现肿瘤特异性和按需给药、定点释放的递送目的, 解决了纳米递送系统的细胞摄取和递送难题。
2.2.4 中药多糖中药多糖是天然活性多糖的重要组成部分。本课题组基于“药辅合一”的设计理念, 以中药提取物为辅料, 负载多糖, 构建了诸如灵芝多糖的灵芝糖萜复合微乳[83]、薏苡仁-灵芝多糖复合微乳[84]以及含有薏苡仁多糖的雷公藤红素-薏苡仁组分微乳[85]。此类递药系统整合了中药多糖的免疫调节和纳米给药系统的肿瘤递送优势, 有效地调节肿瘤免疫的同时, 也大幅提高给药系统的抗肿瘤综合效能。以当归多糖、白头翁多糖为代表的中药多糖既能作为药效物质调控免疫, 也可作药物载体用于构建纳米新型递药系统, 同时具备一定的肿瘤靶向作用。Zhang等[86]用脱氧胆酸作为疏水性基团修饰当归多糖可提高载药系统的亲水性, 此后装载DOX形成肝肿瘤靶向的复合纳米递药系统, 与HepG2肿瘤表面去唾液酸糖蛋白受体特异性亲合, 提高了DOX的抗肿瘤和整体免疫活性。Wang等[87]以当归多糖为载体负载DOX, 构建了一种酶敏感的肿瘤靶向纳米递药系统, 在TME中MMP2的作用下, 该纳米递药系统逐渐解组装。释放出来的当归多糖发挥免疫调控作用, 通过促进IL-2的表达增加、IL-10的表达降低, 恢复TME中T淋巴细胞的免疫平衡。以白头翁多糖为载体构建的抗肿瘤纳米递药系统有胶束、纳米粒、微球等, 同样具有肿瘤靶向的功能, 又具有较强的药理活性。Guan等[88, 89]开发了一种用于递送抗肿瘤药物多西他赛(docetaxel, DTX) 的白头翁多糖胶束系统[88]和pH/氧化还原双敏感共聚物[89], 可高度响应TME中微酸和高谷胱甘肽(glutathione, GSH), 增强肿瘤部位递送的同时, 大幅提高抗肿瘤疗效。
2.2.5 其他多糖海藻酸盐[90]、岩藻依聚糖[91]、葡聚糖[92]、淀粉[93, 94]等天然多糖用作药物载体也具有调控TME的潜力。海藻酸盐是从棕色海藻中提取的天然线性多糖, 具有生物相容性好、可生物降解性、低毒、易得等优势, 在生物医学和医药领域得到了广泛的研究。Li等[90]制备了具有还原性海藻酸盐-聚乙烯亚胺纳米凝胶系统, 有效地增强疫苗诱导的抗体生成和CD8+ T细胞介导的杀伤肿瘤作用。岩藻依聚糖是一种免疫调节多糖, Pawar等[91]使用岩藻依聚糖制备了装载有DOX的免疫治疗纳米颗粒, 使M2型TAMs向M1型反向极化。Yuba等[95]报道了一系列葡聚糖衍生物修饰的脂质体, 可靶向DC和巨噬细胞, 在肿瘤免疫治疗中具有广阔的应用前景。
3 多糖/多糖纳米递药系统调控肿瘤免疫面临的挑战尽管多糖/多糖纳米递药系统在抗肿瘤治疗中有许多独特的优势, 但是仍有诸多问题亟需解决。首先, 天然多糖分子质量大且跨度广, 糖基组成复杂, 理化结构解析十分困难。多糖的理化结构决定了其生理活性, 例如β-葡聚糖溶解性和构象变化会导致与TAMs上受体的亲和力不同, 进而影响靶向递送效率[91]; 灵芝多糖的溶解方式会影响其微乳体系的构建[84]。虽然目前采用的基质辅助激光解吸电离飞行时间质谱联用技术(matrix assisted laser desorption/ionization-time of flight mass spectrometry, MALDI-TOF-MS)、二维核磁共振技术等技术可以提供多糖组成、链接顺序等一级结构信息, 但是对多糖立体构象的解析需要借助其他高精尖仪器, 使得大规模系统化研究多糖结构-特性关系的工作难以下沉到更广范围的研究团队。其次, 纳米给药系统体内表征工作目前仍面临诸多技术瓶颈。常用探针修饰方法追踪体内粒子分布、吸收和代谢, 但是该技术手段尚不能直接证实多糖/多糖纳米粒的体内稳定性和组织分布特性。多糖/多糖给药系统的体内分布-渗透-解离过程不明晰, 多糖/多糖给药系统调节肿瘤免疫的具体分子机制也随之滞后, 这些问题也是制约多糖/多糖给药系统实际应用的主要因素。此外, 天然多糖的质量控制标准体系尚未建立, 同一种类的多糖因产地来源不同可能导致理化性质差异巨大, 批量化应用和生产工作也因此遭遇许多经济和法规问题, 这也是天然多糖作为药用辅料或药物进入药典面临的主要障碍。最后, 天然多糖对肿瘤免疫调节的整体效能较弱, 既与多糖的成分组成、提取纯度和加工工艺有关, 也可能与多糖进入靶部位的浓度有关, 多糖组装成新型给药系统后能否提高其肿瘤免疫调节活性需要从处方优化、粒子组装、体内分布等环节进行多维综合验证。
4 总结与展望针对以上问题, 在此做以下几点展望。首先, 要积极推进学科交叉融合, 联合植物化学、分析化学等学科力量对有开发前景的天然多糖理化结构进行详尽解析; 借助计算化学优势建立多糖-包埋药物的装配兼容性预测模型, 在多糖结构信息清晰的前提下, 探索出一套多糖纳米给药系统构建特征的普适性规律。其次, 可通过核同位素标记法、近红外染料标记法、肿瘤组织内荧光共振能量转移等方法联合定位多糖/多糖纳米给药系统的结构变化和体内分布, 解析它们在肿瘤中分布-解离-渗透过程, 从制剂学、药理学等多角度剖析多糖干预肿瘤微环境的潜在机制。此外, 应通过合理的给药系统设计, 优化多糖/多糖给药系统在肿瘤部位特异性聚集和渗透的能力, 通过剂型和生物分布的差异分析多糖干预肿瘤免疫的贡献因素。天然多糖与放化疗协同治疗可以增强自身免疫调节能力。以此为依据构建的多糖-化疗药递送系统不仅可以通过改善肿瘤分布降低化疗药物的系统毒性, 还有望通过多糖与化疗药物的联合应用提高免疫干预活性。最后, 天然多糖还可以作为一种新型的非病毒基因载体, 与多种基因药物组装成基因给药系统。病毒载体搭载基因药物具有载药量低、基因转染效率不高等天生的局限性, 多糖可以凭借其可化学修饰、载药量高、无毒/低毒的优势, 在多糖-基因纳米药物领域找到新的应用空间。
天然多糖既具有广泛的免疫调节功能, 也有作为递药载体的基础和潜力, 在肿瘤治疗和肿瘤新型给药系统领域具有广阔的应用前景。本综述以肿瘤微环境的组成及特点、天然多糖的免疫调控以及基于多糖的新型纳米递药系统为主线, 总结了近年来多糖在抗肿瘤领域的研究与应用实例。同时提出了多糖结构解析、体内示踪以及效应机制评价方面面临的技术问题, 并根据目前的技术力量和发展趋势提出潜在的解决方法, 期待能对天然多糖的基础研究、应用范围以及产业转化提供有价值的文献参考。尽管天然多糖拥有许多中药组分或大分子药物载体无可比拟的优势, 但是尚有诸多科学问题亟待阐明, 围绕天然多糖的药学研究工作仍然任重道远。
作者贡献: 韩陶为主要撰写者; 陈彦和瞿鼎为通讯作者, 负责文章指导修改。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Kessenbrock K, Plaks V, Werb Z. Matrix metalloproteinases: regulators of the tumor microenvironment[J]. Cell, 2010, 141: 52-67. DOI:10.1016/j.cell.2010.03.015 |
| [2] |
Fridman WH, Zitvogel L, Sautès Fridman C, et al. The immune contexture in cancer prognosis and treatment[J]. Nat Rev Clin Oncol, 2017, 14: 717-734. DOI:10.1038/nrclinonc.2017.101 |
| [3] |
Binnewies M, Roberts EW, Kersten K, et al. Understanding the tumor immune microenvironment (TIME) for effective therapy[J]. Nat Med, 2018, 24: 541-550. DOI:10.1038/s41591-018-0014-x |
| [4] |
Chakraborty I, Sen IK, Mondal S, et al. Bioactive polysaccharides from natural sources: a review on the antitumor and immunomodulating activities[J]. Biocatal Agric Biotechnol, 2019, 22: 101425. DOI:10.1016/j.bcab.2019.101425 |
| [5] |
Li Q, Niu Y, Xing P, et al. Bioactive polysaccharides from natural resources including Chinese medicinal herbs on tissue repair[J]. Chin Med, 2018, 13: 7. DOI:10.1186/s13020-018-0166-0 |
| [6] |
Lee SJ, Lee HS, Kim SY, et al. Immunostimulatory and anti-metastatic activity of polysaccharides isolated from byproducts of the corn starch industry[J]. Carbohydr Polym, 2018, 181: 911-917. DOI:10.1016/j.carbpol.2017.11.060 |
| [7] |
Tabarsa M, You S, Abedi M, et al. The activation of RAW264.7 murine macrophage and natural killer cells by glucomannogalactan polysaccharides from Tornabea scutellifera[J]. Carbohydr Polym, 2019, 219: 368-377. DOI:10.1016/j.carbpol.2019.05.044 |
| [8] |
Ahmed HB. Recruitment of various biological macromolecules in fabrication of gold nanoparticles: overview for preparation and applications[J]. Int J Biol Macromol, 2019, 140: 265-277. DOI:10.1016/j.ijbiomac.2019.08.138 |
| [9] |
Wang M, Zhao J, Zhang L, et al. Role of tumor microenvironment in tumorigenesis[J]. J Cancer, 2017, 8: 761-773. DOI:10.7150/jca.17648 |
| [10] |
Chen L, Ge MD, Zhu YJ, et al. Structure, bioactivity and applications of natural hyperbranched polysaccharides[J]. Carbohydr Polym, 2019, 223: 115076. DOI:10.1016/j.carbpol.2019.115076 |
| [11] |
Liu QM, Xu SS, Li L, et al. In vitro and in vivo immunomodulatory activity of sulfated polysaccharide from Porphyra haitanensis[J]. Carbohydr Polym, 2017, 165: 189-196. DOI:10.1016/j.carbpol.2017.02.032 |
| [12] |
Long T, Liu Z, Shang J, et al. Polygonatum sibiricum polysaccharides play anti-cancer effect through TLR4-MAPK/NF-κB signaling pathways[J]. Int J Biol Macromol, 2018, 111: 813-821. DOI:10.1016/j.ijbiomac.2018.01.070 |
| [13] |
Zheng YS, Wu ZS, Ni HB, et al. Codonopsis pilosula polysaccharide attenuates cecal ligation and puncture sepsis via circuiting regulatory T cells in mice[J]. Shock, 2014, 41: 250-255. DOI:10.1097/SHK.0000000000000091 |
| [14] |
Vitale I, Manic G, Coussens LM, et al. Macrophages and metabolism in the tumor microenvironment[J]. Cell Metab, 2019, 30: 36-50. DOI:10.1016/j.cmet.2019.06.001 |
| [15] |
De Palma M, Biziato D, Petrova TV. Microenvironmental regulation of tumour angiogenesis[J]. Nat Rev Cancer, 2017, 17: 457-474. DOI:10.1038/nrc.2017.51 |
| [16] |
Li C, Peng D, Huang W, et al. Structural characterization of novel comb-like branched α-D-glucan from Arca inflata and its immunoregulatory activities in vitro and in vivo[J]. Food Funct, 2019, 10: 6589-6603. DOI:10.1039/C9FO01395D |
| [17] |
Fang L, Hodge J, Saaoud F, et al. Transcriptional factor EB regulates macrophage polarization in the tumor microenvironment[J]. Oncoimmunology, 2017, 6: e1312042. DOI:10.1080/2162402X.2017.1312042 |
| [18] |
Li X, Guo X, Ling J, et al. Nanomedicine-based cancer immunotherapies developed by reprogramming tumor-associated macrophages[J]. Nanoscale, 2021, 13: 4705-4727. DOI:10.1039/D0NR08050K |
| [19] |
Wei Z, Chen G, Zhang P, et al. Rhizopus nigricans polysaccharide activated macrophages and suppressed tumor growth in CT26 tumor-bearing mice[J]. Carbohydr Polym, 2018, 198: 302-312. DOI:10.1016/j.carbpol.2018.06.076 |
| [20] |
Xie L, Yang Y, Meng J, et al. Cationic polysaccharide spermine-pullulan drives tumor associated macrophage towards M1 phenotype to inhibit tumor progression[J]. Int J Biol Macromol, 2019, 123: 1012-1019. DOI:10.1016/j.ijbiomac.2018.11.089 |
| [21] |
Shu G, Jiang S, Mu J, et al. Antitumor immunostimulatory activity of polysaccharides from Panax japonicus C. A. Mey: roles of their effects on CD4+ T cells and tumor associated macrophages[J]. Int J Biol Macromol, 2018, 111: 430-439. DOI:10.1016/j.ijbiomac.2018.01.011 |
| [22] |
Bamodu OA, Kuo KT, Wang CH, et al. Astragalus polysaccharides (PG2) enhances the M1 polarization of macrophages, functional maturation of dendritic cells, and T cell-mediated anticancer immune responses in patients with lung cancer[J]. Nutrients, 2019, 11: 2264. DOI:10.3390/nu11102264 |
| [23] |
Bi S, Huang W, Chen S, et al. Cordyceps militaris polysaccharide converts immunosuppressive macrophages into M1-like phenotype and activates T lymphocytes by inhibiting the PD-L1/PD-1 axis between TAMs and T lymphocytes[J]. Int J Biol Macromol, 2020, 150: 261-280. DOI:10.1016/j.ijbiomac.2020.02.050 |
| [24] |
Shin MS, Hwang SH, Yoon TJ, et al. Polysaccharides from ginseng leaves inhibit tumor metastasis via macrophage and NK cell activation[J]. Int J Biol Macromol, 2017, 103: 1327-1333. DOI:10.1016/j.ijbiomac.2017.05.055 |
| [25] |
Xu L, Zhang W, Zeng L, et al. Rehmannia glutinosa polysaccharide induced an anti-cancer effect by activating natural killer cells[J]. Int J Biol Macromol, 2017, 105: 680-685. DOI:10.1016/j.ijbiomac.2017.07.090 |
| [26] |
Xie X, Ma L, Zhou Y, et al. Polysaccharide enhanced NK cell cytotoxicity against pancreatic cancer via TLR4/MAPKs/NF-κB pathway in vitro/vivo[J]. Carbohydr Polym, 2019, 225: 115223. DOI:10.1016/j.carbpol.2019.115223 |
| [27] |
Lee DY, Park CW, Lee SJ, et al. Immunostimulating and antimetastatic effects of polysaccharides purified from ginseng berry[J]. Am J Chin Med, 2019, 47: 823-839. DOI:10.1142/S0192415X19500435 |
| [28] |
Dong XD, Feng YY, Liu YN, et al. A novel polysaccharide from Castanea mollissima Blume: preparation, characteristics and antitumor activities in vitro and in vivo[J]. Carbohydr Polym, 2020, 240: 116323. DOI:10.1016/j.carbpol.2020.116323 |
| [29] |
Chen SJ, Li JY, Zhang JM. Extraction of yellow pear residue polysaccharides and effects on immune function and antioxidant activity of immunosuppressed mice[J]. Int J Biol Macromol, 2019, 126: 1273-1281. DOI:10.1016/j.ijbiomac.2018.12.248 |
| [30] |
Gardner A, Ruffell B. Dendritic cells and cancer immunity[J]. Trends Immunol, 2016, 37: 855-865. DOI:10.1016/j.it.2016.09.006 |
| [31] |
Wang C, Feng L, Su J, et al. Polysaccharides from Epimedium koreanum Nakai with immunomodulatory activity and inhibitory effect on tumor growth in LLC-bearing mice[J]. J Ethnopharmacol, 2017, 207: 8-18. DOI:10.1016/j.jep.2017.06.014 |
| [32] |
Zong A, Cao H, Wang F. Anticancer polysaccharides from natural resources: a review of recent research[J]. Carbohydr Polym, 2012, 90: 1395-1410. DOI:10.1016/j.carbpol.2012.07.026 |
| [33] |
Mukherjee S, Ghosh K, Hahn F, et al. Chemically sulfated polysaccharides from natural sources: assessment of extraction-sulfation efficiencies, structural features and antiviral activities[J]. Int J Biol Macromol, 2019, 136: 521-530. DOI:10.1016/j.ijbiomac.2019.05.005 |
| [34] |
Hao J, Ding XL, Yang X, et al. Prunella vulgaris polysaccharide inhibits growth and migration of breast carcinoma-associated fibroblasts by suppressing expression of basic fibroblast growth factor[J]. Chin J Integr Med, 2020, 26: 270-276. DOI:10.1007/s11655-016-2587-x |
| [35] |
Kobayashi H, Enomoto A, Woods SL, et al. Cancer-associated fibroblasts in gastrointestinal cancer[J]. Nat Rev Gastroenterol Hepatol, 2019, 16: 282-295. DOI:10.1038/s41575-019-0115-0 |
| [36] |
Ou M, Sun X, Liang J, et al. A polysaccharide from Sargassum thunbergii inhibits angiogenesis via downregulating MMP-2 activity and VEGF/HIF-1α signaling[J]. Int J Biol Macromol, 2017, 94: 451-458. DOI:10.1016/j.ijbiomac.2016.10.046 |
| [37] |
Li L, Wang Z, Tan NH. Advances in natural products that target the tumor microenvironment[J]. Acta Pharm Sin (药学学报), 2021, 56: 1580-1590. |
| [38] |
Cong Q, Chen H, Liao W, et al. Structural characterization and effect on anti-angiogenic activity of a fucoidan from Sargassum fusiforme[J]. Carbohydr Polym, 2016, 136: 899-907. DOI:10.1016/j.carbpol.2015.09.087 |
| [39] |
Zong A, Zhao T, Zhang Y, et al. Anti-metastatic and anti-angiogenic activities of sulfated polysaccharide of Sepiella maindroni ink[J]. Carbohydr Polym, 2013, 91: 403-409. DOI:10.1016/j.carbpol.2012.08.050 |
| [40] |
Tang D, Zhang S, Shi X, et al. Combination of Astragali polysaccharide and curcumin improves the morphological structure of tumor vessels and induces tumor vascular normalization to inhibit the growth of hepatocellular carcinoma[J]. Integr Cancer Ther, 2019, 18: 1534735418824408. |
| [41] |
Su F, Song Q, Zhang C, et al. A β-1, 3/1, 6-glucan from Durvillaea Antarctica inhibits tumor progression in vivo as an immune stimulator[J]. Carbohydr Polym, 2019, 222: 114993. DOI:10.1016/j.carbpol.2019.114993 |
| [42] |
Li G, Zhang Y, Xie E, et al. Functional characterization of a potent anti-tumor polysaccharide in a mouse model of gastric cancer[J]. Life Sci, 2019, 219: 11-19. DOI:10.1016/j.lfs.2019.01.003 |
| [43] |
Tabarsa M, You S, Yelithao K, et al. Isolation, structural elucidation and immuno-stimulatory properties of polysaccharides from Cuminum cyminum[J]. Carbohydr Polym, 2020, 230: 115636. DOI:10.1016/j.carbpol.2019.115636 |
| [44] |
Xiong Q, Hao H, He L, et al. Anti-inflammatory and anti-angiogenic activities of a purified polysaccharide from flesh of Cipangopaludina chinensis[J]. Carbohydr Polym, 2017, 176: 152-159. DOI:10.1016/j.carbpol.2017.08.073 |
| [45] |
He BL, Zheng QW, Guo LQ, et al. Structural characterization and immune-enhancing activity of a novel high-molecular-weight polysaccharide from Cordyceps militaris[J]. Int J Biol Macromol, 2020, 145: 11-20. DOI:10.1016/j.ijbiomac.2019.12.115 |
| [46] |
Liang J, Li H, Chen J, et al. Dendrobium officinale polysaccharides alleviate colon tumorigenesis via restoring intestinal barrier function and enhancing anti-tumor immune response[J]. Pharmacol Res, 2019, 148: 104417. DOI:10.1016/j.phrs.2019.104417 |
| [47] |
Sun J, Sun J, Song B, et al. Fucoidan inhibits CCL22 production through NF-κB pathway in M2 macrophages: a potential therapeutic strategy for cancer[J]. Sci Rep, 2016, 6: 35855. DOI:10.1038/srep35855 |
| [48] |
Mao GH, Zhang ZH, Fei F, et al. Effect of Grifola frondosa polysaccharide on anti-tumor activity in combination with 5-Fu in Heps-bearing mice[J]. Int J Biol Macromol, 2019, 121: 930-935. DOI:10.1016/j.ijbiomac.2018.10.073 |
| [49] |
Sun S, Li K, Lei Z, et al. Immunomodulatory activity of polysaccharide from Helicteres angustifolia L. on 4T1 tumor-bearing mice[J]. Biomed Pharmacother, 2018, 101: 881-888. DOI:10.1016/j.biopha.2018.03.029 |
| [50] |
Deng X, Luo S, Luo X, et al. Polysaccharides from Chinese herbal Lycium barbarum induced systemic and local immune responses in H22 tumor-bearing mice[J]. J Immunol Res, 2018, 2018: 3431782. |
| [51] |
Guo T, Yang Y, Gao M, et al. Lepidium meyenii Walpers polysaccharide and its cationic derivative re-educate tumor-associated macrophages for synergistic tumor immunotherapy[J]. Carbohydr Polym, 2020, 250: 116904. DOI:10.1016/j.carbpol.2020.116904 |
| [52] |
Li C, Dong Z, Zhang B, et al. Structural characterization and immune enhancement activity of a novel polysaccharide from Moringa oleifera leaves[J]. Carbohydr Polym, 2020, 234: 115897. DOI:10.1016/j.carbpol.2020.115897 |
| [53] |
Jia X, Liang Y, Zhang C, et al. Polysaccharide PRM3 from Rhynchosia minima root enhances immune function through TLR4-NF-κB pathway[J]. Biochim Biophys Acta Gen Subj, 2018, 1862: 1751-1759. DOI:10.1016/j.bbagen.2018.05.012 |
| [54] |
Razali FN, Ismail A, Abidin NZ, et al. Stimulatory effects of polysaccharide fraction from Solanum nigrum on RAW 264.7 murine macrophage cells[J]. PLoS One, 2014, 9: e108988. DOI:10.1371/journal.pone.0108988 |
| [55] |
Yuan L, Zhong ZC, Liu Y. Structural characterisation and immunomodulatory activity of a neutral polysaccharide from Sambucus adnata Wall[J]. Int J Biol Macromol, 2020, 154: 1400-1407. DOI:10.1016/j.ijbiomac.2019.11.021 |
| [56] |
Zhu B, Qian C, Zhou F, et al. Antipyretic and antitumor effects of a purified polysaccharide from aerial parts of Tetrastigma hemsleyanum[J]. J Ethnopharmacol, 2020, 253: 112663. DOI:10.1016/j.jep.2020.112663 |
| [57] |
Gao MY, Fu JX, Wang XT. Major progress in tumor accumulation and penetration of nanomedicine[J]. Acta Pharm Sin (药学学报), 2021, 56: 138-145. |
| [58] |
Weber EW, Maus MV, Mackall CL. The emerging landscape of immune cell therapies[J]. Cell, 2020, 181: 46-62. DOI:10.1016/j.cell.2020.03.001 |
| [59] |
Zhang W, Ma W, Zhang J, et al. The immunoregulatory activities of astragalus polysaccharide liposome on macrophages and dendritic cells[J]. Int J Biol Macromol, 2017, 105: 852-861. DOI:10.1016/j.ijbiomac.2017.07.108 |
| [60] |
Qin Y, Liu T, Guo M, et al. Mild-heat-inducible sequentially released liposomal complex remodels the tumor microenvironment and reinforces anti-breast-cancer therapy[J]. Biomater Sci, 2020, 8: 3916-3925. DOI:10.1039/D0BM00498G |
| [61] |
Zhang S, Pang G, Chen C, et al. Effective cancer immunotherapy by Ganoderma lucidum polysaccharide-gold nanocomposites through dendritic cell activation and memory T cell response[J]. Carbohydr Polym, 2019, 205: 192-202. DOI:10.1016/j.carbpol.2018.10.028 |
| [62] |
Yu H, Yang Y, Jiang T, et al. Effective radiotherapy in tumor assisted by ganoderma lucidum polysaccharide-conjugated bismuth sulfide nanoparticles through radiosensitization and dendritic cell activation[J]. ACS Appl Mater Interfaces, 2019, 11: 27536-27547. DOI:10.1021/acsami.9b07804 |
| [63] |
Pang G, Chen C, Liu Y, et al. Bioactive polysaccharide nanoparticles improve radiation-induced abscopal effect through manipulation of dendritic cells[J]. ACS Appl Mater Interfaces, 2019, 11: 42661-42670. DOI:10.1021/acsami.9b16814 |
| [64] |
Xiong J, Jiang B, Luo Y, et al. Multifunctional nanoparticles encapsulating Astragalus polysaccharide and gold nanorods in combination with focused ultrasound for the treatment of breast cancer[J]. Int J Nanomedicine, 2020, 15: 4151-4169. DOI:10.2147/IJN.S246447 |
| [65] |
Wusiman A, Xu S, Ni H, et al. Immunomodulatory effects of Alhagi honey polysaccharides encapsulated into PLGA nanoparticles[J]. Carbohydr Polym, 2019, 211: 217-226. DOI:10.1016/j.carbpol.2019.01.102 |
| [66] |
Luo Y, Ren Z, Bo R, et al. Designing selenium polysaccharides-based nanoparticles to improve immune activity of Hericium erinaceus[J]. Int J Biol Macromol, 2020, 143: 393-400. DOI:10.1016/j.ijbiomac.2019.12.061 |
| [67] |
Varaprasad K, Raghavendra GM, Jayaramudu T, et al. Nano zinc oxide-sodium alginate antibacterial cellulose fibres[J]. Carbohydr Polym, 2016, 135: 349-355. DOI:10.1016/j.carbpol.2015.08.078 |
| [68] |
Münster L, Fojtů M, Capáková Z, et al. Oxidized polysaccharides for anticancer-drug delivery: what is the role of structure?[J]. Carbohydr Polym, 2021, 257: 117562. DOI:10.1016/j.carbpol.2020.117562 |
| [69] |
Wang QS, Gao LN, Zhu XN, et al. Co-delivery of glycyrrhizin and doxorubicin by alginate nanogel particles attenuates the activation of macrophage and enhances the therapeutic efficacy for hepatocellular carcinoma[J]. Theranostics, 2019, 9: 6239-6255. DOI:10.7150/thno.35972 |
| [70] |
Qu D, Jiao M, Lin H, et al. Anisamide-functionalized pH-responsive amphiphilic chitosan-based paclitaxel micelles for sigma-1 receptor targeted prostate cancer treatment[J]. Carbohydr Polym, 2020, 229: 115498. DOI:10.1016/j.carbpol.2019.115498 |
| [71] |
Walter F, Winter E, Rahn S, et al. Chitosan nanoparticles as antigen vehicles to induce effective tumor specific T cell responses[J]. PLoS One, 2020, 15: e0239369. DOI:10.1371/journal.pone.0239369 |
| [72] |
Jiang Z, Han B, Li H, et al. Carboxymethyl chitosan represses tumor angiogenesis in vitro and in vivo[J]. Carbohydr Polym, 2015, 129: 1-8. DOI:10.1016/j.carbpol.2015.04.040 |
| [73] |
Yang X, Yu T, Zeng Y, et al. Tumor-draining lymph node targeting chitosan micelles as antigen-capturing adjuvants for personalized immunotherapy[J]. Carbohydr Polym, 2020, 240: 116270. DOI:10.1016/j.carbpol.2020.116270 |
| [74] |
Wang T, Zhang J, Hou T, et al. Selective targeting of tumor cells and tumor associated macrophages separately by twin-like core-shell nanoparticles for enhanced tumor-localized chemoimmunotherapy[J]. Nanoscale, 2019, 11: 13934-13946. DOI:10.1039/C9NR03374B |
| [75] |
Castro F, Pinto ML, Silva AM, et al. Pro-inflammatory chitosan/poly(γ-glutamic acid) nanoparticles modulate human antigen-presenting cells phenotype and revert their pro-invasive capacity[J]. Acta Biomater, 2017, 63: 96-109. DOI:10.1016/j.actbio.2017.09.016 |
| [76] |
Rodell CB, Arlauckas SP, Cuccarese MF, et al. TLR7/8-agonist-loaded nanoparticles promote the polarization of tumour-associated macrophages to enhance cancer immunotherapy[J]. Nat Biomed Eng, 2018, 2: 578-588. DOI:10.1038/s41551-018-0236-8 |
| [77] |
Jiang J, Zhang Y, Peng K, et al. Combined delivery of a TGF-β inhibitor and an adenoviral vector expressing interleukin-12 potentiates cancer immunotherapy[J]. Acta Biomater, 2017, 61: 114-123. DOI:10.1016/j.actbio.2017.05.009 |
| [78] |
Park J, Wrzesinski SH, Stern E, et al. Combination delivery of TGF-β inhibitor and IL-2 by nanoscale liposomal polymeric gels enhances tumour immunotherapy[J]. Nat Mater, 2012, 11: 895-905. DOI:10.1038/nmat3355 |
| [79] |
Xu Z, Wang Y, Zhang L, et al. Nanoparticle-delivered transforming growth factor-β siRNA enhances vaccination against advanced melanoma by modifying tumor microenvironment[J]. ACS Nano, 2014, 8: 3636-3645. DOI:10.1021/nn500216y |
| [80] |
Huang WC, Chen SH, Chiang WH, et al. Tumor microenvironment-responsive nanoparticle delivery of chemotherapy for enhanced selective cellular uptake and transportation within tumor[J]. Biomacromolecules, 2016, 17: 3883-3892. DOI:10.1021/acs.biomac.6b00956 |
| [81] |
Sun Q, Bi H, Wang Z, et al. Hyaluronic acid-targeted and pH-responsive drug delivery system based on metal-organic frameworks for efficient antitumor therapy[J]. Biomaterials, 2019, 223: 119473. DOI:10.1016/j.biomaterials.2019.119473 |
| [82] |
Zhang X, Zhao M, Cao N, et al. Construction of a tumor microenvironment pH-responsive cleavable PEGylated hyaluronic acid nano-drug delivery system for colorectal cancer treatment[J]. Biomater Sci, 2020, 8: 1885-1896. DOI:10.1039/C9BM01927H |
| [83] |
He JJ, Chen Y, Du M, et al. Exploration of one-step preparation of Ganoderma lucidum multicomponent microemulsion[J]. Acta Pharm Sin (药学学报), 2013, 48: 441-446. |
| [84] |
Guo J, Yuan C, Huang M, et al. Ganoderma lucidum-derived polysaccharide enhances coix oil-based microemulsion on stability and lung cancer-targeted therapy[J]. Drug Deliv, 2018, 25: 1802-1810. DOI:10.1080/10717544.2018.1516006 |
| [85] |
Huang MM, Li P, Liu YP, et al. Preparation of tripterine-Coix seed microemulsion and its anti-lung cancer efficacy in vivo[J]. World Sci Technol Mod Tradit Chin Med (世界科学技术-中医药现代化), 2017, 19: 1801-1808. |
| [86] |
Zhang Y, Cui Z, Mei H, et al. Angelica sinensis polysaccharide nanoparticles as a targeted drug delivery system for enhanced therapy of liver cancer[J]. Carbohydr Polym, 2019, 219: 143-154. DOI:10.1016/j.carbpol.2019.04.041 |
| [87] |
Wang MZ, He X, Yu Z, et al. A nano drug delivery system based on Angelica sinensis polysaccharide for combination of chemotherapy and immunotherapy[J]. Molecules, 2020, 25: 3096. DOI:10.3390/molecules25133096 |
| [88] |
Guan Q, Sun D, Zhang G, et al. Docetaxel-loaded self-assembly stearic acid-modified Bletilla striata polysaccharide micelles and their anticancer effect: preparation, characterization, cellular uptake and in vitro evaluation[J]. Molecules, 2016, 21: 1641. DOI:10.3390/molecules21121641 |
| [89] |
Guan Q, Zhang G, Sun D, et al. In vitro and in vivo evaluation of docetaxel-loaded stearic acid-modified Bletilla striata polysaccharide copolymer micelles[J]. PLoS One, 2017, 12: e0173172. DOI:10.1371/journal.pone.0173172 |
| [90] |
Li P, Luo Z, Liu P, et al. Bioreducible alginate-poly(ethylenimine) nanogels as an antigen-delivery system robustly enhance vaccine-elicited humoral and cellular immune responses[J]. J Control Release, 2013, 168: 271-279. DOI:10.1016/j.jconrel.2013.03.025 |
| [91] |
Pawar VK, Singh Y, Sharma K, et al. Improved chemotherapy against breast cancer through immunotherapeutic activity of fucoidan decorated electrostatically assembled nanoparticles bearing doxorubicin[J]. Int J Biol Macromol, 2019, 122: 1100-1114. DOI:10.1016/j.ijbiomac.2018.09.059 |
| [92] |
Su Y, Chen L, Yang F, et al. β-D-Glucan-based drug delivery system and its potential application in targeting tumor associated macrophages[J]. Carbohydr Polym, 2021, 253: 117258. DOI:10.1016/j.carbpol.2020.117258 |
| [93] |
Torres FG, Troncoso OP, Pisani A, et al. Natural polysaccharide nanomaterials: an overview of their immunological properties[J]. Int J Mol Sci, 2019, 20: 5092. DOI:10.3390/ijms20205092 |
| [94] |
Miura R, Sawada SI, Mukai SA, et al. Antigen delivery to antigen-presenting cells for adaptive immune response by self-assembled anionic polysaccharide nanogel vaccines[J]. Biomacromolecules, 2020, 21: 621-629. DOI:10.1021/acs.biomac.9b01351 |
| [95] |
Yuba E, Yamaguchi A, Yoshizaki Y, et al. Bioactive polysaccharide-based pH-sensitive polymers for cytoplasmic delivery of antigen and activation of antigen-specific immunity[J]. Biomaterials, 2017, 120: 32-45. DOI:10.1016/j.biomaterials.2016.12.021 |
 2021, Vol. 56
2021, Vol. 56


