2. 陕西中医药大学医学技术学院, 陕西 咸阳 712046;
3. 陕西中医药大学药学院/陕西省秦岭中草药应用开发工程技术研究中心, 陕西 咸阳 712046;
4. 陕西中医药大学省部共建特色秦药资源研究开发国家重点实验室 (培育), 陕西 咸阳 712083
2. College of Medical Technology, Shaanxi University of Chinese Medicine, Xianyang 712046, China;
3. College of Pharmacy and Shaanxi Qinling Application Development and Engineering Center of Chinese Herbal Medicine, Shaanxi University of Chinese Medicine, Xianyang 712046, China;
4. State Key Laboratory of Research and Development of Characteristic Qin Medicine Resources (Cultivation), Shaanxi University of Chinese Medicine, Xianyang 712083, China
WRKY是高等植物特有的一类转录因子, 能够调节植物应答干旱、高盐、低温等环境胁迫, 从而参与调节植物的生长发育等生理过程[1]。WRKY转录因子家族成员众多, 其最重要的结构特征是含有约60个氨基酸的WRKY结构域, 根据高度保守的WRKYGQK结构域C2H2或C2HC型锌指基序类型, 又分为WRKY Ⅰ、Ⅱ、Ⅲ亚族, 各自发挥转录调控功能[2]。WRKY转录因子可以特异识别并结合DNA序列的W-box元件, 从而调控靶基因的转录与表达[3]。自红薯WRKY基因SPF1首次克隆之后[4], 许多植物的WRKY基因纷纷被鉴定, 广泛与植物应答逆境胁迫相关[5]。大豆WRKY27基因能够提高植物的耐寒性, 而大豆WRKY54基因则在调控植物应答盐胁迫与干旱胁迫中发挥作用[6]。拟南芥WRKY70在病原菌入侵后激活植物免疫激活因子SARD1, 启动植物防御基因的表达[7]。CHYR1通过介导WRKY70磷酸化/非磷酸化控制其与SARD1顺式元件的结合, 从而作为开关调节免疫和生长之间的平衡[8]。
柴胡是伞形科北柴胡Bupleurem chinense DC.或狭叶柴胡B. scorzonerifolium Willd.的干燥根, 始载于《神农本草经》, 是药用历史悠久的大宗药材, 辛、苦、微寒, 有疏散退热、疏肝解郁的功效[9]。现代药理学研究显示, 柴胡主要药效成分为柴胡皂苷、黄酮类及多糖类化合物等, 有抗癌、抗炎、保心护肝等药理功效[10-12]。然而北柴胡的研究多集中于活性成分药效机制领域, 关于柴胡皂苷生源合成的转录调控及抗逆分子机制研究鲜有报道[13]。
在分析北柴胡转录组[12]数据时发现了一条在柴胡根中高表达的EST序列, 比对分析显示与拟南芥WRKY70基因同源性较高, 为了进一步研究该基因在北柴胡逆境应答及柴胡皂苷生源合成中的功能, 本研究克隆该基因BcWRKY70, 进行编码蛋白理化性质、结构、亚细胞定位、系统进化等生物信息学分析, 并用qRT-PCR检测不同组织、不同激素处理下基因表达模式, 为后续深入基因功能提供依据。
材料与方法材料 北柴胡样品采集于陕西中医药大学药用植物园, 由陕西中医药大学药学院王继涛高级实验师鉴定为伞形科植物北柴胡B. chinense DC.。收集盛花期时北柴胡植株的根、茎、叶和花组织材料, 液氮速冻、并于-80 ℃冻存备用。用少量乙醇溶解脱落酸(abscisic acid, ABA) 和茉莉酸甲酯(methyl jasmonic acid, MeJA), 分别加水稀释至终浓度为100 μmol·L-1和50 mmol·L-1。用100 μmol·L-1的脱落酸溶液和50 mmol·L-1的茉莉酸甲酯溶液喷施萌发60 d的北柴胡幼苗叶片, 在处理0、4、8和12 h后收集叶片, 每个处理5株, 液氮速冻后保持。
试剂 RNA提取试剂盒Plant RNA kit (R6827-01)、反转录试剂盒One step RT-PCR Kit购自OMEGA公司; Plasmid Miniprep kit Ⅱ (PD1213) 购自Biomiga EZgeneTM公司; 琼脂糖凝胶DNA回收试剂盒购自北京百泰克生物技术公司; Universal Genome WalkerTM Kit购自Clontech公司; SYBR Green® Ⅱ Premix Ex TaqTM、限制性内切酶EcoRV、Pvu Ⅱ、Stu Ⅰ和Dra Ⅰ、pMD19-T simple vector均购自大连宝生物(TaKaRa) 公司; 大肠杆菌E. coli DH5α为本实验室保存。
核酸提取 采用RNA提取试剂盒Plant RNA kit和反转录试剂盒One step RT-PCR kit完成样品RNA提取及反转录, 获得的cDNA保存于-20 ℃冰箱备用。按照改良的CTAB法[14]提取北柴胡基因组DNA, 保存于-20 ℃冰箱备用。
BcWRKY70基因克隆 根据北柴胡转录组数据库中EST序列信息, 设计上下游扩增的特异性引物(表 1), 以北柴胡cDNA为模板, 扩增BcWRKY70 ORF序列。反应程序为95 ℃变性5 min; 95 ℃变性30 s, 57 ℃退火30 s, 72 ℃延伸55 s, 35个循环; 72 ℃延伸10 min。PCR扩增产物经胶回收与pMD19-T simple vector连接, 转化E. coli DH5α, 阳性克隆送至北京擎科生物科技有限公司测序。
| Table 1 Primer sequences used for PCR analysis |
BcWRKY70启动子区克隆及序列分析 按照Universal Genome WalkerTM Kit操作说明, 用“DNA-walking”方法克隆启动子区。用限制性内切酶EcoR V、Pvu Ⅱ、Stu Ⅰ和Dra Ⅰ消化北柴胡基因组DNA, 将得到的酶切反应物与基因组步移接头相连, 即构建北柴胡基因组DNA步移文库。根据北柴胡BcWRKY70基因序列设计步移引物pWRKY70-GSP1和pWRKY70-GSP2, 分别和接头引物AP1、AP2进行两轮巢式PCR反应。反应程序为95 ℃变性5 min; 95 ℃变性30 s, 56 ℃退火30 s, 72 ℃延伸120 s, 35个循环; 72 ℃延伸10 min。将所得PCR反应产物进行测序。利用在线工具Plant-CARE数据库(http://bioinformatics.psb.ugent.be/webtools/plantcare/html) 对BcWRKY70基因启动子区的顺式作用元件进行分析。
BcWRKY70基因生物信息学分析 用DNAMAN分析BcWRKY70基因编码氨基酸序列理化性质。利用在线工具Clustal W2 (http://www.ebi.ac.uk/) 进行氨基酸序列的同源性比对; 信号肽及跨膜结构域用Signal P和TMHMM进行分析; 利用SOPMA和SWISS-MODEL分析预测蛋白质的二级、三级结构。运用MEGA 7.0软件采用邻接法(neighbour-joining) 构建植物WRKY蛋白进化树。
BcWRKY70基因的表达模式分析 以北柴胡根、茎、叶、花, ABA和MeJA处理不同时间点的cDNA为模板进行qRT-PCR反应, 以β-actin基因为内参, 检测不同样本中北柴胡BcWRKY70基因的表达量。反应体系为20 μL, 包含10 μL SYBR Green® Ⅱ Premix Ex TaqTM、5 μL稀释50倍的cDNA模板、3 μL H2O以及待扩增基因上下游引物各1 μL (10 mmol·L-1); 反应条件为95 ℃预变性10 min; 95℃变性15 s, 60 ℃反应1 min, 循环40次。同时绘制熔解曲线, 包括不加模板的对照在内, 所有qRT-PCR反应就技术重复和实验重复各3次, 利用Step One Plus® Real-Time (Applied Biosystems, US) 进行qRT-PCR检测, 用2-ΔΔct法[15]对实验数据进行处理。
结果与分析 1 BcWRKY70基因的克隆根据北柴胡转录组数据库中的序列信息, 采用扩增引物对BcWRKY70-F/BcWRKY70-R对北柴胡cDNA模板进行PCR扩增。电泳检测可见一条约为1 000 bp条带(图 1)。经过切胶回收、连接T载体、转化大肠杆菌、测序后, 获得北柴胡BcWRKY70基因开放阅读框序列(GenBank登录号MT235144)。

|
Figure 1 PCR product of BcWRKY70 ORF. The left lane shows the amplified PCR product; M: DNA Ladder DL 2000 |
BcWRKY70基因ORF 948 bp, 编码316个氨基酸。预测编码蛋白分子质量为36.03 kDa, 等电点为8.13。该蛋白质含有34个碱性氨基酸(10.76%), 出现频率最高的氨基酸为丝氨酸(10.13%)、天冬氨酸(8.23%) 和赖氨酸(7.28%), 含有125个疏水性氨基酸和82个极性氨基酸, 蛋白质带正电荷。BcWRKY70含有1个WRKY结构域, C端含有C2HC结构, 属于WRKY Ⅲ类亚族成员。二级结构预测显示, BcWRKY70蛋白有70.21%无规卷曲、17.6% α-螺旋、7.49% β转角和4.7% β片层组成。预测蛋白的稳定指数(stability index (Ⅱ)) 为44.18, 提示其属于不稳定蛋白。Signal P 4.1预测显示BcWRKY70蛋白无信号肽结构, 属于非分泌蛋白。亚细胞定位结果显示, BcWRKY70蛋白定位于细胞核内。
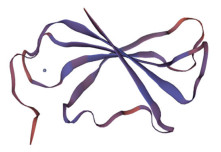
以拟南芥AtWRKY1 (PDB ID: 2ayd.1) A链为模板[16], 利用SWISS-MODEL进行三维建模。预测显示, BcWRKY70由β片层折叠包围形成的空间可以与DNA或者二价金属离子结合(图 2)。
|
Figure 2 Three-dimensional structure of deduced BcWRKY70 protein by SWISS-MODEL |
采用“DNA-walking”方法克隆获得BcWRKY70基因5'侧翼区, 长1 589 bp, 其中, ATG上游+56 bp处为预测的转录起始位点。PlantCARE分析5'侧翼区结果显示, 除了常规启动子元件之外, BcWRKY70启动子区含有大量与环境、生长调节相关的作用元件(表 3), 如脱落酸反应元件ABRE、茉莉酸甲酯反应元件TGACG-motif和CGTCA-motif、低温响应元件LTR、参与干旱诱导反应的MYB结合位点ARE以及防御和应激反应中的顺式作用元件TC-rich repeats。这些元件说明BcWRKY70可能与响应环境和激素相关。
| Table 3 cis-Elements analyses in BcWRKY70 5'-flanking region |
利用DNAMAN对BcWRKY70和其他已报道WRKY70蛋白之间进行多序列比对(图 3)。结果显示, BcWRKY70蛋白与芜菁(Brassica rapa, XM_009105752)、牛角瓜(Calotropis procera, MN105122)、岷江百合(Lilium regale, MG149587)、小麦(Triticum aestivum, KY784578) 的WRKY70蛋白同源性分别为86.8%、85%、82.5%和82.1%, 表明BcWRKY70蛋白在植物中高度保守。

|
Figure 3 The sequence alignment of BcWRKY70 and other WRKY70 homologies WRKY conserved domains were boxed |
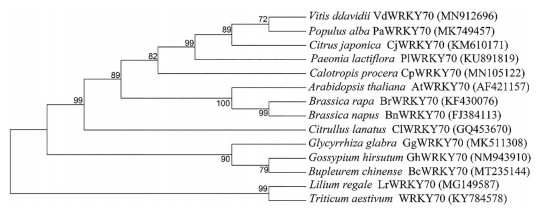
利用MEGA 7.0软件, 采用邻接法构建BcWRKY70蛋白与其他已报道13种植物的WRKY70蛋白的进化树。结果显示(图 4), BcWRKY70蛋白与棉花GhWRKY70蛋白聚为一支。
|
Figure 4 Neighbour-joining phylogenetic tree of the WRKY70 protein sequences in plants |
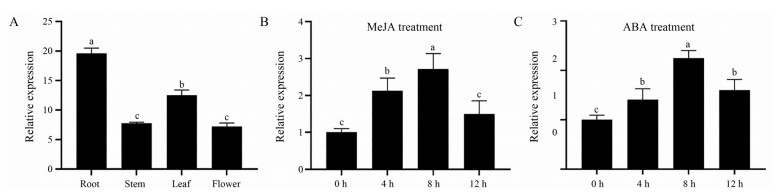
运用qRT-PCR检测BcWRKY70基因在不同组织部位中的表达量, 结果显示, BcWRKY70在北柴胡根、茎、叶和花中均有表达, 根中表达量最高, 且与其他部位的表达量差异显著(图 5A); BcWRKY70受到MeJA和ABA处理强烈诱导(图 5B、5C), 表明BcWRKY70基因参与北柴胡激素应答反应。
|
Figure 5 The expression partterns of BcWRKY70 in different tissues and under MeJA and ABA treatments. Small letters a, b, c, d represent difference between groups |
近年来药用植物基因组学发展迅速, 国内外已经开展青蒿、丹参、西洋参、甘草、人参、三七等多种药用植物的大规模转录组与基因组测序研究。目前, 赤芝、杜仲、人参、黄芩、铁皮石斛等重要药用植物基因组先后公布[17], 为药用植物活性成分合成途径解析及分子辅助育种提供重要基础, 同时也急需对这些基因组展开精细化的功能基因组学研究。
北柴胡功能基因研究方面, 柴胡皂苷合成关键酶基因环阿屯醇合酶和鲨烯合酶[18, 19]、MeJA响应转录因子以及成花基因BcSVP、BcPAF1、BcCO、BcFT[20]已有报道, 为北柴胡中与柴胡皂苷合成以及发育过程基因鉴定提供基础。本课题组在分析北柴胡转录组时, 发现一条根中高表达的EST序列与拟南芥WRKY70同源性最高, 鉴于拟南芥WRKY70在应答病原菌入侵后防御过程中的重要作用[7, 8], 推测该EST在北柴胡抗逆过程发挥作用。因此, 本研究克隆BcWRKY70基因。BcWRKY70属于WRKY家族Ⅲ类亚家族成员, 预测定位于细胞核内, 与GhWRKY70亲缘关系最近, 且与陆地棉GhWRKY70蛋白特征[21]相似。BcWRKY70基因在根中表达量高, 推测其可能在根中发挥重要的调控功能。
为进一步分析BcWRKY70的调控元件, 本研究采用DNA walking获得BcWRKY70基因5'侧翼区, 分析发现该区域共含有21个顺式所用元件, 包含调节发育、应答环境因子、响应ABA和MeJA的顺式作用元件以及与MYB转录因子结合的位点, 提示BcWRKY70基因可能参与胁迫应答或者激素响应, 并且可能会与MYB转录因子结合并受其调控。进一步的qRT-PCR结果显示BcWRKY70基因受脱落酸与茉莉酸甲酯的显著诱导, 与启动子区域作用元件分析结果相互支持。BcWRKY70基因在根中表达量最高, 而根中是柴胡皂苷的积累部位, 提示BcWRKY70基因可能参与柴胡皂苷的生物合成。这些结果显示北柴胡BcWRKY70基因可能在激素间协同、逆境胁迫以及柴胡皂苷合成等方面发挥作用。
大量研究表明WRKY基因响应多种植物激素, 例如乙烯、水杨酸、赤霉素、茉莉酸或脱落酸等, 从而发挥其调控功能[22]。茉莉酸在植物抗病虫防御及逆境反应中具有重要的生理功能[23]。植物遭受干旱、高盐等逆境盐胁迫时, 通过ABA信号转导, 调节气孔关闭, 减少水分损失, 抵御干旱和盐害, 并且诱导多种基因表达与生理反应, 抵御胁迫[24]。本研究结果显示BcWRKY70基因受MeJA、ABA诱导, 表明该基因可能通过茉莉酸与脱落酸信号途径参与北柴胡抗逆反应, 具体作用机制尚待进一步研究。
作者贡献: 第一作者冯飞雪完成相关实验及论文撰写工作; 通讯作者张岗、李依民负责设计、指导实验及论文修改; 吕瑞华、高静、张明英参与实验及数据分析; 王凯、肇玉博、彭亮参与数据分析及对论文的修改。
利益冲突: 无任何利益冲突。
| [1] |
Agarwal P, Reddy MP, Chikara J. WRKY: its structure, evolutionary relationship, DNA-binding selectivity, role in stress tolerance and development of plants[J]. Mol Biol Rep, 2011, 38: 3883-3896. DOI:10.1007/s11033-010-0504-5 |
| [2] |
Zhang Y, Wang L. The WRKY transcription factor superfamily: its origin in eukaryotes and expansion in plants[J]. BMC Evol Biol, 2005, 5: 1. DOI:10.1186/1471-2148-5-1 |
| [3] |
Brand LH, Fischer NM, Harter K, et al. Elucidating the evolutionary conserved DNA-binding specificities of WRKY transcription factors by molecular dynamics and in vitro binding assays[J]. Nucleic Acids Res, 2013, 41: 9764-9778. DOI:10.1093/nar/gkt732 |
| [4] |
Ishiguro S, Nakamura K. Characterization of a cDNA encoding a novel DNA binding protein, SPF1, that recognizes SP8 sequences in the 5' upstream regions of genes coding for sporamin and β-amylase from sweet potato[J]. Mol Gen Genet, 1994, 244: 563-571. DOI:10.1007/BF00282746 |
| [5] |
Zhan ZG. Advances is biosynthesis and regulation of the active ingredient of Salvia miltiorrhiza based on multi-omics approach[J]. Acta Pharm Sin (药学学报), 2020, 55: 2892-2903. |
| [6] |
Yin G, Xu H, Xiao S, et al. The large soybean (Glycine max) WRKY TF family expanded by segmental duplication events and subsequent divergent selection among subgroups[J]. BMC Plant Biol, 2013, 13: 148. DOI:10.1186/1471-2229-13-148 |
| [7] |
Zhou M, Lu Y, Bethke G, et al. WRKY70 prevents axenic activation of plant immunity by direct repression of SARD1[J]. New Phytol, 2018, 217: 700-712. DOI:10.1111/nph.14846 |
| [8] |
Liu H, Liu B, Lou S, et al. CHYR1 ubiquitinates the phosphorylated WRKY70 for degradation to balance immunity in Arabidopsis thaliana[J]. New Phytol, 2021, 230: 1095-1109. DOI:10.1111/nph.17231 |
| [9] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. 2020 Ed. Vol 1. Beijing: China Medical Science Press, 2020: 293.
|
| [10] |
Wu D, Gao Y, Xiang H, et al. Exploration into mechanis of antidepressant of Bupleuri Radix based on network pharmacology[J]. Acta Pharm Sin (药学学报), 2018, 53: 210-219. |
| [11] |
Xie WN, Peng HB, Li Y, et al. Liver with liver stagnation and spleen deficiency syndrome and intestinal microflora[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2021, 27: 129-137. |
| [12] |
Sui C, Zhang J, Wei J, et al. Transcriptome analysis of Bupleurum chinense focusing on genes involved in the biosynthesis of saikosaponins[J]. BMC Genomics, 2011, 12: 539. DOI:10.1186/1471-2164-12-539 |
| [13] |
Han WJ, Xu J, Zhu CR, et al. Gene cloning and prokaryotic expression of transcription factor BcZIP179 from Bupleurum chinense DC.[J]. World Sci Technol Mod Chin Med (世界科学技术-中医药现代化), 2020, 22: 3116-3121. |
| [14] |
Allen GC, Flores-Vergara MA, Krasynanski S, et al. A modified protocol for rapid DNA isolation from plant tissues using cetyltrimethylammonium bromide[J]. Nat Protoc, 2006, 1: 2320-2325. DOI:10.1038/nprot.2006.384 |
| [15] |
Pfaffl MW. A new mathematical model for relative quantification in real-time RT-PCR[J]. Nucleic Acids Res, 2001, 29: e45. DOI:10.1093/nar/29.9.e45 |
| [16] |
Duan MR, Nan J, Liang YH, et al. DNA binding mechanism revealed by high resolution crystal structure of Arabidopsis thaliana WRKY1 protein[J]. Nucleic Acids Res, 2007, 35: 1145-1154. DOI:10.1093/nar/gkm001 |
| [17] |
Chen SL, Song JY, Sun C, et al. Herbal genomics: examining the biology of traditional medicines[J]. Science, 2015, 347: S27-S29. DOI:10.1126/science.aaa3600 |
| [18] |
Li JC, Qi WT, Wang C, et al. Full-length clone and expression analysis of CAS gene in Bupleurum chinense DC.[J]. Mol Plant Breed (分子植物育种), 2021, 19: 2899-2905. |
| [19] |
Sui C, Wei JH, Zhan QQ, et al. Cloning and sequence analysis of squalene synthase gene and cDNA in Bupleurum chinense DC.[J]. Acta Hort Sin (园艺学报), 2010, 37: 283-290. |
| [20] |
Li M, Zhang QF, Pu GB, et al. Cloning and spatio-temporal expression analysis of flowering genes in Bupleurum chinense DC.[J]. Acta Pharm Sin (药学学报), 2021, 56: 1188-1196. |
| [21] |
Liu DM, Lou XY, Yu Y. Cloning and expressing analysis of transcription factor GhWRKY70 in upland cotton[J]. Southwest China J Agric Sci (西南农业学报), 2019, 32: 967-972. |
| [22] |
Sun SH, Yu DQ. WRKY transcription factors in regulation of stress response in plant[J]. Biotechnol Bull (生物技术通报), 2016, 32: 66-76. |
| [23] |
Dai YJ, Luo XF, Zhou WG, et al. Plant systemic signaling under biotic and abiotic stressed conditions[J]. Chin Bull Bot (植物学报), 2019, 54: 255-264. |
| [24] |
Fujita Y, Fujita M, Satoh R, et al. AREB1 is a transcription activator of novel ABRE-dependent ABA signaling that enhances drought stress tolerance in Arabidopsis[J]. Plant Cell, 2005, 17: 3470-3488. DOI:10.1105/tpc.105.035659 |
 2021, Vol. 56
2021, Vol. 56


