固体药物通常有多种固体存在形式, 被称为药物多晶型, 根据其组成、构型构象、排列规律的不同可将多晶型分为单组分多晶型、溶剂合物(水合物)、共晶和盐等。药物的不同晶型在理化性质(溶解性、稳定性、吸湿性) 和生物活性(有效性、安全性、不良反应) 上存在一定差异, 且药物的不同晶型间可以相互转化, 因此为确保药物安全有效, 需寻找药物的多晶型物质, 探索晶型间转化规律, 防止晶型转变对药物质量造成影响, 从而对药物晶型质量进行有效控制 [1-3]。
伊马替尼(imatinib, IM, 图 1a) 化学结构为4-[(4-甲基-1-哌嗪基)甲基]-N-[4-甲基-3-[[4-(3-吡啶基)-2-嘧啶基]氨基]苯基]苯甲酰胺, 是一种强效酪氨酸激酶抑制剂, 因其水溶性较差, 不易被人体吸收, 临床常以其甲磺酸盐的方式销售, 商品名为“格列卫”, 2001年获得美国食品药品监督管理局(FDA) 批准, 用于治疗慢性粒细胞白血病和急性淋巴细胞白血病[4, 5], 同时还可治疗侵袭性全身肥大细胞增多症[6, 7]、纤维化疾病[8]、肺动脉高压等多种疾病[9-11], 近期研究表明, 伊马替尼对COVID-19有潜在药用价值[12-14]。文献调研可知, 伊马替尼甲磺酸盐现已有α、β、ε、δ、F、G、H、I和K等多种晶型报道且均已申请专利保护, 其中α型和β型主要用于临床治疗[15]。Veverka等[16]采用共晶技术制备了伊马替尼甲磺酸盐与5-氟尿嘧啶、羟基脲等共晶, 希望通过构建药物-药物共晶改善其理化性质, 增强抗肿瘤作用。近年来研究发现, 伊马替尼也可与D-酒石酸, L-酒石酸, 琥珀酸和丙二酸成盐改善其水溶性、稳定性和生物利用度[17]。此外, 伊马替尼还可与丁香酸形成共晶提升溶解性[18]。

|
Figure 1 Molecular structures of imatinib (IM, 1a), oxalic acid (OA, 1b) |
本研究采用加液研磨法、高温转晶法及高湿转晶法制备获得了伊马替尼与草酸(oxalic acid, OA, 图 1b) 盐的3种新晶型和1种无定形, 利用粉末X射线衍射法(PXRD)、差示扫描量热法(DSC)、热重分析法(TG)、红外光谱法(IR) 对其进行表征并研究其晶型转化规律, 分析各分子间氢键、盐键等作用力, 探索新盐型多晶型的形成机制。通过晶型转化研究发现, 晶型Ⅱ在室温下稳定, 晶型Ⅰ和Ⅲ及无定形Ⅳ在室温下不稳定; 晶型Ⅰ在室温下可向晶型Ⅱ转化; 晶型Ⅰ、Ⅱ和无定形Ⅳ在相对湿度90%下均可转化为晶型Ⅲ, 晶型Ⅲ在70 ℃下可转化为无定形Ⅳ。选择室温下稳定晶型Ⅱ进行溶解度测定, 结果表明伊马替尼-草酸盐晶型Ⅱ在纯水和pH 6.8缓冲液中可显著提高伊马替尼原料药的溶解度。该研究采用成盐技术制备了4种新型伊马替尼草酸盐, 为打破伊马替尼甲磺酸盐专利壁垒提供了物质基础, 同时研究了4种固体物质间的转化规律, 为伊马替尼新盐型的开发和晶型质量控制提供指导。
材料与方法仪器 粉末X射线衍射仪(Rigaku D/max-2550), 日本理学Rigaku公司; 差示扫描量热仪(DSC1型), 瑞士Mettler Toledo公司; 热重分析仪(TGA/DSC1), 瑞士Mettler Toledo公司; 傅里叶变换红外光谱仪(Spectrum 400型), 美国PerkinElmer公司; 分析天平(XS105 Dual Range型), 瑞士Mettler Toledo公司; 集热式恒温加热磁力搅拌器(DF-101S型), 郑州长城科工贸有限公司; 真空干燥箱(DZF-6020型), 上海一恒科技有限公司; 药品稳定性实验箱(TEMI880型), 上海迈捷实验设备有限公司; 溶出试验仪(RC12AD型), TDTF天大天发有限公司; 高效液相色谱仪(Agilent 1200型), 美国Agilent公司。
试药 伊马替尼(批号: 20190614, 纯度 > 98.0%), 武汉远成科技发展有限公司; 二水合草酸(OA, 批号: 20130718, 分析纯), 国药集团化学试剂有限公司; 实验中使用的溶剂均为分析纯, 实验用水为纯净水。
样品制备 称取伊马替尼493.6 mg和二水合草酸126.0 mg, 置于研钵中, 加3 mL乙醇, 室温下研磨30 min后可得伊马替尼-草酸盐晶型Ⅰ; 晶型Ⅰ在140 ℃下放置30 min可获得晶型Ⅱ; 晶型Ⅰ、Ⅱ在相对湿度90%的环境下放置6天可制备晶型Ⅲ; 晶型Ⅲ在70 ℃下放置5天可制备无定形Ⅳ。
粉末X-射线衍射法 取等量IM、OA原料和IM-OA Ⅰ、Ⅱ、Ⅲ和Ⅳ盐型样品, 研磨过筛后上机测试。测试条件为: CuKα靶, 电压40 kV、电流150 mA, 2θ扫描范围在3°~40°, 步长0.02°, 扫描速度为8°·min-1。
差示扫描量热法 分别称取IM、OA原料和IM-OA Ⅰ、Ⅱ、Ⅲ和Ⅳ盐型样品约3 mg, 在30~250 ℃内测试差示扫描量热曲线, N2保护, 升温速率设为10 ℃·min-1。
热重分析法 称取IM-OA Ⅰ、Ⅱ、Ⅲ和Ⅳ盐型样品约10 mg, 扫描范围30~250 ℃测试失重曲线, N2保护, 升温速率设为10 ℃·min-1。
红外光谱分析法 分别称取等量的IM、OA原料和IM-OA Ⅰ、Ⅱ、Ⅲ和Ⅳ盐型样品适量, 采用衰减全反射法记录光谱数据, 扫描范围4 000~650 cm-1, 扫描次数16次, 分辨率为4 cm-1。
溶解度实验 分别称取过100目筛的30 mg的IM-OA Ⅱ (以IM计), 分别加入450 mL溶出介质(pH 6.8缓冲溶液, 纯水) 于溶出仪, 在37 ℃、转速100 r·min-1条件下进行溶解度实验, 分别于5、15、30、45、60、90、120、180、240和360 min取样, 用0.22 μm滤膜过滤, 续滤液用高效液相色谱法分析测定样品的溶解性能。测试条件[19]: XB-C18色谱柱(250 mm × 4.6 mm, 5 μm); 流动相: 0.05 mol·L-1 KH2PO4-乙腈(77∶23, v/v); 检测波长: 272 nm; 流速: 1.0 mL·min-1; 柱温: 30 ℃; 进样量: 10 μL。
结果与讨论 1 粉末X-射线衍射分析粉末X射线衍射分析是研究多晶粉末的有效手段, 衍射图谱具有特征性, 可通过分析衍射峰位置、强度、形状的变化鉴别物相, 研究晶型转化过程[20]。伊马替尼草酸盐的4种盐型及其原料的PXRD图谱见图 2。对比发现, IM-OA Ⅰ、Ⅱ、Ⅲ和Ⅳ的PXRD图谱各异且与原料PXRD图谱明显不同, 表明形成了4种伊马替尼草酸盐新固体物质。与原料比较可知, 在IM-OA的4种盐中, 归属于IM的2θ为6.02°、9.58°、12.88°、17.18°和24.30°的特征峰均消失, 归属于OA的2θ为14.92°、18.87°和29.10°特征峰消失, 同时在4种盐型中形成新的衍射峰, 晶型Ⅰ中2θ为4.52°、8.34°、8.98°、10.13°、20.34°和21.06°形成新衍射峰, 晶型Ⅱ中2θ为6.14°、10.40°和17.27°形成新衍射峰, 晶型Ⅲ中2θ为3.99°、6.21°、7.76°、16.25°、22.98°和25.33°形成新衍射峰, 盐Ⅳ为无定形, 没有明显衍射峰。在研究4种物质转化时, 上述特征衍射峰峰强不断变化, 可依据它们的形成与消失判断晶型转化过程的进度与方向。
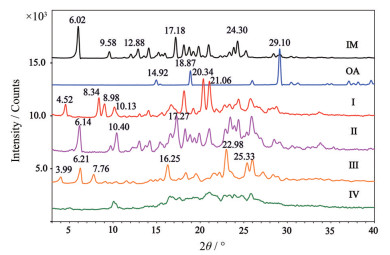
|
Figure 2 PXRD of IM, OA, IM-OA salt polymorphs Ⅰ, Ⅱ, Ⅲ and Ⅳ |
差示扫描量热法是晶型物质鉴别的方法之一, 它通过研究样品在程序控温下的热力学行为, 测定待测物熔点, 判断样品有无结晶溶剂, 研究样品的相变过程[21]。伊马替尼草酸盐的4种盐型及其原料的DSC图谱见图 3。由DSC可知, IM的熔点为210.28 ℃, OA为二水合草酸, 可在101.23和191.17 ℃下产生两个吸热峰。IM和OA形成的4种新盐型均产生了不同于原料的吸热峰, 其中晶型Ⅰ可在75.37、116.40和197.66 ℃下产生3个吸热峰, 表明晶型Ⅰ含有结晶溶剂; 晶型Ⅱ在196.53 ℃处有一个尖锐的吸热峰, 表明晶型Ⅱ不含溶剂且其熔点位于196.53 ℃; 晶型Ⅲ在60~130 ℃内吸热, 表明晶型Ⅲ含有溶剂, 且在该范围内晶型Ⅲ发生失水及熔融等多个热反应; 盐型Ⅳ为无定形, DSC图谱中无明显吸热峰, 玻璃化转变温度(Tg) 为140.00 ℃。四种盐型DSC图谱不同, 表明在程序升温过程中样品热力学行为不同, 这与4种盐型的组成、分子间作用力及分子排列不同有关。

|
Figure 3 DSC of IM, OA, IM-OA salt polymorphs Ⅰ, Ⅱ, Ⅲ and Ⅳ |
热重分析法是一种研究在程序控温下待测样品质量与温度变化关系的热分析技术, 它通过分析失重温度和失重百分比, 判断样品稳定性, 确定样品组成[22, 23]。伊马替尼草酸盐4种盐型的TG图谱及失重信息见图 4。由TG图谱可知, 在该程序升温下4种盐型样品在190~250 ℃下均有失重台阶, 表明4种盐型在该温度下分解, 晶型Ⅰ在40~105 ℃和105~150 ℃内仍有两个失重台阶, 通过计算确定晶型Ⅰ中可能含有2分子水(实验值1.90) 和0.5分子乙醇(实验值0.43); 晶型Ⅲ在40~120 ℃内有一个失重台阶, 通过计算确定晶型Ⅲ可能含有5.0分子水(实验值5.0); 晶型Ⅱ和盐型Ⅳ在30~200 ℃内没有失重台阶, 表明二者不含有溶剂。
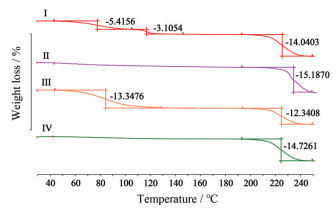
|
Figure 4 TG of IM-OA salt polymorphs Ⅰ, Ⅱ, Ⅲ and Ⅳ |
红外吸收光谱是晶型物质鉴别与分析的辅助手段, 不同晶型物质分子间作用力不同, 共价键弯曲与伸缩振动存在差异, 因此可利用红外吸收峰的移动与改变推断未知物结构, 分析不同晶型物质的氢键等分子间作用力[24-26]。由图 5可知, IM-OA-Ⅰ、Ⅱ、Ⅲ和Ⅳ样品IR谱图相似, 均在3 440、3 263、1 725和1 645 cm-1等产生吸收峰, 其中3 440~3 216 cm-1归属于νO-H, 与OA相比, IM与OA成盐后O-H吸收峰红移且峰强减小, 可能与氢键的形成及O-H质子转移有关; 3 263 cm-1归属于νN-H, 相较于IM, IM与OA成盐后N-H吸收峰红移变宽, 可能与氢键的形成有关; 1 725和1 645 cm-1归属于νC=O, 其中1 645 cm-1归属于IM中C=O的伸缩振动, 与IM相比未发生移动, 1 725cm-1归属于OA中C=O的伸缩振动, 与OA相比发生蓝移。IM-OA-Ⅰ、Ⅱ、Ⅲ和Ⅳ四种盐型相比, 晶型Ⅰ和Ⅲ可在3 623~3 015cm-1处形成更宽更强的O-H伸缩振动吸收峰, 这是由于晶型Ⅰ和Ⅲ可能含有乙醇和水, 结晶溶剂可与IM和OA形成更多的氢键从而使νO-H变宽变强。

|
Figure 5 IR of IM, OA, IM-OA salt polymorphs Ⅰ, Ⅱ, Ⅲ and Ⅳ |
不同药物晶型间的转化普遍存在, 根据转化过程是否可逆又将晶型转化过程分为单变型和互变型[27, 28]。本研究中通过PXRD图谱判断晶型转化过程的进度与方向, 当PXRD图谱中原晶型衍射峰完全消失, 新生成的衍射峰的位置和强度不再变化稳定重现时认为转化过程完全。伊马替尼草酸盐4种盐型的转化关系见图 6, 由图可知晶型Ⅰ、Ⅱ、Ⅲ之间的转化为单变型, 晶型Ⅰ室温下不稳定, 在室温下(24 ℃、39% RH) 放置18 h晶型Ⅰ可完全转变为晶型Ⅱ, 也可采用高温转晶法加速转化过程, 如将晶型Ⅰ置于140 ℃下放置30 min就可完全转为晶型Ⅱ; 晶型Ⅰ、Ⅱ在相对湿度90%的环境下放置6天可转为晶型Ⅲ。而晶型Ⅲ、无定形Ⅳ间的转化为互变型, 晶型Ⅲ在70 ℃下放置5天可转化为无定形Ⅳ, 无定形Ⅳ在相对湿度90%的环境下放置4天又可转化为晶型Ⅲ, 但晶型Ⅲ和无定形Ⅳ在室温下均不稳定, 在室温下二者会相互转化最终得到二者的混晶。
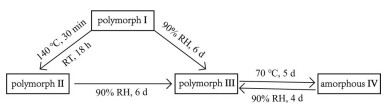
|
Figure 6 Transformation rules among IM-OA salt polymorphs Ⅰ, Ⅱ, Ⅲ and Ⅳ |
IM原料药和IM-OA Ⅱ在pH 6.8缓冲液和纯水中的溶解度结果见图 7。在pH 6.8缓冲液中, IM原料药的平衡溶解度为14.8 μg·mL-1, IM-OA Ⅱ的平衡溶解度为61.1 μg·mL-1, IM-OA Ⅱ相比于IM原料药溶解度提高了4.1倍。在纯水中, IM原料药的平衡溶解度为3.1 μg·mL-1, IM-OA Ⅱ的平衡溶解度为65.7 μg·mL-1, IM-OA Ⅱ相比于IM原料药溶解度提高了21.2倍。

|
Figure 7 In vitro dissolution studies of IM and IM-OA Ⅱ in phosphate buffer pH 6.8 and pure water |
伊马替尼甲磺酸盐是治疗慢性粒细胞白血病和急性淋巴细胞白血病的一线药物, 已有多个专利保护, 其游离碱水溶性差, 为突破专利壁垒, 本研究通过成盐技术制备了伊马替尼草酸盐, 并获得新盐的3种新晶型和1种无定形, 表明伊马替尼草酸盐存在多晶型现象。PXRD、DSC、TG、IR技术可用于表征和区分4种不同盐型。伊马替尼草酸盐晶型Ⅱ在室温下稳定, 晶型Ⅰ、Ⅲ和无定形Ⅳ在室温下不稳定; 晶型Ⅰ在室温下可向晶型Ⅱ转化; 晶型Ⅰ、Ⅱ和无定形Ⅳ在相对湿度90%下均可转化为晶型Ⅲ, 晶型Ⅲ在高温(70 ℃) 可转化为无定形Ⅳ。研究室温下稳定晶型Ⅱ的溶解度, 结果表明伊马替尼-草酸盐晶型Ⅱ在纯水和pH 6.8缓冲溶液中可显著提高IM原料药溶解度, 因此该晶型可进一步作为伊马替尼新物质进行开发, 但样品应注意干燥保存。本研究制备的伊马替尼草酸盐为打破伊马替尼甲磺酸盐专利壁垒提供了物质基础和研究数据, 也为伊马替尼新盐型的开发和晶型质量控制提供指导。
作者贡献: 房政钰负责样品制备、表征和论文撰写; 邢逞负责热分析实验, 邢文慧负责红外光谱实验, 王雪负责粉末衍射实验; 龚宁波和吕扬负责实验设计和论文修改审阅。
利益冲突: 所有作者声明本文无任何利益冲突。
| [1] |
Ma K, Gao J, Ma L. Pharmaceutical cocrystals and salts[J]. J China Pharm Univ (中国药科大学学报), 2012, 43: 475-480. |
| [2] |
Zhang YX, Wang LY, Dai JK, et al. The comparative study of cocrystal/salt in simultaneously improving solubility and permeability of acetazolamide[J]. J Mol Struct, 2019, 1184: 225-232. DOI:10.1016/j.molstruc.2019.01.090 |
| [3] |
Gong NB, Yu HM, Wang Y, et al. Crystal structures, stability, and solubility evaluation of a 2∶1 diosgenin-piperazine cocrystal[J]. Nat Prod Bioprospect, 2020, 10: 261-267. DOI:10.1007/s13659-020-00256-y |
| [4] |
Xu XM, Xing HY, Han LY. Research progress on the drug resistance mechanism of imatinib in the treatment of chronic myeloid leukemia[J]. Chin J Conval Med (中国疗养医学), 2019, 28: 804-807. |
| [5] |
Liu L. The pharmacological actions and clinical application of imatinib[J]. World Latest Med Inf (世界最新医学信息文摘), 2014, 14: 156, 163. |
| [6] |
Helga JD, Hanneke JCK, Jaap JD, et al. Imatinib mesylate in the treatment of systemic mastocytosis[J]. Cancer, 2006, 107: 345-351. DOI:10.1002/cncr.21996 |
| [7] |
Savchuk A, Cabrera W, Sola E, et al. Chronic myeloid leukemia developing after systemic mastocytosis: fast and complete molecular response induced by imatinib[J]. HemaSphere, 2019, 3: 890-891. |
| [8] |
Wu T, Goodarzi H, Wang J, et al. Imatinib as a potentially effective therapeutic alternative in corticosteroid‐resistant eosinophilic fasciitis[J]. Ped Dermatol, 2020, 37: 1171-1172. DOI:10.1111/pde.14327 |
| [9] |
Hoeper MM, Opitz C, Olschewski H, et al. Imatinib for pulmonary arterial hypertension[J]. Dtsch Med Wochenschr, 2014, 139: 151-154. DOI:10.1055/s-0034-1387457 |
| [10] |
Leong ZP, Arita S, Hikasa Y, et al. Long-term effect of low-dose imatinib therapy for pulmonary hypertension due to chronic degenerative mitral valve disease in six dogs[J]. Thai J Vet Med, 2018, 48: 499-505. |
| [11] |
Douschan P, Kovacs G, Foris V, et al. Imatinib for right heart failure in COPD[J]. Pulm Circ, 2018, 9: 1-3. |
| [12] |
Mikhaylova IN, Treshalina NM, Shubina IZ, et al. Antitumor proteinkinase inhibitor imatinib may be regarded as a potential correcting agent for COVID-19 associated pulmonary fibrosis[J]. Adv Mol Onc, 2021, 7: 20-28. DOI:10.17650/2313-805X-2020-7-4-20-28 |
| [13] |
Assaad HS, Assaad-Khalil S. Imatinib a tyrosine kinase inhibitor: a potential treatment for SARS- COV-2 induced pneumonia[J]. Alex J Med, 2020, 56: 68-72. |
| [14] |
Nejat R, Sadr AS. Are losartan and imatinib effective against SARS-CoV2 pathogenesis? A pathophysiologic-based in silico study[J]. Silico Pharmacol, 2021, 9: 1-22. DOI:10.1007/s40203-020-00058-7 |
| [15] |
Wang Q, Xia YX. Patent review of imatinib mesilate's crystal form[J]. Guangdong Chem Ind (广东化工), 2019, 46: 114. |
| [16] |
Veverka M, Šimon P, Gallovič J, et al. Imatinib mesylate cocrystals: synthesis, screening, and preliminary characterization[J]. Monatsh Chem, 2012, 143: 1405-1415. DOI:10.1007/s00706-012-0788-3 |
| [17] |
Birger HM, Manley PW, Marz M. 4-[(4-Methyl-1-piperazinyl)methyl]-N-[4-methyl-3-[4-(3-pyridinyl)-2-pyrimidinyl]aminophenyl]-the salt form of benzamide: CN, 100558723C[P]. 2009-11-11.
|
| [18] |
Reggane M, Wiest J, Saedtler M, et al. Bioinspired co-crystals of imatinib providing enhanced kinetic solubility[J]. Eur J Pharm Biopharm, 2018, 128: 290-299. DOI:10.1016/j.ejpb.2018.05.012 |
| [19] |
Luo XX, Huang L, Li TF, et al. Simultaneous determination of concentrations of imatinib and N-desmethyl imatinib in human plasma by HPLC[J]. Chin J New Drugs (中国新药杂志), 2018, 27: 1159-1164. |
| [20] |
Thayyil AR, Juturu T, Nayak S, et al. Pharmaceutical co-crystallization: regulatory aspects, design, characterization, and applications[J]. Adv Pharm Bull, 2020, 10: 203-212. DOI:10.34172/apb.2020.024 |
| [21] |
Li QY, Sun T, Wang DK. Preparation, characterization and properties of ginkgolide B polymorph[J]. Chin J Pharm (中国药剂学杂志), 2019, 17: 100-106. |
| [22] |
Sarkar A, Rohani S. Cocrystals of acyclovir with promising physicochemical properties[J]. J Pharm Sci, 2015, 104: 98-105. DOI:10.1002/jps.24248 |
| [23] |
Lin L, Ning BM, Yang LH, et al. Application of thermal analysis for drug control[J]. Chin J New Drugs (中国新药杂志), 2014, 23: 1734-1737. |
| [24] |
Chen X, Wu S, Zhang JL, et al. Polymorphic study and pharmacokinetic evaluation of hypolipidemic candidate IMM-H007[J]. Chin J Pharm (中国医药工业杂志), 2020, 51: 1029-1035. |
| [25] |
Zhao QY, Wu JY, Shen ZB. Application of infrared spectroscopy in pharmaceutical polycrystalline analysis[J]. Guangdong Chem Ind (广州化工), 2013, 41: 34-35, 54. |
| [26] |
Xu P, Cao ZN, Qian ZH, et al. Infrared spectrum analysis of heroin and its salt form[J]. Chin J Drug Depend (中国药物依赖性杂志), 2010, 19: 493-496. |
| [27] |
Perlovich G, Surov A. Polymorphism of monotropic forms: relationships between thermochemical and structural characteristics[J]. Acta Crystallogr B Struct Sci Cryst Eng Mater, 2020, 76: 65-75. DOI:10.1107/S2052520619015671 |
| [28] |
Simões RG, Cátia SD, Lopes M, et al. Conformational and nonconformational polymorphism in 4'-hydroxyvalerophenone: a structure-energetics-dynamics perspective[J]. Cryst Growth Des, 2020, 20: 2321-2336. DOI:10.1021/acs.cgd.9b01481 |
 2021, Vol. 56
2021, Vol. 56


