失眠是影响身心健康的一大重要问题[1]。据统计, 全世界至少有6%的人遭受失眠和睡眠紊乱的困扰[2]。临床上常用镇静催眠类化学药治疗失眠, 但该类药物不良反应强, 依赖性高, 并存在戒断反应[3], 因此, 不良反应小、疗效好的中药越来越受到人们的关注。
复方酸枣仁汤是治疗失眠的经典名方, 张仲景《金匮要略·血痹虚劳病脉证并治》[4]记载“虚劳虚烦不得眠, 酸枣仁汤主之”。该方剂临床疗效显著, 沿用至今。复方酸枣仁汤由酸枣仁、知母、茯苓、川芎、甘草五味药组成, 方中酸枣仁养血补肝, 为君药; 茯苓安神通阴, 知母滋阴润燥、清热除烦, 二者共为臣药; 川芎调肝血疏肝气, 为佐药; 甘草和中缓急, 调和诸药, 为使药[5], 各药味相辅相成, 能够起到养血补肝, 治疗失眠的功效。
复方酸枣仁汤成分繁多, 目前含量测定指标的选取未能很好地揭示药物与靶点、疾病之间的关联性, 不能体现中药复方“多靶点、多通路”的作用特点[6], 因此, 本研究采用HPLC-Q-TOF MS/MS法鉴定了复方酸枣仁汤的化学成分, 采用网络药理学方法建立了“化学成分-疾病靶点”相关性网络[7], 预测了复方酸枣仁汤的药效物质, 并根据传统水提取方法, 建立了基于药效物质的高效、快速的含量测定方法, 为复方酸枣仁汤质量评价体系的完善提供参考。
材料与方法仪器 Agilent 1260 Infinity Ⅱ (美国安捷伦公司)-Q-TOF 5600 (AB Sciex公司)、Agilent 1290 Infinity Ⅱ (美国安捷伦公司); PeakViewTM v 1.1软件(AB Sciex公司); AB135-S十万分之一天平(Mettler TOLEDO仪器有限公司); DZTW电子调温加热套(北京市永光明医疗仪器有限公司); TDZ24 WS低速台式离心机(湖南湘仪实验室仪器开发有限公司); EYELA N-1100型旋转蒸发仪(日本东京理化器械株式会社); SHZ-Ⅲ型循环水真空泵(上海亚荣生化仪器厂); KQ-300E型超声波清洗器(昆山市超声仪器有限公司)。
试剂 酸枣仁皂苷A (批号CHB191210); 酸枣仁皂苷B (批号CHB190125); 斯皮诺素(批号CHB171011); 6'''-阿魏酰斯皮诺素(批号CHB180324); 知母皂苷BⅡ (批号CHB18115); 新芒果苷(批号CHB160910); 芒果苷(批号CHB160628); 阿魏酸(批号CHB180206); 洋川芎内酯A (批号CHB180615); 洋川芎内酯Ⅰ (批号CHB170926); 甘草苷(批号CHB180608); 甘草酸(CHB170606); 芹糖甘草苷(批号CHB180109)。所有的对照品均购自成都克洛玛生物有限公司, 含量质量分数均不低于98.0%。纯净水(杭州娃哈哈有限公司); 乙腈(色谱纯, 美国Fisher有限公司); 甲酸(色谱纯, 天津市博迪试剂有限公司); 甲醇(色谱纯, 美国Sigma-Aldrich公司); 磷酸(色谱纯, 天津市科密欧化学试剂有限公司)。
材料 酸枣仁、知母、茯苓、甘草饮片均由某企业提供, 川芎饮片购自沈阳市各大药房, 所有饮片均由沈阳药科大学中药学院王东教授鉴定, 分别为鼠李科植物酸枣Ziziphus jujuba Mill. var. spinosa (Bunge) Hu ex H. F. Chou的干燥成熟种子、百合科植物知母Anemarrhena asphodeloides Bge.的干燥根茎、多孔菌科真菌茯苓Poria cocos (Schw.) Wolf的干燥菌核、豆科植物甘草Glycyrrhiza uralensis Fisch.的干燥根和根茎、伞形科植物川芎Ligusticum chuanxiong Hort.的干燥根茎。
化学成分鉴定色谱条件 色谱柱: Aglient Zorbax Eclipse Plus C18 (150 mm × 4.6 mm, 3.5 μm); 流动相: 0.1%甲酸水溶液(A)-乙腈(B); 流速为1.0 mL·min-1, 柱温30 ℃, 梯度洗脱, 洗脱程序: 0~3 min, 7%~9% B; 3~8 min, 9%~15% B; 8~16 min, 15%~20% B; 16~28 min, 20%~55% B; 28~38 min, 55%~70% B; 38~48 min, 70%~90% B; 48~51 min, 90% B。进样量: 5 μL。
质谱条件 采用AB Sciex Q TOF系统, 离子源为电喷雾离子源(ESI源); 检测方式为正、负离子检测; 离子喷雾电压为-4 500 V和5 000 V; 离子源温度: 550 ℃; 雾化气(N2) 压力: 55 psi (1 psi ≈ 6.9 kPa); 辅助气(N2) 压力: 55 psi; 气帘气(N2) 压力: 35 psi; TOF MS模式下扫描范围为m/z 100~1 500 Da; 去簇电压(DP): 60 V (正离子)/-60 V (负离子); 碰撞能(CE): 10 V (正离子)/-10 V (负离子); TOF MS/MS模式下扫描范围为m/z 100~1 000 Da; 去簇电压(DP): 60 V (正离子)/-60 V (负离子); 碰撞能(CE): 35 V (正离子)/-35 V (负离子)。
对照品溶液的制备 分别取酸枣仁皂苷A、酸枣仁皂苷B、斯皮诺素、6'''-阿魏酰斯皮诺素、知母皂苷BⅡ、芒果苷、新芒果苷、阿魏酸、洋川芎内酯Ⅰ、洋川芎内酯A、甘草苷、甘草酸、芹糖甘草苷13种对照品适量, 用甲醇溶解, 摇匀配制成浓度均为25 μg·mL-1的混合对照品溶液。
供试品溶液的制备 将收集的酸枣仁、知母、茯苓、川芎、甘草多批饮片按复方酸枣仁汤处方比例, 随机组合成10批次样品。精密称取各味饮片于圆底烧瓶中, 加入8倍体积的水, 浸泡80 min, 加热回流30 min, 采用七号药筛滤过。向药渣中继续加入6倍体积的水, 加热回流25 min, 滤过, 合并两次滤液, 减压浓缩至0.83 g·mL-1 (生药材), 即得复方酸枣仁汤。精密量取复方酸枣仁汤2.0 mL于10 mL量瓶, 加入甲醇适量, 超声20 min, 放冷, 定容, 摇匀, 4 000 r·min-1离心5 min, 取上清, 过0.22 μm微孔滤膜, 取续滤液即得。
按照上述色谱条件和质谱条件, 进样分析, 通过与对照品保留时间、高分辨准分子离子及碎片离子等信息进行比对, 并参考文献, 进行结构鉴定。
网络药理学分析流程 通过查阅文献, 在已鉴定出来的化合物中, 寻找复方酸枣仁汤组方饮片水提入血成分, 作为潜在的活性成分。通过PubChem[8]查询潜在活性成分的3D结构, 导入PharmMapper数据库[9]预测成分的靶点(仅选择“人源基因”)。通过GeneCards数据库和OMIM数据库, 以“insomnia”和“sleepless”为关键词, 搜索与失眠有关的靶点。成分靶点与疾病靶点取交集得到共同靶点, 将这些共同靶点视为复方酸枣仁汤治疗失眠的关键靶点, 利用Cytoscape 3.7.2软件[10]构建“化学成分-疾病靶点”网络并进行通路富集分析, 筛选药效物质。
UHPLC法测定6种药效物质UHPLC色谱条件 色谱柱: Waters Cortecs T3 (2.1 mm × 150 mm, 1.6 μm); 流动相: 0.1%磷酸水溶液(A)-乙腈(B); 流速为0.3 mL·min-1, 柱温30 ℃, 梯度洗脱, 洗脱程序: 0~3 min, 7%~8% B; 3~8 min, 8%~8.5% B; 8~13 min, 8.5% B; 13~16 min, 8.5%~9% B; 16~20 min, 9% B; 20~23 min, 9%~10% B; 23~27 min, 10%~11% B; 27~40 min, 11%~15% B; 40~55 min, 15%~17% B; 55~60 min, 17%~19% B; 60~62 min, 19%~22% B; 62~66 min, 22%~90% B。进样量1 μL, 检测波长275 nm。
混合对照品溶液的制备 分别取新芒果苷、芒果苷、阿魏酸、洋川芎内酯Ⅰ、斯皮诺素、6'''-阿魏酰斯皮诺素对照品适量, 精密称定, 用甲醇溶解、稀释定容, 配制成质量浓度分别为386.9、271.9、44.32、28.74、93.15和33.87 μg·mL-1的混合对照品溶液。
供试品溶液的制备 按照“化学成分鉴定”项下“供试品溶液的制备”方法, 制备供试品溶液。
缺味对照溶液的制备 按照“化学成分鉴定”项下“供试品溶液的制备”方法, 分别制备缺少酸枣仁饮片、缺少知母饮片、缺少川芎饮片的缺味对照溶液。
系统适用性 取混合对照品溶液, 按照“UHPLC色谱条件”, 连续进样6次, 记录理论塔板数(n)、相邻色谱峰的分离度(R)、各色谱峰信噪比、拖尾因子、计算各待测成分峰面积的RSD。
分析方法验证专属性 分别取混合对照品溶液、供试品溶液、各缺味对照溶液, 按照“UHPLC色谱条件”, 进样分析, 比较色谱图。
线性与范围 分别精密量取上述混合对照品溶液0.5、1.0、2.0、5.0和7.5 mL置于10 mL量瓶中, 用甲醇定容至刻度, 将这5种溶液及“混合对照品溶液的制备”项下的溶液作为标准系列溶液。按照“UHPLC色谱条件”进样分析, 记录峰面积。
检测限和定量限 取混合对照品溶液, 用甲醇进行逐步稀释, 以信噪比为3∶1和10∶1为参考, 配制溶液, 分别测得各化合物的检测限和定量限。
稳定性 取供试品溶液, 4 ℃放置, 分别于0、2、4、8、12和24 h进样分析, 计算各待测成分峰面积的RSD。
精密度 精密量取同一批复方酸枣仁汤1.0、2.0和3.0 mL, 按“化学成分鉴定”项下“供试品溶液的制备”方法, 制备低、中、高3个浓度的供试品溶液, 每一种浓度平行制备3份, 按照“UHPLC色谱条件”进样分析, 计算各成分含量, 并计算RSD, 作为重复性实验。精密量取同一批复方酸枣仁汤2.0 mL, 按“化学成分鉴定”项下“供试品溶液的制备”方法, 每天制备相同浓度的供试品溶液3份, 平行制备3天, 按照“UHPLC色谱条件”连续3天进样分析, 计算各成分含量, 并计算RSD, 作为中间精密度实验。
准确度 取已知各待测成分含量的复方酸枣仁汤9份, 精密量取1.0 mL, 分别按约为已知含量的50%、100%和150%等3个水平加入对照品, 制备低、中、高3种不同浓度的供试品溶液, 每一种浓度平行制备3份, 按照“UHPLC色谱条件”进样分析。计算各待测成分的平均回收率及RSD。
耐用性 分别考察色谱条件在不同进样体积(0.9、1和1.1 μL), 不同检测波长(274、275和276 nm), 不同体积分数的磷酸溶液流动相(体积分数为0.09%磷酸溶液、体积分数为0.10%磷酸溶液和体积分数为0.11%磷酸溶液), 不同柱温(29、30和31 ℃) 的条件下, 测定待测成分的含量, 并计算不同条件的RSD。
含量测定 分别取混合对照品溶液, 按供试品溶液制备方法制备10批不同批次饮片提取的复方酸枣仁汤供试品, 按“UHPLC色谱条件”进样分析, 记录各待测成分峰面积, 采用外标法计算各待测成分的含量。
结果 1 化学成分鉴定在复方酸枣仁汤中初步鉴定了103个化合物, 通过与对照品保留时间、高分辨准分子离子及碎片离子等信息进行比对, 准确鉴定了13个化合物, 所有化合物的质量误差均小于5.0×10-6。鉴定结果及成分信息如表 1[11-18]所示。对103个化合物的来源进行归属[16-18], 发现有27个化合物来源于酸枣仁, 14个来自知母, 5个来自茯苓, 20个来自川芎, 33个来源于甘草, 化合物100、101、102、103为酸枣仁和甘草两种饮片的共有成分。
| Table 1 Identification of 103 chemical compounds in Compound Suanzaoren Decoction by HPLC-Q-TOF MS/MS. aIdentified with reference standard. SZR: Ziziphi Spinosae semen; ZM: Anemarrhenae Rhizoma; FL: Poria; CX: Chuanxiong Rhizoma; GC: Glycyrrhizae Radix et Rhizoma |
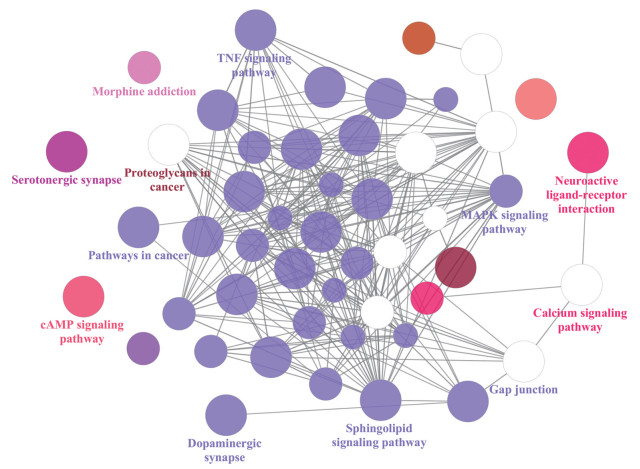
依据实验室的前期研究成果[13]以及文献报道, 在已鉴定的化合物中查找到入血成分27个, 如表 2[19-26]所示, 每种成分选取排名靠前的35个靶点。以“insomnia”和“sleepless”为关键词, 得到与失眠有关的靶点5 052个。成分靶点与疾病靶点取交集得到156个关键靶点, 将27个入血成分及关键靶点导入Cytoscape 3.7.2, 构建“化学成分-疾病靶点”的可视化网络, 该网络有183个节点, 460条边, 如图 1所示。图中绿色菱形代表关键靶点, 粉色圆形代表入血成分。针对关键靶点进行通路富集分析, 筛选P < 0.01的通路, 最终富集到49条信号通路, 如图 2所示。选取度值高于24的6个成分作为复方酸枣仁汤的药效物质对其进行质量控制, 它们依次为新芒果苷(28)、芒果苷(27)、洋川芎内酯Ⅰ (27)、斯皮诺素(26)、6'''-阿魏酰斯皮诺素(25)、阿魏酸(25)。
| Table 2 Degree and source of 27 compounds found in blood |

|
Figure 1 The "component-target" network of Compound Suanzaoren Decoction |
|
Figure 2 Pathways based on KEGG pathways analysis |
结果显示按新芒果苷峰计, 理论塔板数(n) 均大于4.2×104, 相邻色谱峰的分离度(R) 均大于1.5, 各色谱峰信噪比(S/N) 均大于10, 拖尾因子均介于0.95~1.05之间。新芒果苷、芒果苷、阿魏酸、洋川芎内酯Ⅰ、斯皮诺素、6'''-阿魏酰斯皮诺素峰面积的RSD分别为0.8%、0.8%、0.8%、0.6%、0.9%、1.0%, 表明仪器的精密度良好。
4 分析方法验证 4.1 专属性通过对比混合对照品溶液、供试品溶液、缺味对照溶液, 结果显示, 新芒果苷、芒果苷来自知母, 阿魏酸、洋川芎内酯Ⅰ来自川芎, 斯皮诺素、6'''-阿魏酰斯皮诺素来自酸枣仁, 该方法专属性良好, 阴性溶液无干扰。典型色谱图见图 3。

|
Figure 3 UHPLC chromatogram of test solution of Compound Suanzaoren Decoction (A); UHPLC chromatogram of negative solution: negative control sample of Compound Suanzaoren Decoction without Ziziphi Spinosae semen (B); negative control sample of Compound Suanzaoren Decoction without Chuanxiong Rhizoma (C); negative control sample of Compound Suanzaoren Decoction without Anemarrhenae Rhizoma (D). 1: Neomangiferin; 2: Mangiferin; 3: Ferulic acid; 4: Senkyunolide Ⅰ; 5: Spinosin; 6: 6'''-Feruloylspinosin |
以各对照品质量浓度(μg·mL-1) 为横坐标(x), 以峰面积A为纵坐标(y), 绘制标准曲线, 计算回归方程。新芒果苷、芒果苷、阿魏酸、洋川芎内酯Ⅰ、斯皮诺素、6'''-阿魏酰斯皮诺素在考察范围内线性关系良好, 相关系数均大于0.999 0, 结果见表 3。
| Table 3 Results of linearity test |
结果显示, 新芒果苷、芒果苷、阿魏酸、洋川芎内酯Ⅰ、斯皮诺素和6'''-阿魏酰斯皮诺素的检测限质量浓度分别为0.201 5、0.504 5、0.372 2、0.191 9、0.284 7和0.188 9 μg·mL-1, 各成分定量限质量浓度分别为0.604 6、0.756 8、0.744 5、0.383 8、0.569 4和0.377 9 μg·mL-1, 表明方法灵敏度良好。
4.4 稳定性新芒果苷、芒果苷、阿魏酸、洋川芎内酯Ⅰ、斯皮诺素和6'''-阿魏酰斯皮诺素峰面积的RSD分别为1.6%、1.4%、2.0%、1.6%、1.4%和1.6%, 各成分在24 h内稳定(RSD < 2.0%)。
4.5 精密度重复性实验中新芒果苷、芒果苷、阿魏酸、洋川芎内酯Ⅰ、斯皮诺素和6'''-阿魏酰斯皮诺素含量的RSD分别为2.1%、1.2%、1.1%、0.8%、1.1%、1.3%, 表明方法重复性良好(RSD < 3.0%)。中间精密度实验中各成分含量的RSD分别为0.6%、0.8%、1.0%、0.5%、0.7%和1.2%, 表明方法中间精密度良好(RSD < 3.0%)。
4.6 准确度测得新芒果苷、芒果苷、阿魏酸、洋川芎内酯Ⅰ、斯皮诺素和6'''-阿魏酰斯皮诺素的平均回收率在104.2%~108.9%, RSD均不高于2.1%, 表明方法准确度良好。
4.7 耐用性各色谱条件下, 新芒果苷、芒果苷、阿魏酸、洋川芎内酯Ⅰ、斯皮诺素和6'''-阿魏酰斯皮诺素含量的RSD均不超过2.5%, 表明方法耐用性良好。
5 含量测定结果测得10批复方酸枣仁汤中新芒果苷、芒果苷、阿魏酸、洋川芎内酯Ⅰ、斯皮诺素和6'''-阿魏酰斯皮诺素的含量, 结果如表 4所示。
| Table 4 The content results of 6 compounds in ten batches |
实验研究表明, 失眠与体内神经递质如5-HT (5-羟色胺)、NO (一氧化碳)、GABA (γ-氨基丁酸) 等密切相关[27]。5-HT是引发睡眠的重要神经递质, 中缝核内的5-HT能神经元分泌的5-HT与快眼动睡眠时间成正比[28]。研究发现, 长期使用地西泮治疗失眠, 能够使神经活性配体-受体相互作用信号通路显著变化, 证明该通路和失眠存在很强相关性[29]。本研究网络药理学中通路富集分析结果最显著的是5-羟色胺能突触通路, 其次是神经活性配体-受体相互作用通路, 这与文献报道结果吻合。除此之外, 富集得到的通路还包含TNF信号通路、多巴胺能信号通路、cAMP信号通路、钙信号通路等。因而推断复方酸枣仁汤治疗失眠可能是多通路协同作用。
网络药理学中“成分-靶点-通路”相互作用不但可以预测中药复方制剂治疗疾病的机制, 还能够辅助中药复方制剂中有效成分的筛选[30-32]。有研究表明, 6'''-阿魏酰斯皮诺素能够不同程度地改变大鼠的自主活动、入睡数量和睡眠时间[33], 斯皮诺素能够作用于5-HT1A, 增强戊巴比妥钠诱导的小鼠的翻正反射丧失[34]。阿魏酸能够提高脑内5-HT的浓度[35], 影响大脑活动, 诱导睡眠。通过“化学成分-疾病靶点”网络, 推测这些化合物促进睡眠作用的发挥可能是通过作用于MAOB、PTGS1、PTGS2等靶点参与5-羟色胺能通路。大量研究发现, 细胞因子能够调节睡眠[36]。长期失眠的患者由于细胞内的炎症反应, 体内细胞因子发生明显变化, 例如IL-6、TNF-α等明显增加, 导致睡眠质量下降[37], 而芒果苷、新芒果苷、洋川芎内酯Ⅰ可以通过调节MAPK8、CASP3、MMP3、PIK3CG等靶点参与TNF信号通路, 发挥抗炎作用[38-40], 从而改善睡眠质量。这体现了中药复方“多成分、多靶点、多通路”的作用特点, 同时也为复方酸枣仁汤药效物质的选择提供了依据。
《中华人民共和国药典》2020年版[41]并未收载复方酸枣仁汤相关制剂, 只对单味饮片含量测定指标进行了规定, 酸枣仁、知母、川芎饮片中非皂苷类成分含量测定的指标分别为斯皮诺素、芒果苷和阿魏酸, 本研究依据“化学成分-疾病靶点”网络分析结果, 从质量控制指标的选择原则和实际操作出发, 选取了酸枣仁中的斯皮诺素和6'''-阿魏酰斯皮诺素, 知母中的新芒果苷和芒果苷, 川芎中的阿魏酸和洋川芎内酯Ⅰ这6种度值大于24的药效物质对其进行含量测定。所建立的UHPLC法能够高效、简单、快速地完成对10批复方酸枣仁汤中6种药效物质的含量测定, 为基于药效的复方酸枣仁汤的质量评价提供了依据。
作者贡献: 王茜主要进行了本文的选题与设计、方法建立、实验数据处理、撰写文章等。杨肖在前期方法摸索及数据处理方面提供了帮助。张倩对本文的实验思路、方法建立提供了指导。李清对本文选题与设计、实验思路、方法建立及文章修改提供了宝贵意见。
利益冲突: 无任何利益冲突。
| [1] |
Zhang X, Xia Z, Yu T. Physiotherapy and research progress of insomnia[J]. J Int Psychiatry (国际精神病学杂志), 2021, 48: 17-19. |
| [2] |
Li YD, Cui DX, Sun Y, et al. Recent advances in orexin receptor antagonists for the treatment of insomnia[J]. Acta Pharm Sin (药学学报), 2017, 53: 1068-1079. |
| [3] |
Jiang HF, Zhao M, Liu TQ, et al. Expert opinion on rational use of sedative and hypnotics[J]. Chin Mag Drug Abuse Prev Treat (中国药物滥用防治杂志), 2021, 27: 103-105. |
| [4] |
Zhang ZJ. Jingui Yaolue Fanglun (金匮要略方论)[M]. Beijing: People's Medical Publishing House, 1972: 21.
|
| [5] |
He BS. Screening of Active Fractions in Suanzaoren Decoction According to Endogenous Substance and Study on Pharmacokinetics in Rats (基于内源性物质的酸枣仁汤有效部位确定与相关成分药动学研究)[D]. Shenyang: Shenyang Pharmaceutical University, 2013.
|
| [6] |
Zhang JW, Zhao Q, Ye ML, et al. Study on quality standard of Suanzaoren Decoction[J]. Med J Lioaning (辽宁中医杂志), 2018, 45: 119-122. |
| [7] |
Hu XR, Zheng HR, Dang HX, et al. Pharmacological network-based study on quality control of Carthamus tinctorius L. for safflower injection[J]. Acta Pharm Sin (药学学报), 2019, 54: 2074-2082. |
| [8] |
Sunghwan K, Paul TA, Cheng TJ, et al. An update on PUG-REST: RESTful interface for programmatic access to PubChem[J]. Nucleic Acids Res, 2018, 46: W563-W570. DOI:10.1093/nar/gky294 |
| [9] |
Wang X, Shen YH, Wang SW, et al. PharmMapper 2017 update: a web server for potential drug target identification with a comprehensive target pharmacophore database[J]. Nucleic Acids Res, 2017, 45: W356-W360. DOI:10.1093/nar/gkx374 |
| [10] |
Shannon P, Markiel A, Ozier O, et al. Cytoscape: a software environment for integrated models of biomolecular interaction networks[J]. Genome Res, 2003, 13: 2498-2504. DOI:10.1101/gr.1239303 |
| [11] |
Liu JX, Wei J, Wu JC, et al. Identification of chemical constituents in Suanzaoren Tang Granules by UPLC-Q-TOF-MS/MS[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2021, 27: 1-12. |
| [12] |
Wang D, Li Q, Liu R, et al. Quality control of Semen Ziziphi Spinosae standard decoction based on determination of multi-components using TOF-MS/MS and UPLC-PDA technology[J]. J Pharm Anal, 2019, 9: 406-413. DOI:10.1016/j.jpha.2019.01.001 |
| [13] |
Mao YN, Wu WQ, Kang Y, et al. Rapid analysis of chemical components in Zizyphi Spinosae Semen by UHPLC-LTQ-Orbitrap-MS[J]. China J Chin Mater Med (中国中药杂志), 2018, 43: 4884-4891. |
| [14] |
Du YY, He BS, Li Q, et al. Identification and analysis of chemical constituents and rat serum metabolites in Suan-Zao-Ren granule using ultra high performance liquid chromatography quadrupole time-of-flight mass spectrometry combined with multiple data processing approaches[J]. J Sep Sci, 2017, 40: 2914-2924. DOI:10.1002/jssc.201700236 |
| [15] |
Du YY, He BS, Li Q, et al. Simultaneous determination of multiple active components in rat plasma using ultra-fast liquid chromatography-tandem mass spectrometry method and application to a comparative pharmacokinetic study after oral administration of Suan-Zao-Ren decoction and Suan-Zao-Ren granule[J]. J Sep Sci, 2017, 40: 2097-2106. DOI:10.1002/jssc.201601383 |
| [16] |
Yang B, Dong W, Zhang AH, et al. Ultra-performance liquid chromatography coupled with electrospray ionization/quadrupole-time-of-flight mass spectrometry for rapid analysis of constituents of Suanzaoren decoction[J]. J Sep Sci, 2011, 34: 3208-3215. DOI:10.1002/jssc.201100632 |
| [17] |
Ji D, Huang ZY, Fei CH, et al. Comprehensive profiling and characterization of chemical constituents of rhizome of Anemarrhena asphodeloides Bge[J]. J Chromatogr B, 2017, 1060: 355-366. DOI:10.1016/j.jchromb.2017.06.032 |
| [18] |
Li YJ, Chen J, Li Y, et al. Screening and characterization of natural antioxidants in four Glycyrrhiza species by liquid chromatography coupled with electrospray ionization quadrupole time-of-flight tandem mass spectrometry[J]. J Chromatogr A, 2011, 1218: 8181-8191. DOI:10.1016/j.chroma.2011.09.030 |
| [19] |
Ren HD, Guan LJ, Gao RK, et al. Identification of chemical constituents of modified Suanzaoren decoction in vitro and in vivo by UPLC-Q-TOF-MS[J]. Cent South Pharm (中南药学), 2020, 18: 477-480. |
| [20] |
Li Q, Du CH, Zhang M, et al. Investigation of effective components screening of Ziziphi Spinosae Semen based on serum pharmacochemistry and network pharmacology[J]. Chin Tradit Herb Drugs (中草药), 2017, 48: 1936-1943. |
| [21] |
Sun ZG. Chemical Components of Rhizoma Anemarrhenae-Phellodendri Chinesis Herb-Pair in vivo and Pharmacokinetic Studies (知母-黄柏药对体内化学成分及药代动力学研究)[D]. Guangzhou: Guangzhou University of Chinese Medicine, 2017.
|
| [22] |
Liu Y, Luo ZQ, Lv BR, et al. Absorption and metabolism of Chuanxiong Rhizoma decoction with multi-component sequential metabolism method[J]. China J Chin Mater Med (中国中药杂志), 2016, 41: 1178-1182. |
| [23] |
Lv BR. Study on Multi-component Absorption and Sequential Metabolism of Ligusticum Chuanxiong Rhizoma (川芎多成分吸收与序贯代谢研究)[D]. Beijing: Beijing University of Chinese Medicine, 2015.
|
| [24] |
Wei P, Ma QH, Ren MY, et al. Effects of Ephedrae Herba on plasma levels of three constituents in Glycyrrhizae Radix et Rhizoma[J]. Chin Tradit Pat Med (中成药), 2017, 39: 2009-2014. |
| [25] |
Luo S. Study on Pharmacodynamic Substances and Quality Control Method of Ling-gui-zhu-gan Decoction (苓桂术甘汤药效物质基础及质量控制方法研究)[D]. Hangzhou: Zhejiang University, 2020.
|
| [26] |
Lang JL, Han LP, Jiagn LL. Identification of constituents in rat serum by HPLC-MS following oral administration if saponins from Anemarrhena as phodeloidess[J]. Guangzhou Med J (广州医药), 2010, 41: 69-72. |
| [27] |
Yu FT, Zhang JJ. Advances in research on the role of nitric oxide in regulating sleep and arousal[J]. Acta Pharm Sin (药学学报), 2020, 55: 421-426. |
| [28] |
Du YY. Study on Material Basis and Action Mechanism of Compound Suan-Zao-Ren Granule in the Treatment of Insomnia (复方酸枣仁颗粒治疗失眠的药效物质基础和作用机制研究)[D]. Shenyang: Shenyang Pharmaceutical University, 2019.
|
| [29] |
Pan LZ, Yan ZY, Zuo CY, et al. Influence of long-term usage of diazepam on neuroactive ligand-receptor interaction signaling pathway[J]. J China Med Univ (中国医科大学学报), 2011, 42: 443-446. |
| [30] |
Chen L, Cao Y, Zhang H, et al. Network pharmacology-based strategy for predicting active ingredients and potential targets of Yangxinshi tablet for treating heart failure[J]. J Ethnopharmacol, 2018, 219: 359-368. DOI:10.1016/j.jep.2017.12.011 |
| [31] |
Cai FF, Bian YQ, Wu R, et al. Yinchenhao decoction suppresses rat liver fibrosis involved in an apoptosis regulation mechanism based on network pharmacology and transcriptomic analysis[J]. Biomed Pharmacother, 2019, 114: 108863. DOI:10.1016/j.biopha.2019.108863 |
| [32] |
Yu S, Liu H, Li K, et al. Rapid characterization of the absorbed constituents in rat serum after oral administration and action mechanism of Naozhenning granule using LC-MS and network pharmacology[J]. J Pharm Biomed Anal, 2019, 166: 281-290. DOI:10.1016/j.jpba.2019.01.020 |
| [33] |
Li YJ, Bi KS. Study on the therapeutic material basis of traditional Chinese medicinal preparation Suanzaoren decoction[J]. Chem Pharm Bull, 2006, 54: 847-851. DOI:10.1248/cpb.54.847 |
| [34] |
Wang LE, Zhang XQ, Yin YQ, et al. Augmentative effect of spinosin on pentobarbital-induced loss of righting reflex in mice associated with presynaptic 5-HT1A receptor[J]. J Pharm Pharmacol, 2012, 64: 277-282. DOI:10.1111/j.2042-7158.2011.01400.x |
| [35] |
Xiao Z. Nobiletin and Ferulic Acid Through Anti-inflammatory and Oxidative Stress and Ghrelin Exerts Antidepressant and Prokinetic Effects Similar to Zhiqiaodanggui (川陈皮素与阿魏酸通过抗炎与氧化应激及调控胃饥饿素发挥类似枳壳当归的抗抑郁促动力作用)[D]. Xiamen: Xiamen University, 2017.
|
| [36] |
Hong F, Yao M, Shen B. Clinical effect of Chaihu Longgu Muli Decoction in treating insomnia of Liver-Qi stagnation[J]. Acta Chin Med Pharmacol (中医药学报), 2021, 49: 75-78. |
| [37] |
Yu ZH, Wang JM, Zhao SW. Effect of Tiaoxin Shugan Decoction and heat sensitive moxibustion on the curative effect and serum IL-2 and IL-6 levels of patients with coronary heart disease and insomnia[J]. Yunnan J Tradit Chin Med Mater Med (云南中医中药杂志), 2019, 40: 41-42. |
| [38] |
Fan K. Mangiferin attenuates blast-induced traumatic brain injury via inhibiting NLRP3 inflammasome[J]. Chem Biol Interact, 2017, 271: 15-23. DOI:10.1016/j.cbi.2017.04.021 |
| [39] |
Wang HT, Li J, Ma ST, et al. A study on the prevention and treatment of murine calvarial inflammatory osteolysis induced by ultra high molecular weight polyethylene particles with neomangiferin[J]. Exp Ther Med, 2018, 16: 3889-3896. |
| [40] |
Zheng SM, Lin XF, Yang L, et al. Study on cerebral protective effect of Senkyunolide Ⅰ on rats with septic encephalopathy based on p38 MAPK signaling pathyway[J]. Tradit Chin Drug Res Clin Pharmacol (中药新药与临床药理), 2019, 30: 1083-1087. |
| [41] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. Beijing: China Medical Science Press, 2020.
|
 2021, Vol. 56
2021, Vol. 56


