云南紫菀和臭蚤草是藏医传统习用药材, 云南紫菀为菊科多年生草本植物云南紫菀(Aster yunnanensis Franch.) 的干燥全草, 生于高山及亚高山草地, 海拔2 500~4 500 m, 用于治流行性感冒、发烧、食物中毒、疮疔、癣症、清瘟病时疫热, 解痉挛[1]。臭蚤草为菊科植物臭蚤草(Pulicaria insignis Drumm ex Dunn) 的干燥全草, 多年生草本植物, 生于山脊岩石、石砾坡地和草丛中, 海拔2 800~4 310 m, 具有散肿止痛之功效, 用于治热性炭疽、疔疮等[2]。这两种药材在藏区被广泛使用, 然而国内外对其研究较少。Shao等[3-10]先后从云南紫菀中分离鉴定15个三萜皂苷类化合物。课题组前期对臭蚤草进行了生药学研究[11], 化学成分研究表明臭蚤草主要含有苯丙素苷类[12]、二萜苷类[13]、倍半萜[14-16]等。
藏医药典籍《晶珠本草》记载臭蚤草花蕊色黑状如紫菀, 故可作为替代品[17], 而《藏药晶镜本草》记载: 云南紫菀和臭蚤草同属于“敏间"类, 味苦治疔疮, 具有较浓郁的特殊恶臭气味[18]。因此, 在藏医药民间, 这两种植物常被混淆使用。然而, 它们分属于菊科紫菀属和蚤草属, 亲缘关系相差较远, 现阶段对其物质基础研究薄弱, 临床应用存在较大的安全隐患。近年来, 基于液相色谱质谱联用(LC-MS)、气相色谱质谱联用(GC-MS) 的代谢组学技术在中药及民族医药的研究中得到了广泛应用[19]。GC-MS具有可靠的硬质电离技术, 可提供可重现的分子片段化, 同时, 拥有更确定的丰富的数据库利于代谢物的识别, 被广泛应用于代谢组学分析[20-22]。云南紫菀和臭蚤草代谢物结构类型复杂, 且它们的代谢物的脂水分配系数差异极大, 涵盖了水溶性的糖及其衍生物到脂溶性的脂类等数百种代谢物。由于LC-MS对不同类型化合物的响应差异较大, 如对苯丙素类和芳香类化合物常需要负离子模式, 而生物碱类则需要正离子模式, 难以统一; 另外, 生物碱类化合物的质谱响应极强, 造成即使低含量的生物碱也对相对高含量的其他类化合物形成明显的离子抑制, 影响化合物的鉴定[23]。而用于代谢组学研究的分析技术应同时分析样品中尽可能多的成分, 样品衍生化以后, GC-MS可对样品中的不挥发性成分和热不稳定成分进行同时分析和鉴定。在本课题组前期分别使用GC-MS和LC-MS开展的预实验中, 发现LC-MS分离及鉴定的化合物数量远不及GC-MS, 因此, 本次研究选择云南紫菀和臭蚤草样品衍生化以后, 采用GC-MS代谢组学技术对其代谢物进行全面分析、鉴定和比较。同时, 对其挥发油的抑菌活性进行初步研究, 为藏药材“敏间”的正本清源和临床安全应用提供科学依据。
材料与方法实验材料 实验药材云南紫菀Aster yunnanensis Franch. (YNZW) 和臭蚤草Pulicaria insignis Drumm ex Dunn (CZC) 的干燥全草均为作者实地采集并鉴定。样品来源详细信息见表 1。
| Table 1 Sample information of Aster yunnanensis and Pulicaria insignis. YNZW: Aster yunnanensis; CZC: Pulicaria insignis |
仪器 气相色谱-质谱联用仪(7890B-5977A, Agilent); 色谱柱(DB-5MS, 30 m × 0.25 mm × 0.25 μm, Agilent); 多点接种仪(Denley A400, 英国Denley仪器有限公司); 隔水式恒温培养箱(GNP-9080, 上海精宏实验设备有限公司); 立式压力蒸汽灭菌器(LDZX-75KBS, 上海申安医疗器械厂); MH (A) 培养基(批号: 2375735, 英国Oxoid有限公司); 冷冻浓缩离心干燥器(LNG-T98, 太仓市华美生化仪器厂)。
试剂和药品 11种脂肪酸甲酯: 辛酸甲酯C8 (批号: G162300)、壬酸甲酯C9 (批号: N-9M-AU4-B)、癸酸甲酯C10 (批号: N-10M-A18-D)、十二烷酸甲酯/月桂酸甲酯C12 (批号: N-12M-AU15-D)、十四烷酸甲酯/肉豆蔻酸甲酯C14 (批号: N-14M-A24-E)、十六烷酸甲酯/棕榈酸甲酯C16 (批号: G161798)、十八烷酸甲酯/硬脂酸甲酯C18 (批号: N-18M-O9-C) (瑞典Larodan公司); 二十烷酸甲酯/花生酸甲酯C20 (批号: N-20M-J27-E)、二十二烷酸甲酯/山俞酸甲酯C22 (批号: N-22M-JY30-E)、二十四烷酸甲酯/木蜡酸甲酯C24 (批号: N-24M-S6-A)、二十六烷酸甲酯C26 (批号: N-26M-A6-E) (美国Nu-Chek公司); 吡啶(批号: W296600)、O-甲基羟胺盐酸盐(97%) (批号: M0343)、BSTFA+1% TMCS (批号: B3402) (上海安谱实验科技有限公司); L-2-氯苯丙氨酸(批号: S60230, 上海恒创生物有限公司)。乳酸左氧氟沙星氯化钠注射液(批号: 118190906, 规格: 500 mg/250 mL, 浙江医药股份有限公司); 左氧氟沙星药敏纸片(批号: 2529788, 规格: 5 μg, OXOID Ltd. UK); 氯化钠注射液(批号: M20040806C, 四川科伦药业股份有限公司); DMSO (批号: 2022/12, 北京生物顶科技有限公司)。
供试菌株 临床分离致病菌: 甲氧西林敏感金葡菌(MSSA) 5株; 产超广谱β-内酰胺酶大肠埃希菌(E-) 5株; 肺炎克雷伯菌(E-) 5株; 铜绿假单胞菌5株; 鲍曼不动杆菌5株(四川抗菌素工业研究所)。质控菌株: 金葡菌ATCC29213、大肠埃希菌ATCC25922 (北纳创联生物技术研究院)。
GC-MS代谢组学样品前处理 精密称取供试品60 mg, 放入1.5 mL的离心管中, 加入40 μL内标(L-2-氯-苯丙氨酸, 0.3 mg·mL-1, 甲醇配置), 依次加入两颗小钢珠, 360 μL的预冷的甲醇, 在-20 ℃冰箱中放置5 min; 取出, 放入研磨机中研磨(60 Hz, 2 min), 冰水浴超声提取30 min; 加入200 μL的氯仿, 再加入400 μL的水, 涡旋仪中涡旋2 min; 然后冰水浴超声提取30 min; -20 ℃静置30 min后低温离心10 min (13 000 r·min-1, 4 ℃), 取150 μL的上清液装入玻璃衍生瓶中。质控样本(QC) 由所有样本的提取液等体积混合制备而成, QC的体积与样本相同。用离心浓缩干燥器挥干样品, 向玻璃衍生小瓶中加入80 μL的甲氧胺盐酸盐吡啶溶液(15 mg·mL-1), 涡旋震荡2 min后, 于震荡培养箱中37 ℃中90 min进行肟化反应; 将样本取出后再加入80 μL的BSTFA (含1% TMCS) 衍生试剂和20 μL正己烷, 加入11种内标(C8/C9/C10/C12/C14/C16, 0.16 mg·mL-1; C18/C20/C22/C24/C26, 0.08 mg·mL-1, 均为氯仿配置) 10 μL, 涡旋震荡2 min后, 于70 ℃反应60 min; 取出样本后, 在室温放置30 min, 进行GC-MS代谢组学分析。
GC-MS色谱条件 DB-5MS毛细管柱(30 m × 0.25 mm × 0.25 μm, Agilent J & W Scientific, Folsom, CA, USA), 载气为高纯氦气(纯度不小于99.999%), 流速1.0 mg·mL-1, 进样口的温度为260 ℃。进样量1 μL, 不分流进样, 溶剂延迟5 min。程序升温: 柱温箱的初始温度为60 ℃, 保持0.5 min; 以8 ℃·min-1程序升温至125 ℃; 4 ℃·min-1升温至210 ℃; 5 ℃·min-1升温至270 ℃; 10 ℃·min-1升温至305 ℃, 保持3 min。
GC-MS质谱条件 电子轰击离子源(EI), 离子源温度230 ℃, 四级杆温度150 ℃, 电子能量70 eV。扫描方式为全扫描模式(SCAN), 质量扫描范围: m/z 50~500。
数据处理及统计分析 UNIFI 1.8.1.软件用于原始数据的采集; 将GC/MS的原始数据(D格式) 经Analysis Base File Converter软件转换为分析基本文件abf格式以便快速检索数据, 之后导入MS-DIAL软件进行峰检测, 峰识别, MS2Dec反卷积, 定性, 峰对齐, 滤波, 缺失值插值等一系列预处理。将预处理完毕的数据矩阵归一化后导入SIMCA-P软件进行主成分分析(PCA)、偏最小二乘判别分析(PLS-DA) 和正交偏最小二乘法判别分析(OPLS-DA) 等多元统计分析[24, 25], 再依据变量对分组贡献得分(VIP > 1) 和组间变化的差异检验(t检验) 显著性(P < 0.05) 为差异性代谢产物的筛选标准。基于KEGG数据库对差异代谢物进行代谢通路富集分析[26], 应用超几何检验, 找出与整个背景相比, 在显著性差异表达代谢物中显著富集的通路条目, 其计算公式为:
| $ P=1-\sum\limits _{i=0}^{m-1}\frac{\left(\genfrac{}{}{0pt}{}{M}{i}\right)\left(\genfrac{}{}{0pt}{}{N-M}{n-i}\right)}{\left(\genfrac{}{}{0pt}{}{N}{n}\right)} $ | (1) |
式1中, N为代谢物总数; n为N中差异表达代谢物的数目; M为注释为某特定通路的代谢物数目; m为注释为某特定通路的差异代谢物数目。以P ≤ 0.05为阈值, 满足此条件的通路为在差异代谢物中显著富集的通路。
挥发油的提取 分别取云南紫菀样品(YNZW-5) 和臭蚤草样品(CZC-4) 粉末(过2号筛) 各300 g, 置2 L圆底烧瓶中, 照挥发油测定法乙法[27]测定, 将收集的挥发油转移置于20 mL量瓶中, 用甲醇稀释至刻度, 摇匀, 用无水Na2SO4脱水, 滤过, 取续滤液作为供试品溶液, 挥发油的提取率分别为0.30%和0.24%。
测试菌株培养方法 每株细菌在试验前经琼脂平板划单菌落分纯, 35~37 ℃培养后挑取单菌落, 麦氏比浊法调至约0.5麦氏单位(约1×108 CFU·mL-1), 再将此混悬菌液进行100倍稀释, 使菌悬液最终浓度约为1×106 CFU·mL-1。用多点接种仪接种稀释后的菌液于制备好的MH琼脂平皿上, 每点接种量约1×104 CFU/点, 35~37 ℃孵育24 h。
抑菌圈测定 牛津杯法: 将菌液调至麦氏浊度0.5, 约1×108 CFU·mL-1, 然后稀释100倍, 取稀释后的菌液100 μL, 均匀涂布至制备好的MH (A) 琼脂培养基上, 待表面干燥后, 放置牛津杯, 每孔加入供试品液100 μL, 对照孔加入50 μg·mL-1的左氧氟沙星100 μL, 放入培养箱培养24 h后量取抑菌圈直径。
纸片法: 将菌液调至麦氏浊度0.5, 约1×108 CFU·mL-1, 然后稀释100倍, 取稀释后的菌液100 μL, 均匀涂布至制备好的MH (A) 琼脂培养基上, 待表面干燥后, 放置直径5 mm的空白纸片, 每片加入供试品液20 μL, 对照使用5 μg/片的左氧氟沙星纸片, 放入培养箱培养24 h后量取抑菌圈直径。
最低抑菌浓度(MIC) 的测定 采取美国国家临床实验室标准化委员会(CLSI) 推荐的琼脂二倍稀释法进行MIC的测定。于无菌平皿内加入1 mL供试药液, 再加入融化的50 ℃ MH (A) 培养基14 mL, 混匀。待冷却后用多点接种仪接种细菌, 接种菌量约为1×104 CFU/点, 盖上皿盖, 在35~37 ℃培养箱中孵育24 h。培养结束后, 进行肉眼观察, 平皿内未见细菌生长的最低样品浓度即为其MIC。同时设立不加任何样品的空白菌对照及加入DMSO的溶媒对照。
结果 1 云南紫菀和臭蚤草的GC-MS结果GC-MS对云南紫菀和臭蚤草进行分析, 得到其总离子流图(图 1)。GC/MS的原始数据经过预处理以后, 采用LUG数据库(Untarget database of GC-MS from Lumingbio) 进行检索匹配以及查阅相关文献资料[28-30], 对色谱峰进行鉴定分析, 最终得到384种代谢物, 见表 2。主要包括61种氨基酸及其衍生物、13种苯丙素类、38种芳香族、13种苷类、36种核苷酸、7种黄酮类、40种生物碱类、47种糖类、3种维生素、52种有机酸、57种脂类、8种酯类、9种醇类。同时采用内标对代谢物进行定量分析, 即每个样本中, 添加L-2-氯苯丙氨酸和11种脂肪酸甲酯内标, 根据内标的离子碎片及其保留时间进行人工定性检测, 将所有样本中RSD > 0.3的内标删除, 保留RSD < 0.3的内标, 将样品代谢物按保留时间分区段进行内标归一化, 并将每个峰信号强度转化成在该谱图中该时间段的相对内标强度, 以此来计算其定量。
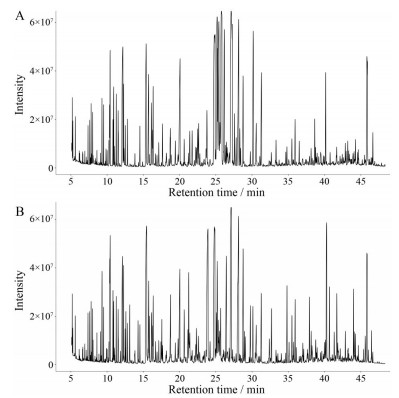
|
Figure 1 Total ion chromatogram (TIC) of Pulicaria insignis (A)and Aster yunnanensis (B) |
| Table 2 384 differential metabolites in Pulicaria insignis and Aster yunnanensis. Rt: Retention time |
总离子流图显示了云南紫菀和臭蚤草化学轮廓的异同, 为肃清云南紫菀和臭蚤草之间化学成分的差异, 采用多元统计分析方法对其代谢物进行分析。首先采用无监督的PCA对云南紫菀和臭蚤草的GC-MC数据从整体上进行评价, 观察各样本间的总体分布和整个分析过程的稳定性, 直观描述各主成分的差异(图 2A)。云南紫菀样本都集中于PC1负半轴, 臭蚤草样本都集中于PC1正半轴, 二者明显分开, 说明这两个物种代谢物存在显著差异。但是YNZW-4与其他云南紫菀相距较远、离群, 可能是其地理环境、海拔等因素造成的个体差异。

|
Figure 2 Multivariate statistical analysis (A-D) of YNZW and CZC |
为进一步明确两物种间的差异代谢, 采用有监督的PLS-DA及OPLS-DA来区分各组间代谢轮廓的总体差异, 找到组间的差异代谢物。PLS-DA加入分组变量, 可弥补PCA方法不能忽略组内误差, 消除与研究目的无关的随机误差的不足。对云南紫菀和臭蚤草建立的PLS-DA模型参数解释率R2Y (cum) 为0.999, 预测率Q2 (cum) 为0.985, 两者很接近1, 说明该PLS-DA模型能很好地解释和预测云南紫菀和臭蚤草样本之间的差异, 模型预测能力极好。得到的PLS-DA得分图如图 2B所示, 两物种明显分开, 表明两物种代谢物存在显著差异。OPLS-DA在PLS-DA的基础上进行修正, 滤除与分类信息无关的噪音, 提高模型的解析能力和有效性, 最大化地凸显模型内部不同组别之间的差异。OPLS-DA分析以变量重要性为依据进行差异代谢物筛选, 更能把握多位数据整体特征和变异规律[31]。在云南紫菀和臭蚤草OPLS-DA得分图上, 有两种主成分, 即预测主成分和正交主成分, R2X = 0.669, R2Y = 0.999, Q2 = 0.955, 3个参数均大于0.5, 说明所建立的模型能够较好地解释两物种间的代谢差异, 如图 2C所示, 云南紫菀主要分布在置信区间的左侧, 臭蚤草主要分布在置信区间的右侧, 也进一步说明云南紫菀和臭蚤草代谢物存在显著差异。
为防止模型过拟合, 采用七次循环交互验证和200次响应排序检验(response permutation testing, RPT) 的方法来考察模型的质量。RPT是一种用来评价OPLS模型准确性的随机排序方法, 用来避免监督性学习方法获得分类不是偶然的。对所建立的云南紫菀和臭蚤草的OPLS-DA模型进行了200次响应排序检验, 建立对应的OPLS-DA模型以获取随机模型的R2和Q2值, 与原模型的R2Y、Q2Y进行线性回归, 得到的回归直线与y轴的截距值分别为R2和Q2, 用来衡量模型是否过拟合。结果如图 2D所示, R2Y和Q2Y直线的斜率均大于0, 模型质量良好, 不存在过度拟合, 可用于云南紫菀和臭蚤草代谢物的差异分析。
为进一步分析具体的差异物质, 采用载荷图(loading图) 和S型曲线图(splot) 标识差异代谢物。在云南紫菀和臭蚤草的载荷图(图 3A) 中, 接近于-0.1或0.1的载荷表明变量对分组影响越强, 黄色点代表的物质对分组影响较强, 绿色点代表的物质对分组的影响很弱。S型曲线图(图 3B) 中, 越靠近右上角和左下角的代谢物(黄色点) 表示其差异越显著, 是云南紫菀和臭蚤草的差异标志物。

|
Figure 3 Loading plot (A) and Splot (B) of Aster yunnanensis and Pulicaria insignis. The yellow dots represent substances that have a strong influence on the grouping, and the green have a very weak influence |
OPLS-DA分析中, 变量权重值(variable important in projection, VIP) 可用来衡量各代谢物的表达模式对各组样本分类判别的影响强度和解释能力, VIP越大, 说明该变量对分组的贡献越大, 从而挖掘具有生物意义的差异代谢物。
利用t检验验证组间差异代谢物是否具有显著性[32]。云南紫菀和臭蚤草差异代谢物筛选的标准为OPLS-DA模型第一主成分的VIP > 1, t检验的P < 0.05。共筛选到差异代谢物92种, 其中51种代谢物在云南紫菀中的相对含量远远高于臭蚤草, 且差异倍数的log2FC在1.53~8.10之间, 41种代谢物在臭蚤草中的相对含量远远高于云南紫菀, 差异倍数的log2FC在-6.98~-1.58之间。其中, 焦性没食子酸、异丁烯醇、氨甲环酸、十八烷醇、D-岩藻糖、乙酰丝氨酸、对羟苯基乙醇、双甘油、核糖醇、2-异丙基苹果酸、L-丙氨酸、2-油酸甘油单酯、7-羟基烟酸、L-2-羟基戊二酸主要存在于云南紫菀中, 可以作为云南紫菀的特征标志物; 花生四烯酸、6-磷酸葡糖酸、双氯芬酸、叶绿醇、黄豆苷元、蔗糖、2'-脱氧鸟苷、油酸、3-苯乳酸、白皮杉醇、D-木糖醇、胆固酮、维生素e、2-羟基丁酸、柚皮素-7-O-葡萄糖苷、D-果糖-1-磷酸酯主要存在于臭蚤草中, 可作为臭蚤草的特征标志物。
为了更直观地展示云南紫菀和臭蚤草代谢物在不同样本之间的表达差异, 对云南紫菀和臭蚤草中的所有显著差异代谢物表达量进行层次聚类(图 4), 颜色从蓝到红表示代谢物的表达丰度从低到高。从第一分类层次看, 云南紫菀和臭蚤草的差异代谢物明显分为两大类, 从L-天冬酰胺至肌苷的41种成分在臭蚤草中表达量较高, 从2, 4-二氨基丁酸至假尿苷的51种成分在云南紫菀中表达量较高, 这与根据上述VIP值筛选出的结果一致。并利用火山图对P < 0.05、VIP > 1和变异倍数分析(fold change) 值≥ 2的云南紫菀和臭蚤草中的差异代谢物进行可视化, 如图 5所示, 红色表示云南紫菀中含量较高的差异代谢物, 蓝色表示臭蚤草中含量较高的差异代谢物。
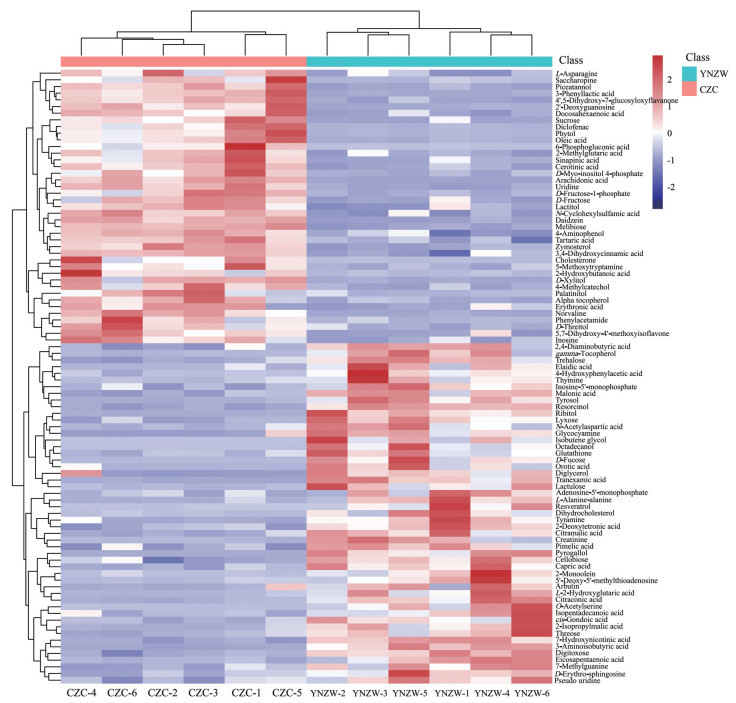
|
Figure 4 Heatmap of 92 differential metabolites in Aster yunnanensis and Pulicaria insignis (P < 0.05, VIP > 1). Rows represent samples; columns represent metabolites. The degree of color saturation indicates the metabolite expression values with blue representing the lowest expression and red representing the highest expression |
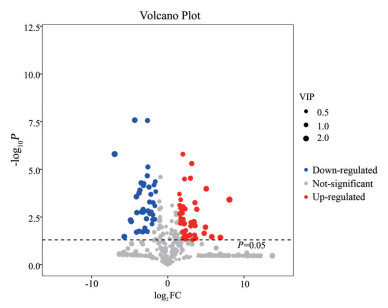
|
Figure 5 Volcanic map of Aster yunnanensis and Pulicaria insignis (VIP > 1, P < 0.05). The red indicates the high content of differential metabolites in Aster yunnanensis, and the blue indicates the high content of differential metabolites in Pulicaria insignis |
为进一步了解生物状态变化过程中代谢物之间的相互关系, 通过相关性分析来衡量显著差异代谢物之间的相关程度。相关性分析使用Pearson相关系数衡量两个代谢物之间的线性相关程度[33]。云南紫菀和臭蚤草差异代谢物相关性分析结果如图 6所示, 红色表示正相关, 即一个成分含量增加, 与之相关联的另一个成分的含量也增加; 蓝色表示负相关, 即一个成分含量增加, 与之相关联的另一个成分的含量反而减少。表明云南紫菀和臭蚤草中各差异代谢物间协同或拮抗作用, 共同影响着两物种间的异同。这也促使本课题组对这些差异代谢物做进一步分析, 从代谢机制寻找它们的变化根源。
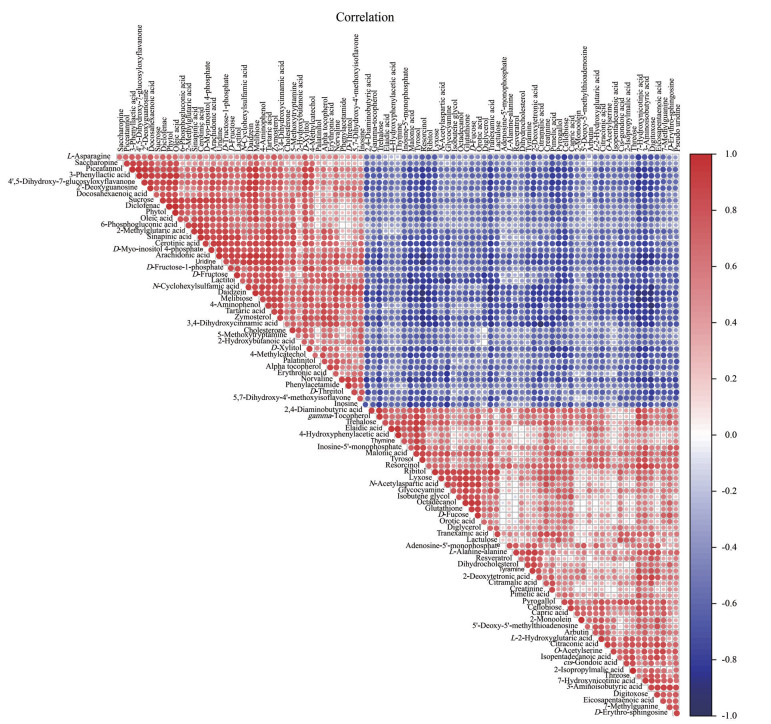
|
Figure 6 Correlation analysis of the differential metabolites between Aster yunnanensis and Pulicaria insignis. Red is a positive correlation and blue is a negative correlation |
基于KEGG数据库对云南紫菀和臭蚤草的差异代谢物进行代谢通路富集分析, 以助于理解在差异样品中代谢途径变化机制。P值越小, 则该代谢通路的差异性越显著。选择显著性富集通路进行云南紫菀和臭蚤草代谢通路气泡图绘制(图 7A), 红线示意P值为0.01, 蓝线示意P值为0.05, 条柱的顶端高于蓝线时, 其所代表的信号通路具有显著性。气泡图(图 7B) 中, 纵坐标为代谢通路名称, 横坐标为富集因子(显著差异代谢物个数/该通路中的总代谢物个数), 富集因子越大, 则说明富集程度越大; 颜色由绿到红表示P值依次降低; 点越大, 说明富集到该通路上的代谢物数目越多。通过KEGG pathway mapper功能对差异代谢通路进行展示, 可以看出参与各代谢通路的差异代谢物。结果表明, 云南紫菀和臭蚤草差异代谢物主要代谢途径为: 不饱和脂肪酸生物合成途径, 玉米素生物合成途径, 嘌呤代谢途径, 缬氨酸、亮氨酸和异亮氨酸的生物合成途径, 二苯乙烯、二芳基庚烷和姜酚的生物合成途径, 半胱氨酸和蛋氨酸代谢途径, 丙氨酸、天冬氨酸和谷氨酸代谢途径, 嘌呤嘧啶代谢缺陷途径等。这也与云南紫菀和臭蚤草代谢物主要有氨基酸、脂肪酸、核苷酸、糖类、有机酸、脂类、维生素等相吻合。
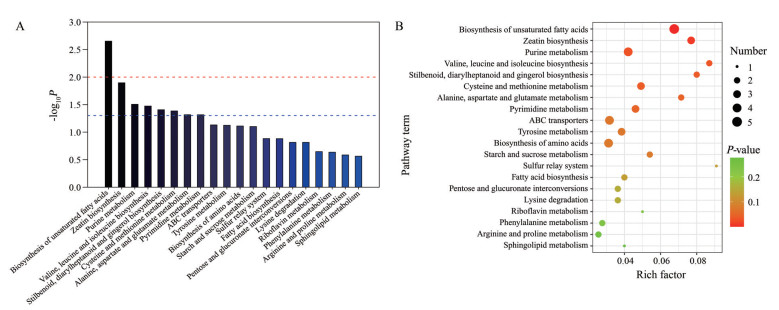
|
Figure 7 Metabolic pathway enrichment map (A) and bubble diagram (B) of TOP-20 of Aster yunnanensis and Pulicaria insignis differential metabolites |
纸片法中, 5 µg左氧氟沙星药敏纸片对ATCC25922和ATCC29213的抑菌圈直径分别为36.45和28.87 mm, 符合CLSI中抑菌圈质控范围29~37 mm、25~30 mm的标准, 表明实验方法可靠。臭蚤草挥发油对铜绿假单胞菌的抑菌圈直径分别为7.51 mm, 表明臭蚤草挥发油具有较弱的抑菌作用。牛津杯法中, 云南紫菀和臭蚤草对鲍曼不动杆菌104株的抑菌圈直径分别为15.9和16.3 mm, 表明云南紫菀和臭蚤草具有较弱的抑菌作用。
4.2 MIC测定结果结果表明, 空白对照和溶媒对照的菌株均正常生长。对照品左氧氟沙星对质控菌株ATCC29213的MIC值为0.125 µg·mL-1, 对ATCC25922的MIC值为≤ 0.008 µg·mL-1, 符合CLSI M100中ATCC29213 0.06~0.5 µg·mL-1、ATCC25922 0.008~0.06 µg·mL-1的范围标准, 表明本实验系统和方法可靠。
云南紫菀对受试的菌株MIC均 > 2.4 mg·mL-1。臭蚤草对受试的产超广谱β-内酰胺酶大肠埃希菌(E-)、肺炎克雷伯菌(E-)、铜绿假单胞菌、鲍曼不动杆菌的MIC均 > 3.4 mg·mL-1, 对MSSA的MIC50为3.4 mg·mL-1, MIC90为 > 3.4 mg·mL-1, MIC众数为3.4 mg·mL-1, 表明臭蚤草对MSSA具有较弱的抑菌活性。
讨论云南紫菀和臭蚤草植物形态相似, 都具有特殊的恶臭气味, 因此在藏医药中不加区别的入药。本研究通过柱前衍生与GC-MS代谢组学的方法共鉴定出两种植物中的384种代谢产物, 其中的氨基酸及其衍生物、核苷酸、糖类、脂类、维生素等是机体将营养物质转化为具生理活性的物质或为生长提供能量的物质基础, 是机体生存必不可少的物质。云南紫菀和臭蚤草具有较多的芳香族化合物, 该类化合物具有抗菌、抗炎之功效[34]。苯丙素类物质具有抗肿瘤、抗氧化、抗微生物、抗炎、保肝等活性[35]。苷类成分具有祛痰止咳的功效。生物碱类物质具有抗炎、抗肿瘤、降血糖、调血脂、细胞毒性等生物活性[36]。黄酮类化合物具有抗肿瘤、抗氧化、抗炎、降低血糖、保护心血管系统、抗菌、抗病毒的活性[37]。
对化学指纹进行PCA、PLS-DA和OPLS-DA等多元分析, 共筛选出92种差异代谢物, 它们在含量上存在显著差异。云南紫菀和臭蚤草在有机小分子水平上存在较大差异, 这些代谢物是药材发挥疗效的物质基础, 代谢物存在明显的差异, 故从现代研究来看, 这两种植物亲缘关系相差甚远, 物质基础存在明显差异, 因而, 云南紫菀和臭蚤草应该进行区别应用于临床。
对差异代谢物进行相关性分析、富集通路分析, 共富集到8条主要代谢途径。其中, 不饱和脂肪酸生物合成途径为云南紫菀和臭蚤草差异代谢物的最主要生物代谢途径, 因为不饱和脂肪酸可为植物提供能量, 且对植物本身的抗逆性起重要的作用, 使其可以适应高海拔寒冷的生长环境[38]。这与云南紫菀和臭蚤草的高海拔生存环境密切相关。玉米素生物合成途径, 嘌呤代谢途径, 缬氨酸、亮氨酸和异亮氨酸的生物合成途径, 半胱氨酸和蛋氨酸代谢途径, 丙氨酸、天冬氨酸和谷氨酸代谢途径, 嘌呤嘧啶代谢缺陷途径主要影响氨基酸及其衍生物、核苷酸类物质的合成与代谢, 它们对植物生长发育起着重要作用。这也是云南紫菀和臭蚤草中该类物质成分较多的原因。二苯乙烯、二芳基庚烷和姜酚的生物合成途径可生成二苯乙烯类物质, 二苯乙烯类化合物是一类以1, 2-二苯乙烯为母核的植保素, 属于苯丙素家族, 是植物抗病毒、抗病虫害或抗逆境反应的产物[39]。
通过对云南紫菀和臭蚤草挥发油的抑菌活性研究, 发现云南紫菀对鲍曼不动杆菌有较弱的抑菌活性, 臭蚤草对铜绿假单胞菌和鲍曼不动杆菌有较弱的抑菌活性, 其代谢物的差异可能是导致他们对不同的临床致病菌起抑制作用的原因。然而, 其差异代谢物与抑菌活性的相关性分析, 需要进一步研究。
致谢: 四川抗菌素工业研究所抗生素研究与再评价四川省重点实验室程强研究员团队对本课题提供抗菌实验研究。
作者贡献: 李丽采集样品、分析数据并撰写和修改论文; 张英秀采集样品和参与实验; 赵日杂和蔡汶甫进行方法学研究和整理数据; 张志锋进行项目构思和项目管理、监督。
利益冲突: 无任何利益冲突。
| [1] |
Jia MR, Li XW. Chinese Ethnomedicine Annals (中国民族药志要)[M]. Beijing: China Medical Science and Technology Press, 2005: 77-78.
|
| [2] |
Flora of China Editorial Committee, Chinese Academy of Sciences. Flora of China (中国植物志)[M]. Beijing: Science Press, 1979: 292.
|
| [3] |
Shao Y, Zhou BN. Asteryunnanosides C and D, two novel triterpenoid saponins from Aster yunnanensis Franch[J]. Nat Prod J, 2006, 6: 87-93. |
| [4] |
Shao Y, Zhou BN, Lin LZ, et al. Asteryunnanosides F and G: two new triterpenoid saponins from Aster yunnanensis[J]. Planta Med, 1995, 61: 446-449. DOI:10.1055/s-2006-958133 |
| [5] |
Shao Y, Zhou BN, Lin LZ, et al. Triterpene saponins from Aster yunnanensis[J]. Phytochemistry, 1995, 38: 1487-1492. DOI:10.1016/0031-9422(94)00794-T |
| [6] |
Shao Y, Zhou BN, Gao JH, et al. Glycosides from Aster yunnanensis[J]. Phytochemistry, 1995, 38: 675-680. DOI:10.1016/0031-9422(94)00716-7 |
| [7] |
Shao Y, Zhou BN, Ma K, et al. A new triterpenoid saponin, asteryunnanoside H, from Aster yunnanensis[J]. Chin Chem Lett, 1994, 5: 839-842. |
| [8] |
Shao Y, Zhou BN, Lin LZ, et al. Two new oleanolic acid saponin from Aster yunnanensis[J]. Chin Chem Lett, 1994, 5: 843-846. |
| [9] |
Shao Y, Zhou BN, Lin LZ, et al. Asteryunnanoside E, a new triterpenoid saponin from Aster yunnanensis Franch[J]. Chin Chem Lett, 1994, 5: 761-764. |
| [10] |
Shao Y, Gao JH, Zhou BN. Asteryunnanoside A and B, two new triterpenoid saponin from Aster yunnanensis Franch[J]. Chin Chem Lett, 1994, 5: 121-124. |
| [11] |
Li L, Lv X, Su XY, et al. Pharmacognostical studies on Tibetan medicine Pulicaria insignis[J]. Chin Med Mat (中药材), 2021, 44: 318-321. |
| [12] |
Hunag SZ, Jiang SP, Zhu HJ. A new phenylpropanoid glycoside from Tibetan medicine Pulicaria insignis[J]. Nat Prod Res Dev (天然产物研究与开发), 2009, 21: 549-552. |
| [13] |
Fan HF, Huang SZ, Jiang SP, et al. A new phenylpropanoid glycoside from Tibetan medicine Pulicaria insignis[J]. Chem J Chin Univ (高等学校化学学报), 2011, 32: 292-295. |
| [14] |
Huang SZ, Li LB, Jiang SP, et al. A rarely reported trinorsesquiterpene-type structure in an isolate from Pulicaria insignis[J]. Helv Chim Acta, 2010, 93: 1808-1811. DOI:10.1002/hlca.200900475 |
| [15] |
Huang SZ, Jiang SP, Zhu HJ. Sesquiterpenoids from Tibetan folk drug Pulicaria insignis[J]. Nat Prod Res Dev (天然产物研究与开发), 2010, 22: 736-739, 785. |
| [16] |
Qi W, Li MW, Fu DH, et al. Sesquiterpene glycoside diversities with anti-nematodal activities from Pulicaria insignis[J]. Phytochem Lett, 2020, 38: 161-165. |
| [17] |
Di MaErDZPC. Jingzhu Bencao (晶珠本草)[M]. Shanghai: Shanghai Science and Technology Press, 1986: 102-103.
|
| [18] |
Ga W. Zangyao Jingjing Bencao (藏药晶镜本草)[M]. Beijing: Nationalities Press, 1995: 261-262.
|
| [19] |
Zhi H, Ai D, Wu KX, et al. Comparison on chemical constituents between Potentilla chinensis and P. acaulis using GC-MS by metabolomics approach[J]. Bull Bot Res (植物研究), 2020, 40: 718-727. |
| [20] |
Adebo OA, Oyeyinka SA, Adebiyi JA, et al. Application of gas chromatography-mass spectrometry (GC-MS)-based metabolomics for the study of fermented cereal and legume foods: a review[J]. Int J Food Sci Tech, 2021, 56: 1514-1534. DOI:10.1111/ijfs.14794 |
| [21] |
Zeki ÖC, Eylem CC, Reçber T, et al. Integration of GC-MS and LC-MS for untargeted metabolomics profiling[J]. J Pharm Biomed Anal, 2020, 190: 113509. |
| [22] |
Papadimitropoulos MP, Vasilopoulou CG, Maga-Nteve C, et al. Untargeted GC-MS metabolomics[J]. Methods Mol Biol, 2018, 1738: 133-147. |
| [23] |
Beale DJ, Pinu FR, Kouremenos KA, et al. Review of recent developments in GC-MS approaches to metabolomics-based research[J]. Metabolomics, 2018, 14: 152. DOI:10.1007/s11306-018-1449-2 |
| [24] |
Nicholson JK, Lindon JC, Holmes E. 'Metabonomics': understanding the metabolic responses of living systems to pathophysiological stimuli via multivariate statistical analysis of biological NMR spectroscopic data[J]. Xenobiotica, 1999, 29: 1181-1189. |
| [25] |
Trygg J, Wold S. Orthogonal projections to latent structures (O-PLS)[J]. J Chemometr, 2002, 16: 119-128. |
| [26] |
Tsugawa H, Cajka T, Kind T, et al. MS-DIAL: data-independent MS/MS deconvolution for comprehensive metabolome analysis[J]. Nat Methods, 2015, 12: 523-526. |
| [27] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. Part Ⅳ. Beijing: China Medical Science Press, 2020: 233.
|
| [28] |
Chen YJ, Wu H, Wei ZY, et al. Identification of chemical constituents in Aster tataricus by UHPLC-Q-TOF-MS[J]. Acta Pharm Sin (药学学报), 2019, 54: 1645-1654. |
| [29] |
Sun YP, Li L, Liao M, et al. A systematic data acquisition and mining strategy for chemical profiling of Aster Tataricus Rhizoma (Ziwan) by UHPLC-Q-TOF-MS and the corresponding anti-depressive activity screening[J]. J Pharm Biomed Anal, 2018, 154: 216-226. |
| [30] |
Zhao DX, Hu BQ, Zhang M, et al. Simultaneous separation and determination of phenolic acids, pentapeptides, and triterpenoid saponins in the root of Aster tataricus by high-performance liquid chromatography coupled with electrospray ionization quadrupole time-of-flight mass spectrometry[J]. J Sep Sci, 2015, 38: 571-575. |
| [31] |
Wang J, Xu DK, Xiao Y, et al. The OPLS-DA model of tobacco producing areas based on chemical measurements[J]. Chin Tob Sci (中国烟草科学), 2017, 38: 91-96. |
| [32] |
Cheng Y, Xie G, Chen T, et al. Distinct urinary metabolic profile of human colorectal cancer[J]. J Proteome Res, 2012, 11: 1354-1363. |
| [33] |
Kind T, Wohlgemuth G, Lee DY, et al. FiehnLib: mass spectral and retention index libraries for metabolomics based on quadrupole and time-of-flight gas chromatography/mass spectrometry[J]. Anal Chem, 2009, 81: 10038-10048. |
| [34] |
Huang LS, Gu YF, Li H. Advances in herbal volatile oil and aromatic herbs[J]. China J Chin Mater Med (中国中药杂志), 2009, 34: 1605-1611. |
| [35] |
Gu XW, Chen Y, Wang M, et al. Progress in the research on the phenylpropanoids and its related chemical constituents of Malvaceae[J]. Chin Wild Plant Resour (中国野生植物资源), 2012, 31: 17-21. |
| [36] |
Liu HD, Pan LL, Zhou X, et al. Research progress on chemical constituents and pharmacological activities of alkaloids in Orchidaceae plants[J]. Chin Tradit Herb Drugs (中草药), 2019, 50: 731-744. |
| [37] |
Zhao XW, Liu PY, Liu D, et al. Research progress in structure-activity relationship of flavoniods[J]. Chin Tradit Herb Drugs (中草药), 2015, 46: 3264-3271. |
| [38] |
Kaplan F, Kopka J, Sung DY, et al. Transcript and metabolite profiling during cold acclimation of Arabidopsis reveals an intricate relationship of cold-regulated gene expression with modifications in metabolite content[J]. Plant J, 2007, 50: 967-981. |
| [39] |
Zhao W. Screening and Analysis of 2, 3, 5, 4'-Tetrahydroxy Stilbene-2-O-β-D-Glucoside Biosynthesis Related Transcripts from Fallopia multiflora (何首乌中二苯乙烯苷生物合成相关基因的筛选与分析)[D]. Guangzhou: South China University of Technology, 2014.
|
 2021, Vol. 56
2021, Vol. 56


