2. 河南省中药开发工程技术研究中心, 河南 郑州 450046
2. The Engineering and Technology Center for Chinese Medicine Development of Henan Province China, Zhengzhou 450046, China
地黄为玄参科植物地黄Rehmannia glutinosa Libosch的新鲜或干燥块根, 始载于《神农本草经》, 产地主要集中在河南、山西、山东等地[1], 以河南焦作为道地产区, 当地所产地黄素有“怀地黄”之称。地黄现代药理活性主要表现为降血糖[2]、免疫抑制[3]、抗肿瘤[4]等方面的作用。此外, 相关研究表明, 地黄的化学成分主要为环烯醚萜苷类、苯乙醇类、紫罗兰酮类、糖类、氨基酸等[5, 6]。鉴于地黄在实际生产过程中出现品种退化、病虫害加重等问题已严重影响其产量与品质, 新品种的培育与研究, 可以提高单一品种的质量并扩大药源, 对地黄可持续发展具有重要意义。目前, 本课题组已报道了从新品种怀中1号鲜地黄中分离得到的新的艾里莫酚烷类化合物及其活性筛选[7]。为了进一步明确其化学成分, 本实验对怀中1号鲜地黄的化学成分进行系统分离与鉴定, 从中分离得到20个化合物, 分别为3-methyl-2-(hydroxymethyl)-4H-pyrone-4-one (1) (图 1)、3-氨基-2-吡啶乙醇(2) (图 1)、(5'S)-2-oxo-N-phenylpyrrolidine-3-carboxamide (3) (图 1)、焦谷氨酸甲酯(4)、吲唑(5)、尿苷(6)、腺苷(7)、rehmanalkaloid C (8)、1-(3-乙基苯基)-1, 2-乙二醇(9)、(3-乙基苯基)-1, 2-乙二醇(10)、2-羟甲基苯基-1-O-β-D-葡萄糖苷(11)、玉叶金花苷酸甲酯(12)、11-methylforsythide (13)、7-去氧栀子新苷(14)、1-O-α-L-鼠李糖苷(1→6)-β-D-吡喃葡萄糖苷(15)、6-deoxy-D-mannono-1, 4-lactone (16)、富马酸单甲酯(17)、daphneresinol (18)、二氢槲皮素(19)、rhamnopyranosyl vaniloyl (20)。化合物1为新化合物, 化合物2、3为新天然产物, 化合物4、5、9~11、13、14以及16~19是从地黄属中首次分离得到的。
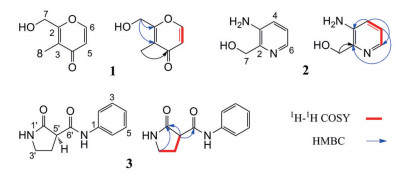
|
Figure 1 Structure and key 1H-1H COSY and HMBC correlations of compounds 1-3 |
化合物1 无色蜡状物, 易溶于甲醇; IR (iTR) 图谱中显示有羟基(3 378 cm-1)、羰基(1 715 cm-1)、双键(1 616, 1 635 cm-1) 基团特征吸收峰; UV (MeOH) λmax(logε): 216 (1.48), 277 (1.21) nm; HR-ESI-MS给出m/z: 121.028 7 [M-H2O-H]- (Calcd. 121.028 4), 确定分子式为C7H8O3, 计算不饱和度为4。1H NMR (CD3OD, 500 MHz) 谱中, δH 8.00 (1H, d, J=5.5 Hz, H-6)、6.41 (1H, d, J=5.5 Hz, H-5) 为2个双键上的氢信号, δH 4.61 (2H, s, H-7) 为1个连氧亚甲基氢信号, δH 2.55 (3H, s, H-8) 为1个甲基氢信号; 13C NMR (CD3OD, 125 MHz) 谱中, 显示7个碳信号, 结合HSQC谱可知, δC 176.3 (C-4) 为羰基碳信号, δC 156.8 (C-2)、152.0 (C-6)、145.0 (C-3)、114.5 (C-5) 为两个双键碳信号, δC 56.9 (C-7) 为连氧亚甲基碳信号, δC 29.9 (C-8) 为甲基碳信号。化合物1的核磁数据与文献报道的已知化合物3-hydorxy-2-hydorxymethly-4H-pyran-4-one的核磁数据对比[8], 发现主要区别在于化合物1的C-3位为甲基取代。基于以上分析, 确定化合物1结构为3-methyl-2-(hydroxymethyl)-4H-pyrone-4-one, 为1个新化合物, 数据归属见表 1。
| Table 1 1H NMR (500 MHz in CD3OD) and 13C NMR (125 MHz in CD3OD) data of compounds 1-3 |
化合物2 无色蜡状物, 易溶于甲醇; IR (iTR) 提示该化合物含有羟基(3 318 cm-1) 基团特征吸收峰; UV (MeOH) λmax: 202, 285 nm; HR-ESI-MS给出m/z: 163.019 8 [M+K]+ (Calcd. 163.026 8), 分子式为C6H8N2O, 计算不饱和度为4。1H NMR (CD3OD, 500 MHz) 谱中, δH 7.77 (1H, d, J=8.3 Hz, H-4)、7.71 (1H, dd, J=8.3, 5.7 Hz, H-5) 为1组邻位偶合芳香氢信号, δH 4.91 (2H, s, H-7) 为1个亚甲基氢信号; 13C NMR (CD3OD, 125 MHz) 谱中, 共显示6碳信号, 结合DEPT-135和HSQC谱发现, 其中包括2个季碳信号[δC 154.7 (C-2), 146.9 (C-3)]、3个叔碳信号[δC 129.9 (C-4), 126.9 (C-5), 132.7 (C-6)] 以及一个仲碳信号[δC 58.2 (C-7)]。在1H-1H COSY谱中, H-5分别与H-4和H-6具有相关关系, 即H4/H5/H6为一个自旋偶合体系。在HMBC谱中, δH 7.77 (H-4) 与C-2/C-3/C-6相关, 结合分子式以及C-2 (δC 154.7) 与C-6 (δC 132.7) 的化学位移, 可推测出化合物结构中含有一个吡啶环片段, 另外δH 4.91 (H-7) 与C-2远程相关, 推测C-2位连有一个亚甲基(图 1), 综合上述信息, 确定化合物2结构为3-氨基-2-吡啶乙醇。经检索, 化合物2与文献[9]报道合成的产物具有相同结构, 而相关文献未见其波谱数据报道, 因此确定化合物2为新天然产物, 数据归属见表 1。
化合物3 黄色固体颗粒物, 易溶于甲醇;

|
Figure 2 Experimental and calculated ECD spectra of compound 3 |
Bruker AVANCE Ⅲ 500型核磁共振仪(德国布鲁克公司); Bruker maxis HD型飞行时间质谱(德国布鲁克公司); 赛谱锐思LC52型高压制备液相色谱仪(赛谱锐思北京科技有限公司); Thermo EVO300紫外分光光度计(Thermo Scientific, USA) 型紫外检测器; Autopol Ⅳ全自动旋光仪(美国鲁道夫公司); N-1001型旋转蒸发仪、A-1000S型水流抽气机、N-1111型冷冻水循环装置(上海埃朗仪器有限公司); 电热鼓风干燥箱(上海一恒科学仪器有限公司); YMC-Pack ODS-A色谱柱(250 mm × 20 mm, 5 μm, 日本YMC有限公司); 柱色谱填料Sephadex LH-20 (Pharmaci Biotech公司); Toyopearl HW-40C (日本TOSOH公司); ODS (40~60 μm, 日本YMC有限公司); MCI gel CHP-20、大孔树脂Diaion HP-20 (日本三菱化学公司); 薄层色谱硅胶GF 254、柱色谱硅胶(100~200目、200~300目, 青岛海洋化工厂); 甲醇(色谱纯, 天津四友精细化学品有限公司); 乙腈(色谱纯, 美国天地有限公司); 所用其他分析纯试剂均为天津市富宇精细化工有限公司及天津市致远化学试剂有限公司生产。
怀中1号鲜地黄于2018年11月采自河南省武陟县, 经过药学院董诚明教授及陈随清教授鉴定为玄参科植物地黄(Rehmannia glutinosa Libosch) 新鲜的块根, 植物标本(NO.20181101A) 保存于河南中医药大学中药化学提取分离实验室。
1 提取分离取怀中1号鲜地黄新鲜块根80.0 kg, 切小块, 用70%丙酮组织破碎提取两次, 过滤, 合并提取液, 减压浓缩得浸膏15.0 kg, 加水稀释至20 L, 分别用石油醚、二氯甲烷、乙酸乙酯、正丁醇萃取, 回收溶剂后得石油醚部位42.0 g, 二氯甲烷部位35.0 g, 乙酸乙酯部位80.0 g, 正丁醇部位380.0 g。
乙酸乙酯部位(80.0 g) 经硅胶柱色谱(100~200目) 分离, 以二氯甲烷-甲醇(500∶1→30∶1) 梯度洗脱, TLC检识并合并相同流分得到5个组分, 即E1~E5。E4 (20.0 g) 经ODS反相色谱柱分离, 以甲醇-水(10∶90→100∶0) 梯度洗脱, TLC检识并合并相同流分得到5个组分(E4-1~E4-5)。E4-2 (5.8 g) 经硅胶柱色谱(200~300目) 分离, 以二氯甲烷-甲醇(245∶1→15∶1) 梯度洗脱, TLC检识并合并相同流分得到4个组分(E4-2-1~E4-2-4); E4-2-3 (464.3 mg) 和E4-2-4 (685.1 mg) 分别经半制备型高效液相色谱分离得到化合物7 (甲醇-水31∶69, tR=17.5 min, 1.4 mg) 和化合物19 (甲醇-水46∶54, tR=21.3 min, 5.8 mg)。E4-3 (12.3 g) 上Sephadex LH-20凝胶柱, 以甲醇洗脱, TLC检识并合并相同流分得到6个组分(E4-3-1~E4-3-6); E4-3-5 (4.6 g) 经硅胶柱色谱(200~300目) 分离, 以二氯甲烷-甲醇(135∶1→25∶1) 梯度洗脱, TLC检识并合并相同组流分得到6个组分(E4-3-5-1~E4-3-5-6); E4-3-5-1 (263.2 mg)、E4-3-5-3 (485.6 mg) 和E4-3-5-5 (158.4 mg) 分别经半制备型高效液相色谱分离得到化合物1 (乙腈-水6∶94, tR=15.2 min, 2.4 mg)、化合物16 (甲醇-水5∶95, tR=18.6 min, 23.5 mg)和化合物17 (甲醇-水21∶79, tR=16.3 min, 3.0 mg)。E5 (16.5 g) 经硅胶柱色谱(200~300目)分离, 以二氯甲烷-甲醇(160∶1→5∶1) 梯度洗脱, TLC检识并合并相同流分得到5个组分, 即E5-1~E5-5。E5-2 (16.1 g) 上Toyopearl HW-40C凝胶柱, 以甲醇-水(70∶30) 等度洗脱, TLC检识并合并相同流分得到6个组分, 即E5-2-1~E5-2-6; E5-2-2 (6.1 g) 上Sephadex LH-20凝胶柱, 以甲醇洗脱, TLC检识并合并相同流分得到4个组分(E5-2-2-1~ E5-2-2-4); E5-2-2-1 (865.3 mg) 和E5-2-2-2 (451.4 mg) 分别经半制备型高效液相色谱分离得到化合物2 (甲醇-水9∶91, tR=9.1 min, 2.5 mg) 和化合物6 (乙腈-水10∶90, tR=12.4 min, 3.1 mg); E5-2-3 (451.0 mg) 经半制备型高效液相色谱(乙腈-水10∶90) 等度洗脱, 得到化合物11 (tR=15.4 min, 2.8 mg)、化合物12 (tR=24.5 min, 6.4 mg); E5-2-4 (4.7 g) 经硅胶柱色谱(200~300目) 分离, 以二氯甲烷-甲醇(135∶1→5∶1) 梯度洗脱, TLC检识并合并相同流分得到4个组分(E5-2-4-1~ E5-2-4-4); E5-2-4-2 (186.2 mg) 经半制备型高效液相色谱(甲醇-水24∶76) 等度洗脱, 得到化合物8 (tR=25.2 min, 1.6 mg); E5-2-5 (6.4 g) 上Toyopearl HW-40C凝胶柱, 以甲醇等度洗脱, TLC检识并合并相同流分得到5个组分(E5-2-5-1~E5-2-5-5); E5-2-5-2 (259.0 mg) 经半制备型高效液相色谱(乙腈-水13∶87) 等度洗脱, 得到化合物18 (tR=15.1 min, 0.7 mg)。
正丁醇部位(380 g) 上大孔吸附树脂Diaion HP-20柱, 采用水、10%→100%含水乙醇梯度洗脱。将得到的40%含水乙醇部位(10.0 g) 上MCI gel CHP-20柱, 以甲醇-水(10∶90→100∶0) 梯度洗脱, TLC检识并合并相同流分得到5个组分(F4-1~F4-5)。F4-2 (2.6 g) 经硅胶柱色谱(200~300目) 分离, 以二氯甲烷-甲醇(200∶1→5∶1) 梯度洗脱, TLC检识并合并相同流分得到6个组分(F4-2-1~F4-2-6); F4-2-5 (1.5 g) 上Toyopearl HW-40C凝胶柱, 以甲醇-水(70∶30) 等度洗脱, TLC检识并合并相同流分得到5个组分(F4-2-5-1~F4-2-5-5); F4-2-5-3 (154.7 mg) 和F4-2-5-5 (231.4 mg) 分别经半制备型高效液相色谱分离得到化合物14 (乙腈-水32∶68, tR=25.7 min, 6.1 mg) 和化合物15 (乙腈-水21∶79, tR=28.3 min, 5.4 mg)。将得到的70%含水乙醇部位(16.0 g) 上MCI gel CHP-20柱, 用甲醇-水(10∶90→100∶0) 梯度洗脱, TLC检识并合并相同流分得到6个组分(F7-1~F7-6)。F7-1 (700.0 mg) 经硅胶柱色谱(100~200目) 分离, 以二氯甲烷-甲醇(160∶1→10∶1) 梯度洗脱, TLC检识并合并相同流分得到4个组分(F7-1-1~F7-1-4); F7-1-2 (240.6 mg) 经半制备型高效液相色谱(甲醇-水12∶88) 等度洗脱, 得到化合物4 (tR=26.3 min, 6.3 mg); F7-2 (626.4 mg) 经硅胶柱色谱(200~300目) 分离, 以二氯甲烷-甲醇(120∶1→5∶1) 梯度洗脱, TLC检识并合并相同流分得到7个组分(F7-2-1~F7-2-7); F7-2-6 (179.0 mg) 经半制备型高效液相色谱(乙腈-水12∶88) 等度洗脱, 得到化合物20 (tR=22.9 min, 2.8 mg); F7-4 (3.6 g) 上Sephadex LH-20凝胶柱, 以甲醇-水(70∶30) 等度洗脱, TLC检识并合并相同流分得到7个组分(F7-4-1~F7-4-7); F7-4-3 (611.2 mg) 经半制备型高效液相色谱(乙腈-水21∶79)等度洗脱, 得到化合物9 (tR=13.5 min, 2.5 mg) 和化合物10 (tR=16.1 min, 1.2 mg); F7-4-4 (263.4 mg)、F7-4-5 (320.0 mg) 和F7-4-6 (457.3 mg) 分别经半制备型高效液相色谱分离得到化合物3 (乙腈-水17∶83, tR=17.4 min, 5.0 mg)、化合物5 (甲醇-水39∶61, tR=27.6 min, 1.0 mg) 和化合物13 (乙腈-水14∶86, tR=34.3 min, 4.0 mg)。
2 结构鉴定化合物1 无色蜡状物, 易溶于甲醇; HR-ESI-MS m/z: 121.028 7 [M-H2O-H]- (Calcd. 121.028 4), 分子式为C7H8O3; IRνmax: 3 378、1 715、1 616、1 635 cm-1; UV (MeOH) λmax(logε): 216 (1.48)、277 (1.21) nm。1H NMR (CD3OD, 500 MHz) 和13C NMR (CD3OD, 125 MHz) 数据见表 1。
化合物2 无色蜡状物, 易溶于甲醇; HR-ESI-MS m/z: 163.019 8 [M+K]+(Calcd. 163.026 8), 分子式为C6H8N2O; IRνmax: 3 318 cm-1; UV (MeOH) λmax: 202、285 nm。1H NMR (CD3OD, 500 MHz) 和13C NMR (CD3OD, 125 MHz) 数据见表 1。
化合物3 黄色固体颗粒物, 易溶于甲醇,
化合物4 黄色蜡状物, 易溶于甲醇, ESI-MS m/z: 144 [M+H]+, 分子式为C6H9NO3。1H NMR (CD3OD, 500 MHz) δH 2.16 (1H, m, H-4a), 2.32 (1H, m, H-3a), 2.36 (1H, m, H-4b), 2.48 (1H, m, H-3b), 3.74 (3H, s, 4-OCH3), 4.29 (1H, m, H-5); 13C NMR (CD3OD, 125 MHz) δC 181.6 (C-2), 30.3 (C-3), 25.8 (4-OCH3), 57.0 (C-5), 174.5 (C-6), 52.9 (C-7)。以上数据与文献[11]进行对比, 确定化合物为焦谷氨酸甲酯。
化合物5 白色无定形粉末, 易溶于甲醇, ESI-MS m/z: 119 [M+H]-, 分子式为C7H6N2。1H NMR (CD3OD, 500 MHz) δH 7.16 (1H, m, H-5), 7.19 (1H, m, H-7), 7.45 (1H, d, J=7.6 Hz, H-6), 7.96 (1H, s, H-3), 8.08 (1H, d, J=7.6 Hz, H-8); 13C NMR (CD3OD, 125 MHz) δC 133.0 (C-3), 122.3 (C-4), 122.0 (C-5), 127.5 (C-6), 112.9 (C-7), 138.2 (C-8), 123.5 (C-9)。以上数据与文献[12]进行对比, 确定化合物为吲唑。
化合物6 无色蜡状物, 易溶于甲醇, ESI-MS m/z: 245 [M+H]+, 分子式为C9H12O6N2。1H NMR (CD3OD, 500 MHz) δH 3.73 (1H, dd, J=12.3, 2.8 Hz, H-5b'), 3.83 (1H, dd, J=12.3, 2.8 Hz, H-5a'), 3.99 (1H, dd, J=7.0, 1.9 Hz, H-4'), 4.14 (1H, m, H-3'), 4.16 (1H, m, H-2'), 5.68 (1H, dd, J=8.1, 1.5 Hz, H-5), 5.88 (1H, d, J=3.9 Hz, H-1'), 7.99 (1H, dd, J=8.1, 1.5 Hz, H-6); 13C NMR (CD3OD, 125 MHz) δC 152.5 (C-2), 166.2 (C-4), 102.7 (C-5), 142.7 (C-6), 90.7 (C-1'), 75.7 (C-2'), 71.3 (C-3'), 86.3 (C-4'), 62.3 (C-5')。以上数据与文献[13]进行对比, 确定化合物为尿苷。
化合物7 黄色固体颗粒物, 易溶于甲醇, ESI-MS m/z: 268 [M+H]+, 分子式为C10H13O4N5。1H NMR (CD3OD, 500 MHz) δH 3.53 (1H, m, H-5'a), 3.66 (1H, m, H-5'b), 3.96 (1H, m, H-4'), 4.14 (1H, m, H-3'), 4.61 (1H, t, J=6.0 Hz, H-2'), 5.87 (1H, dd, J=6.2, 1.8 Hz, H-1'), 8.13 (1H, s, H-8), 8.35 (1H, s, H-2); 13C NMR (DMSO-d6, 125 MHz) δC 152.6 (C-2), 149.3 (C-4), 119.6 (C-5), 156.4 (C-6), 140.1 (C-8), 88.1 (C-1'), 73.6 (C-2'), 70.9 (C-3'), 86.1 (C-4'), 61.9 (C-5')。以上数据与文献[14]进行对比, 确定化合物为腺苷。
化合物8 无色蜡状物, 易溶于甲醇, ESI-MS m/z: 206 [M+Na]+, 分子式为C9H13NO3。1H NMR (CD3OD, 500 MHz) δH 2.33 (2H, t, J=7.2 Hz, H-5), 2.54 (2H, m, H-8), 2.56 (2H, m, H-7), 3.36 (2H, t, J=7.2 Hz, H-6), 3.66 (3H, s, H-10), 5.60 (1H, s, H-3); 13C NMR (CD3OD, 125 MHz) δC 167.7 (C-2), 119.2 (C-3), 158.3 (C-4), 28.6 (C-5), 40.1 (C-6), 32.4 (C-7), 31.9 (C-8), 174.5 (C-9), 52.2 (C-10)。以上数据与文献[15]进行对比, 确定化合物为rehmanalkaloid C。
化合物9 淡黄色固体, 易溶于甲醇, ESI-MS m/z: 165 [M-H]+, 分子式为C10H14O2。1H NMR (CD3OD, 500 MHz) δH 1.21 (3H, s, 10-CH3), 2.63 (2H, m, H-9), 3.59 (2H, t, J=4.7 Hz, H-8), 4.64 (1H, t, J=5.7 Hz, H-7), 7.08~7.23 (4H, m, H-2, 4, 5, 6); 13C NMR (CD3OD, 125 MHz) δC 143.3 (C-1), 124.7 (C-2), 145.5 (C-3), 128.1 (C-4), 129.3 (C-5), 126.9 (C-6), 76.0 (C-7), 68.8 (C-8), 29.9 (C-9), 16.2 (10-CH3)。以上数据与文献[16]进行对比, 确定化合物为1-(3-乙基苯基)-1, 2-乙二醇。
化合物10 淡黄色蜡状物, 易溶于甲醇, ESI-MS m/z: 193 [M-H]-, 分子式为C10H14O2。1H NMR (CD3OD, 500 MHz) δH 1.19 (3H, s, 10-CH3), 2.61 (2H, m, H-9), 3.58 (2H, t, J=5.1 Hz, H-8), 4.63 (1H, t, J=5.1 Hz, H-7), 7.16 (2H, m, H-3, 5), 7.26 (2H, m, H-2, 6); 13C NMR (CD3OD, 125 MHz) δC 144.8 (C-1), 128.7 (C-2, 6), 129.3 (C-4), 127.5 (C-3, 5), 75.8 (C-7), 68.8 (C-8), 29.6 (C-9), 16.3 (C-10)。以上数据与文献[17]进行对比, 确定化合物为(3-乙基苯基)-1, 2-乙二醇。
化合物11 白色固体颗粒物, 易溶于甲醇, ESI-MS m/z: 309 [M+Na]+, 分子式为C13H18O7。1H NMR (CD3OD, 500 MHz) δH 4.38 (1H, d, J=7.8 Hz, H-1'), 4.72 (1H, d, H-7a), 4.92 (1H, d, H-7b), 6.79 (2H, d, H-4, 5), 7.11 (1H, d, H-3), 7.33 (1H, d, H-6); 13C NMR (CD3OD, 125 MHz) δC 125.2 (C-1), 156.6 (C-2), 116.3 (C-3), 130.1 (C-4), 120.5 (C-5), 131.0 (C-6), 71.7 (C-7), 103.5 (C-1'), 75.1 (C-2'), 78.1 (C-3', 5'), 67.8 (C-4'), 62.8 (C-6')。以上数据与文献[18]进行对比, 确定化合物为2-羟甲基苯基-1-O-β-D-葡萄糖苷。
化合物12 白色无定形粉末, 易溶于甲醇, ESI-MS m/z: 413 [M+Na]+, 分子式为C17H26O10。1H NMR (CD3OD, 500 MHz) δH 1.30 (3H, s, H-10), 3.68 (3H, s, H-12), 4.65 (1H, d, J=8.0 Hz, H-1'), 5.44 (1H, d, J=4.3 Hz, H-1), 7.39 (1H, s, H-3); 13C NMR (CD3OD, 125 MHz) δC 95.4 (C-1), 152.0 (C-3), 113.4 (C-4), 32.0 (C-5), 30.7 (C-6), 40.7 (C-7), 80.5 (C-8), 52.3 (C-9), 24.6 (C-10), 169.4 (C-11), 51.6 (C-12), 99.8 (C-1'), 74.7 (C-2'), 78.4 (C-3'), 71.7 (C-4'), 78.0 (C-5'), 62.9 (C-6')。以上数据与文献[19]进行对比, 确定化合物为玉叶金花苷酸甲酯。
化合物13 无色蜡状物, 易溶于甲醇, ESI-MS m/z: 427 [M+Na]+, 分子式为C17H24O11。1H NMR (CD3OD, 500 MHz) δH 1.52 (1H, m, H-6a), 1.80 (1H, m, H-7a), 2.06 (1H, m, H-7b), 2.21 (1H, m, H-6b), 2.52 (1H, t, J=7.6 Hz, H-9), 2.94 (1H, m, H-8), 3.20 (1H, m, H-5), 3.69 (3H, s, H-12), 4.65 (1H, d, J=7.9 Hz, H-1'), 5.21 (1H, d, J=6.4 Hz, H-1), 7.46 (1H, brs, H-3); 13C NMR (CD3OD, 125 MHz) δC 97.5 (C-1), 153.3 (C-3), 111.9 (C-4), 36.2 (C-5), 33.4 (C-6), 29.6 (C-7), 46.3 (C-8), 45.1 (C-9), 178.9 (C-10), 169.3 (C-11), 51.7 (C-12), 100.5 (C-1'), 74.7 (C-2'), 78.5 (C-3'), 71.5 (C-4'), 77.9 (C-5'), 62.7 (C-6')。以上数据与文献[20]进行对比, 确定化合物为11-methylforsythide。
化合物14 无色蜡状物, 易溶于甲醇, FAB-MS m/z: 357 [M-H]-, 分子式为C16H22O9。1H NMR (CD3OD, 500 MHz) δH 1.78 (1H, m, H-6a), 2.01 (1H, m, H-6b), 2.30 (2H, m, H-7), 3.20 (1H, m, H-5), 4.67 (1H, d, J=7.9 Hz, H-1'), 5.06 (1H, d, J=1.6 Hz, H-10a), 5.12 (1H, d, J=1.6 Hz, H-10b), 5.44 (1H, d, J=4.9 Hz, H-1), 7.46 (1H, brs, H-3); 13C NMR (CD3OD, 125 MHz) δC 96.4 (C-1), 153.9 (C-3), 111.3 (C-4), 35.5 (C-5), 31.9 (C-6), 31.6 (C-7), 150.5 (C-8), 46.4 (C-9), 109.9 (C-10), 170.3 (C-11), 99.8 (C-1'), 74.7 (C-2'), 78.4 (C-3'), 71.7 (C-4'), 78.0 (C-5'), 62.8 (C-6')。以上数据与文献[21]进行对比, 确定化合物为7-去氧栀子新苷。
化合物15 无色蜡状物, 易溶于甲醇, ESI-MS m/z: 535 [M+H]+, 分子式为C23H34O14。1H NMR (CD3OD, 500 MHz) δH 2.08 (1H, m, H-6a), 2.69 (1H, t, J=7.8 Hz, H-9), 2.80 (1H, m, H-6b), 3.21 (1H, m, H-5), 3.70 (3H, s, H-12), 4.16 (1H, d, J=4.3 Hz, H-10a), 4.32 (1H, d, J=4.3 Hz, H-10b), 4.66 (1H, brs, H-1''), 4.69 (1H, d, J=1.4 Hz, H-1'), 5.03 (1H, d, J=7.9 Hz, H-1), 5.83 (1H, s, H-7), 7.51 (1H, brs, H-3); 13C NMR (CD3OD, 125 MHz) δC 99.2 (C-1), 153.8 (C-3), 113.0 (C-4), 37.3 (C-5), 40.3 (C-6), 129.1 (C-7), 145.3 (C-8), 47.5 (C-9), 61.9 (C-10), 170.0 (C-11), 52.2 (C-12), 101.1 (C-1'), 75.3 (C-2'), 78.3 (C-3'), 72.7 (C-4'), 77.4 (C-5'), 68.1 (C-6'), 102.6 (C-1''), 71.9 (C-2''), 74.5 (C-3''), 70.3(C-4''), 72.9 (C-5''), 18.6 (C-6'')。以上数据与文献[22]进行对比, 确定化合物为1-O-α-L-鼠李糖苷(1→6)-β-D-吡喃葡萄糖苷。
化合物16 白色针状结晶, 易溶于甲醇, ESI-MS m/z: 162 [M]+, 分子式为C6H10O5。1H NMR (CD3OD, 500 MHz) δH 1.28 (3H, d, J=6.1 Hz, H-6), 4.01 (1H, m, H-5), 4.06 (1H, m, H-2), 4.43 (1H, m, H-1), 4.49 (1H, d, J=4.6 Hz, H-3); 13C NMR (CD3OD, 125 MHz) δC 84.2 (C-1), 70.6 (C-2), 72.4 (C-3), 178.1 (C-4), 64.9 (C-5), 20.3 (C-6)。以上数据与文献[23]进行对比, 确定化合物为6-deoxy-D-mannono-1, 4-lactone。
化合物17 白色针状结晶, 易溶于甲醇, FAB-MS m/z: 131 [M+H]+, 分子式为C5H6O4。1H NMR (CD3OD, 500 MHz) δH 3.77 (3H, s, 5-OCH3), 6.78 (2H, s, H-2, 3); 13C NMR (CD3OD, 125 MHz) δC 167.0 (C-1), 135.6 (C-2), 133.9 (C-3), 167.9 (C-4), 52.7 (5-OCH3)。以上数据与文献[24]进行对比, 确定化合物为富马酸单甲酯。
化合物18 白色针状结晶, 易溶于甲醇, ESI-MS m/z: 378 [M]+, 分子式为C20H26O7。1H NMR (CD3OD, 500 MHz) δH 3.82 (3H, s, 3'-OCH3), 3.83 (3H, s, 3-OCH3), 6.61 (1H, d, J=8.1 Hz, H-5, 5'), 6.69 (1H, t, J=8.0 Hz, H-6, 6'), 6.93 (1H, s, H-2, 2'); 13C NMR (CD3OD, 125 MHz) δC 137.8 (C-1), 113.1 (C-2), 149.1 (C-3), 145.7 (C-4, 4'), 116.3 (C-5), 121.7 (C-6), 52.1 (C-7), 45.0 (C-8), 43.9 (C-9), 63.7 (C-10), 59.7 (C-11), 60.4 (C-12), 137.2 (C-1'), 112.8 (C-2'), 148.8 (C-3'), 116.2 (C-5'), 121.4 (C-6'), 56.5 (3-OCH3), 56.4 (3'-OCH3)。以上数据与文献[25]进行对比, 确定化合物为daphneresinol。
化合物19 黄色无定形粉末, 易溶于甲醇, ESI-MS m/z: 303 [M-H]-, 分子式为C15H12O7。1H NMR (CD3OD, 500 MHz) δH 4.51 (1H, d, J=11.5 Hz, H-3), 4.92 (1H, d, J=11.5 Hz, H-2), 5.89 (1H, d, J=2.1 Hz, H-6), 5.93 (1H, d, J=2.1 Hz, H-8), 6.80 (1H, d, J=8.2 Hz, H-5'), 6.86 (1H, dd, J=8.2, 1.9 Hz, H-6'), 6.97 (1H, d, J=1.9 Hz, H-2'); 13C NMR (CD3OD, 125 MHz) δC 85.2 (C-2), 73.8 (C-3), 198.5 (C-4), 165.4 (C-5), 97.3 (C-6), 168.8 (C-7), 96.3 (C-8), 164.6 (C-9), 101.9 (C-10), 129.9 (C-1'), 116.1 (C-2'), 146.4 (C-3'), 147.2 (C-4'), 115.9 (C-5'), 120.9 (C-6')。以上数据与文献[26]进行对比, 确定化合物为二氢槲皮素。
化合物20 白色固体颗粒物, 易溶于甲醇, ESI-MS m/z: 337 [M+H]+, 分子式为C14H18O8。1H NMR (CD3OD, 500 MHz) δH 1.20 (3H, d, J=6.2 Hz, H-6'), 3.46 (1H, t, J=9.5 Hz, H-4'), 3.68 (1H, m, H-5'), 3.86 (3H, s, 3-OCH3), 3.89 (1H, m, H-3'), 4.06 (1H, dd, J=3.0, 2.0 Hz, H-2'), 5.48 (1H, d, J=1.5 Hz, H-1'), 6.61 (1H, d, J=8.6 Hz, H-5), 7.61 (2H, d, J=7.7 Hz, H-2, 6); 13C NMR (CD3OD, 125 MHz) δC 126.3 (C-1), 114.4 (C-2), 150.9 (C-3), 151.3 (C-4), 117.5 (C-5), 124.4 (C-6), 169.6 (C-7), 100.6 (C-1'), 71.9 (C-2'), 72.2 (C-3'), 73.7 (C-4'), 71.1 (C-5'), 17.9 (C-6'), 56.5 (3-OCH3)。以上数据与文献[27]进行对比, 确定化合物为rhamnopyranosyl vaniloyl。
作者贡献: 范锡玲是本文章的第一作者, 负责怀中1号鲜地黄化学成分的分离、鉴定以及文章的整理; 曹彦刚博士和刘晏灵及时对实验中遇到的问题给予帮助和指导, 并负责相关稿件的修改; 任英杰、王梦娜、陈旭、何晨和郑晓珂帮助怀中1号鲜地黄化学成分的分离; 冯卫生教授是本文章的通讯作者, 负责实验设计、稿件修改等工作。
利益冲突: 所有作者均声明不存在利益冲突
| [1] |
Feng WS, Li M, Zheng XK, et al. Study on chemical constituents of immunosuppressive parts from the roots of Rehmannia glutinosa[J]. Chin Pharm J (中国药学杂志), 2014, 49: 1496-1502. |
| [2] |
Meng QY, Lv XF, Jin XD. Effect of Rehmannia glutinosa Libosch water extraction on gene expression of proinsulin in type 2 diabetes mellitus rats[J]. J Chin Med Mater (中药材), 2008, 31: 397-399. |
| [3] |
Yu M, Qin LQ, Chi JM, et al. Effects of Dihuang Tusi Tiaojing granules on expression of GnRHR protein in premature ovarian failure rats caused by cyclophosphamide[J]. J Chin Med Pharmacol (中医药学报), 2015, 43: 51-54. |
| [4] |
Xu L, Zhang W, Zeng L, et al. Rehmannia glutinosa polysaccharide induced an anti-cancer effect by activating natural killer cells[J]. Int J Biol Macromol, 2017, 105: 680-685. DOI:10.1016/j.ijbiomac.2017.07.090 |
| [5] |
Zhao YY, Chen Y, Shan ZF, et al. Evaluation of the estrogenic effects of rehmapicrogenin[J]. Acta Pharm Sin (药学学报), 2019, 54: 308-312. |
| [6] |
Liu YF, Shi GR, Wang X, et al. Chemical constituents from whole plants of Rehmannia chingii[J]. Chin Tradit Herb Drugs (中草药), 2016, 47: 1830-1833. |
| [7] |
Liu YL, Cao YG, Kan YX, et al. Two new eremophilane-type sesquiterpenes from the fresh roots of Rehmannia glutinosa[J]. Phytochem Lett, 2020, 42: 125-128. |
| [8] |
Wei JH, Li YN, Mo HW, et al. Study on chemical constituents of Zhuang medicine Sauropus rostratus[J]. Lishizhen Med Mater Med Res (时珍国医国药), 2017, 28: 289-291. |
| [9] |
Xiong B, Li Y, Lv W, et al. Ruthenium-catalyzed straightforward synthesis of 1, 2, 3, 4-tetrahydronaphthyridines via selective transfer hydrogenation of pyridyl ring with alcohols[J]. Org Lett, 2015, 17: 4054-4057. DOI:10.1021/acs.orglett.5b01976 |
| [10] |
Kraatz U. Addition of aryl isocyanates with γ-butyrolactim and δ-valerolactim ether[J]. Tetrahedron, 1973, 29: 3991-3993. DOI:10.1016/0040-4020(73)80226-1 |
| [11] |
He CJ, Peng C, Dai O, et al. Chemical constituents from Leonurus japonicus injection[J]. Chin Tradit Herb Drugs (中草药), 2014, 45: 3048-3052. |
| [12] |
Ren YJ, Cao YG, Zhang BB, et al. Chemical constituents and antitumor activity from stems and leaves of Dioscorea opposita[J]. Chin Tradit Herb Drugs (中草药), 2020, 51: 918-924. |
| [13] |
Ren J, Xie YG, Guo YG, et al. Chemical constituents of Liparis viridiflora[J]. Chem Nat Compound, 2019, 55: 552-554. DOI:10.1007/s10600-019-02740-5 |
| [14] |
Feng WS, Li F, Guo MH, et al. A new pyrazine derivative from Dioscorea opposite Thunb[J]. Acta Pharm Sin (药学学报), 2017, 52: 1299-1301. |
| [15] |
Liu YF, Shi GR, Wang X, et al. Bioactive iridoid glycosides from the whole plants of Rehmannia chingii[J]. J Nat Prod, 2016, 79: 428-433. DOI:10.1021/acs.jnatprod.5b01126 |
| [16] |
Yan YM, Zhu HJ, Xiang B, et al. Chemical constituents from Periplaneta americana and their effects on wound healing[J]. Nat Prod Res Dev (天然产物研究与开发), 2018, 30: 591-596. |
| [17] |
Zhao JY, Ding JH, Li ZH, et al. Three new phenyl-ethanediols from the fruiting bodies of the mushroom Fomes fomentarius[J]. J Asian Nat Prod Res, 2013, 15: 310-314. DOI:10.1080/10286020.2013.764519 |
| [18] |
Zhuang XC, Yan YM, Zhang QZ, et al. Chemical constituents from n-BuOH extract of Codonopsis pilosula[J]. Mod Chin Med (中国现代中药), 2017, 19: 1233-1239. |
| [19] |
Li M, Wang XL, Zhang ZG, et al. Three new alkaloids and a new iridoid glycoside from the roots of Rehmannia glutinosa[J]. Phytochem Lett, 2017, 21: 157-162. DOI:10.1016/j.phytol.2017.06.010 |
| [20] |
Zhang YL, Gan ML, Li S, et al. Chemical constituents of stems and branches of Adina polycephala[J]. China J Chin Mater Med(中国中药杂志), 2010, 35: 1261-1271. |
| [21] |
Yang JQ, He WJ, Tan NH, et al. Chemical constituents of Pedicularis cephalantha Franch and P. siphonantha Don[J]. Nat Prod Res Dev (天然产物研究与开发), 2009, 21: 600-603. |
| [22] |
Zhang YL, Gan ML, Lin S, et al. Glycosides from the bark of Adina polycephala[J]. J Nat Prod, 2008, 71: 905-909. DOI:10.1021/np700758q |
| [23] |
Liu ZY, Luo DQ. Chemical constituents from the Trollius chinensis[J]. Chin Tradit Herb Drugs (中草药), 2010, 41: 370-373. |
| [24] |
Zhang Y, Ruan HL, Zhang YH, et al. Chemical constituents from the Cirsium henryi[J]. Her Med (医药导报), 2007, 12: 1425-1426. |
| [25] |
Liang S, Shen YH, Tian JM, et al. Phenylpropanoids from Daphne feddei and their inhibitory activities against NO production[J]. J Nat Prod, 2008, 71: 1902-1905. DOI:10.1021/np8004166 |
| [26] |
Jin HZ, Chen G, Li XF, et al. Flavonoids from Rhododendron decorum[J]. Chem Nat Compound, 2009, 45: 85-86. DOI:10.1007/s10600-009-9245-x |
| [27] |
Liu YF, Liang D, Luo H, et al. Chemical constituents from root tubers of Rehmannia glutinosa[J]. Chin Tradit Herb Drugs (中草药), 2014, 45: 16-22. |
 2021, Vol. 56
2021, Vol. 56


