目前, 多药耐药菌感染对人类的健康和生存构成了巨大的威胁, 而革兰阴性细菌的情况则更为严峻。世界卫生组织公布了一份对于抗生素耐药的“重点致病菌”名单, 列出了对人类健康威胁最大的12类细菌, 其中有9种是革兰阴性细菌, 包括3种最关键的病原体: 鲍曼不动杆菌、铜绿假单胞菌、肠杆菌[1]。这些细菌已经对许多抗生素产生了耐药性, 包括碳青霉烯类抗生素和第三代头孢菌素类抗生素, 这是目前抗多药耐药性细菌的最主要的药物。然而, 自1968年首个氟喹诺酮类抗菌药物上市以来, 至今鲜有全新机制的抗革兰阴性菌的抗生素被应用于临床[2]。因此, 关注抗革兰阴性细菌感染药物的研究, 以应对正在到来的健康危机, 已成为一个十分紧迫的问题。
革兰阴性菌细胞壁由外膜及含较薄肽聚糖层的水性周质组成, 对于抗生素的扩散构成了一个显著的渗透屏障。并且, 革兰阴性菌可利用多重外排泵将抗生素排出细菌细胞外, 减少抗生素在细胞内的积累。因此, 抗革兰阴性菌的药物研发非常困难[3]。目前, 在研药物的主要策略包括阻断脂蛋白转运系统、抑制脂多糖的形成、抑制Ⅱ型拓扑异构酶以及通过铁载体转运等[4]。铁载体结合型抗菌药是将抗生素与细菌的铁载体或铁载体的模拟物共价连接得到的铁载体-抗生素偶联物[5], 它们利用细菌对铁载体的特异性识别和转运, 进而跨越革兰阴性菌细胞壁的屏障, 起到抑制革兰阴性菌生长的作用[6-9]。
铁是世界上最丰富的元素之一, 几乎在所有生物中起着重要的作用。铁作为一个关键的酶辅因子参与着细菌的增殖和感染等重要的生物过程[10-12]。在生理pH条件下, 人血清中Fe3+的浓度约为1×10-24 mol·L-1, 而在铁离子被动扩散的条件下, 细菌生长所需要的铁离子浓度至少要维持在1×10-6 mol·L-1水平[13]。为了在感染过程中获得足够浓度的铁离子, 细菌会合成和分泌一系列相对分子质量在200至2 000之间、对Fe3+有高度亲和力的物质, 即铁离子载体(siderophore)[14]。到目前为止, 已经发现了500多种不同的铁离子载体。根据铁离子螯合基团的不同, 这些铁载体可以分为5个主要的类型[14, 15]: 儿茶酚酸类如Enterobctin (Ent, 肠杆菌素)[16]、氧肟酸类如Ferrichrome[17]、酚酸类如Pyochelin[18]、羧酸类如Staphyloferrin A[19]和“混合型”如Aerobactin[20] (图 1)。
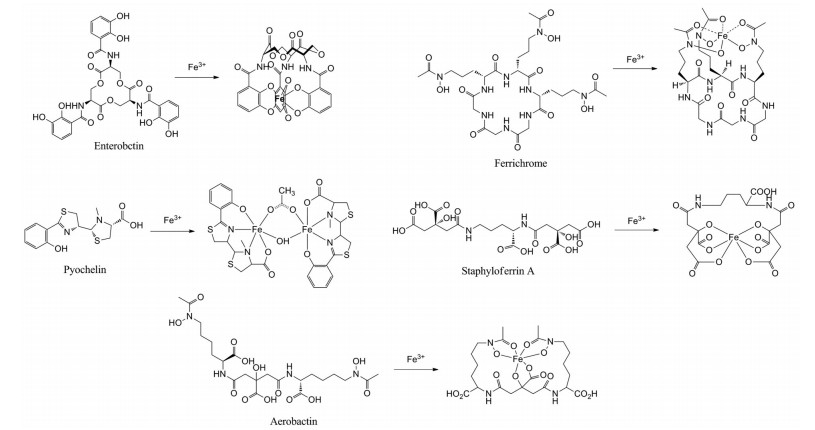
|
Figure 1 Different structures of siderophores and siderophore-iron chelates |
在革兰阴性细菌中, 以大肠杆菌为例, 外源性铁载体-Fe3+复合物需借助特定的外膜受体FepA转运到外膜周质内, 并且此过程由TonB-ExbB/D蛋白复合物介导的质子转移提供能量。然后该复合物与周质结合蛋白FepB结合, 通过ABC转运蛋白进入细胞质。在还原酶的作用下, Fe3+还原为Fe2+。铁载体-Fe2+复合物没有铁载体-Fe3+复合物稳定, Fe2+会从复合物中释放出来, 继而被细菌利用。随后, 铁载体会被分泌回胞外以收集更多的铁离子。或者, 游离铁离子可在周质中从铁离子-铁载体复合物释放出来, 而后被内化到细胞质中[21]。研究表明, 细菌的铁载体摄取途径可以通过主动转运将铁载体-抗生素偶联物运送到细菌细胞中(图 2), 这种方法被称为“特洛伊木马”策略[22-24]。

|
Figure 2 The siderophore-antibiotic conjugates transport pathway in E. coli |
目前, 已经有铁载体-头孢菌素偶联物Cefiderocol成功上市作为抗菌药使用。本文将综述近年来报道的铁载体-抗生素偶联物的研究进展, 并从不同种类的抗生素进行论述。
1 天然的铁载体-抗生素偶联物高铁霉素(sideromycins) 是天然的铁载体-抗生素偶联物, 而阿波霉素(albomycin, 1) 和salmycins (2) 是迄今为止研究最多的高铁霉素[14, 25]。阿波霉素包括一个含三个氧肟酸(tri-hyrdroxmate) 的铁螯合部分和一个具有抗菌作用的tRNA合成酶抑制剂部分[26]。阿波霉素在转运蛋白的协助下可以穿过外膜、周质和内膜, 从而内化到革兰阴性菌中[27]。阿波霉素进入细胞质后, 会被肽酶裂解, 抑制蛋白质合成的抗菌部分则在细胞质中被释放, 从而产生抗菌活性。阿波霉素对大肠杆菌的抗菌活性较强, 最低抑菌浓度(MIC值) 比β-内酰胺类抗生素氨苄西林低100倍。Salmycins是从链霉菌属Streptomyces violaceus DSM 8286中分离出来的。与阿波霉素相似, salmycins也包括一个含有三个氧肟酸的铁螯合部分。Salmycins可通过铁还原引发的分子内环化释放蛋白合成抑制剂氨基糖苷(图 3)[28]。它对葡球菌和链球菌(包括耐药菌株) 表现出很强的抗菌活性(MIC值为10 nmol·L-1)[29]。
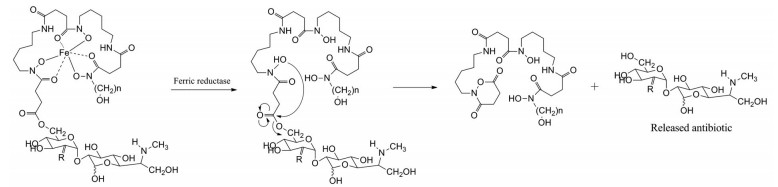
|
Figure 3 The drug release mechanism of salmycins |

|
迄今为止, 人工合成的β-内酰胺类抗生素与铁载体的偶联物在文献中报道最多, 这类化合物普遍具有较好的抗菌活性。因为β-内酰胺类抗生素的靶标是位于细菌细胞壁周质中的青霉素结合蛋白(penicillin binding proteins, PBPs), 其亲和力较高, 所以β-内酰胺类抗生素可耐受显著的侧链修饰, 与PBPs的竞争性结合研究证明了整个偶联物能够与靶标结合[30]。因此, 对于β-内酰胺类抗生素的铁载体偶联物来说, 通常不需要专门设计可裂解的连接臂以释放出抗生素来发挥抗菌作用[31]。目前报道了很多铁载体-β-内酰胺类偶联物, Lin等[32]的综述对多种β-内酰胺-铁载体偶联物进行了概述。
Dolence等[33]从天然高铁霉素中得到灵感, 报道了β-内酰胺类抗生素与三氧肟酸类铁载体偶联物(3) 的合成, 试图模仿阿波霉素的铁螯合与转运功能。偶联物3对β-内酰胺类抗生素敏感的大肠杆菌菌株表现出延迟生长的现象, 证明了合成的铁载体-抗生素偶联物也可以被运输到细菌中。

|
Ji等[34]报道了三儿茶酚铁载体模拟物与β-内酰胺类抗生素阿莫西林的偶联物(4) 的合成及其抗菌效果。偶联物4在缺铁培养基中对铜绿假单胞菌的抗菌活性表现出明显增强的趋势, MIC值在0.05~0.39 μmol·L-1范围内, 在富含铁离子培养基中MIC值在12.5~50 μmol·L-1范围内, 表明偶联物活性提高与铁离子浓度相关。而阿莫西林对铜绿假单胞菌基本没有活性(MIC值大于100 μmol·L-1)。偶联物4铁载体部分的邻苯二酚的羟基被乙酰化后, 可以作为前药绕过儿茶酚-O-甲基转移酶的潜在甲基化作用, 阻止邻苯二酚在体内的代谢和修饰。偶联物可以利用能量依赖的细菌铁吸收系统穿过革兰阴性菌外膜渗透屏障, 这是它们活性增加的原因。
Zheng等[35]将天然三儿茶酚铁载体肠杆菌素与氨苄西林偶联得到了偶联物5。在大肠杆菌菌株中, 该偶联物与氨苄西林相比MIC值低1 000倍。即使与革兰阳性金葡菌共培养, 偶联物5也能够选择性地杀死大肠杆菌。作者强调该偶联物的铁载体部分是天然铁载体肠杆菌素, 而不是人工合成的类似物, 因此偶联物5对菌株选择性及其抗菌活性都有显著增强。Chairatana等[36]合成了偶联物5的类似物6, 该偶联物铁载体部分是单或二糖基化的肠杆菌素(mono- and diglucosylated Ent), 其中两个邻苯二酚部分在C5位点糖功能化, 以模仿天然铁载体salmochelin (7)。与未经修饰的β-内酰胺抗生素相比, 糖功能化的偶联物对于利用salmochelin受体IroN的致病性大肠杆菌菌株的抗菌活性提高了1 000倍。此外, 该偶联物可选择性地杀死在非致病性大肠杆菌存在下表达salmochelin受体IroN的致病性大肠杆菌。
研究表明, 除三儿茶酚类铁载体外, 简化的单儿茶酚结构也可以被许多细菌尤其是革兰阴性细菌识别并吸收[37]。Ohi等[38]报道了儿茶酚类似物与脲基青霉素衍生物(ureidopenicillins derivatives) 共价连接偶联物的合成, 包括化合物8在内的这些偶联物对铜绿假单胞菌的MIC值比哌拉西林(piperacillin, 9) 低30~60倍。
现已上市的新型可注射的铁载体-头孢菌素偶联物Cefiderocol (10) 是一个成功的例子[39, 40]。2019年11月14日, 美国食品药品监督管理局(FDA) 批准新型抗菌药Cefiderocol上市, Cefiderocol由日本盐野义公司(Shionogi) 开发, 用于治疗选择有限或没有治疗选择的18岁及以上成人患者, 治疗由易感革兰阴性菌引起的复杂性尿路感染。Cefiderocol含有简化单儿茶酚结构, 与其他β-内酰胺抗生素相同, Cefiderocol主要是通过与青霉素结合蛋白结合抑制革兰阴性菌细胞壁的合成而产生抗菌活性的。然而, 它的独特之处在于它的类铁载体性质使它能够进入细菌周质间隙, 并且对各种β-内酰胺酶具有高度稳定性。儿茶酚部分使得Cefiderocol在周质中的浓度升高, 芳香环的第3位和第4位相邻的两个羟基有螯合Fe3+的能力, 可以利用革兰阴性菌外膜的铁转运系统有效地将化合物转运到细菌周质内, 从而产生其抗菌活性。进一步的机制研究表明[41], 当铜绿假单胞菌中缺乏外膜铁载体转运蛋白PiuA, 或大肠杆菌中缺乏外膜受体CirA和Fiu时, Cefiderocol的MIC值增加了16倍, 证明了铁载体转运蛋白有助于Cefiderocol穿过革兰阴性菌的外膜。Cefiderocol对碳青霉烯类耐药和耐多药革兰阴性杆菌感染具有很好的效果, 包括产生广谱β-内酰胺酶和碳青霉烯酶(carbapenemase) 的菌株[42]。Cefiderocol的上市进一步证明了简化的单儿茶酚结构也可以用于铁载体偶联物的设计。
研究表明, 单儿茶酚结构的生物电子等排体羟基吡啶酮也具有较强的铁螯合能力, 并且相对于儿茶酚结构, 羟基吡啶酮的代谢稳定性较强[43]。羟基吡啶酮主要用在单环β-内酰胺偶联物中。最早对单环β-内酰胺类偶联物进行研究的是Bristol Myers Squibb公司[43], 该公司以咪唑啉酮作为连接臂, 将临床上唯一使用的单环β-内酰胺类抗生素氨曲南与羟基吡啶酮进行偶联得到了化合物pirazmonam (11)。Pirazmonam对铜绿假单胞菌的MIC值为0.5 μg·mL-1, 而氨曲南本身对铜绿假单胞菌的MIC值为4 μg·mL-1。随后, Upjohn公司在pirazmonam基础上将连接臂更换为三唑酮得到了化合物U-78608 (12)[44], 它对革兰阴性菌具有显著的抗菌活性, 对91株临床分离的铜绿假单胞菌MIC90值为2 μg·mL-1, 而氨曲南的MIC90值大于64 μg·mL-1。
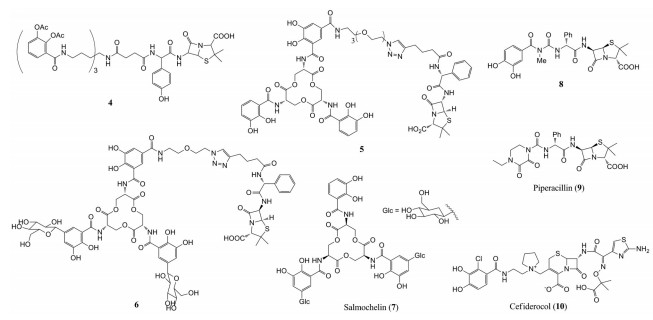
|

|
后来, 辉瑞公司以U-78608为先导化合物, 对连接臂三唑酮部分进行了进一步的优化, 将甲基替换成丙二醇基得到了化合物MC-1 (13)[45]。MC-1对革兰阴性菌的抗菌活性有了进一步的提高, 它对91株临床分离的铜绿假单胞菌的MIC90值为0.5 μg·mL-1, 并且与U-78608相比, MC-1在呼吸道感染的小鼠模型中表现出更强的保护作用。研究证明, 该化合物是借助了特定的TonB依赖性外膜受体PiuA的转运, 从而进入到细菌内发挥抗菌活性, 因此不受孔蛋白下调机制的影响[46]。此外, 作者还证明了其他革兰阴性抗菌剂的耐药机制不会显著改变MC-1对多药耐药革兰阴性菌的活性。在此基础上, 辉瑞公司设计合成了化合物MB-1 (14)[47], 为了模拟MC-1铁螯合基团的位置, MB-1的羟基吡啶酮连接在一个C-4位官能化的单环β-内酰胺上, 这一位置可能有利于MC-1规避耐药机制。MB-1表现出强大的抗革兰阴性菌活性, 但遗憾的是, MB-1的体内活性并不显著, 在中性粒细胞减少的小鼠感染模型中, 其有效性与体外测试结果并不相关, 不能直接从体外活性测定结果中预测。
Basilea公司设计和合成了偶联物BAL30072 (15)[48], 这是一种新型单环β-内酰胺类抗生素偶联物, 其羟基吡啶酮部分连接在氨基噻唑肟侧链上。BAL30072对铜绿假单胞菌和鲍曼不动杆菌均具有较好的抗菌活性(MIC90值分别为4和8 μg·mL-1), 但由于BAL30072具有严重的肝脏毒性而终止于Ⅰ期临床。
3 铁载体-喹诺酮类偶联物喹诺酮类抗生素靶向细菌细胞质中的核糖体, 在设计铁离子载体偶联物时, 通常需要可裂解的连接臂, 以保证偶联物进入细菌细胞质后可以释放出抗生素来发挥抗菌活性[30, 49]。该类偶联物的连接臂可通过不同的机制被裂解, 通常包括水解作用[50]、酶催化裂解[34]和还原作用[51]。目前报道的主要策略包括使用酯类连接臂[52-54]、缩醛连接臂[53, 55, 56]以及“三甲基锁”[57]和二硫键连接臂等[23]。
Noël等[56]合成了环丙沙星-pyochelin偶联物16, 该偶联物含有一个可裂解的缩醛连接臂。作者利用pyochelin铁载体来构建偶联物, 希望提高靶向细胞质DNA回旋酶的环丙沙星对铜绿假单胞菌的抗菌活性。偶联物16对铜绿假单胞菌PAO1菌株的MIC50值为0.6 μmol·L-1, 而具有不可裂解连接臂的类似物基本无活性。但偶联物16的抗菌活性仍低于未经修饰的环丙沙星(MIC50值为0.04 μmol·L-1)。同时, 这种连接臂也会出现过早水解的问题。
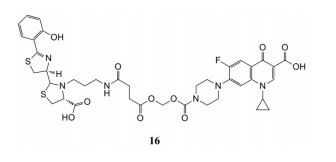
|
Ji和Miller[57]巧妙设计了偶联物17, 该偶联物是通过“三甲基锁”将环丙沙星与铁载体连接。“三甲基锁”是一种邻羟基肉桂酸衍生物, 其中三个甲基之间的位阻会促进其进行内酯化, 从而形成二氢香豆素。偶联物中连接臂释放抗生素的过程由细菌铁代谢的还原途径激活, 三价铁还原为二价铁后, “三甲基锁”中核心结构由醌还原成酚, 并进行内酯化, 从而使抗生素从偶联物中释放(图 4)。在抗菌试验中, 偶联物17比具有稳定连接臂的偶联物更有效, 这表明“三甲基锁”在偶联物被转运后促进了药物的释放过程。然而, 偶联物17的抗菌活性弱于未经修饰的环丙沙星, 这表明该偶联物的铁载体的识别过程或者连接臂的裂解效率还需要进一步的优化。此前, Ji等[34]使用酯酶裂解的三甲基锁也观察到了类似的结果(18)。这些偶联物表现出一定的抗菌活性, 但同样不如未经修饰的环丙沙星有效。

|
Figure 4 "Trimethyl lock" derived siderophore-antibiotic conjugates |
Neumann等[52]设计合成了肠杆菌素-环丙沙星偶联物19, 该偶联物由铁载体肠杆菌素和氟喹诺酮类抗生素环丙沙星组成, 通过烷基酰胺键连接。研究发现, 该偶联物被运送到大肠杆菌的细胞质中, 肠杆菌素可被细胞内的铁载体水解酶裂解并释放出氟喹诺酮。这种水解是由salmochelin酯酶IroD催化的, 而IroD仅在包含iroA基因簇的菌株中表达。偶联物19不仅与其原形物有相当的活性, 而且由于酯酶IroD主要存在于病原性大肠杆菌中, 因此其对病原性大肠杆菌具有一定的选择性抑制作用。Neumann和Nolan[51]随后合成和评价了具有可裂解连接臂的肠杆菌素-二硫键-环丙沙星(Ent–SS–Cipro) 偶联物20, 其中的二硫键为连接臂预期的裂解位点。作者证明了Ent–SS–Cipro的二硫键可被细菌中还原剂裂解, 包括细胞还原剂谷胱甘肽, 以释放未经修饰的氟喹诺酮类抗生素。但是偶联物20仅对有限数量的大肠杆菌菌株表现出抗菌活性, 而且对表达IroD的大肠杆菌的抗菌活性减弱。虽然作者还没阐明其中的具体原因, 但他们指出二硫键连接臂可能不适用于铁载体和抗生素的偶联。

|
Fardeau等[58]报道了带有和未带有哌嗪连接臂的三儿茶酚铁载体与环丙沙星的偶联物21和22, 偶联物21对铜绿假单胞菌DSM 1117菌株的MIC值为8 μg·mL-1, 与带有哌嗪连接臂的偶联物22相比, 其抗菌活性显著增强, 但其活性仍弱于其原形物环丙沙星(MIC值为0.25 μg·mL-1)。
4 铁载体-噁唑烷酮类偶联物以利奈唑胺为代表的噁唑烷酮类抗生素是一类新型化学全合成的细菌蛋白质合成抑制剂, 作用于细菌50S核糖体亚单位, 用于治疗革兰阳性球菌特别是多重耐药的革兰阳性球菌引起的感染, 但该类抗生素对于大多数革兰阴性细菌基本无效[59]。将噁唑烷酮类抗生素与铁离子载体偶联, 有望扩大其抗菌谱, 目前已有相关研究报道。
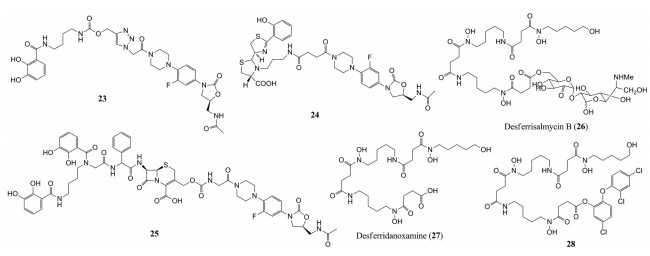
Paulen等[55]合成了利奈唑胺类似物与儿茶酚的偶联物23。该偶联物对铜绿假单胞菌的MIC值为128 μmol·L-1, 而利奈唑胺本身对铜绿假单胞菌的MIC值大于1 024 μmol·L-1。该偶联物不具有可裂解连接臂, 可能影响了噁唑烷酮与细胞质中靶点核糖体的作用。在另一项的研究中, Paulen等[60]将噁唑烷酮与铁载体pyochelin偶联, 得到了偶联物24及其衍生物, 但是所有的偶联物抗菌活性都不是很强。最近, Liu等[61]巧妙地设计并合成了噁唑烷酮偶联物25, 利用头孢菌素作为可裂解连接臂。作者假设该偶联物进入细菌细胞后, 头孢菌素可以被β-内酰胺酶裂解, 从而将噁唑烷酮释放到细菌细胞质中, 尤其是在产生β-内酰胺酶的耐药性菌株中, 偶联物的裂解可能性会增加。事实上, 该偶联物确实对临床分离的鲍曼不动杆菌以及ADC-1 β-内酰胺酶高表达的菌株具有活性。上述结果表明, 当噁唑烷酮类抗生素被有效传递到靶标时, 其对革兰阴性菌是具有较强的抗菌活性的。

|
Wencewicz等[30]对天然高铁霉素desferrisalmycin B (26) 结构进行改造, 分别合成了铁载体desferridanoxamine (27) 及其与三氯生的偶联物28, 三氯生是一种广谱抗菌剂, 被广泛应用于肥皂、牙膏等日用化学品之中, 它通过抑制细菌中的脂肪酸生物合成而表现出抗菌活性。偶联物28与未经修饰的三氯生抗菌活性基本相当, 据报道, 酚酯键对偶联物28的抗菌活性很重要, 但该偶联物在细胞外环境中可能存在过早裂解的问题。
在Miller等[62]的研究中, 将抗疟药青蒿素衍生物与可被结核分枝杆菌利用的铁载体mycobactin T类似物偶联, 得到了偶联物29。Mycobactin T的结合可将青蒿素从一种专门的抗疟药转化为具有双重活性的抗结核药, 其针对临床分离的8种不同多药耐药性结核分枝杆菌菌株的MIC值范围在0.125~1.25 μg·mL-1之间。作者猜测在将Fe3+还原为Fe2+的过程中, 会导致青蒿素转化为还原状态。还原状态的青蒿素可诱导氧自由基的产生, 从而产生抗菌活性。
Gosh等[63]使用混合的邻苯二酚和氧肟酸类铁载体类似物, 模拟鲍曼不动杆菌的天然铁载体fimsbactin, 将主要对革兰阳性菌有效的抗生素达托霉素改造为对鲍曼不动杆菌有效的药物(30)。该偶联物的活性取决于铁载体中的铁螯合基团, 其对于鲍曼不动杆菌ATCC 17961和金葡菌ATCC 11632的MIC值分别为0.4和12.5 μmol·L-1。而达托霉素自身对金葡菌ATCC 11632的MIC值为0.4 μmol·L-1, 对于鲍曼不动杆菌ATCC 17961的MIC值大于100 μmol·L-1。
最近, Ghosh等[64]合成了双邻苯二酚-替考拉宁偶联物31和儿茶酚-异羟肟酸-替考拉宁偶联物32。替考拉宁是类似于万古霉素的糖肽类抗生素, 通过结合肽聚糖的D-Ala-D-Ala末端来抑制细菌细胞壁的生物合成, 是5种成分的混合物, 即替考拉宁A2-1至A2-5, 但替考拉宁仅对革兰阳性菌有效。而将替考拉宁与人工合成的铁离子载体类似物偶联后, 化合物31与32对鲍曼不动杆菌包括产生碳青霉烯酶的鲍曼不动杆菌均具有较好的活性, 化合物31与32对鲍曼不动杆菌ATCC 17978-PNT-165菌株的MIC值分别为0.8和0.4 μmol·L-1, 而替考拉宁为25 μmol·L-1。
|

|
依赖于铁载体的铁摄取系统对于细菌的生物过程尤其是感染过程起着重要的作用[65-67]。同时, 由于哺乳动物不会分泌或利用铁载体, 因此基于铁摄取系统的新型抗菌药物具有较好的安全性。事实上, 铁载体-抗生素偶联物设计策略为发现抗多药耐药革兰阴性菌的新型抗菌药物提供了很好的思路。由于不同细菌会产生和利用特定的铁载体, 因此与原形抗生素相比, 偶联物的抗菌选择性有了进一步的提升, 这种选择性也可能降低细菌耐药性的发生。这种策略也可以用于扩大抗生素的抗菌谱, 如将抗革兰阳性菌药物转变成广谱抗菌药物。迄今为止, 大部分成功的铁载体-抗生素偶联物是基于靶向细胞周质的抗生素, 例如β-内酰胺类抗生素, 包括已经上市的Cefiderocol。研究表明, 一些偶联物也可以穿过细菌内膜进一步将药物递送至细胞质发挥作用, 例如氟喹诺酮类及噁唑烷酮类药物。目前铁载体-抗生素偶联物的研究方向主要是选择合适的铁离子载体及连接臂, 以使得偶联物发挥最佳的抗耐药革兰阴性菌作用。综上所述, 铁载体-抗生素偶联物有望成为临床抗革兰阴性菌感染的有力武器, 值得进一步关注及探索。
作者贡献: 赵欣彤、张文轩负责组织文章的框架, 文章的撰写及修改; 吴松负责了文章的思路指导和审阅; 李天磊对稿件进行了完善。
利益冲突: 所有作者声明不存在利益冲突。
| [1] |
Willyard C. The drug-resistant bacteria that pose the greatest health threats[J]. Nature, 2017, 543: 15. DOI:10.1038/nature.2017.21550 |
| [2] |
Lewis K. Platforms for antibiotic discovery[J]. Nat Rev Drug Discov, 2013, 12: 371-387. DOI:10.1038/nrd3975 |
| [3] |
Lin J, Nishino K, Roberts MC, et al. Mechanisms of antibiotic resistance[J]. Front Microbiol, 2015, 6: 34. |
| [4] |
Lu HJ, Zhang DF, Huang HH. Recent advances in study of drugs against Gram-negative pathogens[J]. Acta Pharm Sin (药学学报), 2019, 54: 1554-1563. |
| [5] |
Zgurskaya HI, Lopez CA, Gnanakaran S. Permeability barrier of Gram-negative cell envelopes and approaches to bypass it[J]. ACS Infect Dis, 2015, 1: 512-522. DOI:10.1021/acsinfecdis.5b00097 |
| [6] |
Ji C, Juárez-Hernández RE, Miller MJ. Exploiting bacterial iron acquisition: siderophore conjugates[J]. Future Med Chem, 2012, 4: 297-313. DOI:10.4155/fmc.11.191 |
| [7] |
Pagès JM, James CE, Winterhalter M. The porin and the permeating antibiotic: a selective diffusion barrier in Gram-negative bacteria[J]. Nat Rev Drug Discov, 2008, 6: 893-903. |
| [8] |
Hancock REW. The bacterial outer membrane as a drug barrier[J]. Trends Microbiol, 1997, 5: 37-42. DOI:10.1016/S0966-842X(97)81773-8 |
| [9] |
Jordi V, Sara M, Javier SC. Porins, efflux pumps and multidrug resistance in Acinetobacter baumannii[J]. J Antimicrob Chemother, 2007, 59: 1210-1215. DOI:10.1093/jac/dkl509 |
| [10] |
Taylor KG, Konhauser KO. Iron in earth surface systems: a major player in chemical and biological processes[J]. Elements, 2011, 7: 83-88. DOI:10.2113/gselements.7.2.83 |
| [11] |
Wilson BR, Bogdan AR, Miyazawa M, et al. Siderophores in iron metabolism: from mechanism to therapy potential[J]. Trends Mol Med, 2016, 22: 1077-1090. DOI:10.1016/j.molmed.2016.10.005 |
| [12] |
Soares MP, Weiss G. The iron age of host-microbe interactions[J]. Embo Reports, 2015, 16: 1482-1500. DOI:10.15252/embr.201540558 |
| [13] |
Braun V, Killmann H. Bacterial solutions to the iron-supply problem[J]. Trends Biochem Sci, 1999, 24: 104-109. DOI:10.1016/S0968-0004(99)01359-6 |
| [14] |
Hider RC, Kong X. Chemistry and biology of siderophores[J]. Nat Prod Rep, 2010, 27: 637-657. DOI:10.1039/b906679a |
| [15] |
Raymond KN, Allred BE, Sia AK. Coordination chemistry of microbial iron transport[J]. Acc Chem Res, 2015, 48: 2496-2505. DOI:10.1021/acs.accounts.5b00301 |
| [16] |
Raymond KN, Dertz EA, Kim SS. Enterobactin: an archetype for microbial iron transport[J]. Proc Natl Acad Sci U S A, 2003, 100: 3584-3588. DOI:10.1073/pnas.0630018100 |
| [17] |
Hannauer M, Barda Y, Mislin GL, et al. The ferrichrome uptake pathway in Pseudomonas aeruginosa involves an iron release mechanism with acylation of the siderophore and recycling of the modified desferrichrome[J]. J Bacteriol, 2010, 192: 1212-1220. DOI:10.1128/JB.01539-09 |
| [18] |
Schlegel K, Lex J, Taraz K, et al. The X-ray structure of the pyochelin Fe3+ complex[J]. J Biosci, 2006, 61: 263-266. |
| [19] |
Modun B, Evans RW, Joannou CL, et al. Receptor-mediated recognition and uptake of iron from human transferrin by Staphylococcus aureus and Staphylococcus epidermidis[J]. Infect Immun, 1998, 66: 3591-3596. DOI:10.1128/IAI.66.8.3591-3596.1998 |
| [20] |
Gao Q, Wang X, Xu H, et al. Roles of iron acquisition systems in virulence of extraintestinal pathogenic Escherichia coli: salmochelin and aerobactin contribute more to virulence than heme in a chicken infection model[J]. BMC Microbiol, 2012, 12: 143. DOI:10.1186/1471-2180-12-143 |
| [21] |
Schalk IJ, Guillon L. Fate of ferrisiderophores after import across bacterial outer membranes: different iron release strategies are observed in the cytoplasm or periplasm depending on the siderophore pathways[J]. Amino Acids, 2013, 44: 1267-1277. DOI:10.1007/s00726-013-1468-2 |
| [22] |
Roosenberg JM 2nd, Lin YM, Lu Y, et al. Studies and syntheses of siderophores, microbial iron chelators, and analogs as potential drug delivery agents[J]. Curr Med Chem, 2000, 7: 159-197. DOI:10.2174/0929867003375353 |
| [23] |
Negash KH, Norris JKS, Hodgkinson JT. Siderophore-antibiotic conjugate design: new drugs for bad bugs?[J]. Molecules, 2019, 24: 3314. DOI:10.3390/molecules24183314 |
| [24] |
Kong H, Cheng W, Wei H, et al. An overview of recent progress in siderophore-antibiotic conjugates[J]. Eur J Med Chem, 2019, 182: 111615. DOI:10.1016/j.ejmech.2019.111615 |
| [25] |
Braun V, Pramanik A, Gwinner T, et al. Sideromycins: tools and antibiotics[J]. Biometals, 2009, 22: 3-13. DOI:10.1007/s10534-008-9199-7 |
| [26] |
Gause FG. Recent studies on albomycin, a new antibiotic[J]. Br Med J, 1955, 2: 1177-1179. DOI:10.1136/bmj.2.4949.1177 |
| [27] |
Braun V, Braun M. Active transport of iron and siderophore antibiotics[J]. Curr Opin Microbiol, 2002, 5: 194-201. DOI:10.1016/S1369-5274(02)00298-9 |
| [28] |
Roosenberg JM, Miller MJ. Total synthesis of the siderophore danoxamine[J]. J Org Chem, 2000, 65: 4833-4838. DOI:10.1021/jo000050m |
| [29] |
Vértesy L, Aretz W, Fehlhaber HW, et al. Salmycin A-D, antibiotika aus Streptomyces violaceus, DSM 8286, mit siderophor‐aminoglycosid‐struktur[J]. Helv Chim Acta, 1995, 78: 46-60. DOI:10.1002/hlca.19950780105 |
| [30] |
Wencewicz TA, Mollmann U, Long TE, et al. Is drug release necessary for antimicrobial activity of siderophore-drug conjugates? Syntheses and biological studies of the naturally occurring salmycin "Trojan horse" antibiotics and synthetic desferridanoxamine-antibiotic conjugates[J]. Biometals, 2009, 22: 633-648. DOI:10.1007/s10534-009-9218-3 |
| [31] |
Brochu A, Brochu N, Nicas TI, et al. Modes of action and inhibitory activities of new siderophore-beta-lactam conjugates that use specific iron uptake pathways for entry into bacteria[J]. Antimicrob Agents Chemother, 1992, 36: 2166-2175. DOI:10.1128/AAC.36.10.2166 |
| [32] |
Lin YM, Ghosh M, Miller PA, et al. Synthetic sideromycins (skepticism and optimism): selective generation of either broad or narrow spectrum Gram-negative antibiotics[J]. Biometals, 2019, 32: 425-451. DOI:10.1007/s10534-019-00192-6 |
| [33] |
Dolence EK, Lin CE, Miller MJ, et al. Synthesis and siderophore activity of albomycin-like peptides derived from N5-acetyl-N5-hydroxy-L-ornithine[J]. J Med Chem, 1991, 34: 956-968. DOI:10.1021/jm00107a013 |
| [34] |
Ji C, Miller PA, Miller MJ. Iron transport-mediated drug delivery: practical syntheses and in vitro antibacterial studies of tris-catecholate siderophore-aminopenicillin conjugates reveals selectively potent antipseudomonal activity[J]. J Am Chem Soc, 2012, 134: 9898-9901. DOI:10.1021/ja303446w |
| [35] |
Zheng T, Nolan EM. Enterobactin-mediated delivery of beta-lactam antibiotics enhances antibacterial activity against pathogenic Escherichia coli[J]. J Am Chem Soc, 2014, 136: 9677-9691. DOI:10.1021/ja503911p |
| [36] |
Chairatana P, Zheng T, Nolan EM. Targeting virulence: salmochelin modification tunes the antibacterial activity spectrum of beta-lactams for pathogen-selective killing of Escherichia coli[J]. Chem Sci, 2015, 6: 4458-4471. DOI:10.1039/C5SC00962F |
| [37] |
Annamalai R, Jin B, Cao Z, et al. Recognition of ferric catecholates by FepA[J]. J Bacteriol, 2004, 186: 3578-3589. DOI:10.1128/JB.186.11.3578-3589.2004 |
| [38] |
Ohi N, Aoki B, Shinozaki T, et al. Semisynthetic beta-lactam antibiotics. I. Synthesis and antibacterial activity of new ureidopenicillin derivatives having catechol moieties[J]. J Antibiot, 1986, 39: 230-241. DOI:10.7164/antibiotics.39.230 |
| [39] |
Ito A, Nishikawa T, Matsumoto S, et al. Siderophore cephalosporin cefiderocol utilizes ferric iron transporter systems for antibacterial activity against Pseudomonas aeruginosa[J]. Antimicrob Agents Chemother, 2016, 60: 7396-7401. DOI:10.1128/AAC.01405-16 |
| [40] |
Page MGP. The role of iron and siderophores in infection, and the development of siderophore antibiotics[J]. Clin Infect Dis, 2019, 69: S529-S537. DOI:10.1093/cid/ciz825 |
| [41] |
Ito A, Sato T, Ota M, et al. In vitro antibacterial properties of cefiderocol, a novel siderophore cephalosporin, against Gram-negative bacteria[J]. Antimicrob Agents Chemother, 2018, 62: e01454-17. |
| [42] |
Zhanel GG, Golden AR, Zelenitsky S, et al. Cefiderocol: a siderophore cephalosporin with activity against carbapenem-resistant and multidrug-resistant Gram-negative bacilli[J]. Drugs, 2019, 79: 271-289. DOI:10.1007/s40265-019-1055-2 |
| [43] |
Sykes RB, Koster WH, Bonner DP. The new monobactams: chemistry and biology[J]. J Clin Pharmacol, 1988, 28: 113-119. DOI:10.1002/j.1552-4604.1988.tb05734.x |
| [44] |
Michael R, Terrence C. Synthesis and structure-activity relationships of monocarbams leading to U-78608[J]. J Antibiot, 1990, 43: 1199-1203. DOI:10.7164/antibiotics.43.1199 |
| [45] |
Flanagan ME, Brickner SJ, Lall M, et al. Preparation, Gram-negative antibacterial activity, and hydrolytic stability of novel siderophore-conjugated monocarbam diols[J]. ACS Med Chem Lett, 2011, 2: 385-390. DOI:10.1021/ml200012f |
| [46] |
McPherson CJ, Aschenbrenner LM, Lacey BM, et al. Clinically relevant Gram-negative resistance mechanisms have no effect on the efficacy of MC-1, a novel siderophore-conjugated monocarbam[J]. Antimicrob Agents Chemother, 2012, 56: 6334-6342. DOI:10.1128/AAC.01345-12 |
| [47] |
Tomaras AP, Crandon JL, McPherson CJ, et al. Potentiation of antibacterial activity of the MB-1 siderophore-monobactam conjugate using an efflux pump inhibitor[J]. Antimicrob Agents Chemother, 2015, 59: 2439-2442. DOI:10.1128/AAC.04172-14 |
| [48] |
Page MG, Dantier C, Desarbre E. In vitro properties of BAL30072, a novel siderophore sulfactam with activity against multiresistant gram-negative bacilli[J]. Antimicrob Agents Chemother, 2010, 54: 2291-2302. DOI:10.1128/AAC.01525-09 |
| [49] |
Schalk IJ, Mislin GLA. Bacterial iron uptake pathways: gates for the import of bactericide compounds[J]. J Med Chem, 2017, 60: 4573-4576. DOI:10.1021/acs.jmedchem.7b00554 |
| [50] |
Rivault F, Liébert C, Burger A, et al. Synthesis of pyochelin-norfloxacin conjugates[J]. Bioorg Med Chem Lett, 2007, 17: 640-644. DOI:10.1016/j.bmcl.2006.11.005 |
| [51] |
Neumann W, Nolan EM. Evaluation of a reducible disulfide linker for siderophore-mediated delivery of antibiotics[J]. J Biol Inorg Chem, 2018, 23: 1025-1036. DOI:10.1007/s00775-018-1588-y |
| [52] |
Neumann W, Sassone-Corsi M, Raffatellu M, et al. Esterase-catalyzed siderophore hydrolysis activates an enterobactin-ciprofloxacin conjugate and confers targeted antibacterial activity[J]. J Am Chem Soc, 2018, 140: 5193-5201. DOI:10.1021/jacs.8b01042 |
| [53] |
Zheng T, Nolan EM. Evaluation of (acyloxy)alkyl ester linkers for antibiotic release from siderophore-antibiotic conjugates[J]. Bioorg Med Chem Lett, 2015, 25: 4987-4991. DOI:10.1016/j.bmcl.2015.02.034 |
| [54] |
Ji C, Miller MJ. Chemical syntheses and in vitro antibacterial activity of two desferrioxamine B-ciprofloxacin conjugates with potential esterase and phosphatase triggered drug release linkers[J]. Biorg Med Chem, 2012, 20: 3828-3836. DOI:10.1016/j.bmc.2012.04.034 |
| [55] |
Paulen A, Gasser V, Hoegy F, et al. Synthesis and antibiotic activity of oxazolidinone-catechol conjugates against Pseudomonas aeruginosa[J]. Org Biomol Chem, 2015, 13: 11567-11579. DOI:10.1039/C5OB01859E |
| [56] |
Noël S, Gasser V, Pesset B, et al. Synthesis and biological properties of conjugates between fluoroquinolones and a N3''-functionalized pyochelin[J]. Org Biomol Chem, 2011, 9: 8288. DOI:10.1039/c1ob06250f |
| [57] |
Ji C, Miller MJ. Siderophore-fluoroquinolone conjugates containing potential reduction-triggered linkers for drug release: synthesis and antibacterial activity[J]. Biometals, 2015, 28: 541-551. DOI:10.1007/s10534-015-9830-3 |
| [58] |
Fardeau S, Dassonville-Klimpt A, Audic N, et al. Synthesis and antibacterial activity of catecholate-ciprofloxacin conjugates[J]. Bioorg Med Chem, 2014, 22: 4049-4060. DOI:10.1016/j.bmc.2014.05.067 |
| [59] |
Barbachyn, Michael R. Antibacterials[M]. Cham: Springer International Publishing, 2018: 97-121.
|
| [60] |
Paulen A, Fo Hoegy, Roche B, et al. Synthesis of conjugates between oxazolidinone antibiotics and a pyochelin analogue[J]. Bioorg Med Chem Lett, 2017, 27: 4867-4870. DOI:10.1016/j.bmcl.2017.09.039 |
| [61] |
Liu R, Miller PA, Vakulenko SB, et al. A synthetic dual drug sideromycin induces Gram-negative bacteria to commit suicide with a Gram-positive antibiotic[J]. J Med Chem, 2018, 61: 3845-3854. DOI:10.1021/acs.jmedchem.8b00218 |
| [62] |
Miller MJ, Walz AJ, Zhu H, et al. Design, synthesis, and study of a mycobactin-artemisinin conjugate that has selective and potent activity against tuberculosis and malaria[J]. J Am Chem Soc, 2011, 133: 2076-2079. DOI:10.1021/ja109665t |
| [63] |
Ghosh M, Miller PA, Mollmann U, et al. Targeted antibiotic delivery: selective siderophore conjugation with daptomycin confers potent activity against multidrug resistant acinetobacter baumannii both in vitro and in vivo[J]. J Med Chem, 2017, 60: 4577-4583. DOI:10.1021/acs.jmedchem.7b00102 |
| [64] |
Ghosh M, Miller PA, Miller MJ. Antibiotic repurposing: bis-catechol- and mixed ligand (bis-catechol-mono-hydroxamate)-teicoplanin conjugates are active against multidrug resistant Acinetobacter baumannii[J]. J Antibiot (Tokyo), 2020, 73: 152-157. DOI:10.1038/s41429-019-0268-7 |
| [65] |
Nagy TA, Moreland SM, Andrews-Polymenis H, et al. The ferric enterobactin transporter Fep is required for persistent Salmonella enterica serovar Typhimurium infection[J]. Infect Immun, 2013, 81: 4063-4070. DOI:10.1128/IAI.00412-13 |
| [66] |
Caza M, Lepine F, Dozois CM. Secretion, but not overall synthesis, of catecholate siderophores contributes to virulence of extraintestinal pathogenic Escherichia coli[J]. Mol Microbiol, 2011, 80: 266-282. DOI:10.1111/j.1365-2958.2011.07570.x |
| [67] |
Crouch ML, Castor M, Karlinsey JE, et al. Biosynthesis and IroC-dependent export of the siderophore salmochelin are essential for virulence of Salmonella enterica serovar Typhimurium[J]. Mol Microbiol, 2008, 67: 971-983. DOI:10.1111/j.1365-2958.2007.06089.x |
 2021, Vol. 56
2021, Vol. 56


