2. 西南交通大学生命科学与工程学院, 四川 成都 610031
2. College of Life Science and Engineering, Southwest Jiaotong University, Chengdu 610031, China
肝纤维化是肝脏在慢性酒精中毒、肝炎病毒、胆汁淤积、毒物或药物等多种致病因素影响下, 导致慢性炎症活动, 进而产生肝脏损伤后的一种瘢痕化修复反应, 其基本特征为肝细胞外基质(extracellular matrix, ECM) 的过度沉积, 且降解相对不足[1, 2]。肝纤维化是一种可逆性的病理反应, 及时有效地逆转肝纤维化可防止慢性肝病进展为肝硬化或肝癌[3]。然而, 目前临床防治肝纤维化所用的药物大多以控制各种原发致病因素为主, 尚无特异性治疗药物出现[4]。
藏医药学是祖国传统医学宝库的重要组成部分, 具有悠久的历史与独立完整的理论体系[5]。独特的地理条件和饮食习惯致使青藏高原地区肝脏疾病高发, 历代藏医家基于临床经验构建了对不同种类肝病病因病机的宏观及微观认识, 总结了相应特色诊断方法与一系列行之有效的临床用药经验, 使得传统藏医药对肝病治疗独具优势。现代临床与药学实验研究已证实, 多种藏药成方制剂及单味药材可以其多成分、多层次、多靶标的作用特点, 改善、抑制肝纤维化甚至肝硬化的病理进程。为深入挖掘传统藏医药防治肝纤维化疾病的现代药学价值, 笔者以“藏医”、“藏药”、“肝纤维化”等为关键词, 组合检索近30年来中国知网、维普、万方、PubMed、ScienceDirect等数据库中相关报道, 按照病因病机认识、临床应用与药理作用3个方面对藏药防治肝纤维化的研究现状进行归纳总结, 以期为源于藏医药的抗肝纤维化新药开发提供一定的参考和相关研究思路。
1 藏医对肝纤维化的认识在藏医经典著作《四部医典》中记载:“肝居于腹右侧肋下, 与隔膜相贴, 形如上厚下薄马蹄状, 像国王(心脏) 的妃子, 伺候着国王, 不能遭受任何创伤。”由此可见, 藏医对于肝脏的形状、功能、位置及其疾病的认识和治疗历史悠久[5]。在藏医三因学说中, “隆”、“培根”及“赤巴”三种因素是构成人体生命物质的基础, 也是人体进行生命活动的基础。“隆”意译为“气”, 其功能为主管呼吸、血液运行及肢体运动等, “培根”意译为“水”和“土”, 功能是磨碎食物, 促进胃液分泌及保持人体体液等, “赤巴”意译为“火”, 其功能为产生热能并维持体温等, 肝脏即为“赤巴”所藏之处[6]。根据藏医三因学说中“隆”、“培根”、“赤巴”偏盛的性质及相应的临床表现, 将肝脏疾病细分为13种热性肝病和5种寒性肝病, 这18种肝病均可导致肝纤维化, 其中诱因又以“琼乃丁布”(乙型肝炎) 和“琼乃呷哇”(丙型肝炎) 最为常见[7, 8]。
目前, 藏医认为肝纤维化疾病在属于传统藏医理论中“木布病”范畴, 其“木布病”即指以肝、血热为主的综合性消化系统疾病[6]。肝纤维化与藏医所说的肝“毒塔”症类似, 意译为类中毒肝病, 且肝“毒塔”症所具备的目赤面青、胁肋刺痛、胃肝胀满、纳谷不化等症状类似于现代医学的肝纤维化及肝硬化, 故藏医在临床上将二者合并为一类疾病[9]。有学者从藏医三因的病理角度分析, 认为肝纤维化疾病属于藏医中的复合型疾病“肝木布”, 按照病程发展分为“培赤型”、“隆赤型”和“培隆型”三种, 并加以辨证施治[10]。德庆白珍等[11, 12]认为该病的主要诱因为过量食用热性和酸性食物, 疲劳过度或外邪入侵等, 起初由于肝脏藏血制胆, 致使肝脏瘀血而膨胀, 久之则血脉不通, 进而阻塞和萎缩, 产生“赤巴匝久” (黄疸) 及“木布怼熱” (门脉高压、消化道出血) 等并发症, 部分可导致“庆贞” (肝癌) 的发生。另有学者[5]按“培根木布病”中的肝血旺盛期(藏文: 庆查木布杰巴) 对肝纤维化疾病的病因、病机及辩治进行论述。其同样认为此类疾病主要因长期辛辣酸味或热性饮食, 过度劳累或强力劳作等因素导致机体内“赤巴”、“培根”、“血”、“黄水”等失调凝结于胃及肝脏。“赤巴”与血热亢进, 引发“赤巴”热毒素侵入并长期损害肝脏, 进而转化为陈旧性的“热”潜伏于肝脏, 迁延不愈, 致使肝脏处“三因”紊乱, 血液生发及全身代谢失调, 致使肝脏灼热而瘀血不化, 久而失养则引发实质性病变。藏医对于“庆查木布杰巴”是以病因来命名的, 为肝脏疾病发展的一个阶段, 如不及时干预则演变为类中毒肝病和肝血下注症, 进而出现肝区疼痛、腹胀不适、不喜油腻饮食、大便异常、恶心呕吐、牙龈及鼻出血等症状[5]。藏医学理论对于“庆查木布杰巴”这一病机转化的认识及临床表现, 与现代医学对肝纤维化发展进程的认知多有相似之处。
2 藏药治疗肝纤维化的现代临床应用基于肝纤维化病因和属性的藏医理论认识, 将多种藏药材进行调配组合形成的复方制剂是其临床治疗该疾病的主要物质手段, 且剂型多见传统丸、散剂。除单方用药外, 采用多个复方进行时辰协同组合及辩证组合成为藏医治疗肝纤维化的特色用药形式。
2.1 单方用药多数藏医学者采用清肝脏灼热、补肝脏血气等治法对肝纤维化加以治疗, 取得显著临床疗效, 代表性经典复方药味组成及功效如表 1[8, 13-15]所示。有研究显示, 采用石榴日轮次散(石榴日轮散、冬虫夏草、藏红花) 对134例乙型肝炎和丙型肝炎肝纤维化患者进行口服治疗, 并以肝纤四项作为临床疗效观察指标, 结果显示114例患者的肝纤四项指标显著下降, 13例无明显下降或升高, 总体显效率为85%[8]。彭毛才旦等[13]采用十三味红花丸治疗酒精性肝炎及病毒性肝炎等引起的肝纤维化患者40例, 以患者肝脏组织活检肝纤维化SSS评分相比较治疗前下降≥2为临床有效标准, 经治疗后34例患者有效, 无效6人, 总有效率85%。经长期临床观察, 十三味红花丸可显著改善患者症状、体征及肝功能, 半年后随访疗效基本稳定。有学者采用十八味红花丸治疗乙型肝炎肝纤维化患者30例, 同时设置中药注射剂对照组30例, 进行为期6个月的治疗后, 患者乏力、纳差、肋痛、目黄及脾肿大等体征均得到显著改善, 且与治疗前及对照组相比较, 十八味红花丸可显著改善患者血清谷丙转氨酶(alanine aminotransferase, ALT) 与透明质酸(hyaluronic acid, HA) 含量[16]。青海省藏医医院自制的十八味大象红花散在36例肝硬化患者中进行的临床研究表明, 经该药治疗后可显著改善患者恶心、腹胀、乏力等临床症状和体征, 并可明显逆转HA升高, 表明其可有效减轻肝硬化患者的肝纤维化程度[14]。张健维等[15]选取慢性乙型肝炎患者84例, 随机分为对照组和治疗组各42例, 对照组给予口服恩替卡韦片, 治疗组在此基础上给予二十五味松石丸。连续治疗3个月后, 两组患者血清中转化生长因子β1 (transforming growth factor-β1, TGF-β1)、HA及Ⅳ型胶原(type Ⅳ collagen, Ⅳ-C) 显著降低, 且治疗组显著优于对照组。同时, 治疗组药物的不良反应发生比率为4.76%, 显著低于恩替卡韦对照组。该研究结果表明, 藏药二十五松石丸联合恩替卡韦可显著改善乙肝患者的肝纤维化程度, 且减轻恩替卡韦的临床不良反应。
| Table 1 The composition and efficacy of the representative complex prescription of Tibetan medicine for clinical treatment of liver fibrosis |
多个复方制剂的不同时辰联合给药是藏医治疗肝硬化等肝纤维化疾病的特色方式。以抗纤维化等为主要治疗原则, 给予50例早期肝硬化患者早晨口服二十五味松石丸1粒、中午口服月晶甘露丸2粒, 下午口服五味岩精散胶囊2粒, 并按病情给予医痞月亮加佐太、牛黄、藏红花晚口服1 g, 通过B超及血清生化检查表明该时辰联合给药方案可显著改善门脉性和胆汁性的肝硬化早期[17]。当增才让等[18]统计其收治的肝硬化早期患者57例, 患者清晨空腹服用二十五味马宝丸1粒, 早饭后冲服二十一味寒水石散2 g, 中午冲服十八味大象红花散、牛黄及藏红花2 g, 下午口服九味牛黄丸5粒, 晚上服用大月晶丸5粒, 通过不同时辰口服藏药联合藏医放血等疗法显著改善患者肝纤维化程度, 结果表明显效23例, 有效30例, 无效4例, 经3个月随访观察鲜有复发。
2.3 辩证组合用药藏医根据肝纤维化患者的共性与个性, 将多种复方制剂相组合的辩证用药在临床治疗中也多有体现。德庆白珍等[11]参照西医肝纤维化及藏医诊断标准, 收治“庆查木布杰巴” (肝硬化) 患者70例。以七味铁屑丸卡擦、庆乃贡久、九味牛黄丸卡擦和五味大棚丸联合用药为基本治疗方, 在此基础之上结合临床辩证, 对伴有黄疸(寒性) 患者加用十味黑冰片散卡擦, 对伴有腹水患者加服德吉曲久丸、三味蒺藜汤。经45天治疗后, 患者肝区痛、腹胀、腹水、皮黄等临床指证显著改善, B超检查显示患者肝大、脾大及门静脉增宽等症状明显减轻, 综合有效率可达91.43%。此外, 结合尿常规、血常规和肾功能检查发现患者未产生明显药物不良反应。
目前, 对于抗肝纤维化藏药的临床研究可在一定程度证实相关复方制剂的临床药效性, 但同时部分研究存在临床观察指标单一、患者样本量较少、随机双盲对照实验研究较少。此外, 藏医药从整体辩证的角度对肝纤维化的认识, 与西医具有本质区别。如何构建符合藏医理论并与现代西医诊断技术相结合的临床诊断及疗效评价标准仍需进一步系统研究。同时, 二十五味松石丸及十八味红花丸等包含药味较多, 且其中多包含矿物药, 其安全性有待进一步深入研究。多数的临床研究以进行短期的临床疗效评价为主, 缺乏切实的临床安全性评价数据及不良反应报告。
3 藏药抗肝纤维化的药理作用肝纤维化是在肝脏遭受各种致病因子刺激下, 肝实质细胞产生损伤与凋亡, 肝血窦中的炎性细胞向损伤区域募集, 释放大量趋化因子, 诱导肝星状细胞(hepatic stellate cells, HSC) 活化增生为成纤维细胞, 成纤维细胞进一步分泌胶原, 致使肝细胞外基质过度沉积而降解相对不足, 从而加剧肝脏炎症反应[19]。多种藏药复方、单味药及其活性成分对肝纤维化具有显著抑制作用, 兹对近年来藏药抗肝纤维化的药理作用及机制研究现状总结(表 2[20-45])。
| Table 2 Anti-hepatic fibrosis effects of Tibetan medicine formulas and herbs. ALT: Alanine aminotransferase; α-SMA: α-Smooth muscle actin; Bcl-2: B-cell lymphoma-2; CAT: Catalase; CCl4: Carbon tetrachloride; Col-Ⅰ: Collagen type Ⅰ; HA: Hyaluronic acid; HYP: Hydroxyproline; IL-6: Interleukin-6; IFN-γ: Interferon γ; Ⅳ-C: Type Ⅳ collagen; LN: Laminin; MAO: Monoamine oxidase; MDA: Malondialdehyde; Mrp3: Multidrug resistance protein 3; Mrp4: Multidrug resistance protein 4; NF-κB: Nuclear factor kappa-B; PC-Ⅲ: Procollagen type Ⅲ; SOD: Superoxide dismutase; TNF-α: Tumor necrosis factor; TGF-β1: Transforming growth factor-β1; TIMP-1: Tissue inhibitor of metalloproteinase 1 |
慢性肝损伤过程中的脂质过氧化反应是诱发肝纤维化的重要因素之一, 过氧化产生的甲醛、丙二醛(malondialdehyde, MDA) 等可刺激Kupffer细胞产生纤维化细胞因子, 诱导HSC的胶原合成, 从而促进肝纤维化形成[46, 47]。藏药郎庆阿塔[21]、仁青芒觉[24]和苦空确屯卡察尔[25]均可降低肝纤维化模型大鼠肝组织中MDA, 缓解脂质过氧化损伤, 并恢复肝功能。肝脏抗氧化酶超氧化物歧化酶(superoxide dismutase, SOD) 和过氧化氢酶(catalase, CAT) 活性的高低可间接反映机体清除自由基能力, 从而抑制自由基启动的脂质过氧化。波棱瓜子总木脂素部位可升高肝纤维化大鼠肝组织SOD水平, 改善肝组织纤维化病理改变, 表明其作用机制可能与调节脂质过氧化相关[27]。五脉绿绒蒿醇提取物和总黄酮组分可以通过升高SOD和CAT活性, 减少MDA产生, 进而减轻肝损伤, 抑制胶原生成[29]。杨晗等[41]研究发现, 独一味颗粒可降低肝纤维化大鼠血清中HA、Ⅲ型前胶原(procollagen type Ⅲ, PC-Ⅲ) 及单胺氧化酶(monoamine oxidase, MAO) 含量, 进而抑制大鼠肝脏纤维组织增生。
3.2 抑制HSC活化在肝纤维化的形成过程中, TGF-β1是目前已知的致肝纤维化的重要细胞因子之一[33]。在正常的肝细胞中, TGF-β1几乎不表达, 当肝组织损伤后, 巨噬细胞、血小板、Kupffer细胞及肝窦内皮细胞等释放的TGF-β1与细胞膜上的受体(TβR) 结合, 进而激活Smad、核因子κB (nuclear factor kappa-B, NF-κB) 或磷脂酰肌醇3激酶(phosphatidylinositol 3-kinases, PI3K)/AKT等通路, 促进HSC活化为成纤维细胞, 进而促进ECM合成, 产生肝纤维化[31, 48]。TGF-β1对诱导基质的累积机制既活化了基质产生的基因转录, 又下调了降解基质的基因表达。因此, 阻断TGF-β1的分泌可抑制肝纤维化的发生和发展。藏红花水煎液对四氯化碳(carbon tetrachloride, CCl4) 腹腔注射诱导的肝纤维化大鼠具有保护作用, 可改善其血清中肝纤四项及纤维化病理改变, 并通过抑制肝组织中TGF-β1的表达, 减少肝星状细胞的激活和肝内细胞基质的沉积发挥抗纤维化作用[33, 34]。五脉绿绒蒿总黄酮部位可显著改善复合因素诱导的肝纤维化大鼠羟脯氨酸(hydroxyproline, HYP)、胶原含量及HA、层黏连蛋白(laminin, LN) 和PC-Ⅲ等指标, 呈现一定的量效关系, 并发现其抗肝纤维化作用机制与降低血清中炎症细胞因子分泌及肝脏中TGF-β1的表达有关[30, 31]。此外, 研究表明藏药苦空确屯卡察尔[25]、郎庆阿塔[22]、波棱瓜子[27]、砂生槐子[43]等也可抑制TGF-β1生成, 起到良好的抗肝纤维化作用。
TGF-β1是促使HSC活化、增殖、分化的关键细胞因子, Smad蛋白家族是TGF-β1下游的关键信号转导分子, TGF-β1/Smad信号通路在肝纤维化发展过程中发挥重要作用[49]。在信号转导过程中, TGF-β1首先与TβRII结合成复合物, 进一步与TβRI结合, 使胞质内下游Smad2/3磷酸化, Smad2/3同Smad4形成异源寡聚体后使信号入核, 进而调节胶原的转录合成。此外, Smad7是TGF-β1信号转导的抑制分子, 可干扰Smad2/3等受体调控性Smad活化[35, 50]。藏红花酸(crocetin) 是一种多不饱和共轭烯酸结构的类胡萝卜素类成分[51], 其对TGF-β1刺激的肝星状细胞LX-2的影响结果表明, 藏红花酸可上调LX-2细胞中Smad7 mRNA, 并下调Smad2和Smad3 mRNA表达, 提示藏红花酸可通过抑制TGF-β1/Smads信号转导通路进而抑制肝星状细胞活化[35]。
藏药砂生槐子可降低纤维化大鼠血清HA、TGF-β1和HYP含量, 且抑制血清miRNA-181b表达, 提高miRNA-16、miRNA-200a和miRNA-126b表达[43]。miRNA是一类内生的, 长度在20~24个核苷酸的小RNA, 有报道显示多种miRNA参与调节肝纤维化进程。现有研究证实, miRNA-181b可能与PTEN/AKT通路激活HSC有关, miRNA-200a可靶向于转化生长因子-2和连环蛋白抑制HSC活化, miRNA-16及miRNA-126b也可抑制HSC活化和迁移[52, 53]。因此, 砂生槐子抗肝纤维化作用可能与通过调节miRNA抑制HSC活化相关。
3.3 抑制炎症反应多种炎性介质可损伤肝窦及血管内皮稳态, 造成肝脏微血栓形成, 促使肝细胞变性坏死, 受损肝细胞进一步分泌多种炎性细胞因子, 诱发HSC激活, 加速纤维化过程。其中, 肿瘤坏死因子α (tumor necrosis factor α, TNF-α) 可激活免疫细胞, 促进HSC增殖。TNF-α亦可通过TNF受体和不同细胞蛋白受体相结合, 激活过氧化物酶体增生物激活受体γ (peroxisome proliferators-activated receptor γ, PPAR-γ), 进而抑制PPAR-γ转录活性, 导致肝纤维化[54]; 白细胞介素-6 (interleukin-6, IL-6) 可促使纤维母细胞增生, 促进Ⅰ、Ⅲ型胶原表达。五脉绿绒蒿总黄酮可降低肝纤维化大鼠血清中TNF-α和IL-6的含量, 升高干扰素γ (interferon γ, IFN-γ) 水平, 表明其可能通过抑制炎症反应起到抗肝纤维化作用[32]。李萍等[45]采用猪血清诱导的免疫性肝纤维化大鼠模型评价余甘子提取物的药效作用, 结果发现余甘子醇提物可显著降低其血清中TNF-α含量, 表明减少炎症细胞因子释放可能是其抗肝纤维化的作用途径之一。
3.4 促进HSC凋亡研究表明, 活化状态下HSC的减少主要归因于HSC凋亡, 而非表型转化[55]。因此, 促进HSC凋亡可在不诱发细胞溶酶体破坏与微环境炎症发生的情况下, 降低活化的HSC数量, 从而可有效抑制肝纤维化发展。陈雪晴[39]观察印度獐牙菜醇提物乙酸乙酯部位中18个化合物对TGF-β1刺激下的肝星状细胞的增殖影响, 发现熊果酸和齐墩果酸具有体外抗HSC增殖活性。波棱瓜子木脂素部位可能通过降低B淋巴细胞瘤-2蛋白(B-cell lymphoma-2, Bcl-2) 及NF-κB等蛋白表达促进肝星状细胞的凋亡, 进而发挥抗肝纤维化作用[28]。
藏红花具有活血化瘀与散瘀开结等功效[56]。有研究表明, 经藏红花水煎液干预的肝纤维化大鼠肝实质中caspase-3表达减少, 而在纤维间隔内侧表达增加, 并抑制纤维间隔内及汇管区的Bcl-2表达, 由于纤维间隔中主要为激活的HSC, 因此藏红花可能通过激活caspase-3, 抑制Bcl-2诱导HSC凋亡发挥肝纤维化作用[36]。另有研究发现, 藏红花酸对CCl4诱导的小鼠肝纤维化具有保护作用, 其可减低肝脏结缔组织增生与假小叶的形成, 同时肝脏中p38MAPK蛋白的表达下降, 表明其可能通过降低p38MAPK信号通路激活减少HSC增殖, 进而起到抗肝纤维化的作用[37]。
3.5 调节胶原代谢胶原蛋白是ECM的主要成分之一, 抑制胶原蛋白的表达是阻断ECM过度沉积的主要途径[57]。基质金属蛋白酶抑制剂-1 (tissue inhibitor of metalloproteinase-1, TIMP-1) 可抑制胶原酶的降解活性, 特别是抑制间质性胶原为主的ECM分解, 导致胶原沉积。同时, TIMP-1又可抑制HSC凋亡, 进而持续产生ECM。郎庆阿塔可抑制肝纤维化大鼠肝组织TIMP-1及Ⅰ型胶原蛋白(collagen type Ⅰ, Col-Ⅰ) 的表达, 提示其抗肝纤维化作用机制与促进胶原降解与抑制胶原过度沉积有关[23]。HYP占胶原蛋白比例最高, 通过检测肝组织中HYP含量可反映肝脏中胶原蛋白的代谢状况, 间接评价肝纤维化程度[58, 59]。藏药仁青芒觉[24]、七十味松石丸[26]、二十五味松石丸[20]和川西獐牙菜[44]等均可显著降低肝纤维化大鼠肝组织中的HYP含量, 促进肝纤维组织中的胶原降解是其抗肝纤维化的可能作用机制。
3.6 其他机制瘦素是一种主要来源于脂肪细胞的激素, 其与瘦素受体结合后可诱发HSC氧化应激, 激活胶原基因表达从而产生肝纤维化。藏药复方制剂郎庆阿塔可显著抑制复合因素(CCl4、乙醇及高脂高胆固醇饮食) 诱导的肝纤维化大鼠肝组织中的瘦素受体mRNA表达, 表明其可能通过瘦素受体途径发挥抗肝纤维化作用[22]。
川西獐牙菜是藏医治疗肝脏疾病的常用药材之一。Zhang等[60]借助气相、液相多维质谱分析, 探究川西獐牙菜对CCl4诱导的肝纤维化大鼠血清代谢轮廓的影响。结果表明, 川西獐牙菜提取物对代谢物的调控主要涉及花生四烯酸、甘氨酸、丝氨酸、苏氨酸、酪氨酸、精氨酸和脯氨酸代谢, 初级胆汁酸合成, 甘油磷脂及三羧酸循环。进一步结合分子生物学验证发现, 其可通过升高肝脏细胞色素P450 7A1 (cytochrome P450 7A1, CYP7A1)、细胞色素P450 27A1 (cytochrome P450 27A1, CYP27A1) 及细胞色素P450 8B1 (cytochrome P450 8B1, CYP8B1) 并降低溶血卵磷脂胆碱酰基转移酶1 (lysophosphatidylcholine acyltransferase 1, LPCAT1) 调控代谢紊乱, 该研究表明靶向调控初级胆汁酸合成及甘油磷脂代谢是川西獐牙菜抗肝纤维化的潜在作用机制。
獐牙菜苦苷是一种裂环烯醚萜苷类成分, 存在于藏药印度獐牙菜及川西獐牙菜等獐牙菜属植物中[61-63]。獐牙菜苦苷可降低胆汁淤积导致的肝纤维化大鼠血清中HA、LN、PC-Ⅲ、Ⅳ-C及HYP含量, 改善肝脏组织纤维化病理状态, 其可通过升高肝脏膜转运蛋白多药耐药相关蛋白3 (multidrug resistance protein 3, Mrp3) 和多药耐药相关蛋白4 (multidrug resistance protein 4, Mrp4) 表达进而促进胆汁分泌, 从而改善胆汁淤积导致的肝脏纤维化[40]。
4 总结与展望藏医药治疗肝脏疾病历史悠久且优势突出, 积累了大量宝贵的临床用药经验。近年来, 国内外研究者对藏药防治肝纤维化的临床疗效及药理机制进行了大量的研究。二十五味松石丸、十三味红花丸及十八味红花丸等藏医经典方剂的临床有效性被证实。藏医根据对肝纤维化患者个性与共性认识, 采用多个复方进行时辰协同组合及辩证联合用药的特色用药方式, 对肝纤维化患者临床症状及相关指标改善作用明显。此外, 药理作用研究明确了一些具有抗肝纤维化作用的复方制剂、药材、活性组分及单体化合物, 并初步探讨可能的药理作用机制, 主要涉及抗脂质过氧化、抑制肝星状细胞激活与增殖、调节胶原合成与降解及瘦素受体途径等(图 1)。
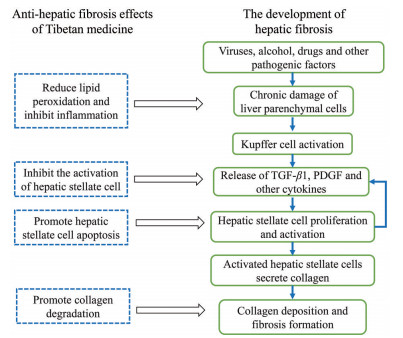
|
Figure 1 Mechanisms of hepatic fibrosis and possible actions of Tibetan medicine |
临床有效是对传统民族药进行现代药学研究及新药开发的先决条件。藏药用于肝纤维化的临床治疗及相关新药的开发均显示出广阔的前景。然而, 抗肝纤维化藏药的现代研究仍存有一些不足之处, 如①临床应用与基础研究存在一定脱节; ②组方合理性与配伍规律不明确; ③物质基础与药理作用机制研究不深入等, 制约了其临床的应用与市场认可。作者认为, 藏药防治肝纤维化的相关研究可从以下几个方面开展: ①基于临床价值开展防治肝纤维化藏药复方的基础研究。应针对二十五味松石丸和十三味红花丸等临床确有疗效的成方制剂采用多种不同病因诱发的肝纤维化生物学模型进行系统的药效学评价, 明确其有效性及对肝纤维化逆转的作用特点, 进而准确定位临床适应症并指导临床合理用药; ②针对临床防治肝纤维化常用的红花丸系列品种, 以藏医“六味”、“八性”、“三化味”、“十七效”配伍理论为依据, 结合肝纤维化的病性特点, 进行组方规律研究, 阐释其主要功效组合及配伍特点, 进而实现组方优化或简化, 从而实现现代藏药开发与转化; ③基于抗肝纤维化藏药的物质与生物效应的整体性, 引入网络药理学、代谢组学、蛋白质组学和脂质组学等系统生物学研究手段并加以整合分析, 探讨有效组分及成分的抗肝纤维化作用靶标, 进而为成分明确与作用机制新颖的藏药抗肝纤维化的创新药物研发提供科学依据。
作者贡献: 龚普阳负责组织文章框架、撰写及修改文章; 尹可欢和李雪冬负责整理文献资料; 顾健和谭睿负责指导文章撰写思路。
利益冲突: 所有作者已声明不存在利益冲突。
| [1] |
Shan L, Liu Z, Ci L, et al. Research progress on the anti-hepatic fibrosis action and mechanism of natural products[J]. Int Immunopharmacol, 2019, 75: 105765. DOI:10.1016/j.intimp.2019.105765 |
| [2] |
Wang X, Fu T, Wang J, et al. Hepatoprotection of yangonin against hepatic fibrosis in mice via farnesoid X receptor activation[J]. Int Immunopharmacol, 2019, 75: 105833. DOI:10.1016/j.intimp.2019.105833 |
| [3] |
Friedman SL. Hepatic fibrosis—overview[J]. Toxicology, 2008, 254: 120-129. DOI:10.1016/j.tox.2008.06.013 |
| [4] |
Xia HS, Chen SR, Zhong YC, et al. Pathogenesis of liver fibrosis and its treatment status[J]. Chin Med Herald (中国医药导报), 2014, 11: 162-168. |
| [5] |
Peng MDZ, La MZM. Study on the understanding and treatment of cirrhosis in Tibetan medicine[J]. J Med Pharm Chin Minor (中国民族医药杂志), 2016, 6: 53-55. |
| [6] |
Xizhu JC. A brief discussion on understanding of Tibetan medicine on liver and liver diseases[J]. China Tibetol (中国藏学), 2010, 4: 155-158. |
| [7] |
Ciren BZ, Gu J, Shi ZL. To explore the core composition and compatibility features of Tibetan medicine Ershiwuwei Songshi Pills in the treatment of liver disease[J]. World Sci Technol Mod Tradit Chin Med (世界科学技术-中医药现代化), 2018, 20: 140-145. |
| [8] |
Gengzang DZ, Kamao CR. The clinical application of Tibetan medicine Shiliu Rilunkacisan against liver fibrosis[J]. J Med Pharm Chin Minor (中国民族医药杂志), 2017, 7: 27. |
| [9] |
Feng X. Study on Anti-hepatic Fibrosis Effect and Mechanism of Tibetan Medicine (藏药波棱瓜子抗肝纤维化作用及机理研究)[D]. Beijing: Beijing University of Chinese Medicine, 2018.
|
| [10] |
Lan KJ, Que Z. Treatment plan of Tibetan medicine for liver cirrhosis[J]. J Med Pharm Chin Minor (中国民族医药杂志), 2011, 17: 63. |
| [11] |
Deqing BZ, Bai M, Bai Y, et al. Clinical observation on therapeutic effect of liver cirrhosis (Mchim Khray Smug porgyas pa) treated with Tibetan medicine[J]. World Sci Technol Mod Tradit Chin Med (世界科学技术-中医药现代化), 2013, 15: 1009-1014. |
| [12] |
De J, Bai M. Clinical observation of Tibetan medicine Dangmatruzhen in the treatment of ascites due to liver cirrhosis[J]. Chin J Integr Tradit West Med Liver Dis (中西医结合肝病杂志), 2019, 29: 33-34. |
| [13] |
Pengmao CD, Tai B. Study on the clinical curative effect of Tibetan medicine Shisanwei Honghua Pills against liver fibrosis[J]. J Med Pharm Chin Minor (中国民族医药杂志), 2013, 6: 23. |
| [14] |
Zhuo M, Lan KJ. Clinical analysis on the treatment of 36 cases of liver cirrhosis with Tibetan medicine Shibawei Daxiang Honghua Powder[J]. J Med Pharm Chin Minor (中国民族医药杂志), 2007, 3: 21. |
| [15] |
Zhang JW, Gao JJ, Liu DL, et al. Clinical study on Ershiwuwei Songshi Pills combined with entecavir in treatment of chronic hepatitis B[J]. Drug Clin (现代药物与临床), 2019, 34: 212-216. |
| [16] |
Wanma LD. A clinical research on Tibetan medicine saffron pill composed of eighteen medicinals's anti-fibrosis effect on liver[J]. Clin J Chin Med (中医临床研究), 2014, 6: 94-95. |
| [17] |
Ji B, Zhuoma T. Clinical observation on Tibetan medicine treating 50 cases of early liver cirrhosis[J]. J Med Pharm Chin Minor (中国民族医药杂志), 2009, 8: 12. |
| [18] |
Dangzeng CR, Niangmao ZX. Observation on curative effect of oral Tibetan medicine and external treatment of Tibetan medicine in treating liver cirrhosis[J]. J Med Pharm Chin Minor (中国民族医药杂志), 2020, 26: 27-28. |
| [19] |
Shi XT, OuYang XH, Su XL. Research progress of anti-hepatic fibrosis drug treatment[J]. Med Recapit (医学综述), 2019, 25: 480-489. |
| [20] |
Gao YP, Wang NP. Effect of Tibetan medicine Songshi pill on experimental liver fibrosis rats[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2005, 11: 47-48. |
| [21] |
Peng YR, Ding YF, Luo YH, et al. Experimental study on the therapeutical effect of Lang Qing A Ta on hepatic fibrosis[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2012, 18: 190-194. |
| [22] |
Jing XY, Ding YF, Huang YP, et al. Effect of LangQing Ata on TGF-β, α-SMA and OB-R of collagen in rat hepatic fibrosis model[J]. Mod Chin Med (中国现代中药), 2015, 17: 1258-1262. |
| [23] |
Xue J, Peng YR, Ding YF, et al. Effect of Langqing Ata on metabolism of collage in rat hepatic fibrosis model[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2012, 18: 260-265. |
| [24] |
Chen WW, Wang HR, Huo X, et al. Therapeutic effect of Renqing Mangjue capsule on liver fibrosis rats induced by DMN[J]. Drug Eval Res (药物评价研究), 2019, 42: 1099-1104. |
| [25] |
Huang LL. The Protective Effect and Mechanism of ZYJN on Experimental Liver Injury (藏药苦空确屯卡察尔保肝作用研究及机制探讨)[D]. Chengdu: Chengdu University of Traditional Chinese Medicine, 2009.
|
| [26] |
Feng HL, Wang NP. Effect of Qishiwei Songshi Pill on experimental cirrhosis in rats[J]. Chin Tradit Pat Med (中成药), 2005, 27: 741-742. |
| [27] |
Liu W, Fu XH, Huang SY, et al. Protective effect and mechanism of total lignans from Tibetan medicinal Herpetospermum seeds on carbon tetrachloride induced liver fibrosis in rats[J]. China J Chin Mater Med (中国中药杂志), 2017, 42: 567-571. |
| [28] |
Liu W, Shi LL, Shi YC, et al. Effects of total lignans from Tibetan medicine Herpetospermum pedunculosum seeds on proliferation and apoptosis of rat hepatic stellate cells[J]. Chin Tradit Herbal Drugs (中草药), 2017, 48: 2912-2917. |
| [29] |
Wang ZW, Wang RQ, Guo M, et al. Influence of active fractions of Meconopsis quintuplinervia Regel growing in Gansu province on antioxidant system of experimental liver fibrosis rat[J]. Chin J Gerontol (中国老年学杂志), 2013, 33: 5043-5046. |
| [30] |
Wang ZW, Shao J, Guo M, et al. Effect of total flavonoids and alkaloids from Meconopsis quintuplinervia on hepatic fibrosis in rat[J]. Chin Tradit Pat Med (中成药), 2013, 35: 1125-1128. |
| [31] |
Wang ZW, Cheng XL, Guo M, et al. Influence of active fractions of MQR growing in Gansu province on effect and expression of TGF-β1 of experimental liver fibrosis in rat[J]. Chin J Immunol (中国免疫学杂志), 2013, 29: 135-139. |
| [32] |
Wang ZW, Shao J, Guo M. Influence of the active fractions of Meconopsis quintuplinervia Regel growing in Gansu region on inflammatory cytokines in experimental liver fibrosis rat[J]. Immunol J (免疫学杂志), 2013, 29: 24-27. |
| [33] |
Wang Q, Zhong LH, Yu L, et al. Effects of Zanghonghua on expression of transforming growth factors-β1 in rats with liver fibrosis[J]. Prog Mod Biomed (现代生物医学进展), 2012, 12: 3228-3231, 3262. |
| [34] |
Wang Y, Zhu LY. Experimental study on the treatment of rat hepatic fibrosis with saffron[J]. Prog Mod Biomed (现代生物医学进展), 2010, 10: 3244-3247. |
| [35] |
Yang PQ, Wang Y, Mei XQ, et al. Effects of crocetin on signal transduction pathway of human hepatic stellate cells stimulated by TGF-β1[J]. Prog Mod Biomed (现代生物医学进展), 2018, 18: 3230-3234. |
| [36] |
Mei XQ, Wang Y, Wang FX, et al. The influence of saffron in expression of apoptosis related protein caspase-3, Bcl-2 in rats with liver fibrosis[J]. Prog Mod Biomed (现代生物医学进展), 2016, 16: 4427-4430. |
| [37] |
Wang FX, Wang Y, Mei XQ, et al. An experimental study on the treatment of liver fibrosis with crocetin[J]. Prog Mod Biomed (现代生物医学进展), 2017, 17: 5432-5435, 5577. |
| [38] |
He DD, Xu MD, Zeng BL, et al. Effects of Swertia chirayita on hepatic fibrosis model rats induced by carbon tetrachloride[J]. Chin J Tradit Chin Med Pharm (中华中医药杂志), 2017, 32: 4680-4683. |
| [39] |
Chen XQ. Study on Anti-hepatic Fibrosis Component from Ethylacetate Fraction of Swertia chirayita (印度獐牙菜乙酸乙酯部位抗肝纤维化活性成分研究)[D]. Hefei: Anhui University of Chinese Medicine, 2018.
|
| [40] |
Wei SL, Wang J, Li DM. Inhibitory effect of Swertiamarin on fibrosis in rats with cholestatic liver damage[J]. World Chin J Digestol, 2016, 24: 3482-3487. |
| [41] |
Yang H, Zhang Y, Tan WC, et al. Anti-fibrosis effects of "Duyiwei Granule" on hepatic fibrosis[J]. Shanghai J Tradit Chin Med (上海中医药杂志), 2010, 44: 64-67. |
| [42] |
Jiang H, Li KQ, Li X, et al. Protective effects of effective components group of medicine Terminalia Fruit on experimental liver fibrosis[J]. J Int Pharm Res (国际药学研究杂志), 2013, 40: 611-614. |
| [43] |
Min H, Hu CH, Hu B, et al. Optimization of extraction technology of total alkaloids from Sophora Moorcroftiana based on multi index comprehensive detection and its mechanism of anti-hepatic fibrosis[J]. Guid J Tradit Chin Med Pharm (中医药导报), 2018, 24: 14-18. |
| [44] |
Han Q, Wei LX, Du YZ. Experimental study on the effect of glycosides in Swertiam mussotii against carbon tetrachloride-induced liver fibrosis in rats[J]. Chin Tradit Pat Med (中成药), 2009, 31: 936-937. |
| [45] |
Li P, Yang ZT, Peng BC, et al. Effect of Phyllanthus emblica L. on immunity hepatic fibrosis in rats[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2010, 16: 171-173. |
| [46] |
Feng JL, Shen HR, Li X, et al. Effect of Fangji Huangqi Decoction on liver mitochondrial per-oxidative injury in hepatic fibrosis mice induced by lipopolysaccharide and nitrosodimethylamine[J]. Tradit Chin Drug Res Clin Pharmacol (中药新药与临床药理), 2010, 21: 506-508. |
| [47] |
Fei Y, Zhang QY, Jiao L, et al. Synergistic hepatoprotective effect of Schisandrae lignans with Astragalus polysaccharides on chronic liver injury in rats[J]. Phytomedicine, 2009, 16: 805-813. DOI:10.1016/j.phymed.2009.02.004 |
| [48] |
Lin Y, Luo H, Wang X, et al. Flavanones from Sedum sarmentosum bunge alleviate CCl4-induced liver fibrosis in rats by targeting TGF-β1/TβR/Smad pathway in turn inhibiting epithelial mesenchymal transition[J]. Evid Based Complement Alternat Med, 2018, 8: 3080837. |
| [49] |
Katsunori Y, Miki M, Takashi Y, et al. TGF-β/Smad signaling during hepatic fibro-carcinogenesis (review)[J]. Int J Oncol, 2014, 45: 1363-1371. DOI:10.3892/ijo.2014.2552 |
| [50] |
Fabregat I, Moreno-Càceres J, Sánchez A, et al. TGF-β signaling and liver disease[J]. FEBS J, 2016, 283: 2219-2232. DOI:10.1111/febs.13665 |
| [51] |
Hashemi M, Hosseinzadeh H. A comprehensive review on biological activities and toxicology of crocetin[J]. Food Chem Toxicol, 2019, 130: 44-60. DOI:10.1016/j.fct.2019.05.017 |
| [52] |
Koscianska E, Baev V, Skreka K, et al. Prediction and preliminary validation of oncogene regulation by miRNAs[J]. BMC Mol Biol, 2007, 8: 79-87. DOI:10.1186/1471-2199-8-79 |
| [53] |
Zheng J, Wu C, Xu Z, et al. Hepatic stellate cell is activated by microRNA-181b via PTEN/Akt pathway[J]. Mol Cell Biochem, 2015, 398: 1-9. DOI:10.1007/s11010-014-2199-8 |
| [54] |
Wei Z, Zhao D, Zhang Y, et al. Rosiglitazone ameliorates bile duct ligation-induced liver fibrosis by down-regulating NF-κB-TNF-α signaling pathway in a PPARγ-dependent manner[J]. Biochem Biophys Res Commun, 2019, 519: 854-860. DOI:10.1016/j.bbrc.2019.09.084 |
| [55] |
Kubo N, Saito R, Hamano K, et al. Conophylline suppresses hepatic stellate cells and attenuates thioacetamide-induced liver fibrosis in rats[J]. Liver Int, 2014, 34: 1057-1067. DOI:10.1111/liv.12328 |
| [56] |
Zhang N, Li LS. Research progress on pharmacological effects of Crocus sativus and its active ingredients[J]. Drug Eval Res (药物评价研究), 2013, 36: 394-396. |
| [57] |
Zhang YH, Liu JT. Progress in mechanism of traditional Chinese herbs against hepatic fibrosis[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2006, 12: 66-70. |
| [58] |
Caviglia GP, Ciancio A, Rosso C, et al. Non-invasive methods for the assessment of hepatic fibrosis: transient elastography, hyaluronic acid, 13C-aminopyrine breath test and cytokeratin 18 fragment[J]. Ann Hepatol, 2013, 13: 91-97. |
| [59] |
Jing J, Zhao JY, Hua B, et al. Inhibitory effect of flavonoids from Glycyrrhiza uralensis on expressions of TGF-β1 and caspase-3 in thioacetamide-induced hepatic fibrosis in rats[J]. China J Chin Mater Med (中国中药杂志), 2015, 40: 3034-3040. |
| [60] |
Zhang Y, Zhou Q, Ding X, et al. Chemical profile of Swertia mussotii Franch and its potential targets against liver fibrosis revealed by cross-platform metabolomics[J]. J Ethnopharmacol, 2021, 274: 114051. DOI:10.1016/j.jep.2021.114051 |
| [61] |
Tian CW, Zhang TJ. Determination of Swertiopicrin and gentiopicrin in Swertiam mussotii by HPLC[J]. Chin Tradit Herbal Drugs (中草药), 2006, 37: 442-443. |
| [62] |
Shi M, Xiong K, Zhang T, et al. Pharmacokinetics and metabolic profiles of swertiamarin in rats by liquid chromatography combined with electrospray ionization tandem mass spectrometry[J]. J Pharm Biomed Anal, 2020, 179: 112997. DOI:10.1016/j.jpba.2019.112997 |
| [63] |
Hairul-Islam MI, Saravanan S, Thirugnanasambantham K, et al. Swertiamarin, a natural steroid, prevent bone erosion by modulating RANKL/RANK/OPG signaling[J]. Int Immunopharmacol, 2017, 53: 114-124. DOI:10.1016/j.intimp.2017.10.022 |
 2021, Vol. 56
2021, Vol. 56


