2. 江苏省中药高效给药系统工程中心, 江苏 南京 210023
2. Jiangsu Engineering Research Center for Efficient Delivery System of TCM, Nanjing 210023, China
肺纤维化是一种慢性、不可逆性和致死性的肺间质病, 主要表现为胸膜下与基底部的纤维化和蜂窝样改变, 以及肺纤维化灶周围的胶原与细胞外基质(extracellular matrix, ECM) 沉积, 最终导致肺组织结构改变, 肺通气和弥散功能丧失而危及生命[1, 2]。研究表明, 多种呼吸道病毒(包括常见的流感以及去年突发的新冠病毒) 感染均可能导致肺纤维化的发生[3]。FDA批准的吡非尼酮和尼达尼布均为姑息药物, 仅能延缓轻中度患者肺功能下降速率, 降低急性加重的风险, 并不会阻止或逆转已经发生的肺纤维化, 其不良反应明显且价格昂贵[4, 5]。当前, 可用于进行性肺纤维化的唯一有效疗法是肺移植, 但也存在存活率有限、费用高、器官供体少等问题[6]。
肺纤维化属于中医学“肺痹”、“肺痿”等病范畴, 而“肺痹”、“肺痿”为肺纤维化在不同阶段的病机特征, 早期以肺痹为主, 晚期发展为肺痿[7]。《内台方议》记载: “用桔梗为君, 桔梗能浮而治上焦, 利肺痿, 为众药之舟楫也”。桔梗是一种传统药食同源的中药材[8], 现代药理研究表明, 桔梗总皂苷通过降低胶原合成以及抗氧化对肺纤维化具有一定的治疗作用[9]; 桔梗皂苷-D可通过减弱转化生长因子-β1 (transforming growth factor-β1, TGF-β1) 诱导的肺成纤维细胞增殖和ECM积累在肺纤维化治疗中发挥作用[10]。
网络药理学是基于系统生物学的理论, 用生物信息学和网络分析方法对生物系统进行分析的新兴交叉学科。运用网络药理学方法可以有效预测中药的药效成分及作用机制, 体现中药具有多成分、多靶点、多途径、互协同的特点[11]。本研究利用网络药理学与体内实验相结合的方法, 构建“化合物-靶点-通路-药理作用-功效”网络预测桔梗治疗肺纤维化作用机制, 同时利用博莱霉素构建肺纤维化小鼠模型进行相关实验验证。
材料与方法数据库与软件 TCMSP数据库(http://tcmspw.com/tcmsp.php)、PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)、Swiss Target Prediction数据库(http://www.swisstargetprediction.ch/)、OMIM数据库(https://omim.org/)、Disgenet数据库(https://www.disgenet.org/)、Drugbank数据库(https://go.drugbank.com/)、STRING数据库(https://string-db.org/)、Venny2.1在线软件作图工具平台(https://bioinfogp.cnb.csic.es/tools/venny/)、Cytoscape3.7.2软件、R3.6.1软件等。
潜在活性成分的获取及靶点预测 在TCMSP数据库中检索桔梗的成分, 并结合文献补充有相关药理作用的成分作为潜在活性成分。使用PubChem数据库获得上述成分的SDF结构, 导入Swiss Target Prediction数据库, 取预测得分大于0的靶标作为药物靶点。使用OMIM、Disgenet、Drugbank数据库以“pulmonary fibrosis”为关键词进行检索, 获得疾病作用靶点。在Venny2.1在线软件作图工具平台上绘制韦恩图, 获得药物-疾病共同靶点。
中药-成分-靶点-疾病网络构建及分析 使用Cytoscape 3.7.2软件构建“药物-成分-靶点-疾病”网络图, 使用Network Analyzer功能对桔梗的主要活性成分进行分析。
蛋白互作(PPI) 网络的构建及核心靶点分析 将药物-疾病共同靶点输入到STRING数据库中进行检索, 设置蛋白种类为“homo sapiens”, 最低相互作用阈值为0.4, 获取靶点相互作用的网络关系数据, 将其导入Cytoscape软件, 绘制蛋白相互作用网络图。将PPI网络导入Cystoscape 3.7.2中, 通过Network Analyzer工具进行拓扑分析, 通过degree排序, 选取分值大于平均分的基因作为核心靶点。
富集分析 基于R软件使用Bioconductor生物信息软件包以P < 0.05、Q < 0.05进行关键靶基因GO与KEGG功能富集分析, 富集分析结果均以P < 0.05作为筛选条件。
试剂与仪器 博莱霉素(TCI梯希爱公司); 羟脯氨酸检测试剂盒(上海西唐生物科技有限公司); ECL高敏发光液、蛋白预染marker (天能生物科技有限公司); 脱脂奶粉(日本Wako公司); SDS-PAGE蛋白上样缓冲液(5×) (Biosharp生物科技有限公司); 磷酸化磷脂酰肌醇3激酶(phospho-phosphatidylinositol 3 kinase, p-PI3K) 抗体、磷脂酰肌醇3激酶(phosphatidylinositol 3 kinase, PI3K) 抗体、蛋白激酶B (protein kinase B, AKT) 抗体、磷酸化蛋白激酶B (phospho-protein kinase B, p-AKT) 抗体(Cell Signaling公司); RIPA裂解液、BCA蛋白浓度定量试剂盒、SDS-PAGE凝胶配制试剂盒、HE、Masson、β-半乳糖苷酶染色试剂盒(南京碧云天公司); 辣根过氧化酶标记的山羊抗兔(南京福麦斯生物技术有限公司); 蛋白印迹多功能成像系统(美国Bio-Rad公司); 倒置显微镜(日本尼康公司); 酶标仪(瑞士帝肯公司); 梯度PCR仪(MJ mini购自德国Eppendorf公司); 高速低温组织研磨仪(武汉赛维尔公司); 冰冻切片机(德国Leica公司); Flexivent小动物肺功能仪(法国EMKA公司)。
桔梗水煎液制备 称取桔梗药材75 g, 加入0.9 L水, 浸泡30 min, 武火煮沸后文火煎煮1 h, 将药液倒出冷却; 再加入0.75 L水, 武火煮沸后文火煎煮1 h, 混合两次药液, 过滤, 减压浓缩至一定浓度的桔梗水煎液[12]。
实验动物分组与造模 SPF级雄性C57BL/6J小鼠36只, 8周龄, 由浙江维通利华公司提供。所有动物实验均经南京中医药大学动物委员会批准(许可证号: 202005A016)。适应性饲养1周后, 将小鼠随机分为6组, 每组6只, 分别为空白组(control)、模型组(model)、吡非尼酮组(Pir 0.3 g·kg-1·d-1)、桔梗低剂量组(PR 1.35 g·kg-1·d-1)、桔梗中剂量组(PR 2.7 g·kg-1·d-1)、桔梗高剂量组(PR 5.4 g·kg-1·d-1)。采用单次气管给予浓度为5 mg·kg-1博莱霉素造模。造模后次日, 空白组和模型组给予生理盐水灌胃。根据人与小鼠体表面积换算, 其余各组分别给予吡非尼酮(0.3 g·kg-1·d-1)、桔梗低、中、高剂量(1.35、2.7、5.4 g·kg-1·d-1) 水煎液进行灌胃。连续给药21天, 末次给药3 h后处死小鼠, 取肺组织。所有小鼠均取右肺下叶置于4%多聚甲醛中固定。其余肺组织置2 mL冻存管中于液氮快速冷冻, 后移至-80 ℃超低温冰箱保存备用。
组织病理学 小鼠肺组织置于4%多聚甲醛固定24 h后常规脱色、石蜡包埋, 肺切片(4 μm) 后进行HE染色和Masson染色。根据Szapiel方法进行肺泡炎症评分, 参照Ashcroft方法进行纤维化评分。
羟脯氨酸含量测定 根据上海西唐生物科技有限公司的羟脯氨酸ELISA试剂盒的说明书进行, 具体实验步骤为: 每只小鼠称取肺组织约30 mg, 根据质量加入相应比例匀浆液进行匀浆并收集上清液, 同时稀释标准品用于绘制标准曲线。将待测样品与标准品加样于包被羟脯氨酸的酶标板上, 先后加入酶标抗体工作液、底物工作液、终止液后在450 nm处测吸光值, 根据标准曲线计算羟脯氨酸的含量。
肺功能 最后一次给药后, 麻醉小鼠后剪开颈部皮肤, 钝性分离气管, 将肺功能仪的针管插入并用手术线固定连接部位, 固定小鼠于体描仪平台, 运行仪器检测并记录小鼠肺顺应性[cm(H2O)·mL-1] 与肺阻力[cm(H2O)·mL-1] 指标的变化。
实时荧光定量PCR (qRT-PCR) 采用qRT-PCR方法检测肺组织中待测基因的表达, 以2-ΔΔCt值表示基因相对表达量。引物信息见表 1, 由上海生工生物技术有限公司合成。
| Table 1 PCR primer sequence of each gene. AKT1: Serine/threonine kinase 1; EGFR: Epidermal growth factor receptor; MAPK3: Mitogen-activated protein kinase 3; TNF: Tumor necrosis factor; SRC: Rous sarcoma oncogene; STAT3: Signal transducer and activator of transcription 3; JUN: Jun proto-oncogene; MAPK1: Mitogen-activated protein kinase 1; PTGS2: Prostaglandin-endoperoxide synthase 2; ERBB2: Erb-b2 receptor tyrosine kinase 2; MMP9: Matrix metallopeptidase 9; IL2: Interleukin 2; ESR1: Estrogen receptor 1; MTOR: Mechanistic target of rapamycin kinase; HSP90AA1: Heat shock protein 90, alpha (cytosolic), class A member 1; MMP2: Matrix metallopeptidase 2; MAPK14: Mitogen-activated protein kinase 14; PIK3CA: Phosphatidylinositol-4, 5-bisphosphate 3-kinase catalytic subunit alpha; ICAM1: Intercellular adhesion molecule 1; PLG: Plasminogen; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase |
蛋白质免疫印迹 取肺组织冰上剪碎后加入适量RIPA溶液(含蛋白酶及磷酸酯酶混合抑制剂) 进行裂解, 12 000 r·min-1离心10 min后取上清, 用BCA法测定蛋白浓度, 向上清中按比例加入上样缓冲液后置于沸水浴中5 min。制得的蛋白样品进行SDS-PAGE (sodium dodecyl sulfate polyacrylamide gel electrophoresis) 电泳, 按每孔40 μg上样电泳, 转膜, 5%脱脂奶粉室温封闭2 h, TBST (Tris buffered saline Tween20) 洗膜, 按照抗体说明书稀释一抗, 4 ℃孵育过夜, TBST洗膜后加入HRP标记的二抗, 37 ℃孵育1 h。ECL显影, 凝胶成像系统分析目的蛋白的相对表达量, 目标蛋白表达量通过GAPDH进行校正。
衰老染色 将冰冻的肺组织切片复温, 用PBS洗涤3次, 每次不少于5 min。加入适当体积的β-半乳糖苷酶染色固定液, 室温固定不少于15 min。用PBS浸泡洗涤组织3次, 每次不少于5 min。吸除PBS, 加入适量的染色工作液。37 ℃孵育过夜后普通光学显微镜下观察。
统计学分析 使用GraphPad Prism 8.0软件进行绘图, 以均数±标准差(x ± s) 表示, 多组数据比较采用方差分析(one-way ANOVA), 两组数据比较采用学生t检验(student's t test); P < 0.05表明差异具有统计学意义。
结果 1 桔梗抗肺纤维化靶点预测在TCMSP数据库中设定生物利用度(oral bioavailability, OB) ≥ 30%、类药性(drug likeness, DL) ≥ 0.18, 对桔梗的有效成分进行筛选, 并结合文献补充纳入桔梗皂苷D[13], 共得到潜在活性成分8个, 分别为cis-dihydroquercetin、2-O-methyl-3-O-β-D-glucopyranosyl platycogenate A、acacetin、spinasterol、robinin、dimethyl 2-O-methyl-3-O-α-D-glucopyranosyl、luteolin、platycodin D。使用Swiss Target Prediction数据库筛选出289个药物靶点; 使用OMIM、Disgenet、Drugbank数据库获得1 129个疾病作用靶点。在Venny2.1在线软件作图工具平台上输入289个药物靶点、1 129个疾病靶点, 绘制韦恩图, 两者取交集后获得药物-疾病共同靶点65个。
2 桔梗抗肺纤维化网络图将桔梗中8个潜在活性成分与65个药物-疾病共同靶点输入Cytoscape软件中, 删除与靶点无交集的孤立成分, 绘制出“药物-成分-靶点-疾病”相互作用的网络图(图 1)。图中紫色代表药物, 绿色代表桔梗中的7种活性成分(1个活性成分靶点与疾病靶点无交集, 予删除), 蓝色代表 65个共同靶点, 红色代表疾病。
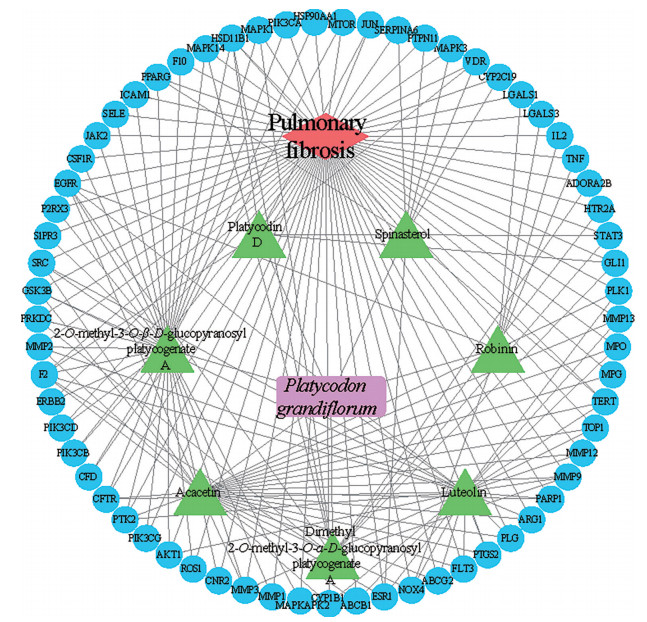
|
Figure 1 Network of drugs-components-targets-disease interaction |
将上述药物-疾病共同靶点输入到STRING数据库中进行检索, 构建蛋白相互作用的PPI网络。得到桔梗治疗肺纤维化潜在靶点的蛋白质相互作用(PPI) 网络中共有65个节点(靶点蛋白)、609条边(蛋白相互作用), 见图 2。其中, 节点的大小、颜色及其深浅变化代表degree值的大小。
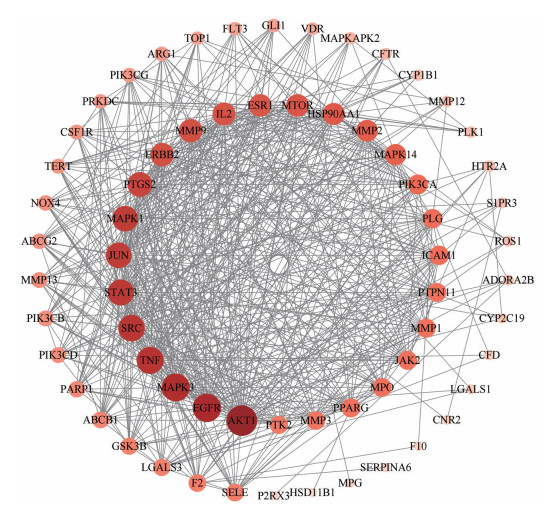
|
Figure 2 Protein-protein interaction network of Platycodon grandiflorum (PR) in the treatment of pulmonary fibrosis |
将PPI网络导入Cystoscape 3.7.2中, 通过Network Analyzer工具进行拓扑分析, 以degree、betweenness centrality、average shortest path length和closeness centrality这4个参数为参考标准, 通过degree排序, 选取分值大于平均分的基因作为核心靶点, 将前20个靶点使用R 3.6.1绘制条形图(图 3), 得到桔梗治疗肺纤维化可能通过的核心靶点。

|
Figure 3 Ranking of core targets of PR in the treatment of pulmonary fibrosis based on PPI topology analysis |
将65个共同靶点经R语言运行后GO分析选取生物学过程、细胞组分及分子功能3部分(图 4A)。GO结果显示, 交集基因共富集至1 472条生物学过程, 34条细胞组分表达过程, 69个与分子功能相关过程。

|
Figure 4 Gene oncology (GO) biological process, cellular component, molecular function (A) and pathway enrichment analysis (B) of PR in the treatment of pulmonary fibrosis |
将65个共同靶点经R语言运行后共得到146条KEGG通路, 前20的结果形成KEGG功能富集的条形图(图 4B), P值代表富集的显著性, 颜色越红则显著性越高。结果表明, 桔梗抗肺纤维化可能通过PI3K-AKT信号通路、肿瘤坏死因子(tumor necrosis factor, TNF) 信号通路、表皮生长因子受体(epidermal growth factor receptor, EGFR) 信号通路等发挥作用。
5 桔梗对肺纤维化小鼠肺组织的影响为了验证网络药理学分析结果并深入探讨桔梗抗肺纤维化的机制, 本研究进一步构建了博莱霉素诱导的肺纤维化小鼠模型进行后续研究。
HE染色观察肺泡炎症程度, Masson染色观察肺纤维化程度(图 5A~C)。空白组未见炎性细胞浸润及蓝色胶原沉积; 与空白组相比, 模型组小鼠肺泡间质及肺泡腔出现大量炎性细胞浸润及蓝色胶原沉积; 与模型组相比, 随着水煎液剂量的增加, 肺组织炎症和胶原沉积的改善逐渐明显, 桔梗高剂量组效果最佳。生存曲线结果表明(图 5D), 桔梗能提高肺纤维化小鼠的存活率且存在剂量依赖性。

|
Figure 5 Effects of PR on lung changes of bleomycin-induced mice. A: Lung tissue were stained with HE (hematoxylin-eosin) and Masson (magnification 100×); B: Inflammation score; C: Fibrosis score; D: Survival curve; E: Expressions of hydroxyproline in the lung tissues were detected by ELISA method. n = 6, x ± s. ##P < 0.01, ###P < 0.001 vs blank group; **P < 0.01, ***P < 0.001 vs model group. Pir: Pirfenidone |
羟脯氨酸是机体胶原蛋白的主要成分之一, 为胶原纤维所特有, 因此可作为肺纤维化的评价指标[14]。ELISA结果表明(图 5E), 与空白组相比, 模型组小鼠肺组织羟脯氨酸含量明显升高, 高剂量桔梗水煎液可以明显降低其含量。
小鼠肺功能检测结果表明(图 6), 博莱霉素诱导后的小鼠肺部顺应性明显降低, 桔梗能够改善小鼠肺功能, 降低肺阻力增加肺部的顺应性, 且随着剂量增加, 变化逐渐明显。
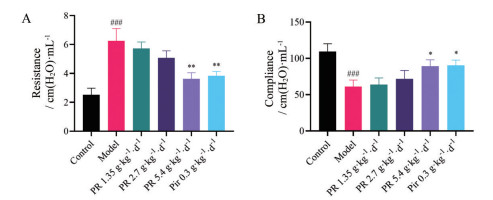
|
Figure 6 Effects of PR on lung function of bleomycin-induced mice with pulmonary fibrosis. A: Lung resistance; B: Lung compliance. n = 6, x ± s. ###P < 0.001 vs blank group; *P < 0.05, **P < 0.01 vs model group |
通过qPT-PCR检测图 3中核心靶点的表达情况, 对网络药理学结果进行初步验证。结果提示, 存在差异性表达的基因有JUN (Jun proto-oncogene)、AKT1 (serine/threonine kinase 1)、SRC (Rous sarcoma oncogene)、HSP90AA1 [heat shock protein 90, alpha (cytosolic), class A member 1]、MTOR (mechanistic target of rapamycin kinase)、PIK3CA (phosphatidylinositol-4, 5-bisphosphate 3-kinase catalytic subunit alpha)、STAT3 (signal transducer and activator of transcription 3)、ESR1 (estrogen receptor 1) 等, MTOR、HSP90AA1、PIK3CA等靶点均与PI3K-AKT信号通路有关(图 7)。

|
Figure 7 Effects of PR on the transcription of key target genes in lung tissue of bleomycin-induced mice with pulmonary fibrosis. n = 3, x ± s |
网络药理学富集分析及qRT-PCR实验验证的结果均表明, 桔梗可能通过PI3K-AKT信号通路发挥抗肺纤维化作用。通过Western blot对此通路的关键蛋白进行检测, 结果表明(图 8), 模型组p-AKT、p-PI3K蛋白相对表达量均显著高于空白组(P < 0.05), 给予桔梗水煎液治疗后, 其相对含量明显降低且具有剂量依赖性(P < 0.05)。

|
Figure 8 Effects of PR on the expression of PI3K-AKT-related marker proteins in lung tissue of bleomycin-induced mice with pulmonary fibrosis. A: The protein expressions of p-PI3K, PI3K, p-AKT, AKT, and GAPDH were determined by Western blot analysis; B: Quantitative results of p-AKT/AKT; C: Quantitative results of p-PI3K/PI3K. n = 3, x ± s. #P < 0.05, ###P < 0.001 vs blank group; *P < 0.05, **P < 0.01 vs model group |
已有文献报道肺纤维化与细胞衰老密切相关, 且PI3K-AKT通路可影响下游衰老相关蛋白P21的表达, 推测桔梗治疗小鼠肺纤维化的作用可能与通过PI3K-AKT通路影响细胞衰老有关[15, 16]。β-半乳糖苷酶是一种公认的可用于体内外衰老研究的生物学标志[17], 染色结果表明(图 9A), 肺纤维化模型组小鼠衰老细胞较空白组显著增加, 高剂量桔梗水煎液能明显降低染色阳性率, 其余组染色阳性率均有不同程度的降低, 但较模型组没有显著差异。P16是主要的细胞周期抑制蛋白, 直接参与细胞增殖的负调节, 在细胞衰老过程中起重要作用, P21和P16聚集的增加均是重要且典型的衰老标志[18]。Western blot结果表明(图 9B~D), 与空白组比较, 模型组P21和P16蛋白含量明显升高(P < 0.001); 与模型组比较, 给予桔梗水煎液治疗后, 其含量明显降低(P < 0.05), 且高剂量桔梗水煎液效果最佳。
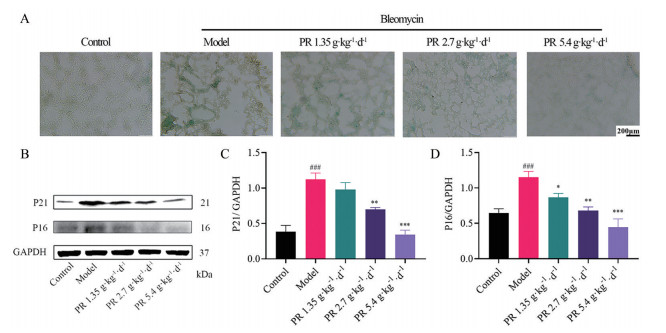
|
Figure 9 Effects of PR on the expression of aging-related marker proteins in lung tissue of bleomycin-induced mice with pulmonary fibrosis. A: Senescence staining (magnification 100×); B: The protein expressions of P21, P16, and GAPDH were determined by Western blot analysis; C: The protein expressions f P21 relative to GAPDH; D: The protein expressions of P16 relative to GAPDH. n = 3, x ± s. ###P < 0.001 vs blank group; *P < 0.05, **P < 0.01, ***P < 0.001 vs model group |
肺纤维化是一种渐进性和致命性的间质性肺疾病, 其特征是纤维母细胞灶、肺泡蜂窝状和持续性纤维化, 最终导致肺结构的破坏和暴发性呼吸衰竭[19]。目前肺纤维化发病机制主要是肺泡上皮细胞损伤, 释放大量炎症因子, 激活肺成纤维细胞, 诱导ECM大量分泌, 最终导致肺重塑和瘢痕肺[20]。通过动物实验, 本研究发现高剂量桔梗水煎液可以减轻博莱霉素诱导的肺纤维化小鼠的炎症反应和胶原沉积, 可以改善小鼠肺功能。
网络药理学结果显示, 桔梗活性成分8个, 对应289个作用靶点, 其中与肺纤维化相关的共同靶点65个。通过构建PPI网络发现, AKT1、EGFR、MAPK3、TNF等度值较大, 可能是桔梗治疗肺纤维化的关键性靶标。AKT1基因编码的是丝氨酸/苏氨酸蛋白激酶, 可以通过PI3K被激活, 广泛地分布在组织中, 调控细胞增殖与生长等过程[21]; EGFR家族活化后可促进基因转录、蛋白表达、细胞分裂与增殖等, 已有研究表明活化后的EGFR可向下传递纤维化信号, 在肺纤维化发生发展中起到重要作用[22]; MAPK3 (ERK1) 是在哺乳动物中发现的第一个丝裂原活化蛋白激酶, 参与生长因子信号传导, 可作为细胞增殖调节剂[23]; TNF为肿瘤坏死因子, 主要活化巨噬细胞、自然杀伤细胞(natural killer cell, NK) 和T淋巴细胞产生[24]。KEGG通路富集分析表明, 桔梗治疗肺纤维化与PI3K-AKT信号通路、TNF信号通路、EGFR信号通路等有关。TNF信号通路和EGFR信号通路均与PI3K-AKT信号通路关系密切, TNFR1的下游是核因子κB (nuclear factor kappa-B, NF-κB) 信号通路和MAPK信号通路, TNFR2的下游是PI3K-AKT信号通路; EGFR可通过二聚化后刺激Ras蛋白, 导致磷酸化级联反应而激活PI3K-AKT信号通路[25]。
PI3K蛋白家族参与细胞增殖、分化、凋亡和葡萄糖转运等多种细胞功能的调节。研究发现, PI3K-AKT信号通路能使受体酪氨酸激酶活化, 从而使细胞质上的PI3K易位至细胞膜, 激活及催化亚基, 产生第2信使PI (3, 4, 5) P3, 与AKT氨基酸末端PH结构域相结合, 通过调控下游MTOR、缺氧诱导因子(hypoxia-inducible factor 1α, HIF-1α)、活性氧(reactive oxygen species, ROS) 等参与肺纤维化[26, 27]。通过阻断PI3K-AKT信号通路来抑制肺纤维化, 有可能成为治疗肺纤维化的新思路。已有研究表明PI3K抑制剂能够改善博莱霉素诱导的肺纤维化小鼠模型的肺功能和病理损伤, 降低肺组织羟脯氨酸含量和α-平滑肌动蛋白(α-SMA) 水平[28]。本研究结果已经证实, 桔梗能够减轻肺纤维化小鼠肺组织中磷酸化的PI3K及AKT的蛋白表达。
PI3K激活AKT可以通过磷酸化或抑制其下游靶蛋白P21、B淋巴细胞瘤-2基因相关启动子(Bad)、含半胱氨酸的天冬氨酸蛋白水解酶9 (caspase9)、NF-κB、Forkhead、MTOR等, 从而介导胰岛素、多种生长因子等诱发的细胞生长, 经多种途径促进细胞存活, 发挥抗衰老作用[29]。不可逆的细胞周期停滞被视为衰老的标志, DNA损伤、氧化应激和端粒损伤都可能引起细胞衰老, 衰老细胞不能增殖, 但依然存活且能代谢, 主要表现为β-半乳糖苷酶活性增加以及细胞周期调节蛋白P53、P21和P16表达增加, 亦分泌衰老相关因子[30]。多数研究认为, 肺纤维化患者的肺成纤维细胞具有衰老表型且过表达α-SMA, 呈现肌成纤维细胞特征, 同时肺纤维化小鼠上皮细胞和成纤维细胞都可发生衰老, 通过分泌衰老相关的分泌表型(senescence-associated secretory phenotype, SASP) 加重肺纤维化[31, 32]。Western blot实验结果证实了桔梗可以降低衰老标志蛋白P21和P16的表达, 且高剂量效果最佳。另外, β-半乳糖苷酶染色表明, 高剂量桔梗水煎液能够减少肺组织中细胞衰老。本研究结果证实了桔梗可以通过PI3K-AKT信号通路抑制细胞衰老发挥抗肺纤维化作用。然而, 在肺纤维中, 成纤维细胞和上皮细胞均扮演着重要角色, 肺组织中同时包含其他多种类型的细胞。桔梗水煎液抗衰老发生于何种细胞目前是未知的, 这也待本课题组进一步深入探讨。
综上所述, 本研究基于网络药理学方法, 对桔梗多成分-多靶点-多途径-多效应的抗肺纤维化机制进行了分析, 在此基础上, 进行了动物实验验证。结果表明, 桔梗可能通过PI3K-AKT信号通路调控细胞衰老发挥抗肺纤维化作用。
作者贡献: 王璇负责网络药理学分析和体外验证实验, 对数据进行分析以及文章撰写; 徐泳、罗子宸、韩迪参与了网络药理学分析; 谢彤、林丽丽、徐建亚参与文章修改; 时晨、单进军负责构思和设计实验、结果分析、基金获得、对文章进行审阅指导。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Upagupta C, Shimbori C, Alsilmi R, et al. Matrix abnormalities in pulmonary fibrosis[J]. Eur Respir Rev, 2018, 27: 148. |
| [2] |
Justice JN, Nambiar AM, Tchkonia T, et al. Senolytics in idiopathic pulmonary fibrosis: results from a first-in-human, open-label, pilot study[J]. EBioMedicine, 2019, 40: 554-563. DOI:10.1016/j.ebiom.2018.12.052 |
| [3] |
Spagnolo P, Balestro E, Aliberti S, et al. Pulmonary fibrosis secondary to COVID-19: a call to arms?[J]. Lancet Respir Med, 2020, 8: 750-752. DOI:10.1016/S2213-2600(20)30222-8 |
| [4] |
Vancheri C, Kreuter M, Richeldi L, et al. Nintedanib with add-on pirfenidone in idiopathic pulmonary fibrosis. Results of the INJOURNEY Trial[J]. Am J Respir Crit Care Med, 2018, 197: 356-363. DOI:10.1164/rccm.201706-1301OC |
| [5] |
Lancaster LH, de Andrade JA, Zibrak JD, et al. Pirfenidone safety and adverse event management in idiopathic pulmonary fibrosis[J]. Eur Respir Rev, 2017, 26: 170057. DOI:10.1183/16000617.0057-2017 |
| [6] |
Glass DS, Grossfeld D, Renna HA, et al. Idiopathic pulmonary fibrosis: molecular mechanisms and potential treatment approaches[J]. Respir Investig, 2020, 58: 320-335. DOI:10.1016/j.resinv.2020.04.002 |
| [7] |
Huang YJ, Gong JN. The law on pulmonary atrophic lung disease and pulmonary fibrosis syndrome[J]. Lishizhen Med Mater Med Res (时珍国医国药), 2016, 27: 1439-1441. |
| [8] |
Xu WC, Luo ZC, Xie T, et al. Advance in research on platycidonis radix and preliminary analysis of its quality marker prediction[J]. J Nanjing Univ Tradit Chin Med (南京中医药大学学报), 2021, 37: 294-302. |
| [9] |
Wang XY, Han L, Gan YH. Mechanism of total saponins of Platycodon grandiflorum against pulmonary fibrosis in rats[J]. Chin J Gerontol (中国老年学杂志), 2015, 35: 2957-2958. |
| [10] |
Hou HH, Su CC, Hong LL, et al. Platycodin D alleviates proliferation and extracellular matrix accumulation in TGF-beta1 induced pulmonary fibroblasts[J]. Bratisl Lek Listy, 2021, 122: 145-151. |
| [11] |
Li XJ, Xu HY. Network pharmacology and traditional Chinese medicine research[J]. Acta Pharm Sin (药学学报), 2018, 53: 1385-1386. |
| [12] |
Deng XH, Lin MY, Tan HM. Study on the quality standard of Platycodon grandiflorum standard decoction based on the characteristic map of high performance liquid phase[J]. Jiangxi J Tradit Chin Med (江西中医药), 2018, 49: 66-68. |
| [13] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. Beijing: China Medical Science Press, 2020: 289.
|
| [14] |
Yazaki M, Ito Y, Yamada M, et al. Oral ingestion of collagen hydrolysate leads to the transportation of highly concentrated Gly-Pro-Hyp and its hydrolyzed form of Pro-Hyp into the bloodstream and skin[J]. J Agric Food Chem, 2017, 65: 2315-2322. DOI:10.1021/acs.jafc.6b05679 |
| [15] |
Schafer MJ, White TA, Iijima K, et al. Cellular senescence mediates fibrotic pulmonary disease[J]. Nat Commun, 2017, 8: 14532. DOI:10.1038/ncomms14532 |
| [16] |
Yang L, Fu WL, Zhu Y, et al. Tbeta4 suppresses lincRNA-p21-mediated hepatic apoptosis and fibrosis by inhibiting PI3K-AKT-NF-kappaB pathway[J]. Gene, 2020, 758: 144946. DOI:10.1016/j.gene.2020.144946 |
| [17] |
Lee BY, Han JA, Im JS, et al. Senescence-associated beta-galactosidase is lysosomal beta-galactosidase[J]. Aging Cell, 2006, 5: 187-195. DOI:10.1111/j.1474-9726.2006.00199.x |
| [18] |
Leontieva OV, Blagosklonny MV. CDK4/6-inhibiting drug substitutes for p21 and p16 in senescence: duration of cell cycle arrest and MTOR activity determine geroconversion[J]. Cell Cycle, 2013, 12: 3063-3069. DOI:10.4161/cc.26130 |
| [19] |
Meyer KC. Pulmonary fibrosis, part I: epidemiology, pathogenesis, and diagnosis[J]. Expert Rev Respir Med, 2017, 11: 343-359. |
| [20] |
Thannickal VJ, Toews GB, White ES, et al. Mechanisms of pulmonary fibrosis[J]. Annu Rev Med, 2004, 55: 395-417. DOI:10.1146/annurev.med.55.091902.103810 |
| [21] |
Duggal S, Jailkhani N, Midha MK, et al. Defining the Akt1 interactome and its role in regulating the cell cycle[J]. Sci Rep, 2018, 8: 1303. DOI:10.1038/s41598-018-19689-0 |
| [22] |
Venkataraman T, Frieman MB. The role of epidermal growth factor receptor (EGFR) signaling in SARS coronavirus-induced pulmonary fibrosis[J]. Antiviral Res, 2017, 143: 142-150. DOI:10.1016/j.antiviral.2017.03.022 |
| [23] |
Dang T, Liou GY. Macrophage cytokines enhance cell proliferation of normal prostate epithelial cells through activation of ERK and Akt[J]. Sci Rep, 2018, 8: 7718. DOI:10.1038/s41598-018-26143-8 |
| [24] |
Varfolomeev E, Vucic D. Intracellular regulation of TNF activity in health and disease[J]. Cytokine, 2018, 101: 26-32. DOI:10.1016/j.cyto.2016.08.035 |
| [25] |
Lee JH, Liu R, Li J, et al. EGFR-phosphorylated platelet isoform of phosphofructokinase 1 promotes PI3K activation[J]. Mol Cell, 2018, 70: 197-210. DOI:10.1016/j.molcel.2018.03.018 |
| [26] |
Fruman DA, Chiu H, Hopkins BD, et al. The PI3K pathway in human disease[J]. Cell, 2017, 170: 605-635. DOI:10.1016/j.cell.2017.07.029 |
| [27] |
Hsu HS, Liu CC, Lin JH, et al. Involvement of ER stress, PI3K/AKT activation, and lung fibroblast proliferation in bleomycin-induced pulmonary fibrosis[J]. Sci Rep, 2017, 7: 14272. DOI:10.1038/s41598-017-14612-5 |
| [28] |
Hettiarachchi SU, Li YH, Roy J, et al. Targeted inhibition of PI3 kinase/mTOR specifically in fibrotic lung fibroblasts suppresses pulmonary fibrosis in experimental models[J]. Sci Transl Med, 2020, 12: eaay3724. DOI:10.1126/scitranslmed.aay3724 |
| [29] |
Lien EC, Dibble CC, Toker A. PI3K signaling in cancer: beyond AKT[J]. Curr Opin Cell Biol, 2017, 45: 62-71. DOI:10.1016/j.ceb.2017.02.007 |
| [30] |
Noren HN, Evans MK. Techniques to induce and quantify cellular senescence[J]. J Vis Exp, 2017(123): 55533. |
| [31] |
Waters DW, Blokland K, Pathinayake PS, et al. Fibroblast senescence in the pathology of idiopathic pulmonary fibrosis[J]. Am J Physiol Lung Cell Mol Physiol, 2018, 315: L162-L172. DOI:10.1152/ajplung.00037.2018 |
| [32] |
Alvarez D, Cardenes N, Sellares J, et al. IPF lung fibroblasts have a senescent phenotype[J]. Am J Physiol Lung Cell Mol Physiol, 2017, 313: L1164-L1173. DOI:10.1152/ajplung.00220.2017 |
 2021, Vol. 56
2021, Vol. 56


