2. 无锡第二人民医院药学部, 江苏 无锡 214000
2. Department of Pharmacy, Wuxi No. 2 People's Hospital, Wuxi 214000, China
肺纤维化既是独立的疾病也是多种慢性肺疾病的终末期病理改变, 是许多慢性肺疾病致残和致死的重要原因[1], 其主要病理特征之一为肺成纤维细胞过度增殖转化和细胞外基质异常生成积聚[2]。在正常生理情况下, 肺成纤维细胞具有合成和分泌细胞外基质蛋白的功能, 并具有修复损伤和保护肺泡正常生理活性的功能。而在病理条件下, 肺成纤维细胞受各种因子的刺激, 目前认为转化生长因子-β1 (transforming growth factor-β1, TGF-β1) 是其中最重要的因子[3]。肺成纤维细胞异常增殖转化成为肺肌成纤维细胞, 大量生成细胞外基质, 促进肺纤维化的发展, 最终破坏肺部功能。因此抑制肺成纤维细胞的异常增殖转化是目前有效阻滞肺纤维化发展进程的重要途径[4]。
来自于中药蓝萼香茶菜的蓝萼甲素 (glaucocalyxin A, GLA), 其活性主要来源于具有贝壳杉烯的骨架, 具有抗血小板凝集及抗血栓[5]、抗炎抑菌[6]、抗肿瘤[7, 8]等多种活性。最近, Yang等[9]发现蓝萼甲素可显著改善博莱霉素诱导的肺纤维化小鼠的肺纤维化症状, 减少肺脏胶原沉积。然而, 蓝萼甲素减轻肺纤维化的机制尚未阐明。本实验应用TGF-β1诱导肺成纤维细胞转化为肺肌成纤维细胞模型, 探讨蓝萼甲素抑制肺成纤维细胞转化的作用及其通过GSK3β/β-catenin发挥药理作用的机制, 为蓝萼甲素抗肺纤维化的应用提供理论线索。
材料与方法细胞培养与给药 人胚肺成纤维细胞MRC-5细胞株(62559214, ATCC), 置于10% FBS的MEM培养基中在37 ℃、含5% CO2的细胞培养箱中培养。取对数生长期的MRC-5细胞, 制备单细胞悬液, 按细胞密度每毫升2×104个接种于6孔板中, 每孔加2 mL单细胞悬液, 隔天用含有0.5% FBS的MEM培养基饥饿。饥饿24 h后, 给予不同处理, 溶剂对照组、模型组 (TGF-β1 2.5 ng·mL-1) 以及不同剂量蓝萼甲素组 (2和4 μmol·L-1), 在指定时间收取细胞。
蛋白质免疫印迹分析 细胞培养结束后, 置于冰盒上收取细胞至离心管, 然后在冰水中用细胞超声破碎仪进行超声裂解, 离心后取上清。蛋白粗提物在95.0 ℃金属浴中加热5 min使蛋白质变性, 即为蛋白样本。样本使用10% SDS-PAGE电泳进行分离, 然后转印至聚偏二氟乙烯膜 (PVDF膜)。PVDF膜使用5%牛奶封闭1 h, 后用相应一抗孵育过夜。次日, 二抗孵育1 h, 使用Odyssey近红外双色激光成像系统扫描、拍照成像。Western blot图采用Image J进行蛋白条带灰度的相对定量分析。
抗体信息 兔多克隆抗体糖原合成酶激酶3β (glycogen synthase kinase 3β, GSK3β, 22104-1-AP) 抗体、兔多克隆抗体HA标签抗体(51064-2-AP), 武汉三鹰生物技术有限公司生产; 兔多克隆抗体纤维黏连蛋白(fibronectin, FN, ab2413) 抗体、兔多克隆抗体GAPDH抗体(ab32211)、兔多克隆抗体α平滑肌肌动蛋白(α-smooth muscle actin, α-SMA, ab124694) 抗体、兔多克隆抗体细胞外信号调节激酶(extracellular regulated protein kinases, ERK, ab184699) 抗体, 英国Abcam公司生产; 兔多克隆抗体p-GSK3β抗体(Ser9, 5558)、兔多克隆抗体p-ERK1/2抗体(Thr202/Tyr204, 4370)、兔多克隆抗体β-连环蛋白(β-catenin) 抗体(8480)、兔多克隆抗体Smad3抗体(9523)、兔多克隆抗体p-Smad3抗体(Ser423/425, 9520), 美国Cell Signaling Technology公司生产; 荧光鼠二抗(926-32210)、荧光兔二抗(926-32211), 美国Odyssey公司生产。
肺成纤维细胞胶原胶收缩实验 MRC-5细胞用胰酶消化并重悬于含有1 mg·mL-1大鼠鼠尾胶原的MEM中, 再将细胞混悬液接种到24孔板中并在37 ℃下孵育30 min, 最后从孔中释放凝胶, 并将细胞在含有10% FBS的培养基中培养过夜。次日, 将培养基换成含有0.5% FBS的培养基, 过夜培养。第3天, 含有肺成纤维细胞胶原胶用2.5 ng·mL-1 TGF-β1以及蓝萼甲素 (4 μmol·L-1) 处理48 h, 拍摄凝胶图像。最后, 采用Image J进行凝胶表面积测量分析。
细胞免疫荧光 用TGF-β1 (2.5 ng·mL-1) 及蓝萼甲素(4 μmol·L-1) 处理细胞48 h后, 将细胞洗涤、固定、透化后与100 nmol·L-1罗丹明鬼笔环肽工作液一起于室温下避光孵育30 min。用PBS洗涤细胞3次, 并用200 μL含100 nmol·L-1 DAPI的PBS溶液复染3 min, 后用PBS洗涤细胞3次后, 使用荧光倒置显微镜拍摄图像。
统计学分析 本实验中数据使用平均值±标准差(x ± s) 表示。数据采用One-way ANOVA进行分析, 并采用GraphPad Prism进行绘图。P < 0.05时判定具有统计学意义。
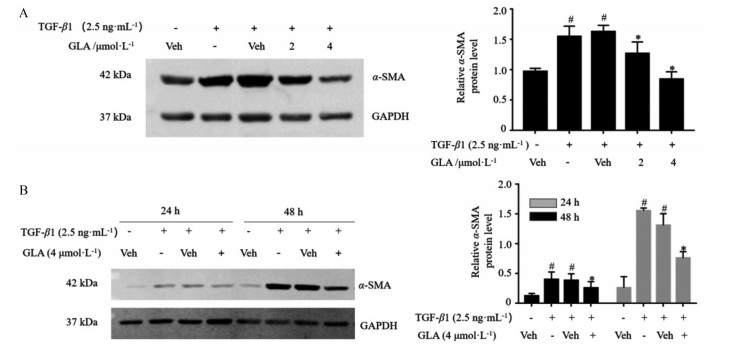
结果 1 蓝萼甲素对TGF-β1诱导肺成纤维细胞转化的影响肺成纤维细胞转化成肺肌成纤维细胞的重要标志物为α-SMA。如图 1A所示, 2和4 μmol·L-1蓝萼甲素作用于MRC-5细胞48 h后, 均能明显下调MRC-5细胞中的α-SMA蛋白表达水平; 如图 1B所示, 4 μmol·L-1蓝萼甲素作用于MRC-5细胞24和48 h后, 均能显著抑制细胞中α-SMA蛋白表达水平。上述结果提示, 蓝萼甲素能够抑制肺成纤维细胞转化为肺肌成纤维细胞。
|
Figure 1 Glaucocalyxin A (GLA) repressed transforming growth factor β1 (TGF-β1)-stimulated lung fibroblast differentiation. A: The levels of α-smooth muscle actin (α-SMA) protein expression in TGF-β1-stimulated MRC-5 cells treated with 2 and 4 μmol·L-1 of GLA for 48 h were determined by Western blot; B: The levels of α-SMA in TGF-β1-stimulated MRC-5 cells treated with 4 μmol·L-1 of GLA at different time points were analyzed by Western blot. n = 3, x ± s. #P < 0.05 vs control group; *P < 0.05 vs Veh+TGF-β1 group. Veh: Vehicle |
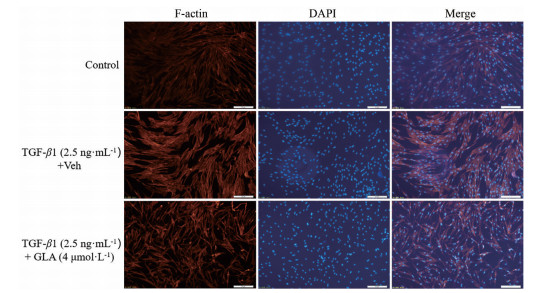
肺成纤维细胞转化的重要细胞表型标志之一是细胞肌丝的形成。肺成纤维细胞中细胞肌丝的细胞免疫化学染色结果表明, 与对照组相比, TGF-β1诱导的MRC-5细胞中细胞肌丝明显增多, 而4 μmol·L-1蓝萼甲素能显著抑制TGF-β1诱导的MRC-5细胞中细胞肌丝纤维 (丝状肌动蛋白: 红色) 的形成(图 2)。这一结果进一步说明, 蓝萼甲素的确能抑制从肺成纤维细胞向肺肌成纤维细胞的表型转变。
|
Figure 2 Stress fiber formation in TGF-β1-stimulated fibroblast differentiation treated with or without GLA (4 μmol·L-1) for 48 h was cytochemically evaluated. Scale bar: 50 μm, 200×. DAPI: 4', 6-Diamidino-2-phenylindole |
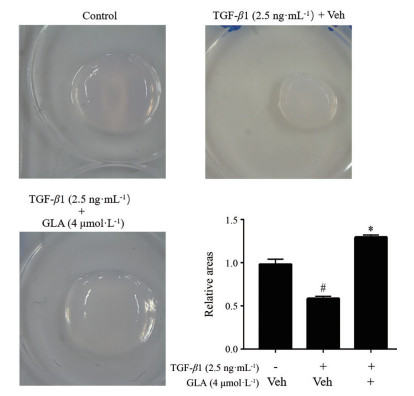
为进一步说明蓝萼甲素在肺成纤维细胞转化中的作用, 本研究进行了含肺成纤维细胞的胶原胶收缩实验。如图 3所示, 与对照组相比, TGF-β1明显降低了肺成纤维细胞胶原胶表面积, 而4 μmol·L-1蓝萼甲素处理后的TGF-β1诱导肺成纤维细胞的胶原胶面积显著增加, 明显减轻了TGF-β1诱导肺成纤维细胞的收缩能力, 提示蓝萼甲素能抑制TGF-β1刺激肺成纤维细胞向肺肌成纤维细胞的转化。
|
Figure 3 GLA ameliorated TGF-β1-induced MRC-5 cell-containing collagen gel contraction. Images of the MRC-5 cell-containing collagen gels treated by GLA (4 μmol·L-1) for 48 h were captured and the surface areas of the gels were determined. n = 3, x ± s. #P < 0.05 vs control group; *P < 0.05 vs Veh+TGF-β1 group |
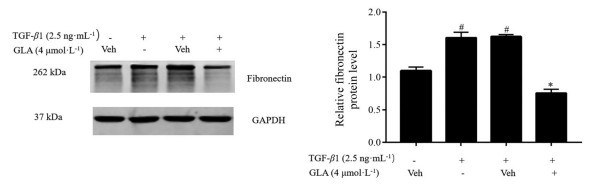
FN是由肺成纤维细胞及肌成纤维细胞分泌的重要细胞外基质 (extracellular matrix, ECM) 蛋白之一。本研究检测了蓝萼甲素作用于TGF-β1刺激的MRC-5细胞48 h后FN的表达情况。Western blot实验结果表明, TGF-β1诱导肺成纤维细胞转化中FN的表达水平显著上调, 而蓝萼甲素可明显降低TGF-β1刺激的MRC-5细胞中的FN表达水平(图 4)。以上结果提示, 蓝萼甲素能抑制TGF-β1刺激肺成纤维细胞MRC-5细胞转化中细胞外基质的生成。
|
Figure 4 GLA suppressed TGF-β1-stimulated extracellular matrix production in lung fibroblasts. The levels of fibronectin expression in TGF-β1-stimulated MRC-5 cells treated with 4 μmol·L-1 of GLA for 48 h were determined by Western blot. n = 3, x ± s. #P < 0.05 vs control group; *P < 0.05 vs Veh+TGF-β1 group |
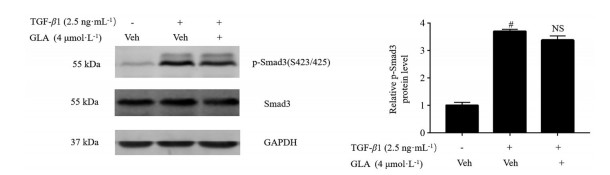
TGF-β1/Smad3信号传导在纤维化发病机制中起重要作用, 该途径是抗纤维化治疗的潜在靶标[10]。本研究分析了蓝萼甲素对TGF-β1诱导MRC-5细胞转化过程中Smad3磷酸化水平的变化情况。如图 5所示, TGF-β1诱导的MRC-5细胞中Smad3磷酸化水平显著升高, 而蓝萼甲素对TGF-β1诱导MRC-5细胞中Smad3的磷酸化水平无显著影响。以上结果提示, 蓝萼甲素不通过经典的TGF-β1/Smad3途径干预肺成纤维细胞转化。
|
Figure 5 GLA did not affect the phosphoration of Smad3 in TGF-β1-stimulated MRC-5 cells. The phosphorylation levels of Smad3 in TGF-β1 (2.5 ng·mL-1)-stimulated MRC-5 cells with/without 4 μmol·L-1 of GLA for 1 h were determined by Western blot analysis. n = 3, x ± s. #P < 0.05 vs control group. NS: No significance vs Veh+TGF-β1 group |
已有文献报道, ERK途径的激活参与了肺成纤维细胞向肺肌成纤维细胞转化的过程[11]。为探究蓝萼甲素抑制肺成纤维细胞转化的作用是否与ERK1/2通路有关, 本研究检测了蓝萼甲素对TGF-β1刺激MRC-5细胞中的ERK1/2磷酸化水平的影响。如图 6所示, 与对照组相比, TGF-β1刺激的MRC-5细胞中的ERK1/2磷酸化水平显著上调, 而蓝萼甲素对TGF-β1刺激MRC-5细胞中ERK1/2的磷酸化水平无显著影响, 提示蓝萼甲素抑制肺成纤维细胞转化的作用与ERK途径无关。

|
Figure 6 GLA did not affect the phosphoration of extracellular regulated protein kinases (ERK) 1/2 in TGF-β1-stimulated MRC-5 cells. The phosphorylation levels of ERK1/2 in TGF-β1-stimulated MRC-5 cells with/without 4 μmol·L-1 of GLA were determined by Western blot analysis. n = 3, x ± s. #P < 0.05 vs control group. NS: No significance vs Veh+TGF-β1 group |
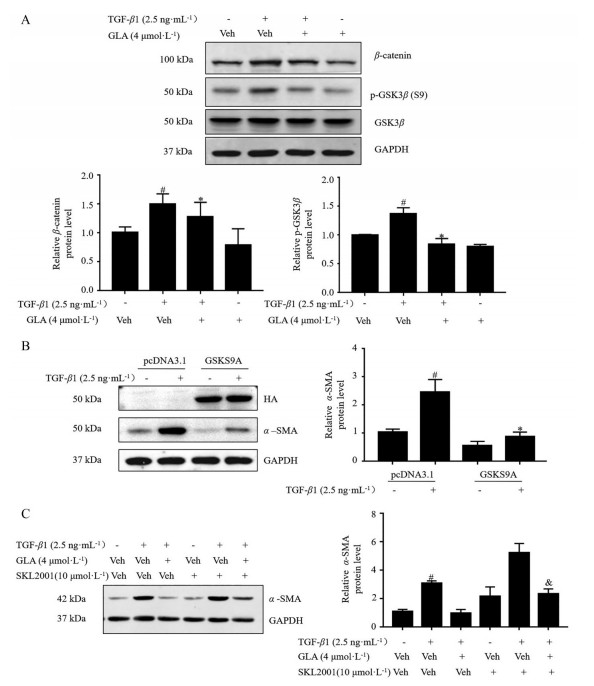
GSK3β/β-连环蛋白(β-catenin) 是肺成纤维细胞激活转化的重要调节信号通路之一[12, 13]。为研究蓝萼甲素是否通过调节GSK3β/β-catenin表达发挥抑制肺成纤维细胞转化的作用, 本研究首先检测了蓝萼甲素对TGF-β1刺激MRC-5细胞中GSK3β/β-catenin表达水平的影响。结果发现, 与对照组相比, TGF-β1显著上调肺成纤维细胞中GSK3β (S9) 磷酸化水平和β-catenin的表达水平, 而蓝萼甲素可明显降低TGF-β1刺激的肺成纤维细胞中GSK3β (S9) 的磷酸化水平和β-catenin的表达水平 (图 7A)。进一步应用GSK3β (S9A) 突变体处理TGF-β1刺激的肺成纤维细胞。如图 7B所示, GSK3β (S9A) 突变体, 即GSK3β (S9) 不能被磷酸化的突变体, 的确能明显抑制TGF-β1诱导肺成纤维细胞向肺肌成纤维细胞的转化。同时, 本研究联合应用β-catenin激活剂SKL2001[14]处理TGF-β1刺激的肺成纤维细胞, 观察肺成纤维细胞的转化情况。如图 7C所示, β-catenin激活剂SKL2001能部分逆转蓝萼甲素抑制肺成纤维细胞转化的作用。上述结果提示, 蓝萼甲素的确可以通过下调GSK3β/β-catenin通路的表达, 从而发挥抑制TGF-β1诱导的肺成纤维细胞转化的作用。
|
Figure 7 GLA repressed TGF-β1-stimulated lung fibroblast differentiation via the down-regulation of GSK3β/β-catenin. A: MRC-5 cells were treated with or without TGF-β1 and 4 μmol·L-1 of GLA for 48 h. The levels of GSK3β (S9) phosphorylation and β-catenin were determined by Western blot analysis; B: The protein levels of α-SMA in TGF-β1-stimulated MRC-5 cells with/without GSK3β (S9A) mutant for 48 h were determined by Western blot analysis; C: MRC-5 cells were treated with or without TGF-β1, 4 μmol·L-1 of GLA and 10 μmol·L-1 SKL2001 for 48 h. The expression levels of α-SMA were determined by Western blot analysis. n = 3, x ± s. #P < 0.05 vs control group; *P < 0.05 vs Veh+TGF-β1 group; & P < 0.05 vs GLA-treated group |
肺成纤维细胞激活转化为肺肌成纤维细胞, 并在此过程中生成大量的细胞外基质是肺纤维化疾病的主要病理特征之一。发现活性化合物干预肺成纤维细胞分化是获得肺纤维化疾病候选药物的重要手段。同时研究这些活性化合物的分子作用机制, 这是优化已有抗肺纤维化活性化合物和发现潜在肺纤维化药物治疗靶点的必由途径。Yang等[9]前期研究发现, 蓝萼甲素能够改善小鼠肺纤维化症状, 但蓝萼甲素抗肺纤维化的作用机制仍不清楚。本研究从肺成纤维细胞转化、肺成纤维细胞中肌丝纤维的形成、肺成纤维细胞转化后收缩力的改变以及细胞外基质生成等多个角度发现蓝萼甲素能明显抑制TGF-β1诱导的肺成纤维细胞向肺肌成纤维细胞转化。
TGF-β1在肺纤维化发生发展过程中主要通过激活下游经典的Smad蛋白信号通路和非经典信号通路, 诱导肺成纤维细胞转化为肌成纤维细胞, 同时促进细胞外基质的大量生成。Smad3是经典TGF-β1/Smad信号通路中的关键活化蛋白[10, 15-17], 但本研究结果发现蓝萼甲素对TGF-β1诱导的肺成纤维细胞中Smad3磷酸化水平没有明显影响, 提示蓝萼甲素抗肺纤维化作用可能与经典的TGF-β1/Smad3信号通路无关。众所周知, ERK能够促进肺成纤维细胞激活转化[18], 是TGF-β1非经典信号通路中的一个重要分子。因此, 本文研究了蓝萼甲素对TGF-β1刺激后的肺成纤维细胞中的ERK1/2磷酸化的变化情况, 但结果表明蓝萼甲素对肺成纤维细胞中ERK1/2磷酸化也没有明显影响。
GSK3β/β-catenin是一种常见的细胞信号通路, 是多种细胞信号通路的调控汇合的中枢[13], 参与机体的多种器官纤维化的分子调控, 在肺成纤维细胞转化成肺肌成纤维细胞中也发挥着重要作用。本研究发现, 蓝萼甲素能明显下调TGF-β1诱导肺成纤维细胞中GSK3β (S9) 磷酸化和β-catenin的表达水平, 并发现GSK3β (S9A) 突变体能显著抑制肺成纤维细胞转化, 而联合β-catenin激活剂可部分逆转蓝萼甲素抑制肺成纤维细胞转化的作用。
综上所述, 本研究发现蓝萼甲素能够显著抑制肺成纤维细胞向肺肌成纤维细胞转化, 这与蓝萼甲素下调GSK3β/β-catenin信号相关, 而与Smad3活化以及ERK1/2活性无关, 这丰富了蓝萼甲素的药理作用内涵, 为蓝萼甲素的应用研究提供了理论线索。
作者贡献: 朱含月、朱媚负责实验研究; 陈喜华负责部分实验数据分析及细胞培养工作; 蒋小岗负责实验设计和论文书写工作。
利益冲突: 所有作者均声明无任何利益冲突。
| [1] |
Li Y, Lv X, Liu C, et al. Pirfenidone and nintedanib inhibit the lung alveolar regeneration in chronic pulmonary fibrosis mouse[J]. Acta Pharm Sin (药学学报), 2020, 55: 861-867. |
| [2] |
Henderson NC, Rieder F, Wynn TA. Fibrosis: from mechanisms to medicines[J]. Nature, 2020, 587: 555-566. DOI:10.1038/s41586-020-2938-9 |
| [3] |
Carthy JM. TGFbeta signaling and the control of myofibroblast differentiation: implications for chronic inflammatory disorders[J]. J Cell Physiol, 2018, 233: 98-106. DOI:10.1002/jcp.25879 |
| [4] |
Kendall RT, Feghali-Bostwick CA. Fibroblasts in fibrosis: novel roles and mediators[J]. Front Pharmacol, 2014, 5: 123. |
| [5] |
Zhu S, Zhang J, Lv Y. Glaucocalyxin A inhibits hydrogen peroxide-induced oxidative stress and inflammatory response in coronary artery smooth muscle cells[J]. Clin Exp Pharmacol Physiol, 2020, 47: 765-770. DOI:10.1111/1440-1681.13253 |
| [6] |
Hou X, Xu G, Wang Z, et al. Glaucocalyxin A alleviates LPS-mediated septic shock and inflammation via inhibiting NLRP3 inflammasome activation[J]. Int Immunopharmacol, 2020, 81: 106271. DOI:10.1016/j.intimp.2020.106271 |
| [7] |
Liu HC, Qiao LM, Zheng W, et al. Synthesis and cytotoxicity assessment of novel 7-O- and 14-O-derivatives of glaucocalyxin A[J]. Anticancer Agents Med Chem, 2020, 20: 1241-1249. DOI:10.2174/1871520620666200302114550 |
| [8] |
Chen J, Zhang W, Pan C, et al. Glaucocalyxin A induces cell cycle arrest and apoptosis via inhibiting NF-κB/p65 signaling pathway in melanoma cells[J]. Life Sci, 2021, 271: 119185. DOI:10.1016/j.lfs.2021.119185 |
| [9] |
Yang F, Cao Y, Zhang J, et al. Glaucocalyxin A improves survival in bleomycin-induced pulmonary fibrosis in mice[J]. Biochem Biophys Res Commun, 2017, 482: 147-153. DOI:10.1016/j.bbrc.2016.11.003 |
| [10] |
Hu B, Wu Z, Phan SH. Smad3 mediates transforming growth factor-beta-induced alpha-smooth muscle actin expression[J]. Am J Respir Cell Mol Biol, 2003, 29: 397-404. DOI:10.1165/rcmb.2003-0063OC |
| [11] |
Ghatak S, Markwald RR, Hascall VC, et al. Transforming growth factor beta1 (TGFbeta1) regulates CD44V6 expression and activity through extracellular signal-regulated kinase (ERK)-induced EGR1 in pulmonary fibrogenic fibroblasts[J]. J Biol Chem, 2017, 292: 10465-10489. DOI:10.1074/jbc.M116.752451 |
| [12] |
Lu F, Sun X, Xu X, et al. SILAC-based proteomic profiling of the suppression of TGF-beta1-induced lung fibroblast-to-myofibroblast differentiation by trehalose[J]. Toxicol Appl Pharmacol, 2020, 391: 114916. DOI:10.1016/j.taap.2020.114916 |
| [13] |
Baarsma HA, Engelbertink LH, van Hees LJ, et al. Glycogen synthase kinase-3 (GSK-3) regulates TGF-beta(1)-induced differentiation of pulmonary fibroblasts[J]. Br J Pharmacol, 2013, 169: 590-603. DOI:10.1111/bph.12098 |
| [14] |
Gwak J, Hwang SG, Park HS, et al. Small molecule-based disruption of the Axin/beta-catenin protein complex regulates mesenchymal stem cell differentiation[J]. Cell Res, 2012, 22: 237-247. DOI:10.1038/cr.2011.127 |
| [15] |
Pan X, Li J, Tu X, et al. Lysine-specific demethylase-1 regulates fibroblast activation in pulmonary fibrosis via TGF-beta1/Smad3 pathway[J]. Pharmacol Res, 2020, 152: 104592. DOI:10.1016/j.phrs.2019.104592 |
| [16] |
Guo J, Fang Y, Jiang F, et al. Neohesperidin inhibits TGF-beta1/Smad3 signaling and alleviates bleomycin-induced pulmonary fibrosis in mice[J]. Eur J Pharmacol, 2019, 864: 172712. DOI:10.1016/j.ejphar.2019.172712 |
| [17] |
Wang C, Chen J, Jiang M, et al. Relationship between artesunate influence on the process of TGF-β1 induced alveolar epithelial cells transform into mesenchymal cells and on idiopathic pulmonary fibrosis[J]. Acta Pharm Sin (药学学报), 2014, 49: 142-147. |
| [18] |
Weng J, Tu M, Wang P, et al. Amiodarone induces cell proliferation and myofibroblast differentiation via ERK1/2 and p38 MAPK signaling in fibroblasts[J]. Biomed Pharmacother, 2019, 115: 108889. DOI:10.1016/j.biopha.2019.108889 |
 2021, Vol. 56
2021, Vol. 56


