2. 广州医科大学, 呼吸疾病国家重点实验室, 广东 广州 510180
2. State Key Laboratory of Respiratory Diseases, Guangzhou Medical University, Guangzhou 510180, China
肺纤维化(pulmonary fibrosis) 是一类慢性进展性、致死性的纤维化肺疾病, 也是许多慢性肺疾病的共同结局, 其治疗困难, 预后差, 患者平均生存期仅为3~5年[1]。肺纤维化的发病原因有多种, 如肺部感染、吸烟、放疗、化疗、环境或职业污染源、遗传因素等, 此外, 一些基础疾病如肥胖、糖尿病、胃食管反流病、肺动脉高压、自身免疫病等也会诱发肺纤维化[2]。由于肺纤维化早期临床症状不明显, 容易漏诊, 确诊时多数为纤维化中晚期, 患者肺功能持续性下降最终会引起缺氧、呼吸衰竭, 因而对患者危害很大。尽管目前已有吡非尼酮(pirfenidone) 和尼达尼布(nintedanib) 两个治疗肺纤维化的新药, 但这两种药物价格昂贵, 长期服药对于普通患者难以承受, 同时还存在肝毒性等不良反应。因此, 研发新的经济、高效、低毒的抗肺纤维化药物十分必要。
异佛司可林(isoforskolin, ISOF) 是从滇产植物毛喉鞘蕊花(Coleus forskohlii) 提取的半日花烷型二萜类化合物, 为印度同种植物成分佛司可林(forskolin, FSK) 的异构体, 具有平喘、强心、降低眼压、抗肿瘤和抗HIV活性等多种药理作用[3, 4]。研究发现, 异佛司可林能够通过抑制炎症细胞因子释放明显减轻脂多糖诱导的急性肺损伤[5]。肺纤维化的早期病理表现与急性肺损伤相似, 均为肺部炎症病变。因而, 作者推测异佛司可林对肺纤维化可能有治疗作用。本研究采用博莱霉素诱导肺小鼠纤维化模型, 探讨异佛司可林对肺纤维化的治疗作用, 并初步探讨其作用机制。
材料与方法实验动物 健康雄性SPF (specific pathogen free) 级昆明小鼠100只, 体重(20 ± 2) g, 由昆明医科大学实验动物学部提供, 合格证号: SCSK (滇K2015-0002)。动物福利和实验过程均遵循昆明医科大学动物伦理委员会的规定。
试剂 博莱霉素(bleomycin, BLM) (浙江省海正辉瑞制药有限公司); 异佛司可林由实验室自制, 以佛司可林为原料, 采用碱性催化剂、二氯甲烷溶剂, 在适宜条件下进行乙酰基重排反应; 反应完成后过滤, 滤液合并后蒸馏得到粗品; 用一定配比及量的乙酸乙酯(EA) 和石油醚(PE) 结晶纯化, 制备得到纯度≥ 99%的高纯度异佛司可林。地塞米松磷酸钠注射液(遂成药业股份有限公司); 羟脯氨酸(hydroxyproline, HYP) 试剂盒(碱水解法) (南京建成生物工程研究所); Masson三色染色试剂盒(福州迈新生物技术开发有限公司); ELISA (enzyme-linked immunosorbent assay) 检测试剂盒为小鼠肿瘤坏死因子α (tumor necrosis factor α, TNF-α) (Invitrogen公司) 和小鼠白细胞介素1β (interleukin 1β, IL-1β)、GAPDH (glyceraldehyde-3-phosphate dehydrogenase)、二抗HRP-IgG (ProteinTech Group, Inc.); 兔抗小鼠转化生长因子β1 (transforming growth factor β1, TGF-β1) 抗体、结缔组织生长因子(connective tissue growth factor, CTGF) 抗体(Abcam公司); Stripping buffer (碧云天生物技术有限公司)。
实验用仪器 微量进样器(50 μL, 上海安亭微量进样器厂); Multiskan GO酶标仪(Thermo Scientific公司); Fluor Chem E System凝胶成像系统(American Protein Simple公司); Nikon eclipse Ni自动显微镜(Nikon公司)。
实验动物分组与处理 小鼠随机分为5组: ①假手术组: 小鼠暴露气管后, 气管滴入生理盐水; ②博莱霉素组: 一次性气管内缓慢滴入BLM 5 mg·kg-1; ③阳性药物对照组: 一次性气管注入BLM 5 mg·kg-1, 每天1次腹腔注射地塞米松磷酸钠(2.5 mg·kg-1) 生理盐水稀释液; ④异佛司可林低剂量组: 一次性气管注入BLM 5 mg·kg-1, 每天灌胃给予异佛司可林(2.5 mg·kg-1) 生理盐水稀释液; ⑤异佛司可林高剂量组: 与低剂量组处理方法相似, 其异佛司可林给药剂量为10 mg·kg-1。给药方式为气管内缓慢滴入博莱霉素当天开始, 每日给药1次, 连续给药28天。异佛司可林的给药剂量依据其防治小鼠急性肺损伤的给药剂量[5]进行减半和加倍作为低剂量和高剂量。每组20只, 分别于术后7和28天分两批各处死10只, 其中5只行气管灌洗收集肺泡灌洗液(bronchoalveolar lavage fluid, BALF), 另5只取肺组织行病理学、羟脯胺酸及Western blot等检测。
肺纤维化模型建立 实验小鼠用4%水合氯醛10 µL·g-1体重腹腔注射麻醉, 仰卧固定。无菌条件下, 颈前正中切开颈部皮肤、暴露气管, 用无菌注射器经气管软骨环间隙注入BLM 5 mg·kg-1, 注药后将小鼠直立并360度旋转2周使BLM均匀分布于肺内, 缝合切口, 置于SPF动物室内饲养观察。分别于术后7和28天后处死, 检测各项指标。
肺组织形态学观察 分别采用H & E染色和Masson染色, 显微镜下观察肺组织炎症和胶原纤维沉积情况。H & E染色: 将各组小鼠左肺组织以10%中性甲醛固定24 h后, 浸入系列浓度的乙醇溶液进行脱水, 二甲苯透明, 常规石蜡包埋、切片机切片, 厚度约5 μm平铺于载玻片上, 60 ℃恒温箱烘烤20~30 min, 常规脱蜡、水化, 苏木素染色2~5 min, 伊红染色1 min, 二甲苯透明、中性树胶封片。Masson染色: 切片后常规烤片、脱蜡、透明、脱水(同H & E染色), Masson复合染色液染色5 min, 冲洗后依次滴加磷钼酸、苯胺蓝、分化液, 常规脱水、透明、封片。
肺组织HYP含量测定 麻醉处死小鼠后开胸取出左肺上叶称取50 mg肺组织, 按肺重量(mg) ∶体积(mL) = 1∶19比例加入生理盐水, 然后迅速置于冰上, 使用匀浆器尽可能将肺组织充分碾碎, 研磨成5%的组织匀浆。采用碱水解法测定肺组织HYP含量, 严格按试剂盒说明书操作。
双抗体夹心法 (ELISA) 测定BALF中TNF-α、IL-1β含量 每组另取5只小鼠分别于术后7和28天处理, 麻醉后, 剪开颈部皮肤, 暴露气管, 气管远心端剪一小口, 插入导管固定, 注入预冷的生理盐水1 mL, 停留约30 s后回抽, 灌洗3次。BALF回收率70%~90%, 将灌洗液1 500 r·min-1离心10 min, 取上清液行ELISA检测BALF中TNF-α、IL-1β水平, 按试剂盒说明书操作。
Western blot检测肺组织TGF-β1及CTGF蛋白表达 将各组小鼠的右肺叶组织取出, 标本离体后冰上常规匀浆、离心制备组织蛋白抽提液, 以BCA法检测总蛋白含量并定量变性。上样变性蛋白(每孔40 μg) 于12% SDS-PAGE电泳, 半干式转膜(PVDF膜, 15 V恒压30 min), 5%脱脂奶粉TBST封闭液封闭2 h, TBST缓冲液充分振荡清洗, 分别滴加一抗(TGF-β 1∶1 000, CTGF 1∶1 000, GAPDH 1∶10 000) 及二抗(HRP-IgG, 1∶10 000), DAB显色, FluorChem E System拍照, ScnImage软件进行图像分析, 与内参条带灰度比值表示其蛋白相对表达量。先行CTGF显影后, stripping buffer洗膜5 min, 继续5%脱脂奶粉封闭等过程, 再次显影GAPDH蛋白。
统计学处理 计量资料以均数士标准差(x ± s) 表示, 采用SPSS17.0软件进行统计分析, 多组间比较采用单因素方差分析(ANOVA), 进一步组间两两比较采用q检验。P < 0.05为差异显著性有统计学意义。
结果 1 异佛司可林明显减轻肺纤维化小鼠肺组织炎症病变气管滴入博莱霉素7天, 假手术组肺组织基本正常, 未见明显的炎性细胞浸润。博莱霉素组肺泡腔广泛性缩小甚至消失, 肺泡壁明显增宽, 大量炎性细胞浸润肺泡间质及肺泡腔, 肺泡壁毛细血管扩张、淤血。阳性药物组肺内有轻度肺泡上皮细胞增生, 局部有炎症细胞浸润。异佛司可林低剂量组的肺组织病理与博莱霉素组比较未见明显改变, 异佛司可林高剂量组可见局灶性肺泡壁增宽, 局部炎症细胞浸润(图 1A~E)。气管滴入博莱霉素28天, 博莱霉素组小鼠肺组织出现片状肺实变, 提示肺纤维化形成; 阳性药物组小鼠肺组织有轻度肺泡上皮细胞增生和少量炎症细胞浸润。异佛司可林低剂量组小鼠肺组织出现局部肺实变, 异佛司可林高剂量组小鼠肺组织有少量炎症细胞浸润, 未见肺实变(图 1F~J)。
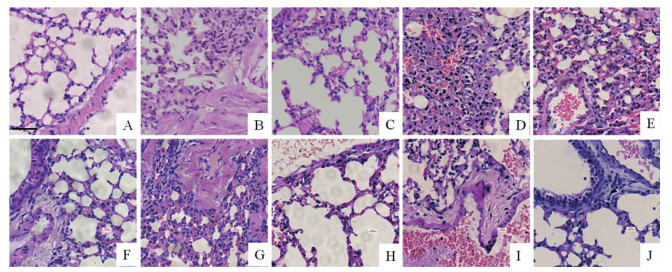
|
Figure 1 Hematoxylin-eosin (H & E)-stained lung sections of mice in each group on the 7th and 28th day after bleomycin (BLM) induction. A-E: Sham group, BLM group, dexamethasone (DXM, the positive drug control) group, isoforskolin (ISOF) group (2.5 mg·kg-1), and ISOF group (10 mg·kg-1) on the 7th day after BLM induction; F-J: Sham group, BLM group, DXM group, ISOF group (2.5 mg·kg-1), and ISOF group (10 mg·kg-1) on the 28th day after BLM induction. Scale bar = 50 μm |
气管滴入博莱霉素7天, 假手术组小鼠肺组织结构基本正常, 博莱霉素组小鼠肺组织肺泡腔变小或消失, 肺泡壁明显增宽, 但肺组织内胶原纤维沉积(蓝染部分) 不明显, 表明气管滴入博莱霉素1周主要为纤维化早期炎症反应阶段, 异佛司可林低剂量组小鼠肺泡腔缩小和肺间隔增厚较模型组略有减轻, 但局部胶原纤维沉积明显, 异佛司可林高剂量组小鼠肺组织未见明显肺泡腔缩小和肺间隔增厚, 局部可见胶原纤维沉积(图 2A~E), 提示异佛司可林短期给药可能通过抑制炎症反应促进组织修复而缩短了肺纤维化的自然进程。气管滴入博莱霉素28天, 博莱霉素组小鼠肺组织有弥漫性胶原纤维沉积, 表明肺纤维化形成, 阳性药物组未见明显的胶原纤维沉积, 异佛司可林低剂量组小鼠肺局灶性有胶原纤维沉积, 异佛司可林高剂量组小鼠肺内未见明显胶原纤维沉积(图 2F~J), 提示异佛司可林长期给药能够明显抑制肺纤维化后期组织过度修复引起纤维化。
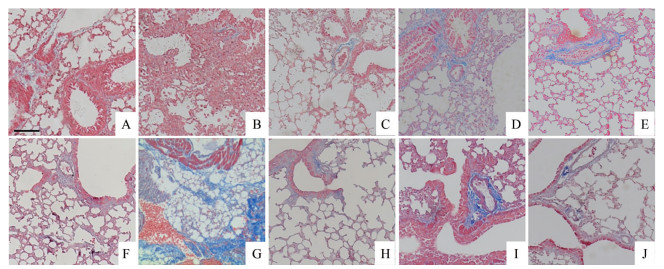
|
Figure 2 Masson-stained lung sections of mice in each group on the 7th and 28th day after BLM induction. A-E: Sham group, BLM group, DXM group, ISOF (2.5 mg·kg-1) group, and ISOF (10 mg·kg-1) group on the 7th day after BLM induction; F-J: Sham group, BLM group, DXM group, ISOF (2.5 mg·kg-1) group, and ISOF (10 mg·kg-1) group on the 28th day after BLM induction. Scale bar = 100 μm |
假手术组小鼠的肺组织羟脯氨酸含量在气管内滴入生理盐水后7和28天无明显改变; 博莱霉素组小鼠的肺组织羟脯氨酸含量在气管内滴入博莱霉素后7和28天均明显高于假手术组, 且28天时的肺组织羟脯氨酸含量明显高于7天的, 差异有统计学意义(P < 0.05), 表明肺纤维化模型制备成功; 与博莱霉素组比较, 异佛司可林低剂量组小鼠的肺组织羟脯氨酸含量在气管内滴入博莱霉素后7和28天有所降低, 但差异无统计学意义(P > 0.05); 阳性药物组和异佛司可林高剂量组在气管内滴入博莱霉素后7和28天均明显低于纤维化模型组, 表明异佛司可林对肺纤维化有一定的防治作用(图 3)。
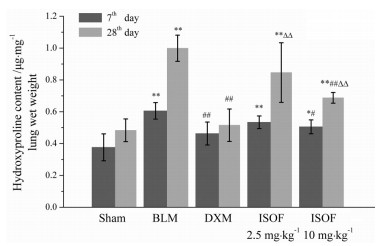
|
Figure 3 Effects of ISOF on hydroxyproline content in lung tissues. n = 5, x ± s. *P < 0.05, **P < 0.01 vs sham group; #P < 0.05, ##P < 0.01 vs BLM group; △△P < 0.01 vs DXM group |
与假手术组比较, 博莱霉素组的肺组织TGF-β1和CTGF蛋白表达在气管滴入博莱霉素后7和28天明显上调, 差异有统计学意义(P < 0.05); 与博莱霉素组比较, 异佛司可林低剂量组小鼠的肺组织TGF-β1和CTGF蛋白表达有所降低, 但差异无统计学意义(P > 0.05); 与博莱霉素组比较, 阳性药物组和异佛司可林高剂量组小鼠的肺组织TGF-β1和CTGF蛋白表达明显降低, 差异有统计学意义(P < 0.05) (图 4)。

|
Figure 4 Effects of ISOF on transforming growth factor β1 (TGF-β1) and connective tissue growth factor (CTGF) protein expression in lung tissues on the 7th and 28th day after BLM induction. The protein expression of TGF-β1 and CTGF was evaluated by Western blot, glyceraldehyde-3-phosphate dehydrogenase (GAPDH) was used as control. A: Relative expression of TGF-β1; B: Relative expression of CTGF; C, D: Representative pictures of Western blot of TGF-β1 and CTGF. n = 5, x ± s. *P < 0.05, **P < 0.01 vs sham group; #P < 0.05, ##P < 0.01 vs BLM group; △P < 0.05 vs DXM group |
与假手术组比较, 博莱霉素组小鼠BALF中TNF-α和IL-1β含量在气管滴入博莱霉素后7和28天明显升高, 差异有统计学意义(P < 0.05); 与博莱霉素组比较, 异佛司可林低剂量组小鼠BALF中TNF-α含量在气管滴入博莱霉素后7和28天有所下降, 但差异无统计学意义(P > 0.05), BALF中IL-1β含量在气管滴入博莱霉素后7天明显下降, 差异有统计学意义(P < 0.05), 而在气管滴入博莱霉素后28天略有降低, 差异无统计学意义(P > 0.05); 与博莱霉素组比较, 阳性药物组和异佛司可林高剂量组小鼠BALF中TNF-α和IL-1β含量在气管滴入博莱霉素后7和28天均明显降低, 差异有统计学意义(P < 0.05) (图 5)。

|
Figure 5 Effects of ISOF on the levels of TNF-α and IL-1β in bronchoalveolar lavage fluid (BALF) on the 7th and 28th day after BLM induction. A: TNF-α; B: IL-1β. n = 5, x ± s. *P < 0.05, **P < 0.01 vs sham group; #P < 0.05, ##P < 0.01 vs BLM group; △P < 0.05, △△P < 0.01 vs DXM group |
肺纤维化是一种慢性进展性疾病, 近年来国内发病率呈逐年上升的趋势。不同国家地区对于肺纤维化患者的5年生存率的报道不一, 我国肺纤维化患者5年生存率约为30%[6]。肺纤维化的本质是肺组织损伤与修复失衡导致肺组织修复过度引起的组织异常重构, 其病理特征为早期肺上皮细胞损伤和肺泡炎, 后期大量成纤维细胞增殖分化及细胞外基质异常堆积, 破坏正常肺结构, 引起肺实质增厚与瘢痕形成[7]。博莱霉素素诱导小鼠肺纤维化模型是最常用的肺纤维化模型, 单次气管滴注博莱霉素通常在最初7天引起炎症反应和上皮细胞凋亡, 随后进入慢性炎症和纤维增生期[8]。本研究采用单次气管滴注博莱霉素诱导小鼠肺纤维化模型, 病理检测发现模型小鼠给予博莱霉素第7天肺组织主要为炎症病变, 第28天肺组织为纤维化改变, 大量胶原纤维沉积于肺组织, 这与肺纤维化的病理进程一致, 表明肺纤维化模型制作成功; 异佛司可林高剂量组(10 mg·kg-1) 小鼠肺组织炎症改变以及胶原纤维沉积均明显改善, 表明异佛司可林对肺纤维化早期炎症和后期纤维化均有抑制作用。
研究发现, 异佛司可林能够通过下调炎症细胞因子IL-1β和TNF-α蛋白表达而减轻脂多糖诱导的人单核白细胞炎症反应[9]。异佛司可林还可通过下调炎症细胞因子TNF-α和IL-6的表达而抑制伯氏疏螺旋体碱性膜蛋白A诱导的鼠巨噬细胞、人巨噬细胞和树突状细胞炎症反应[10]。本研究发现, 博莱霉素组小鼠BALF中炎症细胞因子TNF-α和IL-1β水平明显高于假手术组, 而异佛司可林高剂量组(10 mg·kg-1) 小鼠BALF中TNF-α和IL-1β水平明显低于博莱霉素组, 表明异佛司可林能够抑制肺纤维化小鼠肺组织炎症细胞因子释放, 这与上述体外细胞炎症模型研究结果一致。
TGF-β1是目前已知最强效的致纤维化因子, 通过激活下游的Smad信号转导因子, 在各种器官组织纤维化中发挥着至关重要的作用[11]。因此, TGF-β1是抗纤维化治疗的一个关键靶标, 通过下调TGF-β1蛋白表达以及抑制TGF-β1/Smad信号通路可以减轻肺纤维化病变[12]。研究发现, 在血小板源生长因子(platelet derived growth factor, PDGF) 刺激的大鼠气道平滑肌细胞水平和卵清蛋白诱导的大鼠哮喘模型上, 异佛司可林能够下调促纤维化细胞因子TGF-β1蛋白表达, 从而发挥抗气道重构的作用[13]。本研究蛋白表达结果发现, 与博莱霉素组比较, 异佛司可林高剂量组(10 mg·kg-1) 小鼠肺组织TGF-β1蛋白表达明显下调。CTGF也是一个强效致纤维化细胞因子, 其转录还受到TGF-β1的调控, 参与肺损伤的修复过程, 可促进细胞外基质的产生, 在肺纤维化的形成过程中发挥重要作用, 且在肺纤维化发生时CTGF与TGF-β1呈正相关, 均为过表达[14]。本研究发现, 与博莱霉素组比较, 异佛司可林高剂量组(10 mg·kg-1) 小鼠肺组织CTGF蛋白表达明显下调, 与TGF-β1蛋白表达趋势一致。羟脯氨酸是胶原纤维的标志性水解产物, 其含量可反映胶原纤维的含量, 继而间接反映组织纤维化程度。本研究发现, 与假手术组比较, 博莱霉素组小鼠肺组织羟脯氨酸含量明显升高, 与模型组比较, 异佛司可林高剂量组(10 mg·kg-1) 小鼠肺组织羟脯氨酸含量明显下降。上述结果表明, 异佛司可林可通过下调两个强致纤维化细胞因子TGF-β1和CTGF蛋白表达, 抑制肺组织胶原纤维沉积, 而发挥抗肺纤维化作用。
综上所述, 异佛司可林可通过抑制炎症细胞因子TNF-α和IL-1β释放, 下调促纤维化因子TGF-β和CTGF蛋白表达, 通过抗炎与抗纤维化双重作用发挥抗肺纤维化作用, 其抗肺纤维化的确切作用机制有待进一步研究。
作者贡献: 张旋负责实验研究和论文撰写; 肖创、黄蓉、邹澄、陈骋、王永艳、陈晨、李鲜参与部分实验研究; 杨子峰参与论文修改; 杨为民负责实验设计和论文修改。
利益冲突: 本文作者之间无利益冲突。
| [1] |
Nair GB, Matela A, Kurbanov D, et al. Newer developments in idiopathic pulmonary fibrosis in the era of anti-fibrotic medications[J]. Expert Rev Respir Med, 2016, 10: 699-711. DOI:10.1080/17476348.2016.1177461 |
| [2] |
Kolahian S, Fernandez IE, Eickelberg O, et al. Immune mechanisms in pulmonary fibrosis[J]. Am J Respir Cell Mol Biol, 2016, 55: 309-322. DOI:10.1165/rcmb.2016-0121TR |
| [3] |
Zhao JK, Yang WM, Yang ZB, et al. Study on general pharmacology of forskolin and isoforskolin[J]. J Kunming Med Univ (昆明医科大学学报), 2014, 35: 37-40. |
| [4] |
Wang YQ, Yin JJ, Mao YC, et al. Metabolism and degradation of isoforskolin in human liver microsomes and artificial gastrointestinal fluid[J]. Chin Tradit Pat Med (中成药), 2016, 38: 1244-1248. |
| [5] |
Yang W, Qiang D, Zhang M, et al. Isoforskolin pretreatment attenuates lipopolysaccharide-induced acute lung injury in animal models[J]. Int Immunopharmacol, 2011, 11: 683-692. DOI:10.1016/j.intimp.2011.01.011 |
| [6] |
Lv X, Li K, Hu Z. Autophagy and pulmonary fibrosis[J]. Adv Exp Med Biol, 2020, 1207: 569-579. |
| [7] |
Malaviya R, Kipen HM, Businaro R, et al. Pulmonary toxicants and fibrosis: innate and adaptive immune mechanisms[J]. Toxicol Appl Pharmacol, 2020, 409: 115272. DOI:10.1016/j.taap.2020.115272 |
| [8] |
Wei PX, Wang WY, Li YX, et al. The cell cycle inhibitor p21 promote mouse lung fibrosis by activating alveolar macrophages[J]. Acta Pharm Sin (药学学报), 2020, 55: 1792-1800. |
| [9] |
Du X, Shi R, Wang Y, et al. Isoforskolin and forskolin attenuate lipopolysaccharide-induced inflammation through TLR4/MyD88/NF-κB cascades in human mononuclear leukocytes[J]. Phytother Res, 2019, 33: 602-609. DOI:10.1002/ptr.6248 |
| [10] |
Zhao H, Liu A, Shen L, et al. Isoforskolin downregulates proinflammatory responses induced by Borrelia burgdorferi basic membrane protein A[J]. Exp Ther Med, 2017, 14: 5974-5980. |
| [11] |
Hua HH, Chen DQ, Wang YN, et al. New insights into TGF-β/Smad signaling in tissue fibrosis[J]. Chem Biol Interact, 2018, 292: 76-83. DOI:10.1016/j.cbi.2018.07.008 |
| [12] |
Chen C, Zhang X, Hong ZP. Research progress of key cells and molecules in the formation of pulmonary fibrosis[J]. Basic Clin Med (基础医学与临床), 2018, 38: 1329-1332. |
| [13] |
Liang X, Wang J, Chen W, et al. Inhibition of airway remodeling and inflammation by isoforskolin in PDGF-induced rat ASMCs and OVA-induced rat asthma model[J]. Biomed Pharmacother, 2017, 95: 275-286. DOI:10.1016/j.biopha.2017.08.063 |
| [14] |
Liang RJ. Study on the effects of aerosolized budesonide on the expression of TGF-β and CTGF in lung tissue of rats with pulmonary fibrosis[J]. J North Pharm (北方药学), 2018, 15: 158-159. |
 2021, Vol. 56
2021, Vol. 56


