纤维化是世界性的医学难题, 到目前为止, 尚无治疗此病的特效药物。根据美国相关统计资料显示, 因纤维化疾病所引起的死亡占该国所有死亡人数的45%[1]。纤维化的病因主要是由于组织受到损伤后, 过度产生的瘢痕超出了正常伤口愈合反应, 导致持续性的损伤、实质细胞死亡, 进而引起组织炎症、巨噬细胞活化及免疫细胞浸润等反应[2]。纤维化的形成不是一个单向的简单过程, 它的消退需要多个程序, 包括减轻慢性组织损伤和炎症反应同时使肌成纤维细胞逐渐失活等[3]。尽管在过去的几十年里已进行了大量的临床前研究, 但目前批准用于临床治疗纤维化的有效疗法仍较少[4]。因此, 阐明纤维化的发病机制对治疗该疾病至关重要。目前已发现当器官或组织发生纤维化时会出现以下病理性特征, 如自噬功能障碍, 发生氧化应激(oxidative stress, OS), 成纤维细胞过度增殖、上皮-间质转化(epithelial-mesenchymal transition, EMT) 以及成纤维细胞向肌成纤维细胞分化(fibroblast-to-myofibroblast differentiation, FMD) 等[5-10]。因此, 寻求以上病理特征之间的共性成为本综述重点讨论的内容。
如今, 随着生活质量的提升, 人类对食物的摄入量远远超越机体本身的需求量, 这使体内能量失衡导致肥胖、衰老和2型糖尿病的发生。因此, 对能量代谢调节分子腺苷酸活化蛋白激酶(AMP-activated protein kinase, AMPK) 的深入研究对临床上治疗这些慢性代谢疾病至关重要[11]。AMPK作为机体内能量代谢调节剂和细胞生物传感器, 它可以控制细胞从合成代谢到分解代谢的转化。同时许多研究报告明确表示, 当组织或器官发生自噬功能被破坏、细胞外基质(extracellular matrix, ECM) 沉积、线粒体功能障碍和获得性凋亡时, AMPK活性丧失, 从而促进肌成纤维细胞的持续活化[12]。因此, 在纤维化区域中AMPK的表达显著下调。目前纤维化疾病的治疗, 不是通过阻断一个分子途径就可以有效控制的, 而是需要通过多个分子途径靶向纤维化中多种病理过程来开发更有效的药物。而根据纤维化的病理分子学的研究发现, AMPK是纤维化中一个关键的分子蛋白, 其参与到了纤维化防治的多种途径中[1]。因此, 本综述主要通过探讨AMPK在纤维化的多个病理过程中的作用机制, 来证明激活AMPK对纤维化疾病存在显著保护作用。
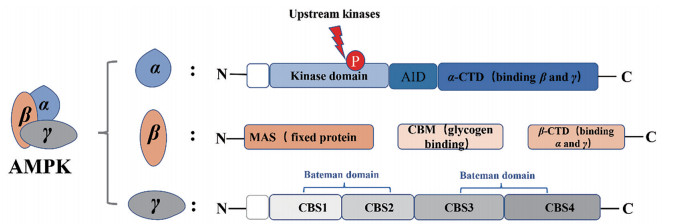
1 AMPK的简介 1.1 AMPK的结构高度进化保守的丝氨酸/苏氨酸蛋白激酶AMPK存在于真核细胞中。作为调节生物能的关键蛋白分子, 它主要通过调节细胞中ATP的浓度来维持细胞的新陈代谢[13-16]。AMPK是一个由3个亚基[α (PRKAA)、β (PRKAB) 和γ (PRKAG)] 组成的异源三聚体αβγAMPK复合物, 其中α亚基主要被上游蛋白激酶AMP激活为催化域。β和γ亚基是非催化域, 两者主要维持三聚体复合物的稳定性以及底物的特异性(图 1)[11, 17]。α亚基由N端和C端结构域组成, 两者大小基本一致。其中N端是催化核心区域, 含有自动抑制剂结构域(AID) 的常规激酶结构域, 它使α亚基能够处于无活性状态; 而C端含有与AID连接的α-亚基羧基末端结构域(α-CTD), 它主要负责与三聚体中的β和γ亚基结合[11]。β亚基的中心是糖原结合域, 称为碳水化合物结合模板(CBM), 它将AMPK的近端结合到作用基质中的糖原合成酶上, 进而调节糖原代谢。此外, β亚基N端的十四烷酰化序列(MAS) 在蛋白质结合中起到重要作用, 而β亚基C末端结构域(β-CTD) 主要负责与α亚基C末端的α-CTD和γ结合, 构成AMPK的关键区域[18]。γ亚基含有4个胱硫醚β2合酶(CBS) 结构域, 这4个CBS结构域在所有的γ亚基上高度保守, 并为AMP/ATP创建了两个结合位点, 被称为Bateman域, 它们会分别和AMP/ATP结合, 并参与到导向细胞质、蛋白之间相互作用以及调节蛋白活性中[19]。
|
图 1 The structure of AMPK. AMPK: AMP-activated protein kinase; AID: α-Subunit carboxy terminal domian; CTD: C-Terminal domain; MAS: Myristyl acylation sequence; CBM: Carbohydrate binding template; CBS: Cystathionine beta 2 synthase |
AMPK作为生物体内的信号枢纽及细胞能量平衡的传感器, 它参与到多种细胞途径和疾病中[20]。目前, 已知降低AMPK的活性可诱发高血压、炎症反应、脂质代谢、胰岛素抵抗和纤维化等疾病[21-24]。此外, AMPK与多种生理和病理反应相关, 它在维持能量平衡、氧化还原平衡和生长方面发挥重要作用。如AMPK的活化会降低合成代谢(ATP消耗) 途径的速率, 同时增加分解代谢(ATP产生) 途径的速率, 进而维持能量达到平衡状态[25]。同时, AMPK参与到许多耗能的分子反应中, 如活化的AMPK会作用于癌基因c-myc或c-Jun N端激酶后面的caspase通路调节细胞凋亡过程, 并通过激活核因子κB (NF-κB) 促进OS介导的凋亡[26]。活化AMPK还有助于维持血管生成前的Akt信号通路, 进而促进血管生成; 并通过自身磷酸化来激活内皮型氧化氮合成酶使其生成一氧化氮(nitric oxide, NO), 用来调节血管产生明显张力[24]。AMPK可以通过影响cAMP介导的上皮氯化物的分泌来减少炎症细胞活化[27]。衰老的细胞与正常的细胞相比, AMP: ATP的比例会比正常细胞高2~3倍。因此, AMPK激活剂会诱导细胞产生衰老迹象, 促进β-半乳糖苷酶活性的表达[28]。
2 AMPK可改善纤维化疾病中多种病理过程 2.1 AMPK与自噬反应自噬近年来十分热门, 它最早在肝脏实验中被发现, 主要是细胞营养不良、压力或损伤时所造成的自我吞噬过程[29]。当发生自噬时, 自噬小体会吞噬受损细胞器或脂质以及结构发生异常(错误折叠) 的蛋白质, 然后与溶酶体相结合形成自噬溶酶体结构, 这将导致异常细胞组分被降解, 维持细胞正常功能及结构的完整性[30, 31]。已有研究报道, 自噬会参与到纤维化疾病的发展过程中, 但是在不同类型的疾病中, 自噬起到双刃剑的作用[32]。
自噬的初始阶段是VPS34-UPS15-Beclin1核心复合物的形成, 据报道, AMPK通过使自噬基因Beclin1的丝氨酸第93、96位磷酸化来影响VPS34的活性[33]。而激活自噬要求在吞噬细胞组装位点(PAS) 形成unc-51样激酶1 (ULK1) 复合物, 以允许其他自噬相关基因(Atg) 的募集和激活。ULK1作为自噬信号传导途径中的关键蛋白, 它会将上游营养素、雷帕霉素靶蛋白(mTORC1) 和AMPK与下游自噬小体完美地连接起来[34]。mTORC1和AMPK是主要的自噬调节剂, 它们可以感应并整合多种信号通路。mTORC1被认为是调节自噬的核心枢纽, 当细胞内营养充足的情况下, mTORC1会被激活, 并通过调节ULK1活性进而负调节自噬[29]。而当细胞内能量不足时, AMPK会被激活, 并作用于ULK1的不同位置(S317、S467、S555、T574、S637和S777) 使其磷酸化, 但这时被激活的ULK1会促进自噬, 导致细胞成分分解代谢并降解; 同时AMPK也可以通过抑制mTORC1来促进自噬[34, 35]。此外, AMPK还可以通过磷酸化细胞周期素依赖性蛋白激酶抑制因子(P27) 来阻断细胞周期蛋白依赖激酶, 从而诱导细胞自噬[25]。或通过调节转录因子(如FOXO3、BRD4和TFEB) 下游相关自噬基因的表达来间接增强自噬反应, 以及在网络中诱导破碎的线粒体来促进自噬迁移到受损的线粒体中[15]。作为调节自噬的关键分子途径—LKB1-AMPK-ULK1轴, 当小鼠在妊娠期暴露于炭黑纳米颗粒(CBNPs) 后可能通过破坏该自噬轴而加剧博来霉素(bleomycin, BLM) 诱导的后代肺纤维化反应[36]。在心肌纤维化中, 报道了人参总皂苷的主要成分chikusetsusaponin Ⅳa (CS), 通过激活AMPK, 抑制mTOR磷酸化, 进而增强自噬调节异丙肾上腺素诱导的心肌纤维化[37]。与减轻心肌纤维化的途径相同, AMPK会在代谢应激下被激活, 进而通过AMPK-mTORC1/ULK1通路介导自噬改善肾损伤, 防止进一步恶化为肾纤维化。如人参皂甙Rb1是通过AMPK/mTOR途径改善肾小管上皮细胞的自噬反应, 二甲双胍可能通过调节AMPK-mTOR-自噬轴来减少糖尿病肾病(DN) 损伤[38]。此外, 外源性的硫化氢(H2S) 可以通过SIRT6/AMPK信号通路激活自噬, 抑制心肌细胞衰老并改善糖尿病心肌纤维化[39]。Kim等[40]也发现一种广泛用于治疗高胆固醇血症的药物ezetimibe通过激活AMPK和TFEB核易位诱导自噬来改善小鼠的脂质积累、炎症和纤维化反应, 这与独立的mTOR作用和丝裂原活化蛋白激酶(MAPK)/ERK通路有关。而一种具有口服活性的合成脂联素受体激动剂AdipoRon, 通过激活上皮细胞中的AMPK/ULK1途径诱导细胞发生自噬, 预防高血压患者发生肾纤维化[35, 41]。在肝纤维化中, 也是通过AMPK信号激活自噬, 改善肝纤维化, 即姜黄素通过调节自噬上游信号通路AMPK和PI3K/Akt/mTOR, 导致肝细胞自噬活性增加[42]。同时, 在四氯化碳(CCl4) 诱导的肝纤维化大鼠中, 发现可以通过利用褪黑素激活AMPK, 来增强线粒体吞噬功能和线粒体生物合成功能从而改善肝纤维化[29, 42]。Acetylshikonin (AS) 通过AMPK/mTOR途径增加了蛋氨酸-胆碱缺乏(MCD) 饮食诱导的小鼠肝细胞自噬, 改善脂肪变性、炎症、肝损伤及纤维化[43]。术后关节纤维化是限制关节内手术发展的最大因素之一, 作为丹参关键活性成分的丹参酮IIA (Tan IIA), 已被用于治疗肺纤维化、肝纤维化和心肌纤维化等纤维化相关疾病。通过对兔术后关节纤维化的研究发现, Tan IIA对成纤维细胞增殖和迁移的抑制作用可能与PI3K和AMPK-mTOR信号通路介导的自噬有关[44]。因此在纤维化疾病中, AMPK通过增强自噬改善纤维化是被广泛探究和认可的, 同时AMPK/mTORC1也被认为是经典的激活自噬改善纤维化的信号通路。
2.2 AMPK与OS线粒体氧化磷酸化会产生活性氧(ROS)、一氧化氮合酶(NOS) 和活性氮(RNS), 机体在正常情况下, 它们都可以通过具有抗氧化作用的还原性硫氧还蛋白(Trx)、还原性谷胱甘肽(glutathione, GSH) 等物质清除。而当机体受到刺激时, ROS和RNS迅速大量产生, 超出自身的恢复能力, 破坏机体能量代谢与氧化还原之间的动态平衡, 进而引发OS。同时, ROS也会导致脂质和蛋白质的氧化损伤, 降低生物体的抗氧化防御功能, 导致机体发生炎症损伤, 产生ECM并诱发内皮功能障碍。因此, 机体内发生衰老和疾病的关键因素就包括OS的发生[45, 46]。
当机体受到刺激, 发生OS时, 增多的ROS和RNS可以直接或间接地激活AMPK, 同时被激活的AMPK也会参与到细胞氧化还原的调节中。因此, OS和AMPK之间存在相互调节关系。研究发现, ROS中主要包括代谢产生的过氧化氢(H2O2)、超氧阴离子(•O2) 及羟基自由基(•OH), 而H2O2会使细胞内的ATP减少激活AMPK[47, 48]。同时基于AMPK作用于氧化还原的原理, 外源性H2O2增加AMPK的活性, 它的作用会独立于腺嘌呤核苷酸的变化, 是通过对AMPKα、β催化亚基中关键的半胱氨酸残基C299和C304进行氧化还原改变所引起的。而另有实验室研究表明外源性H2O2可以抑制AMPK[49]。以上这两种不同的结果可能源于方法学或生物学上的差异, 如测量腺嘌呤核苷酸的方法或所使用的细胞类型中不同水平下ROS的清除系统不同。另外, NO、NOS和RNS这些在OS下所产生的物质也都与AMPK的激活有关。在机体状态稳定的情况下, NO可上调Ca2+的表达, 进而引发钙调素依赖蛋白激酶的激酶β (CaMKKβ) 对AMPK活性的调节[50]。近期研究发现, 二甲双胍是多效抗氧化剂, 并且具有抗炎和抗增殖作用[51]。就抗氧化剂而言, 二甲双胍可通过激活AMPK减轻NADPH氧化酶和线粒体调节的ROS, 并促进超氧化物歧化酶(SOD) 的活性和SOD2的表达[52]。综上所述, OS和AMPK之间存在着密切的联系, 但两者之间是间接还是直接的作用关系, 仍需要大量的研究去证实。
目前发现在肾小管上皮细胞(TECs) 中, 二甲基精氨酸二甲基氨基水解酶(DDAH) 的其中一种亚型DDAH1缺乏时, 会增加OS的产生、减弱AMPK信号的传导并下调过氧化物酶5 (Prdx5) 的表达, 促使EMT进程, 进而诱导肾脏纤维化的发生[53]。此外, AMPK的激活会抑制NADPH氧化酶亚型4 (NOX4) 的表达, 减轻OS的发生, 改善多种器官和组织纤维化, 形成一条经典的AMPK/NOX4信号通路, 但是两者之间的具体作用位点还未见报道[54, 55]。目前有研究发现, 抑制OS是脂联素抗纤维化反应的主要机制。其中脂联素是通过激活AMPK通路而下调转化生长因子-β1 (transforming growth factor-beta1, TGF-β1) 和Ⅰ型胶原蛋白(collagen type I, Col-I) 的表达, 来减弱OS[56]。乙酰半胱氨酸(NAC) 通过AMPK/SIRT1/NF-κB通路减轻BLM诱导的氧化损伤改善肺纤维化[57]。人参皂苷Re (Gin-Re) 通过促进AMPKα磷酸化, 降低TGF-β1表达, 减弱Smad2/3活化减轻心肌梗死(MI) 大鼠左心室间质纤维化[58]。据报道, 肿瘤坏死因子相关蛋白-9 (CTRP9) 可调节OS和脂质代谢并发挥心脏保护作用, 通过对LKB1基因的慢病毒沉默, 抑制CTRP9对AMPK的激活, 并部分消除了CTRP9对心脏脂毒性的保护作用。这些结果表明, CTRP9可能通过LKB1/AMPK信号通路减轻OS, 进而发挥抗心肌纤维化和心脏肥大的作用[59]。在肝纤维化中, 胸腺嘧啶醌(TQ) 也可通过增强AMPK和LKB1表达, 减少ECM的积累[60]。同样在心脏纤维化中, 通过给小鼠注射飞燕草素发现它会通过AMPK/NOX/MAPK信号通路调节OS抑制病理性心脏肥大, 进而减轻心脏纤维化, 恢复心脏功能[61]。Ma等[62, 63]报道, 活化的AMPKα会诱导核因子红系2相关因子2 (Nrf2) 和血红素加氧酶1 (HO-1) 的活化, 这两种蛋白在氧化还原平衡中起作用。因此, 通过激活AMPKα和Nrf2途径能有效地保护肝脏免受细胞发生OS, 同样在肾脏纤维化中也存在此信号通路。总之, 目前抑制纤维化疾病中的OS过程大多数均通过AMPK调节, 作为另一个在纤维化疾病中经典的抗氧化蛋白Nrf2, 目前也被报道它的表达与AMPK相关, 并受AMPK的调节[62, 64]。
2.3 AMPK与成纤维细胞增殖纤维化的主要病理特征是由于受损器官异常修复, 使成纤维细胞过度增殖和ECM大量聚集[65-67]。成纤维细胞是间充质细胞在胚胎时期所分化形成的, 在炎症和血管生成以及伤口愈合中起重要的生物学作用[68]。当组织出现不同程度的细胞退化、坏死或缺陷时均需进行修复, 而成纤维细胞在此修复过程中就起着关键作用[65]。
一个细胞通过有丝分裂变成两个子细胞的过程被称为一个细胞周期[69]。AMPK对成纤维细胞增殖的作用主要就是通过调控细胞周期而进行的。对于前文所提到的mTOR来说, 作为调节mRNA翻译的启动子, mTOR会调节细胞的生长和分化过程。同时, 蛋白质的合成和细胞生长增殖的主要途径就是氨基酸和生长因子如血小板衍生生长因子(platelet-derived growth factor, PDGF)、表皮生长因子(epidermal growth factor, EGF) 以及胰岛素对于mTOR途径的激活, 研究表明激活AMPK会抑制mTOR所介导的蛋白质合成及细胞增殖现象[70]。这一点已经在TGF-β1诱导的心脏成纤维细胞活化和CCl4诱导的小鼠肝纤维化模型中得以验证[71-73]。当肝脏受损时, 肝星状细胞(hepatic stellate cell, HSC) 被活化成为肌成纤维细胞, 从而产生ECM诱发肝纤维化。作为代谢信号调节剂的琥珀酸和其受体, 所产生的白介素-6 (IL-6) 和TGF-β1可被二甲双胍或AICAR激活的AMPK抑制, 从而抑制HSC的增殖和活化[74]。在纤维化疾病中, 大量LKB1的表达使细胞周期G1期出现明显停滞。新近研究发现在肝纤维化疾病中, PBI-4050通过降低ATP水平, 进而激活细胞内的LKB1/AMPK通路, 并通过阻断mTOR靶点发出信号, 使细胞生长阻滞在G0/G1循环阶段, 抑制HSC增殖改善肝纤维化[71]。成纤维细胞的过度增殖和胶原蛋白的生成是导致病毒性心肌炎的主要致病机制, 研究表明柯萨奇病毒B3 (CVB3) 感染会增加心脏成纤维细胞增殖和胶原蛋白分泌, 而这些现象会被一种特定的AMPK激活剂AICAR所抑制[75]。线粒体蛋白tafazzin敲低会增加ROS的产生和丝裂原活化蛋白激酶的激活, 同时减少AMPK的活化, 介导新生儿心室成纤维细胞(NVF) 增殖[76]。白藜芦醇通过激活AMPK从而降低NOX4衍生的ROS产生, 减轻高糖诱导的肾成纤维细胞(NRK-49F) 的增殖和活化[77]。而Li等[78]也发现芹菜素通过激活AMPK及降低ERK1/2磷酸化抑制肾成纤维细胞增殖和分化功能。以上结论充分说明了AMPK对于成纤维细胞增殖的抑制作用。
2.4 AMPK与EMT当上皮细胞受到一系列外部刺激发生复杂变化时, 它们会全部或部分变为间质细胞, 此过程被称为EMT[79]。EMT的主要特征为表面活性蛋白C (SPC) 和E-钙黏蛋白(E-cad) 等上皮细胞标志蛋白表达下调并伴随着间充质细胞标记蛋白波形蛋白(Vim) 和平滑肌肌动蛋白(α-SMA) 表达的增加[80, 81]。EMT结合间质-上皮转化(mesenchymal transition, MET) 都属于一种发育型的转化过程, 两者都是组织和器官形成中所必需的[73]。此外, TGF-β途径、Wnt信号通路、受体酪氨酸激酶、Notch、细胞因子受体JAK-STAT等均会诱导不同类型的EMT[82]。其中TGF-β信号通路所诱导的EMT, 堪称为经典的EMT诱导途径, 因为TGF-β可以通过调节多种细胞因子、生长因子以及受体表达来促进EMT。如在EMT过程中所必需的转录因子[(转录因子(Snail1/2)、锌指转录因子(ZEB1/2) 和转录因子(Twist1/2)], 会由TGF-β调节, 或者由TGF-β的下游Smad2/3进行调节[83]。近期有研究表明, 二甲双胍和其他类型的AMPK激活剂会通过多种机制抑制EMT过程, 如在BLM诱导的肺纤维化体内模型和TGF-β1诱导的肺成纤维细胞分化的体外模型中, 韦氏内酯(WEL) 通过促进AMPK活化, 抑制TGF-β1/Raf-MAPK信号通路, 减轻EMT以及原代肺成纤维细胞FMD过程改善肺纤维化[84]。EMT是一种促进肾纤维化的新机制, 由不同的刺激物TGF-β、血管紧张素II、醛固酮、高葡萄糖和白蛋白诱导下的肾小管上皮细胞容易发生EMT, 促进肾间质纤维化的发生。活化的AMPK通过调节HO-1和内源性抗氧化剂Trx, 从而抑制ROS的产生和NOX4的表达, 进而减轻EMT进程改善肾小管间质纤维化[85]。同时, 二甲双胍通过激活AMPK会减轻大鼠肾缺血再灌注损伤后EMT和纤维化[54]。为了验证在肾纤维化中AMPK与EMT之间的具体关系, 在TGF-β1诱导的大鼠肾小管上皮细胞中通过导入AMPKα2慢病毒敲除AMPKα2基因, 发现在下调ETS1和RPS6KA1表达的同时影响了肾小管上皮细胞的EMT进程; 而Yin等[86, 87]研究发现, AMPKα2通过与蛋白激酶CK2β相互作用减少损伤后肾上皮细胞的转分化和炎症反应, 说明AMPKα2在调节肾小管的EMT中起到关键作用。此外, 在腹膜纤维化中, 也证明了AMPK对EMT过程所发挥的作用。在腹膜透析(PD) 动物模型上腹膜内注射二甲双胍激活AMPK抑制TGF-β1诱导的EMT进程并降低腹膜厚度[52]。该研究同时说明二甲双胍对腹膜纤维化的改善作用主要由AMPK依赖性途径介导, 该途径可以减少ROS的产生并增强腹膜中的抗氧化活性; HL156A是一种新型AMPK激活剂, HL156A对大鼠腹膜间皮细胞(RPMC) 的处理会抑制高糖(HG) 诱导的肌成纤维细胞转分化和EMT过程[88]。同时通过AMPK/NF-κB途径也可以减轻TGF-β1诱导的腹膜间皮细胞EMT进程和纤溶酶原激活物抑制剂-1 (PAI-1) 表达[52, 88]。以上均说明激活AMPK会减轻多种纤维化疾病中的EMT进程。
2.5 AMPK与FMD肌成纤维细胞是一种高度分化的细胞类型, 它在组织伤口愈合过程中起关键作用, 在病理层面上它会诱导慢性炎症, 如纤维化和癌症[89]。肌成纤维细胞作为专门用于ECM分泌和组织收缩的异质细胞类型, 它的来源有很多, 包括上文提到的成纤维细胞增殖、EMT, 同时FMD也属于肌成纤维细胞的重要来源之一[90]。
目前, TGF-β1作为参与肌成纤维细胞分化和促纤维化微环境创建的主要生长因子, 大量研究都将其作为诱导细胞FMD模型的刺激剂[90-92]。在肺纤维化中, 二甲双胍所介导的AMPK的激活可以抑制TGF-β1诱导的NOX4表达, 进而抑制肌成纤维细胞分化[54]。同时在BLM诱导的小鼠肺纤维化模型中, 二甲双胍以AMPK依赖性方式加速了已确立的纤维化的消退。以上研究内容支持二甲双胍(或其他AMPK激活剂) 通过促进肌成纤维细胞的失活和凋亡的方式来逆转已建立的纤维化模型[12]。此外, 同AMPK对成纤维细胞增殖的影响一致, 在肾纤维化中也证明了白藜芦醇通过激活AMPK调节NOX4/ROS信号通路抑制高糖诱导的NRK-49F增殖和肌成纤维细胞活化, 以及芹菜素通过激活AMPK降低ERK1/2磷酸化水平, 抑制肾成纤维细胞的增殖、分化[77, 78]。角膜碱损伤后TGF-β1合成增加与角膜纤维化有关, AICAR会抑制角膜成纤维细胞损伤后向肌成纤维细胞分化及ECM合成过程[93]。AdipoRon介导的AMPK激活可显著抑制血管诱导的TGF-β1表达和心肌成纤维细胞分化[94]。组织非特异性碱性磷酸酶(TNAP) 在不同组织中广泛表达, 调节代谢和炎症功能。研究发现TNAP通过AMPK-TGF-β1/Smads和p53信号通路减弱胶原相关基因的迁移、分化和表达, 因此TNAP可能是心脏纤维化的新调节剂[95]。此外, 有研究报道, AMPK是一种新型肿瘤坏死因子相关蛋白-3 (CTRP3) 抗纤维化作用所必需的, 通过靶向Smad3的激活, CTRP3可以抑制肌成纤维细胞分化和随后的ECM产生, 进而减弱心脏纤维化[96]。另一肿瘤坏死因子相关蛋白CTRP6同样可通过抑制肌成纤维细胞分化来减弱心脏纤维化, 它也是通过激活AMPK发挥调节作用的[97]。肝细胞生长因子(HGF) 在肌腱成纤维细胞中通过AMPK信号通路依赖性方式抑制TGF-β1诱导的肌成纤维细胞分化[98]。因此, 在纤维化中, AMPK对肌成纤维细胞分化具有明显抑制作用。
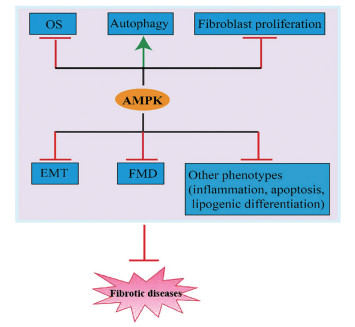
通过以上对AMPK在纤维化疾病中多种病理进程的作用分析, 充分体现出AMPK对纤维化疾病的改善作用(图 2), 为AMPK进一步研究及临床应用提供有力证据。
|
Figure 2 The multiple roles of AMPK in fibrotic diseases. OS: Oxidative stress; EMT: Epithelial-mesenchymal transition; FMD: Fibroblast-to-myofibrobast differentiation |
现已证明, 临床上具有激活AMPK功能的药物分别为二甲双胍、阿司匹林、雷帕霉素、他汀类药物、白藜芦醇以及噻唑烷二酮类[99, 100]。而目前二甲双胍、阿司匹林激活AMPK在基础研究中被广泛探讨, 二甲双胍会抑制复合物I的合成降低ATP的产生, 导致ADP含量增加, 进而转化为AMP, 最终激活AMPK[101]。而阿司匹林激活AMPK是通过其分解产物水杨酸盐实现的[102]。众所周知, 二甲双胍已是临床上治疗2型糖尿病的首选药物[103]。目前也已经发现二甲双胍具有抗肿瘤作用, 有证据表明, 二甲双胍的抗肿瘤机制主要为AMPK的依赖性和独立性机制, 由于AMPK可以调节多种代谢途径, 而癌细胞拥有不同于正常细胞的代谢变化, 因此激活AMPK可以防止癌症过程中机体的代谢失调[25]。另外, 活化的AMPK还可以通过激活真核延伸因子(eEf-2) 激酶诱导自噬, 使促生长和增殖的胰岛素样生长因子1 (insulin-like growth factor 1, IGF-1) 分子途径发生改变来发挥抗肿瘤作用[104]。同时, 二甲双胍激活的AMPK对于纤维化疾病的改善作用在前文中也已被探讨。但是, 近期研究发现二甲双胍用于临床会使机体产生胃肠道刺激等不良反应, 美国食品药品监督管理局(Food and Drug Administration, FDA) 报道这主要是由于二甲双胍引起的乳酸中毒所导致的, 即双胍类药物的暴露与血浆中乳酸水平升高有关。因此, 二甲双胍在临床上的广泛应用还需谨慎。阿司匹林起初作为治疗感冒咳嗽和头疼身痛的药物被大家熟知。经过科学家们多年的探索, 发现阿司匹林还可以改善多种疾病, 如预防心血管疾病、抗衰老、提高机体免疫力等[105-107]。另外目前各项临床指标已经确定, 阿司匹林在许多人类恶性肿瘤中, 尤其是乳腺癌、前列腺癌以及消化道肿瘤中, 均表现出明显的抗癌作用, 这也与AMPK有密切关系[108]。其主要是通过激活AMPK促使肿瘤细胞凋亡, 同时AMPK的激活剂和PI3K抑制剂可以协同抑制肿瘤细胞生长[109]。但是目前, 针对于阿司匹林在基础研究中激活AMPK改善纤维化还未见报道, 这部分内容有待考证。以上内容均体现二甲双胍和阿司匹林通过激活AMPK改善了多种疾病进程, 但对于大多数疾病来说, 它们仍处于基础研究阶段, 是否能够用于临床也仍需深入试验。
此外, 除以上用于临床激活AMPK的药物外, 目前所发现的AMPK激活剂AICAR、WS070117以及A-769662均存在生物利用度低以及选择性差等问题, 使得这些AMPK激活剂未能进入临床试验阶段, 同时也未见报道AMPK激活剂用于临床抗纤维化试验中。考虑到今后AMPK的药物研发, 激活AMPK带来的身体机能的变化应当被重视, AMPK的潜在激活会促进心脏肥大或营养缺乏、低氧和低pH值条件下的癌细胞生长[110]。为了避免这个问题, 针对于特定组织进行AMPK激活剂的研发尤为重要。另外需综合考虑所设计药物的药代动力学和药效学因素, 开发高特异性及高选择性的激活AMPK的小分子药物, 以便在治疗策略上达到最大收益化和最小风险化, 因此解决以上两点问题, 将有利于推动AMPK激活剂作为临床药物的研发进程。
4 结论和未来前景本文通过对AMPK结构、功能以及其在不同器官纤维化中所扮演角色的总结, 揭开了AMPK防治纤维化的神秘面纱。目前大量研究建立在纤维化动物模型以及细胞基础上, 发现AMPK与纤维化疾病中自噬功能障碍、OS、成纤维细胞增殖、EMT、FMD这5种病理表型密切相关, 并且它还可以作为关键蛋白调节细胞信号通路。当然AMPK也会影响纤维化疾病中的其他病理表型, 包括炎症、代谢、脂肪分化等[111-113]。在心脏纤维化及修复研究中的报道指出, AMPK扮演着超越代谢调节的作用, 且对于代谢的调节伴有自噬的参与[114-116]。但在脂肪分化方面, AMPK对于它的调节作用在纤维化中仅少量文献有报道。因此, 本综述就导致纤维化发生的最主要原因—自噬功能障碍、OS、成纤维细胞增殖、EMT、FMD这5种病理表型, 结合AMPK对它们的调节作用展开论述; 并通过阐述AMPK改善不同纤维化疾病的分子机制, 为基础研究以及临床防治纤维化提供了新的思路。
作者贡献: 顾璇、程明涵收集整理了文献资料并进行撰写; 高建提供了文章的总体思路, 并为文章的修改提供了重要的指导和意见。
利益冲突: 所有作者声明没有任何利益冲突。
| [1] |
Jiang S, Li T, Yang Z, et al. AMPK orchestrates an elaborate cascade protecting tissue from fibrosis and aging[J]. Ageing Res Rev, 2017, 38: 18-27. DOI:10.1016/j.arr.2017.07.001 |
| [2] |
Lafuse WP, Wozniak DJ, Rajaram MVS. Role of cardiac macrophages on cardiac inflammation, fibrosis and tissue repair[J]. Cells, 2020, 10: 51. DOI:10.3390/cells10010051 |
| [3] |
Weiskirchen R, Weiskirchen S, Tacke F. Organ and tissue fibrosis: molecular signals, cellular mechanisms and translational implications[J]. Mol Aspects Med, 2019, 65: 2-15. DOI:10.1016/j.mam.2018.06.003 |
| [4] |
Dolivo D, Weathers P, Dominko T. Artemisinin and artemisinin derivatives as anti-fibrotic therapeutics[J]. Acta Pharm Sin B, 2021, 11: 322-339. DOI:10.1016/j.apsb.2020.09.001 |
| [5] |
Li Y, Liu R, Wu J, et al. Self-eating: friend or foe? The emerging role of autophagy in fibrotic diseases[J]. Theranostics, 2020, 10: 7993-8017. DOI:10.7150/thno.47826 |
| [6] |
Vallee A, Lecarpentier Y, Vallee JN. Thermodynamic aspects and reprogramming cellular energy metabolism during the fibrosis process[J]. Int J Mol Sci, 2017, 18: 2537. DOI:10.3390/ijms18122537 |
| [7] |
Wang K, Chen Y, Zhang P, et al. Protective features of autophagy in pulmonary infection and inflammatory diseases[J]. Cells, 2019, 8: 123. DOI:10.3390/cells8020123 |
| [8] |
Hewlett JC, Kropski JA, Blackwell TS. Idiopathic pulmonary fibrosis: epithelial-mesenchymal interactions and emerging therapeutic targets[J]. Matrix Biol, 2018, 71-72: 112-127. DOI:10.1016/j.matbio.2018.03.021 |
| [9] |
Zannad F, Rossignol P. Cardiorenal syndrome revisited[J]. Circulation, 2018, 138: 929-944. DOI:10.1161/CIRCULATIONAHA.117.028814 |
| [10] |
Razali RA, Lokanathan Y, Yazid MD, et al. Modulation of eithelial to mesenchymal transition signaling pathways by Olea europaea and its active compounds[J]. Int J Mol Sci, 2019, 20: 3492. DOI:10.3390/ijms20143492 |
| [11] |
Steinberg GR, Carling D. AMP-activated protein kinase: the current landscape for drug development[J]. Nat Rev Drug Discov, 2019, 18: 527-551. DOI:10.1038/s41573-019-0019-2 |
| [12] |
Rangarajan S, Bone NB, Zmijewska AA, et al. Metformin reverses established lung fibrosis in a bleomycin model[J]. Nat Med, 2018, 24: 1121-1127. DOI:10.1038/s41591-018-0087-6 |
| [13] |
Kim J, Guan KL. Regulation of the autophagy initiating kinase ULK1 by nutrients: roles of mTORC1 and AMPK[J]. Cell Cycle, 2011, 10: 1337-1338. DOI:10.4161/cc.10.9.15291 |
| [14] |
Esparza-López J, Alvarado-Muñoz J, Escobar-Arriaga E, et al. Metformin reverses mesenchymal phenotype of primary breast cancer cells through STAT3/NF-κB pathways[J]. BMC Cancer, 2019, 19: 728. DOI:10.1186/s12885-019-5945-1 |
| [15] |
Li Y, Chen Y. AMPK and autophagy[J]. Adv Exp Med Biol, 2019, 1206: 85-108. |
| [16] |
Lopez M, Dieguez C. Cellular energy sensors: AMPK and beyond[J]. Mol Cell Endocrinol, 2014, 397: 1-3. DOI:10.1016/j.mce.2014.11.007 |
| [17] |
Wang Q, Liu S, Zhai A, et al. AMPK-mediated regulation of lipid metabolism by phosphorylation[J]. Biol Pharm Bull, 2018, 41: 985-993. DOI:10.1248/bpb.b17-00724 |
| [18] |
Hudson ER, Pan DA, James J, et al. A novel domain in AMP-activated protein kinase causes glycogen storage bodies similar to those seen in hereditary cardiac arrhythmias[J]. Curr Biol, 2003, 13: 861-866. DOI:10.1016/S0960-9822(03)00249-5 |
| [19] |
Gu X, Yan Y, Novick S, et al. Deconvoluting AMP-activated protein kinase (AMPK) adenine nucleotide binding and sensing[J]. J Biol Chem, 2017, 292: 12653-12666. DOI:10.1074/jbc.M117.793018 |
| [20] |
Li J, Zhong L, Wang F, et al. Dissecting the role of AMP-activated protein kinase in human diseases[J]. Acta Pharm Sin B, 2017, 7: 249-259. DOI:10.1016/j.apsb.2016.12.003 |
| [21] |
Tsai WL, Hsu CN, Tain YL. Whether AICAR in pregnancy or lactation prevents hypertension programmed by high saturated fat diet: a pilot study[J]. Nutrients, 2020, 12: 448. DOI:10.3390/nu12020448 |
| [22] |
Miki S, Suzuki J, Kunimura K, et al. Mechanisms underlying the attenuation of chronic inflammatory diseases by aged garlic extract: involvement of the activation of AMP-activated protein kinase[J]. Exp Ther Med, 2020, 19: 1462-1467. |
| [23] |
Lin L, Zeng L, Liu A, et al. L-Theanine regulates glucose, lipid, and protein metabolism via insulin and AMP-activated protein kinase signaling pathways[J]. Food Funct, 2020, 11: 1798-1809. DOI:10.1039/C9FO02451D |
| [24] |
Kim H, Moon SY, Kim JS, et al. Activation of AMP-activated protein kinase inhibits ER stress and renal fibrosis[J]. Am J Physiol Renal Physiol, 2015, 308: F226-F236. DOI:10.1152/ajprenal.00495.2014 |
| [25] |
Carling D. AMPK signalling in health and disease[J]. Curr Opin Cell Biol, 2017, 45: 31-37. DOI:10.1016/j.ceb.2017.01.005 |
| [26] |
Van de Casteele M, Kefas BA, Cai Y, et al. Prolonged culture in low glucose induces apoptosis of rat pancreatic beta-cells through induction of c-myc[J]. Biochem Biophys Res Commun, 2003, 312: 937-944. DOI:10.1016/j.bbrc.2003.11.013 |
| [27] |
Walker J, Jijon HB, Churchill T, et al. Activation of AMP-activated protein kinase reduces cAMP-mediated epithelial chloride secretion[J]. Am J Physiol Gastrointest Liver Physiol, 2003, 285: G850-G860. DOI:10.1152/ajpgi.00077.2003 |
| [28] |
Wang W, Yang X, López de Silanes I, et al. Increased AMP: ATP ratio and AMP-activated protein kinase activity during cellular senescence linked to reduced HuR function[J]. J Biol Chem, 2003, 278: 27016-27023. DOI:10.1074/jbc.M300318200 |
| [29] |
Wang H, Liu Y, Wang D, et al. The upstream pathway of mTOR-mediated autophagy in liver diseases[J]. Cells, 2019, 8: 1597. DOI:10.3390/cells8121597 |
| [30] |
Martin LM, Jeyabalan N, Tripathi R, et al. Autophagy in corneal health and disease: a concise review[J]. Ocul Surf, 2019, 17: 186-197. DOI:10.1016/j.jtos.2019.01.008 |
| [31] |
Allaire M, Rautou PE, Codogno P, et al. Autophagy in liver diseases: time for translation?[J]. J Hepatol, 2019, 70: 985-998. DOI:10.1016/j.jhep.2019.01.026 |
| [32] |
Li J, Zeng C, Zheng B, et al. HMGB1-induced autophagy facilitates hepatic stellate cells activation: a new pathway in liver fibrosis[J]. Clin Sci (Lond), 2018, 132: 1645-1667. DOI:10.1042/CS20180177 |
| [33] |
Ghavami S, Shojaei S, Yeganeh B, et al. Autophagy and apoptosis dysfunction in neurodegenerative disorders[J]. Prog Neurobiol, 2014, 112: 24-49. DOI:10.1016/j.pneurobio.2013.10.004 |
| [34] |
Chao X, Ding WX. Role and mechanisms of autophagy in alcohol-induced liver injury[J]. Adv Pharmacol, 2019, 85: 109-131. |
| [35] |
Kaushal GP, Chandrashekar K, Juncos LA, et al. Autophagy function and regulation in kidney disease[J]. Biomolecules, 2020, 10: 100. DOI:10.3390/biom10010100 |
| [36] |
Zhang L, Cheng S, Jiang X, et al. Pregnancy exposure to carbon black nanoparticles exacerbates bleomycin-induced lung fibrosis in offspring via disrupting LKB1-AMPK-ULK1 axis-mediated autophagy[J]. Toxicology, 2019, 425: 152244. DOI:10.1016/j.tox.2019.152244 |
| [37] |
Wang L, Yuan D, Zheng J, et al. Chikusetsu saponin IVa attenuates isoprenaline-induced myocardial fibrosis in mice through activation autophagy mediated by AMPK/mTOR/ULK1 signaling[J]. Phytomedicine, 2019, 58: 152764. DOI:10.1016/j.phymed.2018.11.024 |
| [38] |
Sun T, Liu J, Xie C, et al. Metformin attenuates diabetic renal injury via the AMPK-autophagy axis[J]. Exp Ther Med, 2021, 21: 578. DOI:10.3892/etm.2021.10010 |
| [39] |
Li Y, Liu M, Song X, et al. Exogenous hydrogen sulfide ameliorates diabetic myocardial fibrosis by inhibiting cell aging through SIRT6/AMPK autophagy[J]. Front Pharmacol, 2020, 11: 1150. DOI:10.3389/fphar.2020.01150 |
| [40] |
Kim SH, Kim G, Han DH, et al. Ezetimibe ameliorates steatohepatitis via AMP activated protein kinase-TFEB-mediated activation of autophagy and NLRP3 inflammasome inhibition[J]. Autophagy, 2017, 13: 1767-1781. DOI:10.1080/15548627.2017.1356977 |
| [41] |
Liu X, Chen J, Sun N, et al. Ginsenoside Rb1 ameliorates autophagy via the AMPK/mTOR pathway in renal tubular epithelial cells in vitro and in vivo[J]. Int J Biol Macromol, 2020, 163: 996-1009. DOI:10.1016/j.ijbiomac.2020.07.060 |
| [42] |
Kong D, Zhang Z, Chen L, et al. Curcumin blunts epithelial-mesenchymal transition of hepatocytes to alleviate hepatic fibrosis through regulating oxidative stress and autophagy[J]. Redox Biol, 2020, 36: 101600. DOI:10.1016/j.redox.2020.101600 |
| [43] |
Zeng J, Zhu B, Su MJB, et al. Autophagy is involved in acetylshikonin ameliorating non-alcoholic steatohepatitis through AMPK/mTOR pathway[J]. Biochem Biophys Res Commun, 2018, 503: 1645-1650. DOI:10.1016/j.bbrc.2018.07.094 |
| [44] |
Zhang Z, Zhu D, Zhang X, et al. Tanshinone IIA regulates fibroblast proliferation and migration and post-surgery arthrofibrosis through the autophagy-mediated PI3K and AMPK-mTOR signaling pathway[J]. Am J Transl Res, 2021, 13: 565-584. |
| [45] |
Cameli P, Carleo A, Bergantini L, et al. Oxidant/antioxidant disequilibrium in idiopathic pulmonary fibrosis pathogenesis[J]. Inflammation, 2020, 43: 1-7. DOI:10.1007/s10753-019-01059-1 |
| [46] |
Bai J, Wang Y, Zhu X, et al. Eriodictyol inhibits high glucose-induced extracellular matrix accumulation, oxidative stress, and inflammation in human glomerular mesangial cells[J]. Phytother Res, 2019, 33: 2775-2782. DOI:10.1002/ptr.6463 |
| [47] |
Smith KA, Waypa GB, Schumacker PT. Redox signaling during hypoxia in mammalian cells[J]. Redox Biol, 2017, 13: 228-234. DOI:10.1016/j.redox.2017.05.020 |
| [48] |
Lee SR, An EJ, Kim J, et al. Function of NADPH oxidases in diabetic nephropathy and development of Nox inhibitors[J]. Biomol Ther (Seoul), 2020, 28: 25-33. DOI:10.4062/biomolther.2019.188 |
| [49] |
Fukuyama Y, Ohta K, Okoshi R, et al. Hydrogen peroxide induces expression and activation of AMP-activated protein kinase in a dental pulp cell line[J]. Int Endod J, 2008, 41: 197-203. DOI:10.1111/j.1365-2591.2007.01337.x |
| [50] |
Zhu X, Wang K, Zhou F, et al. Paeoniflorin attenuates atRAL-induced oxidative stress, mitochondrial dysfunction and endoplasmic reticulum stress in retinal pigment epithelial cells via triggering Ca2+/CaMKII-dependent activation of AMPK[J]. Arch Pharm Res, 2018, 41: 1009-1018. DOI:10.1007/s12272-018-1059-6 |
| [51] |
Gamad N, Malik S, Suchal K, et al. Metformin alleviates bleomycin-induced pulmonary fibrosis in rats: pharmacological effects and molecular mechanisms[J]. Biomed Pharmacother, 2018, 97: 1544-1553. DOI:10.1016/j.biopha.2017.11.101 |
| [52] |
Shin HS, Ko J, Kim DA, et al. Metformin ameliorates the phenotype transition of peritoneal mesothelial cells and peritoneal dibrosis via a modulation of oxidative stress[J]. Sci Rep, 2017, 7: 5690. DOI:10.1038/s41598-017-05836-6 |
| [53] |
Shi L, Zhao C, Wang H, et al. Dimethylarginine dimethylaminohydrolase 1 deficiency induces the epithelial to mesenchymal transition in renal proximal tubular epithelial cells and exacerbates kidney damage in aged and diabetic mice[J]. Antioxid Redox Signal, 2017, 27: 1347-1360. DOI:10.1089/ars.2017.7022 |
| [54] |
Sato N, Takasaka N, Yoshida M, et al. Metformin attenuates lung fibrosis development via NOX4 suppression[J]. Respir Res, 2016, 17: 107. DOI:10.1186/s12931-016-0420-x |
| [55] |
Li W, Cheng F, Songyang YY, et al. CTRP1 attenuates UUO-induced renal fibrosis via AMPK/NOX4 pathway in mice[J]. Curr Med Sci, 2020, 40: 48-54. DOI:10.1007/s11596-020-2145-9 |
| [56] |
Cheng J, Wang M, Ma H, et al. Adiponectin inhibits oxidative stress and modulates TGF-b1 and COL-1 expression via the AMPK pathway in HSC-T6 cells[J]. Chin J Hepatol (中华肝脏病杂志), 2015, 23: 69-72. |
| [57] |
Mansour HH, Omran MM, Hasan HF, et al. Modulation of bleomycin-induced oxidative stress and pulmonary fibrosis by N-acetylcysteine in rats via AMPK/SIRT1/NF-kappabeta[J]. Clin Exp Pharmacol Physiol, 2020, 47: 1943-1952. DOI:10.1111/1440-1681.13378 |
| [58] |
Yu Y, Sun J, Liu J, et al. Ginsenoside Re preserves cardiac function and ameliorates left ventricular remodeling in a rat model of myocardial infarction[J]. J Cardiovasc Pharmacol, 2020, 75: 91-97. DOI:10.1097/FJC.0000000000000752 |
| [59] |
Zuo A, Zhao X, Li T, et al. CTRP9 knockout exaggerates lipotoxicity in cardiac myocytes and high-fat diet-induced cardiac hypertrophy through inhibiting the LKB1/AMPK pathway[J]. J Cell Mol Med, 2020, 24: 2635-2647. DOI:10.1111/jcmm.14982 |
| [60] |
Bai T, Yang Y, Wu YL, et al. Thymoquinone alleviates thioacetamide-induced hepatic fibrosis and inflammation by activating LKB1-AMPK signaling pathway in mice[J]. Int Immunopharmacol, 2014, 19: 351-357. DOI:10.1016/j.intimp.2014.02.006 |
| [61] |
Chen Y, Ge Z, Huang S, et al. Delphinidin attenuates pathological cardiac hypertrophy via the AMPK/NOX/MAPK signaling pathway[J]. Aging, 2020, 12: 5362-5383. DOI:10.18632/aging.102956 |
| [62] |
Ma JQ, Sun YZ, Ming QL, et al. Effects of gastrodin against carbon tetrachloride induced kidney inflammation and fibrosis in mice associated with the AMPK/Nrf2/HMGB1 pathway[J]. Food Funct, 2020, 11: 4615-4624. DOI:10.1039/D0FO00711K |
| [63] |
Lee EH, Baek SY, Park JY, et al. Rifampicin activates AMPK and alleviates oxidative stress in the liver as mediated with Nrf2 signaling[J]. Chem Biol Interact, 2020, 315: 108889. DOI:10.1016/j.cbi.2019.108889 |
| [64] |
Li X, Leng Y, Jiang Q, et al. Eye drops of metformin prevents fibrosis after glaucoma filtration surgery in rats via activating AMPK/Nrf2 signaling pathway[J]. Front Pharmacol, 2020, 11: 1038. DOI:10.3389/fphar.2020.01038 |
| [65] |
Zada M, Pattamatta U, White A. Modulation of fibroblasts in conjunctival wound healing[J]. Ophthalmology, 2018, 125: 179-192. DOI:10.1016/j.ophtha.2017.08.028 |
| [66] |
Kendall RT, Feghali-Bostwick CA. Fibroblasts in fibrosis: novel roles and mediators[J]. Front Pharmacol, 2014, 5: 123. |
| [67] |
Wynn TA, Ramalingam TR. Mechanisms of fibrosis: therapeutic translation for fibrotic disease[J]. Nat Med, 2012, 18: 1028-1040. DOI:10.1038/nm.2807 |
| [68] |
Driskell RR, Lichtenberger BM, Hoste E, et al. Distinct fibroblast lineages determine dermal architecture in skin development and repair[J]. Nature, 2013, 504: 277-281. DOI:10.1038/nature12783 |
| [69] |
Yamashita T, Nishimura K, Saiki R, et al. Role of polyamines at the G1/S boundary and G2/M phase of the cell cycle[J]. Int J Biochem Cell Biol, 2013, 45: 1042-1050. DOI:10.1016/j.biocel.2013.02.021 |
| [70] |
Xiao Y, Chang W, Wu Q, et al. Aucubin protects against TGFβ1-induced cardiac fibroblasts activation by mediating the AMPKα/mTOR signaling pathway[J]. Planta Med, 2018, 84: 91-99. DOI:10.1055/s-0043-118663 |
| [71] |
Grouix B, Sarra-Bournet F, Leduc M, et al. PBI-4050 reduces stellate cell activation and liver fibrosis through modulation of intracellular ATP levels and the liver kinase B1/AMP-activated protein kinase/mammalian target of rapamycin pathway[J]. J Pharmacol Exp Ther, 2018, 367: 71-81. DOI:10.1124/jpet.118.250068 |
| [72] |
Hu Y, Ye X, Zhou Q, et al. Sestrin 2 attenuates rat hepatic stellate cell (HSC) activation and liver fibrosis via an mTOR/AMPK-dependent mechanism[J]. Cell Physiol Biochem, 2018, 51: 2111-2122. DOI:10.1159/000495829 |
| [73] |
Xiao Y, Ye J, Zhou Y, et al. Baicalin inhibits pressure overload-induced cardiac fibrosis through regulating AMPK/TGF-beta/Smads signaling pathway[J]. Arch Biochem Biophys, 2018, 640: 37-46. DOI:10.1016/j.abb.2018.01.006 |
| [74] |
Nguyen G, Park S, Le C, et al. Metformin ameliorates activation of hepatic stellate cells and hepatic fibrosis by succinate and GPR91 inhibition[J]. Biochem Biophys Res Commun, 2018, 495: 2649-2656. DOI:10.1016/j.bbrc.2017.12.143 |
| [75] |
Jiang S, Tian S, Wu X, et al. Effect of AMP-activated protein kinase activation on cardiac fibroblast proliferation induced by coxsackievirus B3[J]. Exp Ther Med, 2016, 11: 2547-2552. DOI:10.3892/etm.2016.3174 |
| [76] |
He Q, Wang M, Harris N, et al. Tafazzin knockdown interrupts cell cycle progression in cultured neonatal ventricular fibroblasts[J]. Am J Physiol Heart Circ Physiol, 2013, 305: H1332-H1343. DOI:10.1152/ajpheart.00084.2013 |
| [77] |
He T, Xiong J, Nie L, et al. Resveratrol inhibits renal interstitial fibrosis in diabetic nephropathy by regulating AMPK/NOX4/ROS pathway[J]. J Mol Med (Berl), 2016, 94: 1359-1371. DOI:10.1007/s00109-016-1451-y |
| [78] |
Li N, Wang Z, Sun T, et al. Apigenin alleviates renal fibroblast activation through AMPK and ERK signaling pathways in vitro[J]. Curr Pharm Biotechnol, 2020, 21: 1107-1118. DOI:10.2174/1389201021666200320140908 |
| [79] |
Davis FM, Stewart TA, Thompson EW, et al. Targeting EMT in cancer: opportunities for pharmacological intervention[J]. Trends Pharmacol Sci, 2014, 35: 479-488. DOI:10.1016/j.tips.2014.06.006 |
| [80] |
Qu J, Zhang Z, Zhang P, et al. Downregulation of HMGB1 is required for the protective role of Nrf2 in EMT-mediated PF[J]. J Cell Physiol, 2019, 234: 8862-8872. DOI:10.1002/jcp.27548 |
| [81] |
Zhang E, Yang Y, Chen S, et al. Bone marrow mesenchymal stromal cells attenuate silica-induced pulmonary fibrosis potentially by attenuating Wnt/β-catenin signaling in rats[J]. Stem Cell Res Ther, 2018, 9: 311. DOI:10.1186/s13287-018-1045-4 |
| [82] |
Gao J, Ye J, Ying Y, et al. Negative regulation of TGF-β by AMPK and implications in the treatment of associated disorders[J]. Acta Biochim Biophys Sin, 2018, 50: 523-531. DOI:10.1093/abbs/gmy028 |
| [83] |
McCubrey J, Kumar A, Xu J, et al. Tissue transglutaminase promotes drug resistance and invasion by inducing mesenchymal transition in mammary epithelial cells[J]. PLoS One, 2010, 5: e13390. DOI:10.1371/journal.pone.0013390 |
| [84] |
Yang JY, Tao LJ, Liu B, et al. Wedelolactone attenuates pulmonary fibrosis partly through activating AMPK and regulating Raf-MAPKs signaling pathway[J]. Front Pharmacol, 2019, 10: 151. DOI:10.3389/fphar.2019.00151 |
| [85] |
Lee JH, Kim JH, Kim JS, et al. AMP-activated protein kinase inhibits TGF-β-, angiotensin II-, aldosterone-, high glucose-, and albumin-induced epithelial-mesenchymal transition[J]. Am J Physiol Renal Physiol, 2013, 304: F686-F697. DOI:10.1152/ajprenal.00148.2012 |
| [86] |
Yin X, Ma F, Fan X, et al. Knockdown of AMPKα2 impairs epithelial-mesenchymal transition in rat renal tubular epithelial cells by downregulating ETS1 and RPS6KA1[J]. Mol Med Rep, 2020, 22: 4619-4628. DOI:10.3892/mmr.2020.11556 |
| [87] |
Qiu S, Xiao Z, Piao C, et al. AMPKα2 reduces renal epithelial transdifferentiation and inflammation after injury through interaction with CK2β[J]. J Pathol, 2015, 237: 330-342. DOI:10.1002/path.4579 |
| [88] |
Jin G, Su Y, Dong Q, et al. Arctigenin alleviates TGF-β1-induced epithelial-mesenchymal transition and PAI-1 expression via AMPK/NF-κB pathway in peritoneal mesothelial cells[J]. Biochem Biophys Res Commun, 2019, 520: 413-419. DOI:10.1016/j.bbrc.2019.09.130 |
| [89] |
Carthy JM. TGFbeta signaling and the control of myofibroblast differentiation: implications for chronic inflammatory disorders[J]. J Cell Physiol, 2018, 233: 98-106. DOI:10.1002/jcp.25879 |
| [90] |
Upagupta C, Shimbori C, Alsilmi R, et al. Matrix abnormalities in pulmonary fibrosis[J]. Eur Respir Rev, 2018, 27: 180033. DOI:10.1183/16000617.0033-2018 |
| [91] |
Stempien-Otero A, Kim DH, Davis J. Molecular networks underlying myofibroblast fate and fibrosis[J]. J Mol Cell Cardiol, 2016, 97: 153-161. DOI:10.1016/j.yjmcc.2016.05.002 |
| [92] |
Zhao H, Li C, Li L, et al. Baicalin alleviates bleomycin-induced pulmonary fibrosis and fibroblast proliferation in rats via the PI3K/AKT signaling pathway[J]. Mol Med Rep, 2020, 21: 2321-2334. |
| [93] |
Nuwormegbe SA, Kim SW. AMPK activation by 5-amino-4-imidazole carboxamide riboside-1-beta-D-dibofuranoside attenuates alkali injury-induced corneal fibrosis[J]. Invest Ophthalmol Vis Sci, 2020, 61: 43. |
| [94] |
Zhang N, Wei WY, Liao HH, et al. AdipoRon, an adiponectin receptor agonist, attenuates cardiac remodeling induced by pressure overload[J]. J Mol Med (Berl), 2018, 96: 1345-1357. DOI:10.1007/s00109-018-1696-8 |
| [95] |
Gao L, Wang LY, Liu ZQ, et al. TNAP inhibition attenuates cardiac fibrosis induced by myocardial infarction through deactivating TGF-beta1/Smads and activating P53 signaling pathways[J]. Cell Death Dis, 2020, 11: 44. DOI:10.1038/s41419-020-2243-4 |
| [96] |
Wu D, Lei H, Wang JY, et al. CTRP3 attenuates post-infarct cardiac fibrosis by targeting Smad3 activation and inhibiting myofibroblast differentiation[J]. J Mol Med (Berl), 2015, 93: 1311-1325. DOI:10.1007/s00109-015-1309-8 |
| [97] |
Lei H, Wu D, Wang J, et al. C1q/tumor necrosis factor-related protein-6 attenuates post-infarct cardiac fibrosis by targeting RhoA/MRTF-A pathway and inhibiting myofibroblast differentiation[J]. Basic Res Cardiol, 2015, 110: 35. DOI:10.1007/s00395-015-0492-7 |
| [98] |
Cui Q, Fu S, Li ZJ. Hepatocyte growth factor inhibits TGF-β1-induced myofibroblast differentiation in tendon fibroblasts: role of AMPK signaling pathway[J]. J Physiol Sci, 2013, 63: 163-170. DOI:10.1007/s12576-013-0251-1 |
| [99] |
Pulakat L, Chen HH. Pro-senescence and anti-senescence mechanisms of cardiovascular aging: cardiac microRNA regulation of longevity drug-induced autophagy[J]. Front Pharmacol, 2020, 11: 774. DOI:10.3389/fphar.2020.00774 |
| [100] |
Timm KN, Tyler DJ. The role of AMPK activation for cardioprotection in doxorubicin-induced cardiotoxicity[J]. Cardiovasc Drugs Ther, 2020, 34: 255-269. DOI:10.1007/s10557-020-06941-x |
| [101] |
Hou WL, Yin J, Alimujiang M, et al. Inhibition of mitochondrial complex I improves glucose metabolism independently of AMPK activation[J]. J Cell Mol Med, 2018, 22: 1316-1328. |
| [102] |
Ford RJ, Fullerton MD, Pinkosky SL, et al. Metformin and salicylate synergistically activate liver AMPK, inhibit lipogenesis and improve insulin sensitivity[J]. Biochem J, 2015, 468: 125-132. DOI:10.1042/BJ20150125 |
| [103] |
Hardie DG, Ross FA, Hawley SA. AMP-activated protein kinase: a target for drugs both ancient and modern[J]. Chem Biol, 2012, 19: 1222-1236. DOI:10.1016/j.chembiol.2012.08.019 |
| [104] |
Zaidi S, Gandhi J, Joshi G, et al. The anticancer potential of metformin on prostate cancer[J]. Prostate Cancer Prostatic Dis, 2019, 22: 351-361. DOI:10.1038/s41391-018-0085-2 |
| [105] |
Du G, Lin Q, Wang J. A brief review on the mechanisms of aspirin resistance[J]. Int J Cardiol, 2016, 220: 21-26. DOI:10.1016/j.ijcard.2016.06.104 |
| [106] |
Piskovatska V, Strilbytska O, Koliada A, et al. Health benefits of anti-aging drugs[J]. Subcell Biochem, 2019, 91: 339-392. |
| [107] |
Bassani-Sternberg M, Digklia A, Huber F, et al. A phase Ib study of the combination of personalized autologous dendritic cell vaccine, aspirin, and standard of care adjuvant chemotherapy followed by nivolumab for resected pancreatic adenocarcinoma— a proof of antigen discovery feasibility in three patients[J]. Front Immunol, 2019, 10: 1832. DOI:10.3389/fimmu.2019.01832 |
| [108] |
Song Y, Zhong X, Gao P, et al. Aspirin and its potential preventive role in cancer: an umbrella review[J]. Front Endocrinol (Lausanne), 2020, 11: 3. DOI:10.3389/fendo.2020.00003 |
| [109] |
Liu S, Tang Y, Yan M, et al. PIK3CA mutation sensitizes breast cancer cells to synergistic therapy of PI3K inhibition and AMPK activation[J]. Invest New Drugs, 2018, 36: 763-772. DOI:10.1007/s10637-018-0563-3 |
| [110] |
Xie S, Deng Y, Pan YY, et al. Chronic intermittent hypoxia induces cardiac hypertrophy by impairing autophagy through the adenosine 5'-monophosphate-activated protein kinase pathway[J]. Arch Biochem Biophys, 2016, 606: 41-52. DOI:10.1016/j.abb.2016.07.006 |
| [111] |
Kheirollahi V, Wasnick RM, Biasin V, et al. Metformin induces lipogenic differentiation in myofibroblasts to reverse lung fibrosis[J]. Nat Commun, 2019, 10: 2987. DOI:10.1038/s41467-019-10839-0 |
| [112] |
Myerburg M, King J, Oyster N, et al. AMPK agonists ameliorate sodium and fluid transport and inflammation in cystic fibrosis airway epithelial cells[J]. Am J Respir Cell Mol Biol, 2010, 42: 676-684. DOI:10.1165/2009-0147OC |
| [113] |
Sun Y, Zhou S, Guo H, et al. Protective effects of sulforaphane on type 2 diabetes-induced cardiomyopathy via AMPK-mediated activation of lipid metabolic pathways and NRF2 function[J]. Metabolism, 2020, 102: 154002. DOI:10.1016/j.metabol.2019.154002 |
| [114] |
Daskalopoulos E, Dufeys C, Bertrand L, et al. AMPK in cardiac fibrosis and repair: actions beyond metabolic regulation[J]. J Mol Cell Cardiol, 2016, 91: 188-200. DOI:10.1016/j.yjmcc.2016.01.001 |
| [115] |
Tamargo-Gómez I, Mariño G. AMPK: regulation of metabolic dynamics in the context of autophagy[J]. Int J Mol Sci, 2018, 19: 3812. DOI:10.3390/ijms19123812 |
| [116] |
Ha J, Guan K, Kim J. AMPK and autophagy in glucose/glycogen metabolism[J]. Mol Aspects Med, 2015, 46: 46-62. DOI:10.1016/j.mam.2015.08.002 |
 2021, Vol. 56
2021, Vol. 56


