纤维化是许多慢性炎症性疾病最终的病理结果。尽管胶原沉积是伤口愈合过程不可缺少的环节, 且通常是可逆的, 但是如果组织受到严重且重复损伤以及伤口愈合反应出现失调, 正常的组织修复可能演变为不可逆转的纤维化反应。纤维化的定义是纤维结缔组织(细胞外基质的组成部分, 如胶原和纤维连接蛋白) 在炎症或受损的组织内和周围过度聚集, 这可能导致永久性瘢痕、器官功能障碍, 最终导致死亡, 如终末期肝病、肾脏疾病、特发性肺纤维化(idiopathic pulmonary fibrosis, IPF) 和心力衰竭[1, 2]。纤维化也是许多慢性自身免疫性疾病的主要病理特征, 包括硬皮病、类风湿性关节炎、克罗恩病和溃疡[3]。由于纤维化疾病患者众多、发病机制不明、缺乏有效的治疗手段等原因, 在世界范围内构成了一个重大的健康问题, 所以迫切需要更多的努力来确定纤维化的共同和独特的机制, 并从中寻找有效的抗纤维化靶点和药物[4]。
Skp2归属于泛素-蛋白酶体系统(ubiquitin-proteasome system, UPS) 家族, 该家族中E3泛素连接酶Skp1/cullin 1/F-box (SCF) 复合体能够触发下游蛋白的泛素化和降解, 在此过程中, SCF成员Skp2起到识别蛋白酶体降解底物的功能。Skp2作为一种原癌蛋白在肿瘤如肝癌、肺癌和细胞癌[5]的发生发展中发挥重要作用。同时, 越来越多证据表明Skp2在纤维化模型中被激活, 调控多种纤维化疾病的发病机制, 并且针对Skp2的多种抑制剂正在被开发作为治疗癌症以及纤维化疾病等的药物。因此, 充分了解Skp2的功能及其在纤维化疾病中的作用, 可能会对纤维化的发病机制产生关键的影响, 并为其临床治疗提供新的策略。
1 Skp2的介绍 1.1 Skp2家族概述蛋白质降解是细胞以响应各种细胞外刺激进行快速循环氨基酸的必要环节, 是蛋白质周转的重要组成部分。而UPS是管理蛋白质降解的最关键的翻译后修饰机制[6]。功能性UPS维持蛋白质的动态平衡是通过其蛋白水解功能来消除错误折叠的蛋白, 从而参与调控细胞周期[7]以及凋亡[6]等进程。非蛋白酶体泛素信号同样参与多种机体功能, 如DNA修复、自噬、代谢调节、信号转导和免疫反应等过程[8]。值得注意的是, UPS功能发生紊乱时可能导致严重的疾病, 如癌症以及神经退行性疾病。本质上, 蛋白质的降解受到两个过程的严格调控: 泛素部分与靶标底物的结合以及26S蛋白酶体中泛素标记蛋白的蛋白水解。泛素部分与其靶标的共价连接需要几个关键成分, 包括泛素、ATP、泛素激活酶(ubiquitin-activating enzyme, E1)、泛素结合酶(ubiquitin-conjugating enzyme, E2) 和泛素蛋白连接酶(ubiquitin-protein ligase, E3)[9]。其具体过程为在ATP存在的情况下, 小的泛素蛋白附着在E1酶上, 随后泛素转移到E2酶上, E3通过招募E2泛素和底物蛋白, 从而将E2上泛素转移到底物上, 所形成的多泛素化底物蛋白被26S蛋白酶体识别并降解成小肽。与E1和E2酶相比, E3连接酶受到了更多的关注, 因为E3连接酶的高度变异性在决定底物的特异性方面起着至关重要的作用。
1.2 Skp2结构及下游靶标Skp2是E3泛素连接酶SCF复合体的组成元件之一。SCF复合体包含4个主要单位, 分别是S期激酶相关蛋白1 (Skp1)、支架蛋白cullin-1、环指蛋白1 (ring-finger protein 1, Rbx1) 和多种F-box蛋白[9]。Skp2属于F-box蛋白的FBXWs亚类, 是于1995年鉴定细胞进入S期所必需的激酶复合物时被首次克隆的一个与细胞周期调控密切相关的基因[10]。其定位于人5号染色体断臂(5p13), 由436个氨基酸组成的蛋白质主要定位于细胞核与细胞质中[11]。Skp2由与Skp1羧端相连的F-box序列、“连接子(linker)”序列、C-末端及10个富含亮氨酸重复序列结构域(leucine-rich repeat, LRR) 组成, LRR通过紧密排列所形成的结构域与F-box序列相连, 从而在底物识别中起重要作用。Skp2底物种类繁多, 最初被发现能够诱导K48连接的泛素化, 导致蛋白酶体介导的标记底物的蛋白水解, 包括p27、叉头框家族转录因子1 (forkhead box transcription factor O1, FOXO1) 和组蛋白精氨酸甲基转移酶1 (coactivator-associated arginine methyltransferase 1, CARM1) 等。然而, 最近的研究表明, Skp2还可以通过K63连接的多泛素链与靶蛋白如蛋白激酶B (protein kinase B, Akt/PKB)、肝激酶B1 (liver kinase B1, LKB1)、Nijmegen断裂综合征蛋白1 (Nijmegen break-age syndrome protein 1, NBS1)、yes相关蛋白(yes-associated protein, YAP)、RagA和Twist转录因子(Twist transcription factor, Twist) 偶联而发挥非蛋白水解功能, 为研究Skp2在信号转导和疾病调控中的作用开辟了新的方向(表 1)[12-31]。
| Table 1 Downstream targets of S-phase kinase-associated protein 2 (Skp2). FOXO1: Forkhead box transcription factor O1; CARM1: Coactivator-associated arginine methyltransferase 1; Akt: Protein kinase B; YAP: Yes-associated protein; NBS1: Nijmegen break-age syndrome protein 1; LKB1: Liver kinase B1; Twist: Twist transcription factor |
Skp2广泛表达于心、肾、肝、肺、卵巢等各种人体组织中。
由于其广泛的组织分布和底物识别, Skp2能够调控多种细胞过程。现就其对细胞周期、细胞衰老和凋亡等的调控机制进行总结(图 1)。Skp2对细胞周期的严格调控是通过在细胞周期的不同阶段协调周期蛋白依赖性激酶(cyclin dependent kinase, CDK) 与细胞周期依赖性激酶抑制蛋白(cyclin dependent kinase inhibitor, CKI) 的激活或失活来实现的。CKI通过与周期相关蛋白cyclin、CDK或者cyclin-CDK复合物结合从而干预细胞进程, 抑制细胞异常增殖, 其关键的细胞周期调节因子有p27与p21[8]。如Skp2识别在T187处磷酸化的p27, 将其作为降解的靶点, 使cyclin A或cyclin E/CDK2复合物从p27抑制中解脱出来, 加速细胞从G1期向S期过渡[11], 这表明Skp2的异常激活可能导致细胞周期的紊乱[32, 33]。此外, 其他被Skp2降解的底物如p57[34]、p21[21]、p130[35]和FOXO1[35]也是细胞周期的负调控因子, 提示Skp2可能通过多种机制调控细胞周期进程。研究表明, Skp2的表达在很大程度上能够保护细胞免受衰老, Skp2缺失引起的衰老反应主要依赖于细胞周期抑制因子p21和p27以及内质网应激蛋白激活转录因子4 (activating transcription factor 4, ATF4) 的积累[8]。Skp2对细胞凋亡的调控是通过抑制p53乙酰化及其反式激活能力, Skp2能够结合乙酰基转移酶p300的CH1和CH3结构域, 即p53结合位点, 以阻止p300与p53的相互作用, 除了抑制p53和p300之间的相互作用, 还通过促进p300的降解来改变p53的活性[12, 36]。除此之外, Skp2还被发现促进促凋亡蛋白FOXO1的泛素化和降解, 从而取消其反式激活和随后的凋亡反应[17]。Skp2同样能够促进细胞迁移进程, Skp2的缺乏显著影响细胞迁移进程[29, 37, 38], 目前较为确定的机制是Skp2/小分子鸟苷酸蛋白A (RhoA) 级联反应调控细胞迁移进程[30]。
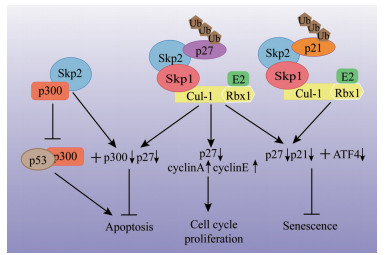
|
Figure 1 Functions of Skp2 in cell cycle, senescence, and apoptosis. Cul-1: Cullin 1; Rbx1: Ring box protein 1; ATF4: Activating transcription factor 4 |
器官纤维化是多种病因导致慢性组织损伤的常见病理结果, 特征为细胞外基质成分(ECM) 过度沉积, 瘢痕组织形成, 最终导致器官功能障碍和衰竭。进行性结构重塑即纤维性进展几乎可见于所有组织和器官, 严重威胁人类生命健康[39]。最近的证据表明, Skp2被认为是纤维化病理机制的关键参与者, 在肝、肺、肾、角膜和心脏纤维化发展中起重要作用(图 2)。
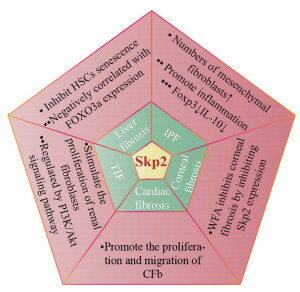
|
Figure 2 The role and mechanism of Skp2 in several fibrosis diseases. IPF: Idiopathic pulmonary fibrosis; Foxp3: Forkhead box P3; IL-10: Interleukin-10; WFA: Withaferin A; CFb: Cardiac fibroblasts; PI3K: Phosphatidylinositol 3 kinases; TIF: Tubulointerstitial fibrosis; HSCs: Hepatic stellate cell |
肝纤维化是许多慢性肝病的共同前驱, 是世界范围内的一个主要健康问题[40], 最终可能发展为肝硬化、肝功能衰竭或肝细胞癌[41, 42]。在肝纤维化形成过程中, 静止的肝星状细胞(hepatic stellate cells, HSCs) 可转化为活化的HSCs, 并伴随多种促炎和促纤维化的细胞因子的分泌[43, 44], 活化的HSCs被认为是肝纤维进程中的主要效应细胞, 抑制HSCs的活化和增殖, 增加活化HSCs的清除率是抗肝纤维化的有效策略[45]。HSCs激活的抑制作用伴随着细胞衰老进程, 所以诱导HSCs衰老是逆转肝纤维化的关键[46]。研究表明, 从多种可溶性虫卵抗原组成的复杂混合物(soluble egg antigens, SEA) 中分离出来的一种日本血吸虫卵抗原p40 (S. japonicum egg antigen p40, Sjp40) 能够促进HSCs衰老, 减少α-平滑肌肌动蛋白(α-SMA) 产生, 上调p27以及下调Skp2蛋白水平, 过表达Skp2或沉默p27可以部分逆转Sjp40诱导的人肝星状细胞系LX-2细胞衰老[47, 48]。并且Sjp40诱导的视网膜母细胞瘤(retinoblastoma, Rb) 的磷酸化和α-SMA的表达下调可以被Skp2过表达部分恢复[48], Rb磷酸化被认为是细胞G1-S相变过程中的关键步骤, 提示Sjp40可能通过Skp2/p27信号通路促进细胞衰老, 从而抑制HSCs的激活。Duan等[49]同样在研究中验证了该通路在肝纤维化中的作用, 并且发现了Skp2/p27信号通路受上游蛋白人类叉头框O蛋白3a (forkhead box O3a, FOXO3a) 的调控。FOXO3a是SEA诱导LX-2细胞衰老的关键调控因子, 在SEA的作用下, FOXO3a发生了从细胞核到细胞质的转移, 并且p27受FOXO3a蛋白在转录水平的调节, SEA通过FOXO3a/Skp2/p27途径促进HSCs衰老, 从而延缓肝纤维化的进展。总之, 上述研究均证明Skp2参与了HSCs在肝纤维化中的发病进程, 对Skp2相关通路的干涉是治疗肝纤维化的潜在靶点。
2.2 Skp2与IPF特发性肺纤维化是一种慢性、进展性和致命性弥漫性肺部疾病, 其特征是肺结构破坏, 成纤维细胞向肌成纤维细胞转变增加, 胶原等细胞外基质积聚。IPF患者预后较差, 平均生存期仅为2~4年[50, 51], 且IPF的病因尚不完全清楚, 其发病机制涉及多种生理病理环节, 其中Skp2被证实参与IPF的发生发展进程。Mikamo等[50]首次证明了Skp2是IPF的一个有前途的治疗靶点。该研究在Skp2基因敲除的小鼠中进行实验, 发现博莱霉素(bleomycin, BLM) 诱导肺纤维化的程度出现明显减弱, 且肺组织中Ⅰ型胶原蛋白和纤维连接蛋白等纤维化标志物的表达以及BLM灌注小鼠支气管肺泡灌洗液(bronchoalveolar lavage fluid, BALF) 的细胞聚集都受到抑制。利用小分子Skp2抑制剂(SZL-P1-41) 进行干预, 发现其能够显著抑制肺纤维化的进展和纤维化标志物的积累, 以及BLM诱导的肺纤维化中p27的下调。除此之外, 作者又利用双重免疫染色实验来鉴定p27阳性细胞, 发现Skp2缺乏症患者骨髓间充质成纤维细胞中p27阳性细胞数的减少及BLM诱导的骨髓间充质成纤维细胞数量增加均被Skp2基因缺陷所抑制。上述结果提示, Skp2可能通过Skp2/p27轴参与BLM诱导的间充质成纤维细胞的增加进程。由此推断, Skp2缺陷可能通过抑制BLM诱导的间质成纤维细胞的增多, 抑制肺组织中纤维化相关蛋白的积聚, 从而延缓BLM诱导的晚期纤维化的进展。除了对IPF晚期纤维化产生影响, Skp2还可能参与肺纤维化的早期炎症进程。Wang等[52]表明Skp2的缺失会导致自身反应性致病T细胞(Tpaths) 中p27和p21的上调。当Skp2受到抑制时, 叉头状转录因子p3 (forkhead box p3, Foxp3) 表达增加, Foxp3是控制调节性T细胞(Tregs) 的关键转录因子, 它抑制效应T细胞的激活和增殖, 并诱导Tpaths转化为产生白介素10 (interleukin-10, IL-10) 的Tregs。Tregs产生抗炎细胞因子IL-10来抑制辅助性T细胞17 (T helper cell 17, Th17) 中IL-17的表达, 从而促进中性粒细胞向炎症部位的聚集[53]。据报道, 在BLM模型的早期炎症阶段中, 首先迁移到肺部的是中性粒细胞。此外, Park等[54]报道高表达的Foxp3可通过抑制BALF中总免疫细胞、嗜酸性粒细胞、中性粒细胞、巨噬细胞的聚集来降低小鼠哮喘模型的气道炎症。总之, 在BLM诱导的纤维化的早期炎症中, Skp2能够通过抑制Foxp3和p27/p21负向调节Tregs。所以抑制Skp2的表达使Foxp3和p27/p21积聚是增加Treg中IL-10的产生以及抑制炎症发生的关键。增加的Treg也可能抑制Th17细胞中IL-17的表达, 导致中性粒细胞在BLM给药后肺内聚集的减少。在BLM模型早期, Skp2抑制剂可能通过抑制肺泡I型上皮细胞(AECI) 和肺泡II型上皮细胞(AECII) 等肺细胞凋亡而发挥抗炎作用。Li等[55]在探讨证明透明质酸合酶2 (hyaluronan synthase 2, HAS2) 在IPF中作用时, 发现在HAS2 siRNA转染后的不同时间点, HAS2缺陷的成纤维细胞中p27蛋白水平显著增加, p27可以调节CDK2活性来抑制细胞增殖, 且p27的积累是通过特异性地抑制Skp2的表达而引起的。研究结果还证明了HAS2下调通过p27-CDK2-Skp2途径启动和调控成纤维细胞的衰老, 推测Skp2及其下游通路参与肺纤维化中诱导成纤维细胞衰老进程中, 且发挥重要作用。上述内容描述了Skp2通过对细胞不同进程的干预从而参与到肺纤维化发病机制中, 由此证明了Skp2可作为IPF治疗靶点的重要意义和巨大潜力, 为IPF的临床治疗添加了新的方向。
2.3 Skp2与肾纤维化肾小管间质纤维化(tubulointerstitial fibrosis, TIF) 是几乎所有进展性慢性肾脏疾病(CKD) 的共同结果。作为肾功能不全的一个主要决定因素和一个可靠的预后预测因子, 肾脏TIF在过去几十年中已经引起了全球的重视[56]。众多流行病学研究表明, CKD患者的患病率在全球范围内呈上升趋势[57, 58]。阐明肾脏TIF的发病机制并将其转化为有效的治疗方法将有助于提供巨大的医疗和经济效益。在肾脏中, 细胞增殖被认为是损伤发生时的关键反应, 并最终导致肾脏损伤和纤维化的发展。肾小管细胞增生是单侧输尿管梗阻(UUO) 中梗阻肾脏的特征。UUO是一种具有代表性的进行性肾小管间质损伤模型, 适用于研究与细胞增殖和凋亡相关的肾纤维化进展过程中发生的细胞和分子事件。肾成纤维细胞的增殖受到多种蛋白质复合体的精确控制和协调, 如cyclins、CDKs和CKIs, 其中p21和p27是核心CKI之一。作为靶向p21或p27蛋白水解的关键蛋白, Skp2同样参与到肾成纤维细胞增殖的分子机制进程中。Skp2 mRNA在UUO小鼠肾脏中表达增加, 并且在Skp2-/-小鼠中纤维化的肾小管间质损伤的进展被减缓[59]。野生型小鼠梗阻肾组织中p27蛋白表达水平明显升高, 而Skp2-/-小鼠中p27蛋白表达水平明显高于野生型小鼠。Skp2-/-小鼠SCF-Skp2泛素连接酶缺陷导致的p27积聚抑制了肾小管上皮细胞的增殖, 参与了梗阻性肾病所致的肾损伤的改善。除此之外, Skp2所介导的肾成纤维细胞增殖受磷脂酰肌醇3-激酶(phosphatidylinositol 3 kinases, PI3K)/Akt信号通路调控, Lu等[60]研究证明血小板衍生生长因子(platelet-derived growth factor, PDGF) 通过激活PI3K/Akt信号通路和Skp2表达来刺激肾成纤维细胞增殖, PDGF被确认为间充质细胞如成纤维细胞和平滑肌细胞的有丝分裂原和趋化剂。Skp2 siRNA抑制了肾成纤维细胞的增殖, 且抑制PI3K可完全阻断PDGF诱导的Skp2表达上调和细胞增殖, 证明Skp2所介导的肾成纤维细胞增殖受PI3K/Akt信号通路调控。Tang等[61]采用UUO小鼠模型和近端肾小管上皮细胞株(NRK-52E) 验证了有丝分裂阻滞缺陷蛋白2 (mitotic spindle assembly checkpoint protein 2, MAD2B) 通过诱导Skp2表达参与到转化生长因子-β (TGF-β) 所诱导的肾小管上皮向间充质转化(EMT) 进程中。并且在体内和体外肾小管间质纤维化过程中, 敲除MAD2B可减轻Skp2积聚, 部分阻止EMT进程和ECM的产生。总之, 通过多种机制所诱导的Skp2表达可以参与到肾间质纤维化中肾成纤维细胞的增殖以及EMT进程中。
2.4 Skp2与角膜纤维化角膜纤维化是角膜损伤后不规则愈合的常见原因, Bargagna-Mohan等[62]在探讨药物WFA (withaferin A) 能否作为一种抗角膜纤维化的强有力的治疗药物时, 验证了WFA减轻角膜纤维化是通过E3泛素连接酶Skp2的下调和CKIs中p27和p21上调介导的。天然产物WFA是一种与波形蛋白(vimentin) 结合并下调其损伤诱导表达的小分子, Skp2和p27都是WFA诱导G2/M细胞周期阻滞所必需的, WFA治疗效果在Skp2和p27缺陷小鼠中减弱更加证实了这一点。总之, Skp2积极参与到抗角膜纤维化的防治中, 抑制Skp2表达或干扰其E3连接酶的功能以减轻纤维化严重程度将为今后角膜纤维化的治疗提供重要参考。
2.5 Skp2与心脏纤维化在高血压或主动脉狭窄等心脏负荷增加的情况下, 心脏纤维化是导致心力衰竭的有害因素之一[63]。心肌内纤维蛋白的增加, 特别是间质和血管周围区域的纤维蛋白积累增加与心力衰竭的进展有关[64-68]。识别促进心脏成纤维细胞(cardiac fibroblasts, CFb) 有丝分裂、分泌和增殖潜能的特定途径可能成为治疗心脏纤维化的独特靶点。虽然心脏纤维化被认为是与心室重塑相关的主要病理特征[69], 但目前还没有特效的抗纤维化治疗方案来抑制充血性心力衰竭(congestive heart failure, CHF) 患者的心脏纤维化[70]。因而, 探索CFb内特定的信号通路对于寻找治疗CHF患者的新靶点至关重要。达沙替尼, 一种主要针对非受体酪氨酸激酶(NTK) 的多激酶抑制剂[71], 被证明在体内慢性压力超负荷(pressure overload, PO) 和体外培养的CFb模型中能够显著减少细胞外基质的沉积, 并且通过减少细胞增殖因子Skp2的核积聚, 从而减少了CFb的增殖和迁移, 发挥抗肥厚相关的纤维化, 改善心室功能[72]。综上, Skp2表达同心脏CFb增殖有关, 且参与抗心脏纤维化的防治进程。
3 Skp2的靶向干预基于Skp2在以上几种纤维化疾病中均发挥了独特作用, 因此针对Skp2抑制剂的研究对于多种疾病的治疗具有良好的前景。目前对于Skp2表达的干预主要有3种形式。第一种靶向Skp2表达, 如PPAR-γ (peroxisome proliferators-activated receptor-γ) 作为Skp2表达的关键负调控因子, 给予PPAR-γ可显著抑制PDGF-AA诱导的肾成纤维细胞增殖, 这种作用与抑制Skp2表达有关[60]。第二种靶向Skp2-SCF复合体, 科研人员针对Skp2-SCF复合物的新型抑制剂研究已经做了很多努力。阻断Skp1-Skp2的相互作用是抑制Skp2-SCF复合体E3连接酶活性的最有吸引力的策略, 对其阻断会导致Skp2的多个底物如p27和Akt泛素化的取消, 如compound 25[73, 74]。第三种为靶向Cks1 (Skp2-cyclin kinase subunit 1) 相互作用, 因为Cks1是SCF-Skp2泛素连接酶靶向p27的重要辅助因子, 所以其他研究集中在通过阻断Skp2-Cks1相互作用或取消Skp2-p27关联来特异性阻断Skp2介导的p27泛素化, 如基于PerkinElmer AlphaScreen技术的高通量筛选检测所产生的两种化合物NSC689857和NSC681152[75]。不断努力开发有效的Skp2抑制剂, 并使其具有良好的药物代谢和药代动力学特性, 将有助于为临床治疗多种疾病尤其是纤维化疾病提供新的方向。
4 总结与展望在细胞的正常周期进程中, Skp2的表达受到严格调控。但如果组织出现异常演变为不可逆转的纤维化反应时, 泛素蛋白酶体系平衡将被打破, 标志蛋白Skp2将在纤维化疾病中呈现过表达并发挥重要作用。如在组织纤维化过程中, Skp2能够抑制纤维化相关靶细胞如活化的HSCs和肺成纤维细胞的衰老进程, 发挥促进产生细胞外基质的肾成纤维细胞与心脏成纤维细胞的增殖作用等。Skp2在纤维化疾病中的独特作用以及抑制Skp2产生的抗纤维化作用, 增加了靶向Skp2成为治疗组织纤维化的一种新的有效治疗策略的可能性。
虽然有较多数据支持了Skp2对纤维化病程的调控作用, 但仍然有许多信息未知, 需要进一步明确和充分挖掘Skp2介导通路作为多种疾病药物作用靶点的潜能, 特别是Skp2不同的调节模式引起的不同病理生理功能。且Skp2基因与多种疾病的关系目前仍处于动物实验及细胞阶段, 对人体的有效性及安全性及其与其他致病因子的相关性有待进一步研究。因此, 深入了解Skp2基因发挥作用的真正作用及机制, 将对相关纤维化疾病的预防、诊治、评估等发挥重大作用。
作者贡献: 兰月娇、程明涵负责文献资料收集和论文撰写; 高建指导综述框架设计并对论文的核心内容提出指导性意见。
利益冲突: 作者声明没有任何利益冲突。
| [1] |
Wynn TA. Integrating mechanisms of pulmonary fibrosis[J]. J Exp Med, 2011, 208: 1339-1350. DOI:10.1084/jem.20110551 |
| [2] |
Wynn TA. Cellular and molecular mechanisms of fibrosis[J]. J Pathol, 2008, 214: 199-210. DOI:10.1002/path.2277 |
| [3] |
Wynn TA, Ramalingam TR. Mechanisms of fibrosis: therapeutic translation for fibrotic disease[J]. Nat Med, 2012, 18: 1028-1040. DOI:10.1038/nm.2807 |
| [4] |
Li LC, Li J, Gao J. Functions of galectin-3 and its role in fibrotic diseases[J]. J Pharmacol Exp Ther, 2014, 351: 336-343. DOI:10.1124/jpet.114.218370 |
| [5] |
Wu J, Su HK, Yu ZH, et al. Skp2 modulates proliferation, senescence and tumorigenesis of glioma[J]. Cancer Cell Int, 2020, 20: 71. DOI:10.1186/s12935-020-1144-z |
| [6] |
Wilkinson KD. Protein ubiquitination: a regulatory post-translational modification[J]. Anticancer Drug Des, 1987, 2: 211-229. |
| [7] |
Nakayama KI, Nakayama K. Ubiquitin ligases: cell-cycle control and cancer[J]. Nat Rev Cancer, 2006, 6: 369-381. DOI:10.1038/nrc1881 |
| [8] |
Cai Z, Moten A, Peng D, et al. The Skp2 pathway: a critical target for cancer therapy[J]. Semin Cancer Biol, 2020, 67: 16-33. DOI:10.1016/j.semcancer.2020.01.013 |
| [9] |
Lee Y, Lim HS. Skp2 inhibitors: novel anticancer strategies[J]. Curr Med Chem, 2016, 23: 2363-2379. DOI:10.2174/0929867323666160510122624 |
| [10] |
Zhang H, Kobayashi R, Galaktionov K, et al. p19Skp1 and p45Skp2 are essential elements of the cyclin A-CDK2 S phase kinase[J]. Cell, 1995, 82: 915-925. DOI:10.1016/0092-8674(95)90271-6 |
| [11] |
Chan CH, Lee SW, Wang J, et al. Regulation of Skp2 expression and activity and its role in cancer progression[J]. ScientificWorldJournal, 2010, 10: 1001-1015. DOI:10.1100/tsw.2010.89 |
| [12] |
Nakayama K, Nagahama H, Minamishima YA, et al. Targeted disruption of Skp2 results in accumulation of cyclin E and p27(Kip1), polyploidy and centrosome overduplication[J]. EMBO J, 2000, 19: 2069-2081. DOI:10.1093/emboj/19.9.2069 |
| [13] |
Ganoth D, Bornstein G, Ko TK, et al. The cell-cycle regulatory protein Cks1 is required for SCF (Skp2)-mediated ubiquitinylation of p27[J]. Nat Cell Biol, 2001, 3: 321-324. DOI:10.1038/35060126 |
| [14] |
Hao B, Zheng N, Schulman BA, et al. Structural basis of the Cks1-dependent recognition of p27 (Kip1) by the SCF (Skp2) ubiquitin ligase[J]. Mol Cell, 2005, 20: 9-19. DOI:10.1016/j.molcel.2005.09.003 |
| [15] |
Sitry D, Seeliger MA, Ko TK, et al. Three different binding sites of Cks1 are required for p27-ubiquitin ligation[J]. J Biol Chem, 2002, 277: 42233-42240. DOI:10.1074/jbc.M205254200 |
| [16] |
Spruck C, Strohmaier H, Watson M, et al. A CDK-independent function of mammalian Cks1: targeting of SCF (Skp2) to the CDK inhibitor p27Kip1[J]. Mol Cell, 2001, 7: 639-650. DOI:10.1016/S1097-2765(01)00210-6 |
| [17] |
Huang H, Regan KM, Wang F, et al. Skp2 inhibits FOXO1 in tumor suppression through ubiquitin-mediated degradation[J]. Proc Natl Acad Sci U S A, 2005, 102: 1649-1654. DOI:10.1073/pnas.0406789102 |
| [18] |
Calvisi DF, Ladu S, Pinna F, et al. SKP2 and CKS1 promote degradation of cell cycle regulators and are associated with hepatocellular carcinoma prognosis[J]. Gastroenterology, 2009, 137: 1816-1826. DOI:10.1053/j.gastro.2009.08.005 |
| [19] |
Dehan E, Pagano M. Skp2, the FoxO1 hunter[J]. Cancer Cell, 2005, 7: 209-210. DOI:10.1016/j.ccr.2005.02.014 |
| [20] |
Linton PJ, Gurney M, Sengstock D, et al. This old heart: cardiac aging and autophagy[J]. J Mol Cell Cardiol, 2015, 83: 44-54. DOI:10.1016/j.yjmcc.2014.12.017 |
| [21] |
Bornstein G, Bloom J, Sitry-Shevah D, et al. Role of the SCFSkp2 ubiquitin ligase in the degradation of p21Cip1 in S phase[J]. J Biol Chem, 2003, 278: 25752-25757. DOI:10.1074/jbc.M301774200 |
| [22] |
Yu ZK, Gervais JL, Zhang H. Human CUL-1 associates with the SKP1/SKP2 complex and regulates p21(CIP1/WAF1) and cyclin D proteins[J]. Proc Natl Acad Sci U S A, 1998, 95: 11324-11329. DOI:10.1073/pnas.95.19.11324 |
| [23] |
Lee SW, Li CF, Jin G, et al. Skp2-dependent ubiquitination and activation of LKB1 is essential for cancer cell survival under energy stress[J]. Mol Cell, 2015, 57: 1022-1033. DOI:10.1016/j.molcel.2015.01.015 |
| [24] |
Chan CH, Li CF, Yang WL, et al. The Skp2-SCF E3 ligase regulates Akt ubiquitination, glycolysis, herceptin sensitivity, and tumorigenesis[J]. Cell, 2012, 151: 913-914. DOI:10.1016/j.cell.2012.10.025 |
| [25] |
Yao F, Zhou Z, Kim J, et al. SKP2- and OTUD1-regulated non-proteolytic ubiquitination of YAP promotes YAP nuclear localization and activity[J]. Nat Commun, 2018, 9: 2269. DOI:10.1038/s41467-018-04620-y |
| [26] |
Wu J, Zhang X, Zhang L, et al. Skp2 E3 ligase integrates ATM activation and homologous recombination repair by ubiquitinating NBS1[J]. Mol Cell, 2012, 46: 351-361. DOI:10.1016/j.molcel.2012.02.018 |
| [27] |
Lee SW, Lin HK. A new mechanism for LKB1 activation[J]. Mol Cell Oncol, 2018, 5: e1035691. DOI:10.1080/23723556.2015.1035691 |
| [28] |
Jin G, Lee SW, Zhang X, et al. Skp2-mediated RagA ubiquitination elicits a negative feedback to prevent amino-acid-dependent mTORC1 hyperactivation by recruiting GATOR1[J]. Mol Cell, 2015, 58: 989-1000. DOI:10.1016/j.molcel.2015.05.010 |
| [29] |
Ruan D, He J, Li CF, et al. Skp2 deficiency restricts the progression and stem cell features of castration-resistant prostate cancer by destabilizing Twist[J]. Oncogene, 2017, 36: 4299-4310. DOI:10.1038/onc.2017.64 |
| [30] |
Chan CH, Lee SW, Li CF, et al. Deciphering the transcriptional complex critical for RhoA gene expression and cancer metastasis[J]. Nat Cell Biol, 2010, 12: 457-467. DOI:10.1038/ncb2047 |
| [31] |
Kitagawa M, Lee SH, McCormick F. Skp2 suppresses p53-dependent apoptosis by inhibiting p300[J]. Mol Cell, 2008, 29: 217-231. DOI:10.1016/j.molcel.2007.11.036 |
| [32] |
Sutterluty H, Chatelain E, Marti A, et al. p45SKP2 promotes p27Kip1 degradation and induces S phase in quiescent cells[J]. Nat Cell Biol, 1999, 1: 207-214. DOI:10.1038/12027 |
| [33] |
Fujita T, Liu W, Doihara H, et al. Dissection of the APCCdh1-Skp2 cascade in breast cancer[J]. Clin Cancer Res, 2008, 14: 1966-1975. DOI:10.1158/1078-0432.CCR-07-1585 |
| [34] |
Kamura T, Hara T, Kotoshiba S, et al. Degradation of p57Kip2 mediated by SCFSkp2-dependent ubiquitylation[J]. Proc Natl Acad Sci U S A, 2003, 100: 10231-10236. DOI:10.1073/pnas.1831009100 |
| [35] |
Tedesco D, Lukas J, Reed SI. The pRb-related protein p130 is regulated by phosphorylation-dependent proteolysis via the protein-ubiquitin ligase SCF (Skp2)[J]. Genes Dev, 2002, 16: 2946-2957. DOI:10.1101/gad.1011202 |
| [36] |
Wang H, Bauzon F, Ji P, et al. Skp2 is required for survival of aberrantly proliferating Rb1-deficient cells and for tumorigenesis in Rb1+/- mice[J]. Nat Genet, 2010, 42: 83-88. DOI:10.1038/ng.498 |
| [37] |
Lin HK, Wang G, Chen Z, et al. Phosphorylation-dependent regulation of cytosolic localization and oncogenic function of Skp2 by Akt/PKB[J]. Nat Cell Biol, 2009, 11: 420-432. DOI:10.1038/ncb1849 |
| [38] |
Zhang Y, Zvi YS, Batko B, et al. Down-regulation of Skp2 expression inhibits invasion and lung metastasis in osteosarcoma[J]. Sci Rep, 2018, 8: 14294. DOI:10.1038/s41598-018-32428-9 |
| [39] |
Parola M, Pinzani M. Pathophysiology of organ and tissue fibrosis[J]. Mol Aspects Med, 2019, 65: 1. DOI:10.1016/j.mam.2019.02.001 |
| [40] |
Duval F, Moreno-Cuevas JE, Gonzalez-Garza MT, et al. Liver fibrosis and mechanisms of the protective action of medicinal plants targeting inflammation and the immune response[J]. Int J Inflam, 2015, 2015: 943497. |
| [41] |
Bataller R, Brenner DA. Liver fibrosis[J]. J Clin Invest, 2005, 115: 209-218. DOI:10.1172/JCI24282 |
| [42] |
Friedman SL. Mechanisms of hepatic fibrogenesis[J]. Gastroenterology, 2008, 134: 1655-1669. DOI:10.1053/j.gastro.2008.03.003 |
| [43] |
Anthony B, Allen JT, Li YS, et al. Hepatic stellate cells and parasite-induced liver fibrosis[J]. Parasit Vectors, 2010, 3: 60. DOI:10.1186/1756-3305-3-60 |
| [44] |
Duval F, Moreno-Cuevas JE, Gonzalez-Garza MT, et al. Liver fibrosis and protection mechanisms action of medicinal plants targeting apoptosis of hepatocytes and hepatic stellate cells[J]. Adv Pharmacol Sci, 2014, 2014: 373295. |
| [45] |
Zhang X, Han X, Yin L, et al. Potent effects of dioscin against liver fibrosis[J]. Sci Rep, 2015, 5: 9713. DOI:10.1038/srep09713 |
| [46] |
Krizhanovsky V, Yon M, Dickins RA, et al. Senescence of activated stellate cells limits liver fibrosis[J]. Cell, 2008, 134: 657-667. DOI:10.1016/j.cell.2008.06.049 |
| [47] |
Zhou XH, Wu JY, Huang XQ, et al. Identification and characterization of Schistosoma japonicum Sjp40, a potential antigen candidate for the early diagnosis of schistosomiasis[J]. Diagn Microbiol Infect Dis, 2010, 67: 337-345. DOI:10.1016/j.diagmicrobio.2010.03.003 |
| [48] |
Xu T, Chen J, Zhu D, et al. Egg antigen p40 of Schistosoma japonicum promotes senescence in activated hepatic stellate cells via SKP2/P27 signaling pathway[J]. Sci Rep, 2017, 7: 275. DOI:10.1038/s41598-017-00326-1 |
| [49] |
Duan Y, Pan J, Chen J, et al. Soluble egg antigens of Schistosoma japonicum induce senescence of activated hepatic stellate cells by activation of the FoxO3a/SKP2/P27 pathway[J]. PLoS Negl Trop Dis, 2016, 10: e0005268. DOI:10.1371/journal.pntd.0005268 |
| [50] |
Mikamo M, Kitagawa K, Sakai S, et al. Inhibiting Skp2 E3 ligase suppresses bleomycin-induced pulmonary fibrosis[J]. Int J Mol Sci, 2018, 19: 474. DOI:10.3390/ijms19020474 |
| [51] |
Li H, Zhao X, Shan H, et al. MicroRNAs in idiopathic pulmonary fibrosis: involvement in pathogenesis and potential use in diagnosis and therapeutics[J]. Acta Pharm Sin B, 2016, 6: 531-539. DOI:10.1016/j.apsb.2016.06.010 |
| [52] |
Wang D, Qin H, Du W, et al. Inhibition of S-phase kinase-associated protein 2 (Skp2) reprograms and converts diabetogenic T cells to Foxp3+ regulatory T cells[J]. Proc Natl Acad Sci U S A, 2012, 109: 9493-9498. DOI:10.1073/pnas.1207293109 |
| [53] |
Pereira LMS, Gomes STM, Ishak R, et al. Regulatory T cell and forkhead box protein 3 as modulators of immune homeostasis[J]. Front Immunol, 2017, 8: 605. DOI:10.3389/fimmu.2017.00605 |
| [54] |
Park S, Chung HS, Shin D, et al. Adenovirus-mediated Foxp3 expression in lung epithelial cells reduces airway inflammation in ovalbumin and cockroach-induced asthma model[J]. Exp Mol Med, 2016, 48: e259. DOI:10.1038/emm.2016.83 |
| [55] |
Li Y, Liang J, Yang T, et al. Hyaluronan synthase 2 regulates fibroblast senescence in pulmonary fibrosis[J]. Matrix Biol, 2016, 55: 35-48. DOI:10.1016/j.matbio.2016.03.004 |
| [56] |
Liu Y. Cellular and molecular mechanisms of renal fibrosis[J]. Nat Rev Nephrol, 2011, 7: 684-696. |
| [57] |
Sharma SK, Zou H, Togtokh A, et al. Burden of CKD, proteinuria, and cardiovascular risk among Chinese, Mongolian, and Nepalese participants in the International Society of Nephrology Screening Programs[J]. Am J Kidney Dis, 2010, 56: 915-927. DOI:10.1053/j.ajkd.2010.06.022 |
| [58] |
Lin B, Shao L, Luo Q, et al. Prevalence of chronic kidney disease and its association with metabolic diseases: a cross-sectional survey in Zhejiang province, Eastern China[J]. BMC Nephrol, 2014, 15: 36. DOI:10.1186/1471-2369-15-36 |
| [59] |
Suzuki S, Fukasawa H, Kitagawa K, et al. Renal damage in obstructive nephropathy is decreased in Skp2-deficient mice[J]. Am J Pathol, 2007, 171: 473-483. DOI:10.2353/ajpath.2007.070279 |
| [60] |
Lu J, Shi J, Gui B, et al. Activation of PPAR-gamma inhibits PDGF-induced proliferation of mouse renal fibroblasts[J]. Eur J Pharmacol, 2016, 789: 222-228. DOI:10.1016/j.ejphar.2016.06.051 |
| [61] |
Tang H, Fan D, Lei CT, et al. MAD2B promotes tubular epithelial-to-mesenchymal transition and renal tubulointerstitial fibrosis via Skp2[J]. J Mol Med (Berl), 2016, 94: 1297-1307. DOI:10.1007/s00109-016-1448-6 |
| [62] |
Bargagna-Mohan P, Paranthan RR, Hamza A, et al. Corneal antifibrotic switch identified in genetic and pharmacological deficiency of vimentin[J]. J Biol Chem, 2012, 287: 989-1006. DOI:10.1074/jbc.M111.297150 |
| [63] |
Xiao D, Zhang Y, Wang R, et al. Emodin alleviates cardiac fibrosis by suppressing activation of cardiac fibroblasts via upregulating metastasis associated protein 3[J]. Acta Pharm Sin B, 2019, 9: 724-733. DOI:10.1016/j.apsb.2019.04.003 |
| [64] |
Weber KT, Brilla CG. Pathological hypertrophy and cardiac interstitium. Fibrosis and renin-angiotensin-aldosterone system[J]. Circulation, 1991, 83: 1849-1865. DOI:10.1161/01.CIR.83.6.1849 |
| [65] |
Mandinov L, Eberli FR, Seiler C, et al. Diastolic heart failure[J]. Cardiovasc Res, 2000, 45: 813-825. DOI:10.1016/S0008-6363(99)00399-5 |
| [66] |
Kai H, Kuwahara F, Tokuda K, et al. Diastolic dysfunction in hypertensive hearts: roles of perivascular inflammation and reactive myocardial fibrosis[J]. Hypertens Res, 2005, 28: 483-490. DOI:10.1291/hypres.28.483 |
| [67] |
Zile MR, Baicu CF. Biomarkers of diastolic dysfunction and myocardial fibrosis: application to heart failure with a preserved ejection fraction[J]. J CardiovascTransl Res, 2013, 6: 501-515. |
| [68] |
Zile MR, Baicu CF, Ikonomidis JS, et al. Myocardial stiffness in patients with heart failure and a preserved ejection fraction: contributions of collagen and titin[J]. Circulation, 2015, 131: 1247-1259. DOI:10.1161/CIRCULATIONAHA.114.013215 |
| [69] |
Gonzalez A, Lopez B, Diez J. Fibrosis in hypertensive heart disease: role of the renin-angiotensin-aldosterone system[J]. Med Clin North Am, 2004, 88: 83-97. DOI:10.1016/S0025-7125(03)00125-1 |
| [70] |
Leask A. Potential therapeutic targets for cardiac fibrosis: TGFbeta, angiotensin, endothelin, CCN2, and PDGF, partners in fibroblast activation[J]. Circ Res, 2010, 106: 1675-1680. DOI:10.1161/CIRCRESAHA.110.217737 |
| [71] |
Gratacap MP, Martin V, Valera MC, et al. The new tyrosine-kinase inhibitor and anticancer drug dasatinib reversibly affects platelet activation in vitro and in vivo[J]. Blood, 2009, 114: 1884-1892. |
| [72] |
Balasubramanian S, Pleasant DL, Kasiganesan H, et al. Dasatinib attenuates pressure overload induced cardiac fibrosis in a murine transverse aortic constriction model[J]. PLoS One, 2015, 10: e0140273. DOI:10.1371/journal.pone.0140273 |
| [73] |
Chan CH, Morrow JK, Li CF, et al. Pharmacological inactivation of Skp2 SCF ubiquitin ligase restricts cancer stem cell traits and cancer progression[J]. Cell, 2013, 154: 556-568. DOI:10.1016/j.cell.2013.06.048 |
| [74] |
Chan CH, Morrow JK, Zhang S, et al. Skp2: a dream target in the coming age of cancer therapy[J]. Cell Cycle, 2014, 13: 679-680. DOI:10.4161/cc.27853 |
| [75] |
Ungermannova D, Lee J, Zhang G, et al. High-throughput screening AlphaScreen assay for identification of small-molecule inhibitors of ubiquitin E3 ligase SCFSkp2-Cks1[J]. J Biomol Screen, 2013, 18: 910-920. DOI:10.1177/1087057113485789 |
 2021, Vol. 56
2021, Vol. 56


