2. 山东省中药质量控制与全产业链建设协同创新中心, 山东 济南 250355;
3. 山东英才学院, 山东 济南 250100
2. Shandong Provincial Collaborative Innovation Center for Quality Control and Construction of the Whole Industrial Chain of Traditional Chinese Medicine, Jinan 250355, China;
3. Shandong Yingcai University, Jinan 250100, China
金银花为忍冬科植物忍冬Lonicera japonica Thunb.的干燥花蕾或带初开的花, 具有清热解毒、疏散风热的功效[1]。近年来, 金银花的需求量大幅攀升, 种植面积逐年增加, 仅山东省就已经超过65万亩。白粉病是金银花产区的常见主要病害之一, 危害叶、花蕾和幼嫩枝条, 形成灰白色粉状霉层, 后期呈灰褐色坏死, 发病严重时导致叶片脱落、花蕾畸形和枝条枯死, 造成严重减产和品质降低[2-5]。长期以来, 人们主要利用化学农药防治金银花白粉病。化学农药频繁使用导致的农药残留, 严重影响金银花的品质, 不符合中药材规范化种植的要求[6]。而利用基因编辑技术培育抗病品种, 已成为防治病害的安全有效途径, 是植物病害防治研究的热点之一[7-9]。
MLO (mildew resistance locus O) 家族基因是植物特有的“感病基因”, 普遍认为它对白粉病具有负调控作用, 被认为是研究植物广谱抗病性的最佳模式基因[10, 11]。无论在双子叶植物拟南芥(Arabidopsis thaliana) 还是单子叶植物大麦(Hordeum vulgare) 上, 都有证据证明MLO突变体对白粉病菌具有广谱抗性, 在农作物白粉病育种方面具有重要的应用价值。1942年, Freisleben等[12]首次使用X射线诱变了德国大麦品种Haisa, 获得的突变体产生了对大麦白粉菌的广谱抗性, MLO抗性从此为人们所了解。随后Büschges等[13]克隆了大麦的MLO基因, 并将其突变为隐性基因, 显著提高了大麦的抗白粉病能力。王延鹏等[14]通过基因编辑, 同时敲除小麦基因组中3个MLO同源基因, 获得了高抗白粉病的突变体植株。Nekrasov等[15]利用CRISPR/Cas9技术产生了对白粉病真菌病原体具有抗性的非转基因番茄品种Tomelo。Michela等[16]将MLO基因在番茄SlMLO突变体中过表达, 恢复了白粉病感病表型, 证实了MLO基因在白粉病发生过程中是必需的。Pessina等[17]通过RNA干扰抑制MdMLO11和MdMLO19, 降低了苹果对白粉病的易感性。Wan等[18]利用CRISPR/Cas9技术编辑了两个葡萄MLO基因VvMLO3和VvMLO4, 通过突变一个等位基因降低VvMLO3的表达显著提高了敏感葡萄品种对白粉病的抗性。可见, 通过MLO的下调表达, 可以显著提高突变体植株的抗病能力。关于金银花MLO基因的研究尚未见报道。
在金银花基因组测序的基础上, 本研究对已获得的25个MLO家族候选基因进行了基础理化性质、亚细胞定位、系统发育、表达水平等分析, 找到了与白粉病发生密切相关的MLO基因, 为进一步利用MLO作为靶基因, 培育金银花抗白粉病新种质奠定了基础。
材料与方法样品 金银花基因组测序选用的材料为山东中医药大学培育的金银花新品种“华金6号”。
试剂 多糖多酚植物RNA提取试剂盒(RC401) (南京诺唯赞生物科技股份有限公司); SYBR Preminx EX TaqTM (ROX) 和RT反转录试剂盒(TaKaRa公司); DNA分子量MakerDL2000 [天根生化科技(北京) 有限公司]; 引物由铂尚生物技术(上海) 有限公司负责合成。
仪器 CFX96 Touch Real-Time PCR仪(Bid-Rad公司); 超微量核酸检测仪、凝胶成像仪(GE公司); 5424D型高速离心机(Eppendorf公司)。
金银花MLO基因的获得 在金银花基因组测序的基础上, 通过基因注释、同源比对以及PCR克隆等方法鉴定、获得了25个MLO基因, 分别命名为MLO1~MLO25。
金银花MLO蛋白理化性质分析 利用ExPASy ProtParam (http://web.expasy.org/protparam/) 对获得的金银花的MLO蛋白序列进行理化性质分析。利用Cell-PLoc 2.0在线工具(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi) 对金银花MLO家族成员进行亚细胞定位分析。利用TMHMM在线分析工具(http://www.cbs.dtu.dk/services/TMHMM/) 对金银花MLO蛋白的跨膜结构进行预测。利用钙调素结合蛋白(CaMBP) 数据库(http://calcium.uhnres.utoronto.ca/ctdb/pub_pages/search/index.htm) 对MLO蛋白进行CaM结合结构域预测。
金银花MLO家族进化分析 从TAIR数据库(http://www.arabidopsis.org/) 下载拟南芥(Arabidopsis thaliala) MLO家族成员的蛋白全长序列, 从NCBI数据库获得小麦(Triticum aestivum)、普通烟草(Nicotiana tabacum)、林烟草(Nicotiana sylvestris)、绒毛状烟草(Nicotiana tomentosiformis) 的MLO家族成员的蛋白全长序列, 从UniProt数据库(https://www.uniprot.org/uniprot/) 下载番茄(Solanum lycopersicum) MLO家族成员的蛋白全长序列。利用Clustal X程序对以上MLO蛋白序列进行多序列比对, 基于比对结果利用MEGA X软件采用邻接法(neighbor-joining, NJ) 构建系统进化树, 检验参数(bootstrap) 设置为1 000。
金银花MLO蛋白的保守位点和保守结构域分析 选择蛋白序列较为完整的25条MLO序列与普通烟草、拟南芥、番茄的MLO蛋白进行序列比对, 利用MEME在线工具(http://meme-suite.org/tools/meme) 对获得的金银花MLO家族成员的蛋白序列进行保守结构域分析, 参数设置为: motif长度限制在6~50个氨基酸残基范围内, 识别的motif总数限制为10个。
金银花MLO基因表达分析 分别取生长旺盛的茎、叶和花, 液氮迅速冷冻, 于-80 ℃保存备用。健康生长的“华金6号”金银花, 进行白粉病接种实验。取新鲜的感染白粉病的金银花叶片, 与正常的叶片摩擦, 使其叶片下表面接触到白粉病菌, 分别在接种后的0、6、9、12、24和48 h取叶片, 液氮迅速冷冻, 于-80 ℃保存备用。
通过生物信息学分析, 剔除跨膜结构域少或非膜定位的MLO蛋白3个, 对剩余22个基因进行表达分析。根据MLO基因的CDS设计荧光定量特异引物, 选用金银花Actin基因(NTU60495) 为内参基因, 并设计实时荧光定量PCR引物(表 1)。采用SYBR Green法在实时荧光定量PCR仪上进行实时荧光定量PCR实验, 每个组织设置3次生物学重复和3次实验重复, PCR反应体系和反应程序参照TaKaRa定量PCR试剂盒说明书。分析MLO基因在金银花不同组织中的表达情况, 相对表达量按照2-ΔΔCT法进行计算。
| Table 1 Primer sequence for real-time PCR |
由表 2可知, 金银花MLO家族蛋白的氨基酸数量在130~846之间, 分子质量介于14.25~96.79 kDa, 其中MLO5、MLO20和MLO24三个蛋白较小, 只有不到300个氨基酸, MLO14最大, 为846个氨基酸; 蛋白质的理论等电点在5.02~9.78之间, 除MLO5、MLO9、MLO13、MLO23和MLO24 5个蛋白以外, 其他的蛋白质理论等电点都大于7。蛋白稳定系数分析显示有9个MLO蛋白的不稳定系数小于40, 是稳定蛋白; 16个是不稳定蛋白。蛋白序列脂肪族氨基酸指数(AI) 在66.20~107.86之间。疏水性分析结果表明, 25个金银花MLO蛋白中有11个疏水性为负值, 属于亲水性蛋白, 14个金银花MLO蛋白的疏水性为正值, 为疏水性蛋白。
| Table 2 The prediction of physicochemical properties of MLO proteins in Lonicera japonica |
亚细胞定位的预测结果表明, 大部分蛋白定位于细胞膜上, MLO5定位于细胞核上, MLO19和MLO22定位于细胞膜和叶绿体上, MLO20定位在细胞膜、叶绿体、线粒体、细胞核、液泡(表 2)。跨膜结构域预测发现金银花MLO蛋白的跨膜结构域多数为4~7个, MLO14最多为10个, MLO5、MLO23和MLO24三个蛋白不含或只有1或2个跨膜结构域。对25个金银花MLO蛋白进行钙离子结合区预测, 仅有MLO18在227处有钙离子结合区。
2 金银花MLO蛋白的保守位点和保守结构域分析MLO蛋白相对比较保守, 图 1可知金银花MLO蛋白的保守氨基酸位点分布大部分与文献报道的保守氨基酸位点一致, 在跨膜结构域3和跨膜结构域4之间的保守位点与烟草、番茄、拟南芥的不同, 金银花MLO蛋白缺少F、Q、Y、R、F、F、Y位点。MLO1、MLO6、MLO14等3个蛋白具有肽结构域Ⅰ, MLO1、MLO6、MLO11、MLO14、MLO17、MLO22、MLO25等7个蛋白在C末端具有肽结构域Ⅱ。
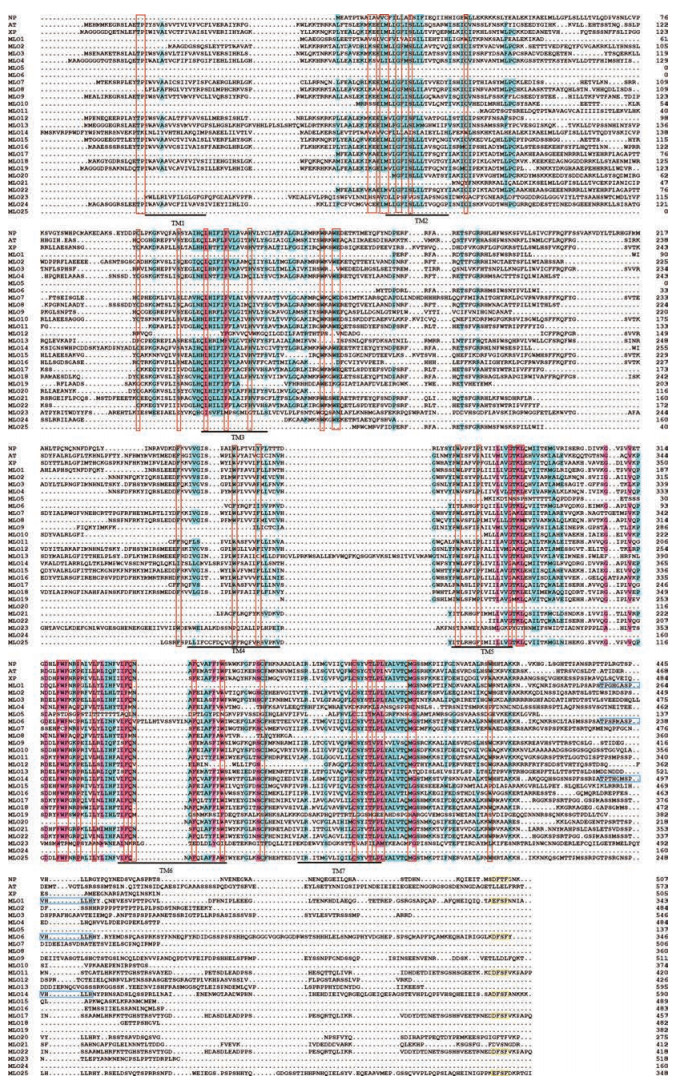
|
Figure 1 The alignment of MLO sequences in Lonicera japonica. (Red background homology > 75%, the blue background said homology > 50%, the red line boxes represent conservative amino acid sites, TM said transmembrane domain structure, the blue line box said peptide structure domainⅠ, the yellow line said peptide structure domain Ⅱ) |
金银花MLO家族成员的保守结构域分析得到了MLO家族的保守结构域区段, 这个保守的区段共包含10个motif (图 2)。这10个motif含有不同长度的氨基酸序列(图 3)。有2条序列含有10个保守结构域, 4条序列含有9个保守结构域, 8条序列含有8个保守结构域, 2条序列含有7个保守结构域, 1条序列含有6个保守结构域, MLO23没有保守结构域, MLO5只含有1个保守结构域。

|
Figure 2 The analysis of motif composition of MLO proteins in Lonicera japonica |

|
Figure 3 The analysis of amino acid sequences of the conserved motif blocks in Lonicera japonica. (This figure shows the motif sequence information in Figure 2. The height of the letter represents the conservatism of the amino acid; the higher the conservatism, the greater the conservatism.) |
系统进化分析表明(图 4), 133条MLO蛋白聚类形成5个亚组, 各亚组包含不同物种的蛋白数如表 3所示。其中, 第Ⅱ亚组包含蛋白数最多, 有6个金银花MLO蛋白, 第Ⅰ亚组包含4个金银花MLO蛋白, 数量最少, 第Ⅴ亚组包含5个金银花MLO蛋白。
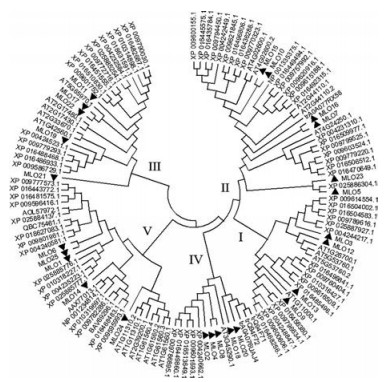
|
Figure 4 The phylogenetic tree of MLO proteins. ▲ represents the MLO protein in honeysuckle, and Ⅰ, Ⅱ, Ⅲ, Ⅳ and Ⅴ represent the different branches of MLO proteins |
| Table 3 The amount of MLO proteins in different species |
通过生物信息学分析, 剔除跨膜结构域少或非膜定位的MLO蛋白3个, 熔解曲线分析表明(图 5), MLO20的引物特异性较低, 故剔除该基因, 对剩余21个基因进行表达分析。本研究所用引物具有较高特异性, 满足实验要求。由图 6可以发现, MLO9、MLO10、MLO11、MLO12、MLO13、MLO17、MLO18、MLO22、MLO25在叶中高表达, MLO6、MLO15在茎中高表达, MLO2、MLO19在花中高表达。
|
Figure 5 Melt diagram. The red curve shows the melting curve of MLO20 |
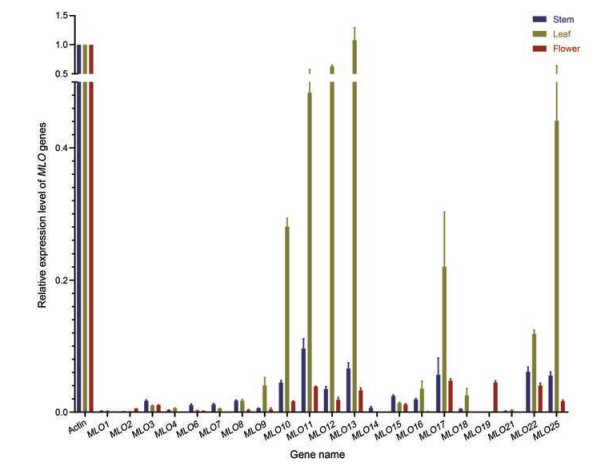
|
Figure 6 The relative expression levels of MLO genes in different tissues of Lonicera japonica. The relative expression level was calculated according to 2-ΔΔCT method, P < 0.05 |
接种白粉菌后, MLO14变化最明显, 表达量显著上调, 在接种后48 h表达量最大, 比对照提高2 000多倍。MLO2、MLO15、MLO21与对照相比也有明显变化, MLO2表达量呈现先增加再减少的趋势, 接种后24 h表达量最达。MLO15在接种后9、24、48 h表达量相差不大。MLO21在接种后9 h表达量最大, 24 h次之。其他基因无明显变化(图 7)。

|
Figure 7 The relative expression levels of MLO genes in Lonicera japonica after powdery mildew inoculation. The relative gene expression was calculated by 2-ΔΔCT method with the expression level of powdery mildew at 0 h after inoculation as control, P < 0.05 |
MLO基因是一类单基因控制的隐性抗病基因, MLO突变体具有对白粉菌广谱、高效且持久的抗性。本研究在金银花全基因组测序的基础上, 通过功能注释获得了该物种25个MLO家族全长CDS序列。生物信息学分析发现, MLO5、MLO23和MLO24三个蛋白分子质量均小于多数已报道的MLO蛋白, 且跨膜结构域数量明显不足, 不具有MLO蛋白的典型特征, MLO20的引物特异性不够。因此, 后期仅对筛选出的21个蛋白进行了深入研究。
研究认为, MLO蛋白定位于细胞质膜上, 在白粉菌侵入的过程中, MLO蛋白会逐渐聚集在白粉菌侵染位点的下方[19-21]。这阻止了宿主细胞内吸器的形成和真菌的定殖, 这种阻力与乳头的形成有关[22]。例如蔷薇科植物的82个MLO蛋白中, 大多数分布于质膜中, 其次分布于内质网和液泡中, 还有少量分布于细胞核、线粒体和高尔基体中[23-25]; 烟草的29个MLO蛋白均定位在细胞膜上[26]; 月季的19个MLO蛋白均定位细胞膜上[27]; 谷子的12个MLO蛋白大部分定位于细胞膜上, 少数位于细胞核和细胞质中[28]。本研究获得的21个MLO蛋白均具有膜定位信号, 符合该家族的基本特征。
跨膜结构域是MLO蛋白膜定位所必需的, 过去一直认为其数量都是7个。但越来越多的研究发现MLO蛋白的跨膜结构域并不一致, 低等植物MLO蛋白的跨膜结构域少于5个, 而高等植物一般有4~8个跨膜结构域[29, 30]。这种差异可能是由种间进化或不同物种自身特性决定的[31]。本研究剔除了4个没有跨膜结构域或者数量小于3个的MLO蛋白。其余21个蛋白均具有4个以上的跨膜结构域。值得关注的是MLO14, 有10个跨膜结构域。这是否暗示着该蛋白在白粉病发生过程中具有特殊的作用, 作者会在下一步的工作中重点关注。
MLO蛋白在不同物种间十分保守, 且保守结构域越多, 其与白粉病的关系越密切。Panstruga[32]提出MLO蛋白C端的肽结构域可能与植株对白粉病的敏感性相关。本研究发现, 金银花中有3个MLO蛋白具有肽结构域Ⅰ, 有7个MLO蛋白具有肽结构域Ⅱ, MLO1、MLO6和MLO14同时具有这2个结构域。有趣的是, 不同于MLO6, MLO14在接种白粉病菌后显著上调表达, 推测其可能与金银花对白粉病的敏感性密切相关。对该基因的下调表达, 有可能会获得抗白粉病的金银花新种质。同时, 关于这两个肽结构域在MLO蛋白与病原菌互作中的作用也值得进一步深入研究。
作者贡献: 第一作者李小丽负责生物信息学分析、RNA提取及论文撰写; 魏丽、刘谦开展基因的表达分析; 李佳、张芳和张永清参与实验材料的准备及数据分析; 通讯作者蒲高斌指导选题及方案实施, 并对论文进行了修改。
利益冲突: 本文所有作者之间不存在利益冲突。
| [1] |
Chinese Pharmacopoeia Commission. Pharmacopeia of the People's Republic of China (中华人民共和国药典)[S]. Beijing: China Medical Science Press, 2020: 52, 230.
|
| [2] |
Chen ML, Liu HY, Li Q, et al. Effect of the occurrence degree of powdery mildew on the content of chlorogenic acid in Lonicera japonica[J]. China J Chin Mater Med (中国中药杂志), 2006, 31: 846-847. |
| [3] |
Yang F. Control effect of three fungicides against powdery mildew of Lonicera japonica Thunb[J]. J Anhui Agric (安徽农业学报), 2017, 45: 162-163+171. |
| [4] |
Su GH, Ou SS, He YQ, et al. Analysis on influencing factors for Lonicera japonica withering in summer[J]. J Anhui Agric (安徽农业学报), 2016, 44: 37-39. |
| [5] |
Yu L, She HL. Occurrence regularity and comprehensive control techniques of powdery mildew of honeysuckle[J]. Mod Rural Sci Technol (现代农村科技), 2012, 16: 29. |
| [6] |
Ye GB, Zhuang QH, Zhu GY, et al. Situation of pesticide residues and development of pesticide products registered for Lonicera Japonicae Flos in China[J]. Pest Sci Admin (农药科学与管理), 2020, 41: 26-32. |
| [7] |
Chen CR, He FZ, Liu MZ, et al. Application of expression quantitative trait loci analysis in pharmacogenomics[J]. Acta Pharm Sin (药学学报), 2017, 52: 1203-1208. |
| [8] |
Wang Y, Huang G, Yang H, et al. Advances on nonviral vectors of CRISPR/Cas9 system for genome editing[J]. Acta Pharm Sin (药学学报), 2020, 55: 2606-2617. |
| [9] |
Lu D, Li L, Deng XM. CRISPR/Cas9 and its application in drugs development[J]. Acta Pharm Sin (药学学报), 2018, 53: 11-20. |
| [10] |
Win KT, Zhang C, Lee S. Genome-wide identification and description of MLO family genes in pumpkin (Cucurbita maxima Duch.)[J]. Hort Environ Biotechnol, 2018, 59: 397-410. DOI:10.1007/s13580-018-0036-9 |
| [11] |
Shi JL, Wan HJ, Zai WS, et al. Phylogenetic relationship of plant MLO genes and transcriptional response of MLO genes to ralstonia solanacearum in tomato[J]. Genes, 2020, 11: 487. DOI:10.3390/genes11050487 |
| [12] |
Freisleben R, Lein A. Über die auffindung einer mehltauresistenten mutante nach röntgenbestrahlung einer anfälligen reinen linie von sommergerste[J]. Naturwissenschaften, 1942, 30: 608. DOI:10.1007/BF01488231 |
| [13] |
Büschges R, Hollricher K, Panstruga R, et al. The barley MLO gene: a novel control element of plant pathogen resistance[J]. Cell, 1997, 88: 695-705. DOI:10.1016/S0092-8674(00)81912-1 |
| [14] |
Wang Y, Cheng X, Shan Q, et al. Simultaneous editing of three homoeoalleles in hexaploid bread wheat confers heritable resistance to powdery mildew[J]. Nat Biotechnol, 2014, 32: 947-951. DOI:10.1038/nbt.2969 |
| [15] |
Nekrasov V, Wang C, Win J, et al. Rapid generation of a transgene-free powdery mildew resistant tomato by genome deletion[J]. Sci Rep, 2017, 7: 482. DOI:10.1038/s41598-017-00578-x |
| [16] |
Michela A, Stefano P, Domenico C, et al. Identification of candidate MLO powdery mildew susceptibility genes in cultivated Solanaceae and functional characterization of tobacco NtMLO1[J]. Transgen Res, 2015, 24: 847-858. DOI:10.1007/s11248-015-9878-4 |
| [17] |
Pessina S, Angeli D, Martens S, et al. The knock-down of the expression of MdMLO19 reduces susceptibility to powdery mildew (Podosphaera leucotricha) in apple (Malus domestica)[J]. Plant Biotechnol J, 2016, 14: 2033-2044. DOI:10.1111/pbi.12562 |
| [18] |
Wan DY, Guo Y, Cheng Y, et al. CRISPR/Cas9-mediated mutagenesis of VvMLO3 results in enhanced resistance to powdery mildew in grapevine (Vitis vinifera)[J]. Hort Res, 2020, 7: 116. DOI:10.1038/s41438-020-0339-8 |
| [19] |
Bhat RA, Miklis M, Schmelzer E, et al. Recruitment and interaction dynamics of plant penetration resistance components in a plasma membrane microdomain[J]. Proc Natl Acad Sci U S A, 2005, 102: 3135-3140. DOI:10.1073/pnas.0500012102 |
| [20] |
Kim MC, Panstruga R, Elliott C, et al. Calmodulin interacts with MLO protein to regulate defence against mildew in barley[J]. Nature, 2002, 416: 447-451. DOI:10.1038/416447a |
| [21] |
Panstruga R. Serpentine plant MLO proteins as entry portals for powdery mildew fungi[J]. Biochem Soc Transact, 2005, 33: 389-392. DOI:10.1042/BST0330389 |
| [22] |
Consonni C, Humphry ME, Hartmann HA, et al. Conserved requirement for a plant host cell protein in powdery mildew pathogenesis[J]. Nat Genet, 2006, 38: 716-720. DOI:10.1038/ng1806 |
| [23] |
Xiang GS, Wang KJ, Yan HJ, et al. Bioinformatics analysis of MLO protein family in rosaceae plants[J]. Gen Appl Biol (基因组学与应用生物学), 2018, 37: 2043-2059. |
| [24] |
Qiu XQ, Wang QG, Jian GY, et al. Subcellular localization and functional analysis of powdery mildew resistance gene MLO in rose[J]. Acta Hort Sin (园艺学报), 2017, 44: 933-943. |
| [25] |
Zheng Z, Nonomura T, Appiano M, et al. Loss of function in MLO orthologs reduces susceptibility of pepper and tomato to powdery mildew disease caused by Leveillula taurica[J]. PLoS One, 2013, 8: e70723. DOI:10.1371/journal.pone.0070723 |
| [26] |
Zhang XL, Zhang JS, Yu SZ, et al. Genome sequence identification and expression analysis of the NtMLO family in tobacco[J]. Plant Physiol J (植物生理学报), 2019, 55: 1705-1720. |
| [27] |
Stefan K, Lina P, Ralph P. Comprehensive phylogenetic analysis sheds light on the diversity and origin of the MLO family of integral membrane proteins[J]. Gen Biol Evol, 2016, 8: 878-895. DOI:10.1093/gbe/evw036 |
| [28] |
Liu BL, Sun Y, Hao QT, et al. Genome-wide identification and expression profile analysis of millet MLO family[J]. J Nucl Agric Sci (核农学报), 2018, 32: 1492-1501. |
| [29] |
Chen YB, Wang Y, Zhang HL. Genome-wide analysis of the mildew resistance locus o (MLO) gene family in tomato (Solanum lycopersicum L.)[J]. Plant Omics, 2014, 7: 87-93. |
| [30] |
Zhang XL, Zhang J, Lei B, et al. Research progress of plant MLO protein[J]. Plant Physiol J (植物生理学报), 2018, 54: 1159-1171. |
| [31] |
Chen L, Qiu XQ, Zhang H, et al. Bioinformatics analysis of MLO gene in different species[J]. Southwest China J Agric Sci (西南农业学报), 2012, 25: 1302-1308. |
| [32] |
Panstruga R. Discovery of novel conserved peptide domains by ortholog comparison within plant multi- protein families[J]. Plant Mol Biol, 2005, 59: 485-500. DOI:10.1007/s11103-005-0353-0 |
 2021, Vol. 56
2021, Vol. 56


