2. 江苏省中医药研究院, 江苏 南京 210028;
3. 中国药科大学中药学院, 江苏 南京 211198
2. Jiangsu Province Academy of Traditional Chinese Medicine, Nanjing 210028, China;
3. School of Traditional Chinese Pharmacy, China Pharmaceutical University, Nanjing 211198, China
淫羊藿为小檗科植物淫羊藿(Epimedium brevicornum Maxim.)、箭叶淫羊藿[Epimedium sagittatum (Sieb.et Zucc.) Maxim.]、柔毛淫羊藿(Epimedium pubescens Maxim.)、或朝鲜淫羊藿(Epimedium koreanum Nakai) 的干燥叶, 始载于《神农本草经》, 具有补肝肾、强筋骨、祛风湿的功效[1]。淫羊藿炮制方法主要有清炒、酒制、盐制和羊脂制等, 其中羊脂制最为常用, 且被药典收载。临床研究发现淫羊藿生用与制用功效迥异, 生品祛风湿、坚筋骨力胜, 羊脂油炙后增强温肾助阳作用, 多用于治疗阳痿、不孕[2]。
淫羊藿是常用的温肾助阳中药之一, 有研究发现, 淫羊藿可促进性激素分泌或表现性激素样作用, 淫羊藿苷灌胃后能够升高肾阳虚大鼠血清皮质醇含量, 抑制肾阳虚小鼠血清睾酮含量的降低, 以及性腺雄激素受体mRNA和蛋白质表达的下降, 从而缓解肾阳虚症状[3, 4]。淫羊藿经羊脂油炮制后其温肾助阳作用增强, Bai等[5]通过研究生品与炮制后的淫羊藿对肾阳虚水肿模型大鼠的作用, 发现与模型组相比, 生品淫羊藿与炙淫羊藿在外观指标和病理切片指标上均有回调作用, 但侧重点有所不同, 结果表明生淫羊藿性寒, 侧重于加强肾阳虚水肿大鼠的肾脏排泄功能来治疗肾阳虚水肿, 炙淫羊藿经羊油炮制后药性由寒转温, 侧重改善肾阳虚水肿大鼠肾阳虚状态来治疗肾阳虚水肿。本课题组前期[6]采用气相色谱-质谱和核磁共振代谢组学技术研究炙淫羊藿炮制增效机制, 本研究在此基础上进一步深入, 从而全面地阐明炙淫羊藿炮制增效机制。
肾阳虚证是中医问诊常见证型, 导致肾阳虚证的病因是多方面的, 而肾阳虚证所导致的机体变化也是多方面的, 因此, 将现代科学技术与检测手段和中医证候相结合, 从整体水平研究机体, 能够更好地阐释肾阳虚证[7, 8]。代谢组学强调把机体作为一个完整系统进行研究, 通过测定代谢物组成的变化, 了解机体代谢网络在不同状态下的变化规律, 与中医学的整体观、动态观一致, 适于中医药研究, 也为中药炮制机制研究提供了有效的方法[9-11]。
课题组前期主要从药物本身黄酮成分吸收代谢的角度研究炙淫羊藿两个炮制因素“加热”“羊脂油”的作用机制[12-14], 但是中药作用于人体是一个“干预系统(中药) —应答系统(生物机体)”相互作用整合的生物学过程, 同时机体受炙淫羊藿系统作用后会在内源性代谢物上发生变化。因此本文从代谢组学的角度通过追踪淫羊藿炮制前后对肾阳虚机体内源性代谢物组的组成和水平的变化, 整体评价炙淫羊藿的温肾助阳作用与增效机制, 从生物体代谢角度进一步阐明炙淫羊藿的炮制机制。
材料与方法仪器 ACQUITY UPLC超高效液相色谱仪(Waters, 美国); SYNAPT Q-TOF质谱仪(Waters, 美国), 配有电喷雾电离源(ESI); MasslynxV4.1工作站(Waters, 美国); Heraeus Fresco 17型离心机(Thermo Fisher Scientific, 美国); BPG-9050烘箱(和呈仪器有限公司, 中国); Vortex Genie® 2 Vortex型涡旋仪(深圳市安必胜科技有限公司, 中国)。
试药 氢化可的松注射液(天津金耀药业有限公司, 批号: 1407271); 生理盐水(江苏亚邦生缘药业有限公司, 批号: 161231005.5); 肝素钠注射液(常州千红生化制药股份有限公司, 批号: 152008047A); 甲醇(色谱纯, Merck公司, 批号: L1052935941); 乙腈、甲酸(LC-MS级, Merck公司); 淫羊藿饮片(亳州市万珍中药饮片厂, 批号: 161231, 经中国医学科学院药用植物研究所郭宝林教授鉴定为心叶淫羊藿); 羊脂油(内蒙古锡林郭勒草原有限公司, 批号: S160402)。
动物 成年SPF级雄性SD (Sprague-Dawley) 大鼠, 体重(210 ± 20 g), 购自南京凯斯佳生物科技有限公司, 合格证号: SCXK (苏) 2020-0001, 饲养于江苏省中医药研究院实验动物中心。本文涉及的动物实验符合伦理学标准, 并且已获得江苏省中医药研究院动物伦理委员会批准(批准号: AEWC-20200702-119)。
淫羊藿饮片炮制品的制备 取1 kg淫羊藿饮片, 平行两份。一份加入200 g热熔融的羊脂油拌匀, 并置于烘箱中, 170 ℃加热7 min, 即得淫羊藿炙品; 另一份淫羊藿饮片直接放入烘箱中, 同法制得淫羊藿加热品。
淫羊藿灌胃液的制备 取淫羊藿生品、加热品、炙品各100 g, 分别将药材进行煎煮, 共煎煮3次, 每次加水30倍, 煎煮0.5 h, 首次煎煮前用30倍沸水浸泡1 h, 合并3次煎液, 趁热过滤, 浓缩至70 mL, 相当于饮片1.42 g·mL-1, 冷藏备用。
动物的分组、造模与给药 将48只雄性SD大鼠随机分为6组(每组8只), 即为对照组(control)、模型组(model)、羊脂油组(YZY)、淫羊藿生品组(SP)、淫羊藿加热品组(JRP)、炙淫羊藿组(ZP)。大鼠正常饲养一周后开始造模, 除对照组外, 其他组每日腹腔注射氢化可的松, 第一天注射剂量为15 mg·kg-1, 第二天剂量减半为7.5 mg·kg-1并以此剂量持续9天; 对照组注射等体积生理盐水。造模同时各给药组灌胃给予相应淫羊藿提取液0.72 g·kg-1, 羊脂油组灌胃给予羊脂油乳浊液0.144 g·kg-1 (淫羊藿用药量的20%, 用CMC-Na分散于水中), 对照组、模型组灌胃等体积生理盐水, 持续给药10天。
生物样品的采集 第十天给药12 h后, 采用代谢笼, 大鼠禁食不禁水12 h, 并收集12 h尿液于离心管中, -80 ℃保存; 再对大鼠进行眼眶取血, 置于离心管(内含20 μL肝素钠溶液) 中, 静置30 min后, 3 500 r·min-1离心5 min, 取上清液, 即得血浆, -80 ℃保存。
生物样品的制备 从-80 ℃冰箱取出尿液和血浆样本, 于4 ℃下解冻。精确吸取300 μL血浆于离心管中, 加入1 200 μL甲醇除去血浆中蛋白, 涡旋2 min, 在4 ℃条件下16 000 r·min-1离心20 min, 取上清液置于氮吹仪中吹干, 再加入300 μL甲醇复溶, 16 000 r·min-1离心10 min, 取上清液待测。等量吸取每个血浆样品20 μL合并, 将其混合均匀后作为血浆质控样本(QC)。
精确吸取尿液样本300 μL于离心管中, 加入1 200 μL甲醇涡旋2 min, 在4 ℃条件下16 000 r·min-1离心20 min, 取上清液置于氮吹仪中吹干, 再加入300 μL甲醇复溶, 16 000 r·min-1离心10 min, 取上清液待测。等量吸取每个尿液样品20 μL合并, 将其混合均匀后作为尿液质控样本(QC)。
色谱条件 色谱柱为ACQUITY UPLC BEH C18 (2.1 mm × 50 mm, 1.7 μm); 柱温35 ℃, 样品室温度10 ℃; 流动相: 0.1%甲酸水溶液(A)-乙腈(B); 梯度洗脱(0~2 min, 5% B; 2~8 min, 5%~50% B; 8~8.2 min, 50%~95% B; 8.2~10 min, 95% B; 10~11 min, 95%~5% B; 11~13 min, 5% B); 进样量2 μL; 流速0.4 mL·min-1。
质谱条件 质谱系统SYNAPT Q-TOF-MS, 电喷雾离子源ESI-, 毛细管电压为2.0 kV, 低能量扫描传输碰撞能量为25 eV, 高能量扫描传输碰撞能量为40 eV, 采样锥孔电压为40 V, 提取锥孔电压为4 V, 源温度120 ℃, 去溶剂化气流温度为350 ℃, 锥孔气流为5 μL·min-1, 去溶剂化气流量为700 L·h-1, 质谱检测的质量范围为m/z 50~1 000。
数据处理及统计分析 将液质联用系统采集到的数据导入TOF 4.3X软件(LECO公司, 美国) 和LECO-Fiehn Rtx5数据库进行原始峰精确匹配、基线滤波和校准、峰对齐、解卷积分析、峰面积的峰识别和积分。原始数据经标准化处理后, 导入SIMCA软件(V14.1, Umetrics, 瑞典) 进行多元统计分析。采用主成分分析(PCA) 表征样本组间的分离趋势, 用正交偏最小二乘法-判别分析(OPLS-DA) 筛选组间有差异的内源性代谢物, 结果以S-Plot图来表征。根据置换检验评价模型的可靠性和过拟合程度。采用单变量统计分析方法对两组间的差异进行显著性分析, P < 0.05认为在统计学上有显著性差异。
生物标志物的筛选、鉴定与代谢通路分析 结合t检验(P) 和变量投影重要度(VIP) 筛选贡献最大的潜在生物标志物。采用HMDB数据库并结合二级碎片离子对潜在生物标志物进行鉴定, 通过MetaboAnalyst 4.0数据处理平台进行通路富集分析, 并利用KEGG在线数据库以及相关文献, 分析生物标志物所涉及的相关代谢通路。
结果 1 血浆、尿液样品UPLC-Q-TOF-MS分析在负离子模式下采用UPLC-Q-TOF-MS分别扫描血浆QC样品和尿液QC样品, 得到总离子流(total ion chromatogram, TIC, 图 1)。
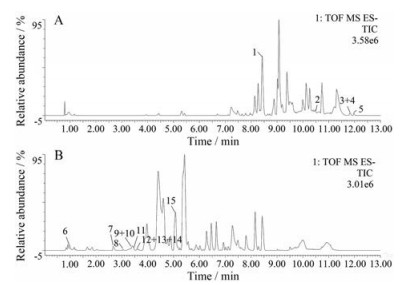
|
Figure 1 Total ion chromatogram of QC sample. A: Plasma, B: Urine. 1: LysoPC(15∶0); 2: PE(22∶4(7Z, 10Z, 13Z, 16Z)/22∶5(7Z, 10Z, 13Z, 16Z, 19Z)); 3: Glucosylceramide (d18∶1/9Z-18∶1); 4: PI(18∶3(9Z, 12Z, 15Z)/18∶0); 5: PI(18∶0/18∶0); 6: 5'-Methylthioadenosine; 7: 4-Hydroxyphenylacetylglutamine; 8: alpha-N-Phenylacetyl-L-glutamine; 9: 4-Hydroxy-5-phenyltetrahydro-1, 3-oxazin-2-one; 10: Aminoparathion; 11: Flecainide; 12: Hydroxypyruvic acid; 13: Ascorbic acid; 14: Adenosine phosphosulfate; 15: beta-Cortolone |
图 2A显示对照组、模型组血浆样品在PCA得分图中各自聚为一类, 且这两组的组间样本在PCA得分图二维空间上显著分离; 图 2B显示, 对照组与模型组尿液样品在PCA得分图上显著分离, 对照组组内尿液样本有一定程度的分离, 说明尿液样本组内也是有差异的。对照组与模型组大鼠血浆、尿液样品在PCA得分图上的显著分离, 表明经氢化可的松诱导, 模型组大鼠的生理机能受到影响, 反应在大鼠血浆和尿液代谢轮廓的改变, 进而映射了肾阳虚证的发生与发展过程。图 2C、2D显示羊脂油组、淫羊藿生品组、淫羊藿加热品组、炙淫羊藿组血浆和尿液样品在PCA得分图中均与模型组分离, 且趋近于对照组, 其中炙品组最靠近对照组, 结果表明各给药组对肾阳虚证均有不同程度地治疗作用, 且炙淫羊藿效果最好。

|
Figure 2 PCA scores plots of plasma and urine samples in rats. Control: Control group; Model: Model group; YZY: Suet oil group; SP: Epimedium raw product group; JRP: Epimedium heating product group; ZP: Epimedium fried with suet oil group. (control group vs model group. A: Plasma; B: Urine, the PCA scores plots of six group; C: Plasma; D: Urine) |
图 3A、3B显示, 对照组、肾阳虚证模型组血浆和尿液样品在有监督的OPLS-DA得分图中分离明显; 图 3C、3D显示, 对血浆和尿液样品的OPLS-DA得分图模型进行置换检验, 左端任何一次随机排列产生的R2、Q2均小于右端, 表明OPLS-DA模型可靠, 未发生过拟合。通过S-plot散点图(3E、3F), 结合VIP值(VIP > 1) 和t检验(P < 0.05) 筛选得到与肾阳虚证模型相关的生物标志物。结合HMDB、KEGG等在线数据库, 最终鉴定15个相关生物标志物, 其中血浆生物标志物5个, 尿液生物标志物10个, 见表 1。

|
Figure 3 Screening of biomarkers in rats with kidney-yang deficiency. (control group vs model group, A: Plasma OPLS-DA scores plots; B: Urine OPLS-DA scores plots; C: Plasma OPLS-DA replacement test; D: Urine OPLS-DA replacement test; E: Plasma S-plot; F: Urine S-plot) |
| Table 1 Biomarkers of kidney-yang deficiency. RT: Retention time; MS2: The secondary mass spectrometry; VIP: Variable importance in the projection; ↑ and ↓ represent higher and lower level; Model vs control: Model group compared with control group; ZP vs model: ZP group compared with model group |
给药后根据生物标志物的回调个数及回调程度, 进一步比较各给药组的药效作用。图 4所示, 羊脂油组能回调肾阳虚证生物标志物有6个, 分别为5'-甲基硫代腺苷、4-羟基苯乙酰谷氨酰胺、α-N-苯乙酰-谷氨酰胺、羟基丙酮酸、抗坏血酸、β-皮酮四醇, 其中显著回调的2个为4-羟基苯乙酰谷氨酰胺和β-皮酮四醇, 表明炮制辅料“羊脂油”具有温肾助阳的作用。生品组参与回调肾阳虚证生物标志物有3个, 分别为磷脂酰肌醇(18∶3(9Z, 12Z, 15Z)/18∶0)、5'-甲基硫代腺苷、β-皮酮四醇, 其中显著回调的是磷脂酰肌醇(18∶3(9Z, 12Z, 15Z)/18∶0); 加热品组能回调肾阳虚证生物标志物有3个, 分别为溶血性磷脂酰胆碱(15∶0)、4-羟基苯乙酰谷氨酰胺、β-皮酮四醇, 其显著回调的2个为溶血性磷脂酰胆碱(15∶0) 和4-羟基苯乙酰谷氨酰胺; 炙品组能回调的肾阳虚证生物标志物有5个, 分别为溶血性磷脂酰胆碱(15∶0)、5'-甲基硫代腺苷、4-羟基苯乙酰谷氨酰胺、α-N-苯乙酰-谷氨酰胺、β-皮酮四醇, 其显著回调的为β-皮酮四醇, 结果显示与生品和加热品相比, 炙淫羊藿回调的肾阳虚生物标志物最多, 表明炙淫羊藿的效果最好。生物标志物在各组的回调结果表明羊脂油、淫羊藿生品、淫羊藿加热品以及炙淫羊藿通过对肾阳虚大鼠15种生物标志物的回调作用, 来达到温肾助阳的目的。
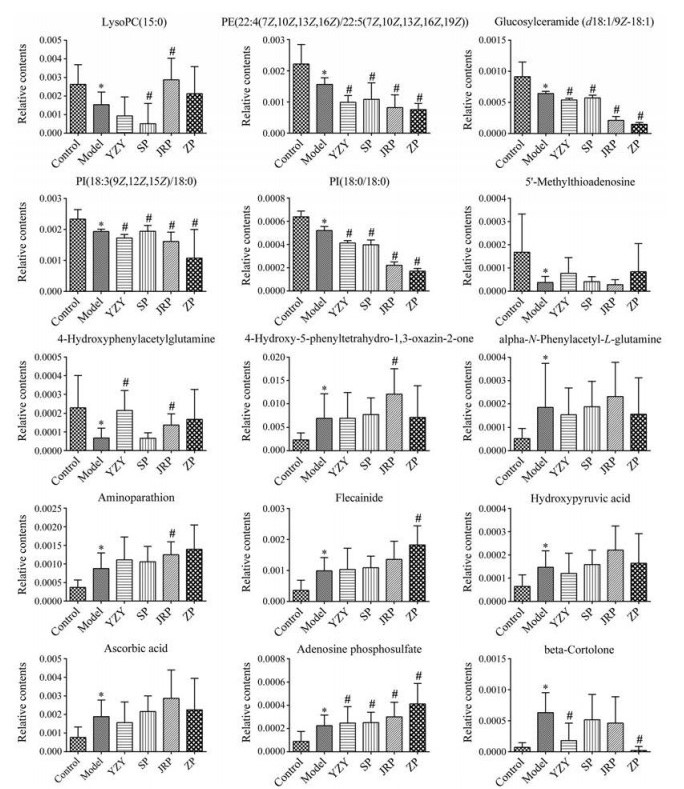
|
Figure 4 The levels of potential biomarkers of kidney-yang deficiency in each group. (compared with the control group, *P < 0.05; compared with the model group, #P < 0.05) |
将表 1中的血浆和尿液生物标志物分别导入MetaboAnalyst 4.0进行代谢通路分析, 然后筛选出-lgP > 1.3且Impact > 0.02的代谢通路作为潜在的相关代谢通路。如图 5A、5B所示, 最终得到5条与肾阳虚证模型相关的代谢通路, 分别是甘油磷脂代谢、鞘脂代谢、硫代谢、乙醛酸和二羧酸代谢、半胱氨酸和蛋氨酸代谢。利用KEGG数据库和MetaboAnalyst对上述5条通路进行通路关联分析(图 6)。
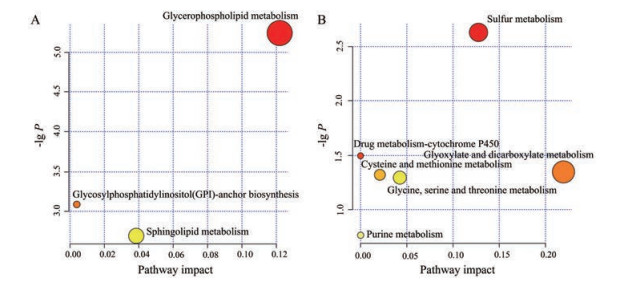
|
Figure 5 Pathways analysis of potential biomarkers. A: Plasma metabolic pathway analysis; B: Urine metabolic pathway analysis |
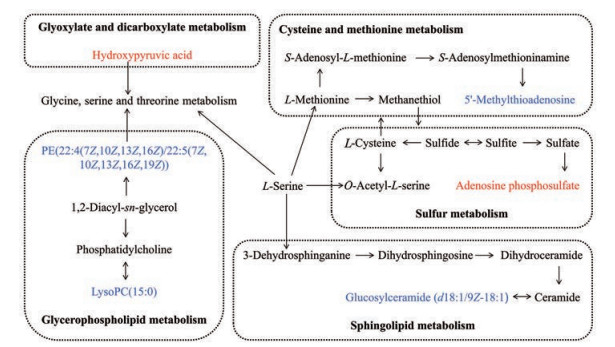
|
Figure 6 The metabolic network involved in kidney-yang deficiency. Red fonts up-regulated metabolites, and blue fonts down-regulated metabolites in the model vs control; purple fonts represent the metabolic pathways |
由肾阳虚潜在生物标志物以及相应的代谢通路分析表明, 羊脂油作为炙淫羊藿的炮制辅料, 其可能通过调节半胱氨酸和蛋氨酸代谢、乙醛酸和二羧酸代谢发挥温肾助阳的作用; 淫羊藿生品可能通过调节半胱氨酸和蛋氨酸代谢来达到温肾助阳的作用; 淫羊藿加热品通过甘油磷脂代谢来调控肾阳虚证; 炙淫羊藿对肾阳虚证模型大鼠具有回调作用的生物标志物涉及甘油磷脂代谢、半胱氨酸和蛋氨酸代谢。同时, 羊脂油参与调控的半胱氨酸和蛋氨酸代谢以及淫羊藿加热品参与调控的甘油磷脂代谢, 均是炙淫羊藿改善肾阳虚证大鼠体内的代谢通路, 结果表明甘油磷脂代谢、半胱氨酸和蛋氨酸代谢是炙淫羊藿温肾助阳的潜在机制, 也进一步阐释了淫羊藿经辅料羊脂油加热炮制后具有增强其温肾助阳作用的炮制机制。
讨论本研究利用氢化可的松诱导的大鼠肾阳虚证模型, 采用UPLC-Q-TOF-MS技术和多元统计分析方法, 分别比较了对照组与模型组大鼠血浆和尿液样品中的生物代谢物, 发现了15种肾阳虚证相关的生物标志物, 并且影响氢化可的松诱导的大鼠肾阳虚证代谢通路有5条, 分别为甘油磷脂代谢、鞘脂代谢、硫代谢、乙醛酸和二羧酸代谢、半胱氨酸和蛋氨酸代谢。根据不同给药组对肾阳虚生物标志物的调控趋势, 以及肾阳虚证大鼠体内相应代谢通路变化的代谢组学特征, 揭示了炮制辅料“羊脂油”通过调节半胱氨酸和蛋氨酸代谢通路, 而“加热”通过调节甘油磷脂代谢来增强了炙淫羊藿温肾助阳的作用, 半胱氨酸和蛋氨酸代谢以及甘油磷脂代谢是炙淫羊藿温肾助阳的潜在作用机制, 同时也进一步阐明了炙淫羊藿增强温肾助阳的炮制机制。
甘油磷脂是细胞膜的结构成分, 在细胞信号传导、膜锚定和底物转运中起主要作用[15]。本研究受甘油磷脂代谢影响的代谢物主要有溶血磷脂酰胆碱类、磷脂酰乙醇胺类和磷脂酰肌醇, 是参与机体生命活动重要的磷脂分子, 调节多种生物学过程[16-18]。模型大鼠血浆中的溶血磷脂酰胆碱(15∶0)、磷脂酰乙醇胺(22∶4(7Z, 10Z, 13Z, 16Z)/22∶5(7Z, 10Z, 13Z, 16Z, 19Z))、磷脂酰肌醇(18∶0/18∶0) 和磷脂酰肌醇(18∶3(9Z, 12Z, 15Z)/18∶0) 四种甘油磷脂水平显著降低, 表明肾阳虚大鼠血浆中的甘油磷脂水平受到干扰。淫羊藿加热品和炙淫羊藿均可回调血浆中的溶血磷脂酰胆碱(15∶0) 水平趋向于正常对照组, 表明调节机体的甘油磷脂代谢是炙淫羊藿温肾助阳的作用机制之一。
5'-甲基硫代腺苷是半胱氨酸和蛋氨酸代谢中的代谢产物。5'-甲基硫代腺苷是S-腺苷甲硫氨酸在多胺合成过程中产生的疏水性含硫核苷, 与严重的综合性免疫缺陷综合征有关, 还可以抑制肿瘤细胞的增殖、侵袭、凋亡, 调节肿瘤的炎性微环境[19]。目前尚未有研究表明5'-甲基硫代腺苷与肾阳虚证有直接联系, 但可引起肾脏损伤, 其机制与炎症、氧化应激和DNA甲基化不足有关[20]。本研究模型组尿液中参与半胱氨酸和蛋氨酸代谢的5'-甲基硫代腺苷水平显著低于对照组, 表明肾阳虚伴随一定程度的肾损伤, 与文献[21]中记载的肾阳虚大鼠尿液代谢组学研究结果一致, 经羊脂油、淫羊藿生品、炙淫羊藿干预后均可发生逆转, 揭示羊脂油、淫羊藿生品、炙淫羊藿对肾阳虚证的改善作用可能与炎症、氧化应激和DNA低甲基化有关。
乙醛酸和二羧酸代谢与体内的氧化反应有关, 扰动此代谢可间接导致三羧酸循环异常[22]。羟基丙酮酸广泛存在于生物体中, 是乙醛酸和二羧酸代谢的中间产物, 与二甲基甘氨酸脱氢酶缺乏途径的代谢疾病有关[23]。模型组尿液中羟基丙酮酸的含量较空白对照组呈显著上调趋势, 导致机体乙醛酸和二羧酸代谢紊乱, 这与文献报道[6]的肾阳虚证中出现的乙醛酸和二羧酸代谢紊乱结果一致。本研究中羊脂油可回调尿液中的羟基丙酮酸水平趋向于正常对照组, 表明羊脂油可通过调节机体的乙醛酸和二羧酸代谢发挥温肾助阳作用。
本研究中肾阳虚模型组大鼠血浆中葡萄糖神经酰胺(d18∶1/9Z-18∶1) 与对照组相比显著下降, 这一现象表明肾阳虚证很大程度上扰乱了鞘脂代谢。鞘脂和鞘脂的分解产物与细胞的功能和生长密切相关[24]。鞘脂代谢一般以神经酰胺为中心, 该物质在酶的作用下由二氢神经鞘氨醇转化生成, 并在神经酰胺酶的作用下转化成鞘氨醇。有研究表明葡萄糖基神经酰胺是多种形式的肾脏疾病的标志, 甲状腺激素能够调节鞘磷脂酶和神经酰胺合成酶的生成, 并且甲状腺激素的缺乏会通过降低鞘磷脂酶的活性来减少神经酰胺的含量[25, 26]。因此, 肾阳虚状态下导致的鞘磷脂酶活性下降可能是葡萄糖神经酰胺(d18∶1/9Z-18∶1) 含量下降的一个因素, 通过调节鞘脂代谢可改善肾阳虚证。
磷酸腺苷是硫代谢中的代谢物, 在本研究中肾阳虚模型大鼠尿液中的浓度显著高于对照组水平, 被筛选为肾阳虚的生物标志物。磷酸腺苷是一种辅酶, 参与体内脂肪、蛋白质、糖、核酸及核苷酸的代谢, 同时又是体内能量的主要来源。肾阳虚模型大鼠尿液中磷酸腺苷水平升高, 表明磷酸腺苷在肾阳虚模型大鼠体内积累, 导致相关的硫代谢发生紊乱。文献报道腺苷的积累会导致小鼠睾丸代谢紊乱和睾丸激素水平降低, 甚至是不育症[27]。Gao[28]应用1H NMR代谢组学研究技术, 通过多元化综合分析技术与方法, 对围绝经期正常妇女和绝经综合征肾阴虚、肾阳虚患者血代谢物谱进行比较分析, 结果表明绝经综合征肾阳虚证主要与硫代谢等途径相关, 进一步说明了肾阳虚与磷酸腺苷的水平及其相关的硫代谢密切相关。
作者贡献: 孙娥、韦英杰、贾晓斌负责实验思路设计; 王玲、侯健、徐金娣、郭舒臣负责完成主要的实验部分; 王玲负责完成实验数据及文章撰写; 孙娥负责指导论文撰写与修改; 所有作者均对本文有所贡献。
利益冲突: 本文研究内容无任何利益冲突。
| [1] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. Beijing: China Medical Science Press, 2020: 340-341.
|
| [2] |
Hou J, Li J, Sun E, et al. Synergistic effect of Epimedii Folium fried with suet oil for warming kidney and enhancing yang in dosage form of self-assembled micelles[J]. China J Chin Mater Med (中国中药杂志), 2016, 41: 2633-2637. |
| [3] |
He LJ, Jiang JJ, Chen H, et al. A review on pharmacological effects and clinical application of Herba Epimedii[J]. Clin J Chin Med (中医临床研究), 2020, 12: 17-20. |
| [4] |
Yang Y, Yin CC, Chen HY, et al. Principal component analysis of active flavonoid compounds from different species of Epimedium and its protective effect on kidney-yang deficiency rats[J]. Nat Prod Res Dev (天然产物研究与开发), 2021, 33: 179-187. |
| [5] |
Bai WX, Zhao LY, Zhang N, et al. Effect of crude Epimedii Folium and processed Epimedii Folium on kidney yang deficiency edema model rats[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2019, 25: 85-91. |
| [6] |
Hou J. Processing Mechanism of Herba Epimedii Fried with Suet Oil for Warming Kidney and Enhancing Yang Based on Metabolomics (基于代谢组学的炙淫羊藿温肾助阳炮制机理研究)[D]. Zhenjiang: Jiangsu University, 2017.
|
| [7] |
Zheng YL, Guo CR, Sun ZM, et al. Advances in the biological basis of kidney yang deficiency syndrome[J]. Chin J Tradit Med Sci Technol (中国中医药科技), 2019, 26: 318-319. |
| [8] |
Yang T, Gao K, Jiao TT, et al. Study on the correlation between the syndrome of "Kidney-Yang Deficiency" and biological indexes in chronic kidney disease[J]. World Sci Technol/Mod Tradit Chin Med Mater Med (世界科学技术-中医药现代化), 2020, 22: 63-68. |
| [9] |
Wang LL, Li B, Wang ZY, et al. Application of systematic biology technology in research of traditional Chinese medicine based on overall research[J]. Chin Tradit Herb Drugs (中草药), 2020, 51: 5053-5064. |
| [10] |
Lv S, Yang SL, Rao Y, et al. Application of metabolomics and related technologies in research and development field of traditional Chinese medicine[J]. China J Chin Mater Med (中国中药杂志), 2018, 43: 4182-4191. |
| [11] |
Li CY, He Q, Tang JF, et al. Metabolomic study on immunological stress-mediated hepatotoxicity of Polygonum multiflorum and its processed products of nine times steaming and nine times sunning[J]. Acta Pharm Sin (药学学报), 2017, 52: 1069-1076. |
| [12] |
Li MY, Sun E, Xu FJ, et al. Analysis changes of Epimedii Folium's flavonoids before and after processing based on UPLC-Q/TOF-MS[J]. Chin Tradit Herb Drugs (中草药), 2020, 51: 2900-2907. |
| [13] |
Sun E, Xu FJ, Zhang ZH, et al. Discussion on research ideas of synergistic mechanism of Epimedium fried with suet oil based on self-assembled micelles formation in vivo[J]. China J Chin Mater Med (中国中药杂志), 2014, 39: 370-377. |
| [14] |
Sun E, Wei YJ, Zhang ZH, et al. Processing mechanism of Epimedium fried with suet oil based on absorption and metabolism of flavonoids[J]. China J Chin Mater Med (中国中药杂志), 2014, 39: 383-390. |
| [15] |
Wang XL, Xu YY, Song X, et al. Analysis of glycerophospholipid metabolism after exposure to PCB153 in PC12 cells through targeted lipidomics by UHPLC-MS/MS[J]. Ecotoxicol Environ Saf, 2019, 169: 120-127. DOI:10.1016/j.ecoenv.2018.11.006 |
| [16] |
Semba RD, Zhang P, Adelnia F, et al. Low plasma lysophosphati-dylcholines are associated with impaired mitochondrial oxidative capacity in adults in the baltimore longitudinal study of aging[J]. Aging Cell, 2019, 18: e12915-e12922. |
| [17] |
Du K, Gao XX, Feng Y, et al. Effects of Guilingji on kidney-yang deficiency syndrome in rats based on serum metabolomics[J]. Acta Pharm Sin (药学学报), 2019, 54: 1476-1483. |
| [18] |
Calzada E, Onguka O, Claypool SM. Phosphatidylethanolamine metabolism in health and disease[J]. Int Rev Cell Mol Biol, 2016, 321: 29-88. |
| [19] |
Li YT, Wang YB, Wu P. 5'-Methylthioadenosine and cancer: old molecules, new understanding[J]. J Cancer, 2019, 10: 927-936. DOI:10.7150/jca.27160 |
| [20] |
Suszyńska-Zajczyk J, Utyro O, Jakubowski H. Methionine-induced hyperhomocysteinemia and bleomycin hydrolase deficiency alter the expression of mouse kidney proteins involved in renal disease[J]. Mol Genet Metab, 2014, 112: 339-346. DOI:10.1016/j.ymgme.2014.05.010 |
| [21] |
Zou ZJ, Gong MJ, Xie YY, et al. Urinary metabonomic study of kidney-yang deficiency syndrome induced by hydrocortisone[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2012, 18: 133-136. |
| [22] |
Du K. Study on Pharmacological Effects and Metabolomics Mechanism of Guilingji on Improving Kidney-Yang Deficiency Syndrome in Rat Model (龟龄集改善肾阳虚证模型大鼠的药理作用与代谢组学机制研究)[D]. Taiyuan: Shanxi University, 2020.
|
| [23] |
Lassalle L, Engilberge S, Madern D, et al. New insights into the mechanism of substrates trafficking in glyoxylate/hydroxypyruvate reductases[J]. Sci Rep, 2016, 6: 20629-20640. DOI:10.1038/srep20629 |
| [24] |
Hernández-Corbacho MJ, Salama MF, Canals D, et al. Sphingolipids in mitochondria[J]. Biochim Biophys Acta Mol Cell Biol Lipids, 2017, 1862: 56-68. |
| [25] |
Shayman JA. Targeting glycosphingolipid metabolism to treat kidney disease[J]. Nephron, 2016, 134: 37-42. DOI:10.1159/000444926 |
| [26] |
Wu S. Metabonomic Studies of the Essence of Hypothyroidism with Spleen and Kidney-Yang Deficiency Syndrome and Therapeutical Effects of Sini Decoction (基于代谢组学的甲减脾肾阳虚证本质及四逆汤治疗作用研究)[D]. Shanghai: The Second Military Medical University, 2013.
|
| [27] |
Yang X, Zhao Y, Sun Q, et al. Adenosine accumulation causes metabolic disorders in testes and associates with lower testosterone level in obese mice[J]. Mol Reprod Dev, 2020, 87: 241-250. DOI:10.1002/mrd.23321 |
| [28] |
Gao J. Serum Metabolic Markers of renal Yin Deficiency And renal Yang Deficiency In Menopause Syndrome based on 1H NMR Metabolomics (基于1H NMR代谢组学的绝经综合征肾阴虚、肾阳虚证血清代谢标志物研究)[D]. Taiyuan: Shanxi University of Chinese Medicine, 2019.
|
 2021, Vol. 56
2021, Vol. 56


