2. 徐州医科大学江苏省新药研究与临床药学重点实验室, 江苏 徐州 221004
2. Jiangsu Key Laboratory of New Drug Research and Clinical Pharmacy, Xuzhou Medical University, Xuzhou 221004, China
据国际糖尿病联合会(International Diabetes Federation, IDF) 2019年的报告[1], 全球约有4.63亿糖尿病(diabetes mellitus, DM) 患者, 据估计, 到2045年, DM患者人数将增加到6.29亿; 在中国, DM患病率已达10.9%, 预计有1.16亿患者, 约占全球DM患者总数的1/3, 其中2型DM (type 2 diabetes mellitus, T2DM) 占DM患者总数的90%以上[1]。T2DM长期发展可引发糖尿病肾病、糖尿病足、糖尿病酮症酸中毒等并发症, 严重危害人类健康。尽管化学药物及生活干预可有效降低血糖及缓解T2DM的发生发展, 但大多数DM患者仍存在疗效不佳、不良反应明显、易产生耐受性等特点[2]。中药因其具有多成分、多途径、多靶点、多环节、不良反应小、协同效应强和综合调节等特点, 近年来在DM的独立或辅助治疗中引起广泛关注[3]。
DM状态下, 肉毒碱棕榈酰基转移酶1A (carnitine palmitoyltransferase 1A, CPT1A)、脂肪酸合成酶(fatty acid synthase, Fasn) 和磷脂酶A2 (phospholipase A2, PLA2) 表达水平增加[4-6], 可提升循环中花生四烯酸(arachidonic acid, AA) 的水平。AA在体内的酶代谢途径主要包括环氧合酶(cyclooxygenase, COX)、脂氧合酶(lipoxygenase, LOX) 和细胞色素P450酶(cytochrome P450, CYP450) 三条代谢通路[7, 8]。AA经COX-2代谢可产生前列腺素(prostaglandins, PGs) 产物, T2DM状态下, COX-2过表达, 导致PGs含量增加, 而PGs可减弱葡萄糖诱导的β-细胞的胰岛素分泌, 导致胰腺β-细胞遭到破坏并发功能障碍[9]; AA经LOX-5代谢可生成羟基花生四烯酸(hydroxyl eicosatetraenoic acids, HETEs), DM状态下, LOX-5被炎症刺激激活后可导致HETEs水平显著增加, 促进炎症和胰岛素抵抗的发生发展[10]; AA还可经细胞色素P450酶4A (cytochrome P450 family 4A, CYP4A) 代谢生成环氧化花生四烯酸(epoxy eicosatrienoic acid, EETs), EETs可增强胰岛素信号传导和敏感性, 增加胰岛大小和脉管系统, 降低血浆葡萄糖[11]。EETs为可溶性环氧化物水合酶(soluble epoxide hydrolase, sEH) 的优选底物, 抑制sEH活性可改善DM状态下的胰岛素敏感性、降低血糖[11, 12]。上述分析表明, AA的水平及其PGs、HETEs、EETs类代谢物对DM发生发展中的炎症及胰岛素抵抗具有重要影响[7]。
桑叶是桑科植物桑的干燥叶, 为药食两用植物, 具有疏散风热, 清肺润燥, 清肝明目的功效。《本草拾遗》中记载: “细锉, 大釜中煎取如赤糖, 去老风及宿血, 降糖”; 《本草纲目》中记载“桑叶乃手、足阳明之药, 汁煎代茗, 能止消渴”。现代药理学研究证实, 桑叶水提物、醇提物及其含有的多糖、黄酮类、生物碱、酚酸、纤维素等成分, 均具有防治DM的作用[13-18]。特别值得注意的是, 桑叶甲醇提取物在体外可同时抑制COX及LOX酶活性, 从而发挥其抗炎、解热、镇痛作用[19], 但桑叶在体内是否影响DM状态下AA代谢通路, 目前尚不可知。
因此, 本文主要在链脲佐菌素(streptozotocin, STZ) 联合高脂高糖(high fat and high sucrose, HFHS) 饮食诱导的T2DM小鼠动物实验模型上, 观察桑叶水提物(mulberry leaf water extract, MLWE) 对T2DM小鼠肝脏中AA生成及代谢的相关酶的表达及血液中AA及其相关PGs、HETEs、EETs类代谢产物水平的影响, 探讨MLWE对T2DM的防治作用及潜在机制。
材料与方法仪器与试剂 NanoDrop 1000核酸浓度测定仪(美国Thermo公司); PCR仪(美国AB公司); 酶标仪(Elx808, 美国Bio Tek公司); Light Cycler 480 II实时荧光定量PCR (quantitative real time PCR, qPCR) 仪(瑞士Roche公司); 半干转印系统(170-3940, 美国Bio-Rad公司); Agilent 1260-6460液相色谱三重四级杆串联质谱仪(美国Agilent公司); Fortis C18色谱柱(1.7 μm, 50 mm × 2.1 mm) (美国Waters公司); 固相萃取C8柱(苏州金郡实验耗材); 真空冷冻浓缩干燥仪(LNG-T98, 太仓市科教器材厂)。一抗稀释液、二抗稀释液、BCA (bicinchoninic acid) 蛋白浓度测定试剂盒和磷酸酶抑制剂(上海碧云天生物技术研究所); Fasn、CPT1A、COX-2、LOX-5和CYP4A抗体(英国Abcam公司); 山羊抗兔IgG (美国LI-COR公司); β-actin抗体、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH) 抗体(武汉ABclonal公司); 鼠源PLA2、Fasn、CPT1A、COX-2、LOX-5、CYP4A和GAPDH的上下游引物(上海捷瑞生物科技公司); STZ、AA、PGE2、15-HETE、12-HETE、5-HETE、8, 9-EET、14, 15-EET、PGE-d4、20-HETE-d6和AA-d8等对照品(美国Sigma公司)。Trizol总RNA提取剂(大连美仑生物科技有限公司); TransStart Top Green qPCR SuperMix试剂盒(北京全式金生物技术有限公司)。桑叶(徐州广济连锁药店有限公司; 生产许可证号: 20160280; 批号: 181101) 经徐州医科大学季帅副教授鉴定为桑科植物桑的干燥叶。其他试剂均为化学纯。
动物 8周龄雄性C57BL/6J小鼠, 约25 g (上海斯莱克实验动物有限责任公司)。动物生产许可证号: SCXK (沪) 2008-0016。饲养于徐州医科大学SPF级实验动物中心, 温度(22 ± 2) ℃, 湿度55% ± 5%, 12 h光暗循环, 饲料与水消毒后自由摄取。动物实验获得徐州医科大学伦理委员会批准(批准号: XZMULL201612024), 实验严格按照国家和徐州医科大学动物中心动物使用管理条例进行。
MLWE的制备 取桑叶1 kg, 粉碎, 加水15 L微沸煮4 h, 过滤, 滤液真空冷冻干燥, 得MLWE干浸膏粉末(1 mg干浸膏约相当于3 g生药)。经本课题组建立的高效液相色谱法(high performance liquid chromatography, HPLC) 测定, 5批不同操作者在不同时间制备的MLWE在254 nm波长下共检测到共有峰31个, 它们之间的相似度均大于0.999, 原儿茶酸、新绿原酸、绿原酸、隐绿原酸、芦丁和紫云英苷的含量分别为0.56、6.72、11.89、6.76、1.84和0.96 mg·g-1。于-20 ℃保存, 临用时用生理盐水配制成合适的浓度。
动物分组、造模、给药及样本收集 C57BL/6J雄性小鼠适应性饲养7天后, 称重, 测定空腹血糖(fasting blood glucose, FBG) 基线水平(0周) 后, 随机分为正常组和模型组。正常组给予普通饲料, 模型组给予HFHS饲料(脂肪占60%, 蛋白质占20%, 碳水化合物占20%), 4周后, 各组小鼠均禁食不禁水12 h, 模型组小鼠按90 mg·kg-1腹腔注射STZ的柠檬酸盐缓冲液(0.1 mol·L-1, pH 4.5), 正常组注射同等剂量的柠檬酸盐缓冲液。一周后测FBG (5周), FBG水平 > 11.1 mmol·L-1视为造模成功。将造模成功小鼠随机分为模型组(DM) 及MLWE干预组(HSML); 另取正常组小鼠随机分为正常对照组(NC) 和正常对照加MLWE干预组(NCML)。NCML组及HSML组按250 mg·kg-1·d-1剂量灌胃给予MLWE; NC组及HFHS组同法给予等剂量生理盐水, 连续10周。每周测定1次体重。实验结束收集血液, 测定FBG及空腹胰岛素(fasting blood insulin, FBI; 15周) 水平。
AA及其相关代谢产物测定
色谱-质谱条件 Fortis C18色谱柱; 流动相: 水(A) 和乙腈(B), A、B中均含有0.1 mmol·L-1甲酸铵; 流速: 0.4 mL·min-1; 洗脱程序: 0 min, 5% B; 5 min, 95% B; 6 min, 5% B; 柱温: 30 ℃, 自动进样器温度: 4 ℃; 进样量: 2 μL。电喷雾(electrospray ionization, ESI) 离子源, 负离子模式检测; 毛细管电压: 4 000 V; 雾化气压力: 30 psi; 干燥气温度: 350 ℃; 干燥气流量: 11 L·min-1。采用同位素内标法定量, PGE2-d4为PGE2内标, AA-d8为AA内标, 20-HETE-d6为其他分析物的内标。各化合物及内标的多级反应监测(multiple reaction monitoring, MRM) 参数见表 1。
| Table 1 Multiple reaction monitoring (MRM) parameters of analytes for liquid chromatography tandem with mass spectrometry (LC-MS/MS). AA: Arachidonic acid; PGE2: Prostaglandin E2; HETE: Hydroxyl eicosatetraenoic acid; EET: Epoxy eicosatrienoic acid |
血清样品处理 取小鼠血清, 上样于活化后的C8固相萃取小柱, 用1 mL 0.1%甲酸冲洗后, 再用1 mL甲醇洗脱, 收集甲醇洗脱液, 冷冻真空干燥, 50%乙腈水溶液复溶, 20 000 ×g离心, 取上清进样分析。
方法学验证 选取23:00~1:00小鼠血清作为空白生物基质配制模拟生物样本及质控样本。参照美国食品药品监督管理局(Food and Drug Administration, FDA) 和国际人用药品注册技术协调会(International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use, ICH) 生物样品定量分析方法验证指导原则, 分别从方法的特异性、线性和范围、定量下限、批内精密度、批间精密度、准确度、加样回收率、基质效应(matrix effect, ME) 和稳定性方面进行方法学验证。
含量测定 取AA、PGE2、15-HETE、12-HETE、5-HETE、8, 9-EET和14, 15-EET对照品溶液, 加入空白血清经固相萃取处理后的洗脱液配制系列标准溶液, 加入内标后进行处理, 以各分析物与其内标的峰面积之比对各分析物浓度进行回归, 得线性方程。样品测定: 取实验结束后小鼠血清, 经固相萃取处理后进行分析, 以线性方程计算AA及其相关代谢产物含量。
qPCR实验 各基因上下游引物分别为: GAPDH 5'-CAACTTTGGCATTGTGGAAGG-3'、3'-ACACATT GGGGGTAGGAACAC-5'; COX-2 5'-ACGGTCCTGAA CGCATTTATG-3'、3'-TTGGCCCCATTTAGCAATCTG-5'; LOX-5 5'-GGGCTGTAGCGAGAAGCATC-3'、3'-CACGGTGACATCGTAGGAGT-5'; CYP4A 5'-GCAAAC CATACCCAATCC-3'、3'-TCCCAAGTGCCTTTCCTA- 5'; PLA2 5'-CCAGGGGGCTTGCTAGAAC-3'、3'-AGC ACCAATCAGTGCCATCC-5'; Fasn 5'-TCGGAGACA ATTCACCAAACC-3'、3'-AGCCATCCCACAGGAGA AACC-5'; CPT1A 5'-TATGGTCAAGGTCTTCTCGGG TCG-3'、3'-AAGTGCTGTCATGCGTTGGAAGTCTC-5'。实验结束后取小鼠肝脏组织, 依试剂盒法提取总RNA、进行逆转录反应获得cDNA。以上述cDNA为模板, 将鼠来源的GAPDH、COX-2、LOX-5、CYP4A、Fasn、CPT1A、PLA2上下游引物稀释到10 μmol·L-1, 使用TransStart Top Green qPCR SuperMix试剂盒法进行qRT-PCR反应, 以GAPDH基因为内参, 校正每个样本目的基因的Ct值, 以2-△△Ct值计算目的基因的mRNA水平。
Western blot实验 取小鼠肝脏组织, 进行总蛋白提取, 采用BCA法用酶标仪在550 nm处测定吸光度, 计算总蛋白浓度。待用蛋白煮沸5 min后, 充分混匀, 上样样品蛋白20 μL, 进行SDS-PAGE实验, 将样品转至聚偏氟乙烯(polyvinylidene fluoride, PVDF) 膜, 用5%脱脂奶粉封闭1 h, 洗膜后加入一抗, 于4 ℃孵育过夜, 用1×TBST (Tris-HCl缓冲盐溶液+ Tween-20) 溶液洗膜3次, 每次10 min, 加入稀释的二抗(1% BSA以1∶10 000稀释), 于室温孵育1 h后, 洗膜3次, 每次10 min。Odyssey红外荧光扫描成像系统扫描成像, Image J软件进行灰度分析, 以Fasn、CPT1A、COX-2、LOX-5和CYP4A与β-actin灰度值之比分别表示Fasn、CPT1A、COX-2、LOX-5和CYP4A蛋白的相对表达量。
统计学分析 数据以均数±标准差(x ± s) 表示, 采用SPSS统计软件进行数据处理。两组比较采用t检验, 多组比较采用单因素方差分析(one-way ANOVA)。假设检验水准按α = 0.05判定, P < 0.05为差异有统计学意义。
结果 1 MLWE对T2DM小鼠空腹血糖及胰岛素的影响结果显示(图 1), NCML组与NC组小鼠周体重、FBG及FBI水平无显著性差异; HFHS组和NC组相比, 第1周之后的周体重逐渐增加, 基线(0周) FBG水平无显著差异、分组前(5周) 及实验结束后(15周) 的FBG水平均显著增加(P < 0.01), FBI水平显著升高(P < 0.01); HSML组和HFHS组相比, 基线及分组前(5周) 的FBG水平无显著差异、实验结束后的FBG水平明显降低(P < 0.01), FBI水平显著降低(P < 0.01)。上述结果提示, MLWE对正常小鼠血糖及胰岛素水平无影响, 可改善T2DM小鼠的血糖升高及胰岛素抵抗。
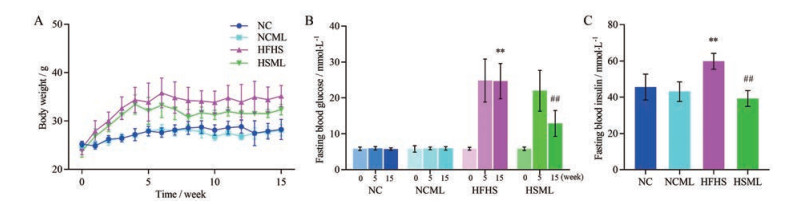
|
Figure 1 Effect of mulberry leaf water extract (MLWE) on the levels of body weight (A), fasting blood glucose (FBG, B), and fasting blood insulin (FBI, C) of type 2 diabetes mellitus (T2DM) mice. n = 6, x ± s. **P < 0.01 vs NC group; ##P < 0.01 vs HFHS group. T2DM mice were induced by streptozotocin (STZ) and high fat and high sucrose (HFHS). NC, NCML, HFHS, and HSML groups represent the normal control group treated with drug-free solution, NC group treated with MLWE, T2DM group treated with drug-free solution, and T2DM group treated with MLWE, respectively |
在本实验“色谱-质谱条件”下, 血清样品中的其他内源性杂质不影响各化合物及内标的分离测定, 且目标待测物与内标峰形良好; 各化合物峰面积与内标峰面积的比值与浓度之间均呈现良好的线性关系, 结果见表 2; 高、中、低3个质控样本的精密度相对标准偏差(relative standard deviation, RSD) 均小于15%, 准确度在85%~115%范围内, 基质效应为78.87%~107.9%, 各化合物及其内标的加样回收率均大于75%; 血清样本反复冻融3次、-80 ℃冷冻1个月、4 ℃放置24 h均稳定, 血浆经处理后的上清, 室温下放置12 h、进样环境(4 ℃) 放置24 h稳定。
| Table 2 Regression equation, correlation coefficient, linear range, and lower limit of quantitative limit of analytes. R: Correlative coefficient; LLOQ: Lower limit of quantification |
将各组小鼠血清样本在本实验中代谢物含量测定项的“血清样品处理”方法及“色谱-质谱条件”下进行处理和分析, 记录AA、PGE2、15-HETE、12-HETE、5-HETE、8, 9-EET和14, 15-EET等7种化合物及内标的峰面积, 用线性回归方程计算浓度。由表 3中结果可见, NCML和NC组小鼠血浆中各分析物的水平无显著性差异; HFHS组小鼠血浆中各分析物水平均显著高于NC组(P < 0.01); HSML组小鼠血浆中AA、PGE2、15-HETE、12-HETE、5-HETE、8, 9-EET的水平均显著低于HFHS组(P < 0.01), 提示MLWE对正常小鼠血浆中AA的代谢无显著性影响, 但可改善T2DM小鼠体内AA的代谢异常。
| Table 3 The effect of MLWE on the contents of AA and its metabolites in plasma of T2DM (n = 6, x ± s). **P < 0.01 vs NC group; ##P < 0.01 vs HFHS group |
MLWE干预10周后, 分别用qPCR和Western blot法对T2DM小鼠肝脏中与脂肪酸代谢的相关酶基因和蛋白表达水平进行测定(图 2)。NCML组和NC组小鼠肝脏中PLA2、Fasn、CPT1A的mRNA及蛋白的表达水平无统计学差异; 与NC组相比, HFHS组小鼠肝脏中PLA2的mRNA表达显著增加(P < 0.05)、Fasn的mRNA及蛋白的表达水平显著升高(P < 0.01), 而CPT1A的mRNA及蛋白的表达水平显著降低(P < 0.05或P < 0.01); 与HFHS组相比, HSML组小鼠肝脏中PLA2的mRNA表达显著降低(P < 0.01)、Fasn的mRNA及蛋白的表达水平显著降低(P < 0.01), 而CPT1A的mRNA及蛋白的表达水平显著升高(P < 0.01)。以上结果提示, MLWE对正常小鼠肝脏中PLA2、Fasn和CPT1A等酶的表达无影响, 可改善T2DM小鼠肝脏中PLA2、Fasn和CPT1A等酶的表达异常。
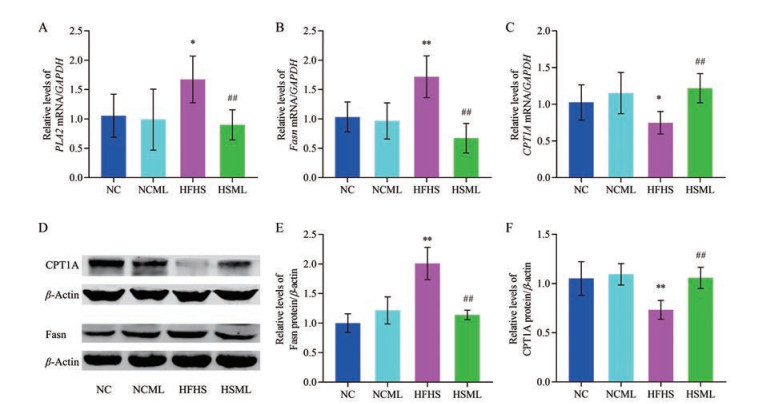
|
Figure 2 Effects of MLWE on the relative mRNA or protein expression levels of phospholipase A2 (PLA2), fatty acid synthase (Fasn), and carnitine palmitoyl transferase 1A (CPT1A) in livers of T2DM mice. A-C: The relative mRNA expression levels of PLA2 (A), Fasn (B), and CPT1A (C) were detected by quantitative real time PCR (qPCR); D: The representative Western blot figures of CPT1A, Fasn, and β-actin; E, F: The relative protein expression levels of Fasn and CPT1A were detected by Western blot. n = 6, x ± s. *P < 0.05, **P < 0.01 vs NC group; ##P < 0.01 vs HFHS group. GAPDH: Glyceraldehyde-3-phosphate dehydrogenase |
MLWE干预10周后, 分别用qPCR和Western blot法对T2DM小鼠肝脏中与AA代谢相关酶的基因和蛋白表达水平进行测定(图 3)。NCML组和NC组小鼠肝脏中COX-2、LOX-5、CYP4A的mRNA及蛋白的表达水平无统计学差异; 与NC组相比, HFHS组小鼠肝脏中COX-2和LOX-5的mRNA及蛋白的表达水平显著升高(P < 0.01), 而CYP4A的mRNA及蛋白的表达水平显著降低(P < 0.05, P < 0.01); 与HFHS组相比, HSML组小鼠肝脏中COX-2和LOX-5的mRNA及蛋白的表达水平显著降低(P < 0.01), 而CYP4A的mRNA及蛋白的表达水平显著升高(P < 0.01)。以上结果提示, MLWE对正常小鼠肝脏中COX-2、LOX-5、CYP4A等酶的表达无影响, 可逆转T2DM小鼠肝脏中COX-2、LOX-5、CYP4A等酶的表达。
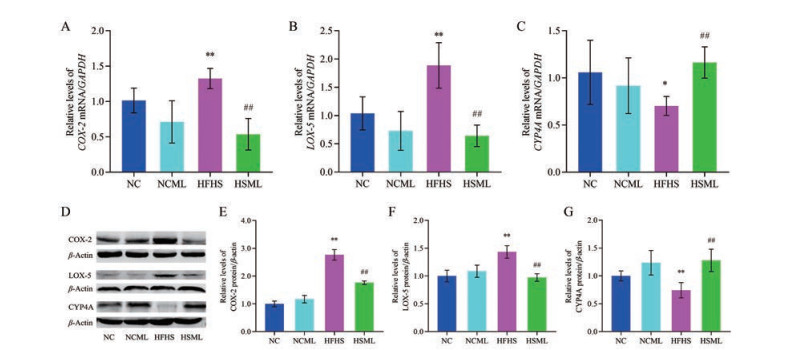
|
Figure 3 Effects of MLWE on the relative mRNA and protein expression levels of cyclooxygenase-2 (COX-2), lipoxygenase-5 (LOX-5), and cytochrome P450 family 4A (CYP4A) in livers of T2DM mice. A-C: The relative mRNA expression levels of COX-2, LOX-5, and CYP4A were detected by qPCR; D-G: The relative protein expression levels of COX-2, LOX-5, and CYP4A were detected by Western blot. n = 6, x ± s. *P < 0.05, **P < 0.01 vs NC group; ##P < 0.01 vs HFHS group |
桑叶自古以来就用于“消渴症”的治疗, 现代药理学研究结果也证实, 桑叶可降低DM状态下的高糖水平、改善胰岛素抵抗[13-18]。本实验结果也证实MLWE可降低HFHS饮食联合STZ诱导的T2DM小鼠的FBG及FBI水平, 与上述文献报道一致[13-18]。
AA为一种多不饱和脂肪酸, 其在DM循环中的水平存在相互矛盾的呈现。一方面, 循环中低水平的AA在DM中得以证实, 而外源性摄入AA可有效改善DM的脂质代谢异常、炎症及胰岛素抵抗[20, 21]; 另一方面, 也有研究发现, DM状态下, 循环中显著升高的AA水平推动了DM的发生发展[22]。这种呈现可能与疾病模型、样本采集时段、AA检测方法和手段相关。本研究发现了T2DM小鼠血液中AA水平显著高于正常组, 与文献报道一致[22]; 同时, 本研究发现了MLWE干预可显著降低T2DM小鼠循环中AA的水平。
外源性摄入、脂肪酸从头合成、磷脂水解、脂肪酸氧化是体内AA生成及消耗的主要途径。Fasn为脂肪酸合成酶, PLA2是磷脂水解酶, 而CPT1A为脂肪酸氧化酶, 其在肝脏中的表达水平影响循环中的脂肪酸包括AA的水平。高脂饮食可导致宿主肝脏中Fasn表达增加, 而DM宿主肝脏中PLA2表达增加、CPT1A表达降低[4-6]; 与上述报道一致的是, 本研究同样发现HFHS组小鼠肝脏中Fasn及PLA2表达显著增加、CPT1A表达显著降低, 因而推测HFHS组小鼠血浆中AA水平的升高可能与这些酶的表达异常有关。既往研究表明, 桑叶可降低高脂饮食诱导肥胖小鼠肝脏中Fasn的表达[23], 本研究结果同样证实了MLWE可降低高脂高糖联合STZ诱导T2DM小鼠肝脏中Fasn的表达; 同时本研究发现了MLWE可降低T2DM小鼠肝脏中PLA2表达、提高CPT1A表达, 而这些酶表达异常的调节作用可能是MLWE降低T2DM小鼠循环中AA水平的潜在原因。
AA分别经COX-2及LOX-5代谢生成的PGs及HETEs可破坏胰腺β-细胞, 降低胰岛素分泌, 促进炎症和胰岛素抵抗的发生发展[9, 10]; 而经CYP4A代谢生成的EETs可增强胰岛素信号传导和敏感性、降低血浆葡萄糖[11]。本实验发现T2DM小鼠肝脏中COX-2、LOX-5表达均降低, CYP4A表达增加; 相应地, T2DM小鼠血液中AA及其代谢产物PGE2、15-HETE、12-HETE、5-HETE水平均显著升高, 与上述文献报道一致[7-12]。T2DM小鼠经MLWE干预后, 肝脏中COX-2及LOX-5表达显著降低, 与文献表达一致[19]; 相应地, 小鼠血液中AA及其代谢产物PGE2、15-HETE、12-HETE、5-HETE含量均显著降低。特别意外的是, 本研究结果显示, T2DM小鼠肝脏中CYP4A的表达显著低于正常小鼠, 但AA经CYP4A代谢的产物8, 9-EET及14, 15-EET水平却显著升高, 这是否是sEH表达降低及其他代谢AA的CYP450酶表达增加所致, 尚有待进一步研究; T2DM小鼠经MLWE干预后, 肝脏中CYP4A表达显著增加, 但血液中8, 9-EET及14, 15-EET水平却显著降低, 推测可能是sEH活性同时得以增加所致, 但桑叶对sEH活性的影响目前尚未见报道, 尚有待进一步深入研究。
综上所述, 桑叶可改善AA代谢通路中PLA2、Fasn、CPT1A、COX-2、LOX-5、CYP4A等多个酶的表达异常, 调节循环中AA及PGs、HETEs、EETs类等相关代谢产物的水平, 发挥其对AA代谢通路的调节作用, 体现了中药桑叶多组分、多环节、多靶点的作用特点, 这可能是其发挥改善T2DM的作用的潜在机制之一。
作者贡献: 汤道权、赵燕琳和许冰菊构思并设计了实验; 赵燕琳、许冰菊和李丁香进行论文的整体实验和数据分析; 陆东裕、杜岩和曹煜姗参与体内动物实验; 陆东裕、曹煜姗和李阳参与数据分析工作; 赵燕琳、许冰菊和汤道权撰写并修改了论文。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
International Diabetes Federation. IDF Diabetes Atlas, 9th edn[EB/OL]. Brussels, Belgium: International Diabetes Federation, 2019[2021-06-11]. https://www.diabetesatlas.org.
|
| [2] |
Quattrocchi E, Goldberg T, Marzella N. Management of type 2 diabetes: consensus of diabetes organizations[J]. Drugs Context, 2020, 9: 212607. |
| [3] |
Wu H, Tian J, Dai D, et al. Efficacy and safety assessment of traditional Chinese medicine for metabolic syndrome[J]. BMJ Open Diabetes Res Care, 2020, 8: e001181. DOI:10.1136/bmjdrc-2020-001181 |
| [4] |
Karahashi M, Hirata-Hanta Y, Kawabata K, et al. Abnormalities in the metabolism of fatty acids and triacylglycerols in the liver of the Goto-Kakizaki rat: a model for non-obese type 2 diabetes[J]. Lipids, 2016, 51: 955-971. DOI:10.1007/s11745-016-4171-8 |
| [5] |
Wei X, Song H, Yin L, et al. Fatty acid synthesis configures the plasma membrane for inflammation in diabetes[J]. Nature, 2016, 539: 294-298. DOI:10.1038/nature20117 |
| [6] |
Jackisch L, Kumsaiyai W, Moore JD, et al. Differential expression of Lp-PLA2 in obesity and type 2 diabetes and the influence of lipids[J]. Diabetologia, 2018, 61: 1155-1166. DOI:10.1007/s00125-018-4558-6 |
| [7] |
Das UN. Arachidonic acid in health and disease with focus on hypertension and diabetes mellitus: a review[J]. J Adv Res, 2018, 11: 43-55. DOI:10.1016/j.jare.2018.01.002 |
| [8] |
Wang T, Fu X, Chen Q, et al. Arachidonic acid metabolism and kidney inflammation[J]. Int J Mol Sci, 2019, 20: 3683. DOI:10.3390/ijms20153683 |
| [9] |
Qiu J, Shi Z, Jiang J. Cyclooxygenase-2 in glioblastoma multiforme[J]. Drug Discov Today, 2017, 22: 148-156. DOI:10.1016/j.drudis.2016.09.017 |
| [10] |
He Z, Tao D, Xiong J, et al. Phosphorylation of 5-LOX: the potential set-point of inflammation[J]. Neurochem Res, 2020, 45: 2245-2257. DOI:10.1007/s11064-020-03090-3 |
| [11] |
Xu X, Li R, Chen G, et al. The role of cytochrome P450 epoxygenases, soluble epoxide hydrolase, and epoxyeicosatrienoic acids in metabolic diseases[J]. Adv Nutr, 2016, 7: 1122-1128. DOI:10.3945/an.116.012245 |
| [12] |
He J, Wang C, Zhu Y, et al. Soluble epoxide hydrolase: a potential target for metabolic diseases[J]. J Diabetes, 2016, 8: 305-313. DOI:10.1111/1753-0407.12358 |
| [13] |
Chan EW, Lye PY, Wong SK. Phytochemistry, pharmacology, and clinical trials of Morus alba[J]. Chin J Nat Med, 2016, 14: 17-30. |
| [14] |
Ji S, Zhu C, Gao S, et al. Morus alba leaves ethanol extract protects pancreatic islet cells against dysfunction and death by inducing autophagy in type 2 diabetes[J]. Phytomedicine, 2021, 83: 153478. DOI:10.1016/j.phymed.2021.153478 |
| [15] |
Riche DM, Riche KD, East HE, et al. Impact of mulberry leaf extract on type 2 diabetes (Mul-DM): a randomized, placebo-controlled pilot study[J]. Complement Ther Med, 2017, 32: 105-108. DOI:10.1016/j.ctim.2017.04.006 |
| [16] |
Wang WW, Zhang S, Zhu XH, et al. Protective effects of total flavonoid from Mori folium on renalfibrosis in type 1 diabetic mice and specific mechanisms of these effects[J]. Chin Pharmacol Bull (中国药理学通报), 2017, 33: 1278-1285. |
| [17] |
Ji T, Zhang LL, Huang XC, et al. The action mechanisms of Morus alba leaves extract for the treatment of diabetes based on plasma metabolomics[J]. Acta Pharm Sin (药学学报), 2015, 50: 830-835. |
| [18] |
Zhang LW, Su SL, Dai XX, et al. Regulatory effect of mulberry leaf components on intestinal microflora in db/db mice[J]. Acta Pharm Sin (药学学报), 2019, 54: 867-876. |
| [19] |
Chauhan S, Devi U, Kumar VR, et al. Dual inhibition of arachidonic acid pathway by mulberry leaf extract[J]. Inflammopharmacology, 2015, 23: 65-70. DOI:10.1007/s10787-014-0223-y |
| [20] |
Sonnweber T, Pizzini A, Nairz M, et al. Arachidonic acid metabolites in cardiovascular and metabolic diseases[J]. Int J Mol Sci, 2018, 19: 3285. DOI:10.3390/ijms19113285 |
| [21] |
Poreba M, Mostowik M, Siniarski A, et al. Treatment with high-dose n-3 PUFAs has no effect on platelet function, coagulation, metabolic status or inflammation in patients with atherosclerosis and type 2 diabetes[J]. Cardiovasc Diabetol, 2017, 16: 50. DOI:10.1186/s12933-017-0523-9 |
| [22] |
Du Y, Xu BJ, Deng X, et al. Predictive metabolic signatures for the occurrence and development of diabetic nephropathy and the intervention of Ginkgo biloba leaves extract based on gas or liquid chromatography with mass spectrometry[J]. J Pharm Biomed Anal, 2019, 166: 30-39. DOI:10.1016/j.jpba.2018.12.017 |
| [23] |
Lee MR, Kim JE, Choi JY, et al. Anti-obesity effect in high-fat-diet-induced obese C57BL/6 mice: study of a novel extract from mulberry (Morus alba) leaves fermented with Cordyceps militaris[J]. Exp Ther Med, 2019, 17: 2185-2193. |
 2021, Vol. 56
2021, Vol. 56


