2. 上海药明生物技术有限公司分析科学部, 上海 200131;
3. 上海张江生物技术有限公司, 抗体药物与靶向治疗国家重点实验室, 国家药品监督管理局治疗类单抗质量控制重点实验室, 上海 201203
2. Analytical Sciences, WuXi Biologics (Shanghai) Co., Ltd., Shanghai 200131, China;
3. State Key Laboratory of Antibody Medicine and Targeted Therapy, NMPA Key Laboratory for Quality Control of Therapeutic Monoclonal Antibodies, Shanghai Zhangjiang Biotechnology Co., Ltd., Shanghai 201203, China
目前已上市的蛋白质药物有三分之二以上为治疗类糖蛋白。以2020年全球销售前十名的药物为例, 糖蛋白占二分之一。糖基化是一种至关重要的蛋白质翻译后修饰, 在多种生物过程中扮演着重要的角色, 影响着治疗类糖蛋白的溶解度、稳定性、药代动力学、药效动力学、免疫原性和生物学活性等理化及生物效能[1]。
与蛋白质的转录、翻译过程不同, 糖基化的生物合成为非模板依赖性的酶促反应, 是由糖基受体、糖基供体和糖基转移酶三类分子协同完成。糖基化可分为N-连接糖基化、O-连接糖基化、糖基磷脂酰肌醇锚和C-连接糖基化。由于复杂的生物合成过程, 及蛋白结构、生产工艺、宿主-载体表达体系和细胞培养条件的进一步影响, 糖基化在结构上呈现广泛异质性。具体表现在: 寡糖结构的连接、分支及延伸的多样性; 糖基化位点及占有率的多样性; 糖基化类型的多样性; 同一糖基化位点糖型的多样性。这使得治疗类糖蛋白的每个糖蛋白分子以及每个糖基化位点均呈现一组寡糖(图 1)。糖基化复杂的异质性以及对生物功能的重要影响, 使治疗类糖蛋白的糖基化分析成为研究的热点, 同时也成为表征及质控分析的一个挑战。

|
Figure 1 Recombinant human follicle stimulating hormone (rhFSH) glycan heterogeneity |
为了更好地对治疗类糖蛋白进行糖基化分析, 推动治疗类糖蛋白的技术法规建立及质控水平提高, 以下将从治疗类糖蛋白糖基化分析的核心理念、分析策略、良好分析的实施以及技术趋势等4个方面进行深入探讨。
1 治疗类糖蛋白糖基化分析的核心理念2008年美国健赞公司开发了阿葡糖苷酶重组冻干粉注射剂用于治疗庞培氏病, 但工艺放大过程导致了糖基化组成变化(甘露糖-6-磷酸)。美国食品药品监督管理局(FDA) 以变更前后不具有可比性为由拒绝了该公司放大规模产品的上市申请[2]。该事件成为治疗类糖蛋白糖基化控制的分水岭。工业界及监管部门逐渐认识到糖基化控制的重要性, 而将其作为蛋白质药物的关键质量属性(critical quality attribute, CQA) 进行控制。目前, 糖基化分析广泛应用于质量表征、工艺验证、可比性评估、稳定性检测、生产过程监控以及放行检测等方面。为了保障糖蛋白药物的安全、有效、质量可控, 需要明确糖基化分析的核心理念, 并基于核心理念搭建糖基化分析策略。
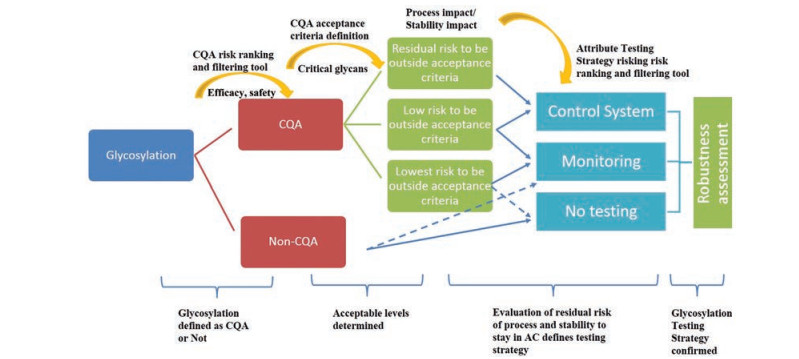
基于风险评估的质量源于设计(quality by design, QbD) 理念、人用药品注册技术国际协调会议(ICH) Q5E及Q6B、“FDA行业指南”以及“创新药物研发、生产和质量保障框架体系-PAT”等, 可将糖基化分析的核心理念归纳为: 应基于糖基化对产品的安全性、有效性及质量可控性的风险评估来确定糖基化分析开展与否及分析的广度及深度; 应在产品生产的全过程以及全生命周期评估糖基化控制(图 2)。
|
Figure 2 The overall control strategy of glycosylation of therapeutic drugs. CQA: Critical quality attribute; Non-CQA: Non-critical quality attribute; AC: Acceptance criteria |
根据核心理念, 首先需要确认糖基化是否对产品的安全性和有效性有影响。如果风险评估的结果显示, 糖基化对安全性和有效性可能有较大影响, 那就需要进一步考虑该糖基化分析的广度和深度, 然后综合产品特性, 确认该糖基化分析实施在该产品生产全过程以及整个产品生命周期的哪个阶段。若对于安全性和有效性没有特别影响, 仅需要从质量可控性方面考虑糖基化分析的必要性。分析技术的选择及其在产品开发和常规生产中的应用取决于多种因素, 如糖蛋白的复杂性、糖基化与安全性和有效性之间关系的理解以及生产过程控制策略的总体设计。即使目前的研究表明糖基化与糖蛋白生物功能不相关时, 糖基化控制也可以是质量可控性的量度。在考量治疗类蛋白的糖基化修饰分析策略时, 需结合药物本身及生产工艺的特性, 以安全有效、质量可控为总原则, 根据所需的信息水平确定糖基化分析方法, 并在产品不同阶段实施分析。美国药典(USP) 42通则<1084>的糖基化分析策略, 也在一定程度上契合了糖基化控制的核心理念, 可以参考其策略图进行糖基化分析方法的选择[3]。
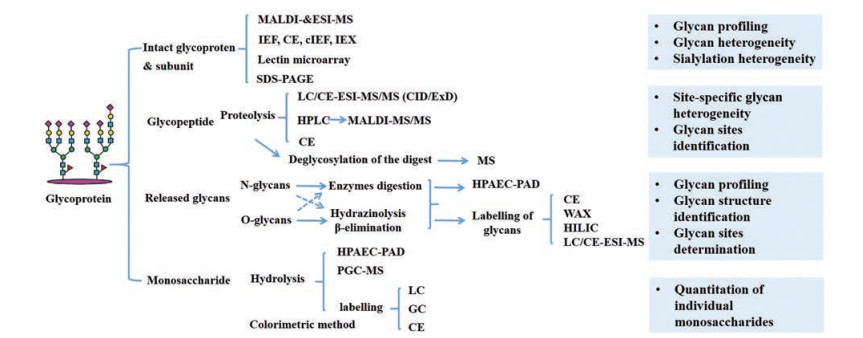
2 治疗类糖蛋白糖基化分析策略糖基化的异质性给分析带来了巨大的挑战。在治疗类糖蛋白的开发过程中, 应基于糖基化分析核心理念制定分析策略, 采用互补方法对糖基化进行分析, 揭示如糖基化位点、寡糖结构及相对含量、单糖组成、糖基化分布等信息。为了全面地分析糖基化结构, 一般从以下四个方面开展: 完整糖蛋白及亚基水平、糖肽水平、游离寡糖水平、单糖水平(图 3)。
|
Figure 3 Overview of glycan analysis procedure. MALDI: Matrix-assisted laser desorption ionization; ESI: Electrospray ionization; MS: Mass spectrometry; IEF: Isoelectric focusing; CE: Capillary electrophoresis; cIEF: Capillary isoelectric focusion; IEX: Ion exchange chromatography; SDS-PAGE: Sodium dodecyl sulfate polyacrylamide gel electrophoresis; LC: Liquid chromatography; CID: Collision-induced dissociation; ExD: Electron capture/transfer dissociation; HPLC: High performance liquid chromatography; HPAEC-PAD: High-performance anion-exchange chromatography with pulsed amperometric detection; WAX: Weak anion exchange chromatography; HILIC: Hydrophilic interaction liquid chromatography; PGC: Non-graphitizing carbon chromatography; GC: Gas chromatography |
完整糖蛋白分析是最直接的糖基化分析模式。不过, 由于糖蛋白一般分子量大, 且可能包含多个糖基化位点, 因此这种方法获得信息有限, 主要呈现糖基化的总体异质性、唾液酸化水平等。
可以采用等电聚焦电泳(IEF)、毛细管电泳(CE)、毛细管等电聚焦电泳(cIEF) 或离子交换色谱法(IEX), 在完整糖蛋白水平进行唾液酸化异质性分析。质谱(MS) 更是用于完整蛋白糖基化分析的一种重要手段。基质辅助激光解析电离技术(MALDI) 和电喷雾电离技术(ESI) 可以使完整蛋白很好地离子化, 从而获得糖基化分布的信息[4]。此外, 凝集素芯片也可以用于糖蛋白中复杂寡糖的识别[5, 6]。通过还原剂或酶将完整糖蛋白解离成更小的亚基后进行质谱分析, 可以获得更多更全面的糖基化信息。
2.2 糖肽水平为了更精确地分析糖基化, 可以进一步糖肽分析, 对糖基化位点进行测定, 并提供位点特异性的糖链结构、糖基化的占有率等信息。蛋白酶解后, 通过分离或富集糖肽, 可采用MS或CE等进行分析。利用MS还可以对分析难度较大的O-寡糖。其中, 通过结合多种MS串级裂解方式可以更好地实现糖基化位点和寡糖结构的鉴定。
目前, 对N-糖基化位点的分析测定大多利用MS技术, 在去糖肽或糖肽水平进行。对于去糖肽水平, 是利用去糖基化后天冬酰胺(asparagine, Asn) 脱酰胺造成0.982 Da的质量数增加, 或者通过比较酶处理前后的肽图来鉴定蛋白质的糖基化位点。从糖肽水平进行分析时, 通过MS技术寻找寡糖的特征离子来确定糖肽, 并进一步分析肽段的碎片离子来实现糖基化位点的鉴定。
2.3 游离寡糖水平将寡糖解离下来进行分析, 是目前最常用的一种糖基化分析手段。这一水平的寡糖分析可以根据需要选用的不同分析技术, 获得糖链分子量、单糖组成、糖链类型、糖苷键连接和唾液酸化水平等丰富信息。
N-寡糖的释放方式取决于需要测定的糖蛋白性质以及需要获得的糖基化信息。酶反应或化学反应都可以用于释放N-寡糖。常用的酶可以参考USP通则<1084>或相关文献[7]。化学法主要有肼解法和β消除法。
游离寡糖分析, 可以从以下两个方面展开: ①不使用标记试剂: 由于寡糖具有弱酸性和亲水性, 在碱性溶液中以阴离子形式存在, 因此使用高效阴离子交换色谱串联脉冲安培检测器(high-performance anion-exchange chromatography with pulsed amperometric detection, HPAEC-PAD) 法, 可以对游离寡糖进行直接分析且不需要标记或衍生化。HPAEC也可与MS技术联用, 对不同糖型进行定性分析[8]。MALDI-TOF对干扰物耐受性好, 碎片离子产生较少, 图谱中没有多电荷信号, 容易解析, 是寡糖结构解析中常用的工具。②使用标记试剂: 由于解离下的寡糖没有紫外和荧光吸收, 研究者基于还原氨化、Michael加成、肼标记的完全甲基化等反应原理, 开发了许多紫外和荧光标记试剂用于寡糖标记。其中, 通过游离寡糖的还原氨基进行衍生化, 是最常用的标记方式。常用的标记试剂包括用于液相色谱(LC) 分离的2-氨基苯甲酸(2-aminobenzoic acid, 2-AA)、2-氨基苯甲酰胺(2-aminobenzamide, 2-AB)、2-氨基吡啶, 以及用于CE分离的8-氨基芘-1, 3, 6-三磺酸三钠盐(8-aminopyrene-1, 3, 6-trisulfonate, APTS) 等。此外, 亦有报道应用两种氘代的荧光探针标记N-寡糖, 然后进行LC-MS分析[9]。标记后的寡糖可以利用亲水相互作用液相色谱法(HILIC)、弱阴离子交换色谱、CE和MS进行分析测定, 技术的联用可以更好地分析糖基化信息[4, 10, 11]。
2.4 单糖水平单糖水平分析是将寡糖解离为单糖进行分析, 可提供单糖鉴别、含量及单糖组成信息。相对于游离寡糖分析, 用于单糖组成分析的方法一般更简单, 所获得的信息也相对较少。最常用的方法是唾液酸含量测定。与游离寡糖分析不同, 单糖水平分析一般侧重于采用对照品进行定量。可以采用酸水解、酶解、甲醇分解等手段从糖蛋白上释放单糖, 而单糖的定量则可采用比色法测定或高效液相色谱法、气相色谱法、离子色谱法等进行分离测定。单糖的释放条件、单糖的衍生试剂选择及测定方法与方法验证结果(分离度、线性、重现性、精密度等) 等已获得较深入研究, 为单糖水平分析的方法开发及验证提供了重要的信息[12]。
3 良好糖基化分析的实施良好的糖基化分析是实现产品结构表征、可比性评估、稳定性检测、工艺开发及监控以及放行检测的重要基础。游离寡糖分析在糖基化分析扮演着重要的角色。为了更好地阐述如何实现良好的糖基化分析, 以下主要以游离N-寡糖2-AB标记HILIC分离荧光检测方法为例, 从6个方面进行介绍: ①较优的样品制备; ②分析策略选择; ③关键糖链的全面鉴定; ④对照品; ⑤系统适用性及可接受标准; ⑥方法验证。
3.1 较优的样品制备该方法在样品前处理过程中有两个关键步骤, 分别是N-寡糖的释放和标记。N-寡糖的释放, 可以采用酶切和化学剪切。其中PNGase F酶切释放是较为常用的方法, 可以从酶的来源、糖蛋白取样量、酶切过程等优化角度来保证良好的酶切效率, 从而保证后续游离寡糖的良好分析[13]。目标蛋白酶解缓冲液的pH及所含组分(如十二烷基硫酸钠、吐温等) 是否影响酶的活性, 也需要考虑。有些糖蛋白, 如Fab端带有糖基化位点的抗体, 或含有多个糖基化位点的融合蛋白等, 需在酶切步骤前进行变性处理, 使其高级结构充分打开, 以达到更高的寡糖释放效率。可以采用还原十二烷基磺酸钠-毛细管电泳比对未脱糖和脱糖样品, 进行寡糖释放效率的考察。一般来说, 脱糖效率应达到90%以上。N-寡糖的标记, 同样有多种试剂或试剂盒选择。可以参考相关操作说明或说明书、预实验中对标记效率的考察(如寡糖信号强弱、稳定性) 来决定最佳的标记时间。此外, 在寡糖释放后和标记后的脱盐步骤也是保障信号良好、结果可重复的重要的步骤。
3.2 分析策略选择对于单一糖基化位点的单抗, 一般常见的糖型约有20多种。HILIC分析时可以选用柱长较短的色谱柱, 在较短时间就可以完成所有糖型的分析, 从而提高分析效率。而对于有多个糖基化位点的融合蛋白或单抗, 其糖型较为复杂。在HILIC分析时需选用更长的色谱柱并增加流动相梯度的时间来保证所有糖型均可以被良好的分离。具体的色谱条件可以参考各国药典及文献报道。
3.3 关键糖链的全面鉴定需要基于糖基化控制核心理念来全面鉴定治疗类糖蛋白中的关键寡糖结构, 如天线结构、唾液酸(α-2, 3、α-2, 6连接), 位点特异性糖基化结构及占有率, 岩藻糖基化、半乳糖基化、N-乙酰乳糖胺重复单元、高甘露糖、与免疫原性相关的糖链结构。实现糖链的全面鉴定, 目前主流手段是采用MS, 其优点是准确度高、快速高效。如果配合使用相应的寡糖标准品, 则可以采用其他检测法对N-寡糖进行鉴定。寡糖的限度要求可参照中国药典2020年版各论中的具体要求[14]。
3.4 对照品可以采用同质的对照品、经充分表征的对照品中释放的寡糖组分; 标准糖蛋白(如胎球蛋白、免疫球蛋白) 中释放且经充分表征的寡糖组分或寡糖标志物等。USP42通则<212>寡糖分析中提到了寡糖分析对照品(表 1)。
| Table 1 United States Pharmacopeia (USP) oligosaccharide system suitability mixture |
从表 1可以看出, USP提供的系统适用性对照品基本覆盖了大部分单抗及融合蛋白中存在的糖型。另外, 商业化公司也提供相应的寡糖对照品。
3.5 系统适用性试验及供试品的可接受标准建立系统适用性试验时, 可以参考USP42通则<212>及中国药典2020年版通则<3130>的规定进行设置。另外, 根据实际经验, 对于N-寡糖中最高峰的响应值或一些寡糖相对响应值也应该根据实际情况做一定规定(如应大于20 EU), 以反映样品在前处理的回收率。在建立供试品的可接受标准时, 除了需要对主要寡糖的百分含量进行控制外, 还需要对含量较低但对药物的安全、有效、质量可控产生重要影响的寡糖(如高甘露糖等) 百分含量进行控制与监测。
3.6 方法验证根据ICH Q2 (R1) 指导原则, 为了保证所用的糖基化分析方法确实能够用于在研药品的质量控制, 需要对分析方法进行验证。主要可以从专属性、准确度、精密度、线性、范围、定量限、耐用性这些方面考虑[15]。良好的样品制备可以保证N-寡糖分析的有效性, 关键糖链的全面鉴定, 系统适用性、可接受标准的设定以及方法验证的良好实施, 可以保证N-寡糖分析的准确性。两者结合最终达到良好的N-寡糖分析的目的。
4 治疗类糖蛋白糖基化分析技术趋势 4.1 N-寡糖快速分析虽然糖基化分析方法已日渐成熟, 但以N-寡糖分析为例, 分析周期通常需要几天时间, 限制了工艺开发进度, 并难以实现对工艺过程的“实时”调整。因此, 业界开发了多个快速而简洁的糖基化分析方法用于日常糖基化分析, 以加快生产工艺开发, 保证精确的质量控制。
目前主要可以从两个方面来提高糖基化分析效率: ①快速的样品分析; ②快速的样品前处理。比如长度50 mm的色谱柱可以在15 min内实现对结构较简单的N-寡糖的良好分离, 以达到高通量的糖基化快速分析目的。快速寡糖标记和分析的试剂盒可用于游离N-寡糖的快速样品制备及CE分析。整个样品制备只需一个小时左右即可完成。而样品分析时间只需5 min, 并利用数据库对图谱中的寡糖结构进行鉴定。目前该方法已应用于抗体、重组人促红素(recombinant human erythropoietin, rhEPO) 等的游离寡糖分析[11, 16]。
此外, 6-氨基喹啉-N-羟基琥珀酰亚胺氨基甲酸酯、InstantAB、InstantPC和RapiFluor-MS试剂盒的开发, 可以快速释放及标记寡糖, 从而加快了工作流程[17-19]。与2-AA和2-AB相比, 上述荧光标记物具有增强荧光信号或同时增强荧光与MS信号的特性。可以通过将快速的样品前处理和仅5 min的液质联用检测, 并结合自动化的数据分析来实现高通量的糖基化分析, 从而加快生物药开发[20]。自动化分析工作站的应用使得糖基化分析更为便捷快速, 且进一步提高了分析通量和测定结果的重复性[17, 20]。自动化高通量的快速糖基化分析将是生物药糖基化表征及质控的发展趋势。
4.2 基于高分辨质谱的分析技术为了更好地揭示糖基化的异质性, 近年来出现了新型高分辨技术, 如质谱技术可以高分辨、高灵敏地检测糖蛋白、糖肽、寡糖等分子, 而高效分离技术和质谱的结合在糖基化分析也扮演着越来越重要的作用。分离技术包括了HILIC、反相液相色谱(reversed phase liquid chromatography, RPLC)、CE、多孔石墨碳液相色谱(non-graphitizing carbon chromatography, PGC) 以及二维液相色谱(two dimension liquid chromatography, 2D LC) 等方法。
4.2.1 多属性分析方法基于LC-MS的多属性分析方法(multi attribute method, MAM) 是通过一次LC-MS分析同时检测和定量多个产品质量属性的方法。作为一项新技术, MAM已经具备了在蛋白质药物质量控制中取代传统分析技术的潜力。该方法可应用于治疗类蛋白质开发的所有阶段, 包括候选药物选择、过程开发、稳定性和可比性评估、质量控制等。采用RPLC-MS的MAM是从糖肽水平揭示位点不均一性的重要手段之一。可利用特定的软件, 在糖肽水平来对IgG进行糖基化分析[21]。将MAM得到的每种寡糖相对含量结果和传统HILIC的结果进行比较, 发现两种方法得到的寡糖结果有着非常好的相关性。有研究进一步建立了含两个糖基化位点IgG1的MAM方法, 通过比较两个位点MAM定量结果与两个亚基中的HILIC测定结果, 表明二者之间具有可比性[22]。
除了单抗领域的应用, MAM还被应用于rhEPO的质量监控中[23]。由于rhEPO含有3个N-糖基化位点和1个O-糖基化位点, 因此给MAM方法的开发以及数据分析提出了更大的挑战。通过采用Glu C酶解、C8色谱柱分离等, 实现了rhEPO的MAM分析。与传统的质控方法进行比较, MAM的测定结果与HPAEC-PAD、唾液酸测定结果具有可比性。采用三重四极杆质谱, 选择性地对特定的糖肽分子离子进行检测与定量, 可直接用于不经纯化的培养液中融合蛋白的糖肽分析[24]。鉴于MAM可以对多个糖基化位点的寡糖结构进行定量, 在未来的质控、过程控制中将发挥越来越重要的作用。
基于糖肽的MAM开发过程较为复杂、损失一定的蛋白完整信息且验证较为烦琐。基于亚基/完整蛋白的MAM作为一种自上而下(top-down/middle-down) 的检测策略, 有望成为另一个发展趋势[25]。该方法通过简单的样品处理, 以及自动化的软件方法可以让几乎没有质谱经验的分析人员完成分析工作, 同时在一定程度上平衡蛋白糖基化的完整和局部信息, 还可以同时分析其他属性如降解产物和相关杂质[26]。该方法可以应用于单抗/双抗亚基的糖基化分析, 能够较为全面地测定主要的糖链结构分布[27, 28]。但该方法相比于肽图的MAM方法, 该方法更适用于糖基化结构较为简单的糖蛋白药物分析[29]。
4.2.2 CE-MS与其他分析方法相比, CE实现了快速微量蛋白质分析。然而, CE和MS联用具有较多的挑战性。早期三层同轴鞘液的结构设计有效地实现了CE与MS的串联。后期无鞘液结构采用多孔界面实现电压的传导, 提高了检测灵敏度。近年来, 具有多胺涂层的集成CE和ESI于一体的微流控液相芯片(microfluidic CE-MS) 的开发降低了死体积, 保证电泳的有效分离和ESI的稳定性和重现性。目前的CE-MS主要采用CZE的分离原理对样品进行分离。
有研究将蛋白质组学中常用的串级质量标签(tandem mass tags, TMT) 来标记寡糖和单糖, 从而提高了其在CE中的电泳迁移, 并可实现质谱的多重定量。microfluidic CE-MS可以较好地对TMT标记的寡糖、单糖以及糖肽进行分析[30]。由于microfluidic CE-MS可以在短时间对完整或抗体亚基进行分离, 获得主要糖型的分布, 从而大大加速生产工艺的开发[31, 32]。EPO上未经衍生的游离寡糖及糖肽也可以采用CE-MS进行分析, 可以区分含有α-2, 3和α-2, 6连接的唾液酸的糖肽[33, 34]。CE-MS还被用来分离西妥昔单抗的游离寡糖并与串联使用的外切酶相结合来确证寡糖结构[35]。CE-MS在分析双抗时可以揭示Fab及Fc片段上均含有糖基化修饰的IgG4抗体可能出现的Fab臂互换以及稳定性实验中的双抗断裂及解离[36]。
由于CE根据电荷来分离样品, 因此可以将带有唾液酸残基(带负电荷) 的寡糖或糖肽进行良好地分离。与LC-MS相比, CE-MS在糖肽分离上具有更好的分离度、更低的检测限、更加宽的动态范围、以及更快的分离速度[37]。因此, CE-MS在分析含多唾液酸、糖基化结构较为复杂的糖肽时有较好的应用前景。
4.2.3 其他方法PGC是基于疏水性、极性相互作用及离子相互作用对游离寡糖进行分离的方法。PGC可与MS串联用于分析未标记和标记后的寡糖。由于PGC可提供结构选择性, 因此适用于表征寡糖的同分异构体[38]。近年来有科研机构建立了一个PGC寡糖图谱库, 包括了寡糖的确切结构(组成和连接), 保留时间以及精确分子量[39]。数据库中包含了7种糖蛋白的超过100种寡糖结构。
2D LC采用正交和互补机制来达到分离目的。这项技术的优势在于不需要显著增加分析时间, 便可大幅度提高方法的分辨能力。该方法还适用于与质谱相容性较差的分离方法。2D LC-MS可以用于糖肽分析, 以此获得更多的糖肽信息。通过2D LC-MS发现了NIST单抗的247个糖肽离子及60种不同的寡糖分子, 在一维的反相中能够将唾液酸化及非唾液酸化的肽段进行分离, 同时2D-LC增加了糖肽的峰容量可鉴定到更多的糖肽离子[40]。
4.3 O-糖基化的分析O-糖基化修饰在治疗类糖蛋白中也很常见, 通常发生在Ser或Thr上。与N-连接寡糖相比, O-寡糖中单糖的序列和连接更为复杂多变, 因而其分析更具有挑战性。目前O-糖基化的分析策略主要有3种: ①采用化学或酶法释放O-寡糖, 产生的O-寡糖用于后续的表征; ②将糖蛋白酶解形成O-糖肽进行分析; ③分析和表征完整糖蛋白。
由于α-N-乙酰半乳糖胺酶(EC 3.2.1.97) 的特异性高, 应用具有局限性。目前释放O-寡糖的主要方式是化学释放。化学释放方法又分为还原或非还原β消除法以及肼解法。释放后的游离寡糖可进一步进行标记, 采用LC或LC-MS检测。但在化学释放的过程中, 有可能会面临副反应“剥离”, 从而造成寡糖从还原末端的逐级降解, 不利于数据解析。
在O-糖肽的分析中, 质谱技术扮演着重要的作用。特别是两种碎裂技术, 碰撞诱导解离(collision-induced dissociation, CID) 和电子捕获/转移解离(electron capture/transfer dissociation, ECD/ETD), 可以实现O-糖基化位点的鉴定与寡糖结构的分析。CID可进一步分为低能CID和高能CID, 其中低能CID可主要产生糖链的b/y碎片离子, 而高能CID时则主要产生肽段的b/y碎片离子。ECD和ETD, 统称为ExD, 是一种与CID互补的碎裂方式, 产生c/z离子。ExD碎裂主要发生在肽段上, 可以较好地保留寡糖的完整分子量信息, 有利于O-糖基化位点鉴定。目前通常将CID和ETD互补来解析O-糖肽。从完整糖蛋白分析O-糖基化时, 可以采用高分辨质谱从上至下进行分析。阿塞西普的O-糖肽采用了逐级递进能量的CID和ETD进行解析。并利用CE-MS对去N-寡糖后的完整蛋白及亚基进行测定, 获得了O-糖基化的分布信息[41]。
此外, 一种O-糖肽固定方法可特异性捕获糖肽, 在酶切N-寡糖后, 使用新发现的O-蛋白酶酶切O-糖基化位点的N端, 从而释放O-糖肽用于LC-MS鉴定[42]。
5 结语随着生物药的发展, 特别是抗体药物及生物类似药的开发, 糖基化分析在治疗类糖蛋白的质量控制中扮演着越来越重要的作用。为推动治疗类糖蛋白的技术法规建立及质控水平提高, 需要掌握治疗类糖蛋白糖基化分析的核心理念, 明确糖基化分析策略, 充分研究糖基化对治疗类糖蛋白的安全、有效、质量可控所产生的影响, 实现良好的糖基化分析, 并通过持续改进, 依靠先进的技术, 开发更多快速、高效的糖基化分析方法。这些都需要监管部门、工业界及科研单位的共同努力。
致谢: 上海药明生物技术有限公司分析科学部曹晓林、李志国, 抗体药物与靶向治疗国家重点实验室, 国家药品监督管理局治疗类单抗质量控制重点实验室, 上海张江生物技术有限公司郭怀祖, 罗氏制药李爽、焦吉祥, 复宏汉霖谢力琦、张仲理, 沈阳三生制药袁杰, 三生国健王晓闻参与本文的材料提供及撰写。
作者贡献: 汪泓负责资料整理、全文撰写与修改; 尹红锐负责文献查找和段落撰写; 陈益乐、方欣欣、徐明明负责文献翻译; 田橙、徐进负责段落撰写; 陈钢负责资料的整理; 邵泓负责参与人员协调与整体把控。
利益冲突: 无任何利益冲突。
| [1] |
Zhang P, Woen S, Wang T, et al. Challenges of glycosylation analysis and control: an integrated approach to producing optimal and consistent therapeutic drugs[J]. Drug Discov Today, 2016, 21: 740-765. DOI:10.1016/j.drudis.2016.01.006 |
| [2] |
Fournier J. A review of glycan analysis requirements[J]. BioPharm Int, 2015, 28: 32-37. |
| [3] |
Yeoman LC. Glycoprotein and Glycan Analysis[M] // United States Pharmacopeia 42. Baltimore: United Book Press, Inc., 2019: 1259-1270.
|
| [4] |
Reusch D, Haberger M, Falck D, et al. Comparison of methods for the analysis of therapeutic immunoglobulin G Fc-glycosylation profiles-Part 2: mass spectrometric methods[J]. MAbs, 2015, 7: 732-742. DOI:10.1080/19420862.2015.1045173 |
| [5] |
Srinivasan K, Roy S, Washburn N, et al. A quantitative microtiter assay for sialylated glycoform analyses using lectin complexes[J]. J Biomol Screen, 2015, 20: 768-778. DOI:10.1177/1087057115577597 |
| [6] |
Zhang L, Luo S, Zhang B. The use of lectin microarray for assessing glycosylation of therapeutic proteins[J]. MAbs, 2016, 8: 524-535. DOI:10.1080/19420862.2016.1149662 |
| [7] |
Huang YN, Wu LR, Zheng B, et al. Recombinant expression and characterization of endo-β-N-acetyglucosaminidase form Enterococcus faecalis[J]. J Agric Biotechnol (农业生物技术学报), 2018, 26: 698-710. |
| [8] |
Maier M, Reusch D, Bruggink C, et al. Applying mini-bore HPAEC-MS/MS for the characterization and quantification of N-glycans form heterogeneously glycosylated IgGs[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2016, 1033-1034: 342-352. DOI:10.1016/j.jchromb.2016.08.001 |
| [9] |
Yuan J, Hashii N, Kawasaki N, et al. Isotope tag method for quantitative analysis of carbohydrates by liquid chromatography-mass spectrometry[J]. J Chromatogr A, 2005, 1067: 145-152. DOI:10.1016/j.chroma.2004.11.070 |
| [10] |
Liu S, Gao W, Wang Y, et al. Comprehensive N-glycan profiling of cetuximab biosimilar candidate by NP-HPLC and MALDI-MS[J]. PLoS One, 2017, 12: e0170013. DOI:10.1371/journal.pone.0170013 |
| [11] |
Hamm M, Wang Y, Rustandi RR. Characterization of N-linked glycosylation in a monoclonal antibody produced in NS0 cells using capillary electrophoresis with laser-induced fluorescence detection[J]. Pharmaceuticals (Basel), 2013, 6: 393-406. DOI:10.3390/ph6030393 |
| [12] |
Harazono A, Kobayashi T, Kawasaki N, et al. A comparative study of monosaccharide composition analysis as a carbohydrate test for biopharmaceuticals[J]. Biologicals, 2011, 39: 171e. DOI:10.1016/j.biologicals.2011.04.002 |
| [13] |
Marija V, Gordan L, Trbojevic-Akmacic I. Evaluation of different PNGase F enzymes in immunoglobulin G and total plasma N-glycans analysis[J]. Glycobiology, 2021, 31: 2-7. |
| [14] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[M]. Beijing: China Medical Science Press, 2020.
|
| [15] |
Wang WB, Wu G, Yu CF, et al. Interlaboratory validation of HILIC-UPLC method for N-glycan profile analysis of monoclonal antibodies[J]. Chin Pharm J (中国药学杂志), 2019, 54: 2028-2033. |
| [16] |
Li X, Lei Y, Shi XC, et al. Rapid analysis of N-glycan in recombinant human erythropoietin by capillary electrophoresis with laser-induced fluorescence detector[J]. Chin J Pharm Anal (药物分析杂志), 2019, 39: 1852-1857. |
| [17] |
Stockmann H, Duke RM, Millan MS, et al. Ultrahigh throughput, ultrafiltration-based N-glycomics platform for ultraperformance liquid chromatography (ULTRA(3))[J]. Anal Chem, 2015, 87: 8316. DOI:10.1021/acs.analchem.5b01463 |
| [18] |
Segu Z, Stone T, Berdugo C, et al. A rapid method for relative quantification of N-glycans from a therapeutic monoclonal antibody during trastuzumab biosimilar development[J]. MAbs, 2020, 12: 1750794. DOI:10.1080/19420862.2020.1750794 |
| [19] |
Zhang XM, Reed CE, Birdsall RE, et al. High-Throughput Analysis of Fluorescently Labeled N-Glycans Derived from Biotherapeutics Using an Automated LC-MS-Based Solution[C] // Society for Laboratory Automation and Screening, Boston: SLAS Technology Press, 2020, 25: 380-387.
|
| [20] |
O'Flaherty R, Muniyappa M, Walsh I, et al. A robust and versatile automated glycoanalytical technology for serum antibodies and acute phase proteins: ovarian cancer case study[J]. Mol Cell Proteomics, 2019, 18: 2191. DOI:10.1074/mcp.RA119.001531 |
| [21] |
Rogers RS, Nightlinger NS, Livingston B, et al. Development of a quantitative mass spectrometry multi-attribute method for characterization, quality control testing and disposition of biologics[J]. MAbs, 2015, 7: 881-890. DOI:10.1080/19420862.2015.1069454 |
| [22] |
Wang T, Chu L, Li WZ, et al. Application of a quantitative LC-MS multi-attribute method for monitoring site-specific glycan heterogeneity on a monoclonal antibody containing two N-linked glycosylation sites[J]. Anal Chem, 2017, 89: 3562-3567. DOI:10.1021/acs.analchem.6b04856 |
| [23] |
Buettner A, Maier M, Bonnington L, et al. Multi-attribute monitoring of complex erythropoetin beta glycosylation by GluC liquid chromatography-mass spectrometry peptide mapping[J]. Anal Chem, 2020, 92: 7574-7580. DOI:10.1021/acs.analchem.0c00124 |
| [24] |
Chi B, Veyssier C, Kasali T, et al. At-line high throughput site-specific glycan profiling using targeted mass spectrometry[J]. Biotechnol Rep, 2020, 25: e00424. DOI:10.1016/j.btre.2020.e00424 |
| [25] |
Liu T, Guo HZ, Zhu L, et al. Fast characterization of Fccontaining proteins by middle-down mass spectrometry following IdeS digestion[J]. Chromatographia, 2016, 79: 1491-1505. DOI:10.1007/s10337-016-3173-2 |
| [26] |
Wang H, Xu J, Yin HR, et al. Prospects and current use of the multi-attribute method for quality control of therapeutic antibodies[J]. Acta Pharm Sin (药学学报), 2020, 55: 2092-2098. |
| [27] |
Kellie JF, Thomson AS, Chen SG, et al. Biotherapeutic antibody subunit LC-MS and peptide mapping LC-MS measurements to study possible biotransformation and critical quality attributes in vivo[J]. J Pharm Sci, 2019, 108: 1415-1422. DOI:10.1016/j.xphs.2018.11.019 |
| [28] |
Camperi J, Guillarme D, Lei M, et al. Automated middle-up approach for the characterization of biotherapeutic products by combining on-line hinge-specific digestion with RPLC-HRMS analysis[J]. J Pharm Biomed, 2020, 182: 113130. DOI:10.1016/j.jpba.2020.113130 |
| [29] |
Lanter C, Lev M, Cao L, et al. Rapid intact mass based multi-attribute method in support of mAb upstream process development[J]. J Biotechnol, 2020, 314-315: 63-70. DOI:10.1016/j.jbiotec.2020.04.001 |
| [30] |
Khatri K, Klein JA, Haserick JR, et al. Microfluidic capillary electrophoresis-mass spectrometry for analysis of monosaccharides, oligosaccharides, and glycopeptides[J]. Anal Chem, 2017, 89: 6645-6655. DOI:10.1021/acs.analchem.7b00875 |
| [31] |
Wang Y, Feng P, Sosic Z, et al. Monitoring glycosylation profile and protein titer in cell culture samples using ZipChip CE-MS[J]. J Anal Bioanal Tech, 2017, 8: 1000359. |
| [32] |
Deyanova EG, Huang YC, Madia PA, et al. Rapid fingerprinting of a highly glycosylated fusion protein by microfluidic chip-based capillary electrophoresis-mass spectrometry[J]. Electrophoresis, 2021, 42: 460-464. DOI:10.1002/elps.202000132 |
| [33] |
Kammeijer GSM, Jansen BC, Kohler I, et al. Sialic acid linkage differentiation of glycopeptides using capillary electrophoresis - electrospray ionization - mass spectrometry[J]. Sci Rep, 2017, 7: 3733. DOI:10.1038/s41598-017-03838-y |
| [34] |
Jayo RG, Thaysen-Andersen M, Lindenburg PW, et al. Simple capillary electrophoresis-mass spectrometry method for complex glycan analysis using a flow-through microvial interface[J]. Anal Chem, 2014, 86: 6479-6486. DOI:10.1021/ac5010212 |
| [35] |
Váradi C, Jakes C, Bones J. Analysis of cetuximab N-glycosylation using multiple fractionation methods and capillary electrophoresis mass spectrometry[J]. J Pharm Biomed, 2020, 180: 113035. DOI:10.1016/j.jpba.2019.113035 |
| [36] |
Gstöttner C, Vergoossen LE, Wuhrer M, et al. Sheathless CE-MS as a tool for monitoring exchange efficiency and stability of bispecific antibodies[J]. Electrophoresis, 2021, 42: 171-176. DOI:10.1002/elps.202000166 |
| [37] |
Qu YY, Sun LL, Zhu GJ, et al. Sensitive and fast characterization of site-specific protein glycosylation with capillary electrophoresis coupled to mass spectrometry[J]. Talanta, 2018, 179: 22-27. DOI:10.1016/j.talanta.2017.10.015 |
| [38] |
Michael C, Rizzi AM. Quantitative isomer-specific N-glycan fingerprinting using isotope coded labeling and high performance liquid chromatography-electrospray ionization-mass spectrometry with graphitic carbon stationary phase[J]. J Chromatogr A, 2015, 1383: 88-95. DOI:10.1016/j.chroma.2015.01.028 |
| [39] |
Abrahams JL, Campbell MP, Packer NH. Building a PGC-LC-MS N-glycan retention library and elution mapping resource[J]. Glycoconj J, 2018, 35: 15-29. DOI:10.1007/s10719-017-9793-4 |
| [40] |
Dong Q, Yan XJ, Liang YX, et al. In-depth characterization and spectral library building of glycopeptides in the tryptic digest of a monoclonal antibody using 1D and 2D LC-MS/MS[J]. J Proteome Res, 2016, 15: 1472-1486. DOI:10.1021/acs.jproteome.5b01046 |
| [41] |
Stavenhagen K, Gahoual R, Vega ED, et al. Site-specific N- and O-glycosylation analysis of atacicept[J]. MAbs, 2019, 11: 1053-1063. DOI:10.1080/19420862.2019.1630218 |
| [42] |
Yang S, Onigman P, Wu WW, et al. Deciphering protein O-glycosylation: solid-phase chemoenzymatic cleavage and enrichment[J]. Anal Chem, 2018, 90: 8261-8269. DOI:10.1021/acs.analchem.8b01834 |
 2021, Vol. 56
2021, Vol. 56


