2. 医药分子科学与制剂工程工信部重点实验室, 北京 102488;
3. 沈阳药科大学制药工程学院, 辽宁 本溪 117000
2. Key Laboratory of Medical Molecule Science and Pharmaceutics Engineering, Ministry of Industry and Information Technology, Beijing 102488, China;
3. School of Pharmaceutical Engineering, Shenyang Pharmaceutical University, Benxi 117000, China
2019年国家癌症中心发布的全国癌症统计数据显示: 2015年相比2014年的恶性肿瘤发病率增长3.2%[1]。恶性肿瘤最主要的特征是无限增殖。随着肿瘤不断生长, 肿瘤细胞会通过淋巴、血液转移到远离肿瘤的位置形成继发性肿瘤, 治愈率低且治疗费用高。据统计, 20%~30%的肿瘤早期患者可以治愈。早期诊断可以为肿瘤患者提供最佳的治疗方案, 争取有效的治疗时机, 改善患者生存质量, 提高生存率。肿瘤早期诊断依赖于合适和敏感的肿瘤标志物的选择[2-4]。
甘露糖受体是C型凝集素超家族中的一员, 高密度表达于多种肿瘤组织和前哨淋巴结中, 已成为多种恶性肿瘤新的生物标志物[5]。作为一种模式识别受体和内吞受体, 甘露糖受体能够识别末端连接甘露糖、海藻糖、N-乙酰氨基葡萄糖等配体基团的外源物质并吞噬进入细胞内。因此在含有荧光基团、顺磁性氧化铁纳米粒子和放射性核素的配体上键合甘露糖基时, 这些配体会特异性聚集于肿瘤病灶及前哨淋巴结, 用于肿瘤显像。近年来国内外在这方面开展了大量的研究并取得了一定进展, 本文针对以甘露糖受体为靶点的荧光显像剂、磁共振显像剂和放射性核素显像剂展开了综述。
1 甘露糖受体及其在肿瘤组织中的表达甘露糖受体(mannose receptor, MR) 是C型凝集素超家族的一员, 属钙依赖型Ⅰ型跨膜蛋白受体。MR从N端到C端共有5个结构域, 依次为胞外富含半胱氨酸结构域(CR域)、Ⅱ型纤维连接蛋白结构域(FNⅡ结构域)、C型凝集素样结构域(CTLD结构域)、跨膜结构域和胞质内短尾巴结构域[6, 7]。甘露糖受体能特异性识别携带有甘露糖、海藻糖、N-乙酰氨基葡萄糖等配体基团的内源性及外源物质[8], 参与包括感染、免疫、肿瘤转移等多种病理生理过程, 在维持内环境稳定、抵御病原体感染、转运和呈递抗原以及免疫调节等过程中发挥重要作用[9, 10]。
近年来研究发现甘露糖受体在多种肿瘤组织中呈高密度表达, Lü等[11]对乳腺癌间质甘露糖受体的浸润与临床病理特征之间的关系进行了探索, 研究结果表明甘露糖受体在乳腺癌组织中有较高的浸润密度, 且高于良性病变组织, 其高密度表达与肿瘤直径、淋巴结分期及临床分期增高等有关。Fan等[12]通过对327例肝癌患者病理组织的研究系统评价了甘露糖受体在肝癌发展和愈后的作用。与正常肝组织相比, 肝癌患者的甘露糖受体表达明显增高, 而且与肝癌尺寸和转移相关, 甘露糖受体在肝癌干细胞样细胞中的表达与其他国际公认肿瘤标志物相当, 而且甘露糖受体在肝癌中的表达显著影响肝癌的转移和扩散, 导致愈后效果不佳。Ding等[13]研究显示甘露糖受体在大肠癌细胞系CT26和HCT116中有高密度表达且明显高于癌旁组织, 甘露糖受体在大肠癌组织中的表达与总生存期、淋巴结转移也有显著相关性。此外MR在胃癌[14]、膀胱癌[15]、多发性骨髓瘤[16, 17]和弥漫大B细胞淋巴瘤[18]等恶性肿瘤原发病灶中也呈现过度表达状态, 且MR的高密度表达与肿瘤恶化程度呈正相关, 与患者存活率呈负相关, 故MR被认为是多种恶性肿瘤新的生物标志物。
MR不仅存在于肿瘤原发病灶中, 还与L-选择素、CD44蛋白相互作用促进了肿瘤细胞淋巴道的转移[19, 20]。研究表明甘露糖受体在前哨淋巴结(sentinel lymph node, SLN) 巨噬细胞中大量表达[21]。前哨淋巴结是原发肿瘤位置通过淋巴引流到达的第一站淋巴结, 也是最可能发生转移的淋巴结[22]。因此, 开发靶向前哨淋巴结MR的显像剂可以判断肿瘤是否发生了淋巴结转移, 从而对肿瘤分期提供参考[23]。
2 荧光显像剂荧光物质被特定外界能量激发, 引起其电子轨道向高能轨道跃迁, 并最终释放能量回归基态的过程中会产生可被检测的荧光信号。当该物质与激发光具有相同的频率并在吸收该能量后具有高的荧光效率, 其荧光信号可被光学设备所检测。荧光生物成像技术具有成本低、成像速度快、生物安全性高等优势, 该技术可以非侵入性实时进行肿瘤诊断和成像, 引导肿瘤切除手术, 辅助外科医生灵敏、准确地检测和切掉微小的肿瘤, 使肿瘤手术的治疗效果显著提高。荧光成像的主要缺点是由于组织本身对光的吸收, 在多数情况下, 会观察到明显的背景信号, 干扰成像分析的灵敏度。文献报道以MR为靶点的荧光显像剂包括以下几类。
2.1 Cy7标记的脱氧甘露糖(Cy7-DM)由于细胞和组织的自发荧光在近红外波段最小, 因此在检测复杂生物系统时, 近红外染料能提供更高的特异性和灵敏度。菁染料的摩尔吸光系数在荧光染料中是最高的, 是近红外荧光染料中最常用的一类荧光染料。其中Cy7 NHS ester的吸收在近红外区背景非常低, 是荧光强度最高、最稳定的长波长染料, 目前已广泛应用于蛋白质、抗体、核酸等生物分子的标记和检测, 它可以代替放射性元素用于活体动物体内成像。脱氧甘露糖(deoxymannose, DM) 是一种高亲和力、易获得的MR的配体。Jiang等[24]用Cy7 NHS ester标记2-氨基甘露糖得到Cy7-DM。体外研究表明相比于M1型巨噬细胞, Cy7-DM对肿瘤相关巨噬细胞(tumor-associated macrophage, TAMs) 具有更高的亲和力。对乳腺癌小鼠模型的全身成像表明Cy7-DM富集在肿瘤病灶中的TAMs中, 明显高于炎症部位。Cy7-DM合成步骤简单、血液清除率高, 并能够快速地在TAMs中聚集, 是一种有前景的肿瘤诊断试剂。
2.2 荧光标记的甘露糖基化的牛血清白蛋白(BFM)Yang等[25]选择牛血清白蛋白作为骨架, 连接异硫氰酸荧光素酯(fluorescein isothiocyanate isomer I, FITC) 和多个甘露糖, 制备了荧光标记的甘露糖基牛血清白蛋白(fluorescent neomanosyl glycoprotein, BFM)。该分子中1个牛血清白蛋白分子与1个FITC结合构成1个BF分子, 10个甘露糖残基与1个BF分子结合构成一个BFM分子(图 1)。表面等离子体共振分析和微阵列分析证明了该分子可以与刀豆蛋白A结合, 证明了使用该蛋白作为潜在生物显像剂的可行性。乳腺癌MCF-7细胞靶向成像结果显示BFM在MCF-7细胞内大量积累, 表明BFM分子可以用于肿瘤靶向成像。此外, BFM还可以作为甘露糖基化的糖蛋白用于碳水化合物-蛋白相互作用的研究。
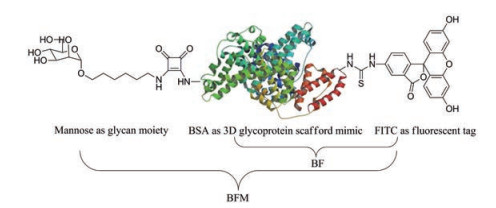
|
Figure 1 Structure of fluorescent neomanosyl glycoprotein (BFM) |
苝酰亚胺(perylene bisimides, PBI) 是一类性能优异的光电材料, 由于其对热稳定、生物相容性好以及近红外区域荧光量子效率高等优点而在荧光探针方面有着良好的应用前景。Wang等[26]设计合成了一种以苝酰亚胺为母核的新型水溶性糖簇分子化合物PBI-12-Man, 一分子糖簇包含12个甘露糖分子(图 2)。他们通过荧光光谱和圆二色谱测定了PBI-12-Man对刀豆蛋白A的选择性和亲和力, 结果表明PBI-12-Man表现出比单糖具有更强的亲和力(亲和常数8.2×10-5 L·mol -1)。在与巨噬细胞表面MR相互作用的过程中, PBI-12-Man显示出良好的生物相容性并能对巨噬细胞表面的MR进行显像, 可以用于分子水平研究癌细胞中碳水化合物和蛋白质的相互作用, 为进一步开发用于诊断的荧光探针和分子显像剂打下了基础。
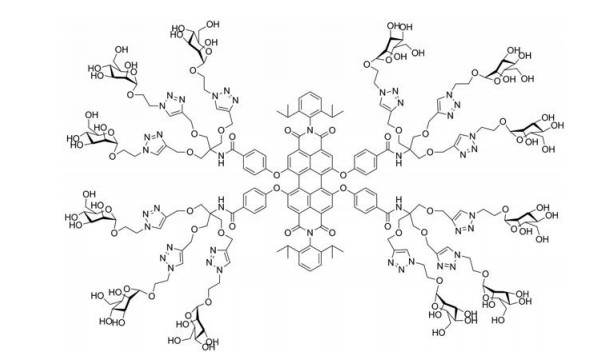
|
Figure 2 Structure of PBI (perylene bisimides) -12-Man |
纳米晶体具有独特的尺寸、可调光谱特性、优异的光稳定性, 因此可提高分子成像和细胞定量分析的灵敏度, 在医学诊断、生物检测、药物筛选等方面具有广阔的应用前景。通过在纳米晶体表面偶联壳聚糖, 可以提高其生物相容性。Jayasree等[27]设计并合成了甘露糖基化的壳聚糖-硫化锌纳米晶体(mannosylated chitosan-ZnS NCs) 作为靶向MR的肿瘤成像荧光生物探针。该晶体平均粒径150 nm, 在600 nm处具有高的胶体稳定性和强的荧光发射。壳聚糖的存在增强了该晶体的稳定性与生物相容性, 与甘露糖的偶联提供了靶向特性。利用荧光显微镜对人口腔上皮癌细胞和正常小鼠纤维细胞进行成像, 结果表明该晶体在MR异常表达的癌细胞中具有高度特异性的附着, 与正常细胞相互作用极小。对该晶体进行数小时的连续的紫外线照射后, 其发光仍然明亮和稳定, 可以实现长时间的高对比度成像, 证明了无重金属、无毒、甘露糖偶联的ZnS纳米晶体用于靶向癌症成像的可行性。
传统的基于有机分子的荧光标记不能提供长期稳定性, 空间分辨率低, 纳米晶体在这方面提供了实质性的改进, 在分子成像方面有着广阔的应用前景。但要实现可重复和稳定的表面功能化以及开发灵活的生物偶联技术, 仍需做大量工作。
3 磁共振显像剂磁共振成像技术利用原子核自旋运动的特点, 在外加磁场内, 经射频脉冲激发后产生信号, 数模转换后输入计算机, 最后经过转换处理得到图像。该技术不仅能够提供较高空间分辨率的图像, 还能够提供高质量的软组织任意断面3D成像信息, 现已成为一种常见的临床肿瘤诊断成像技术[28]。但与其他成像技术相比, 磁共振成像技术对目标分子靶点的灵敏度较低, 需要在较高的磁场作用下长时间采集数据。在临床医疗诊断中, 该技术还需要较高浓度的显像剂来辅助增强正常组织与病变组织间的信号对比度。
3.1 甘露聚糖包被的超顺磁性氧化铁纳米颗粒(mannan-SPIONs)磁性纳米氧化铁粒子是指直径在纳米范围的氧化铁粒子, 具有化学性质稳定、血液滞留时间长、低毒性、生物可降解性等特点, 可通过静电作用或化学作用偶联多肽、单克隆抗体、化疗药物、基因片段等靶向肿瘤病灶的功能分子, 因而在磁共振成像(magnetic resonance imaging, MRI) 方面具有良好的应用。但其在水溶液中容易聚集, 在生理环境中降解速度快的缺点限制了它在生物医学方面的应用, 对其表面进行修饰是克服这些缺点的关键[29, 30]。Yoo等[31]首次合成了甘露聚糖包被的超顺磁性氧化铁纳米颗粒(mannan-coated superparamagnetic iron oxide nanoparticles, mannan-SPIONs, 图 3)。甘露聚糖是一种水溶性多糖, 含有高含量的甘露糖, 可防止SPIONs在生理介质中聚集, 还可以被巨噬细胞上的MR识别。他们采用共沉淀法, 即铁、铁离子合成磁纳米粒子; 然后加入甘露聚糖溶液进行混合, 得到了mannan-SPIONs, 所得产物粒径均匀(约10 nm), 利用傅里叶变换红外光谱仪(Fourier Transform Infrared Spectroscopy, FT-IR) 证明了粒子中甘露糖的存在。为了评价mannan-SPIONs作为MRI对比增强剂对巨噬细胞的靶向性, 他们通过给小鼠尾静脉注射mannan-SPIONs并研究了核磁共振的显像结果。结果表明mannan-SPIONs大量被肝脏Kupffer细胞摄取, 这个结果与小鼠尾静脉注射甘露糖基化乳剂的显像结果一致, 后期肝组织切片的普鲁士蓝染色也证明了肝脏巨噬细胞中存在大量mannan-SPIONs。Vu-Quang等[32]证明该纳米粒子通过MR介导的内吞作用被特异性地传递到淋巴结内的树突状细胞和活化的巨噬细胞, 在淋巴结中通过MRI对其进行检测, 可用于判断肿瘤细胞是否进行了淋巴结转移。
|
Figure 3 Structure of mannan-SPION |
Vu-Quang等[33]合成了羧基化的甘露聚糖包被的超顺磁性氧化铁纳米颗粒(carboxylic mannan-coated SPIONs, CM-SPINOs, 图 4)。粒子表面电荷呈高度负电荷, 带负电荷的CM-SPIONs可以在到达目标之前有效地保护纳米粒子, 使其免受带有负电荷的生物组分(包括红细胞) 的团聚, 适合更长时间在体液中循环, 因此相比于mannan-SPIONs更有优势。他们首先用NaIO4氧化甘露聚糖得到具有醛基的甘露聚糖, 然后经NaClO₂氧化得到羧基化的甘露聚糖, 最后将羧基化的甘露聚糖包覆在SPIONs表面得到CM-SPIONs。所得产物经透射电子显微镜、电泳光散射分光光度计、红外光谱仪进行表征。与mannan-SPION相比, CM-SPION具有更低的毒性。体外实验表明, CM-SPION比PVA-SPION和Dex-SPION更快被腹膜巨噬细胞摄取, 并且在孵育24 h内急剧增加。MRI结果显示, 经皮下注射后, CM-SPION主要富集在小鼠腘窝淋巴结中, 累积速率与阳性对照药物Dex-SPION相等, 普鲁士蓝染色证明了上述结果。
|
Figure 4 Structure of CM-SPION |
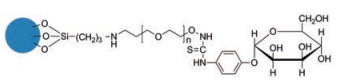
聚乙二醇是一种无毒、水中易溶、生物相容性良好的高分子材料。为了改善SPION的生物相容性和靶向性, Muthiah等[34]合成了末端连接甘露糖聚乙二醇包覆的SPIONs [mannose-poly(ethylene glycol)-linked SPION, mannose-PEG-SPION, 图 5]。他们首先通过共沉淀得到了SPIONs, 然后对其表面进行修饰得到APTES-SPION, 最后用连接甘露糖的聚乙二醇进行包覆得到mannose-PEG-SPION。所得纳米粒子表面带正电荷, 在水溶液中稳定, 4周内未发生聚集。他们采用小鼠尾静脉给药后24 h MRI显像评价mannose-PEG-SPION作为MRI对比增强剂的靶向效果。结果表明, 给药1 h后mannose-PEG-SPION在小鼠淋巴结聚集增强, 与PEG-SPION对照组具有明显差异。淋巴结中mannose-PEG-SPION的信号强度可以稳定24 h, 普鲁士蓝染色获得了一致的实验结果。同时在淋巴结聚集更多、更快, mannose-PEG-SPION在淋巴结特异性MR成像方面显示出巨大的潜力。
|
Figure 5 Structure of mannose-PEG-SPION |
放射性核素显像剂是指引入体内后能进行脏器、组织或分子显像的放射性药物。放射性药物引入体内后, 能浓聚于靶器官或组织中, 通过显像仪器对其发射的射线进行探测, 从而获得药物在体内的分布图像, 用于诊断各种疾病。核医学分子医学影像技术[35]包括正电子发射计算机断层显像技术(PET) 和单光子发射计算机断层显像技术(SPECT), 可以实现全身三维成像, 被广泛用于肿瘤检测、分期和预后[4]。核医学分子医学影像技术具有高灵敏度、可定量定性定位、无限组织渗透能力、可观察动态代谢情况等显著优势, 并且与荧光成像不同, 放射性信号不会发生淬灭。但是, 其空间分辨率相比其他成像模式低。
4.1 99mTc标记甘露糖基化的人血清白蛋白(99mTc-MSA)99mTc半衰期极短(6.01 h), 是核医学单光子发射断层扫描术(SPECT) 中应用最广的核素。人血清白蛋白(HSA) 是人体血液的天然成分, 能在血中稳定存在。经99mTc标记后注入血管后, 可以通过体外探测放射性随血液流动的规律获得宝贵的血流信息, 广泛应用于心脏功能及血管疾病的诊断。为了提高人血清白蛋白的靶向性, Jeong等[36]通过引入甘露糖基对人血清白蛋白进行了修饰, 用于靶向前哨淋巴结巨噬细胞表面的MR。他们首先将甘露糖基苯基异硫氰酸酯与HSA偶联得到甘露糖基化的人血清白蛋白(MSA), 每个HSA分子约与15.9个甘露糖分子结合, 然后用β-巯基乙醇还原HSA蛋白中的二硫键释放出游离的硫醇基团, 与99mTc配位, 得到了99mTc-MSA, 标记率达97%以上, 无需引入DTPA等双功能螯合剂。99mTc-MSA在37 ℃人血清中表现出至少24 h的稳定性。在皮下注射99mTc-MSA、99mTc-锑硫胶体、99mTc-锡胶体和99mTc-HSA后, 利用伽玛射线照相机获得小鼠俯卧时30 min内每2 min的动态平面图像。结果显示99mTc-MSA向淋巴系统的潜移速率最快并富集在腘窝淋巴结(代表前哨淋巴结), 99mTc-锑硫胶体次之, 99mTc-锡胶体几乎只停留在注射部位, 99mTc-HSA则通过淋巴系统进入血池, 无腘窝淋巴结积累。
在一项Ⅰ期临床实验研究中, 42名非小细胞肺癌患者在近肿瘤区域给药99mTc-MSA, 实验结果表明99mTc-MSA可以被淋巴结摄取, 给药21 h后依然可以准确检测, 42名患者中有40名(95.2%) 的前哨淋巴结可以被识别, 没有假阴性结果被检测到。由此可见, 在手术中注射99mTc-MSA用于前哨淋巴结检测是可行的[37, 38]。
4.2 99mTc标记甘露糖基化的金纳米颗粒(99mTc-AuNP-mannose)Mammen等[39]根据分子生物学研究的最新成果, 于1998年提出了生物体系多价态结合理论。该理论认为, 生物实体(分子, 表面) 之间的结合是瞬间的多配体与多受体的多价态结合, 这种多价态结合在生物体系中普遍存在, 而且具有许多单价态结合所没有的特点, 特别是在整体上多价态结合的结合力更强。Ocampo-Garcia等[40]将这一理论应用于显像剂的开发, 将多个甘露糖分子可以连接到金纳米颗粒表面, 使之与MR产生多价态结合, 提高肿瘤部位成像效果。他们首先在金纳米颗粒(AuNPs) 表面连接肼基烟酰胺-甘氨酸-甘氨酸-氨基半胱氨酸(HYNIC-Gly-Gly-Cys-NH2, (HYNIC-GGC)) 和巯基甘露糖(thiol-mannose), 每个AuNP约连接1 000~1 100个HYNIC-GGC、500~600个巯基甘露糖。然后以HYNIC作为双功能螯合剂, 以乙二胺-N, N'-二乙酸(EDDA) 与三(羟甲基) 甲基甘氨酸(tricine) 作为协同配体, 用高锝酸盐对其进行了标记, 得到了99mTc标记表面键合甘露糖的金纳米颗粒(99mTc-AuNP-mannose), 放射化学纯度大于95%, 粒径约23.3 nm。99mTc-AuNP-mannose可在人血清中表现出至少24 h内的稳定性。体外结合实验表明99mTc-AuNP-mannose在肝组织(MR阳性组织)中摄取比99mTc-AuNP高40%。经皮下注射后, micro-SPECT显像表明99mTc-AuNP-mannose在24 h内主要聚集在腘窝淋巴结, 极小量聚集在肾脏, 其他组织中几乎没有。
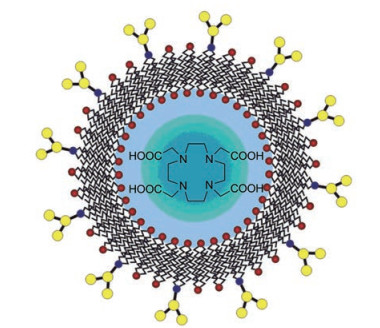
4.3 甘露糖包覆的64Cu脂质体(mannose coated 64Cu liposomes)64Cu具有良好的核物理性质和生物半衰期(12.7 h), 是较好的正电子发射断层扫描术(PET) 中的放射性核素。Locke等[41]首先将1, 4, 7, 10-四氮杂环十二烷-1, 4, 7, 10-四羧酸(DOTA) 封装在脂质体中, 然后甘露三糖和N-(间马来酰亚胺苯甲酰) 二棕榈酰磷脂酰乙醇胺(DPPE) 通过还原胺化结合并包覆在脂质体表面, 利用羟基喹啉将64Cu运送到脂质体内部与DOTA螯合, 得到了甘露糖包覆的64Cu脂质体(mannose coated 64Cu liposomes), 平均直径200 nm (图 6)。体外与巨噬细胞的结合实验中, 与M1型巨噬细胞相比, M2型巨噬细胞与该脂质体的相关性提高了1.9倍。在肺癌小鼠尾静脉注射该脂质体, 6 h后进行PET显像表明该脂质体在肿瘤TAMs中积累, 在远端肺区积累较小。与荧光显像剂的对比实验结果显示该脂质体在肿瘤与远端肺的摄取比例比普通脂质体高2.4倍, 比PEG脂质体高4.9倍。该脂质体能够在正常组织周围快速清除, 并被TAMs特异性吸收, 是一种很有前景的肺癌显像剂, 同时还具有将治疗药物输送到肿瘤微环境的潜力。
|
Figure 6 Structure of mannose coated liposomes |
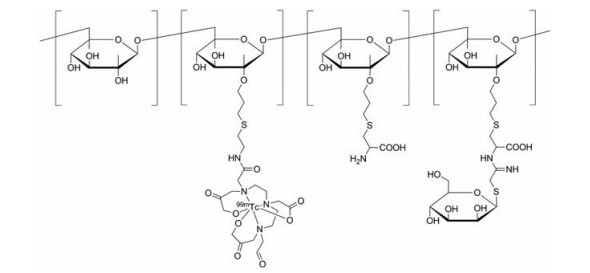
右旋糖酐也称为葡聚糖, 是葡萄糖的聚合物。右旋糖酐具有无毒、可降解、分子量可调节等特点, 当用不同的化学基团修饰右旋糖酐, 可以表现不同的分子性质, 因此常作为载体用于高分子药物的开发[42]。2001年, Vera等[42]首先合成了DTPA-甘露糖-右旋糖酐。该分子以右旋糖酐-10为基本骨架, 每单位的右旋糖酐连接了8个用于99mTc螯合的二乙基三胺五乙酸分子和55个与MR结合的硫代甘露糖分子, 分子平均直径为7.1 nm; 然后用高锝酸钠对其进行放射性标记, 得到了99mTc-DTPA-mannosyl-dextran (99mTc-tilmanocept, 图 7), 放射化学纯度大于98%。
|
Figure 7 Structure of 99mTc-tilmanocept |
体外研究显示, 99mTc-tilmanocept与甘露糖受体的主要结合位点亲和力的Kd值为2.76×10-11 mol·L-1。体内分布实验表明99mTc-tilmanocept在腘窝淋巴结积累, 无远端淋巴结积累, 并在腘窝淋巴结的积累显著高于99mTc-SC, 在注射部位清除速率也比99mTc-SC快。临床研究证明了99mTc-tilmanocept用于淋巴绘图的安全性和有效性, 以下是已完成的Ⅰ~Ⅲ临床研究结果。
Ⅰ期临床研究了24名受试者注射99mTc-tilmanocept或99mTc-SC的注射部位清除率和前哨淋巴结摄取率, 数据详见表 1。Ⅰ期临床表明99mTc-tilmanocept与过滤的99mTc-SC在前哨淋巴结摄取相当, 99mTc-tilmanocept在注射部位清除速率更快[43]。
| Table 1 Injection site clearance and sentinel node uptake of 99mTc-tilmanocept and 99mTc-SC. IDIS: Injected dose injection site; IDSN: Injected dose sentinel node |
Ⅱ期临床研究共78名受试者(47名黑色素瘤患者、31名乳腺癌患者) 参与, 主要研究了99mTc-tilmanocept的淋巴结定位率, 其中包括术中99mTc-tilmanocept定位淋巴结的患者数量、淋巴结数量以及病理阳性数量, 数据详见表 2。此次研究未发现临床重要的药物相关事件, Ⅱ期临床证明了99mTc-tilmanocept用于原发性乳腺癌和皮肤黑色素瘤患者淋巴定位的安全性和有效性[44]。
| Table 2 Histology and pathology results in all evaluable patients |
Ⅲ期临床研究扩大了样本量, 共302名受试者(154名黑色素瘤患者、148名乳腺癌患者) 参与, 研究了99mTc-tilmanocept与术中淋巴绘图的标准制剂蓝染料(vital blue dye, VBD) 在淋巴绘图中的一致性。在黑色素瘤患者中, 99mTc-tilmanocept在235个蓝色淋巴结中检出232个, 符合率为98.7%。在乳腺癌患者中, 99mTc-tilmanocept在209个蓝色淋巴结中检出207个, 符合率为99.04%, 其余数据详见表 3。Ⅲ期临床研究表明99mTc-tilmanocept与VBD的检出率有高度一致性, 并且相比VBD能够检出更多的淋巴结。同时, 该药物未引起严重的药物不良事件, 证明了其安全性[45, 46]。
| Table 3 Intraoperative lymph mapping results |
99mTc-tilmanocept能够靶向前哨淋巴结的甘露糖受体, 并且分子尺寸较小, 因此它能够快速从原发位点向前哨淋巴结转运, 并在前哨淋巴结选择性稳定积累。2013年, 美国食品药品监督管理局正式批准99mTc-tilmanocept (商品名为Lymphoseek) 用于乳腺癌和黑色素瘤的淋巴显像, 它是近30年批准的第一个定位于淋巴结的诊断药物。
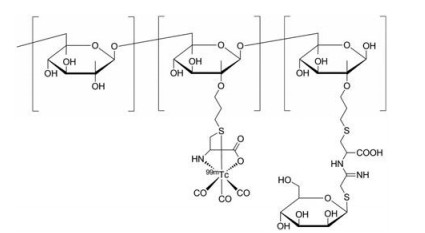
Pirmettis等[47, 48]对99mTc-tilmanocept进行了改进。采用半胱氨酸为作为99mTc的螯合剂, 以羰基锝为前体, 得到99mTc-(CO)3-DCM (图 8), 放射化学纯度大于95%, 平均直径8.3 nm。合成99mTc-(CO)3-DCM时, 他们使用半胱氨酸代替巯基乙胺, 不需要偶联额外的双功能螯合剂, 减少了整体合成步骤。在小鼠皮下注射99mTc-(CO)3-DCM、99mTc-phytate以及99mTc-(CO)3-DC15 [与99mTc-(CO)3-DCM相比, 无硫代甘露糖单元, 其余结构相同] 并用SPECT/CT进行显像, 结果显示在注射99mTc-phytate 6 h后, 小鼠的SPECT/CT图像显示放射性仍留在注射部位, 在注射99mTc-(CO)3-DC15 30 min后在腘窝显示出微弱放射性, 而在注射99mTc-(CO)3-DCM 30 min后, 腘窝淋巴结清晰可见, 注射部位及二级淋巴结仅显示微弱的放射性。99mTc-(CO)3-DCM具有在注射部位清除率高、前哨淋巴结特异性聚集的优点, 其作为前哨淋巴结检测的放射药物值得进一步评价。
|
Figure 8 Structure of 99mTc-(CO)3-DCM |
Giglio等[49]以右旋糖酐-15为基本骨架, 每单位的右旋糖酐偶联36个硫代甘露糖与前哨淋巴结MR结合、一个异氰化结构单元作为99mTc的螯合剂, 合成了DCM30-iso, 然后以99mTc-EDTA为前体对其进行了标记(图 9), 得到99mTc-DCM30-iso, 放射化学纯度大于90%, 在37 ℃至少稳定4 h。99mTc-DCM30-iso以及对照组99mTc-DC25-iso (与99mTc-DCM30-iso相比, 无硫代甘露糖单元, 其余结构相同) 的生物分布和SPECT成像实验表明99mTc-DC25-iso在肾脏、肝脏的摄取较高, 几乎没有淋巴结摄取。Lymphoseek和99mTc(CO)3DCM比99mTc-DC25-iso在腘窝提取率和注射部位清除方面展现了更优异的性质。
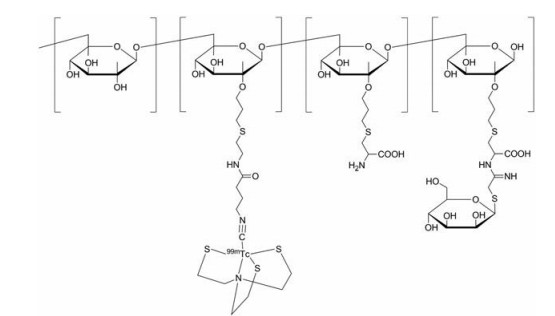
|
Figure 9 Structure of 99mTc-DCM30-iso |
甘露糖受体在乳腺癌、肝癌、胃癌等多种肿瘤组织及前哨淋巴结中呈高密度表达, 已经成为这些肿瘤检测的生物标志物。近年来国内外学者以MR作为靶点设计和合成了多种荧光显像剂。要想获得高质量的荧光图像, 除了荧光成像系统之外, 荧光显像剂的选择也十分关键。一种良好的荧光显像剂要综合考虑特征光谱、光稳定性、量子产率和生物相容性等多个因素。国内外学者分别以有机小分子、生物大分子和纳米晶体为载体通过键合甘露糖获得了新的荧光显像剂, 虽然这些试剂没有进入临床研究, 但进行了有益的尝试。传统有机小分子染料一般尺寸较小, 其优势在于对生物体系的干扰极其细微, 然而却容易被光漂白, 使用寿命过短; 而纳米晶体则不然, 它具有更强的光稳定性, 并且可以融合多种功能以应对复杂的任务, 因此成为近年来研究的热点。甘露糖基化的壳聚糖-硫化锌纳米晶体(mannosylated chitosan-ZnS NCs) 作为靶向MR的肿瘤成像荧光生物探针取得了初步结果并表现出与传统荧光试剂不同的性质, 值得进一步开发研究。
磁共振成像已成为诊断组织病变, 检测肿瘤的有效的方法之一。目前临床使用的造影剂多为纳米级别的磁性材料。超顺磁性氧化铁纳米颗粒生物相容性较好, 比表面积大、饱和磁化强度高, 在外加磁场作用下可控性好, 制备过程相对简便, 易于被功能化, 因此成为用于肿瘤诊断最有前途的纳米载体。甘露糖基化的超顺磁性氧化铁纳米颗粒在病灶组织内呈现特异性分布, 而且SPIONs通过改变磁性纳米颗粒附近的水分子的T2, 提高图像的负反差。但是对SPIONs进行靶向修饰后, 由于SPIONs小尺寸效应导致比表面积大而容易聚集, 从而引起在生物体内的稳定性和生物相容性降低, 影响纳米粒子对肿瘤组织的靶向性, 文献没有对这方面的问题进行系统评价。而且有文献[50]报道通过消化道进入人体的纳米颗粒, 也有可能富集于肝脏、脾脏、肾脏等部位的网状内皮组织中, 因此纳米颗粒的生物毒性也必须引起注意。虽然一般认为包覆有聚乙二醇、葡聚糖等亲水性外壳的中性磁纳米粒子不会与白蛋白、免疫球蛋白、纤连蛋白等蛋白发生相互作用, 但也有学者[51]提出应该建立一系列标准的细胞系用来系统评价纳米颗粒的安全性。
以甘露糖受体为靶点放射性核素显像剂是这一领域中最先取得突破的一类显像剂。99mTc-tilmanocept经过系统的临床前和临床评价, 被美国FDA批准作为乳腺癌及黑色素瘤前哨淋巴结显像剂已经获得上市, 这是近30年来批准的第一个用于淋巴结定位的诊断药物。以此为先导化合物, 通过改变与99mTc配位的基团一些新的放射性核素显像剂陆续被文献报道[42, 49, 52], 希望从中筛选出合成更加简便, 显像效果更好的me-too或me-better药物。
作者贡献: 武丹负责查阅文献及筛选文献, 撰写及修改草稿; 陈聪负责查阅文献及筛选文献; 刘长灏协助指导撰写; 温鸿亮提供撰写思路并修改草稿。
利益冲突: 所有作者均无相关利益冲突。
| [1] |
Wu CC, Li MN, Meng HB, et al. Analysis of status and countermeasures of cancer incidence and mortality in China[J]. Sci China Life Sci, 2019, 62: 640-647. DOI:10.1007/s11427-018-9461-5 |
| [2] |
Zhang JJ, Zhang WC, Li XM, et al. Research progress in the new specific receptor-targeted sentinel lymph node agents[J]. Int J Radiat Med Nucl Med (国际放射医学核医学杂志), 2018, 42: 69-73. |
| [3] |
Guo QJ, Jin ZC, Yuan Y, et al. New mechanisms of tumor-associated macrophages on promoting tumor progression: recent research advances and potential targets for tumor immunotherapy[J]. J Immunol Res, 2016, 2016: 9720912 (1-12). |
| [4] |
Wang WQ, Zhang ZH, Zhou JP, et al. An overview of glycoconjugates for cancer targeting therapy and diagnosis[J]. Acta Pharm Sin (药学学报), 2013, 48: 1763-1770. |
| [5] |
Qiu SQ, Waaijer SJH, Zwager MC, et al. Tumor-associated macrophages in breast cancer: Innocent bystander or important player?[J]. Cancer Treat Rev, 2018, 70: 178-189. DOI:10.1016/j.ctrv.2018.08.010 |
| [6] |
Irache JM, Salman HH, Gamazo C, et al. Mannose-targeted systems for the delivery of therapeutics[J]. Expert Opin Drug Deliv, 2008, 5: 703-724. DOI:10.1517/17425247.5.6.703 |
| [7] |
Stahl PD, Ezekowitz RAB. The mannose receptor is a pattern recognition receptor involved in host defense[J]. Curr Opin Immunol, 1998, 10: 50-55. DOI:10.1016/S0952-7915(98)80031-9 |
| [8] |
Napper CE, Drickamer K, Taylor ME. Collagen binding by the mannose receptor mediated through the fibronectin type Ⅱ domain[J]. Biochem J, 2006, 395: 579-586. DOI:10.1042/BJ20052027 |
| [9] |
Liu XL, Zeng LB. A review of the research advancement of structure, function, expression and application of mannose receptor[J]. Chin J Fish (水产学杂志), 2013, 26: 54-59. |
| [10] |
Martinez-Pomares L. The mannose receptor[J]. J Leukoc Biol, 2012, 92: 1177-1186. DOI:10.1189/jlb.0512231 |
| [11] |
Lü Q, Yin SP, Wang Q, et al. Infiltration of CD68 positive and CD206 positive macrophages in breast cancer tissue and their relation to prognosis[J]. Chin J Clin Exp Pathol (临床与实验病理学杂志), 2016, 32: 252-257. |
| [12] |
Fan WM, Yang X, Huang F, et al. Identification of CD206 as a potential biomarker of cancer stem-like cells and therapeutic agent in liver cancer[J]. Oncol Lett, 2019, 18: 3218-3226. |
| [13] |
Ding DB, Yao Y, Yang CM, et al. Identification of mannose receptor and CD163 as novel biomarkers for colorectal cancer[J]. Cancer Biomarkers, 2018, 21: 689-700. DOI:10.3233/CBM-170796 |
| [14] |
Liu DR, Guan QL, Gao MT, et al. Mannose receptor as a potential biomarker for gastric cancer: a pilot study[J]. Int J Biol Markers, 2017, 32: E278-E283. DOI:10.5301/jbm.5000244 |
| [15] |
Shao JF, Xu ZQ, Hou JQ, et al. Characteristics of CDl63+/CD206+ monocyte-macrophages in tumor microenvironment in patients with bladder cancer[J]. Chin J Exp Surg (中华实验外科杂志), 2017, 34: 1628-1630. |
| [16] |
Andersen MN, Andersen NF, Rodgaard-Hansen S, et al. The novel biomarker of alternative macrophage activation, soluble mannose receptor (sMR/sCD206): implications in multiple myeloma[J]. Leuk Res, 2015, 39: 971-975. DOI:10.1016/j.leukres.2015.06.003 |
| [17] |
Bianchi G, Munshi NC. Pathogenesis beyond the cancer clone(s) in multiple myeloma[J]. Blood, 2015, 125: 3049-3058. DOI:10.1182/blood-2014-11-568881 |
| [18] |
Meng J, Gao YH, Xu HX, et al. Expressions of Toll like receptor 4 and CD163 CD206 in diffuse large B-cell lymphoma and their clinical significance[J]. Chin J Cancer Prev Treat (中华肿瘤防治杂志), 2019, 26: 1180-1186. |
| [19] |
Salmi M, Karikoski M, Elima K, et al. CD44 binds to macrophage mannose receptor on lymphatic endothelium and supports lymphocyte migration via afferent lymphatics[J]. Circ Res, 2013, 12: 1577-1582. |
| [20] |
Irjala H, Johansson EL, Grenman R, et al. Mannose receptor is a novel ligand for L-selectin and mediates lymphocyte binding to lymphatic endothelium[J]. J Exp Med, 2001, 194: 1033-1041. DOI:10.1084/jem.194.8.1033 |
| [21] |
Vera DR, Wallace AM, Hoh CK, et al. A synthetic macromolecule for sentinel node detection: 99mTc-DTPA-mannosyl-dextran[J]. J Nucl Med, 2001, 42: 951-959. |
| [22] |
Morton DL, Chan AD. The concept of sentinel node localization: how it started[J]. Semin Nucl Med, 2000, 30: 4-10. DOI:10.1016/S0001-2998(00)80056-2 |
| [23] |
Morais M, Subramanian S, Pandey U, et al. Mannosylated dextran derivatives labeled with fac-[M(CO)3]+ (M = 99mTc, Re) for specific targeting of sentinel lymph node[J]. Mol Pharm, 2011, 8: 609-620. DOI:10.1021/mp100425p |
| [24] |
Jiang C, Cai HW, Peng XD, et al. Targeted imaging of tumor-associated macrophages by cyanine 7-labeled mannose in xenograft tumors[J]. Mol Imaging, 2017, 16: 1-10. |
| [25] |
Yang Y, Jia TW, Xu F, et al. Fluorescent neomannosyl bovine serum albumin as efficient probe for mannose receptor imaging and MCF-7 cancer cell targeting[J]. ACS Appl Nano Mater, 2018, 1: 1058-1065. DOI:10.1021/acsanm.7b00134 |
| [26] |
Wang KR, An HW, Rong RX, et al. Fluorescence turn-on sensing of protein based on mannose functionalized perylene bisimides and its fluorescence imaging[J]. Biosens Bioelectron, 2014, 58: 27-32. DOI:10.1016/j.bios.2014.02.038 |
| [27] |
Jayasree A, Sasidharan S, Koyakutty M, et al. Mannosylated chitosan-zinc sulphide nanocrystals as fluorescent bioprobes for targeted cancer imaging[J]. Carbohydr Polym, 2011, 85: 37-43. DOI:10.1016/j.carbpol.2011.01.034 |
| [28] |
Huang DH, Qi XY, Ge YR, et al. Application of magnetic iron oxide nanoparticles in magnetic resonance/photothermal dual-modal imaging[J]. Acta Pharm Sin (药学学报), 2017, 52: 481-487. |
| [29] |
Zhi DF, Yang T, Yang J, et al. Targeting strategies for superparamagnetic iron oxide nanoparticles in cancer therapy[J]. Acta Biomater, 2020, 102: 13-34. DOI:10.1016/j.actbio.2019.11.027 |
| [30] |
Hsu FT, Sun R, Hsieh CL. Cellular magnetic resonance imaging with superparamagnetic iron oxide: methods and applications in cancer[J]. Spin, 2019, 9: 1-10. |
| [31] |
Yoo MK, Park IY, Kim IY, et al. Superparamagnetic iron oxide nanoparticles coated with mannan for macrophage targeting[J]. J Nanosci Nanotechnol, 2008, 8: 5196-5202. DOI:10.1166/jnn.2008.1118 |
| [32] |
Vu-Quang H, Yoo MK, Cho CS, et al. Immune cells-specific delivery of mannan-coated superparamagnetic iron oxide nanoparticles for the detection of metastatic lymph node[C]. Hung Hom: 2010 IEEE International conference on nano/molecular medicine and engineering, 2010: 158-163.
|
| [33] |
Vu-Quang H, Muthiah M, Kim YK, et al. Carboxylic mannan-coated iron oxide nanoparticles targeted to immune cells for lymph node-specific MRI in vivo[J]. Carbohydr Polym, 2012, 88: 780-788. DOI:10.1016/j.carbpol.2012.01.067 |
| [34] |
Muthiah M, Vu-Quang H, Kim YK, et al. Mannose-poly(ethylene glycol)-linked SPION targeted to antigen presenting cells for magnetic resonance imaging on lymph node[J]. Carbohydr Polym, 2013, 92: 1586-1595. DOI:10.1016/j.carbpol.2012.11.011 |
| [35] |
Tang GH. Positron emission tomography imaging and drug development[J]. Acta Pharm Sin (药学学报), 2001, 36: 470-474. |
| [36] |
Jeong JM, Hong MK, Kim YJ, et al. Development of 99mTc-neomannosyl human serum albumin (99mTc-MSA) as a novel receptor binding agent for sentinel lymph node imaging[J]. Nucl Med Commun, 2004, 25: 1211-1217. DOI:10.1097/00006231-200412000-00010 |
| [37] |
Kim HK, Kim S, Sung HK, et al. Comparison between preoperative versus intraoperative injection of technetium-99m neomannosyl human serum albumin for sentinel lymph node identification in early stage lung cancer[J]. Ann Surg Oncol, 2012, 19: 1343-1349. DOI:10.1245/s10434-011-2130-4 |
| [38] |
Kim S, Kim HK, Kang DY, et al. Intra-operative sentinel lymph node identification using a novel receptor-binding agent (technetium-99m neomannosyl human serum albumin, 99mTc-MSA) in stage I non-small cell lung cancer[J]. Eur J Cardio Thorac, 2010, 37: 1450-1456. DOI:10.1016/j.ejcts.2010.01.012 |
| [39] |
Mammen M, Choi SK, Whitesides GM. Polyvalent interactions in biological systems: implications for design and use of multivalent ligands and inhibitors[J]. Angew Chem Int Ed, 1998, 37: 2754-2794. DOI:10.1002/(SICI)1521-3773(19981102)37:20<2754::AID-ANIE2754>3.0.CO;2-3 |
| [40] |
Ocampo-Garcia BE, Ramirez FM, Ferro-Flores G, et al. 99mTc-labelled gold nanoparticles capped with HYNIC-peptide/mannose for sentinel lymph node detection[J]. Nucl Med Biol, 2011, 38: 1-11. DOI:10.1016/j.nucmedbio.2010.07.007 |
| [41] |
Locke LW, Mayo MW, Yoo AD, et al. PET imaging of tumor associated macrophages using mannose coated 64Cu liposomes[J]. Biomaterials, 2012, 33: 7785-7793. DOI:10.1016/j.biomaterials.2012.07.022 |
| [42] |
Vera DR, Wallace AM, Hoh CK. [99mTc]MAG3-mannosyl-dextran: a receptor-binding radiopharmaceutical for sentinel node detection[J]. Nucl Med Biol, 2001, 28: 493-498. DOI:10.1016/S0969-8051(01)00218-9 |
| [43] |
Wallace AM, Hoh CK, Ellner SJ, et al. Lymphoseek: a molecular imaging agent for melanoma sentinel lymph node mapping[J]. Ann Surg Oncol, 2007, 14: 913-921. DOI:10.1245/s10434-006-9099-4 |
| [44] |
Leong SPL, Kim J, Ross M, et al. A phase 2 study of 99mTc-tilmanocept in the detection of sentinel lymph nodes in melanoma and breast cancer[J]. Ann Surg Oncol, 2011, 18: 961-969. DOI:10.1245/s10434-010-1524-z |
| [45] |
Sondak VK, King DW, Zager JS, et al. Combined analysis of phase Ⅲ trials evaluating[99mTc]tilmanocept and vital blue dye for identification of sentinel lymph nodes in clinically node-negative cutaneous melanoma[J]. Ann Surg Oncol, 2013, 20: 680-688. DOI:10.1245/s10434-012-2612-z |
| [46] |
Wallace AM, Han LK, Povoski SP, et al. Comparative evaluation of[99mTc]tilmanocept for sentinel lymph node mapping in breast cancer patients: results of two phase 3 trials[J]. Ann Surg Oncol, 2013, 20: 2590-2599. DOI:10.1245/s10434-013-2887-8 |
| [47] |
Pirmettis I, Arano Y, Tsotakos T, et al. New 99mTc(CO)3 mannosylated dextran bearing S-derivatized cysteine chelator for sentinel lymph node detection[J]. Mol Pharm, 2012, 9: 1681-1692. DOI:10.1021/mp300015s |
| [48] |
Subramanian S, Pandey U, Papadopoulos M, et al. Studies toward the biological efficacy of 99mTc-labeled dextran-cysteine-mannose ([99mTc(CO)3]DCM20) for sentinel lymph node detection[J]. Cancer Biother Radiopharm, 2012, 27: 365-370. DOI:10.1089/cbr.2011.1131 |
| [49] |
Giglio J, Fernandez S, Jentschel C, et al. Design and development of 99mTc-'4+1'-labeled dextran-mannose derivatives as potential radiopharmaceuticals for sentinel lymph node detection[J]. Cancer Biother Radiopharm, 2013, 28: 541-551. DOI:10.1089/cbr.2012.1440 |
| [50] |
Pothayee N, Balasubramaniam S, Pothayee N, et al. Magnetic nanoclusters with hydrophilic spacing for dual drug delivery and sensitive magnetic resonance imaging[J]. J Mater Chem B, 2013, 1: 1142-1149. DOI:10.1039/c2tb00275b |
| [51] |
Joris F, Valdeperez D, Pelaz B, et al. The impact of species and cell type on the nanosafety profile of iron oxide nanoparticles in neural cells[J]. J Nanobiotechnol, 2016, 14: 69. DOI:10.1186/s12951-016-0220-y |
| [52] |
Yamaguchi A, Hanaoka H, Pirmettis I, et al. Injection site radioactivity of 99mTc-labeled mannosylated dextran for sentinel lymph node mapping[J]. Mol Pharm, 2015, 12: 514-519. DOI:10.1021/mp500592e |
 2021, Vol. 56
2021, Vol. 56


