由各种原因引起的心脏血液供应不足、心肌供氧量减少所致的心肌代谢不正常, 不能使心脏正常工作的病理状态叫作心肌缺血(myocardial ischemia)。目前心肌缺血疾病已经成为了世界各国普遍存在的非传染性疾病, 因其发病率高, 难以治疗, 治疗负担重等特点成为了威胁人类健康的头号杀手。据统计, 全球每年死亡人数中, 大约有1/3是死于心肌缺血疾病, 其致死率居全球首位[1]。国内情况同样不容乐观, 心肌缺血疾病患者已达到2.9亿, 每年死于心肌缺血疾病的人数占疾病致死总人数的40%以上[2]。目前治疗心肌缺血疾病的主要手段为手术治疗以及针对性的使用西药缓解病症, 但与西药治疗效果单一、不良反应大、价格昂贵等缺点相比, 天然药物具有价格便宜, 治疗途径多样、不良反应小的优势, 因此得到了广泛关注。
长期的心肌缺血会导致心肌组织发生不可逆的损伤[3], 其中最常见的死因是血栓导致的心肌梗死, 以及缺血后再灌注所造成的损伤[myocardial ischemic/reperfusion injury (MI/RI)]。心肌缺血会通过多种途径对机体造成损伤, 缺血使心肌细胞供氧不足, 会影响控制细胞凋亡的因子Bcl-2家族中抗凋亡的Bcl-2和促凋亡的Bax导致心肌细胞的凋亡, 引起组织损伤, 从而导致心肌功能障碍[4]; 由于心肌功能下降, 氧自由基(ROS) 与抗氧化自卫系统之间动态平衡失调, 出现氧化应激反应, 损伤细胞和器官的功能[5], 同时还会激活炎症因子NF-κB, 使炎性因子肿瘤坏死因子-α (TNF-α)、白细胞介素-6 (IL-6) 等增加引起心肌炎症反应[6]; 缺血心肌再灌注时, 细胞会快速聚集Ca2+, 引起Ca2+超载, 损伤线粒体内膜, 不仅会造成细胞损伤, 还会诱导细胞凋亡[7], 最终引起心肌梗死。
天然药物可通过影响多种生理过程治疗心肌缺血疾病, 本文对近十年来抗心肌缺血的天然药物研究现状进行综述, 为抗心肌缺血药物研发与临床应用提供了理论依据。
1 皂苷类的天然药物研究表明, 皂苷类化合物具有消除自由基、阻滞钙超载、减少细胞凋亡、抑制炎症等作用[8], 表明其具有抗心肌缺血作用, 而含有皂苷类化合物的天然药物在自然界分布广泛。因此, 人们对于含有皂苷类化合物的天然药物进行了大量研究。
1.1 人参、西洋参人参、西洋参同属五加科人参属植物, 具有相同的生物活性成分人参皂苷, 因此具有相似的生物功能。通过对人参和西洋参的研究发现, 人参皂苷可通过多种方式发挥其抗心肌缺血作用。Aravinthan等[9]对人参总皂苷、Guo等[10, 11]对西洋参的研究, 人参总皂苷可通过多种机制起到抗心肌缺血作用。包括通过抗炎及抗氧化作用来缓解心肌缺血再灌注造成的损伤, 改善细胞葡萄糖利用率, 促进细胞生长因子的方式来诱导心肌细胞生成, 通过影响一氧化氮合酶提升体内NO水平等。进一步研究表明, 抗心肌缺血的主要成分为人参皂苷Rb1 (ginsenoside-Rb1, 化合物1, 图 1)、Rb2 (ginsenoside-Rb2, 化合物2)、Rb3 (ginsenoside-Rb3, 化合物3)、Re (ginsenoside-Re, 化合物4)、Rg1 (ginsenoside-Rg1, 化合物5) 等。人参皂苷Rg1可激活PI3K/AKT, 抑制p38MAPK, 通过抑制两条信号通路之间的串扰, 促进血管内皮生长因子生物合成, 有效修复受损血管[12]; 人参皂苷Rb3可以通过降低丙二醛(MDA) 含量, 提高超氧化物歧化酶(SOD) 途径调节氧化应激[13], 同时还可调节控制细胞凋亡蛋白Bcl-2/Bax的比例, 与抗氧化应激途径协同起到抑制细胞凋亡、TNF-α、IL-6的作用[14]; 人参皂苷Rb1可通过调节磷脂酰肌醇-3-激酶(PI3K)/Akt通路来缩小心肌梗死范围[15]; 人参皂苷Re可有效清除H2O2和羟基自由基, 起到抗氧化的作用。
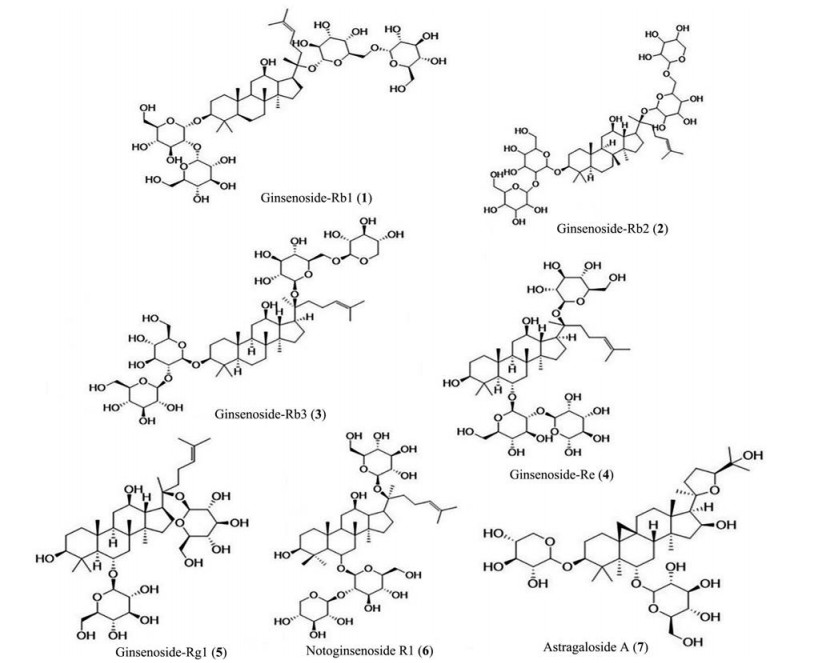
|
Figure 1 Saponins 1-7 |
经蒸干炮制的人参被称为红参, 以往的研究表明, 红参的抗氧化作用较人参明显增强[16], Lim等[17, 18]对红参的研究, 证实了其可通过清除自由基以及增强血流动力学因子对心肌缺血起到调节作用。目前, 国内外对于红参抗心肌缺血作用还处于探索阶段, 值得进行下一步研究。
1.2 三七五加科人参属植物三七具有多种药理作用, 主要活性成分为三七皂苷[19], 其中, 三七皂苷R1 (notoginsenoside R1, 化合物6) 的主要作用是抗心肌缺血[20], 可显著抑制心肌细胞凋亡, 通过抗氧化以及抑制细胞内钙超载来保护心肌细胞[21], 通过对三七的研究表明, 三七总皂苷可通过激活MIF通路[22]以及调控Bcl-2/Bax的正向表达[23]来抑制细胞凋亡, 有效清除体内的氧自由基来抑制氧化应激, 通过与Ca2+争性地结合心肌细胞膜上的位点, 减少Ca2+内流来抑制钙超载[24]。深入研究表明, 三七皂苷中含有多种人参皂苷成分, 其中含量最多是人参皂苷Rb1和Rg1, 也是通过以上机制发挥心肌缺血作用的[25, 26]。
1.3 黄芪Ma等[27]报道了黄芪中的皂苷类成分黄芪甲苷(astragaloside A, 化合物7) 可通过多种途径发挥抗心肌缺血作用, 通过Bcl-2/Bax基因的表达来抑制细胞凋亡。Ge等[28, 29]研究表明, 通过增强SERCA2a酶活性, 增加SR对钙的再摄取, 有效降低心肌细胞中Ca2+浓度; He等[30, 31]报道了黄芪甲苷可通过抑制线粒体通透性转移孔(mPTP) 的开放来保护线粒体, 从而保护心肌细胞, 减少心肌梗死面积, 还可以通过降低MDA的量, 增强SOD活力的途径来清除氧自由基, 减少氧化应激所造成的损伤。
2 黄酮类的天然药物黄酮类化合物是一类在植物中广泛分布的多酚化合物, 研究表明其具有抗氧化、抑制钙超载、抑制细胞凋亡、抑制炎症损伤、调节细胞自噬及抑制金属蛋白酶等药理活性[32]。从而决定了黄酮类化合物在抗心肌缺血方面具有独特作用。因此, 含有黄酮类的天然药物一直是研究热点。
2.1 杜鹃花传统药物杜鹃花中含有丰富的黄酮类化合物成分, 其中的金丝桃苷(hyperoside, 化合物8, 图 2)、槲皮素(quercetin, 化合物9) 对心肌缺血损伤具有保护作用[33]。Li等[34, 35]研究表明, 金丝桃苷可通过激活PI3K/Akt通路来清除氧自由基; 通过上调Cx43、Kir2.1蛋白表达减少心肌酶释放来抑制细胞凋亡。Liu等[36-38]报道了槲皮素通过抑制氧自由基的生成、增加脂质超氧化调节SOD与MOD含量来有效抑制氧化应激, 进而抑制心肌细胞的过度自噬; 通过减少炎症因子的生成来抑制炎症反应, 多种途径协同作用发挥其抗心肌缺血作用。
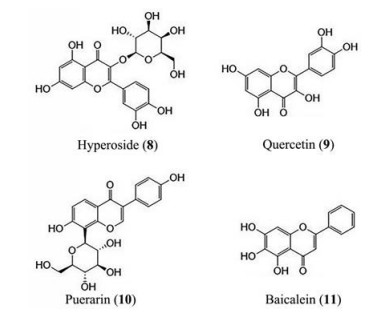
|
Figure 2 Flavonoids 8-11 |
豆科植物葛根的主要活性成分是黄酮类化合物葛根素(puerarin, 化合物10), 其对心血管类疾病特别是心肌缺血有着很好的疗效, 其通过多种途径发挥抗心肌缺血的作用得到了广泛的关注。Xuan等[39, 40]报道了葛根素通过升高抗凋亡因子Bcl-2, 降低凋亡因子Bax的含量起到抗细胞凋亡的作用; 另有报道, 通过升高心肌缝隙连接蛋白43 (connexin43, Cx43) 的含量, 修复由于心肌缺血导致的心肌细胞信号传导不规律, 有效保护心肌细胞[41]; 也可通过调节SOD和MDA水平, 有效清除氧自由基, 起到抗氧化应激作用, 进而保护心肌细胞[42]。Wang等[43]最新研究表明, 葛根素还可通过沉默信息调节因子1 (silent information regulator protein1, Sirt1) 通路, 调控细胞凋亡、炎症、氧化应激等过程来发挥其抗心肌缺血作用。
2.3 黄芩唇形科黄芩有着悠久的用药历史, 其茎叶中的有效成分黄芩素(baicalein, 化合物11) 为黄酮类化合物, 可通过多种途径发挥抗心肌缺血作用。Peng等[44]研究表明, 黄芩素可通过清除细胞中的H2O2及其代谢产物, 并且调节SOD与MOD含量抑制氧化应激, 起到保护细胞的作用; Wang等[45, 46]报道了黄芩素可以有效抑制Janus激酶(JAK)-信号转导与转录激活分子(STAT) 通路, 降低炎症因子TNF-α、IL-6水平, 对凋亡因子Bcl-2/Bax水平也有影响, 发挥抗炎及抗凋亡作用; 通过激活eNOS产生生理性NO, 经过一系列信号传导最终作用于线粒体上, 保护线粒体, 进而保护心肌细胞。
2.4 其他许多天然药物中的黄酮类化合物均有抗心肌缺血活性, 并对其进行了广泛的研究。
唇形科青兰属植物香青兰的主要生物活性成分是香青兰总黄酮。Liang等[47, 48]报道香青兰总黄酮可通过激活细胞自噬调节信号通路AMPK/mTOR、PI3K/AKT/mTOR以及降低了自噬相关蛋白LC3-2、Beclin-1的表达来抑制自噬, 减弱细胞凋亡; 也可通过抑制血清心肌酶的活性, 提高细胞膜的稳定性, 防止线粒体受损[49], 保护心肌细胞; 通过降低MDA的水平并提高抗氧化酶的活性, 抑制氧化应激反应; 通过减少炎症因子IL1、IL-6、TNF-α的释放, 起到抗炎的作用[50]。Ci等[51]对山核桃进行了研究报道, 通过建立动物心肌缺血缺氧损伤模型, 发现山核桃叶总黄酮可以提高心肌细胞抗氧化能力, 有效保护心肌缺血导致的心肌缺氧损伤。Chen等[52]报道了核桃脱脂成分对心肌细胞具有保护作用。同时发现了除不饱和脂肪酸外的又一种抗心血管疾病的成分血清素5, 10-二羟色胺。维药牛舌草长期用于治疗心脑血管疾病, Xu等[53]对其有效成分总黄酮进行了相关研究报道, 通过建立大鼠心肌缺血/再灌注损伤模型, 证实其可减轻心肌损伤, 降低心肌酶谱及炎症因子水平, 抑制细胞凋亡等途径有效保护缺血心肌细胞。Zhao等[54]对鬼箭羽进行了研究, 发现其能够通过降低大鼠血清中CK、CK-MB、AST、LDH、MDA的含量, 同时使大鼠血清NO、SOD含量提高, 对心肌细胞缺血起到保护作用。Wang等[55]研究发现罗布麻总黄酮提取物通过抗氧化、抗细胞凋亡和抗炎机制具有显著的抗心肌缺血再灌注损伤的作用。此外, 金花葵[56]、天山花楸黄酮提取物[57]均可对心肌缺血再灌注损伤起到保护的作用。
目前, 对多种天然药物的黄酮类化合物的研究还处于对总提取物的研究阶段, 发现其具有良好的抗心肌缺血活性, 但对其单体化合物的报道较少, 值得进行深入研究。
3 生物碱类的天然药物多种含有生物碱类化合物的天然药物具有较强的抗心肌缺血作用。研究表明, 一些生物碱类化合物通过增强细胞抗氧化能力、清除自由基以及保护心肌细胞等途径来发挥其抗心肌缺血的作用。
川芎中的主要活性成分为生物碱类化合物川芎嗪(ligustrazine, 化合物12, 图 3), 通过抑制炎症因子NF-κB活性, 进而起到抗炎的作用[58, 59], 可显著升高大鼠血清SOD、T-AOC活性并抑制MDA的含量, 有效减轻心肌缺血大鼠氧化应激损伤[60], 最新研究表明, 川芎嗪还可通过激活Nrf2通路起到抗氧化应激作用[61]。高乌头中的生物碱成分高乌甲素(lappaconitine, 化合物13), 可通过清除体内自由基, 提高NO含量的方式来保护心肌细胞[62], 防己科药物北豆根中的氧化异阿朴啡型生物碱oxoisoaporphine A (化合物14) 以及蝙蝠葛波分碱(CCRIS 3818, 化合物15) 可有效保护心肌细胞[63], 此外, 研究表明, 延胡索的总生物碱可通过升高SOD活力、降低MDA含量的途径, 提高心肌细胞的抗氧化能力[64]。沙棘籽中的生物碱成分[65], 同样发现其具有抗心肌缺血活性, 值得进一步研究。

|
Figure 3 Alkaloids 12-15 |
目前, 除黄酮类、皂苷类以及生物碱类化合物外, 还有许多种化合物同样具有抗心肌缺血的作用, 人们对多种化合物的抗心肌缺血作用进行了研究。
酚酸类化合物具有抗心肌缺血活性。其中丹参因其有效的抗心肌缺血活性被广泛研究。Chen等[66, 67]研究表明, 丹参中的丹酚酸A (salvianolic acid A, 化合物16, 图 4)、丹酚酸B (salvianolic acid B, 化合物17) 可通过清除自由基, 抑制凋亡因子, 抑制炎症因子等途径发挥其抗心肌缺血作用。除此之外, 荔枝中的酚酸类提取物具有良好的抗氧化活性, 具有抗心肌缺血作用[68]。

|
Figure 4 Other compounds 16-18 |
萜类化合物同样具有抗心肌缺血作用。银杏中萜类成分含量较多, 其中以银杏二萜内酯为主。Liu等[69]通过建立大鼠MI/R模型对银杏二萜内酯进行了研究, 发现可有效减轻心肌组织损伤程度, 降低凋亡细胞百分比, 降低心肌中促炎症因子p-IKK, p-IκBα和NF-κBP65的表达, 有效清除氧自由基缓解氧化应激水平, 诱导抗氧化信号通路Nrf2、HO-1和NQO1的表达, 通过抗炎、抗细胞凋亡、抗氧化的途径, 发挥其抗心肌缺血的作用。苏合香中的三萜类化合物通过抑制LDH和CK的释放以及心肌细胞凋亡来改善大鼠心肌缺血、抑制细胞凋亡[70]; 山茱萸中的环烯醚萜化合物具有抗氧化的作用[71], 都可以有效保护受损的心肌细胞。
除此之外, 近几年对其他种类的天然药物的抗心肌缺血活性也有研究报道。如大蒜中的大蒜素(allicin, 化合物18) 可以通过抑制Ca2+超载, 增加NO浓度来缓解急性心肌缺血再灌注后心律失常和心功能影响[72]; 天麻具有较强的抗炎作用, 可对心肌细胞起到保护作用[73]等。
5 天然药物的临床应用药物的联用一直是临床中的重点话题, 多种药物联合使用时可以达到超出预期的效果。中医在药物联用方面具有悠久的历史, 但对其作用机制尚不明确。因此, 对天然药物联用的研究具有很高的价值。
Wang等[74]对丹参红花联用进行了研究, 发现其抗心肌缺血作用明显优于两种药物单独服用时所发挥的作用。Li等[75]对三七总皂苷和红花提取物联用进行了研究, 发现其对心肌缺血后再灌注的保护作用比单独用药时更强, 明显提升了抗心肌缺血的范围。Chen等[76]对三七总皂苷和银杏提取物联用进行了研究, 发现其抗心肌缺血作用优于单味药物的使用。
不同于单一途径发挥药效的西药, 天然药物制剂可通过多种途径发挥抗心肌缺血作用。目前, 一些上市的天然药物在抗心肌缺血方面发挥了重要作用。复方丹参滴丸由丹参、三七、冰片为主要成分制得, 其可以通过抗氧化、抗细胞凋亡、抗钙超载等多个途径发挥抗心肌缺血作用[77], 其药效通过联合应用得到了进一步的加强。不仅如此, 中成药与西药联合应用同样具有良好的效果。复方丹参滴丸在与维生素B6联合使用的临床试验中, 发挥了优秀的疗效的同时, 维生素B6还减轻了复方丹参滴丸中冰片对胃黏膜的刺激[78]。以黄芪、丹参、川芎、红花等几味药材制剂的脑心通胶囊, 在与西药联合使用的临床研究中取得了不错的疗效[79], 脑心通胶囊在发挥其治疗作用的同时, 还可通过调节NO比值来保护心肌细胞。银杏蜜环口服液是以银杏及天麻蜜环菌为主要成分的复方制剂, 能够抑制炎症因子的表达, 有效保护心肌细胞, 且其作用明显优于两种药物单独使用[80]。
6 小结心肌缺血目前已经成为了世界上患者最多、致死率最高的非传染性疾病, 由于其主要致死原因心肌梗死, 以及缺血再灌注时的诸多病理机制使其难以被有效治愈。天然药物因其疗效确切、来源广泛、经济易得等特点具有极高的研究价值, 在对天然药物的研究中, 大多数通过动物实验证明了其作用机制, 临床上也发现其具有良好的疗效。
本文综述了部分含有皂苷类、黄酮类、生物碱类及萜类等成分的天然药物, 其主要通过抑制炎症因子NF-κB发挥抗炎作用、调节Bcl-2/Bax水平起到抗细胞凋亡作用、调节MDA与SOD水平来抗氧化应激等机制发挥其抗心肌缺血作用, 同时综述了部分天然药物制剂在临床中应用的机制, 说明了天然药物在抗心肌缺血领域中发挥了重要作用。
由于天然药物种类多样、成分复杂, 目前已开展研究的品种相对较少, 对许多种类的天然药物成分还需要进一步研究。此外, 天然药物的临床应用表明, 联合用药可以更好地发挥其药理活性, 具有很高研究价值。随着对天然药物研究的深入, 必然会从对单味药物的研究转向对多种药物联合使用方面的研究。而中药在天然药物联用方面有着悠久的历史, 将对天然药物临床使用方面起到重要作用。对具有抗心肌缺血作用的天然药物相关研究仍需加大力度, 争取开发出更多的抗心肌缺血天然药物, 以满足日益增长的广大心肌缺血患者的需求。
作者贡献: 本文中所有作者对论文均有实质性贡献。刘俊彤, 赖思含, 付东兴, 周柏松负责综述的撰写与文献调研及核对; 李平亚, 刘金平负责文章的构思、框架的设计以及文章的修改。
利益冲突: 本文中所有作者均声明不存在利益冲突。
| [1] |
Joseph P, Leong D, Mckee M, et al. Reducing the global burden of cardiovascular disease, Part 1: the epidemiology and risk factors[J]. Circ Res, 2017, 121: 677-694. DOI:10.1161/CIRCRESAHA.117.308903 |
| [2] |
Dong ZX, Feng JJ, Lin LK. Study on the application of traditional Chinese medicine injections in cardiovascular diseases[J]. China Res Hosp (中国研究型医院), 2019, 6: 25-32. |
| [3] |
Pagliaro BR, Cannata F, Stefanini GG, et al. Myocardial ischemia and coronary disease in heart failure[J]. Heart Fail Rev, 2020, 25: 53-65. DOI:10.1007/s10741-019-09831-z |
| [4] |
Yao L, Chen HG, Wu QH, et al. Hydrogen-rich saline alleviates inflammation and apoptosis in myocardial I/R injury via PINK-mediated autophagy[J]. Int J Mol Med, 2019, 44: 1048-1062. |
| [5] |
Lebaron TW, Kura B, Kalocayova B, et al. A new approach for the prevention and treatment of cardiovascular disorders. molecular hydrogen significantly reduces the effects of oxidative stress[J]. Molecules, 2019, 24: 1420-3049. DOI:10.3390/molecules24071420 |
| [6] |
Gray CB, Suetomi T, Xiang S, et al. CaMKⅡdelta subtypes differentially regulate infarct formation following ex vivo myocardial ischemia/reperfusion through NF-kappaB and TNF-alpha[J]. J Mol Cell Cardiol, 2017, 103: 48-55. DOI:10.1016/j.yjmcc.2017.01.002 |
| [7] |
Shintani-ishida K, Inui M, Yoshida K. Ischemia-reperfusion induces myocardial infarction through mitochondrial Ca2+ overload[J]. J Mol Cell Cardiol, 2012, 53: 233-239. DOI:10.1016/j.yjmcc.2012.05.012 |
| [8] |
Zheng XJ, Xu HB. Research progress on the mechanism of anti-myocardial ischemia-reperfusion injury of saponins from traditional Chinese medicine[J]. J Emerg Tradit Chin Med, 2012, 21: 443-445. |
| [9] |
Aravinthan A, Kim JH, Antonisamy P, et al. Ginseng total saponin attenuates myocardial injury via anti-oxidative and anti-inflammatory properties[J]. J Ginseng Res, 2015, 39: 206-212. DOI:10.1016/j.jgr.2014.12.001 |
| [10] |
Guo M, Liu J, Guo F, et al. Panax quinquefolium saponins attenuate myocardial dysfunction induced by chronic ischemia[J]. Cell Physiol Biochem, 2018, 49: 1277-1288. DOI:10.1159/000493407 |
| [11] |
Wu Y, Lu X, Xiang FL, et al. North American ginseng protects the heart from ischemia and reperfusion injury via upregulation of endothelial nitric oxide synthase[J]. Pharmacol Res, 2011, 64: 195-202. DOI:10.1016/j.phrs.2011.05.006 |
| [12] |
Yin H, Liu Z, Li F, et al. Ginsenoside-Rg1 enhances angiogenesis and ameliorates ventricular remodeling in a rat model of myocardial infarction[J]. J Mol Med (Berl), 2011, 89: 363-375. DOI:10.1007/s00109-011-0723-9 |
| [13] |
Shi Y, Han B, Yu X, et al. Ginsenoside Rb3 ameliorates myocardial ischemia-reperfusion injury in rats[J]. Pharm Biol, 2011, 49: 900-906. DOI:10.3109/13880209.2011.554845 |
| [14] |
Liu X, Jiang Y, Yu X, et al. Ginsenoside-Rb3 protects the myocardium from ischemia-reperfusion injury via the inhibition of apoptosis in rats[J]. Exp Ther Med, 2014, 8: 1751-1756. DOI:10.3892/etm.2014.2007 |
| [15] |
Wang Z, Li M, Wu WK, et al. Ginsenoside Rb1 preconditioning protects against myocardial infarction after regional ischemia and reperfusion by activation of phosphatidylinositol-3-kinase signal transduction[J]. Cardiovasc Drugs Ther, 2008, 22: 443-452. DOI:10.1007/s10557-008-6129-4 |
| [16] |
Yamabe N, Song KI, Lee W, et al. Chemical and free radical-scavenging activity changes of ginsenoside Re by maillard reaction and its possible use as a renoprotective agent[J]. J Ginseng Res, 2012, 36: 256-262. DOI:10.5142/jgr.2012.36.2.256 |
| [17] |
Lim KH, Kang CW, Choi JY, et al. Korean red ginseng induced cardioprotection against myocardial ischemia in guinea pig[J]. Korean J Physiol Pharmacol, 2013, 17: 283-289. DOI:10.4196/kjpp.2013.17.4.283 |
| [18] |
Lim KH, Cho JY, Kim B, et al. Red ginseng (Panax ginseng) decreases isoproterenol-induced cardiac injury via antioxidant properties in porcine[J]. J Med Food, 2014, 17: 111-118. DOI:10.1089/jmf.2013.2768 |
| [19] |
Gao WM, Zhou Y, Ren XY. Protective effect of Panax notoginseng stem and leaf saponins on isoproterenol-induced acute myocardial ischemia in rats[J]. Drugs Clin, 2019, 34: 1615-1619. |
| [20] |
Zhou W, Liu ZG. The protective effect of notoginsenoside R1 pretreatment on myocardial ischemia-reperfusion injury in rats and related mechanisms[J]. Chin J Clin Pharmacol (中国临床药理学杂志), 2019, 35: 2589-2592. |
| [21] |
Yu Y, Sun G, Luo Y, et al. Cardioprotective effects of notoginsenoside R1 against ischemia/reperfusion injuries by regulating oxidative stress-and endoplasmic reticulum stress-related signaling pathways[J]. Sci Rep, 2016, 6: 21730. DOI:10.1038/srep21730 |
| [22] |
Chen SX, Wen PJ, Wu YH, et al. Study on the relationship between anti-cardiomyocyte apoptosis effect of Panax notoginseng saponins and MIF[J]. Pharm Today, 2020, 30: 243-245. |
| [23] |
Deng HY, Lai WG. Protective effect of notoginsenoside R1 on acute myocardial ischemia rat model[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2013, 19: 265-268. |
| [24] |
Zhang Y, Dai SY, Xu B, et al. Progress in pharmacological research of Panax notoginseng saponins against myocardial ischemia-reperfusion injury[J]. Jiangsu J Tradit Chin Med (江苏中医药), 2017, 49: 82-85. |
| [25] |
Pan C, Huo Y, An X, et al. Panax notoginseng and its components decreased hypertension via stimulation of endothelial-dependent vessel dilatation[J]. Vascul Pharmacol, 2012, 56: 150-158. DOI:10.1016/j.vph.2011.12.006 |
| [26] |
Zhu D, Wu L, Li CR, et al. Ginsenoside Rg1 protects rat cardiomyocyte from hypoxia/reoxygenation oxidative injury via antioxidant and intracellular calcium homeostasis[J]. J Cell Biochem, 2009, 108: 117-124. DOI:10.1002/jcb.22233 |
| [27] |
Ma XL, Wang GM. The protective effect of pretreatment with astragaloside IV on myocardial ischemia-reperfusion injury in rats[J]. Chin J Gerontol (中国老年学杂志), 2015, 35: 4795-4796. |
| [28] |
Ge HJ, Guo YL, Zhou N, et al. Astragaloside IV mediates SERCA2a pathway to improve myocardial ischemia-reperfusion injury in rats[J]. Prog Anatom Sci (解剖科学进展), 2020, 26: 697-700+5. |
| [29] |
Gong AD, Sun JH. A preliminary study on the effect of astragaloside IV on Ca2+ concentration in a rat model of myocardial ischemia and arrhythmia[J]. Asia-Pac Tradit Med (亚太传统医药), 2013, 9: 11-12. |
| [30] |
He YG, Li WF, Yi HL, et al. Study on the mitochondrial mechanism of astragaloside IV inhibiting GSK-3β activity-mediated myocardial ischemia/reperfusion injury in rats[J]. Chin Pharmacol Bull (中国药理学通报), 2014, 30: 402-406. |
| [31] |
Guan FY, Li H, Yang SJ. The protective effect and mechanism of astragaloside IV pretreatment on myocardial ischemia-reperfusion injury in rats[J]. Chin Tradit Herb Drugs (中草药), 2010, 41: 1146-1150. |
| [32] |
Chen QH, Li Q, Yang WJ, et al. Research progress on the related mechanism of flavonoids against myocardial ischemia reperfusion injury[J]. Chin J Clin Pharmacol (中国临床药理学杂志), 2013, 29: 958-960. |
| [33] |
Fan YF, Wang YH, Zhang JH, et al. The protective effect and mechanism of total flavonoids of rhododendron on myocardial ischemia-reperfusion injury in rats in vivo[J]. Chin Tradit Herb Med(中草药), 2008, 4: 240-244. |
| [34] |
Li GD, Xue T, Huang XF. The cardioprotective effect of hyperoside on myocardial ischemia-reperfusion injury in rats[J]. Chin J Clin Pharmacol(中国临床药理学杂志), 2020, 36: 3721-3724. |
| [35] |
Han J, Xuan JL, Hu HR, et al. The relationship between the effect of hyperoside pretreatment on reducing myocardial ischemia-reperfusion injury in rats and the PI3K/Akt signaling pathway[J]. China J Chin Mater Med (中国中药杂志), 2015, 40: 118-123. |
| [36] |
Liu H, Zhang W, Lu SP. Antioxidant effect of quercetin on myocardial injury in rats[J]. Shaanxi Med J (陕西医学杂志), 2017, 46: 995-996. |
| [37] |
Li DM, Zhang YY, Xu L, et al. The protective effect and mechanism of quercetin on myocardial ischemia-reperfusion injury[J]. Pract Pharm Clin Remed (实用药物与临床), 2016, 19: 410-413. |
| [38] |
Zhang XM, Qian XF. The protective effect of quercetin on myocardial ischemia-reperfusion injury in rats[J]. China Pharm (中国药师), 2015, 18: 1895-1898. |
| [39] |
Xuan JL, Wu SX. The effect of puerarin on myocardial ischemia-reperfusion injury in rats and its mechanism[J]. J Taishan Med Coll (泰山医学院学报), 2017, 38: 248-250. |
| [40] |
Li J, Shi B, Huang KX, et al. Effects of puerarin on the expression levels of Bcl-2, Bax and Caspase-3 in myocardial tissue of myocardial ischemia-reperfusion rats[J]. Chin J Lab Diagn (中国实验诊断学), 2013, 17: 631-633. |
| [41] |
Yao SQ, Cui CL. The effect of puerarin on Cx43 in myocardial ischemia-reperfusion injury in rats[J]. J Baotou Med Coll (包头医学院学报), 2016, 32: 37-39. |
| [42] |
Liu GL, Yang W, Wang YX, et al. The effect and mechanism of puerarin on arrhythmia induced by myocardial ischemia-reperfusion in rats[J]. Gen Appl Biol, 2020, 39: 3350-3354. |
| [43] |
Wang ZK, Li JH, Li W, et al. The protective effect and mechanism of puerarin on myocardial ischemia-reperfusion injury in rats[J]. Clin J Med Off (临床军医杂志), 2020, 48: 528-531, 535. |
| [44] |
Peng J, Xu WJ, He BX, et al. Effects of baicalein on rat myocardial ischemia and neonatal cardiomyocyte injury[J]. Chin J Nat Med, 2011, 9: 132-140. |
| [45] |
Wang JW, Yi DL, Wang T, et al. The protective effect of baicalein on myocardial ischemia-reperfusion injury in rats and its effect on the Janus kinase signal transduction and transcriptional activation molecular signaling pathway[J]. Chin J Gerontol (中国老年学杂志), 2020, 40: 2410-2414. |
| [46] |
Tan S, Zhou S, Luo Y. Baicalein pretreatment confers cardioprotection against acute myocardial infarction by activating the endothelial nitric oxide synthase signaling pathway and inhibiting oxidative stress[J]. Mol Med Rep, 2014, 9: 2429-2434. DOI:10.3892/mmr.2014.2091 |
| [47] |
Liang ZQ, Deng J, Yuan Y, et al. Effects of the total flavonoids of flavonoids on the levels of mTOR signaling pathway and related autophagy proteins in rats with myocardial ischemia-reperfusion injury[J]. J Shihezi Univ (Nat Sci) (石河子大学学报自然科学版), 2020, 38: 513-518. |
| [48] |
Hong Y, Yuan Y, Cao WJ, et al. Study on the autophagy effect of the total flavonoids of sweet green orchid on the autophagy induced by myocardial ischemia-reperfusion injury in rats[J]. Chin Pharm J (中国药学杂志), 2016, 51: 890-895. |
| [49] |
Yao JM, Cao WJ, Yuan Y, et al. The protective effect of the total flavonoids of sweet green orchid on myocardial ischemia-reperfusion injury mitochondria[J]. J Shihezi Univ (Nat Sci) (石河子大学学报自然科学版), 2015, 33: 599-603. |
| [50] |
Fan XM, Cao WJ, Xing JG, et al. Study on the protective effect of the total flavonoids of fragrans on myocardial ischemia-reperfusion injury in rats[J]. Chin Tradit Pat Med (中成药), 2013, 35: 1625-1629. |
| [51] |
Ci HD, Yang X, Zhu XX, et al. Protective effects of total flavonoids of hickory leaves on mice against myocardial ischemia and hypoxia injury of myocardial cells[J]. J Yunnan Univ Tradit Chin Med (云南中医药大学学报), 2015, 38: 1-5. |
| [52] |
Chen C, Xu DP, Jin M, et al. Extraction and separation of serotonin from walnut and its anti-myocardial ischemia activity[J]. Food Machinery, 2019, 35: 167-171. |
| [53] |
Xu XN, Niu ZR, Wang SB, et al. The effect and mechanism of total flavonoids of bugloss on myocardial ischemia-reperfusion injury in rats[J]. Acta Pharm Sin (药学学报), 2014, 49: 875-881. |
| [54] |
Zhao CG, Qin SZ, Zhang Y, et al. Experimental study on anti-myocardial ischemia effects of ghost arrow feathers[J]. West J Tradit Chin Med (西部中医药), 2015, 28: 19-21. |
| [55] |
Wang F, Han JC, Li DF, et al. Anti-myocardial ischemia-reperfusion injury and its mechanism of total flavonoids of Apocynum venetum[J]. Pharm Care Res, 2018, 18: 16-20. |
| [56] |
Wang YX, Li F, Wang J, et al. A study on the mechanism of anti-myocardial ischemia of Abelmoschus manihot based on network pharmacology[J]. China Pharm (中国药师), 2020, 23: 1700-1709. |
| [57] |
Li HF, Pang KJ, Li L, et al. Study on the mechanism of anti-myocardial ischemia-reperfusion injury of flavonoids from Sorbus tianshanensis[J]. Chin Tradit Herb Drugs (中草药), 2020, 51: 5243-5253. |
| [58] |
Zhu JX, Rao LL. Effects of Chuanxiong on myocardial ischemia-reperfusion injury in rats[J]. China Mod Med (中国当代医药), 2016, 23: 109-111. |
| [59] |
Rao LL. The effect of Chuanxiong on NF-κB in rats with myocardial ischemia reperfusion[J]. Guangdong Trace Elements Sci (广东微量元素科学), 2016, 23: 10-13. |
| [60] |
Chen DS, Guo LH. Effects of Ligusticum chuanxiong extract on myocardial ischemia-reperfusion injury in rats[J]. Mod J Integr Tradit Chin West Med (现代中西医结合杂志), 2010, 19: 3427-3429. |
| [61] |
Wang G, Liu Y, Hou XF, et al. Ligusticum chuanxiong extract protects against oxidative stress injury in rats with myocardial ischemia by activating the Nrf2 pathway[J]. China J Chin Mater Med (中国中药杂志), 2017, 42: 4834-4840. |
| [62] |
Gao ZQ, Xie H, Chen L. Study on the protective effect of aconitine alkaloid aconitine on myocardial ischemia/reperfusion injury in rats[J]. Jiangsu J Tradit Chin Med (江苏中医药), 2015, 47: 79-81. |
| [63] |
Yu YY, Shao J, Chen F, et al. Study on the oxidized isoaporphine-type alkaloids and their anti-myocardial ischemic activity in the roots of North Bean[J]. J Logistics Univ PAP (Med Sci) (武警后勤学院学报医学版), 2019, 28: 1-6. |
| [64] |
Tian B, Kang TJ, Jia JL, et al. Protective effect and mechanism of total alkaloids of Corydalis yanhusuo on acute myocardial ischemia in dogs[J]. Res Pract Mod Chin Med (现代中药研究与实践), 2020, 34: 31-39. |
| [65] |
Xu DP, Hu CY, Mei JL, et al. Alkaloids in seabuckthorn seed meal and their anti-myocardial ischemic activity[J]. Nat Prod Res Devel (天然产物研究与开发), 2010, 22: 937-939. |
| [66] |
Chen W, Gao FX, Guo LL, et al. Study on the mechanism of the protective effect of salvianolic acid on myocardial ischemia-reperfusion injury[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2013, 19: 242-245. |
| [67] |
Niu ZR, Xu XN, Chen YC, et al. Protective effect of salvianolic acid A on isoprenaline-induced myocardial ischemia in mice and its mechanism[J]. Chin Pharmacol Bull (中国药理学通报), 2015, 31: 1667-1674. |
| [68] |
Chen Y, Li H, Zhang S, et al. Anti-myocardial ischemia effect and components of litchi pericarp extracts[J]. Phytother Res, 2017, 31: 1384-1391. DOI:10.1002/ptr.5865 |
| [69] |
Liu YQ, Liu H, Han PL, et al. Ginkgolide protects rat myocardial injury caused by ischemia-reperfusion through anti-inflammatory and antioxidant effects[J]. Chin J Pharmacol Toxicol (中国药理学与毒理学杂志), 2019, 33: 241-249. |
| [70] |
Wang Y, Gou DF. Efficacy and dose relationship of Suhexiang on myocardial ischemia model rats[J]. Acta Chin Med (中医学报), 2019, 34: 2157-2163. |
| [71] |
Jiang WL, Zhang SM, Tang XX, et al. Protective roles of cornuside in acute myocardial ischemia and reperfusion injury in rats[J]. Phytomedicine, 2011, 18: 266-271. DOI:10.1016/j.phymed.2010.07.009 |
| [72] |
Yu FH, Li HX, Su BJ, et al. Experimental study on the effects of allicin on arrhythmia and cardiac function after acute myocardial ischemia-reperfusion[J]. J Electrocardiol Circ, 2019, 38: 471-476, 549. |
| [73] |
Han CY, Deng WJ, Li Z, et al. Screening the molecular mechanism of Gastrodia against myocardial ischemia based on network pharmacology[J]. World Latest Med Inf (世界最新医学信息文摘), 2019, 19: 25-28. |
| [74] |
Wang XP, Wang PF, Bai JQ, et al. Investigating the effects and possible mechanisms of danshen-honghua herb pair on acute myocardial ischemia induced by isoproterenol in rats[J]. Biomed Pharmacother, 2019, 118: 109268. DOI:10.1016/j.biopha.2019.109268 |
| [75] |
Li YH, Wei Y, Cheng WH, et al. Protective effects of Panax notoginseng saponins and safflower extract on myocardial ischemia and reperfusion injury[J]. Mod Tradit Chin Med Mater Med-World Sci Technol (世界科学技术中医药现代化), 2019, 21: 1346-1352. |
| [76] |
Chen HQ. Research progress on the cardiovascular protective effects of Panax notoginseng saponins, Ginkgo biloba extract and their combination[J]. J Ningde Norm Univ (Nat Sci) (宁德师范大学学报自然科学版), 2019, 31: 286-291. |
| [77] |
Liang Q, Li WJ, Yang XL, et al. Research progress of compound Danshen dripping pills in improving myocardial ischemia-reperfusion injury[J]. Chin J Mod Drug Appl (中国现代药物应用), 2020, 14: 236-238. |
| [78] |
Yang WG, Wan L. Clinical observation of compound Danshen dripping pills combined with vitamin B6 in the treatment of middle-aged and elderly myocardial ischemia[J]. Inner Mong J Tradit Chin Med (内蒙古中医药), 2014, 33: 59. |
| [79] |
Wu YL, Li X. The effect of Naoxintong capsule combined with western medicine in the treatment of acute cerebral infarction with myocardial ischemia[J]. Cardiovasc Dis Electron J Int Tradit Chin West Med (中西医结合心血管病电子杂志), 2018, 6: 162. |
| [80] |
Guo H, Ren JX, Hao TT, et al. Protective effects of Ginkgo biloba and honey ring oral solution on acute myocardial ischemia injury in rats[J]. Acta Pharm Sin (药学学报), 2017, 52: 1865-1870. |
 2021, Vol. 56
2021, Vol. 56


