那可丁(noscapine) 是来源于罂粟的苯酞四氢异喹啉生物碱, 其含量仅次于吗啡。那可丁结构中含两个手性中心, 理论上有4个立体异构体, 但是自然界中普遍以(-)-α异构体1a存在(图 1)。尽管来源于罂粟, 那可丁却并不具有镇痛作用, 亦不具有呼吸抑制和成瘾性等相关不良反应[1], 而是作为非处方镇咳药在临床上广泛使用, 作用机制为缓激肽受体非竞争性拮抗剂。那可丁的口服生物利用度为31.5%, 半衰期为124 min, 平均体内总清除率为4.78 L·h-1 [2], 表现出相对合理的药代动力学性质, 这使其可口服给药, 方便使用。
|
Figure 1 Noscapine and other opium alkaloids |
近年来, 那可丁被发现可有效抑制多种恶性血液瘤和实体瘤细胞, 表现出中等抗肿瘤活性[3]。尤其是, 它被证明, 可透过血脑屏障, 用于替莫唑胺(temozolomide) 耐药神经胶质瘤的治疗。此外, 那可丁本身, 作为治疗非霍奇金淋巴瘤和慢性淋巴细胞白血病的候选药物, 目前也已处于临床I/II期研究阶段(NCT00183950)。由此可见, 那可丁已经成为一个极具开发前景的抗肿瘤药物先导物。因此, 通过结构改造, 进一步提高抗肿瘤活性, 明确构效关系, 优化药代动力学性质, 阐明作用机制, 就成为进一步新药开发亟须解决的关键科学问题。
由于全合成路线较为复杂, 单一构型那可丁的合成方法严重缺乏, 结构改造目前主要是基于半合成路线。本综述将重点介绍近年来基于半合成路线的那可丁结构改造和抗肿瘤活性研究, 以及那可丁的抗肿瘤机制, 并对未来的发展方向和开发前景进行初步展望, 希望对相关研究提供一定的指导。
1 抗肿瘤机制那可丁最早被认为是微管蛋白抑制剂, 这也被认为是其发挥抗肿瘤作用的主要机制。近年来, 又陆续有其他抗肿瘤机制被发现, 由此可见, 那可丁的抗肿瘤作用, 是多靶点多机制的。
1.1 微管蛋白抑制剂微管(MTs) 是微管蛋白的聚合物(以α和β微管蛋白二聚体形式存在), 是细胞骨架的重要组成部分, 在细胞有丝分裂期间负责纺锤体的形成和破坏。通过改变MTs的结合动力学, 可以破坏细胞从有丝分裂中期到后期的过程, 致使细胞凋亡。那可丁最早被发现, 作用机制为微管蛋白抑制剂, 但和秋水仙碱、紫杉醇等传统微管蛋白抑制剂不同, 那可丁即使在很高的浓度下也不会显著改变微管聚合物的总质量, 而是通过改变微管的动力学特性, 使正在聚合或解聚的微管停滞, 从而在不影响微管总质量的前提下使有丝分裂暂停[4, 5]。当那可丁代谢失活后, 正常细胞仍然可以从有丝分裂暂停状态恢复到正常状态, 而肿瘤细胞则会因为有丝分裂暂停而步入细胞凋亡。这种机制使得那可丁理论上对正常细胞不会表现出毒性, 而对于肿瘤细胞则作用显著, 相较于长春花碱类和紫杉烷类微管蛋白抑制剂, 更具临床应用优势。此外, 作为微管蛋白抑制剂, 还有助于克服此类传统药物的耐药性。
1.2 活化JNK通路应激激活蛋白激酶(JNK), 是一组促分裂素原活化蛋白激酶, 与细胞增殖和凋亡, 以及胚胎形成密切相关[6]。Zhou等[7]的研究表明, 那可丁可通过活化JNK通路, 诱导卵巢癌细胞凋亡。
1.3 抑制HIF-1α的表达缺氧诱导因子-1 (HIF-1) 的过表达是实体瘤的主要特征之一。因此, HIF-1及相关信号通路成为肿瘤治疗的重要靶点[8]。Zagzag等[9]研究发现, 经那可丁处理的神经胶质瘤细胞, HIF-1的靶基因—VEGF的表达显著降低, HIF-1的表达和转录活性被抑制, 从而揭示了那可丁抗肿瘤的新机制: 通过抑制HIF-1α的表达阻碍血管生成活性, 产生抗肿瘤活性。在实体瘤中, 缺氧诱导因子-1 (HIF-1) 的过表达是其共同特征, 这与细胞内多种机制的发生导致氧含量急剧降低有关, 如肿瘤细胞的大量增殖、氧分子扩散不足、血流量下降和肿瘤血管异常等。因此, HIF-1和其信号通路成为肿瘤治疗的重要靶点[8]。Zagzag等[9]基于那可丁与苯基异喹啉类的HIF-1抑制剂的构效关系, 确定其为HIF-1途径的新型小分子抑制剂。
1.4 调节凋亡蛋白Heidari等[10]发现, 经过那可丁处理, 髓系白血病细胞中的PARP和半胱天冬酶-3这两种参与细胞凋亡的蛋白发生了上调。Jackson等[11]在非小细胞肺癌H460细胞中也发现了同样的现象。他们还发现, 经那可丁处理的髓系白血病细胞和肠癌细胞会通过线粒体途径诱导凋亡, 凋亡蛋白Bax/Bcl2上调[10, 12]
1.5 抑制NF-κB信号通路转录因子NF-κB可调节一些涉及肿瘤发生的基因的表达, 包括抗凋亡蛋白、环氧合酶-2 (COX-2)、基质金属蛋白酶-9 (MMP-9) 和细胞周期调控基因等。因此, NF-κB在炎症的发生和肿瘤细胞的存活、增殖方面发挥着重要作用[13]。Aggarwal等[14]发现那可丁可阻碍白血病细胞中NF-κB的活化, 导致相关信号通路受到抑制, 从而抑制了白血病细胞的恶性增殖。
1.6 抑制EGFR磷酸化及下游通路基因突变导致的表皮生长因子受体(EGFR) 的过表达是恶性骨肉瘤的主要特征之一[15]。He等[16]发现骨肉瘤细胞中, 那可丁浓度的增加可导致EGFR的磷酸化程度降低, 进而使得下游通路中的NMP2分子发生明显下调, 而NMP2分子在肿瘤侵袭中起重要作用。因此, 那可丁通过抑制EGFR通路, 下调MMP2的表达, 显著抑制了骨肉瘤细胞的侵袭。
2 那可丁衍生物根据对那可丁改造位点和开发顺序的不同, 可将那可丁衍生物分为三代(图 2)。在9'位引入氨基、硝基、卤原子、烷基等基团, 少数将1位羰基还原去除, 所得衍生物被称为第I代那可丁, 这类那可丁衍生物最早被开发。7位甲氧基被羟基、氨基、苄氧基、苄氨基等取代, 所得衍生物被称为第Ⅱ代那可丁。6'位氮原子上的甲基被其他烷基、酰基、氨甲酰基、氧甲酰基、磺酰基等取代, 辅之以1位羰基被还原, 所得衍生物被称为第Ⅲ代那可丁, 这类那可丁衍生物最晚被开发。这些结构改造, 有效拓展了那可丁衍生物的类型, 提高了抗肿瘤活性, 为进一步新药开发奠定了基础。其中一些活性优异的衍生物如9'-Br那可丁、7-NH2那可丁, 目前已处于临床研究之中。

|
Figure 2 The modification sites of three generations of noscapine derivatives |
2003年, Zhou等[5]从那可丁1a出发, 通过亲电取代, 首先合成了9'-溴代那可丁3 (图 3)。使用一系列肿瘤细胞系包括乳腺癌细胞MCF-7和MDA-MB-231、宫颈癌细胞HeLa和Ca Ski、结肠癌细胞Caco-2和T84、卵巢癌细胞SK-OV-3和SigC、T淋巴细胞性白血病细胞株CEM、以及前列腺癌细胞DU145, 进行细胞增殖抑制实验(表 1), 发现在这些细胞系中, 9'-溴那可丁与那可丁相比, 能更为有效地与微管蛋白结合并阻滞细胞于G2/M期, 进而导致肿瘤细胞凋亡[17], 抗肿瘤活性也因此得到了大幅提升。如针对MCF-7肿瘤细胞, 9'-溴那可丁活性达到了那可丁的近40倍(表 1)。目前, 9'-溴那可丁, 被认为是那可丁结构改造最成功的案例之一[5]。

|
Figure 3 Synthesis of 9'-halogenated noscapine derivatives |
| Table 1 In vitro cell growth inhibitory effects of 9'-halogenated noscapine derivatives |
接着, Aneja等[17]通过亲电取代反应, 又陆续合成了9'-氟那可丁4、9'-氯那可丁5和9'-碘那可丁6 (图 3), 发现这3个衍生物与微管蛋白的亲和力亦高于那可丁, 具体顺序为6 > 5 > 4 > 1a。随后, Verma等[18]用MTT法检测了这些衍生物对神经胶质瘤U87细胞的增殖抑制作用。实验表明, 以50 μmol·L-1浓度处理72 h, 发现9'-氯那可丁的抑制作用最强, 抑制率达到87.8%, 9'-碘和9'-氟那可丁为50%~60%, 而那可丁仅约40%。
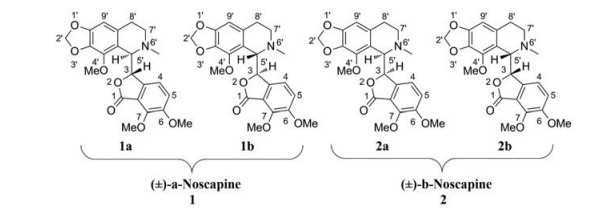
在进一步研究中, Aneja等[19]还将9'-氟那可丁的1位羰基进行了还原, 合成了环醚型衍生物9 (图 4)。发现环醚氟化那可丁同样具有优于那可丁的抗有丝分裂作用, 通过阻滞肿瘤细胞于G2/M期, 导致细胞凋亡。其在乳腺癌MCF-7细胞中的IC50值比那可丁降低了6倍, 在乳腺癌MDA-MB-231细胞中的IC50值比那可丁降低了7倍[17]。需要指出的是, 该衍生物结构中不含内酯环, 理论上应当拥有更好的代谢稳定性, 具有进一步开发的价值。
|
Figure 4 Synthesis of 9'-fluorinated noscapine derivative with a cyclic ether substructure |
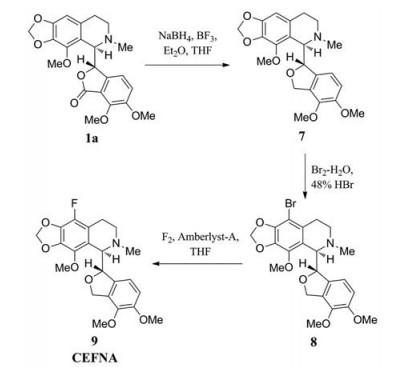
2006年, Aneja等[20]通过硝化反应, 合成了9'-NO2那可丁10 (图 5)。美国国立癌症研究所(NCI) 规定, 抗癌药物开发需筛查60种癌细胞, 被称为NCI-60。使用这些肿瘤细胞对化合物10进行增殖抑制测试, 发现该化合物, 可以显著阻滞肿瘤细胞于G2/M期, 普遍显示出较那可丁更优的抗肿瘤活性。此外, 化合物10对长春碱和替尼泊苷耐药的白血病细胞CEM/VLB100亦具有较好抑制活性。其在CEM、CEM/VLB100和CEM/VM-1-5细胞中的IC50值分别为10、8.1和6.9 μmol·L-1。
|
Figure 5 Synthesis of 9'-NO2 noscapine derivative |
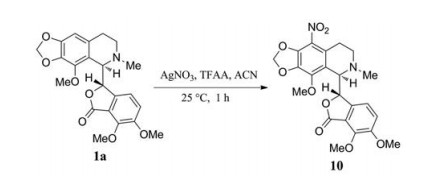
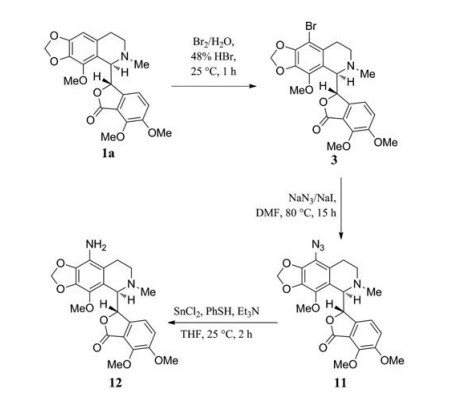
此后, 2011年Naik等[21]通过溴代、叠氮取代、还原等三步反应, 合成了9'-NH2那可丁12 (图 6)。具体操作为, 首先将9'-溴那可丁3与NaN3和NaI在DMF中回流15 h, 得9'-叠氮那可丁11; 进一步在PhSH和Et3N存在下, 用SnCl2还原得目标产物12。实验表明, 9'-NH2那可丁12在NCI-60中显示出比那可丁更强的抗增殖活性。特别是在SNU398细胞中IC50值可达94 nmol·L-1。进一步微管蛋白结合实验证明9'-NH2那可丁的结合自由能(∆Gbind = -6.628 kcal·mol-1) 明显高于那可丁的结合自由能(∆Gbind = -5.246 kcal·mol-1) 且不直接影响微管蛋白亚基的聚合/解聚程度, 并具有与秋水仙碱相似的结合位点(图 7)。因此被认为是最有效的微管蛋白结合剂之一。
|
Figure 6 Synthesis of 9'-NH2 noscapine derivative |

|
Figure 7 Typical snapshot of (a) compounds 12 (green stick) and noscapine (blue stick) bound to tubulin at colchicine binding site (PDB code: 1SA0) from a hybrid Monte Carlo simulation. (b) The enlarge view of the colchicine binding site with the bound ligands |
鉴于9'-NH2那可丁优异的抗肿瘤活性, Manchukonda等[22]对原有合成方法进行了改进(图 8)。实验表明, 在碘化亚铜作用下, 9'-溴那可丁3与NaN3发生偶联反应的同时, 亦发生了叠氮基的还原, 直接生成了9'-NH2那可丁12。该方法有效避免了那可丁的分解, 缩短了反应步骤, 提高了合成效率, 但缺点是会生成副产物1a (收率15%)。
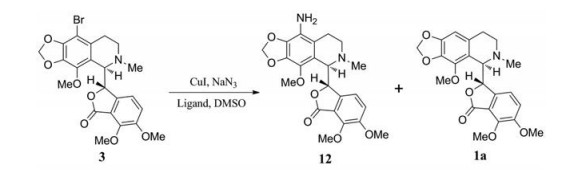
|
Figure 8 Synthesis of 9'-NH2 noscapine derivative by Manchukonda |
虽然上述那可丁衍生物具有良好的抗肿瘤活性, 但水溶性不佳是进一步新药开发亟须解决的另一问题。为了提高水溶性, Henary等[23]从活性优异的9'-NH2那可丁出发, 通过亲核取代反应, 在氨基上引入季铵盐和磺酸等强亲水性团, 合成了衍生物13a~13c (图 9)。这一结构改造, 有效改善了水溶性(表 2), 提高了生物利用度, 然而抗肿瘤作用却没有明显的提升(表 3), 13b的IC50甚至远远高于那可丁, 这表明在9'位进行水溶性改造对那可丁衍生物抗肿瘤作用的发挥极其不利, 因此Henary等转而将水溶性改造的位点聚焦于7位, 这部分将在2.2.5小节中详细介绍。
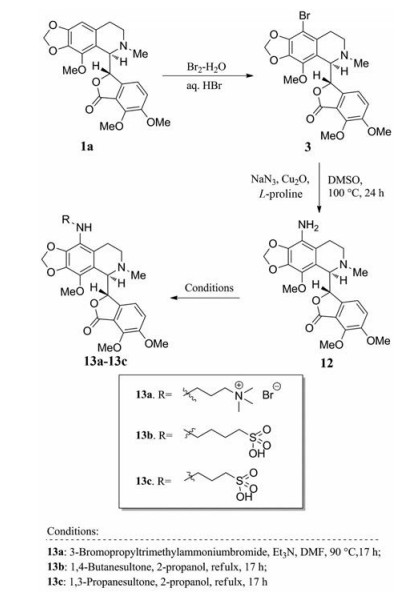
|
Figure 9 Synthesis of water-soluble 9'-NH2 noscapine derivatives |
| Table 2 Phsicochemical descriptor (log P) of water-soluble 9'-NH2 noscapine derivatives |
| Table 3 Comparison of IC50 values of water-soluble noscapine analogs in PC-3 cells |
叶酸受体α (FRα) 在一些肿瘤细胞如卵巢上皮癌细胞中过表达, 是重要抗肿瘤靶点[24, 25]。由于Naik在2011年通过9'-NH2那可丁与微管蛋白的对接试验表明在其9'位与微管蛋白之间存在着很大的结合空腔[21], 受此启发, Naik等[26]在那可丁9'位引入FRα的配体叶酸, 合成了那可丁衍生物18 (图 10、11) 来考察叶酸的引入是否会强化那可丁与微管蛋白的结合。计算实验表明虽然化合物18和那可丁都可以很好地结合于α和β微管蛋白之间的界面中(图 12a~12d), 但是化合物18较大的叶酸基团能更好地伸向α和β微管蛋白之间界面的空腔内(图 12c), 提高了结合稳定性。经过原子电荷优化后得到18与那可丁的QPLD (量子极化配体对接) 对接得分分别为-11.295 kcal·mol-1和-4.752 kcal·mol-1[26]。
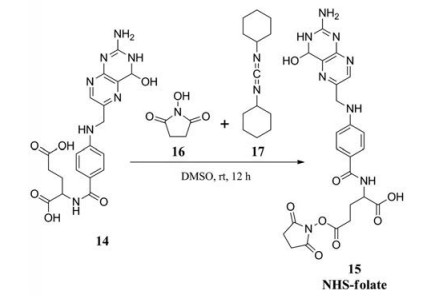
|
Figure 10 Synthesis of NHS-folate |

|
Figure 11 Synthesis of folate-noscapine |
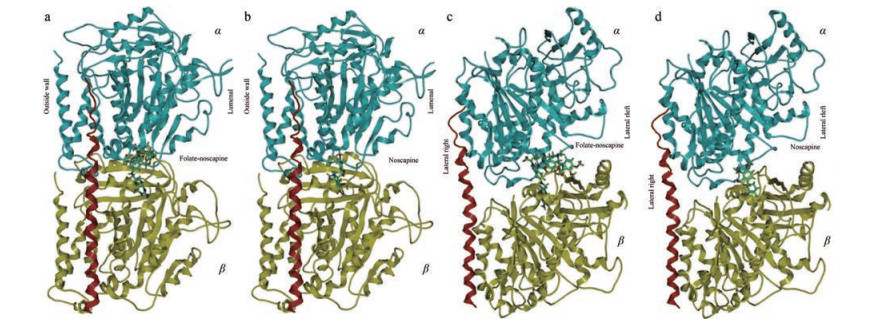
|
Figure 12 Typical snapshots of foalte-noscapine (a, c) and noscapine (b, d) bound to tubulin at the interface between α- and β-tubulin from QPLD (quantum polarized ligand docking) |
由于叶酸基团的引入增强了18与微管蛋白的结合能力, 所以相比于那可丁来说, 化合物18在细胞内的聚集浓度将会明显多于那可丁, 特别是在那些FRα过表达的肿瘤细胞中更是如此, 比如卵巢癌上皮细胞SKOV3和1A9。细胞增殖实验表明, 18对非小细胞肺癌细胞A549、结肠癌细胞HCT116、前列腺癌细胞DU145、乳腺癌细胞T47D以及卵巢癌上皮细胞SKOV3和1A9都表现出比那可丁更强的抗增殖活性, 特别是对于SKOV3和1A9的抑制活性更加明显(表 4)。
| Table 4 IC50 of noscapine and 18 for various cancer cell types |
2014年Porcù等[27]以9'-Br那可丁为起始原料, 通过Suzuki偶联反应, 合成了一系列9'-烷基和9'-芳基那可丁(图 13)。这些衍生物可有效抑制肿瘤细胞的增殖, 可通过浓度依赖的方式, 阻滞宫颈癌HeLa细胞和白血病Jurkat细胞于G2/M期。其中最有效的化合物是9'-CH3那可丁19和9'-Ph那可丁20, 在HeLa细胞中显示出了与9'-Br那可丁相当的细胞毒性(表 5)。此外, 实验表明这类化合物对正常人淋巴细胞没有明显毒性(IC50 > 200 μmol·L-1), 具有进一步开发价值。
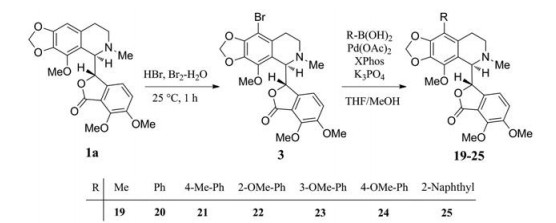
|
Figure 13 Synthesis of 9'-alkylated/arylated noscapine derivatives using Suzuki coupling |
| Table 5 In vitro cell growth inhibitory effects of compounds 3, 19 and 20 |
同年Manchukonda团队, 使用更为有效的Suzuki偶联反应(未使用昂贵的XPhos配体, 催化剂改为四三苯基磷钯), 也合成了一系列9'-芳基那可丁衍生物(图 14), 并研究了这些化合物对乳腺癌细胞(MCF-7), 宫颈癌细胞(HeLa) 和非小细胞肺癌细胞(A549) 的抗增殖活性[28]。实验表明, 这些衍生物抗肿瘤活性普遍优于那可丁, 其中化合物26b、26d和26f活性最佳。例如, 这3个化合物对HeLa细胞的抗增殖活性(IC50值) 分别为9.0、9.2和8.9 μmol·L-1。

|
Figure 14 Synthesis of biaryl type noscapine derivatives using Suzuki coupling |
9'-叠氮那可丁有良好的抗癌活性且没有明显的不良反应, 在急性淋巴瘤细胞CEM中的IC50为2.6 μmol·L-1[29], 具有潜在的开发价值。但是以往合成9'-叠氮那可丁的方法单一且收率极低[5, 30], 因此为了解决9'-叠氮那可丁的合成问题, 2016年Manchukonda团队以9'-Br那可丁为原料两步合成了9'-叠氮那可丁, 随后利用Click反应合成了一系列9'-三氮唑那可丁衍生物28a~28f (图 15)[31]。不过遗憾的是, 作者并未对这些三氮唑衍生物进行活性测试。
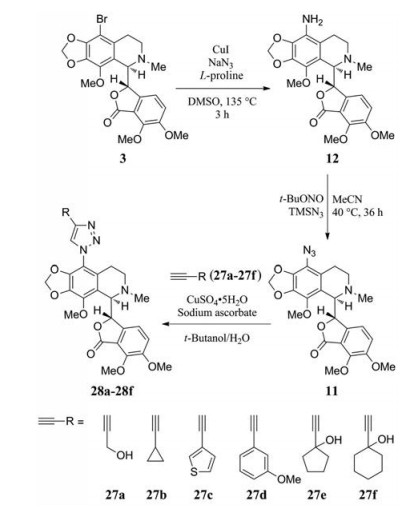
|
Figure 15 Click synthesis of 9'-traizolyl noscapine derivatives |
乙炔基在抗肿瘤药物中经常使用。如已上市药物埃罗替尼、埃克替尼和5-乙炔基-2'-脱氧碳环尿苷中均含有乙炔基[32]。有鉴于此, Reddy等[33]从9'-Br那可丁出发, 利用Heck、氧化、Seyferth-Gilbert等三步反应, 成功制备了9'-炔基那可丁31 (图 16)。
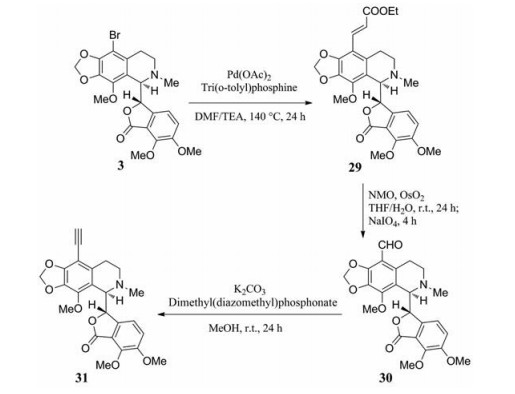
|
Figure 16 Synthesis of 9'-alkynyl noscapine derivative |
Reddy等对合成出的化合物29~31在NCI-60肿瘤细胞中进行抗癌活性筛选。结果发现, 29和30的抗肿瘤活性不佳, 而与之相比的9'-乙炔基那可丁31表现出最佳的抗癌活性, 并且经它处理的NCI-60的平均生长百分比最低(表 6)。
| Table 6 Percentage growth against NCI-60 cancer cell lines in vitro at 10 μmol·L-1 concentration of compounds 29-31 |
1, 3-二炔基团是药物中一种常见优势结构, 表现出抗病毒、抗菌和抗肿瘤等多种生物活性[34]。鉴于那可丁9'位较大的结构可调性, Nagireddy等[35]在上述工作基础上, 以9'-乙炔基那可丁31为原料, 通过Glaser-Hey交叉偶联反应, 制备了一系列9'位含有1, 3-二炔基的那可丁衍生物33a~33n (图 17)。
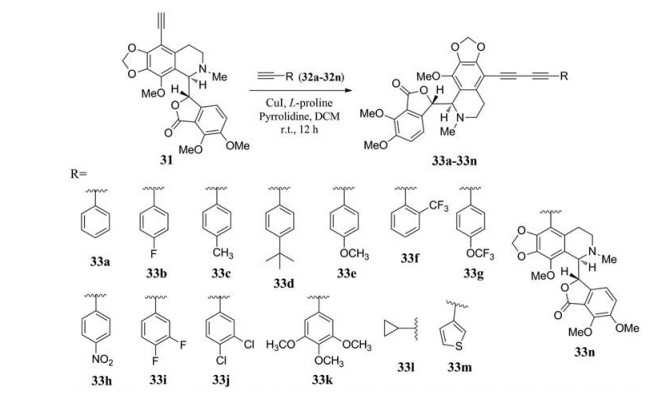
|
Figure 17 Synthesis of 9'-(1, 3-dinynl) noscapine derivatives and 9'-ethynylnoscapine dimer |
针对NCI-60肿瘤细胞的活性筛选表明, 化合物33g具有广谱的抗肿瘤活性。在10 μmol·L-1的浓度下, 33g以大于50%的细胞生长抑制率抑制了所有6种白血病、6种结肠癌和两种前列腺癌细胞系。尤其是对于结肠癌HCT-116和HT 29细胞系和肾癌TK-10细胞系具有最优的抗癌活性, 抑制率高于85%。此外, 作者以62%的收率合成了二聚体33n, 表明Glaser-Hey交叉偶联反应在那可丁的9'位有较好的适应性, 然而由33n处理的NCI-60的平均生长百分比在95%以上, 活性不佳可能是由于较大的分子量降低了33n的细胞透膜能力和以及较大的分子体积使与微管蛋白的结合难度增加, 从而降低了抗肿瘤活性。
2.2 第II代那可丁 2.2.1 7位苄氧基/苄硫基/芳基取代那可丁2005年, Anderson团队从那可丁1a出发, 通过一步烷基置换反应, 合成了7-苄氧基那可丁衍生物34 (图 18), 并发现该化合物具有很强的肿瘤细胞增殖抑制活性[36], 其抑制肿瘤细胞HEK293生长的EC50达到15 μmol·L-1。有趣的是, 与之前报道的那可丁衍生物不同, 这类衍生物会阻滞HEK293于S期。因此, 该衍生物的作用机制理论上应当并非微管蛋白抑制剂。此外, 需要指出的是, 由于反应需在强碱和高温下进行, 那可丁在该过程中发生消旋化, 生成的衍生物为一对非对映异构体(1∶1)。
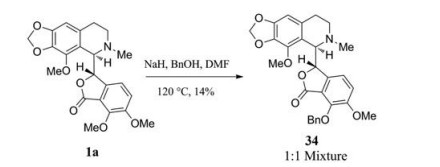
|
Figure 18 Synthesis of 7-OBn noscapine derivative |
进一步研究发现, 以甲基溴化镁替代上述反应中的氢化钠, 则直接得到了7-OH那可丁35, 且消旋化得到很大程度上的抑制(图 19)。但是, 与7-OBn那可丁不同, 该化合物仍然是阻滞HEK293细胞于G2/M期, 通过微管蛋白抑制和抗有丝分裂, 发挥抗肿瘤作用, 且活性较那可丁1a有了大幅提高[37] (表 7)。化合物35进一步发生亲核取代, 得到一系列7位苄氧基衍生物36a~36h (图 20), 这些衍生物中3, 4, 5-三甲氧基取代的化合物36a的S期抑制活性最好, 其次是36e和36f, 而将3, 4, 5-三甲氧基36a替换为3, 4-二甲氧基36b、3, 4-亚甲基二氧基-5-甲氧基36c、3, 4, 5-三乙氧基36d时便没有表现出明显的S期抑制活性, 同样将36e和36f替换为36g和36h时也没有明显的S期抑制作用(表 8)。
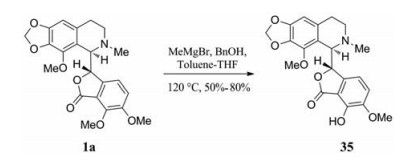
|
Figure 19 Synthesis of 7-OH noscapine derivative |
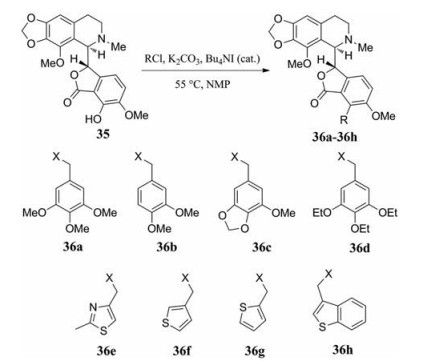
|
Figure 20 Synthesis of 7-O-substituted noscapine derivatives |
| Table 7 Tubulin polymerization and A549 cell growth assays |
| Table 8 Effects on cell cycle distribution |
此外, 他们还合成了7-SBn和7-Ar那可丁(图 21)。7-SBn那可丁38在10 μmol·L-1浓度下, 同样阻滞HEK293细胞于S期(表 7), 但当浓度降低到1 μmol·L-1便几乎没有活性。而7-Ar那可丁39, 却没有表现出明显的S期阻滞。

|
Figure 21 Synthesis of 7-SBn & 7-Ar noscapine derivatives |
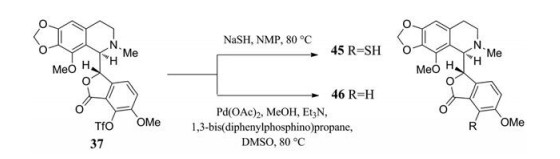
第II代那可丁衍生物的开发还包括利用Buchwald-Hartwig偶联反应, 合成了一系列7位氨基取代那可丁衍生物41~44 (图 22)[38], 尽管反应条件剧烈, 但是并没有差向异构化的发生[39, 40]。其中7-NH2那可丁42, 显示出最为优异的抗肿瘤活性, 可有效阻滞肿瘤细胞于G2/M期, 活性是那可丁1a的250倍(表 8)。同时它的抑制增殖活性也优于7-OH那可丁35, 经过42处理的肝癌细胞SNU398和PLC/PRF/5, IC50分别达到94.3和237.4 nmol·L-1, 而35的IC50都大于2 μmol·L-1[41]。此外, Anderson等[37]利用硫醇钠的亲核取代反应, 以及钯催化的脱三氟甲磺酰氧反应, 还合成了7-SH那可丁45和7位无取代那可丁衍生物46 (图 23), 这两个衍生物对HEK293细胞中的G2/M期抑制率可达90%。
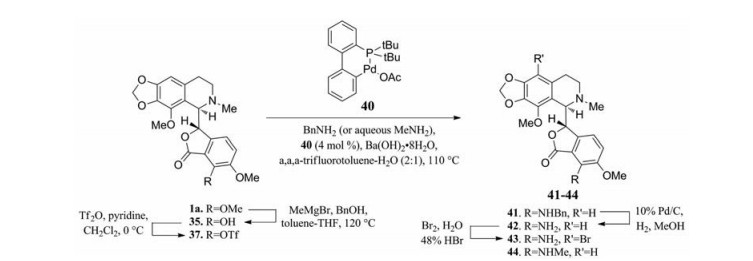
|
Figure 22 Synthesis of 7-alkylated noscapine derivatives using Pd catalyst |
|
Figure 23 Synthesis of noscapine derivatives by Anderson |
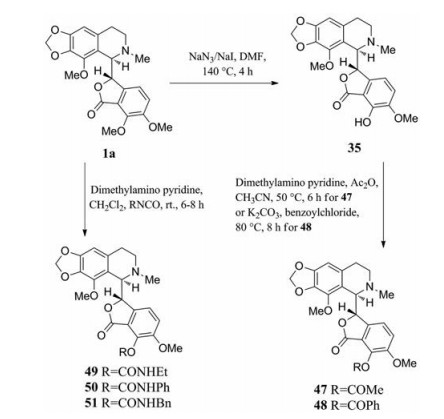
2011年, Mishra等[42]报道一系列7位酰氧基或氨甲酰氧基取代的那可丁衍生物47~51 (图 24)。在合成过程中, 他们采用NaN3/NaI/140 ℃/4 h的方法进行甲基脱除。由于该反应摆脱了强碱性试剂的使用, 进一步减少了差向异构化的发生。这些衍生物对肺癌、骨髓瘤、乳腺癌、胰腺癌和前列腺癌等多种肿瘤细胞均显示出比那可丁更好的微管蛋白结合活性和抗肿瘤活性。其中, 7-OAc那可丁47在大多数肿瘤细胞系中都显示出最为优异的抗肿瘤活性, 7-OCOPh那可丁48对非小细胞肺癌A549细胞具有较好的抑制活性, 而7-OCONHR那可丁49~51对白血病CEM细胞抑制活性最为突出(表 9)。
|
Figure 24 Synthesis of 7-alkylated noscapine derivatives |
| Table 9 In vitro cell growth inhibitory effects of 7-alkylated noscapine derivatives |
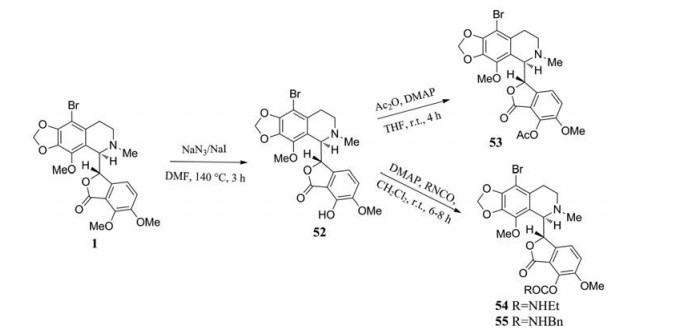
2015年, Mishra团队通过继续在9'位引入溴原子, 合成了一系列7位和9'位双取代的那可丁衍生物52~55, 并测试了它们针对前列腺癌PC-3和乳腺癌MDA-MB-231细胞的抑制活性[43] (图 25)。实验表明, 相比于PC-3细胞系, 这四种衍生物对MDA-MB-231细胞系的抗增值效果更为突出, 衍生物52~55对MDA-MB-231细胞系的IC50值随着7位取代基体积的增大而有所上升, 分别为2.2、2.5、3.9和20 μmol·L-1。这些衍生物相较于那可丁, 均表现出更高的微管蛋白结合活性, 并能显著影响微管蛋白的聚合。例如, 衍生物52~55与微管蛋白相互作用的结合常数分别为55 ± 6、44 ± 6、26 ± 3和21 ± 1 μmol·L-1, 结合能力随着7位取代基体积的增大而增强。
|
Figure 25 Synthesis of di-substituted noscapine derivatives |
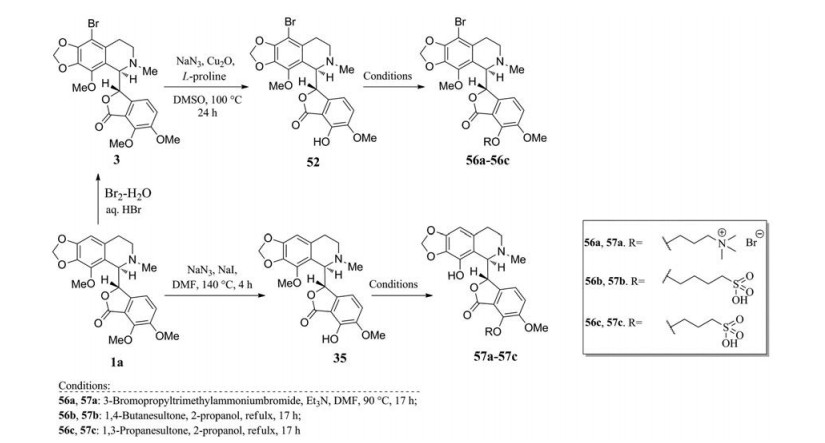
改善水溶性是那可丁类新药开发需要解决的另一关键科学问题。由于Henary等[23]发现在那可丁9'位引入水溶性基团丝毫没有改善衍生物的抗肿瘤活性, 于是转而在7位进行水溶性改造研究。类似于水溶性衍生物13a~13c的设计思路, Henary等[23]在7-OH那可丁35或9'-Br-7-OH那可丁52的酚羟基上, 引入季铵盐或磺酸等水溶性基团(图 26), 合成了一系列水溶性那可丁衍生物56a~56c、57a~57c。化合物56b、56c和57b具有比那可丁更好的微管蛋白聚合抑制活性, 生物利用度比那可丁也提高了一至两倍, 没有明显的不良反应, 并且针对四种肿瘤细胞系(前列腺癌、胰腺癌、乳腺癌和宫颈癌) 均表现出显著的抗增殖活性(表 10)。
|
Figure 26 Synthesis of water-soluble 7-alkylated noscapine derivatives |
| Table 10 Comparison of IC50 values in various cell lines |
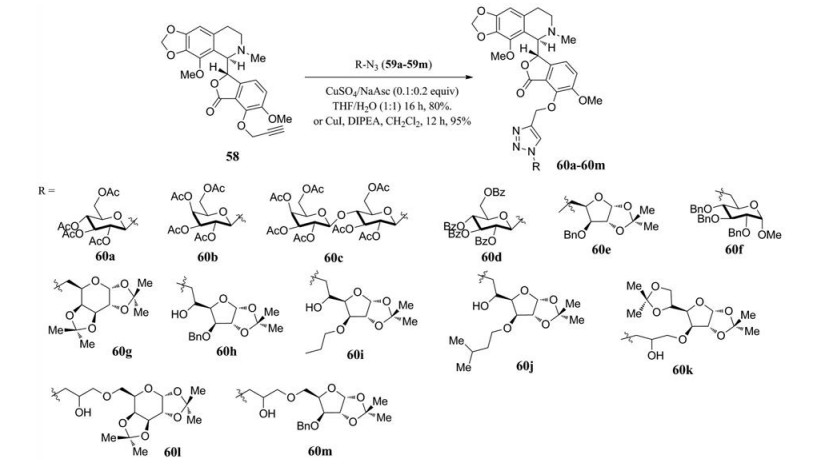
糖基化修饰是提高药物水溶性和靶向性的有效方式。2015年, 从7-OH那可丁35出发, 利用生成三氮唑的点击化学反应, Mishra团队成功合成了一系列7-O-糖缀合那可丁衍生物60a~60m[44] (图 27、28)。这些7-O-糖缀合物中, 58、60a~60c、60e和60l显示出优于那可丁的抗肿瘤活性(表 11)。

|
Figure 27 Activation of 7-O position for click reaction |
|
Figure 28 Synthesis of noscapine glycoconjugates via Cu(I) catalyzed click reaction |
| Table 11 Anti-cancer activity of noscapine glycoconjugates in HeLa cell |
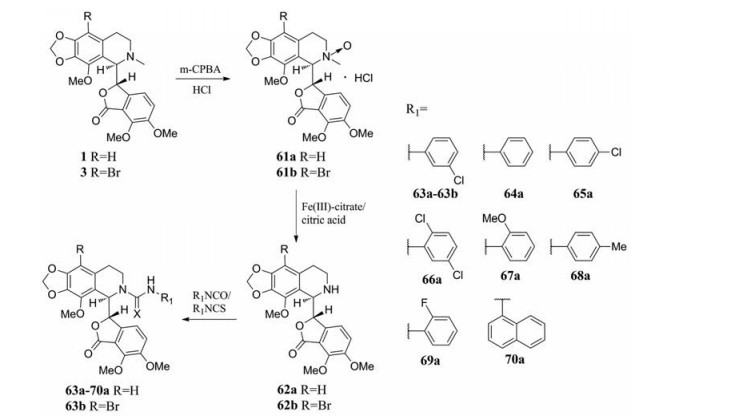
2002年, Aggarwal等[45]通过氧化去甲基化反应, 脱除6'位氮甲基, 进而与异氰酸酯/硫代异氰酸酯反应, 合成了一系列N-氨甲酰基/N-硫代氨甲酰基那可丁衍生物63~70, 由此开始了第III代那可丁的开发(图 29)。
|
Figure 29 Synthesis of N-carbamoyl/N-thiocarbamoyl noscapine derivatives |
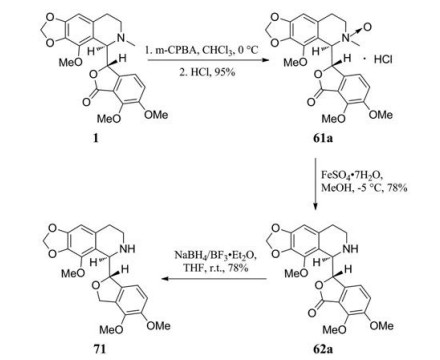
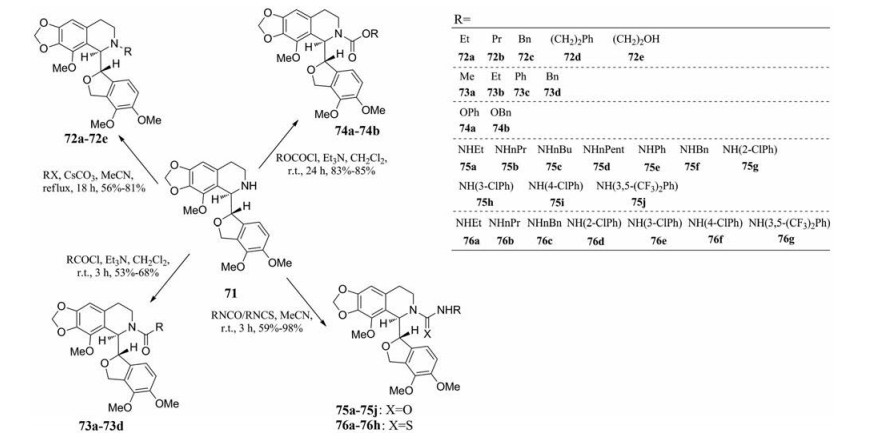
1位羰基还原后的环醚型那可丁衍生物, 理论上具有更好的代谢稳定性。有鉴于此, 2012年DeBono等[46]致力于开发环醚型第III代那可丁衍生物。他们首先用硫酸亚铁替代原有路线中的酒石酸铁, 发展了更为有效的脱甲基反应, 所得关键中间体62a, 经还原反应脱除羰基, 得环醚型那可丁衍生物71, 进而与卤代烷、酰氯、氯甲酸酯、异氰酸酯、异硫氰酸酯等反应, 得到一系列环醚型第III代那可丁衍生物72~76 (图 30、31), 其中G2/M期抑制活性高于那可丁的数据列于表 12中。数据表明, 除了化合物72e外, 大部分N-烷基环醚衍生物对抗肿瘤活性的提升没有任何作用, N-氨甲酰基取代衍生物比相应的N-硫代氨甲酰基衍生物活性更优, 需要指出得是, 对于N-酰基和N-氧甲酰基衍生物来讲, 苯基取代(苯甲酰基或苯氧甲酰基) 对于阻滞肿瘤细胞于G2/M期非常必要, N-尿素衍生物比同样的N-硫脲衍生物更具活性, 在N-尿素衍生物中, 75a和75e对PC-3和MCF-7细胞系的抗恶性增殖活性最好。
|
Figure 30 Synthesis of nornarcotine containing cyclic ether |
|
Figure 31 Synthesis of N-acyl noscapine derivatives containing cyclic ether |
| Table 12 Changes in the percentage of cells arrested at the G2/M phase, along with EC50 values for active compounds |
磺酰胺和氨磺酰胺结构, 代谢稳定, 代表着一类药物分子中的常见基团, 表现出抗菌、抗炎、利尿等多种生物活性[47]。受此启发, 2019年, Yong等[48]在6'位引入磺酰基和氨磺酰基, 将1位羰基还原, 合成了42个含磺酰胺和氨磺酰胺结构的第三代那可丁衍生物77~80 (图 32)。这些衍生物大多都表现出较那可丁1a更强的抗有丝分裂阻滞作用, 可将肿瘤细胞阻滞于G2/M期。细胞活力实验发现, 衍生物79a~79c、79j、79m、79o、79q、79s、79u、80b、80h对MCF-7和PANC-1细胞的EC50都小于2 μmol·L-1, 其中咪唑磺酰基取代的衍生物79q抗肿瘤活性达到亚微摩尔级(EC50值: MCF-7细胞560 nmol·L-1; PANC-1细胞980 nmol·L-1; MDA-MB-435细胞271 nmol·L-1; SK-MEL-5细胞443 nmol·L-1)。79q在NCI-60中进行细胞增殖实验发现, 其对于白血病细胞、黑色素瘤细胞、肺癌细胞、结肠癌细胞、肾癌细胞以及乳腺癌细胞具有显著的生长抑制活性, IC50小于500 nmol·L-1, 特别是对黑色素瘤细胞MDA-MB-435和SK-MEL-5, GI50可以分别达到271 nmol·L-1和443 nmol·L-1。79q可观的活性数据或许暗示着6'位引入有氢键结合能力的杂芳环将有助于改善化合物与微管蛋白的结合能力。

|
Figure 32 Synthesis of N-sulfonyl and N-sulfamoyl noscapine derivatives |
那可丁氮原子上取代基为甲基, 为了研究其他烷基对抗肿瘤活性的影响, 2003年, McCamley等[49]通过氧化去甲基化, 亲核取代等三步反应, 合成了一系列N-烷基取代那可丁衍生物(图 33)。在针对肺癌、骨髓瘤、宫颈癌等恶性肿瘤细胞的增殖抑制实验中, 大部分衍生物都可有效抑制肿瘤细胞恶性增殖, 并诱导其凋亡, 表现出优于那可丁的抗肿瘤活性[50]。其中62a、81c、81f、81i、81j活性最佳(表 13), 且在微管蛋白结合实验中, 显示出浓度依赖性, 结合能力的顺序是81f > 62a > 81i > 81c > 81j, 81f与微管蛋白的结合最为紧密(KD = 38 ± 4 μmol·L-1), 甚至优于处于临床研究阶段的9'-Br那可丁(KD = 54 ± 9.1 μmol·L-1)[29]。
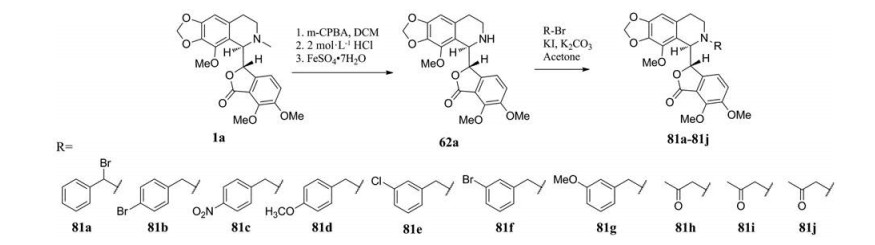
|
Figure 33 Synthesis of N-alkylated noscapine derivatives |
| Table 13 In vitro cell growth inhibitory effects of N-alkylated noscapine derivatives |
咪唑并[2, 1-b]噻唑是驱虫药和免疫调节剂左旋咪唑的核心结构[51]。近年来, 这一稠合杂环骨架也陆续被发现具有抗纤维化、抗病毒、抗肿瘤等多种生物活性[52]。尤其在抗肿瘤方面, Andreani等[53]发现这一结构, 可通过抑制微管蛋白聚合发挥抗肿瘤作用。基于这一发现, 致力于增强那可丁的抗肿瘤活性, Nagireddy团队从6'-去甲基那可丁62a出发, 通过亲核取代和杂环合成等两步反应, 合成了一系列含咪唑并[2, 1-b]噻唑结构的那可丁衍生物84a~84o (图 34)[54]。通过类似的反应路线, 从7-羟基那可丁35出发, 他们还合成了那可丁衍生物86a~86o。
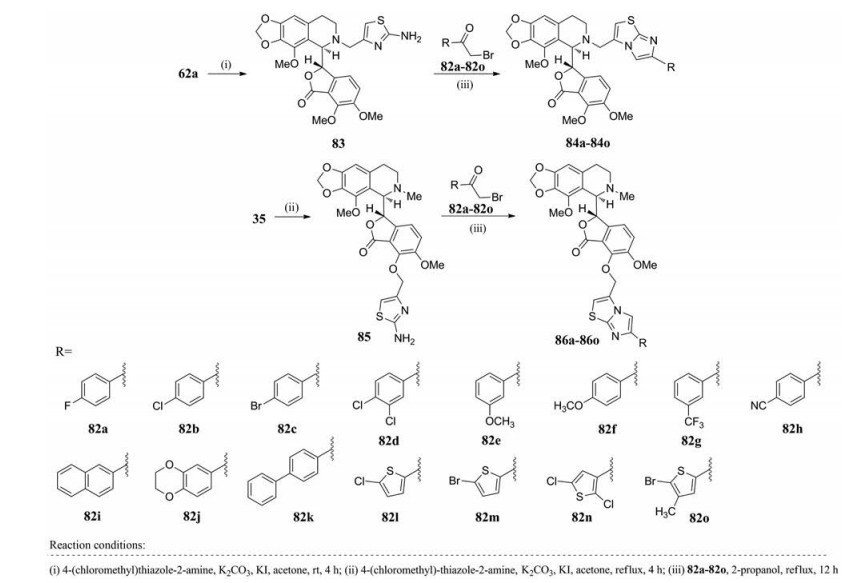
|
Figure 34 Synthesis of noscapine imidazothiazole derivatives |
体外抗肿瘤活性筛选表明, 合成中间体83和85对于胰腺癌细胞MIAPaCa-2具有优异的抗肿瘤活性(83, IC50 = 2.7 ± 1.2 μmol·L-1; 85, IC50 = 7.3 ± 0.7 μmol·L-1)。作者推测, 这可能是由于氨基噻唑基团可通过氢键增强与微管蛋白的结合活性。N-咪唑并噻唑那可丁衍生物84a~84o, 大多表现出不尽如人意的抗肿瘤活性, 只有化合物84a对于MIAPaCa-2表现出较强的抑制活性(IC50 = 4.2 ± 0.6 μmol·L-1)。O-咪唑并噻唑那可丁衍生物86a~86o的整体抗肿瘤效果良好, 其中, 化合物86o对于MIAPaCa-2的抗肿瘤效果最优(IC50 = 3.6 ± 1.3 μmol·L-1)。然而, 将86o结构中噻吩环上的甲基去除, 所得衍生物86m在MIAPaCa-2中的活性却较差(IC50 = 48.7 ± 3.9 μmol·L-1)。此外, 86b、86c和86e在MIAPaCa-2中也显示出较为优异的抗肿瘤活性(86b, IC50 = 3.9 ± 0.6 μmol·L-1; 86c, IC50 = 4.2 ± 1.4 μmol·L-1; 86e, IC50 = 6.9 ± 1.4 μmol·L-1)。
3 构效关系图构效关系见图 35。
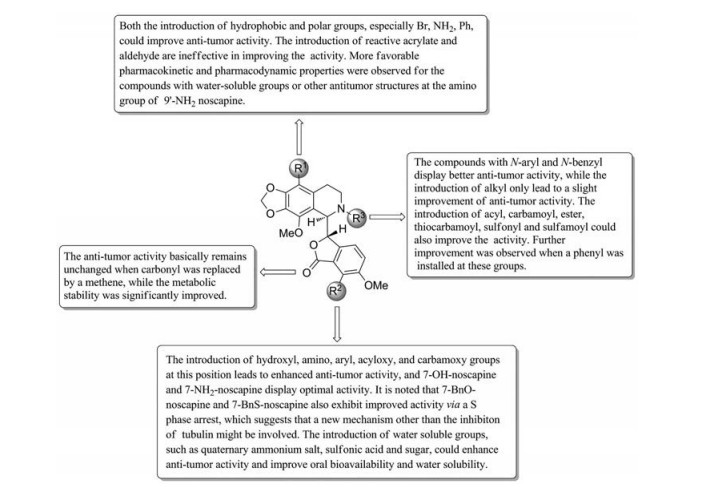
|
Figure 35 Structure-activity relationship of noscapine |
从非处方镇咳药转变为抗肿瘤药物, 老药新用赋予了那可丁良好的新药开发前景。因此, 在过去20多年中, 药物化学家着眼于提高抗肿瘤活性和改善水溶性, 对那可丁进行了大量结构改造, 根据改造位点不同, 形成了三代那可丁衍生物。从中发现了一批具有进一步开发前景的化学实体。其中9'-Br那可丁, 作为最具代表性的衍生物, 目前已处于Ⅱ期临床研究, 用于多种实体瘤的治疗。尽管如此, 那可丁进一步新药开发, 仍需解决四大问题: ①衍生物的结构多样性不足, 构效关系不够明确。由于那可丁结构相对复杂, 官能团多样, 传统反应大多难以与其有效兼容, 限制了结构多样性那可丁衍生物的合成, 不利于构效关系研究。②作用机制不明确, 新的作用靶点有待确证。如上所述, 那可丁衍生物通常被认为是微管蛋白抑制剂, 可阻滞细胞于G2/M期, 通过抗有丝分裂而发挥抗肿瘤作用。但是一些活性较优的化合物, 如7-BnO那可丁, 则显示肿瘤细胞S期的阻滞作用, 这充分表明, 那可丁存在其他抗肿瘤机制。其次, 即便是与微管蛋白结合, 结合位点亦不清楚, 不利于进一步合理药物设计。③那可丁提取自罂粟, 尽管含量丰富, 但来源难以保证, 成为制约进一步新药开发的瓶颈。为了解决那可丁的来源问题。多种那可丁全合成路线被开发, Winzer等[55]也曾通过生物合成的方法实现了那可丁的合成。然而这两种策略, 都不能得到单一构型的那可丁, 且合成效率不佳。④代谢稳定性有待改进, 口服生物利用度有待提高。那可丁尽管可以口服, 但是由于首过效应相对较高, 口服生物利用度仅为31.5%。而目前的结构改造, 并没有触及这一问题。
作者相信, 如果能解决以上四个问题, 那可丁类抗肿瘤新药开发, 必将迎来更为广阔的发展空间。
作者贡献: 杨悦和李得峰是综述的主要撰写人, 完成相关文献的搜集、分析和论文初稿的撰写, 同时李得峰是文章的第二通讯作者; 罗婷和史浩良参与文献的分析和整理; 张永强是文章的构思者及第一通讯作者, 指导论文的写作。全体作者都阅读并同意最终的文本。
利益冲突: 本文研究内容无任何利益冲突。
| [1] |
Vree TB, Rt VD, Koopmankimenai PM. Codeine analgesia is due to codeine-6-glucuronide, not morphine[J]. Int J Clin Pract, 2000, 54: 395-398. |
| [2] |
Aneja R, Dhiman N, Idnani J, et al. Preclinical pharmacokinetics and bioavailability of noscapine, a tubulin-binding anticancer agent[J]. Cancer Chemother Pharmacol, 2007, 60: 831-839. DOI:10.1007/s00280-007-0430-y |
| [3] |
Mahmoudian M, Rahimi-Moghaddam P. The anti-cancer activity of noscapine: a review[J]. Recent Pat Anticancer Drug Discov, 2009, 4: 92-97. DOI:10.2174/157489209787002524 |
| [4] |
Landen JW, Lang R, McMahon SJ, et al. Noscapine alters microtubule dynamics in living cells and inhibits the progression of melanoma[J]. Cancer Res, 2002, 62: 4109-4114. |
| [5] |
Zhou J, Gupta K, Aggarwal S, et al. Brominated derivatives of noscapine are potent microtubule-interfering agents that perturb mitosis and inhibit cell proliferation[J]. Mol Pharmacol, 2003, 63: 799-807. DOI:10.1124/mol.63.4.799 |
| [6] |
Davis RJ. Signal transduction by the JNK group of MAP kinases[J]. Cell, 2000, 103: 239-252. DOI:10.1016/S0092-8674(00)00116-1 |
| [7] |
Zhou J, Gupta K, Yao J, et al. Paclitaxel-resistant human ovarian cancer cells undergo c-Jun NH2-terminal kinase-mediated apoptosis in response to noscapine[J]. J Biol Chem, 2002, 277: 39777-39785. DOI:10.1074/jbc.M203927200 |
| [8] |
Semenza GL. Targeting HIF-1 for cancer therapy[J]. Nat Rev Cancer, 2003, 3: 721-732. DOI:10.1038/nrc1187 |
| [9] |
Zagzag D. Noscapine inhibits hypoxia-mediated HIF-1α expression andangiogenesis in vitro: a novel function for an old drug[J]. Int J Oncol, 2006, 28: 1121-1130. |
| [10] |
Heidari N, Goliaei B, Moghaddam PR, et al. Apoptotic pathway induced by noscapine in human myelogenous leukemic cells[J]. Anticancer Drugs, 2007, 18: 1139-1147. DOI:10.1097/CAD.0b013e3282eea257 |
| [11] |
Jackson T, Chougule MB, Ichite N, et al. Antitumor activity of noscapine in human non-small cell lung cancer xenograft model[J]. Cancer Chemother Pharmacol, 2008, 63: 117-126. DOI:10.1007/s00280-008-0720-z |
| [12] |
Aneja R, Ghaleb AM, Zhou J, et al. p53 and p21 determine the sensitivity of noscapine-induced apoptosis in colon cancer cells[J]. Cancer Res, 2007, 67: 3862-3870. DOI:10.1158/0008-5472.CAN-06-4282 |
| [13] |
Aggarwal BB. Nuclear factor-κB: the enemy within[J]. Cancer Cell, 6: 203-208. DOI:10.1016/j.ccr.2004.09.003 |
| [14] |
Aggarwal BB. Noscapine, a benzylisoquinoline alkaloid, sensitizes leukemic cells to chemotherapeutic agents and cytokines by modulating the NF-κB signaling pathway[J]. Cancer Res, 2010, 70: 3259-3268. DOI:10.1158/0008-5472.CAN-09-4230 |
| [15] |
Kolb EA, Gorlick R, Houghton PJ, et al. Initial testing of dasatinib by the pediatric preclinical testing program[J]. Pediatr Blood Cancer, 2008, 50: 1198-1206. DOI:10.1002/pbc.21368 |
| [16] |
He M, Jiang L, Ren Z, et al. Noscapine targets EGFR(p-Tyr1068) to suppress the proliferation and invasion of MG63 cells[J]. Sci Rep, 2016, 6: 37062. DOI:10.1038/srep37062 |
| [17] |
Aneja R, Vangapandu SN, Lopus M, et al. Synthesis of microtubule-interfering halogenated noscapine analogs that perturb mitosis in cancer cells followed by cell death[J]. Biochem Pharmacol, 2006, 72: 415-426. DOI:10.1016/j.bcp.2006.05.004 |
| [18] |
Verma AK, Bansal S, Singh J, et al. Synthesis and in vitro cytotoxicity of haloderivatives of noscapine[J]. Bioorg Med Chem, 2006, 14: 6733-6736. DOI:10.1016/j.bmc.2006.05.069 |
| [19] |
Aneja R, Vangapandu SN, Joshi HC. Synthesis and biological evaluation of a cyclic ether fluorinated noscapine analog[J]. Bioorg Med Chem, 2006, 14: 8352-8358. DOI:10.1016/j.bmc.2006.09.012 |
| [20] |
Aneja R, Vangapandu SN, Lopus M, et al. Development of a novel nitro-derivative of noscapine for the potential treatment of drug-resistant ovarian cancer and T-cell lymphoma[J]. Mol Pharmacol, 2006, 69: 1801-1809. DOI:10.1124/mol.105.021899 |
| [21] |
Naik PK, Chatterji BP, Vangapandu SN, et al. Rational design, synthesis and biological evaluations of amino-noscapine: a high affinity tubulin-binding noscapinoid[J]. J Comput Aided Mol Des, 2011, 25: 443-454. DOI:10.1007/s10822-011-9430-4 |
| [22] |
Manchukonda NK, Sridhar B, Naik PK, et al. Copper(I) mediated facile synthesis of potent tubulin polymerization inhibitor, 9-amino-α-noscapine from natural α-noscapine[J]. Bioorg Med Chem Lett, 2012, 22: 2983-2987. DOI:10.1016/j.bmcl.2012.02.033 |
| [23] |
Henary M, Narayana L, Ahad S, et al. Novel third-generation water-soluble noscapine analogs as superior microtubule-interfering agents with enhanced antiproliferative activity[J]. Biochem Pharmacol, 2014, 92: 192-205. DOI:10.1016/j.bcp.2014.07.020 |
| [24] |
Ross JF, Chaudhuri PK, Ratnam M. Differential regulation of folate receptor isoforms in normal and malignant tissues in vivo and in established cell lines. Physiologic and clinical implications[J]. Cancer, 1994, 73: 2432-2443. DOI:10.1002/1097-0142(19940501)73:9<2432::AID-CNCR2820730929>3.0.CO;2-S |
| [25] |
Parker N, Turk MJ, Westrick E, et al. Folate receptor expression in carcinomas and normal tissues determined by a quantitative radioligand binding assay[J]. Anal Biochem, 2005, 338: 284-293. DOI:10.1016/j.ab.2004.12.026 |
| [26] |
Naik PK, Lopus M, Aneja R, et al. In silico inspired design and synthesis of a novel tubulin-binding anti-cancer drug: folate conjugated noscapine (Targetin)[J]. J Comput Aided Mol Des, 2012, 26: 233-247. DOI:10.1007/s10822-011-9508-z |
| [27] |
Porcù E, Sipos A, Basso G, et al. Novel 9'-substituted-noscapines: synthesis with Suzuki cross-coupling, structure elucidation and biological evaluation[J]. Eur J Med Chem, 2014, 84: 476-490. DOI:10.1016/j.ejmech.2014.07.050 |
| [28] |
Manchukonda NK, Naik PK, Sridhar B, et al. Synthesis and biological evaluation of novel biaryl type α-noscapine congeners[J]. Bioorg Med Chem Lett, 2014, 24: 5752-5757. DOI:10.1016/j.bmcl.2014.10.046 |
| [29] |
Santoshi S, Naik PK, Joshi HC. Rational design of novel anti-microtubule agent (9-azido-noscapine) from quantitative structure activity relationship (QSAR) evaluation of noscapinoids[J]. J Biomol Screen, 2011, 16: 1047-1058. DOI:10.1177/1087057111418654 |
| [30] |
DeBono A, Capuano B, Scammells PJ. Progress toward the development of noscapine and derivatives as anticancer agents[J]. J Med Chem, 2015, 58: 5699-5727. DOI:10.1021/jm501180v |
| [31] |
Manchukonda NK, Nagireddy PKR, Sridhar B, et al. Synthesis and click reaction of tubulin polymerization inhibitor 9-azido-α-noscapine[J]. Res Chem Intermed, 2017, 43: 2457-2469. DOI:10.1007/s11164-016-2773-7 |
| [32] |
Lehmann J, Wright MH, Sieber SA. Making a long journey short: alkyne functionalization of natural product scaffolds[J]. Chemistry (Easton), 2016, 22: 4666-4678. |
| [33] |
Reddy Nagireddy PK, Kommalapati VK, Manchukonda NK, et al. Synthesis and antiproliferative activity of 9‐formyl and 9‐ethynyl noscapines[J]. ChemistrySelect, 2019, 4: 4092-4096. DOI:10.1002/slct.201900666 |
| [34] |
Liang X, Gopalaswamy R, Navas F, et al. A scalable synthesis of the difluoromethyl-allo-threonyl hydroxamate-based LpxC inhibitor LPC-058[J]. J Org Chem, 2016, 81: 4393-4398. DOI:10.1021/acs.joc.6b00589 |
| [35] |
Nagireddy PKR, Sridhar B, Kantevari S. Copper‐catalyzed Glaser‐Hey‐Type cross coupling of 9‐ethynyl‐α‐noscapine leading to unsymmetrical 1, 3‐diynyl noscapinoids[J]. Asian J Org Chem, 2019, 8: 1495-1500. DOI:10.1002/ajoc.201900316 |
| [36] |
Anderson JT, Ting AE, Boozer S, et al. Discovery of S-phase arresting agents derived from noscapine[J]. J Med Chem, 2005, 48: 2756-2758. DOI:10.1021/jm0494220 |
| [37] |
Anderson JT, Ting AE, Boozer S, et al. Identification of novel and improved antimitotic agents derived from noscapine[J]. J Med Chem, 2005, 48: 7096-7098. DOI:10.1021/jm050674q |
| [38] |
Zim D, Buchwald SL. An air and thermally stable one-component catalyst for the amination of aryl chlorides[J]. Org Lett, 2003, 5: 2413-2415. DOI:10.1021/ol034561h |
| [39] |
Schmidhammer H, Klötzer W. Neue Reaktionen an Phthalidisochinolinalkaloiden. Alkoxytauschreaktionen and isomerisierungen an α‐and β‐narcotin[J]. Arch Pharm, 1978, 311: 664-671. DOI:10.1002/ardp.19783110804 |
| [40] |
Marshall M, Pyman F, Robinson R. Stereoisomerides of narcotine and hydrastin[J]. J Chem Soc, 1934, 1315-1320. DOI:10.1039/jr9340001315 |
| [41] |
Bennani YL, Gu W, Canales A, et al. Tubulin binding, protein-bound conformation in solution, and antimitotic cellular profiling of noscapine and its derivatives[J]. J Med Chem, 2012, 55: 1920-1925. DOI:10.1021/jm200848t |
| [42] |
Mishra RC, Karna P, Gundala SR, et al. Second generation benzofuranone ring substituted noscapine analogs: synthesis and biological evaluation[J]. Biochem Pharmacol, 2011, 82: 110-121. DOI:10.1016/j.bcp.2011.03.029 |
| [43] |
Mishra RC, Gundala SR, Karna P, et al. Design, synthesis and biological evaluation of di-substituted noscapine analogs as potent and microtubule-targeted anticancer agents[J]. Bioorg Med Chem Lett, 2015, 25: 2133-2140. DOI:10.1016/j.bmcl.2015.03.076 |
| [44] |
Mishra KB, Mishra RC, Tiwari VK. First noscapine glycoconjugates inspired by click chemistry[J]. RSC Adv, 2015, 5: 51779-51789. DOI:10.1039/C5RA07321A |
| [45] |
Aggarwal S, Ghosh NN, Aneja R, et al. A convenient synthesis of aryl-substituted N-carbamoyl/N-thiocarbamoyl narcotine and related compounds[J]. Helv Chim Acta, 2002, 85: 2458-2462. DOI:10.1002/1522-2675(200208)85:8<2458::AID-HLCA2458>3.0.CO;2-L |
| [46] |
DeBono AJ, Xie JH, Ventura S, et al. Synthesis and biological evaluation of N-substituted noscapine analogues[J]. ChemMedChem, 2012, 7: 2122-2133. DOI:10.1002/cmdc.201200365 |
| [47] |
Kalgutkar AS, Jones R, Sawant A. Chapter 5: sulfonamide as an essential functional group in drug design[J]. RSC Drug Discov, 2010, 1: 210-274. |
| [48] |
Yong C, Devine SM, Gao XX, et al. A novel class of N-sulfonyl and N-sulfamoyl noscapine derivatives that promote mitotic arrest in cancer cells[J]. ChemMedChem, 2019, 14: 1968-1981. DOI:10.1002/cmdc.201900477 |
| [49] |
McCamley K, Ripper JA, Singer RD, et al. Efficient N-demethylation of opiate alkaloids using a modified nonclassical Polonovski reaction[J]. J Org Chem, 2003, 68: 9847-9850. DOI:10.1021/jo035243z |
| [50] |
Manchukonda NK, Naik PK, Santoshi S, et al. Rational design, synthesis, and biological evaluation of third generation α-noscapine analogues as potent tubulin binding anti-cancer agents[J]. PLoS One, 2013, 8: e77970. DOI:10.1371/journal.pone.0077970 |
| [51] |
Fascio ML, Errea MI, D'Accorso NB. Imidazothiazole and related heterocyclic systems, chemical and biological properties[J]. Eur J Med Chem, 2015, 90: 666-683. DOI:10.1016/j.ejmech.2014.12.012 |
| [52] |
Bin Sayeed I, Garikapati KR, Makani VKK, et al. Development and biological evaluation of imidazothiazole propenones as tubulin inhibitors that effectively triggered apoptotic cell death in alveolar lung cancer cell line[J]. ChemistrySelect, 2017, 2: 6480-6487. DOI:10.1002/slct.201701563 |
| [53] |
Andreani A, Granaiola M, Leoni A, et al. Imidazo[2, 1-b]thiazole guanylhydrazones as RSK2 inhibitors[J]. Eur J Med Chem, 2011, 46: 4311-4323. DOI:10.1016/j.ejmech.2011.07.001 |
| [54] |
Nagireddy PKR, Kommalapati VK, Siva Krishna V, et al. Imidazo[2, 1-b]thiazole-coupled natural noscapine derivatives as anticancer agents[J]. ACS Omega, 2019, 4: 19382-19398. DOI:10.1021/acsomega.9b02789 |
| [55] |
Winzer T, Gazda V, He Z, et al. A Papaver somniferum 10-gene cluster for synthesis of the anticancer alkaloid noscapine[J]. Science, 2012, 336: 1704-1708. DOI:10.1126/science.1220757 |
 2021, Vol. 56
2021, Vol. 56


